Method Article
Análise imunoblot da electroforese do gel do polyacrylamide nativo da dimerization IRF5 endógena
Neste Artigo
Resumo
Um método ocidental nativo do borrão para analisar o dimerização regulador endógeno do fator 5 do interferon na linha de pilha dendríticas do plasmacytoid Cal-1 é descrito. Este protocolo pode ser aplicado a outras linhas de célula também.
Resumo
O fator regulador 5 do interferon (IRF5) é um fator chave da transcrição para regular a resposta imune. É ativado a jusante da via de sinalização do gene de resposta primária 88 (TLR-MyD88) da diferenciação Myeloid do receptor Toll-like. A ativação do IRF5 envolve a fosforilação, a dimerização e a subsequente translocação do citoplasma para o núcleo, que por sua vez induz a expressão gênica de várias citocinas pró-inflamatórias. Um ensaio de detecção para ativação IRF5 é essencial para estudar funções IRF5 e seus caminhos relevantes. Este artigo descreve um ensaio robusto para detectar a ativação IRF5 endógena na linha de célula dendrítica do plasmacytoid humano de CAL-1 (pDC). O protocolo consiste em um ensaio de eletroforese não desnaturante modificado que pode distinguir IRF5 em suas formas de monómero e dímero, proporcionando assim uma abordagem acessível e sensível para analisar a ativação do IRF5.
Introdução
O fator de regulação do interferão 5 (IRF5) é um importante regulador de transcrição que desempenha um papel proeminente na regulação da resposta imune, particularmente na liberação de citocinas pró-inflamatórias e interferões tipo I (ifns)1,2 ,3. A desregulação do IRF5 é um fator contribuinte em inúmeras doenças auto-imunes, como evidente por vários polimorfismos no locus IRF5 que estão associados com lúpus eritematoso sistêmico, esclerose múltipla, artrite reumatóide, etc.4, 5,6,7,8,9,10. Portanto, um ensaio de detecção robusto para o estado de ativação IRF5 endógena é crucial para compreender as vias reguladoras e os efeitos a jusante da IRF5 em um contexto celular fisiologicamente relevante.
IRF5 é constitutivamente expresso em monócitos, células dendríticas (DCs), células B emacrófagos,11. Como com outros fatores da transcrição da família de IRF, IRF5 reside no citoplasma em seu estado latente. Após a ativação, o IRF5 é fosforilado e forma homodimers, que então translocam para o núcleo e se ligam a elementos regulatórios específicos de genes codificadores tipo I IFNs e citocinas pró-inflamatórias, eventualmente induzindo a expressão desses genes1 ,2,11,12,13. IRF5 regula as respostas imunes inatas a jusante de vários receptores de pedágio (TLRs), como TLR7, TLR 8 e TLR 9, que estão localizados em endossomos e usam MyD88 para sinalização1,11,14. Estes TLRs reconhecem primeiramente espécies de ácido nucleico extrangeiro tais como o RNA único-encalhado (ssrna) e o ADN unmethylated do CPG que são sintomáticos de uma infecção15,16,17,18. IRF5 foi demonstrado para regular as respostas imunes contra infecções bacterianas, virais e fúngicas19,20,21. Considerando IRF5's papel influente e diversificado no sistema imunológico, potencializando ou umedecendo a atividade IRF5 poderia servir como uma nova avenida para o desenvolvimento de agentes terapêuticos22. Portanto, é fundamental desenvolver um protocolo para monitorar o status de ativação do IRF5 endógeno para permitir uma investigação minuciosa das vias e mecanismos que regulam a atividade IRF5 em diferentes tipos de células.
Ao melhor de nosso conhecimento, nenhum ensaio electrophoretic bioquímico ou do gel para a ativação IRF5 endógena foi publicado antes do desenvolvimento deste protocolo. O phosphorylation foi mostrado para ser um primeiro passo importante da ativação IRF5, e um anticorpo IRF5 phosphospecific foi desenvolvido que conduziu à descoberta e à confirmação de um resíduo serina importante para a atividade IRF513. Entretanto, quando o anticorpo detectar claramente o IRF5 fosforilada quando Immunoprecipitated ou overexpressado23, não detecta a fosforilação IRF5 em um lisado inteiro da pilha em nossas mãos (dados não mostrados). A dimerização é a próxima etapa da ativação do IRF5, e muitos estudos importantes até o momento investigando este passo dependiam da superexpressão de IRF5 com a tag epitope, muitas vezes em tipos de células irrelevantes que normalmente não expressam IRF5,11,12 ,24,25. Estudos prévios mostraram que a IRF5 dimerizada nem sempre pode ser translocada para o núcleo e, portanto, não é necessariamente totalmente ativada25,26. Um ensaio para a localização nuclear IRF5 endógena foi desenvolvido para avaliar a ativação IRF5 pelo fluxo de imagem citometria27. Este ensaio tem sido aplicado em estudos que foram cruciais para a compreensão da atividade IRF5, especialmente nos tipos de células primárias ou raras28,29 e avançou grandemente o conhecimento no campo. No entanto, este ensaio baseia-se em um instrumento especializado que não está amplamente disponível para os pesquisadores. Além disso, muitas vezes é necessário investigar os passos iniciais de ativação, enquanto dissecando IRF5 vias reguladoras e identificando os reguladores upstream e componentes da via. Este estudo fornece um ensaio bioquímico robusto e confiável para os eventos de ativação precoce de IRF5 que podem ser realizados em laboratórios equipados com ferramentas de biologia molecular. O protocolo aqui descrito será muito útil na investigação das vias e mecanismos das ações IRF5, especialmente quando combinados com ensaios ortogonais como a análise citométrica do fluxo de imagem da localização nuclear de IRF523, 27,28,30.
A electroforese nativa do gel do poliacrilamida (página nativa) é um método amplamente utilizado para analisar complexos da proteína31,32. Ao contrário do dodecylsulfate do sódio a electroforese do gel do poliacrilamida (SDS-PAGE), página nativa separa proteínas com base em seus forma, tamanho, e carga. Igualmente retém a estrutura nativa da proteína sem desnaturação31,33,34,35. O protocolo apresentado aproveita esses recursos da página nativa e detecta formas monoméricas e diméricas de IRF5. Este método é particularmente importante para a detecção de eventos de ativação precoce, pois não há nenhum anticorpo comercialmente disponível adequado que possa detectar a IRF5 fosforilada endógena. Anteriormente, vários estudos publicados utilizavam a página nativa para avaliar a dimerização do IRF5. No entanto, a maioria desses estudos dependeu da superexpressão do epítopo exógeno-Tagged IRF5 para analisar o status de ativação2,13,24,36,37 . Este trabalho apresenta um protocolo passo-a-passo para analisar a dimerização endógena de IRF5 por meio de uma técnica de página nativa modificada em uma linha de células dendríticas de plasmacitoides humanas (pDC), onde a atividade de IRF5 demonstrou ser crucial para sua função1, 38,39,40. Esta mesma técnica foi aplicada a outras linhas celulares23.
Protocolo
Nota: O protocolo descrito aqui utiliza a linha de célula pDC de CAL-1 tratada com resiquimod (R848), um agonista para TLR7/8. Este protocolo foi aplicado a outros tipos de células humanas e murinas, incluindo RAW 264,7 (linha de macrófago murino), THP-1 (linha celular monocítica humana), BJAB (linha celular B humana), ramos (linha celular B humana) e MUTZ-3 (linha celular dendrítica humana)23.
1. estimulação das células CAL-1
- Manter culturas de células CAL-1 em um balão de T75 a 37 ° c e 5% CO2 em condições estéreis com 20 − 25 ml de meio rpmi 1640 contendo 5% de soro bovino FETAL (FBS), 25 mm de HEPES e 1x mercaptoetanol (i.e., completo rpmi 1640 médio).
- Transfira as células para um tubo cônico de 50 mL.
Nota: As células CAL-1 são não aderentes. Para os tipos de células aderentes, a tripsinização padrão pode ser realizada para colher células. - Centrifugue as células a 200 x g durante 5 min à temperatura ambiente (RT). Remova o sobrenadante e Ressuspenda o pellet de células em 8 mL do meio completo RPMI 1640 para obter uma suspensão de célula única homogênea.
- Conte as células usando um Hemocytometer. Semente as pilhas em uma densidade de 1 x 106 pilhas por o poço em uma placa de 6 poços com 4 ml do meio completo pré-aquecido de rpmi 1640 em cada poço. Incubar por 20 − 24 h a 37 ° c e 5% CO2 para permitir que a confluência atinja 90% − 95% (correspondendo a aproximadamente 1,5 x 106 células).
- Estimular as células adicionando 4 μL de 1 mg/mL R848 por poço da placa de 6 poços (concentração final de 1 μg/mL). Também configurar um controle não estimulado bem com as células sem o tratamento R848.
- Assegure-se de que o R848 está uniformemente disperso, balançando suavemente o lado da placa para o lado. Em seguida, incubar as células por 2 − 16 h na incubadora a 37 ° c e 5% CO2.
2. extração de proteínas celulares
- Transfira as suspensões de células da placa de 6 poços para tubos de centrifugação de 5 mL.
- Centrifugador em 200 x g por 5 minutos em RT. Retire o sobrenadante e Ressuspenda o pellet de células em 1 ml de solução salina tamponada com fosfato (PBS) para obter uma suspensão homogênea de uma única célula.
- Transfira a suspensão da célula para um tubo de centrifugação de 1,5 mL.
- Gire para baixo brevemente em 12.000 x g para 0.5 − 1 minuto em 4 ° c e remova com cuidado o sobrenadante.
- Prepare o tampão de Lise contendo 6,25 mL de pH Tris-HCl de 1 M 7,4 (concentração final de 25 mM), 7,5 mL de NaCl de 5 M (concentração final de 150 mM), 0,5 mL de EDTA de 0,5 M (concentração final de 1 mM), 2,5 mL de NP-40 (concentração final de 1%) e 7,5 mL de glicerol (concentração final de 5%) em 250 mL de água desionizada (ddH2O). Adicione o cocktail do único-uso do inibidor de protease 100x a uma concentração final de 1x ao amortecedor do lysis apenas antes de usar. Mantenha o tampão de Lise preparado no gelo.
Nota: O tampão de Lise sem a protease pode ser armazenado a 4 ° c. - Ressuscitar o pellet celular em 30 μL de gelo-frio lise tampão e misture por pipetagem para cima e para baixo.
- Incubar no gelo por 15 − 20 min.
- Esclareça o lisado centrifugação a 12.000 x g durante 15 − 20 min a 4 ° c. Transfira o sobrenadante para um novo tubo de centrífuga 1,5 mL pré-refrigerado. Mantenha os extratos no gelo em todas as vezes.
Nota: Os lisados de células podem ser armazenados a-20 ° c ou-80 ° c. Não Ferva as amostras. - Meça a concentração da proteína usando o reagente de Bradford.
3. análise de IRF5 dimerization por Native PAGE
- Prepare os amortecedores superiores (-) e inferiores (+) da electroforese da câmara. O tampão superior da câmara consiste em 0,3% desoxicolato do sódio (nadoc) no amortecedor running da página do nativo 1x, e a câmara mais baixa consiste somente no amortecedor running da página 1x nativa.
Nota: Prepare um buffer de câmara superior fresco para cada nova corrida. - Enxágüe um gel nativo da página de 3% − 12% completamente com água sem distortar os poços. Ajuste o gel no mini tanque do gel e remova o pente. Prerun o gel em uma sala fria de 4 ° c ou no gelo em 150 V por 30 minutos.
Nota: Prerunning remove a amônia excessiva e os íons do persulfato que podem interferir com o funcionamento do gel. - Durante o pré-lançamento, prepare as amostras para o carregamento misturando as proteínas celulares mantidas no gelo com 4x tampão de amostra nativa.
- Após o pré-lançamento, carregar 10 − 15 μg de proteína com um volume final de 10 − 15 μL por amostra.
Nota: O sobrecarregamento da proteína pode causar manchas. - Run gel em 85 V por 30 min, então 150 V para 2 h.
Nota: Considerando as diferenças em equipamentos e linhas celulares utilizadas por diferentes laboratórios, pequenas modificações na concentração de amostras de proteínas, tensão e tempo de funcionamento podem ser apropriadas para otimizar esse protocolo. Reduzindo a tensão pre-running e running ao aumentar o tempo running pode ajudar a melhorar a definição do dímero e a consistência do resultado. - Mergulhe o gel em SDS running buffer (25 mM TRIS pH 8,3, 250 mM Glycine, 0,1% SDS) para 30 min em RT.
Nota: Nenhuma agitação é exigida. Ocasionalmente, a intensidade da banda pode não ser proporcional à quantidade de proteínas carregadas devido à transferência ineficiente na presença de desoxicolato (DOC), que afeta principalmente a forma monomérica de IRF5. Embebendo o gel no amortecedor running do SDS antes da transferência resolve este problema. O gel é frágil. Manuseie com extremo cuidado da extremidade inferior (i.e., maior percentagem) do gel.
4. análise de immunoblot de IRF5
- Ative a membrana do difluoreto do polyvinylidene (PDVF) mergulhando a no metanol por aproximadamente 5 minutos.
- Faça um corte em um canto da membrana para indicar sua orientação. Monte o sanduíche de transferência de acordo com a ordem seqüencial detalhada no protocolo do fabricante com cuidado extra para assegurar-se de que nenhumas bolhas de ar estejam prendidas dentro.
- Coloque a gaveta de transferência no tanque e transfira a 20 V por 1 h no gelo.
Nota: Realize todas as incubações e lavagens em etapas subsequentes com um agitador de balanço. - Retire a membrana da gaveta com fórceps plástico depois que a transferência é terminada. Bloqueie a membrana no buffer de bloqueio (TBS) por 45 min em RT.
Nota: TBS buffer com 5% BSA também pode ser usado como um buffer de bloqueio. - Incubar a membrana com o anticorpo primário listado na tabela 1. Lave a membrana com 1x TBST tampão de lavagem (20 mM Tris, pH 7,0, 150 mM NaCl e 0,1% Tween 20) para 3 min durante o balanço. Repita a lavagem 2x.
| Coca | Tampão de Dillution | Incubação | Comentários | |
| Anticorpo primário (anti-IRF5) | 1/1000 | Buffer de bloqueio TBS | Pernoite a 4 ° c ou 2 h em RT | Os anticorpos diluídos podem ser reutilizados várias vezes se armazenados a 4 ° c na presença de 0, 2% de azida sódica. |
| Anticorpo secundário (anti-coelho) | 1/10000 | Buffer de bloqueio TBS | 45 min na empresa RT | Os anticorpos diluídos podem ser reutilizados várias vezes se armazenados a 4 ° c na presença de 0, 2% de azida sódica. |
| Nota: A diluição precisa ser otimizada, pois varia entre os fabricantes. | ||||
Tabela 1: especificações dos anticorpos utilizados no procedimento de imunoblotação.
- Incubar a membrana com o anticorpo secundário listado na tabela 1. Lave as membranas durante 3 min em 1x tampão de lavagem TBST. Repita a lavagem 2x.
- Escaneie o Borrão usando um sistema apropriado da documentação do gel.
Resultados
O immunoblot (IB) com um anticorpo IRF5 foi executado em pilhas de CAL-1 não estimuladas ou estimulado com 1 μg/mL R848 para 2 h (Figura 1). Os lysates da pilha foram preparados, e o nativo PAGE foi executado. Em células CAL-1 não estimuladas, o IRF5 foi detectado como uma única banda na página nativa, correspondendo à sua forma monomérica. Em cima do tratamento de pilhas de cal-1 com R848 para 2 h, o nível do monômero IRF5 diminuiu com um aumento simultâneo na acumulação de uma faixa lentamente migrando que correspondesse à forma dimérica de IRF5.
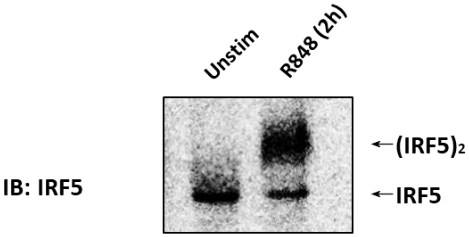
Figura 1: IRF5 endógena dimerizado em células Cal-1 quando estimulado com TLR7/8 agonista. As células de CAL-1 não foram tratadas ou tratados com R848 pelo tempo indicado. As amostras da proteína foram resolvidas pelo nativo PAGE e seguidas pelo IB usando o anticorpo IRF5. Por favor clique aqui para ver uma versão maior desta figura.
O immunoblot com anticorpo anti-IRF5 foi executado em IRF5-overexpressando as pilhas 293T untransfected e transfected com vários constructos. Os lisados celulares foram preparados e a página nativa foi realizada (Figura 2). Nenhum IRF5 foi detectado em células 293T não transfectadas, demonstrando a especificidade do anticorpo IRF5. Uma única faixa correspondente ao IRF5 monomérico só foi detectada nas células de 293T que superexpressam IRF5. Quando constrói a codificação IRF5-ativando proteínas, incluindo nrig (constitutivamente ativo Rig-I), Mavs, e ikkβ foram cotransfected, uma faixa lentamente migrando correspondente à forma de diméricas de IRF5 apareceu. Entretanto, NMDA5 (MDA5 constitutivamente ativo), uma proteína relacionada ao RIG-I, não induziu IRF5 dimerização quando cotransfected.

Figura 2: a Cotransfecção dos fatores ativadores da IRF5 induziu a dimerização IRF5 em células de 293T. As pilhas 293T eram untransfected (pista 1) ou transfected com IRF5 (pista 2) junto com os vários reguladores IRF5 (pistas 3 − 6). As amostras da proteína foram resolvidas pelo nativo PAGE e seguidas pelo IB usando o anticorpo IRF5. NRIG = N-terminal de RIG-I; NMDA5 = N-terminal de MDA5. (Publicado originalmente no jornal de Imunologia. KT Chow, C Wilkins, M Narita, R Green, M Knoll, YM Loo e M Gale Jr. 2018. Diferenciais e sobreposição de programas imunes regulado por IRF3 e IRF5 em células dendríticas Plasmacytoid. J. Immunol. 201 (10) 3036-3050. Copyright © 2018 a associação americana de imunologistas, Inc.23). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
O protocolo descrito aqui é uma página nativa modificada que distingue formas monoméricas e diméricas de IRF5 endógenas. Há poucos estudos relatando a detecção da ativação endógena de IRF5 utilizando a técnica de citometria de fluxo de imagem especializada23,27,28,30. Este protocolo usa uma técnica comum e reagentes e ferramentas comuns para avaliar o estado de ativação IRF5 endógena durante os primeiros eventos de ativação. O protocolo implica modificações simples a um protocolo nativo padrão da página para permitir a distinção entre as formas monoméricas e diméricas de IRF5. Pode facilmente ser adaptado aos estudos que usam outras linhas de pilha23. Este protocolo nativo modificado da página pode resolver o IRF5 endógeno em suas duas formas claramente sem interferências não específicas da proteína (Figura 2). A IRF5 endógena de células não estimuladas foi detectada como uma única banda clara neste sistema de gel, enquanto o tratamento com R848 por 2 h resultou no aparecimento de uma banda correspondente a dímeros IRF5 (Figura 1).
Um ensaio de dimerização de página nativa para IRF3, um fator de transcrição semelhante a IRF5 na mesma família, foi desenvolvido e amplamente utilizado nas últimas duas décadas32. Apesar dos testes e da solução de problemas extensivos, nós éramos incapazes de aplicar o mesmo protocolo que emprega o sistema de Laemmli Tris-Glycine para resolver IRF5 monómero e dímero. O protocolo descrito neste artigo utiliza géis de gradiente bis-Tris, que têm uma química muito diferente para os géis de porcentagem única de tris-glicina usados no protocolo IRF3. O pH e a composição química diferentes dos sistemas electrophoretic do gel podem ser cruciais em distinguir as várias formas de IRF3 e de IRF5. Na verdade, IRF3 e IRF5, embora semelhantes, têm propriedades diferentes (por exemplo, pontos isoelétricos e sites de modificação) provavelmente resultando em comportamento diferente, sendo separados em diferentes sistemas de gel.
Um buffer de execução de página nativa 1x contendo DOC foi usado para a execução de gel. O tampão precisa de ser preparado fresco ou mantido em um ambiente limpo e proteína-livre para evitar a aparência dos precipitados brancos que turvação a solução na câmara superior em conseqüência do doc que precipitam proteínas não específicas. É altamente recomendável que as amostras de IRF5 endógenas extraídas sejam submetidas à página nativa o mais rápido possível, preferencialmente dentro de uma semana com ciclos mínimos de congelamento-degelo. Caso contrário, pode haver degradação significativa da proteína. A degradação é observada com armazenamento a-80 ° c e-20 ° c. Além disso, o pH do tampão de execução SDS e o tampão de lavagem TBST devem ser ajustados em RT.
O volume final ideal da amostra carregada em cada poço era 10 − 15 μL, mas os ajustes ligeiros puderam ser exigidos dependendo dos tipos diferentes da pilha. Após a execução inicial em 85 V por 30 min, recomenda-se continuar a funcionar o gel em 150 V por aproximadamente 2 a 3 h para alcançar a separação e a definição distintas do monómero IRF5 e do dímero. Depois que o funcionamento é terminado, é da importância máxima segurar o gel meticulosamente de sua extremidade inferior devido a seus níveis diferenciais de densidade, variando de 3% na parte superior e do aumento para 12% na parte inferior. Neste caso, é preferível remover o gel da placa mergulhá-lo no tampão running usado, que actua como um coxim do impacto para minimizar a fricção e permite que o gel flutue afastado da placa para evitar a ruptura.
Alguns inconvenientes menores deste protocolo incluem a seleção limitada dos géis disponíveis para conseguir os resultados desejados. Géis caseiros e algumas outras marcas de géis comercialmente disponíveis foram testados sem sucesso. Em nossas mãos, o uso de um tampão running comercial e de um sistema do gel contribuiu à robustez e à reprodutibilidade deste protocolo, embora o teste extensivo de bufferes caseiros não fosse executado. A atenção aos detalhes é essencial, e a experiência é fundamental para o sucesso na obtenção de resultados claros. Finalmente, a resolução de IRF5 exigiu um longo tempo (i.e., 2 − 3 h) para obter uma separação ideal do monómero e dímero. Uma melhoria mais adicional e umas modificações no futuro podem melhorar a eficiência e minimizar as desvantagens deste protocolo.
Em conclusão, este protocolo é um ensaio robusto para a detecção de monômero IRF5 endógeno e dímero. É adequado para aplicações em vários tipos de células humanas e murinas expressando IRF5 endógena. Será uma ferramenta valiosa para estudar as vias reguladoras IRF5 e componentes de sinalização em vários tipos de células.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O trabalho foi apoiado pelo financiamento dos fundos de arranque da Fundação Croucher e da City University. Agradecemos a todos os membros do laboratório Chow por ajuda com o experimento e leitura crítica do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Life Technologies, HK | 21985023 | |
| 300 W/250 V power supply 230 V AC | Life Technologies, HK | PS0301 | |
| Anti-IRF5 antibody | Bethyl Laboratories, USA | A303-385 | |
| BIOSAN Rocker Shaker (cold room safe) | EcoLife, HK | MR-12 | |
| EDTA Buffer, pH 8, 0.5 M 4x 100 mL | Life Technologies | 15575020 | |
| Glycerol 500 mL | Life Technologies | 15514011 | |
| Glycine | Life Technologies, HK | 15527013 | |
| Goat anti-Mouse IgG DyLight 800 Conjugated Antibody | LAB-A-PORTER/Rockland, HK | 610-145-002-0.5 | |
| Goat anti-Rabbit IgG DyLight 800 Conjugated Antibody | LAB-A-PORTER/Rockland, HK | 611-145-002-0.5 | |
| Halt protease inhibitor cocktail (100x) | Thermo Fisher Scientific, HK | 78430 | |
| HEPES | Life Technologies, HK | 15630080 | |
| LI-COR Odyssey Blocking Buffer (TBS) | Gene Company, HK | 927-50000 | |
| Mini Tank blot module combo; Transfer module, accessories | Life Technologies, HK | NW2000 | |
| NativePAGE 3-12% gels, 10 well kit | Life Technologies, HK | BN1001BOX | |
| NativePAGE Running Buffer 20x | Life Technologies, HK | BN2001 | |
| NativePAGE Sample Buffer 4x | Life Technologies, HK | BN2003 | |
| NP-40 Alternative, Nonylphenyl Polyethylene Glycol | Tin Hang/Calbiochem, HK | #492016-100ML | |
| PBS 7.4 | Life Technologies, HK | 10010023 | |
| Polyvinylidene difluoride (PVDF) membrane | Bio-gene/Merck Millipore, HK | IPFL00010 | |
| Protein assay kit II (BSA) | Bio-Rad, HK | 5000002 | |
| R848 | Invivogen, HK | tlrl-r848 | |
| RPMI 1640 | Life Technologies, HK | 61870127 | |
| Sodium Chloride | ThermoFisher | BP358-1 | |
| Sodium deoxycholate ≥97% (titration) | Tin Hang/Sigma, HK | D6750-100G | |
| Tris | Life Technologies, HK | 15504020 | |
| TWEEN 20 | Tin Hang/Sigma, HK | #P9416-100ML |
Referências
- Takaoka, A., et al. Integral role of IRF-5 in the gene induction programme activated by Toll-like receptors. Nature. 434 (7030), 243-249 (2005).
- Ren, J., Chen, X., Chen, Z. J. IKKbeta is an IRF5 kinase that instigates inflammation. Proceedings of the National Academy of Sciences of the United States of America. 111 (49), 17438-17443 (2014).
- Negishi, H., Taniguchi, T., Yanai, H. The Interferon (IFN) Class of Cytokines and the IFN Regulatory Factor (IRF) Transcription Factor Family. Cold Spring Harbor Perspective Biology. 10 (11), (2018).
- Clark, D. N., et al. Four Promoters of IRF5 Respond Distinctly to Stimuli and are Affected by Autoimmune-Risk Polymorphisms. Frontiers in Immunology. 4, 360 (2013).
- Bo, M., et al. Rheumatoid arthritis patient antibodies highly recognize IL-2 in the immune response pathway involving IRF5 and EBV antigens. Scientific Reports. 8 (1), 1789 (2018).
- Duffau, P., et al. Promotion of Inflammatory Arthritis by Interferon Regulatory Factor 5 in a Mouse Model. Arthritis and Rheumatolpgy. 67 (12), 3146-3157 (2015).
- Feng, D., et al. Irf5-deficient mice are protected from pristane-induced lupus via increased Th2 cytokines and altered IgG class switching. European Journal of Immunology. 42 (6), 1477-1487 (2012).
- Richez, C., et al. IFN regulatory factor 5 is required for disease development in the FcgammaRIIB-/-Yaa and FcgammaRIIB-/- mouse models of systemic lupus erythematosus. The Journal of Immunology. 184 (2), 796-806 (2010).
- Tada, Y., et al. Interferon regulatory factor 5 is critical for the development of lupus in MRL/lpr mice. Arthritis and Rheumatology. 63 (3), 738-748 (2011).
- Weiss, M., et al. IRF5 controls both acute and chronic inflammation. Proceedings of the National Academy of Sciences of the United States of America. 112 (35), 11001-11006 (2015).
- Schoenemeyer, A., et al. The interferon regulatory factor, IRF5, is a central mediator of toll-like receptor 7 signaling. Journal of Biological Chemistry. 280 (17), 17005-17012 (2005).
- Balkhi, M. Y., Fitzgerald, K. A., Pitha, P. M. Functional regulation of MyD88-activated interferon regulatory factor 5 by K63-linked polyubiquitination. Molecular and Cellular Biology. 28 (24), 7296-7308 (2008).
- Lopez-Pelaez, M., et al. Protein kinase IKKβ-catalyzed phosphorylation of IRF5 at Ser462 induces its dimerization and nuclear translocation in myeloid cells. Proceedings of the National Academy of Sciences of the United States of America. 111 (49), 17432-17437 (2014).
- McGettrick, A. F., O'Neill, L. A. Localisation and trafficking of Toll-like receptors: an important mode of regulation. Current Opinion Immunology. 22 (1), 20-27 (2010).
- Baccala, R., Hoebe, K., Kono, D. H., Beutler, B., Theofilopoulos, A. N. TLR-dependent and TLR-independent pathways of type I interferon induction in systemic autoimmunity. Nature Medicine. 13 (5), 543-551 (2007).
- Gilliet, M., Cao, W., Liu, Y. J. Plasmacytoid dendritic cells: sensing nucleic acids in viral infection and autoimmune diseases. Nature Reviews Immunology. 8 (8), 594-606 (2008).
- Kawai, T., Akira, S. Toll-like Receptors and Their Crosstalk with Other Innate Receptors in Infection and Immunity. Immunity. 34 (5), 637-650 (2011).
- Liu, Z., Davidson, A. Taming lupus-a new understanding of pathogenesis is leading to clinical advances. Nature Medicine. 18 (6), 871-882 (2012).
- del Fresno, C., et al. Interferon-beta production via Dectin-1-Syk-IRF5 signaling in dendritic cells is crucial for immunity to C. albicans. Immunity. 38 (6), 1176-1186 (2013).
- Wang, X., et al. Expression Levels of Interferon Regulatory Factor 5 (IRF5) and Related Inflammatory Cytokines Associated with Severity, Prognosis, and Causative Pathogen in Patients with Community-Acquired Pneumonia. Medical Science Monitor. 24, 3620-3630 (2018).
- Zhao, Y., et al. Microbial recognition by GEF-H1 controls IKKepsilon mediated activation of IRF5. Nature Communications. 10 (1), 1349 (2019).
- Almuttaqi, H., Udalova, I. A. Advances and challenges in targeting IRF5, a key regulator of inflammation. FEBS Journal. 286 (9), 1624-1637 (2019).
- Chow, K. T., et al. Differential and Overlapping Immune Programs Regulated by IRF3 and IRF5 in Plasmacytoid Dendritic Cells. The Journal of Immunology. 201 (10), 3036-3050 (2018).
- Cheng, T. F., et al. Differential Activation of IFN Regulatory Factor (IRF)-3 and IRF-5 Transcription Factors during Viral Infection. The Journal of Immunology. 176 (12), 7462-7470 (2006).
- Chang Foreman, H. C., Van Scoy, S., Cheng, T. F., Reich, N. C. Activation of interferon regulatory factor 5 by site specific phosphorylation. PLoS One. 7 (3), 33098 (2012).
- Lin, R., Yang, L., Arguello, M., Penafuerte, C., Hiscott, J. A CRM1-dependent nuclear export pathway is involved in the regulation of IRF-5 subcellular localization. Journal of Biological Chemistry. 280 (4), 3088-3095 (2005).
- Stone, R. C., et al. Interferon regulatory factor 5 activation in monocytes of systemic lupus erythematosus patients is triggered by circulating autoantigens independent of type I interferons. Arthritis and Rheumatology. 64 (3), 788-798 (2012).
- De, S., et al. B Cell-Intrinsic Role for IRF5 in TLR9/BCR-Induced Human B Cell Activation, Proliferation, and Plasmablast Differentiation. Frontiers in Immunology. 8, 1938 (2017).
- Fabie, A., et al. IRF-5 Promotes Cell Death in CD4 T Cells during Chronic Infection. Cell Reports. 24 (5), 1163-1175 (2018).
- Cushing, L., et al. IRAK4 kinase activity controls Toll-like receptor-induced inflammation through the transcription factor IRF5 in primary human monocytes. Journal of Biological Chemistry. 292 (45), 18689-18698 (2017).
- Li, C., Arakawa, T. Application of native polyacrylamide gel electrophoresis for protein analysis: Bovine serum albumin as a model protein. International Journal of Biological Macromolecules. 125, 566-571 (2019).
- Iwamura, T., et al. Induction of IRF-3/-7 kinase and NF-kappaB in response to double-stranded RNA and virus infection: common and unique pathways. Genes to Cells. 6 (4), 375-388 (2001).
- Subhadarshanee, B., Mohanty, A., Jagdev, M. K., Vasudevan, D., Behera, R. K. Surface charge dependent separation of modified and hybrid ferritin in native PAGE: Impact of lysine 104. Biochimica et Biophysica Acta - Proteins and Proteomics. 1865 (10), 1267-1273 (2017).
- Reynolds, J. A., Tanford, C. Binding of Dodecyl Sulfate to Proteins at High Binding Ratios - Possible Implications for State of Proteins in Biological Membranes. Proceedings of the National Academy of Sciences of the United States of America. 66 (3), 1002 (1970).
- Manning, M., Colon, W. Structural basis of protein kinetic stability: resistance to sodium dodecyl sulfate suggests a central role for rigidity and a bias toward beta-sheet structure. Biochemistry. 43 (35), 11248-11254 (2004).
- Balkhi, M. Y., Fitzgerald, K. A., Pitha, P. M. IKKalpha negatively regulates IRF-5 function in a MyD88-TRAF6 pathway. Cellular Signalling. 22 (1), 117-127 (2010).
- Paun, A., et al. Functional characterization of murine interferon regulatory factor 5 (IRF-5) and its role in the innate antiviral response. Journal of Biological Chemistry. 283 (21), 14295-14308 (2008).
- Yasuda, K., et al. Murine dendritic cell type I IFN production induced by human IgG-RNA immune complexes is IFN regulatory factor (IRF)5 and IRF7 dependent and is required for IL-6 production. The Journal of Immunology. 178 (11), 6876-6885 (2007).
- Steinhagen, F., et al. IRF-5 and NF-kappaB p50 co-regulate IFN-beta and IL-6 expression in TLR9-stimulated human plasmacytoid dendritic cells. European Journal of Immunology. 43 (7), 1896-1906 (2013).
- Gratz, N., et al. Type I interferon production induced by Streptococcus pyogenes-derived nucleic acids is required for host protection. PLoS Pathogens. 7 (5), 1001345 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados