Method Article
Native Polyacrylamid-Gel-Elektrophorese Immunoblot-Analyse der endogenen IRF5-Dimerisierung
In diesem Artikel
Zusammenfassung
Eine native Western Blot-Methode zur Analyse der endogenen Interferon-Regulierungsfaktor 5-Dimerisierung in der CAL-1-Plasmazytoid-Dendritischen Zelllinie wird beschrieben. Dieses Protokoll kann auch auf andere Zelllinien angewendet werden.
Zusammenfassung
Interferon-Regulierungsfaktor 5 (IRF5) ist ein wichtiger Transkriptionsfaktor für die Regulierung der Immunantwort. Es wird nach dem Signalweg des toll-ähnlichen Rezeptor-Myeloiden-Differenzierungsgens 88 (TLR-MyD88) aktiviert. Die IRF5-Aktivierung beinhaltet Phosphorylierung, Dimerisierung und nachfolgende Translokation vom Zytoplasma in den Zellkern, was wiederum die Genexpression verschiedener pro-inflammatorischer Zytokine induziert. Ein Nachweistest für die IRF5-Aktivierung ist für die Untersuchung von IRF5-Funktionen und deren relevanten Wegen unerlässlich. Dieser Artikel beschreibt einen robusten Test zum Nachweis der endogene IRF5-Aktivierung in der CAL-1-Linie der humanen Plasmazytoid-Dendritischen Zelle (pDC). Das Protokoll besteht aus einem modifizierten nicht denatorischen Elektrophorese-Assay, der IRF5 in seiner Monomer- und Dimerform unterscheiden kann und somit einen erschwinglichen und sensiblen Ansatz zur Analyse der IRF5-Aktivierung bietet.
Einleitung
Interferon-Regulierungsfaktor 5 (IRF5) ist ein wichtiger Transkriptionsregulator, der eine herausragende Rolle bei der Regulierung der Immunantwort spielt, insbesondere bei der Freisetzung von proinflammatorischen Zytokinen und Typ-I-Interferonen (IFNs)1,2 ,3. Die Fehlregulation von IRF5 ist ein Faktor bei zahlreichen Autoimmunerkrankungen, wie verschiedene Polymorphismen im IRF5-Lokus zeigen, die mit systemischem Lupus erythematodes, Multipler Sklerose, rheumatoider Arthritis usw. assoziiert sind.4, 5,6,7,8,9,10. Daher ist ein robuster Nachweis-Test für den endogenen IRF5-Aktivierungszustand entscheidend für das Verständnis der regulatorischen Pfade und nachgelagerten Wirkungen von IRF5 in einem physiologisch relevanten zellulären Kontext.
IRF5 wird konstitutiv in Monozyten, dendritischen Zellen (DCs), B-Zellen und Makrophagen1,11ausgedrückt. Wie bei anderen Transkriptionsfaktoren der IRF-Familie befindet sich IRF5 im Zytoplasma in seinem latenten Zustand. Bei aktivierung wird IRF5 phosphoryliert und bildet Homodimere, die sich dann in den Kern transortieren und an spezifische regulatorische Elemente von Genen binden, die Typ I IFNs und pro-inflammatorische Zytokine kodieren, was schließlich die Expression dieser Gene induzieren1 ,2,11,12,13. IRF5 reguliert die angeborenen Immunantworten stromabwärts von verschiedenen tollähnlichen Rezeptoren (TLRs), wie TLR7, TLR 8 und TLR 9, die in Endosomen lokalisiert sind und MyD88 für die Signalisierung1,11,14verwenden. Diese TLRs erkennen in erster Linie fremde Nukleinsäurearten wie einsträngige RNA (ssRNA) und unmethylierte CpG-DNA, die symptomatisch für eine Infektion15,16,17,18sind. IRF5 hat gezeigt, dass Immunreaktionen gegen bakterielle, virale, und Pilzinfektionen regulieren19,20,21. Angesichts der einflussreichen und vielfältigen Rolle von IRF5 im Immunsystem könnte die Verbesserung oder Dämpfung der IRF5-Aktivität als neuer Weg für die Entwicklung von therapeutischen Wirkstoffen dienen22. Daher ist es wichtig, ein Protokoll zur Überwachung des Aktivierungsstatus des endogenen IRF5 zu entwickeln, um eine gründliche Untersuchung der Wege und Mechanismen zur Regulierung der IRF5-Aktivität in verschiedenen Zelltypen zu ermöglichen.
Nach bestem Wissen und Gewissen wurde vor der Entwicklung dieses Protokolls kein biochemischer oder gelelektrophoretischer Assay zur endogenen IRF5-Aktivierung veröffentlicht. Die Phosphorylierung hat sich als wichtiger erster Schritt der IRF5-Aktivierung erwiesen, und es wurde ein phosphospezifischer IRF5-Antikörper entwickelt, der zur Entdeckung und Bestätigung eines für die IRF5-Aktivität wichtigen Serinrückstands führte13. Während der Antikörper jedoch deutlich phosphoryliertes IRF5 erkennt, wenn er immunpräzipiert oder überexprimiert23 ist,kann er die IRF5-Phosphorylierung in einem ganzen Zelllysat in unseren Händen nicht erkennen (Daten werden nicht angezeigt). Dimerisierung ist der nächste Schritt der IRF5-Aktivierung, und viele wichtige Studien, die diesen Schritt bisher untersuchten, stützten sich auf die Überexpression von IRF5 mit Epitop-Tag, oft in irrelevanten Zelltypen, die normalerweise Nicht IRF511,12 ausdrücken. ,24,25. Frühere Studien haben gezeigt, dass dimerisierte IRF5 kann nicht immer in den Kern translosien und ist daher nicht unbedingt voll aktiviert25,26. Ein Test für die endogene IRF5-Kernlokalisierung wurde entwickelt, um die IRF5-Aktivierung durch bildgebende Durchflusszytometrie27zu bewerten. Dieser Test wurde in Studien angewendet, die für das Verständnis der IRF5-Aktivität entscheidend waren, insbesondere bei primären oder seltenen Zelltypen28,29 und das Wissen auf diesem Gebiet stark weiterentwickelt. Dieser Test stützt sich jedoch auf ein spezialisiertes Instrument, das forschern nicht allgemein zugänglich ist. Darüber hinaus ist es häufig notwendig, die ersten Schritte der Aktivierung zu untersuchen, während die IRF5-Regulierungspfade seziert und vorgeschaltete Regulierungs- und Signalwegkomponenten identifiziert werden. Diese Studie bietet einen robusten und zuverlässigen biochemischen Test für die frühen Aktivierungsereignisse von IRF5, der in Laboren durchgeführt werden kann, die mit molekularbiologischen Werkzeugen ausgestattet sind. Das hier beschriebene Protokoll wird sehr nützlich sein, um die Wege und Mechanismen von IRF5-Aktionen zu untersuchen, insbesondere in Kombination mit orthogonalen Assays wie der zytometrischen Analyse des bildgebenden Durchflusses der IRF5-Kernlokalisierung23, 27,28,30.
Native Polyacrylamid-Gelelektrophorese (native PAGE) ist eine weit verbreitete Methode zur Analyse von Proteinkomplexen31,32. Im Gegensatz zur Natriumdodecylsulfat-Polyacrylamid-Gelelektrophorese (SDS-PAGE) trennt native PAGE Proteine anhand ihrer Form, Größe und Ladung. Es behält auch native Proteinstruktur ohne Denaturierung31,33,34,35. Das vorgestellte Protokoll nutzt diese Funktionen der nativen PAGE und erkennt sowohl monomere als auch dimerische Formen von IRF5. Diese Methode ist besonders wichtig für die Erkennung von Frühaktivierungsereignissen, da es keinen geeigneten handelsüblichen Antikörper gibt, der endogene phosphorylierte IRF5 detektieren kann. Zuvor wurden in mehreren veröffentlichten Studien native PAGE verwendet, um die IRF5-Dimerisierung zu bewerten. Die meisten dieser Studien hingen jedoch von der Überexpression von exogenem Epitop mit IRF5-Tags ab, um den Aktivierungsstatus2,13,24,36,37 zu analysieren. . Diese Arbeit stellt ein Schritt-für-Schritt-Protokoll zur Analyse der endogenen IRF5-Dimerisierung über eine modifizierte native PAGE-Technik in einer menschlichen Plasmazytoid-Dendritischen Zelle (pDC) dar, bei der sich die IRF5-Aktivität als entscheidend für ihre Funktion erwiesen hat1, 38,39,40. Dieselbe Technik wurde auch auf andere Zelllinienangewendet 23.
Protokoll
HINWEIS: Das hier beschriebene Protokoll verwendet CAL-1 pDC-Zelllinie, die mit resiquimod (R848), einem Agonisten für TLR7/8, behandelt wird. Dieses Protokoll wurde auf andere menschliche und murine Zelltypen angewendet, einschließlich RAW 264.7 (murine Makrophagenlinie), THP-1 (menschliche monozytäre Zelllinie), BJAB (menschliche B-Zelllinie), Ramos (menschliche B-Zelllinie) und MUTZ-3 (menschliche dendritische Zelllinie)23.
1. Stimulation von CAL-1-Zellen
- Halten Sie CAL-1-Zellkulturen in einem T75-Kolben bei 37 °C und 5 %CO2 unter sterilen Bedingungen mit 20 bis 25 ml RPMI 1640 Medium, das 5% fetales Rinderserum (FBS), 25 mM HEPES und 1x Mercaptoethanol (d. h. komplettes RPMI 1640 medium) enthält.
- Übertragen Sie die Zellen in ein 50 ml konisches Rohr.
HINWEIS: CAL-1-Zellen sind nicht haftende Zellen. Bei anhaftenden Zelltypen kann eine Standard-Trypsinisierung durchgeführt werden, um Zellen zu ernten. - Zentrifugieren Sie die Zellen bei 200 x g für 5 min bei Raumtemperatur (RT). Entfernen Sie den Überstand und setzen Sie das Zellpellet in 8 ml des gesamten RPMI 1640 Mediums wieder auf, um eine homogene einzellige Suspension zu erhalten.
- Zählen Sie die Zellen mit einem Hämozytometer. Säen Sie die Zellen mit einer Dichte von 1 x 106 Zellen pro Brunnen in einer 6-Well-Platte mit 4 ml vorgewärmten kompletten RPMI 1640 Medium in jedem Brunnen. Inkubieren Sie für 20 bis 24 h bei 37 °C und 5 %CO2, damit die Konfluenz 90 % bis 95 % erreichen kann (entsprechend etwa 1,5 x 106 Zellen).
- Stimulieren Sie die Zellen, indem Sie 4 l von 1 mg/ml R848 pro Bohrung der 6 Wellplatte (Endkonzentration von 1 g/ml) hinzufügen. Richten Sie auch eine unstimulierte Kontrolle gut mit Zellen ohne die R848 Behandlung.
- Stellen Sie sicher, dass der R848 gleichmäßig verteilt ist, indem Sie die Platte sanft zur Seite schaukeln. Dann inkubieren Sie die Zellen für 2-16 h im Inkubator bei 37 °C und 5%CO2.
2. Extraktion von Zellproteinen
- Übertragen Sie die Zellsuspensionen von der 6-Well-Platte in 5 ml Zentrifugenrohre.
- Zentrifugieren Bei 200 x g für 5 min bei RT. Entfernen Sie den Überstand und setzen Sie das Zellpellet in 1 ml phosphatgepufferter Saline (PBS) wieder auf, um eine homogene einzellige Suspension zu erhalten.
- Übertragen Sie die Zellsuspension in ein 1,5 ml Zentrifugenrohr.
- Drehen Sie bei 12.000 x g für 0,5 x 1 min bei 4 °C kurz nach unten und entfernen Sie den Überstand vorsichtig.
- Vorbereiten des Lysepuffers mit 6,25 ml von 1 M Tris-HCl pH 7,4 (Endkonzentration von 25 mM), 7,5 ml 5 M NaCl (Endkonzentration von 150 mM), 0,5 ml von 0,5 m EDTA (Endkonzentration von 1 mM), 2,5 ml NP-40 (Endkonzentration von 1%) und 7,5 ml Glycerin (Endkonzentration von 5%) in 250 ml entionisiertem Wasser (ddH2O). Fügen Sie 100x Protease-Hemmer-Einweg-Cocktail in eine endige Konzentration von 1x in den Lysepuffer kurz vor Gebrauch. Den vorbereiteten Lysepuffer auf Eis halten.
HINWEIS: Der Lysepuffer ohne Protease kann bei 4 °C gelagert werden. - Setzen Sie das Zellpellet in 30 l eiskalten Lysepuffer auf und mischen Sie es durch Pipettieren nach oben und unten.
- Auf Eis für 15-20 min inkubieren.
- Klären Sie das Lysat durch Zentrifugieren bei 12.000 x g für 15 bis 20 min bei 4 °C. Übertragen Sie den Überstand in ein neues vorgechilltes 1,5 ml Zentrifugenrohr. Halten Sie die Extrakte jederzeit auf Eis.
HINWEIS: Zelllysate können bei -20 °C oder -80 °C gelagert werden. Kochen Sie die Proben nicht. - Messen Sie die Proteinkonzentration mit Bradford-Reagenz.
3. Analyse der IRF5-Dimerisierung durch Native PAGE
- Bereiten Sie die oberen (-) und unteren (+) Kammerelektrophoresepuffer vor. Der obere Kammerpuffer besteht aus 0,3% Natriumdeoxycholat (NaDOC) im 1x nativen PAGE-Laufpuffer, und die untere Kammer besteht aus nur 1x nativem PAGE-Laufpuffer.
HINWEIS: Bereiten Sie einen frischen oberen Kammerpuffer für jeden neuen Lauf vor. - Spülen Sie ein 3%-12% natives PAGE-Gel gründlich mit Wasser, ohne die Brunnen zu verzerren. Setzen Sie das Gel in den Mini-Geltank und entfernen Sie den Kamm. Das Gel in einem 4 °C-Kaltraum oder auf Eis bei 150 V 30 min vorrunden.
HINWEIS: Prerunning entfernt übermäßige Ammoniak- und Persulfationen, die das Laufen des Gels stören können. - Bereiten Sie während der Vorlaufzeit die Proben für die Beladung vor, indem Sie die auf Eis gehaltenen zellulären Proteine mit einem 4x nativen Probenpuffer mischen.
- Laden Sie nach der Vorrunde 10 bis 15 g Protein mit einem Endvolumen von 10 bis 15 l pro Probe.
HINWEIS: Eine Überlastung des Proteins kann zu Verschmierungen führen. - Führen Sie Gel bei 85 V für 30 min, dann 150 V für 2 h.
HINWEIS: Unter Berücksichtigung der Unterschiede in der Ausrüstung und zelllinien, die von verschiedenen Labors verwendet werden, können geringfügige Änderungen an der Konzentration von Proteinproben, Spannung und Laufzeit geeignet sein, dieses Protokoll zu optimieren. Die Senkung der Vorlauf- und Laufspannung bei gleichzeitiger Erhöhung der Laufzeit kann dazu beitragen, die Dimer-Auflösung und die Ergebniskonsistenz zu verbessern. - Das Gel in SDS-Laufpuffer (25 mM Tris pH 8,3, 250 mM Glycin, 0,1% SDS) 30 min bei RT einweichen.
HINWEIS: Es ist keine Agitation erforderlich. Gelegentlich kann die Intensität des Bandes nicht proportional zur Menge des Proteins sein, das aufgrund einer ineffizienten Übertragung in Gegenwart von Desoxycholat (DOC) geladen wird, was hauptsächlich die monomere Form von IRF5 betrifft. Das Einweichen des Gels in den SDS-Laufpuffer vor der Übertragung löst dieses Problem. Das Gel ist zerbrechlich. Behandeln Sie mit extremer Sorgfalt vom unteren (d. h. höheren Prozentsatz) Ende des Gels.
4. Immunoblot-Analyse von IRF5
- Aktivieren Sie die Polyvinylidendifluorid-Membran (PDVF), indem Sie sie ca. 5 min in Methanol einweichen.
- Machen Sie einen Schnitt an einer Ecke der Membran, um ihre Ausrichtung anzuzeigen. Montieren Sie das Transfer-Sandwich gemäß der sequenziellen Reihenfolge, die im Herstellerprotokoll beschrieben ist, mit besonderer Sorgfalt, um sicherzustellen, dass keine Luftblasen im Inneren gefangen sind.
- Legen Sie die Transferkassette in den Tank und übertragen Sie bei 20 V für 1 h auf Eis.
HINWEIS: Führen Sie alle Inkubationen und Wälzungen in den folgenden Schritten mit einem schaukelnden Shaker durch. - Entfernen Sie die Membran mit Kunststoffzangen aus der Kassette, nachdem die Übertragung abgeschlossen ist. Blockieren Sie die Membran im Blockierpuffer (TBS) für 45 min bei RT.
HINWEIS: TBS-Puffer mit 5% BSA kann auch als Blockierpuffer verwendet werden. - Inkubieren Sie die Membran mit dem in Tabelle 1aufgeführten primären Antikörper. Waschen Sie die Membran mit 1x TBST Waschpuffer (20 mM Tris, pH 7,0, 150 mM NaCl und 0,1% Tween 20) für 3 min beim Schaukeln. Wiederholen Sie die Wäsche 2x.
| Dillution | Dillution-Puffer | ausbrüten | Kommentare | |
| Primärer Antikörper (Anti-IRF5) | 1/1,000 | TBS-Blockierpuffer | Übernachtung bei 4 °C oder 2 h bei RT | Verdünnte Antikörper können mehrmals wiederverwendet werden, wenn sie bei 4 °C in Gegenwart von 0,02% Natriumazid gelagert werden. |
| Sekundärer Antikörper (Anti-Kaninchen) | 1/10,000 | TBS-Blockierpuffer | 45 Min. bei RT | Verdünnte Antikörper können mehrmals wiederverwendet werden, wenn sie bei 4 °C in Gegenwart von 0,02% Natriumazid gelagert werden. |
| HINWEIS: Die Verdünnung muss optimiert werden, da sie von Hersteller zu Hersteller unterschiedlich ist. | ||||
Tabelle 1: Spezifikationen der Antikörper, die im Immunoblotting-Verfahren verwendet werden.
- Inkubieren Sie die Membran mit dem in Tabelle 1aufgeführten sekundären Antikörper. Waschen Sie die Membranen für 3 min in 1x TBST Waschpuffer. Wiederholen Sie die Wäsche 2x.
- Scannen Sie den Fleck mit einem geeigneten Gel-Dokumentationssystem.
Ergebnisse
Der Immunoblot (IB) mit einem Anti-IRF5-Antikörper wurde an CAL-1-Zellen durchgeführt, die unstimuliert oder stimuliert wurden mit 1 g/ml R848 für 2 h(Abbildung 1). Zelllysate wurden vorbereitet, und die native PAGE wurde durchgeführt. In nicht stimulierten CAL-1-Zellen wurde IRF5 als einzelnes Band auf der nativen PAGE nachgewiesen, entsprechend seiner monomeren Form. Bei der Behandlung von CAL-1-Zellen mit R848 für 2 h verringerte sich der Gehalt an IRF5-Monomer mit einer gleichzeitigen Zunahme der Akkumulation eines langsam migrierenden Bandes, das der dimeren Form von IRF5 entsprach.
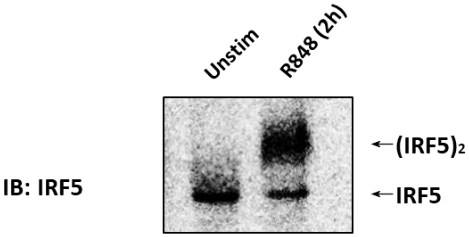
Abbildung 1: Endogenes IRF5 in CAL-1-Zellen dimerisiert, wenn es mit TLR7/8-Agonisten stimuliert wird. CAL-1-Zellen wurden für die angegebene Zeit unbehandelt oder mit R848 behandelt. Proteinproben wurden von nativer PAGE gelöst und gefolgt von IB mit dem Anti-IRF5-Antikörper. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Der Immunoblot mit Anti-IRF5-Antikörper wurde an IRF5-overexektierten 293T-Zellen durchgeführt, die mit verschiedenen Konstrukten transfiziert und transfiziert wurden. Zelllysate wurden vorbereitet und native PAGE durchgeführt (Abbildung 2). In untransfizierten 293T-Zellen wurde kein IRF5 nachgewiesen, was die Spezifität des Anti-IRF5-Antikörpers demonstriert. Ein einzelnes Band, das monomeren IRF5 entspricht, wurde nur in den 293T-Zellen, die IRF5 überexzättieren, nachgewiesen. Wenn Konstrukte, die IRF5-aktivierende Proteine kodieren, einschließlich NRIG (konstitutiv aktive RIG-I), MAVS und IKK, kotransfiziert wurden, erschien ein langsam migrierendes Band, das der dimeren Form von IRF5 entspricht. NMDA5 (konstitutiv aktives MDA5), ein verwandtes Protein von RIG-I, induzierte jedoch keine IRF5-Dimerisierung, wenn es kotransfiziert wurde.

Abbildung 2: Kotransfektion von IRF5-aktivierenden Faktoren induzierte IRF5-Dimerisierung in 293T-Zellen. Die 293T-Zellen waren untransfiziert (Spur 1) oder mit IRF5 (Spur 2) zusammen mit verschiedenen IRF5-Reglern (Spur 3-6) transfiziert. Proteinproben wurden von nativer PAGE gelöst und gefolgt von IB mit dem Anti-IRF5-Antikörper. NRIG = N-Terminal von RIG-I; NMDA5 = N-Terminal von MDA5. (Ursprünglich veröffentlicht in The Journal of Immunology. KT Chow, C Wilkins, M Narita, R Green, M Knoll, YM Loo und M Gale Jr. 2018. Differential- und Überlappungsimmunprogramme reguliert durch IRF3 und IRF5 in Plasmazytoiden dendritischen Zellen. J. Immunol. 201 (10) 3036-3050. Copyright © 2018 The American Association of Immunologists, Inc.23). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Das hier beschriebene Protokoll ist eine modifizierte native PAGE, die sowohl monomische als auch dimerische Formen endogener IRF5 unterscheidet. Es gab nur wenige Studien, die über den Nachweis der endogenen IRF5-Aktivierung mit der spezialisierten Bildflusszytometrietechnik23,27,28,30berichteten. Dieses Protokoll verwendet eine gängige Technik und gängige Reagenzien und Werkzeuge, um den endogenen IRF5-Aktivierungszustand während der frühen Aktivierungsereignisse zu bewerten. Das Protokoll beinhaltet einfache Änderungen an einem nativen Standard-PAGE-Protokoll, um die Unterscheidung zwischen den monomeren und dimerischen Formen von IRF5 zu ermöglichen. Es kann leicht an Studien mit anderen Zelllinien angepasst werden23. Dieses modifizierte native PAGE-Protokoll kann endogenes IRF5 in seinen beiden Formen eindeutig ohne unspezifische Proteinstörungen auflösen (Abbildung 2). Endogene IRF5 aus nicht stimulierten Zellen wurde als klares Einzelband in diesem Gelsystem nachgewiesen, während die Behandlung mit R848 für 2 h zum Auftreten eines Bandes führte, das IRF5-Dimern entspricht (Abbildung 1).
Ein nativer PAGE-Dimerisierungstest für IRF3, ein ähnlicher Transkriptionsfaktor wie IRF5 in der gleichen Familie, wurde in den letzten zwei Jahrzehnten entwickelt und weit verbreitet32. Trotz umfangreicher Tests und Fehlerbehebungen konnten wir nicht dasselbe Protokoll anwenden, das das Laemmli Tris-Glycin-System verwendet, um IRF5-Monomer und Dimer zu lösen. Das in diesem Artikel beschriebene Protokoll verwendet Bis-Tris Gradientengele, die eine ganz andere Chemie haben als die Tris-Glycin-Einzelprozentgele, die im IRF3-Protokoll verwendet werden. Die unterschiedliche pH-Wert- und chemischen Zusammensetzung der gelelektrophoretischen Systeme kann entscheidend für die Unterscheidung der verschiedenen Formen von IRF3 und IRF5 sein. Tatsächlich weisen IRF3 und IRF5, ähnlich, unterschiedliche Eigenschaften auf (z. B. isoelektrische Punkte und Modifikationsstellen), die wahrscheinlich zu unterschiedlichem Verhalten führen, während sie auf verschiedenen Gelsystemen getrennt werden.
Für den Gellauf wurde ein 1x nativer PAGE-Laufpuffer mit DOC verwendet. Der Puffer muss frisch zubereitet oder in einer sauberen und proteinfreien Umgebung aufbewahrt werden, um zu vermeiden, dass weiße Ausscheidungen die Lösung in der oberen Kammer trüben, da DOC unspezifische Proteine ausgefällt. Es wird dringend empfohlen, die extrahierten endogene IRF5-Proben so schnell wie möglich der nativen PAGE zu unterziehen, vorzugsweise innerhalb einer Woche mit minimalen Frost-Tau-Zyklen. Andernfalls kann es zu einem signifikanten Proteinabbau kommen. Der Abbau wird bei Lagerung bei -80 °C und -20 °C beobachtet. Darüber hinaus sollte der pH-Wert des SDS-Laufpuffers und des TBST-Waschpuffers bei RT eingestellt werden.
Das ideale Endvolumen der in jedem Bohrkörper geladenen Probe lag bei 10 bis 15 L, aber je nach Zelltypen können leichte Anpassungen erforderlich sein. Nach dem ersten Lauf bei 85 V für 30 min wird empfohlen, das Gel bei 150 V für ca. 2 bis 3 h weiterlaufen zu lassen, um eine deutliche Trennung und Auflösung des IRF5-Monomers und Dimers zu erreichen. Nach Dem Lauf ist es von größter Bedeutung, das Gel von seinem unteren Ende aus akribisch zu behandeln, da es unterschiedlich dicht ist, von 3% an der Spitze bis zu 12% am unteren Ende. In diesem Fall ist es vorzuziehen, das Gel von der Platte zu entfernen, indem es in den verwendeten Laufpuffer eintaucht, der als Aufprallkissen dient, um Reibung zu minimieren und es dem Gel ermöglicht, von der Platte wegzuschwimmen, um Bruch zu vermeiden.
Einige kleinere Nachteile dieses Protokolls sind die begrenzte Auswahl an Gelen, die zur Verfügung stehen, um die gewünschten Ergebnisse zu erzielen. Hausgemachte Gele und ein paar andere Marken von kommerziell erhältlichen Gelen wurden erfolglos getestet. In unseren Händen trug die Verwendung eines kommerziellen Laufpuffers und Gelsystems zur Robustheit und Reproduzierbarkeit dieses Protokolls bei, obwohl keine umfangreichen Tests von hausgemachten Puffern durchgeführt wurden. Liebe zum Detail ist von wesentlicher Bedeutung, und Erfahrung ist der Schlüssel zum Erfolg, um klare Ergebnisse zu erzielen. Schließlich benötigte die Auflösung von IRF5 eine lange Zeit (d. h. 2 x 3 h), um eine ideale Trennung von Monomer und Dimer zu erhalten. Weitere Verbesserungen und Modifikationen in der Zukunft können die Effizienz verbessern und die Nachteile dieses Protokolls minimieren.
Zusammenfassend ist dieses Protokoll ein robuster Test für den Nachweis von endogenem IRF5-Monomer und Dimer. Es eignet sich für Anwendungen in verschiedenen menschlichen und murinen Zelltypen, die endogene IRF5 exdrücken. Es wird ein wertvolles Werkzeug sein, um die IRF5-Regulierungspfade und Signalkomponenten in verschiedenen Zelltypen zu untersuchen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Arbeit wurde durch Fördermittel der Croucher Foundation und der Startup-Fonds der City University unterstützt. Wir danken allen Mitgliedern des Chow-Labors für die Hilfe beim Experiment und der kritischen Lektüre des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Life Technologies, HK | 21985023 | |
| 300 W/250 V power supply 230 V AC | Life Technologies, HK | PS0301 | |
| Anti-IRF5 antibody | Bethyl Laboratories, USA | A303-385 | |
| BIOSAN Rocker Shaker (cold room safe) | EcoLife, HK | MR-12 | |
| EDTA Buffer, pH 8, 0.5 M 4x 100 mL | Life Technologies | 15575020 | |
| Glycerol 500 mL | Life Technologies | 15514011 | |
| Glycine | Life Technologies, HK | 15527013 | |
| Goat anti-Mouse IgG DyLight 800 Conjugated Antibody | LAB-A-PORTER/Rockland, HK | 610-145-002-0.5 | |
| Goat anti-Rabbit IgG DyLight 800 Conjugated Antibody | LAB-A-PORTER/Rockland, HK | 611-145-002-0.5 | |
| Halt protease inhibitor cocktail (100x) | Thermo Fisher Scientific, HK | 78430 | |
| HEPES | Life Technologies, HK | 15630080 | |
| LI-COR Odyssey Blocking Buffer (TBS) | Gene Company, HK | 927-50000 | |
| Mini Tank blot module combo; Transfer module, accessories | Life Technologies, HK | NW2000 | |
| NativePAGE 3-12% gels, 10 well kit | Life Technologies, HK | BN1001BOX | |
| NativePAGE Running Buffer 20x | Life Technologies, HK | BN2001 | |
| NativePAGE Sample Buffer 4x | Life Technologies, HK | BN2003 | |
| NP-40 Alternative, Nonylphenyl Polyethylene Glycol | Tin Hang/Calbiochem, HK | #492016-100ML | |
| PBS 7.4 | Life Technologies, HK | 10010023 | |
| Polyvinylidene difluoride (PVDF) membrane | Bio-gene/Merck Millipore, HK | IPFL00010 | |
| Protein assay kit II (BSA) | Bio-Rad, HK | 5000002 | |
| R848 | Invivogen, HK | tlrl-r848 | |
| RPMI 1640 | Life Technologies, HK | 61870127 | |
| Sodium Chloride | ThermoFisher | BP358-1 | |
| Sodium deoxycholate ≥97% (titration) | Tin Hang/Sigma, HK | D6750-100G | |
| Tris | Life Technologies, HK | 15504020 | |
| TWEEN 20 | Tin Hang/Sigma, HK | #P9416-100ML |
Referenzen
- Takaoka, A., et al. Integral role of IRF-5 in the gene induction programme activated by Toll-like receptors. Nature. 434 (7030), 243-249 (2005).
- Ren, J., Chen, X., Chen, Z. J. IKKbeta is an IRF5 kinase that instigates inflammation. Proceedings of the National Academy of Sciences of the United States of America. 111 (49), 17438-17443 (2014).
- Negishi, H., Taniguchi, T., Yanai, H. The Interferon (IFN) Class of Cytokines and the IFN Regulatory Factor (IRF) Transcription Factor Family. Cold Spring Harbor Perspective Biology. 10 (11), (2018).
- Clark, D. N., et al. Four Promoters of IRF5 Respond Distinctly to Stimuli and are Affected by Autoimmune-Risk Polymorphisms. Frontiers in Immunology. 4, 360 (2013).
- Bo, M., et al. Rheumatoid arthritis patient antibodies highly recognize IL-2 in the immune response pathway involving IRF5 and EBV antigens. Scientific Reports. 8 (1), 1789 (2018).
- Duffau, P., et al. Promotion of Inflammatory Arthritis by Interferon Regulatory Factor 5 in a Mouse Model. Arthritis and Rheumatolpgy. 67 (12), 3146-3157 (2015).
- Feng, D., et al. Irf5-deficient mice are protected from pristane-induced lupus via increased Th2 cytokines and altered IgG class switching. European Journal of Immunology. 42 (6), 1477-1487 (2012).
- Richez, C., et al. IFN regulatory factor 5 is required for disease development in the FcgammaRIIB-/-Yaa and FcgammaRIIB-/- mouse models of systemic lupus erythematosus. The Journal of Immunology. 184 (2), 796-806 (2010).
- Tada, Y., et al. Interferon regulatory factor 5 is critical for the development of lupus in MRL/lpr mice. Arthritis and Rheumatology. 63 (3), 738-748 (2011).
- Weiss, M., et al. IRF5 controls both acute and chronic inflammation. Proceedings of the National Academy of Sciences of the United States of America. 112 (35), 11001-11006 (2015).
- Schoenemeyer, A., et al. The interferon regulatory factor, IRF5, is a central mediator of toll-like receptor 7 signaling. Journal of Biological Chemistry. 280 (17), 17005-17012 (2005).
- Balkhi, M. Y., Fitzgerald, K. A., Pitha, P. M. Functional regulation of MyD88-activated interferon regulatory factor 5 by K63-linked polyubiquitination. Molecular and Cellular Biology. 28 (24), 7296-7308 (2008).
- Lopez-Pelaez, M., et al. Protein kinase IKKβ-catalyzed phosphorylation of IRF5 at Ser462 induces its dimerization and nuclear translocation in myeloid cells. Proceedings of the National Academy of Sciences of the United States of America. 111 (49), 17432-17437 (2014).
- McGettrick, A. F., O'Neill, L. A. Localisation and trafficking of Toll-like receptors: an important mode of regulation. Current Opinion Immunology. 22 (1), 20-27 (2010).
- Baccala, R., Hoebe, K., Kono, D. H., Beutler, B., Theofilopoulos, A. N. TLR-dependent and TLR-independent pathways of type I interferon induction in systemic autoimmunity. Nature Medicine. 13 (5), 543-551 (2007).
- Gilliet, M., Cao, W., Liu, Y. J. Plasmacytoid dendritic cells: sensing nucleic acids in viral infection and autoimmune diseases. Nature Reviews Immunology. 8 (8), 594-606 (2008).
- Kawai, T., Akira, S. Toll-like Receptors and Their Crosstalk with Other Innate Receptors in Infection and Immunity. Immunity. 34 (5), 637-650 (2011).
- Liu, Z., Davidson, A. Taming lupus-a new understanding of pathogenesis is leading to clinical advances. Nature Medicine. 18 (6), 871-882 (2012).
- del Fresno, C., et al. Interferon-beta production via Dectin-1-Syk-IRF5 signaling in dendritic cells is crucial for immunity to C. albicans. Immunity. 38 (6), 1176-1186 (2013).
- Wang, X., et al. Expression Levels of Interferon Regulatory Factor 5 (IRF5) and Related Inflammatory Cytokines Associated with Severity, Prognosis, and Causative Pathogen in Patients with Community-Acquired Pneumonia. Medical Science Monitor. 24, 3620-3630 (2018).
- Zhao, Y., et al. Microbial recognition by GEF-H1 controls IKKepsilon mediated activation of IRF5. Nature Communications. 10 (1), 1349 (2019).
- Almuttaqi, H., Udalova, I. A. Advances and challenges in targeting IRF5, a key regulator of inflammation. FEBS Journal. 286 (9), 1624-1637 (2019).
- Chow, K. T., et al. Differential and Overlapping Immune Programs Regulated by IRF3 and IRF5 in Plasmacytoid Dendritic Cells. The Journal of Immunology. 201 (10), 3036-3050 (2018).
- Cheng, T. F., et al. Differential Activation of IFN Regulatory Factor (IRF)-3 and IRF-5 Transcription Factors during Viral Infection. The Journal of Immunology. 176 (12), 7462-7470 (2006).
- Chang Foreman, H. C., Van Scoy, S., Cheng, T. F., Reich, N. C. Activation of interferon regulatory factor 5 by site specific phosphorylation. PLoS One. 7 (3), 33098 (2012).
- Lin, R., Yang, L., Arguello, M., Penafuerte, C., Hiscott, J. A CRM1-dependent nuclear export pathway is involved in the regulation of IRF-5 subcellular localization. Journal of Biological Chemistry. 280 (4), 3088-3095 (2005).
- Stone, R. C., et al. Interferon regulatory factor 5 activation in monocytes of systemic lupus erythematosus patients is triggered by circulating autoantigens independent of type I interferons. Arthritis and Rheumatology. 64 (3), 788-798 (2012).
- De, S., et al. B Cell-Intrinsic Role for IRF5 in TLR9/BCR-Induced Human B Cell Activation, Proliferation, and Plasmablast Differentiation. Frontiers in Immunology. 8, 1938 (2017).
- Fabie, A., et al. IRF-5 Promotes Cell Death in CD4 T Cells during Chronic Infection. Cell Reports. 24 (5), 1163-1175 (2018).
- Cushing, L., et al. IRAK4 kinase activity controls Toll-like receptor-induced inflammation through the transcription factor IRF5 in primary human monocytes. Journal of Biological Chemistry. 292 (45), 18689-18698 (2017).
- Li, C., Arakawa, T. Application of native polyacrylamide gel electrophoresis for protein analysis: Bovine serum albumin as a model protein. International Journal of Biological Macromolecules. 125, 566-571 (2019).
- Iwamura, T., et al. Induction of IRF-3/-7 kinase and NF-kappaB in response to double-stranded RNA and virus infection: common and unique pathways. Genes to Cells. 6 (4), 375-388 (2001).
- Subhadarshanee, B., Mohanty, A., Jagdev, M. K., Vasudevan, D., Behera, R. K. Surface charge dependent separation of modified and hybrid ferritin in native PAGE: Impact of lysine 104. Biochimica et Biophysica Acta - Proteins and Proteomics. 1865 (10), 1267-1273 (2017).
- Reynolds, J. A., Tanford, C. Binding of Dodecyl Sulfate to Proteins at High Binding Ratios - Possible Implications for State of Proteins in Biological Membranes. Proceedings of the National Academy of Sciences of the United States of America. 66 (3), 1002 (1970).
- Manning, M., Colon, W. Structural basis of protein kinetic stability: resistance to sodium dodecyl sulfate suggests a central role for rigidity and a bias toward beta-sheet structure. Biochemistry. 43 (35), 11248-11254 (2004).
- Balkhi, M. Y., Fitzgerald, K. A., Pitha, P. M. IKKalpha negatively regulates IRF-5 function in a MyD88-TRAF6 pathway. Cellular Signalling. 22 (1), 117-127 (2010).
- Paun, A., et al. Functional characterization of murine interferon regulatory factor 5 (IRF-5) and its role in the innate antiviral response. Journal of Biological Chemistry. 283 (21), 14295-14308 (2008).
- Yasuda, K., et al. Murine dendritic cell type I IFN production induced by human IgG-RNA immune complexes is IFN regulatory factor (IRF)5 and IRF7 dependent and is required for IL-6 production. The Journal of Immunology. 178 (11), 6876-6885 (2007).
- Steinhagen, F., et al. IRF-5 and NF-kappaB p50 co-regulate IFN-beta and IL-6 expression in TLR9-stimulated human plasmacytoid dendritic cells. European Journal of Immunology. 43 (7), 1896-1906 (2013).
- Gratz, N., et al. Type I interferon production induced by Streptococcus pyogenes-derived nucleic acids is required for host protection. PLoS Pathogens. 7 (5), 1001345 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten