Method Article
Native Polyacrylamide Gel Electrophoresis Immunoblot Analyse de la dimérisation Endogenous IRF5
Dans cet article
Résumé
Une méthode occidentale indigène de tache pour analyser le facteur réglementaire endogène d'interféron 5 dimerization dans la ligne de cellules dendritiques plasmacytoid de CAL-1 est décrite. Ce protocole peut également être appliqué à d'autres lignées cellulaires.
Résumé
Le facteur de régulation de l'interféron 5 (IRF5) est un facteur de transcription clé pour réguler la réponse immunitaire. Il est activé en aval de la voie de signalisation de la différence myéloïde de récepteur de péage 88 (TLR-MyD88). L'activation d'IRF5 implique la phosphorylation, la dimerisation, et la translocation suivante du cytoplasme dans le noyau, qui à son tour induit l'expression de gène de diverses cytokines pro-inflammatoires. Un test de détection pour l'activation iRF5 est essentiel à l'étude des fonctions IRF5 et de ses voies pertinentes. Cet article décrit un analyse robuste pour détecter l'activation endogène d'IRF5 dans la ligne humaine de cellules dendritiques deplasmacytoid de CAL-1. Le protocole consiste en un analyse d'électrophorèse non dénaturante modifiée qui permet de distinguer IRF5 dans ses formes monomères et dimères, offrant ainsi une approche abordable et sensible pour analyser l'activation de l'IRF5.
Introduction
Le facteur de régulation de l'interféron 5 (IRF5) est un important régulateur de transcription qui joue un rôle de premier plan dans la régulation de la réponse immunitaire, en particulier dans la libération de cytokines pro-inflammatoires et d'interférons de type I (IFN)1,2 ,3. La mauvaise régulation de l'IRF5 est un facteur contribuant à de nombreuses maladies auto-immunes, comme en témoignent les divers polymorphismes dans le locus IRF5 qui sont associés au lupus érythémateux systémique, à la sclérose en plaques, à la polyarthrite rhumatoïde, etc.4, 5,6,7,8,9,10. Par conséquent, un essai de détection robuste pour l'état d'activation endogène iRF5 est crucial pour comprendre les voies réglementaires et les effets en aval de l'IRF5 dans un contexte cellulaire physiologiquement pertinent.
IRF5 est constitutivement exprimé dans les monocytes, les cellules dendritiques (DC), les cellules B, et les macrophages1,11. Comme avec d'autres facteurs de transcription de famille d'IRF, IRF5 réside dans le cytoplasme dans son état latent. Lors de l'activation, IRF5 est phosphorylé et forme des homodimères, qui se translocalisent ensuite dans le noyau et se lient à des éléments réglementaires spécifiques des gènes codant les IFN de type I et les cytokines pro-inflammatoires, induisant éventuellement l'expression de ces gènes1 ,2,11,12,13. IRF5 régule les réponses immunitaires innées en aval de divers récepteurs de type Toll (TLR), tels que TLR7, TLR 8, et TLR 9, qui sont localisés en endosomes et utilisent MyD88 pour signaler1,11,14. Ces TLR reconnaissent principalement les espèces étrangères d'acide nucléique telles que l'ARN à brin unique (arDR) et l'ADN CPG non méthylé qui sont symptomatiques d'une infection15,16,17,18. IRF5 a été montré pour réguler les réponses immunitaires contre les infections bactériennes, virales et fongiques19,20,21. Compte tenu du rôle influent et diversifié de l'IRF5 dans le système immunitaire, l'amélioration ou l'amortissement de l'activité IRF5 pourrait servir de nouvelle voie pour le développement d'agents thérapeutiques22. Par conséquent, il est essentiel de développer un protocole pour surveiller l'état d'activation de l'IRF5 endogène pour permettre une étude approfondie des voies et des mécanismes régulant l'activité IRF5 dans différents types de cellules.
Au meilleur de notre connaissance, aucun analyse biochimique ou électrophoretic de gel pour l'activation endogène d'IRF5 n'a été édité avant le développement de ce protocole. La phosphorylation s'est avérée être une première étape importante de l'activation de l'IRF5, et un anticorps IRF5 phosphospecific a été développé qui a mené à la découverte et à la confirmation d'un résidu de sérine important pour l'activitéIRF5 13. Cependant, alors que l'anticorps détecte clairement iRF5 phosphorylé lorsqu'il est immunoprécipité ou surexprimé23, il ne détecte pas la phosphorylation IRF5 dans une cellule entière lysate dans nos mains (données non montrées). La dimérisation est la prochaine étape de l'activation de l'IRF5, et de nombreuses études importantes à ce jour sur lesquelles on s'est appuyée sur la surexpression de l'IRF5 étiqueté eilluant épitope, souvent dans des types de cellules non pertinentes qui n'expriment normalement pas IRF511,12 ,24,25. Des études antérieures ont montré que l'IRF5 dimérisé ne peut pas toujours se translocaliser dans le noyau et n'est donc pas nécessairement pleinement activé25,26. Un essai pour la localisation nucléaire endogène D'IRF5 a été développé pour évaluer l'activation d'IRF5 par la cytométrie de flux d'imagerie27. Cet essai a été appliqué dans des études qui ont été cruciales pour comprendre l'activité IRF5, en particulier dans les types de cellules primaires ou rares28,29 et a grandement avancé les connaissances dans le domaine. Cependant, cet exemple repose sur un instrument spécialisé qui n'est pas largement disponible pour les chercheurs. En outre, il est souvent nécessaire d'étudier les premières étapes de l'activation tout en disséquant les voies réglementaires IRF5 et en identifiant les régulateurs en amont et les composantes de la voie. Cette étude fournit un analyse biochimique robuste et fiable pour les événements d'activation précoce de l'IRF5 qui peut être effectuée dans des laboratoires équipés d'outils de biologie moléculaire. Le protocole décrit ici sera très utile dans l'étude des voies et des mécanismes des actions IRF5, en particulier lorsqu'il est combiné avec des essais orthogonaux tels que l'analyse cytométrique flux d'imagerie de la localisation nucléaire IRF523, 27,28,30.
L'électrophoresis de gel de polyacrylamide indigène (PAGE indigène) est une méthode largement utilisée pour analyser des complexes de protéine31,32. Contrairement à l'électrophorèse de gel de polyacrylamide de dodécylsulfate de sodium (SDS-PAGE), PAGE indigène sépare les protéines en fonction de leur forme, de leur taille et de leur charge. Il conserve également la structure indigène de protéine sans dénaturation31,33,34,35. Le protocole présenté tire parti de ces caractéristiques de page native et détecte les formes monomériques et dimériques de l'IRF5. Cette méthode est particulièrement importante pour détecter les événements d'activation précoce parce qu'il n'existe aucun anticorps disponible dans le commerce qui puisse détecter l'IRF5 phosphorylé endogène. Auparavant, plusieurs études publiées utilisaient page native pour évaluer la dimerisation IRF5. Cependant, la majorité de ces études dépendaient de la surexpression de l'IRF5 exogène étiqueté eépitore pour analyser le statut d'activation2,13,24,36,37 . Ce travail présente un protocole étape par étape pour l'analyse de la dimérisation iRF5 endogène via une technique PAGE indigène modifiée dans une lignée de cellules dendritiques plasmacytoïdes humaines (pDC), où l'activité IRF5 s'est avérée cruciale pour sa fonction1, 38,39,40. Cette même technique a été appliquée à d'autres lignéescellulaires 23.
Protocole
REMARQUE: Le protocole décrit ici utilise la lignée cellulaire CAL-1 pDC traitée avec resiquimod (R848), un agoniste pour TLR7/8. Ce protocole a été appliqué à d'autres types de cellules humaines et murine, y compris RAW 264.7 (ligne de macrophage murine), THP-1 (ligne cellulaire monocytique humaine), BJAB (ligne humaine de cellules B), Ramos (ligne humaine de cellules B), et MUTZ-3 (ligne de cellules dendritiques humaines)23.
1. Stimulation des cellules CAL-1
- Maintenir les cultures cellulaires CAL-1 dans un flacon T75 à 37 oC et 5 % de CO2 dans des conditions stériles avec 20 à 25 ml de RPMI 1640 moyen contenant 5 % de sérum bovin fœtal (SGF), 25 mM HEPES et 1x mercaptoéthanol (c.-à-d. rpMI 1640 moyen complet).
- Transférer les cellules dans un tube conique de 50 ml.
REMARQUE: Les cellules CAL-1 ne sont pas adhérentes. Pour les types de cellules adhérentes, la trypsinisation standard peut être effectuée pour récolter les cellules. - Centrifuger les cellules à 200 x g pendant 5 min à température ambiante (RT). Retirez le supernatant et suspendez la pastille cellulaire en 8 ml du milieu complet de RPMI 1640 pour obtenir une suspension homogène à cellule unique.
- Comptez les cellules à l'aide d'un hémocytomètre. Ensemencer les cellules à une densité de 1 x 106 cellules par puits dans une plaque de 6 puits avec 4 ml de rpMI rpMI préchauffé complet 1640 milieu dans chaque puits. Incuber de 20 à 24 h à 37 oC et 5 % de CO2 pour permettre à la confluence d'atteindre 90 % à 95 % (correspondant à environ 1,5 x 106 cellules).
- Stimuler les cellules en ajoutant 4 oL de 1 mg/mL R848 par puits de la plaque de 6 puits (concentration finale de 1 g/mL). Aussi mettre en place un puits de contrôle non stimulé avec des cellules sans le traitement R848.
- Assurez-vous que le R848 est dispersé uniformément en berçant doucement la plaque d'un côté à l'autre. Ensuite, incuber les cellules pendant 2 à 16 h dans l'incubateur à 37 oC et 5 % de CO2.
2. Extraction de protéines cellulaires
- Transférer les suspensions cellulaires de la plaque de 6 puits dans des tubes centrifugeurs de 5 ml.
- Centrifugeuse à 200 x g pendant 5 min à RT. Retirez le supernatant et suspendez le granule cellulaire dans 1 ml de saline tamponnée de phosphate (PBS) pour obtenir une suspension homogène à une seule cellule.
- Transférer la suspension cellulaire dans un tube centrifugeur de 1,5 ml.
- Faites une rotation brève à 12 000 x g pendant 0,5 à 1 min à 4 oC et retirez soigneusement le supernatant.
- Préparer le tampon de lyse contenant 6,25 ml de 1 M Tris-HCl pH 7,4 (concentration finale de 25 mM), 7,5 ml de 5 M NaCl (concentration finale de 150 mM), 0,5 mL de 0,5 M EDTA (concentration finale de 1 mM), 2,5 mL de NP-40 (concentration finale de 1 %) et 7,5 ml de glycérol (concentration finale de 5 %) dans 250 ml d'eau déionisée (ddH2O). Ajouter 100x inhibiteur de protéase cocktail à usage unique à une concentration finale de 1x à la mémoire tampon de lyse juste avant l'utilisation. Gardez le tampon de lyse préparé sur la glace.
REMARQUE: Le tampon de lyse sans la protéase peut être stocké à 4 oC. - Resuspendre la pastille cellulaire dans 30 l de tampon de lyse glacée et mélanger en pipetting de haut en bas.
- Incuber sur la glace pendant 15 à 20 min.
- Clarifier le lysate en centrifuant à 12 000 x g pendant 15 à 20 min à 4 oC. Transférer le supernatant dans un nouveau tube de centrifugeuse préréfrigéré de 1,5 mL. Gardez les extraits sur la glace en tout temps.
REMARQUE: Les lysates cellulaires peuvent être stockés à -20 oC ou à -80 oC. Ne faites pas bouillir les échantillons. - Mesurer la concentration en protéines à l'aide du réactif Bradford.
3. Analyse de la dimérisation IRF5 par NATIVE PAGE
- Préparer les tampons d'électrophorèse de chambre supérieure (-) et inférieur. Le tampon de chambre supérieure se compose de 0,3% de désoxycholate de sodium (NaDOC) dans 1x tampon de fonctionnement page natif, et la chambre inférieure se compose de seulement 1x tampon de fonctionnement page natif.
REMARQUE: Préparez un tampon de chambre haute frais pour chaque nouvelle course. - Rincer un gel PAGE indigène de 3 % à 12 % à fond avec de l'eau sans déformer les puits. Mettre le gel dans le mini réservoir de gel et retirer le peigne. Préfassez le gel dans une chambre froide à 4 oC ou sur glace à 150 V pendant 30 min.
REMARQUE: Prerunning élimine les ions excessifs d'ammoniac et de persulfate qui peuvent interférer avec le fonctionnement du gel. - Pendant le pré-run, préparer les échantillons pour le chargement en mélangeant les protéines cellulaires conservées sur la glace avec 4x tampon d'échantillon indigène.
- Après le pré-run, chargez 10 à 15 g de protéines avec un volume final de 10 à 15 L par échantillon.
REMARQUE: La surcharge de protéines peut causer un frottis. - Exécuter le gel à 85 V pendant 30 min, puis 150 V pendant 2 h.
REMARQUE: Compte tenu des différences dans l'équipement et les lignes cellulaires utilisées par différents laboratoires, des modifications mineures à la concentration d'échantillons de protéines, la tension et le temps de fonctionnement peuvent être appropriées pour optimiser ce protocole. L'abaissement de la tension de pré-fonctionnement et de fonctionnement tout en augmentant le temps de fonctionnement peut aider à améliorer la résolution de dimère et la cohérence de résultat. - Faire tremper le gel dans le tampon de fonctionnement SDS (25 mM Tris pH 8,3, 250 mM glycine, 0,1% SDS) pendant 30 min à RT.
REMARQUE: Aucune agitation n'est requise. De temps en temps, l'intensité de la bande peut ne pas être proportionnelle à la quantité de protéines chargées en raison d'un transfert inefficace en présence de désoxycholate (DOC), qui affecte principalement la forme monomérique de l'IRF5. Trempage du gel dans SDS en cours d'exécution tampon avant le transfert résout ce problème. Le gel est fragile. Manipuler avec un soin extrême à partir du fond (c.-à-d., pourcentage plus élevé) extrémité du gel.
4. Analyse immunoblot de l'IRF5
- Activer la membrane du difluorure de polyvinylide (PDVF) en la trempant dans du méthanol pendant environ 5 min.
- Faire une coupe sur un coin de la membrane pour indiquer son orientation. Assembler le sandwich de transfert selon l'ordre séquentiel détaillé dans le protocole du fabricant avec un soin supplémentaire pour s'assurer qu'aucune bulle d'air n'est emprisonnée à l'intérieur.
- Placer la cassette de transfert dans le réservoir et transférer à 20 V pendant 1 h sur la glace.
REMARQUE: Effectuer toutes les incubations et les lavages dans les étapes suivantes avec un shaker à bascule. - Retirez la membrane de la cassette avec des forceps en plastique après le transfert. Bloquer la membrane en bloquant le tampon (TBS) pendant 45 min à RT.
REMARQUE: Le tampon TBS avec 5% de BSA peut également être utilisé comme tampon de blocage. - Incuber la membrane avec l'anticorps primaire énuméré dans le tableau 1. Laver la membrane avec un tampon de lavage 1x TBST (20 mM Tris, pH 7,0, 150 mM NaCl et 0,1% Tween 20) pendant 3 min tout en berçant. Répéter le lavage 2x.
| Dillution (Dillution) | Tampon de dillution | incubation | Commentaires | |
| Anticorps primaires (Anti-IRF5) | 1/1,000 | Tampon de blocage du SCT | Nuit à 4 oC ou 2 h à RT | Les anticorps dilués peuvent être réutilisés plusieurs fois s'ils sont entreposés à 4 oC en présence d'azide de sodium de 0,02 %. |
| Anticorps secondaires (Anti-lapin) | 1/10,000 | Tampon de blocage du SCT | 45 min à RT | Les anticorps dilués peuvent être réutilisés plusieurs fois s'ils sont entreposés à 4 oC en présence d'azide de sodium de 0,02 %. |
| REMARQUE: La dilution doit être optimisée car elle varie d'un fabricant à l'autre. | ||||
Tableau 1 : Spécifications des anticorps utilisés dans la procédure d'immunoblotting.
- Incuber la membrane avec l'anticorps secondaire figurant sur le tableau 1. Laver les membranes pendant 3 min dans un tampon de lavage 1x TBST. Répéter le lavage 2x.
- Scanner la tache à l'aide d'un système de documentation de gel approprié.
Résultats
L'immunoblot (IB) avec un anticorps anti-IRF5 a été réalisé sur des cellules CAL-1 non stimulées ou stimulées avec 1 g/mL R848 pour 2 h (Figure 1). Des lysates de cellules ont été préparés, et le PAGE indigène a été exécuté. Dans les cellules CAL-1 non stimulées, IRF5 a été détecté comme une seule bande sur la PAGE native, correspondant à sa forme monomérique. Sur le traitement des cellules CAL-1 avec R848 pendant 2 h, le niveau de monomère d'IRF5 a diminué avec une augmentation simultanée de l'accumulation d'une bande lentement migrante qui a correspondu à la forme dimérique d'IRF5.
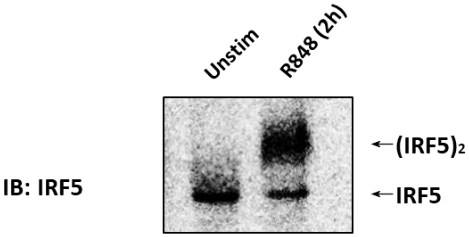
Figure 1 : IRF5 endogène dimerisé dans les cellules CAL-1 lorsqu'il est stimulé par un agoniste TLR7/8. Les cellules CAL-1 n'ont pas été traitées ou traitées avec R848 pour le temps indiqué. Des échantillons de protéines ont été résolus par page indigène et suivis par IB utilisant l'anticorps anti-IRF5. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
L'immunoblot avec l'anticorps anti-IRF5 a été exécuté sur les cellules 293T iRF5-surexprimant untransfected et transfected avec diverses constructions. Des lysates cellulaires ont été préparés et des PAGE indigènes ont été exécutés (Figure 2). Aucun IRF5 n'a été détecté dans les cellules 293T non transfectes, démontrant la spécificité de l'anticorps anti-IRF5. Une seule bande correspondant au monomeric IRF5 n'a été détectée que dans les cellules 293T surexprimant IRF5. Lorsque les constructions encodant iRF5-activant les protéines, y compris NRIG (constitutivement active RIG-I), MAVS, et IKKont ont été cotransfectées, une bande qui migre lentement correspondant à la forme dimérique d'IRF5 est apparue. Cependant, NMDA5 (MDA5 constitutivement actif), une protéine apparentée au RIG-I, n'a pas induit la dimerisation IRF5 lorsqu'il est cotransfecté.

Figure 2 : La cotransfection des facteurs iRF5 induits par la dimérisation IRF5 dans les cellules 293T. Les cellules 293T ont été non transfectées (voie 1) ou transfectées avec IRF5 (voie 2) avec divers régulateurs IRF5 (voies 3 à 6). Des échantillons de protéines ont été résolus par page indigène et suivis par IB utilisant l'anticorps anti-IRF5. NRIG - N-terminal de RIG-I; NMDA5 - N-terminal de MDA5. (Publié à l'origine dans The Journal of Immunology. KT Chow, C Wilkins, M Narita, R Green, M Knoll, YM Loo et M Gale Jr. 2018. Programmes immunitaires différentiels et superposés réglementés par IRF3 et IRF5 dans les cellules dendritiques plasmacytoides. J. Immunol. 201 (10) 3036-3050. Copyright © 2018 The American Association of Immunologists, Inc.23). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Le protocole décrit ici est un PAGE indigène modifié qui distingue les formes monomeric et dimériques de l'IRF5 endogène. Il y a eu peu d'études rapportant la détection de l'activation endogène d'IRF5 utilisant la technique spécialisée de cytométrie de flux d'imagerie23,27,28,30. Ce protocole utilise une technique commune et des réactifs et des outils communs pour évaluer l'état d'activation iDOGenous IRF5 pendant les premiers événements d'activation. Le protocole implique des modifications simples à un protocole PAGE natif standard pour permettre la distinction entre les formes monomeric et dimérique de IRF5. Il peut être facilement adapté aux études utilisant d'autres lignées cellulaires23. Ce protocole PAGE natif modifié peut résoudre iRF5 endogène sous ses deux formes clairement sans interférences protéiques non spécifiques (Figure 2). IRF5 endogène à partir de cellules non stimulées a été détecté comme une bande unique claire dans ce système de gel, tandis que le traitement avec R848 pour 2 h a entraîné l'apparition d'une bande correspondant à IRF5 dimers (Figure 1).
Un analyse de dimerisation PAGE indigène pour IRF3, un facteur de transcription similaire à IRF5 dans la même famille, a été développé et largement utilisé au cours des deux dernières décennies32. Malgré des essais approfondis et le dépannage, nous n'avons pas pu appliquer le même protocole qui utilise le système Laemmli Tris-glycine pour résoudre le monomère et le dimère IRF5. Le protocole décrit dans cet article utilise des gels de gradient Bis-Tris, qui ont une chimie très différente des gels tris-glycine à pourcentage unique utilisés dans le protocole IRF3. Le pH et la composition chimique des systèmes électrophorétic siens peuvent être cruciaux pour distinguer les différentes formes d'IRF3 et d'IRF5. En effet, IRF3 et IRF5, bien que similaires, ont des propriétés différentes (par exemple, les points isoélectriques et les sites de modification) qui ont probablement pour résultat un comportement différent tout en étant séparés sur différents systèmes de gel.
Un tampon de fonctionnement PAGE 1x natif contenant DOC a été utilisé pour la course de gel. Le tampon doit être préparé frais ou conservé dans un environnement propre et sans protéines pour éviter l'apparition de précipités blancs obscurcissant la solution dans la chambre haute à la suite de DOC précipiter les protéines non spécifiques. Il est fortement recommandé que les échantillons iDOgènes extraits soient soumis à la PAGE indigène dès que possible, de préférence dans la semaine avec des cycles de gel-dégel minimes. Sinon, il peut y avoir une dégradation importante des protéines. La dégradation est observée avec un stockage à la fois à -80 oC et à -20 oC. En outre, le pH du tampon de fonctionnement SDS et le tampon de lavage TBST doivent être ajustés à RT.
Le volume final idéal d'échantillon chargé dans chaque puits était de 10 à 15 L, mais de légers ajustements pourraient être nécessaires selon les différents types de cellules. Après la course initiale à 85 V pendant 30 min, il est recommandé de continuer à faire fonctionner le gel à 150 V pendant environ 2 à 3 h pour atteindre la séparation distincte et la résolution du monomère et du dimère IRF5. Une fois la course terminée, il est de la plus haute importance de manipuler le gel méticuleusement à partir de son extrémité inférieure en raison de ses niveaux différentiels de densité, allant de 3% au sommet et augmentant vers 12% au fond. Dans ce cas, il est préférable de retirer le gel de la plaque en l'immergeant dans le tampon de fonctionnement utilisé, qui agit comme un coussin d'impact pour minimiser la friction et permet au gel de flotter loin de la plaque pour éviter la rupture.
Quelques inconvénients mineurs de ce protocole incluent la sélection limitée de gels disponibles pour obtenir les résultats souhaités. Des gels faits maison et quelques autres marques de gels disponibles dans le commerce ont été testés sans succès. Dans nos mains, l'utilisation d'un tampon de fonctionnement commercial et d'un système de gel a contribué à la robustesse et à la reproductibilité de ce protocole, bien que des essais approfondis de tampons faits maison n'aient pas été effectués. L'attention aux détails est essentielle, et l'expérience est la clé du succès pour obtenir des résultats clairs. Enfin, la résolution de l'IRF5 a nécessité un long temps (c'est-à-dire de 2 à 3 h) pour obtenir une séparation idéale du monomère et du dimère. D'autres améliorations et modifications à l'avenir peuvent améliorer l'efficacité et minimiser les inconvénients de ce protocole.
En conclusion, ce protocole est un test robuste pour la détection du monomère et du dimère iFR5 endogène. Il convient aux applications dans divers types de cellules humaines et murines exprimant IFR5 endogène. Ce sera un outil précieux pour étudier les voies réglementaires IRF5 et les composants de signalisation dans divers types de cellules.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les travaux ont été soutenus par des fonds de la Fondation Croucher et des fonds de démarrage de l'Université de la Ville. Nous remercions tous les membres du laboratoire Chow pour leur aide dans l'expérience et la lecture critique du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Life Technologies, HK | 21985023 | |
| 300 W/250 V power supply 230 V AC | Life Technologies, HK | PS0301 | |
| Anti-IRF5 antibody | Bethyl Laboratories, USA | A303-385 | |
| BIOSAN Rocker Shaker (cold room safe) | EcoLife, HK | MR-12 | |
| EDTA Buffer, pH 8, 0.5 M 4x 100 mL | Life Technologies | 15575020 | |
| Glycerol 500 mL | Life Technologies | 15514011 | |
| Glycine | Life Technologies, HK | 15527013 | |
| Goat anti-Mouse IgG DyLight 800 Conjugated Antibody | LAB-A-PORTER/Rockland, HK | 610-145-002-0.5 | |
| Goat anti-Rabbit IgG DyLight 800 Conjugated Antibody | LAB-A-PORTER/Rockland, HK | 611-145-002-0.5 | |
| Halt protease inhibitor cocktail (100x) | Thermo Fisher Scientific, HK | 78430 | |
| HEPES | Life Technologies, HK | 15630080 | |
| LI-COR Odyssey Blocking Buffer (TBS) | Gene Company, HK | 927-50000 | |
| Mini Tank blot module combo; Transfer module, accessories | Life Technologies, HK | NW2000 | |
| NativePAGE 3-12% gels, 10 well kit | Life Technologies, HK | BN1001BOX | |
| NativePAGE Running Buffer 20x | Life Technologies, HK | BN2001 | |
| NativePAGE Sample Buffer 4x | Life Technologies, HK | BN2003 | |
| NP-40 Alternative, Nonylphenyl Polyethylene Glycol | Tin Hang/Calbiochem, HK | #492016-100ML | |
| PBS 7.4 | Life Technologies, HK | 10010023 | |
| Polyvinylidene difluoride (PVDF) membrane | Bio-gene/Merck Millipore, HK | IPFL00010 | |
| Protein assay kit II (BSA) | Bio-Rad, HK | 5000002 | |
| R848 | Invivogen, HK | tlrl-r848 | |
| RPMI 1640 | Life Technologies, HK | 61870127 | |
| Sodium Chloride | ThermoFisher | BP358-1 | |
| Sodium deoxycholate ≥97% (titration) | Tin Hang/Sigma, HK | D6750-100G | |
| Tris | Life Technologies, HK | 15504020 | |
| TWEEN 20 | Tin Hang/Sigma, HK | #P9416-100ML |
Références
- Takaoka, A., et al. Integral role of IRF-5 in the gene induction programme activated by Toll-like receptors. Nature. 434 (7030), 243-249 (2005).
- Ren, J., Chen, X., Chen, Z. J. IKKbeta is an IRF5 kinase that instigates inflammation. Proceedings of the National Academy of Sciences of the United States of America. 111 (49), 17438-17443 (2014).
- Negishi, H., Taniguchi, T., Yanai, H. The Interferon (IFN) Class of Cytokines and the IFN Regulatory Factor (IRF) Transcription Factor Family. Cold Spring Harbor Perspective Biology. 10 (11), (2018).
- Clark, D. N., et al. Four Promoters of IRF5 Respond Distinctly to Stimuli and are Affected by Autoimmune-Risk Polymorphisms. Frontiers in Immunology. 4, 360 (2013).
- Bo, M., et al. Rheumatoid arthritis patient antibodies highly recognize IL-2 in the immune response pathway involving IRF5 and EBV antigens. Scientific Reports. 8 (1), 1789 (2018).
- Duffau, P., et al. Promotion of Inflammatory Arthritis by Interferon Regulatory Factor 5 in a Mouse Model. Arthritis and Rheumatolpgy. 67 (12), 3146-3157 (2015).
- Feng, D., et al. Irf5-deficient mice are protected from pristane-induced lupus via increased Th2 cytokines and altered IgG class switching. European Journal of Immunology. 42 (6), 1477-1487 (2012).
- Richez, C., et al. IFN regulatory factor 5 is required for disease development in the FcgammaRIIB-/-Yaa and FcgammaRIIB-/- mouse models of systemic lupus erythematosus. The Journal of Immunology. 184 (2), 796-806 (2010).
- Tada, Y., et al. Interferon regulatory factor 5 is critical for the development of lupus in MRL/lpr mice. Arthritis and Rheumatology. 63 (3), 738-748 (2011).
- Weiss, M., et al. IRF5 controls both acute and chronic inflammation. Proceedings of the National Academy of Sciences of the United States of America. 112 (35), 11001-11006 (2015).
- Schoenemeyer, A., et al. The interferon regulatory factor, IRF5, is a central mediator of toll-like receptor 7 signaling. Journal of Biological Chemistry. 280 (17), 17005-17012 (2005).
- Balkhi, M. Y., Fitzgerald, K. A., Pitha, P. M. Functional regulation of MyD88-activated interferon regulatory factor 5 by K63-linked polyubiquitination. Molecular and Cellular Biology. 28 (24), 7296-7308 (2008).
- Lopez-Pelaez, M., et al. Protein kinase IKKβ-catalyzed phosphorylation of IRF5 at Ser462 induces its dimerization and nuclear translocation in myeloid cells. Proceedings of the National Academy of Sciences of the United States of America. 111 (49), 17432-17437 (2014).
- McGettrick, A. F., O'Neill, L. A. Localisation and trafficking of Toll-like receptors: an important mode of regulation. Current Opinion Immunology. 22 (1), 20-27 (2010).
- Baccala, R., Hoebe, K., Kono, D. H., Beutler, B., Theofilopoulos, A. N. TLR-dependent and TLR-independent pathways of type I interferon induction in systemic autoimmunity. Nature Medicine. 13 (5), 543-551 (2007).
- Gilliet, M., Cao, W., Liu, Y. J. Plasmacytoid dendritic cells: sensing nucleic acids in viral infection and autoimmune diseases. Nature Reviews Immunology. 8 (8), 594-606 (2008).
- Kawai, T., Akira, S. Toll-like Receptors and Their Crosstalk with Other Innate Receptors in Infection and Immunity. Immunity. 34 (5), 637-650 (2011).
- Liu, Z., Davidson, A. Taming lupus-a new understanding of pathogenesis is leading to clinical advances. Nature Medicine. 18 (6), 871-882 (2012).
- del Fresno, C., et al. Interferon-beta production via Dectin-1-Syk-IRF5 signaling in dendritic cells is crucial for immunity to C. albicans. Immunity. 38 (6), 1176-1186 (2013).
- Wang, X., et al. Expression Levels of Interferon Regulatory Factor 5 (IRF5) and Related Inflammatory Cytokines Associated with Severity, Prognosis, and Causative Pathogen in Patients with Community-Acquired Pneumonia. Medical Science Monitor. 24, 3620-3630 (2018).
- Zhao, Y., et al. Microbial recognition by GEF-H1 controls IKKepsilon mediated activation of IRF5. Nature Communications. 10 (1), 1349 (2019).
- Almuttaqi, H., Udalova, I. A. Advances and challenges in targeting IRF5, a key regulator of inflammation. FEBS Journal. 286 (9), 1624-1637 (2019).
- Chow, K. T., et al. Differential and Overlapping Immune Programs Regulated by IRF3 and IRF5 in Plasmacytoid Dendritic Cells. The Journal of Immunology. 201 (10), 3036-3050 (2018).
- Cheng, T. F., et al. Differential Activation of IFN Regulatory Factor (IRF)-3 and IRF-5 Transcription Factors during Viral Infection. The Journal of Immunology. 176 (12), 7462-7470 (2006).
- Chang Foreman, H. C., Van Scoy, S., Cheng, T. F., Reich, N. C. Activation of interferon regulatory factor 5 by site specific phosphorylation. PLoS One. 7 (3), 33098 (2012).
- Lin, R., Yang, L., Arguello, M., Penafuerte, C., Hiscott, J. A CRM1-dependent nuclear export pathway is involved in the regulation of IRF-5 subcellular localization. Journal of Biological Chemistry. 280 (4), 3088-3095 (2005).
- Stone, R. C., et al. Interferon regulatory factor 5 activation in monocytes of systemic lupus erythematosus patients is triggered by circulating autoantigens independent of type I interferons. Arthritis and Rheumatology. 64 (3), 788-798 (2012).
- De, S., et al. B Cell-Intrinsic Role for IRF5 in TLR9/BCR-Induced Human B Cell Activation, Proliferation, and Plasmablast Differentiation. Frontiers in Immunology. 8, 1938 (2017).
- Fabie, A., et al. IRF-5 Promotes Cell Death in CD4 T Cells during Chronic Infection. Cell Reports. 24 (5), 1163-1175 (2018).
- Cushing, L., et al. IRAK4 kinase activity controls Toll-like receptor-induced inflammation through the transcription factor IRF5 in primary human monocytes. Journal of Biological Chemistry. 292 (45), 18689-18698 (2017).
- Li, C., Arakawa, T. Application of native polyacrylamide gel electrophoresis for protein analysis: Bovine serum albumin as a model protein. International Journal of Biological Macromolecules. 125, 566-571 (2019).
- Iwamura, T., et al. Induction of IRF-3/-7 kinase and NF-kappaB in response to double-stranded RNA and virus infection: common and unique pathways. Genes to Cells. 6 (4), 375-388 (2001).
- Subhadarshanee, B., Mohanty, A., Jagdev, M. K., Vasudevan, D., Behera, R. K. Surface charge dependent separation of modified and hybrid ferritin in native PAGE: Impact of lysine 104. Biochimica et Biophysica Acta - Proteins and Proteomics. 1865 (10), 1267-1273 (2017).
- Reynolds, J. A., Tanford, C. Binding of Dodecyl Sulfate to Proteins at High Binding Ratios - Possible Implications for State of Proteins in Biological Membranes. Proceedings of the National Academy of Sciences of the United States of America. 66 (3), 1002 (1970).
- Manning, M., Colon, W. Structural basis of protein kinetic stability: resistance to sodium dodecyl sulfate suggests a central role for rigidity and a bias toward beta-sheet structure. Biochemistry. 43 (35), 11248-11254 (2004).
- Balkhi, M. Y., Fitzgerald, K. A., Pitha, P. M. IKKalpha negatively regulates IRF-5 function in a MyD88-TRAF6 pathway. Cellular Signalling. 22 (1), 117-127 (2010).
- Paun, A., et al. Functional characterization of murine interferon regulatory factor 5 (IRF-5) and its role in the innate antiviral response. Journal of Biological Chemistry. 283 (21), 14295-14308 (2008).
- Yasuda, K., et al. Murine dendritic cell type I IFN production induced by human IgG-RNA immune complexes is IFN regulatory factor (IRF)5 and IRF7 dependent and is required for IL-6 production. The Journal of Immunology. 178 (11), 6876-6885 (2007).
- Steinhagen, F., et al. IRF-5 and NF-kappaB p50 co-regulate IFN-beta and IL-6 expression in TLR9-stimulated human plasmacytoid dendritic cells. European Journal of Immunology. 43 (7), 1896-1906 (2013).
- Gratz, N., et al. Type I interferon production induced by Streptococcus pyogenes-derived nucleic acids is required for host protection. PLoS Pathogens. 7 (5), 1001345 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon