Method Article
Indução e validação da senescência celular em células humanas primárias
Neste Artigo
Resumo
Aqui, vamos discutir uma série de protocolos para indução e validação da senescência celular em culturas de células. Podemos focar diferentes estímulos indutores senescência e descrever a quantificação de marcadores comuns associadas a senescência. Nós fornecemos detalhes técnicos utilizando fibroblastos como modelo, mas os protocolos podem ser adaptados para vários modelos de celulares.
Resumo
Senescência celular é um estado de prisão permanente ciclo celular ativado em resposta a diferentes estímulos nocivos. Ativação da senescência celular é uma marca registrada de diversas condições fisiopatológicas incluindo supressão de tumor, tecido, remodelação e envelhecimento. Os indutores da senescência celular na vivo caracterizam-se ainda mal. No entanto, uma série de estímulos pode ser usada para promover a senescência celular ex vivo. Entre eles, indutores de senescência mais comuns são exaustão replicative, ionizante e radiação não-ionizante, drogas genotóxicas, estresse oxidativo e demethylating e acetificar agentes. Aqui, iremos fornecer instruções detalhadas sobre como usar esses estímulos para induzir os fibroblastos em senescência. Este protocolo pode ser facilmente adaptado para diferentes tipos de células primárias e de linhagens celulares, incluindo as células cancerosas. Também descrevemos os métodos diferentes para a validação da indução da senescência. Em particular, focamos em medir a atividade da enzima lisossomal associada a senescência β-galactosidase (SA-β-gal), a taxa de síntese de DNA utilizando o ensaio de incorporação 5-ethynyl-2'-desoxiuridina (EdU), os níveis de expressão do ciclo celular p16 inibidores e p21 e a expressão e secreção de membros do fenótipo secretor Senescence-Associated (SASP). Finalmente, podemos fornecer resultados de exemplo e discutir aplicações desses protocolos.
Introdução
Em 1961, Hayflick e Moorhead relataram que fibroblastos primários na cultura perdem seu potencial proliferativo após sucessivas passagens1. Este processo é causado pelo sequencial encurtamento dos telômeros após cada divisão celular. Quando os telômeros atingir um comprimento curto criticamente, eles são reconhecidos pela resposta DNA-danos (DDR) que ativa uma detenção irreversível da proliferação — também definida como senescência replicative. Senescência replicative é atualmente um dos muitos estímulos que são conhecidos por induzir a um estado de prisão permanente ciclo celular que reproduz células minúsculas de mitógenos e apoptotic sinais2,3. O programa de senescência normalmente é caracterizado por recursos adicionais, incluindo a alta atividade dos lisossomos, disfunção mitocondrial, alterações nucleares, rearranjos de cromatina, stress do retículo endoplasmático, danos ao DNA e uma senescência-associados o fenótipo secretor (SASP)3,4. As células senescentes têm múltiplas funções no corpo: desenvolvimento, ferida cura e tumor supressão2. Igualmente, eles são conhecidos por desempenhar um papel importante no envelhecimento e, paradoxalmente, em progressão de tumor5. Os efeitos negativos e parcialmente contraditórios, a senescência são frequentemente atribuídos a SASP6.
Recentemente, foi demonstrado que a eliminação de células senescentes de ratos leva a extensão de vida útil e a eliminação de muitos do envelhecimento características7,8,9,10,11, 12. da mesma forma, várias drogas têm sido desenvolvidas para também eliminar as células senescentes (senolytics) ou para direcionar o SASP13,14. O potencial terapêutico antienvelhecimento recentemente tem atraído mais atenção ao campo.
O estudo dos mecanismos associados à senescência celular e as projecções para intervenções farmacológicas dependem fortemente ex vivo modelos, particularmente em fibroblastos humanos primários. Embora existam algumas características comuns ativadas por indutores de diversas senescência, uma grande variabilidade do fenótipo de senescência é observado e dependente de vários factores, incluindo a célula tipo, o estímulo e o tempo ponto3,15, 16,17. É imperativo considerar a heterogeneidade para estudar e orientar células senescentes. Portanto, esse protocolo visa fornecer uma série de métodos utilizados para induzir a senescência em fibroblastos primários usando tratamentos diferentes. Como será explicado, os métodos podem ser facilmente adaptados para outros tipos de células.
Além de senescência replicative, descrevemos cinco outros tratamentos senescência de indução: ionizando radiação, radiação ultravioleta (UV), doxorrubicina, estresse oxidativo e alterações epigenéticas (nomeadamente promoção da acetilação da histona ou demetilação do ADN) . Ambos, radiação ionizante e radiação UV causam danos diretos do DNA e, com a dose apropriada, desencadear senescência18,19. Doxorrubicina também provoca senescência principalmente através de dano do ADN por intercalação no DNA e interromper a função de topoisomerase II e assim travar o DNA reparo mecanismos20. A expressão de genes essenciais para a senescência é normalmente controlada por acetilação da histona e metilação do DNA. Como consequência, inibidores de deacetilase de histona (por exemplo, o butirato de sódio e Santos) e DNA demethylating (por exemplo, 5-aza) agentes desencadear senescência em células normais21,22.
Finalmente, quatro dos marcadores mais comuns associados às células senescentes será explicado: atividade da senescência associado-β-galactosidase (SA-β-gal), taxa de síntese de DNA por ensaio de incorporação de EdU, superexpressão dos reguladores do ciclo celular e p21, p16 de inibidores da quinase cyclin-dependente e superexpressão e secreção de membros da SASP.
Protocolo
1. preparação geral
- Prepare o suporte de D10. Suplemento DMEM médio-Glutamax com 10% FBS e 1% penicilina/estreptomicina (concentração Final: 100 U/mL).
- Prepare o PBS estéril. Dissolva os comprimidos em água de acordo com as instruções do fabricante. Esterilize em autoclave.
- Prepare 1 tripsina de x. Diluir 5 mL de EDTA de tripsina-Versene/10 x 01:10 em 45 mL de PBS estéril.
Nota: Em todo o protocolo, usamos as condições de cultura de células que estão mais perto a fisiológicas condições de fibroblastos primários. Isto significa que podemos incubar células em 37 ° C e 5% de CO2 , como é normalmente feito mas usando 5% O2 em vez do "padrão" 20% O2. - Manipule as amostras em condições estéreis, usando uma capa de fluxo laminar, jaleco e luvas. Manter as células em 20% O2 (condições de sala) apenas enquanto sendo manipulado.
2. indução da senescência
- Replicative senescência
- Durante a manipulação de células ou qualquer material que estará em contato com eles (pipetas, balões aferidos, mídia, etc.) trabalham sob condições estéreis, usando uma capa de fluxo laminar, jaleco e luvas. Manter as células em 20% O2 (condições de sala) apenas enquanto sendo manipulado.
- Semente de 7 x 105 viável primários fibroblastos em uma população baixa dobrando (PD) em um frasco de T75 (~9.3 x 103 células/cm2) contendo 10 mL de D10.
- Crescem as células em uma incubadora de célula a 37 ° C com 5% de CO2 e de 5% O2 até atingirem a confluência de 70 a 80% (3 – 4 dias para a proliferação de culturas em uma baixa PD).
- Separar as células com 3 mL de 1x tripsina e incubar por ~ 5 – 7 min em uma incubadora de cultura de célula a 37 ° C com 5% de CO2 e de 5% O2. Monitore regularmente as células com um microscópio de cultura celular para verificar o processo de desmontar.
- Quando as células são esféricas, pare a reação de tripsina pela adição de 9 mL de D10. Não mais que 10 min incube.
- Gire as células em 300 x g por 5 min. células formarão um sedimento no fundo do tubo, enquanto que os restos e partículas menores ficam no sobrenadante.
- Remover o sobrenadante e dissolver o centrifugado em 1 mL de D10 e realizar uma contagem de células, usando um contador de célula automatizada de acordo com as instruções do fabricante ou uma câmara de Neubauer para contagem manual. Contando, incluem um ensaio para verificar a viabilidade das células (por exemplo, azul de Trypan exclusão23).
- Calcule o PD cumulativo usando esta fórmula:
Novo PD = 3.32* (LOG(cell number total)-(LOG (número de telemóvel semeado)) + PDold
Número total de células = todas as células contadas: mortos e vivos.
Número semeado de célula = número de células viáveis semeado (8 x 105 células).
Velho PD = no momento da semeadura de duplicação da população.
Novo PD = no momento da contagem (após incubação) de duplicação da população.
Nota: Se 7 x 105 fibroblastos primários (PD 35,2) foram semeados em um frasco de T-75 e, após 4 dias eles alcançar 80% de confluência e dividem-se novamente, contando agora a 1,3 x 106 células total (morto + vivo).
Novo PD = 3.32* (LOG(1,300,000 cells)-LOG(700,000)) + 35,2
Novo PD = 36,1 - Propague novamente 8 x 105 células em um novo T75, repetindo as etapas 2.1.2–2.1.8.
Nota: Depois de várias passagens consecutivas, a cultura levará mais tempo para confluente até células parem dividindo-se em tudo. Uma vez que as células parem dividir, teste para marcadores de senescência e/ou colher para aplicações a jusante. - Considere que o maior tamanho de células senescentes pode causar a cultura a aparecer completo e ainda tem uma baixa contagem de células. Assim, a senescência pode ser assumida quando o PD é estável e outros marcadores de senescência aparecem na cultura (ver protocolos 3.1-3.5).
Nota: Use a proliferação de fibroblastos primários como controle.
- Senescência induzida por radiação ionizante
- Durante a manipulação de células ou qualquer material que estará em contato com eles (pipetas, balões aferidos, mídia, etc.), trabalhe em condições estéreis, usando uma capa de fluxo laminar, jaleco e luvas. Manter as células em 20% O2 (condições de sala) apenas enquanto sendo manipulado.
- Semente de 7 x 105 viável primários fibroblastos em um PD baixo num balão T75 (~9.3 x 103 células/cm2) contendo 10 mL de D10.
- Incube as células durante a noite em uma incubadora de cultura de célula a 37 ° C com 5% de CO2 e de 5% O2.
- Expor as células para 10 cinza de irradiação gama de acordo com as instruções da máquina em uso.
- Aspire o meio das pilhas e substitua com 10 mL de D10.
- Incube as celulas em 10 mL de D10 em uma incubadora de cultura de célula a 37 ° C com 5% de CO2 e de 5% O2 por mais 10 dias, substituindo o meio regularmente, aproximadamente a cada 3 dias.
- Após 10 dias, teste para marcadores de senescência e/ou usar as células para aplicações a jusante.
Nota: Use proliferação fibroblastos primários do PD mesmo (antes da irradiação) como controle.
- Radiação ultravioleta (UV) radiação induzida pela senescência
- Durante a manipulação de células ou qualquer material que estará em contato com eles (pipetas, balões aferidos, mídia, etc.), trabalhe em condições estéreis, usando uma capa de fluxo laminar, jaleco e luvas. Manter as células em 20% O2 (condições de sala) apenas enquanto sendo manipulado.
- Semente de 1,5 a 2 x 105 de fibroblastos viáveis primário em um PD baixo em um bem de uma placa de 6 (1,5-2,0 x 104 células/cm2), adiciona 2 mL do meio de D10.
- Colocar as células em uma incubadora de cultura de célula a 37 ° C com 5% de CO2 e de 5% O2 e permitir-lhes aderir ao plástico pelo menos 5 h.
- Tire a média das células. Coloque a placa de 6-bem no meio da câmara de radiação ultravioleta e tire a tampa de plástico. Irradiação com UVB, 20 – 30 mJ/cm2.
- Adicione 2 mL do meio por bem.
- Incube as celulas em 2 mL de D10 em uma incubadora de cultura de célula a 37 ° C com 5% de CO2 e de 5% O2 por mais 7 dias substituindo o meio regularmente, aproximadamente a cada 3 dias.
Nota: Após 7 dias, as células podem ser testadas para os marcadores de senescência e usadas para aplicações a jusante. Use a proliferação fibroblastos primários do PD mesmo (antes da irradiação) como controle.
- Senescência induzida por doxorrubicina
- Preparar 1.000 x solução estoque de doxorrubicina: fazer um estoque de 250 µM de doxorrubicina em PBS 1x, filtro-esterilizar a solução e a alíquota em 500 µ l por tubo estéril. Armazenar o estoque de doxorrubicina a-80 ° C.
- Durante a manipulação de células ou qualquer material que estará em contato com eles (pipetas, balões aferidos, mídia, etc.), trabalhe em condições estéreis, usando uma capa de fluxo laminar, jaleco e luvas. Manter as células em 20% O2 (condições de sala) apenas enquanto sendo manipulado.
- Semente de 7 x 105 viável primários fibroblastos em um PD baixo num balão T75 (~9.3 x 103 células/cm2) contendo 10 mL de D10.
- Incube as células durante a noite em uma incubadora de cultura de célula a 37 ° C com 5% de CO2 e de 5% O2.
- Diluir a 11 µ l dos 1.000 x solução estoque de doxorrubicina em 11 mL de D10 para uma concentração final de 250 nM.
- Aspire o meio das pilhas e substitua com 10 mL de D10 + doxorrubicina.
- Incube as celulas para exatamente 24 h em uma incubadora de cultura de célula a 37 ° C com 5% de CO2 e de 5% O2.
- Aspire o meio das células e cuidadosamente lave uma vez com 10 mL de D10.
- Incube as celulas em 10 mL de D10 por mais 6 dias substituindo o meio regularmente, aproximadamente a cada 3 dias.
- No dia 7, teste para marcadores de senescência e/ou use para aplicações a jusante.
Nota: como controle, uso proliferam fibroblastos primários do PD mesmo tratada por 24 h com veículo (PBS) 1:1,000 em D10.
- Senescência induzida por estresse oxidativa
- Durante a manipulação de células ou qualquer material que estará em contato com eles (pipetas, balões aferidos, mídia, etc.) trabalham sob condições estéreis, usando uma capa de fluxo laminar, jaleco e luvas. Manter as células em 20% O2 (condições de sala) apenas enquanto sendo manipulado.
- Semente de 7 x 105 viável primários fibroblastos em um PD baixo num balão T75 (~9.3 x 103 células/cm2) contendo 10 mL de D10.
- Incube as células durante a noite em uma incubadora de célula a 37 ° C com 5% de CO2 e de 5% O2.
- Prepare uma solução de ~ 200 μM de peróxido de hidrogênio em meio D10 adicionando 22,6 μL de peróxido de hidrogênio 30% em 11 mL de D10.
Nota: Otimize o tratamento para o tipo de célula de interesse, fazendo uma curva dose-resposta para avaliar a toxicidade. - Aspire o meio das células e adicionar 10 mL de água a D10 médio + oxigenada preparada na hora. Incube durante 2 h a 37 ° C com 5% de CO2 e 5% O2.
- Aspire o meio das células e lave uma vez com fresco D10 sem peróxido de hidrogênio.
- Adicione 10 mL de D10 sem peróxido de hidrogênio.
- Incube durante 48 h em uma incubadora de cultura de célula a 37 ° C com 5% de CO2 e de 5% O2.
- Repita etapas 2.5.4–2.5.8 duas vezes mais para um total de três tratamentos.
- Verifique se há marcadores de senescência ou colheita para aplicações a jusante.
Nota: Como controlar, uso pilhas proliferating do PD mesmo tratada com 22,6 µ l de água estéril em D10 para 2h.
- Senescência induzida por epigenetically
- Prepare ações e soluções de trabalho para o pequeno molecule(s) usar de acordo com a tabela 1. Filtro-esterilize as soluções. Alíquota em tubos estéreis. Loja a-20 ° C.
- Durante a manipulação de células ou qualquer material que estará em contato com eles (pipetas, balões aferidos, mídia, etc.) trabalham sob condições estéreis, por exemplo, usando uma capa de fluxo laminar, jaleco e luvas. Manter as células em 20% O2 (condições de sala) apenas enquanto sendo manipulado.
- Semente de 7 x 105 viável primários fibroblastos em um PD baixo num balão T75 (~9.3 x 103 células/cm2) contendo 10 mL de D10.
- Incube as células durante a noite em uma incubadora de cultura de célula a 37 ° C com 5% de CO2 e de 5% O2.
- Prepare-se 11 mL de meio de D10 + solução de trabalho para o tratamento desejado. A diluição exata por tratamento pode ser vista na tabela 1.
- Prepare-se 11 µ l da solução de trabalho de SAHA 1mm em 11 mL de D10.
- Prepare 44 µ l da solução de trabalho de butirato de sódio de 1 M em 11 mL de D10.
- Prepare-se 11 µ l da solução de trabalho de 5-aza de 10mm em 11 mL de D10.
Nota: Otimize os tratamentos para o tipo de célula de interesse, por exemplo, fazendo uma curva dose-resposta para avaliar a toxicidade.
- Adicione D10 médio + solução de trabalho para o tratamento desejado para a cultura.
- Incube durante 24 h em uma incubadora de cultura de célula a 37 ° C com 5% de CO2 e de 5% O2.
- Repita etapas 2.6.4–2.6.6 duas vezes mais, para um total de três tratamentos.
- Meio de mudança para D10 simples sem drogas.
- Depois de mais de 3 dias, células tornam-se senescentes e pronto para testes de marcadores de senescência e aplicações a jusante.
Nota: como controle, uso proliferam fibroblastos primários do PD mesmo tratada por três dias com veículo médio + D10. O veículo médio + D10 precisa ser atualizados todos os 24 h durante esses três dias. O veículo depende do tratamento usado: 1:1,000 DMSO para Santos e 5-aza e 1: 250 água estéril para butirato de sódio.
3. marcadores de senescência
- Preparação
- Prepare-se 20 mg/mL X-galão: dissolver 20 mg de X-gal em 1 mL de dimetilformamida ou DMSO. Armazenar a-20 ° C, protegido da luz.
- Preparar a solução 0,1 M de ácido cítrico: dissolver 2,1 g de ácido cítrico monoidratado em 100 mL de água. Armazenar em temperatura ambiente.
- Preparar a solução de 0,2 M de fosfato de sódio: dissolver 2,84 g de fosfato de sódio dibásico ou 3,56 g de fosfato dibásico de sódio desidrata-se em 100 mL de água. Armazenar em temperatura ambiente.
- Preparar a 0,2 M de ácido cítrico/sódio fosfato pH 6.0: dissolver 36,85 mL de solução 0,1 M de ácido cítrico e 63,15 mL de fosfato de sódio 0,2 M. Ajustar exatamente para pH 6.0. Armazenar em temperatura ambiente.
- Preparar o ferrocianeto de potássio 100 mM: dissolver 2,1 g de ferrocianeto de potássio em 50 mL de água. Armazenar a 4 ° C, protegido da luz.
- Preparar o ferricianeto de potássio 100 mM: dissolver 1,7 g de ferrocianeto de potássio em 50 mL de água. Armazenar a 4 ° C, protegido da luz.
- Preparar a 5 M de cloreto de sódio: dissolver 14,6 g de cloreto de sódio em 50 mL de água. Armazenar em temperatura ambiente.
- Prepare-se 1 M de cloreto de magnésio: dissolver 4,8 g de cloreto de magnésio em 50 mL de água. Armazenar em temperatura ambiente.
- Preparar o formol 2% + 0,2% glutaraldeído em PBS: dissolver 800 µ l de glutaraldeído 25% e 12,5 µ l de 16% de formaldeído em 100 µ l de PBS. Armazenar em temperatura ambiente protegida da luz.
- Preparar a solução de coloração fresco de acordo com tabela 2.
- Mancha de senescência-associado β-galactosidase
- Para cada amostra, sementes 1 x 104 células em pelo menos um poço de um 500 µ l contendo de 24-(5.2 x 103 células/cm2) placa de D10 para que as células são escassas. Tratamentos (se aplicável) podem ser executados diretamente sobre esta placa ou, alternativamente, as células tratadas já podem ser re-semeadas em uma placa de 24.
- Incube as células durante a noite a 37 ° C, com 5% de CO2 e de 5% O2.
- Lave as células duas vezes com 500 µ l de PBS.
- Fix 3 – 5 min à temperatura ambiente usando 500 μL/poço de formol 2% + 0,2% glutaraldeído em PBS.
- Lave as células duas vezes com 500 µ l de PBS.
- Prepare nova solução, de acordo com o número de amostras a mancha de coloração.
- Adicionar a solução de coloração (500 µ l/poço) e a placa com parafilm para evitar a evaporação do selo.
Nota: A evaporação pode causar cristais para formar e dificultar a observação ao microscópio. - Células no escuro (por exemplo, coberto de papel alumínio), incube a 37 ° C numa incubadora seco (sem CO2) para 12-16 h.
Nota: O CO2 pode afetar o pH e, portanto, modificar os resultados. Alguns tipos de células podem exigir mais curtos tempos de incubação. - Lave duas vezes com 500 µ l de PBS.
- Avalie os resultados. Células positivas apresentam um azul (principalmente) perinuclear coloração sob um microscópio de luz normal (figura 1A).
- Para quantificação, observar pelo menos 100 células por amostra e conte o número de células positivas. Desde células senescentes mudam de forma, muitas vezes é difícil definir os limites da célula e a contagem das células. Counterstain com DAPI para facilitar a visualização e quantificação de células individuais (figura 1B). Quantificar as amostras (porcentagem de células positivas versus a quantidade total de células) usando um microscópio fluorescente (Figura 1). Tire várias fotos da mesma amostra para que no final você pode contar pelo menos 100 single-células e avaliar a porcentagem de células positivas SA-β-gal neles.
- Compare resultados de células senescentes contra seu controle apropriado para o tratamento utilizado.
Nota: Uma coloração co com EdU na mesma amostra é possível. Considere que células então devem ser semeadas em lamelas.
- Ensaio de incorporação de EdU
- Colocar um poço/lamela em uma placa de 24 de acordo com o número de amostras para avaliar.
- Semente de 1 x 104 células em pelo menos um poço de uma placa de 24 poços (5.2 x 103 células/cm2) por condição contendo 500 µ l de D10 para que as células são escassas. Tratamentos (se aplicável) podem ser executados diretamente sobre esta placa ou, alternativamente, células já tratadas podem ser re-semeadas em uma placa de 24.
- Incube as células durante a noite a 37 ° C, com 5% de CO2 e de 5% O2.
- Faça uma solução de 20 µM de EdU em D10 (1: 250) de acordo com o número de amostras a tratar (250 μL por amostra).
- Retire metade do meio (250 μL) de cada poço para tratar e substituí-lo com a D10 + EdU solução que só foi preparada. Concentração final de EdU é 10 µM.
- Incube 18 – 24 h em uma incubadora de cultura de célula a 37 ° C com 5% de CO2 e 5% de O2. Use o mesmo tempo de incubação no controle e células senescentes.
- Lave 2 x com 500 µ l de PBS.
- Fixe as células durante 10 min com 500 μL de formol 4% em PBS.
- Incube 5 min em 500 μL de 100 mM Tris (pH 7,6).
- Permeabilize as células por 10 min em 500 μL de 0,1% Triton X-100 em PBS.
- Lave 3x com PBS.
- Preparar 50 μL de mistura de rótulo para cada lamela, adicionando os componentes na seguinte ordem: 44,45 µ l de PBS, 0,5 µ l de Cu (II) SO4, 0,05 µ l de sulfo-Cy3-azida, 5 µ l de ascorbato de sódio.
- Colocar 50 μL da mistura rótulo em um pedaço de parafilme. Levantar a lamela com o auxílio de um par de pinças e uma agulha e deixe-a descansar em cima da mistura de rótulo, com a superfície que contém as células virado para baixo. Certifique-se que não há nenhuma bolha e que toda a superfície da lamela é comovente o mix de rótulo. Incube durante 30 min no escuro.
- Colocar as células em poços da placa de 24 poços e lavar três vezes com PBS.
- Montar com montando a mídia (incluindo DAPI para visualizar núcleos) em lâminas de vidro e deixe-os secar durante a noite.
- Visualize a incorporação de EdU usando um microscópio fluorescente. Use um filtro apropriado para Cy3 (excitação/emissão: 552/570 nm).
- Tire várias fotos das células para posterior quantificação de pelo menos 100 células por condição (Cy3 e DAPI).
- Quantificar a percentagem de células que incorporaram EdU usando a seguinte fórmula:
EdU células positivas (%) = (contagem de células positivas de EdU (Cy3) / total de contagem de células (DAPI)) * 100 - Compare resultados de células senescentes contra seu controle apropriado para o tratamento utilizado.
Nota: Uma coloração co com SA-β-gal, na mesma amostra é possível. Considere que células ainda devem ser semeadas em lamelas.
- Expressão do gene p16, p21 e SASP
- Prepare a primeira demão-conjuntos de Genes de interesse (cartilha de 50 µM cada).
Nota: Um qPCR de p16, p21 e alguns fatores relevantes do SASP é informativo do estado de senescência. O protocolo descrito aqui faz uso do sistema de biblioteca da sonda Universal (UPL) para quantificação relativa usando um PCR de tempo real. A tabela 3 mostra uma visão geral dos primers usados para a deteção da p16 inibidores CDK e p21 e dos membros do SASP mais relevantes, bem como para tubulina e actina, que servem como genes de referência para o ensaio. A última coluna da tabela 3 inscreve a sonda UPL específica a ser usado para cada ensaio. - Prepare a mistura de reação de qPCR separado para os ensaios desejados. Sempre incluem o gene de referência, bem como de acordo com a tabela 4.
- Execute todas as amostras em duplicado ou triplicado.
- Carga de 7,5 µ l/poço da qPCR reação mistura em uma placa de 384.
- Adicionar 5 ~ ng de cDNA dissolvido em 2,5 µ l de água livre de RNase.
Nota: É preferível ter quantidades semelhantes de cDNA para todas as amostras a serem comparadas. Isto pode ser conseguido usando quantidades iguais de RNA para a transcrição reversa. - Cubra o prato com um selo e certifique-se que ele adere corretamente, cobrindo uniformemente a todos os poços da placa.
- Gire a placa a 2.000 x g por 1 min.
- Verificar a placa na Lightcycler para 40 ciclos utilizando o seguinte protocolo:
95 ° C por 7 min
40 ciclos de 95 ° C por 5 s e 60 ° C por 30 s
37 ° C por 1 min - Para a análise dos resultados, use o método proposto por Livak e colegas para analisar dados de qPCR24. Usar a tubulina ou actina como genes de referência para calcular o ΔCt valorizam e usam o controle apropriado para calcular o para o valor de ΔΔCt para o tratamento específico de senescência de indução.
- Prepare a primeira demão-conjuntos de Genes de interesse (cartilha de 50 µM cada).
- Expressão da proteína e secreção de IL6
- Semente 5 – 10 x 104 células, em pelo menos um poço de uma 6-placa (5.2 – 10.5 x 103 células/cm2) por condição contendo 2 mL de D10. Tratamentos (se aplicável) podem ser executados diretamente sobre esta placa ou, alternativamente, as células tratadas já podem ser re-semeadas em uma placa de 24. Deixe ficar durante a noite após a semeadura.
- O meio de remover e substituir por 2 mL de DMEM médio sem FBS. Incube em condições normais de 24 h.
- Colete o médio em um tubo de 15 mL.
- Centrifugar a amostra a 300 x g por 5 min. do meio pode ser armazenado a-80 ° C até processada.
- Siga as instruções do fabricante para realizar o teste ELISA.
- Comparar resultados de células senescentes versus o controle apropriado para o tratamento específico de senescência de indução
Resultados
Enriquecimento de SA-β-gal coloração em fibroblastos senescentes
Β-galactosidase (β-gal) é uma enzima lisossomal que é expressa em todas as células e que tem um pH ótimo de 4.025,26. No entanto, durante a senescência, lisossomos aumentam de tamanho e, consequentemente, as células senescentes acumulam β-gal. O aumento dos montantes desta enzima tornam possível detectar sua atividade mesmo em uma qualidade inferior de pH 6.025,27. Figura 1A mostra imagens representativas da coloração de SA-β-gal em proliferando contra senescentes fibroblastos primários. As células também olham alargada e com um corpo celular irregular. Como mencionado, pode ser difícil distinguir células individuais, para que uma coloração co com DAPI facilita a visualização e célula contando (figura 1B). É necessário tirar fotos em um microscópio de fluorescência para ser capaz de observar a coloração do DAPI. Isto significa que fotos no canal campo claro serão tomadas em preto/branco, para que a coloração "azul" da SA-β-gal aparecerá preta nas fotos. Digno de nota, nem todas as células dentro de uma amostra são positivas para β-gal. A eficiência da indução da senescência é altamente dependente do estímulo - célula tipo/tensão e usado. Os protocolos descritos aqui renderam > 50% β-gal células positivas em fibroblastos primários (BJ e WI-38) em nossas mãos.
Células menos incorporam EdU após a indução da senescência
EdU é um análogo da timidina nucleosídeo que, durante a síntese de DNA ativo, será incorporada a DNA28. A incorporação do EdU no DNA pode ser visualizada depois de executar a Copper-Catalyzed azida-Alkyne cicloadição (CuAAC) para o EdU, a reação não pode ser executada em timidina regular porque lhe falta o alquino grupo28. Neste protocolo particular, está sendo usado um Sulfo-Cy3-azida. Se a atrelar a azida para o alquino tomou lugar, células exibirão fluorescência sob um filtro Cy3 (Figura 2A). É importante ter em conta que, realizando o ensaio de incorporação de EdU, as células que estão se proliferando distinguem-se de não-proliferação de células. As não-proliferação de células podem ser quiescente ou senescente, significado que o ensaio de incorporação de EdU não pode discriminar entre estes dois tipos de detenção do ciclo celular.
Senescentes fibroblastos upregulate o CDK inibidores p16 e p21
Células senescentes fazem uso de inibidores dos CDKs para parar o ciclo celular,29. Particularmente, p16 e p21 medem-se muitas vezes como marcadores de células senescentes3. Um ou ambos marcadores são normalmente upregulated em células senescentes e o upregulation é medido frequentemente no nível transcricional. É incentivado a usar ambos os marcadores simultaneamente, desde que algumas células não upregulate p16 no nível transcricional e p21 é um marcador universal mas não específico para senescência15,17,30. A Figura 3 mostra representativas quantificações relativas de p16 e p21 mRNA em fibroblastos induzido a senescência. Outras técnicas como imunocoloração e/ou mancha ocidental para detectar níveis de proteína também são possíveis.
Fibroblastos senescentes exibir um SASP
As células senescentes mais transcricionalmente upregulate vários genes que codificam para secretada proteínas, um fenômeno chamado SASP6. O SASP inclui fatores envolvidos na inflamação, por exemplo, interleucinas e quimiocinas, ou na degradação da matriz extracelular (ECM), por exemplo, MMPs, mas é altamente heterogêneo. Indução de factores SASP pode ser avaliada medindo-se os níveis de expressão do mRNA através de qPCR ou níveis de proteína secretada através de Enzyme-Linked imuno Sorbent ensaio (ELISA). A Figura 4 mostra uma imagem representativa, mostrando o upregulation de IL6 ambos os níveis transcricionais e secretado. Nós usamos IL6 apenas como uma representação; no entanto, é incentivado para medir vários membros da SASP da lista sugerida no protocolo 3.4.
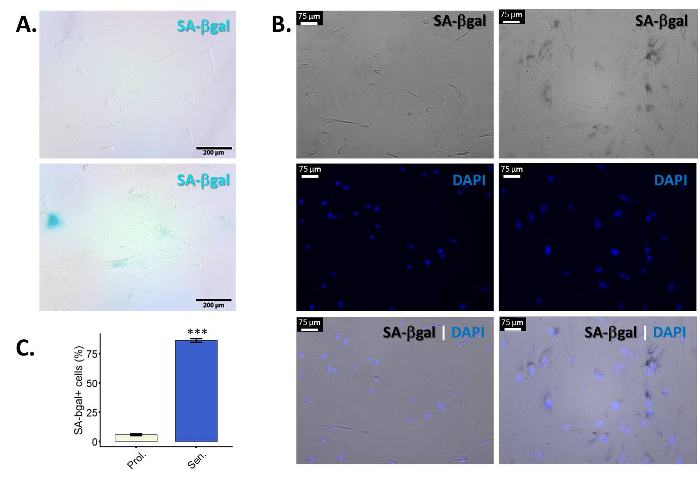
Figura 1: enriquecimento de SA-β-gal coloração em fibroblastos primários senescentes. Fibroblastos de prepúcio primário de BJ (PD 34.1) foram induzidos a senescência, expondo-os à radiação ionizante (10 Gy). As células foram coradas por SA-βgal dez dias após a irradiação. (A) resultados representativos para a coloração de SA-βgal em fibroblastos primários de BJ não tratada (para cima) ou expostos a radiações ionizantes (para baixo). Ampliação final: 100 X. (B) figura representativa de SA-β-gal co manchado com DAPI para fibroblastos primários BJ ou não tratadas (três à esquerda painéis) ou expostos a radiações ionizantes (três painéis certo). O DAPI coloração (azul) ajuda a visualizar a facilitar a quantificação de células individuais. Fotos tiradas em campo claro aparecem em preto/branco. Portanto, nestas fotos particular o SA-β-gal coloração olhará como manchas pretas perinuclear. Ampliação final: 100 X. (C) quantificação de SA-β-gal positivas células em proliferação (Prol., branco) fibroblastos BJ contra ionizantes irradiados-tratados homólogos (senador, azul). Quantificação foi realizada com três réplicas biológicas com barras de erro mostrando o erro padrão da média. Significância estatística foi determinada por um unpaired bicaudal teste t de Student-nos valores de delta-CT. (n = 3, ± SEM, * * * = valor de p < 0,01). Clique aqui para ver uma versão maior desta figura.
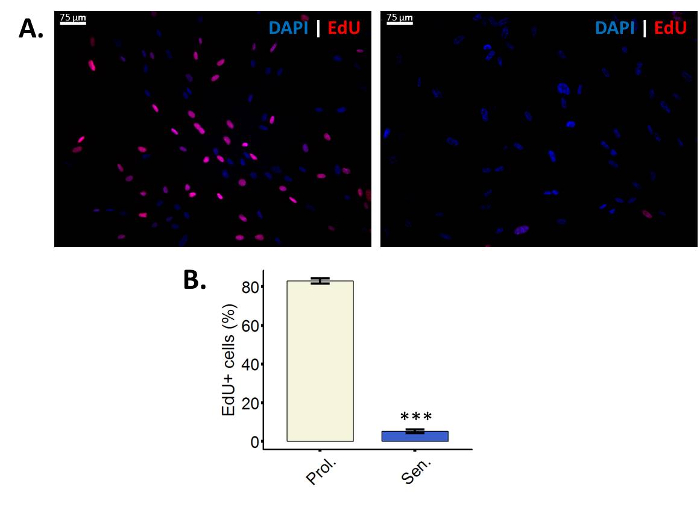
Figura 2: células menos incorporam EdU após a indução da senescência. (A) imagem representativa do ensaio de incorporação do EdU na proliferação fibroblastos WI-38 43.86 PD (à esquerda) e os seus homólogos irradiados ionizantes (à direita). Ampliação final: 100 X. (B) quantificação de EdU positivas células em proliferação (Prol., branco) fibroblastos BJ (PD 38,7) contra suas contrapartes irradiados (senador, azul). Quantificação foi realizada com três réplicas biológicas com barras de erro mostrando o erro padrão da média. Significância estatística foi determinada por um unpaired bicaudal teste t de Student-nos valores de delta-CT (n = 3, ± SEM, * * * = valor de p < 0,01). Clique aqui para ver uma versão maior desta figura.
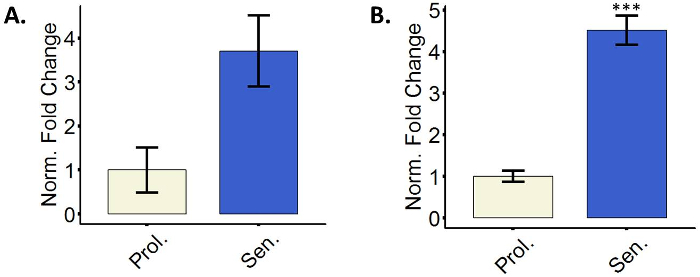
Figura 3: fibroblastos senescentes upregulate o CDK inibidores p16 e p21. (A) a quantificação da expressão de RNAm de p16 em proliferação (Prol., branco, PD 35,3) ou 5-aza-Tratado de células BJ (senador, azul). (B) a quantificação da expressão de RNAm de p21 em proliferação (Prol., branco, PD 35,3) ou 5-aza-tratados BJ células (senador, azul). Quantificação foi realizada com três réplicas biológicas (cada um com dois técnicos Replica) com barras de erro mostrando o erro padrão da média. Significância estatística foi determinada por um unpaired bicaudal teste t de Student-nos valores de delta-CT (n = 3, ± SEM, * * * = p valor < 0,01). Clique aqui para ver uma versão maior desta figura.
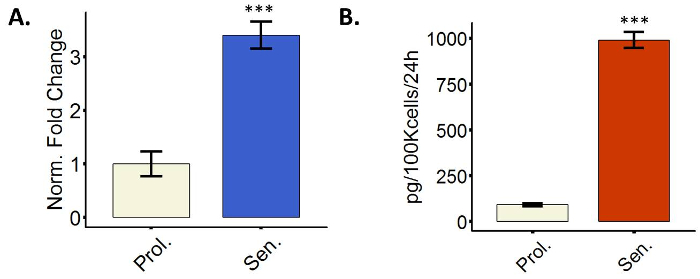
Figura 4: fibroblastos senescentes exibir um fenótipo secretor (SASP). Expressão (A), quantificação de IL6 mRNA em fibroblastos BJ ou proliferando (Prol., branco, PD 38,7) ou induzida a senescência por radiação ionizante (senador, azul). (B) a quantificação da expressão de proteínas IL6 em proliferação 38,6 PD (Prol., branco) ou tratada com radiações ionizantes WI38 fibroblastos (senador, azul). Quantificação foi realizada com três réplicas biológicas com barras de erro mostrando o erro padrão da média. No caso dos dados de qPCR, cada replicar biológica tinha dois técnicas duplicatas. Significância estatística foi determinada por um unpaired bicaudal teste t de Student-nos valores de delta-CT (n = 3, ± SEM, * * * = valor dep < 0,01). Clique aqui para ver uma versão maior desta figura.
| Diluente de | Solução-mãe | Solução de trabalho | Diluição para tratamento | Concentração final | |
| SAHA | DMSO | 100 mM | 1 mM | 1:1,000 | 1 ΜM |
| Butirato de sódio | Água estéril | --- | 1 M | 1: 250 | 4 mM |
| 5-aza-2'-deoxycytidine (5-aza) | DMSO | 100 mM | 10 mM | 1:1,000 | 10 ΜM |
Tabela 1: Estoque e trabalhar soluções para os diferentes tratamentos utilizados para senescência induzida por Epigenetically.
| Componente de | Volume de | Concentração final |
| X-galão de 20 mg/mL | 1 mL | 1 mg/mL |
| 0,2 tampão fosfato de sódio/ácido cítrico M ph 6.0 | 4 mL | 40 mM |
| ferrocianeto de potássio a 100 mM | 1 mL | 5 mM |
| Ferricianeto de potássio a 100 mM | 1 mL | 5 mM |
| Cloreto de sódio 5 M | 0,6 mL | 150 mM |
| 1m de cloreto de magnésio | 0,04 mL | 2 mM |
| Água | 12,4 mL | - |
| Total | 20 mL |
Tabela 2: Composição da solução de coloração usado para senescência associado (SA) - β - gal coloração.
| Alvo | Encaminhar o Primer (5'--> 3') | Reverter o Primer (5'--> 3') | Sonda UPL | ||
| Tubulina | CTTCGTCTCCGCCATCAG | CGTGTTCCAGGCAGTAGAGC | #40 | ||
| Actina B | ccaaccgcgagaagatga | ccagaggcgtacagggatag | #64 | ||
| P16 | GAGCAGCATGGAGCCTTC | CGTAACTATTCGGTGCGTTG | #67 | ||
| P21 | tcactgtcttgtacccttgtgc | ggcgtttggagtggtagaaa | #32 | ||
| VLI | CAGGAGCCCAGCTATGAACT | GAAGGCAGCAGGCAACAC | #45 | ||
| IL8 | GAGCACTCCATAAGGCACAAA | ATGGTTCCTTCCGGTGGT | #72 | ||
| IL1a | GGTTGAGTTTAAGCCAATCCA | TGCTGACCTAGGCTTGATGA | #6 | ||
| CXCL1 | CATCGAAAAGATGCTGAACAGT | ATAAGGGCAGGGCCTCCT | #83 | ||
| CXCL10 | GAAAGCAGTTAGCAAGGAAAGGT | GACATATACTCCATGTAGGGAAGTGA | #34 | ||
| CCL2 | AGTCTCTGCCGCCCTTCT | GTGACTGGGGCATTGATTG | #40 | ||
| CCL20 | GCTGCTTTGATGTCAGTGCT | GCAGTCAAAGTTGCTTGCTG | #39 | ||
| PAI1 | AAGGCACCTCTGAGAACTTCA | CCCAGGACTAGGCAGGTG | #19 | ||
| MMP1 | GCTAACCTTTGATGCTATAACTACGA | TTTGTGCGCATGTAGAATCTG | #7 | ||
| MMP3 | CCAGGTGTGGAGTTCCTGAT | CATCTTTTGGCAAATCTGGTG | #72 | ||
| MMP9 | GAACCAATCTCACCGACAGG | GCCACCCGAGTGTAACCATA | #53 | ||
Tabela 3: Primer sequências e sua sonda UPL correspondente para detectar mRNA de senescência marcadores em amostras de origem humana.
| Componente de | Volume/exemplo |
| Sensifast sonda Lo-Rox mix | 5 Μ l |
| Cartilha-conjunto (50 µM) | 0,1 Μ l |
| Sonda UPL | 0,1 Μ l |
| Água livre de nuclease | 2.3 Μ l |
| cDNA (~ 4 ng) | 2,5 Μ l |
| Total | 7,5 Μ l |
Tabela 4: Composição da reação qPCR mix para o sistema UPL.
Discussão
Os protocolos explicados aqui foram otimizados para fibroblastos humanos primários, particularmente células BJ e WI-38. Os protocolos para a senescência replicative, radiação ionizante e doxorrubicina, foram aplicados com sucesso para outros tipos de fibroblastos (HCA2 e IMR90) e em outros tipos de células (nomeadamente neonatais melanócitos e queratinócitos ou cardiomyocytes iPSC-derivado) em nosso laboratório. No entanto, adaptações para tipos de células adicionais podem ser otimizadas ajustando alguns detalhes como o número de células semeadas, os métodos e produtos químicos para ajudar as células para anexar/desencaixar para suportes de plástico e a dosagem do tratamento para evitar toxicidade.
Nem a utilização de fibroblastos primários representa um número de desafios. Células senescentes são geralmente mais difíceis de separar do que suas contrapartes de proliferação, e elas são muitas vezes mais sensível ao tripsinização ou qualquer outro tipo de desanexação método, significando que a viabilidade após desanexação é ligeiramente menor que a do proliferação de células. A escolha do Controlarar apropriado para os diferentes métodos de indução senescência é difícil. Por exemplo, para os tratamentos baseados em drogas como doxorrubicina, sugerimos um tratamento curto com o veículo: PBS durante 24 h no caso das amostras de controle para células tratados com doxorrubicina seguido de colheita/processamento imediato. Pode-se argumentar que as células induzidas a senescência passam por um tempo prolongado de cultura após o tratamento foi aplicado (seis dias extras de cultura para células tratados com doxorrubicina) e células de controle devem ser culta igual quantidade de tempo após a remoção da PBS. No entanto, uma cultura tão longa permitiria que as células para dividir ainda mais, tornar-se excesso confluente ou exigir a passagem ainda mais e aumentar PD confluência excessiva pode causar marcadores da senescência, como SA-β-gal a aparecer apesar de células mantendo suas proliferando potencial31. O PD aumento iria tirá-los mais perto de seu limite de replicação (e a senescência replicative) e torná-los menos comparáveis aos seus homólogos tratados com doxorrubicina. Uma situação semelhante se aplicaria para os outros tratamentos. Sugerimos os controles que consideramos mais adequadas para cada caso.
A maioria das técnicas usadas para induzir as células em senescência parece relativamente fácil e direta, mas muitos fatores podem afetar o resultado dos experimentos. Por exemplo, a concentração de glicose normal dos meios de cultura de células convencional pelos fibroblastos é 4,5 g/L. No entanto, para alguns tipos de células como as células-tronco, concentrações de glicose estendem seu potencial proliferativo32, enquanto para outros umas concentrações mais elevadas podem levar a senescência prematura33. Além disso, como células senescentes são altamente metabólicas e gastam grandes quantidades de energia para produzir fatores secretados34, outros fenótipos associados a senescência podem ser afetados por oscilações nas concentrações de glicose.
Outra variável potencial em meio de cultura de células é o soro. A composição do soro normalmente não é definida e varia de acordo com a fonte animal e o lote. Particularmente, a quantidade de fatores de crescimento e proteínas pró-inflamatórias pode influenciar a senescência35. Recomendamos que o mesmo lote de soro é usado para o experimento todo para evitar desnecessária e confundimento variabilidade. Ainda, algumas condições técnicas inevitáveis, tais como o uso de meio livre de soro utilizado para alguns protocolos baseados em ELISA podem reduzir a expressão de SASP.
Tensão de oxigênio é importante para a indução da senescência completa. Hipoxia pode inibir a geroconversion, para que as células não proliferam, mas não são irreversivelmente presos36. No entanto, o problema mais comum na configuração experimental não é hipóxia mas hiperóxia. Com efeito, as condições de cultura padrão usam 20% oxigênio como "normoxia", mas condições fisiológicas para a maioria dos tipos de células são mais baixos. Blastocistos mouse apresentam marcadores de senescência (SA-βgal e DNA danos) quando cultivadas em 20% de oxigênio, ao contrário de seus na vivo-derivados homólogos ou as mesmas células cultivadas em 5% oxigênio37. Além disso, fibroblastos de rato cultivados no mais condições fisiológicas (3% de oxigénio) e não no convencional ones (20% de oxigénio) visor um SASP38. Aqui, usamos 5% oxigênio para todas as culturas e experiências e nós instar os investigadores a reconsiderar as concentrações de oxigênio usadas para o tipo de célula específica de interesse.
Finalmente, outro fator a considerar é a heterogeneidade intrínseca das células senescentes. Por um lado, diferentes tipos de células e cepas de célula mesmo exibem diferenças em fenótipos associados a senescência. Por exemplo, algumas cepas de fibroblastos do não upregulate p16 no nível transcricional sobre senescência indução15,16,17, como também é mostrado na Figura 3A, onde apesar de ter visto um upregulation de P16, isto não foi estatisticamente significativo. P16 também é controlada a nível translacional e borne-translational, para que medição dos níveis de proteína pode em alguns casos demonstram um aumento da atividade deste inibidor CDK. No entanto, pode ser que algumas células simplesmente recorrer a outros inibidores CDK como p21. Recomenda-se medir os níveis transcricionais dos dois. A composição exata do SASP também depende da célula que produz a-3. Além disso, algumas células constitutivamente expressam altos níveis de β-galactosidase, dando um resultado positivo para SA-β-gal coloração que não é necessariamente indicativo de senescência3. Em alguns casos, este problema pode ser superado, reduzindo o tempo de incubação com solução de coloração durante o protocolo de coloração de SA-β-gal. Como mencionado, células confluente excessiva também podem manchar com o SA-β-gal sem eles serem senescentes31, assim Evite pesquisadores para células de cultura escassamente para executar esta coloração. Por outro lado, o fenótipo de envelhecimento em si não é estável,39. A composição da SASP e o surgimento de outros marcadores de senescência são dependentes de tempo17,40. Aqui, sugerimos são considerados os pontos de tempo depois de cada tratamento, na qual células senescentes totalmente e que são rotineiramente utilizados em nosso laboratório. Importante, marcadores em um ponto de tempo mais curto de medição pode render resultados negativos devido à incompleta senescência40. Além disso, uma vez que na maioria dos tratamentos uma percentagem de células não tornam-se senescentes, usando um ponto de tempo mais longo pode dar tempo suficiente para as células senescentes-não poucos expandir e ultrapassar a cultura, reduzindo a expressão de marcadores senescentes. Vistas para a heterogeneidade das células senescentes e os vários impedimentos dos marcadores diferentes, altamente encorajamos pesquisadores usar vários marcadores de senescência, dentro da mesma amostra.
Divulgações
N/A
Agradecimentos
Agradecemos a membros do laboratório Demaria para discussões frutuosos e Thijmen van Vliet para compartilhar dados e protocolo sobre a senescência induzida por UV.
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM Media - GlutaMAX | Gibco | 31966-047 | |
| Fetal Bovine Serum | Hyclone | SV30160.03 | |
| Penicillin-Streptomycin (P/S; 10,000 U/ml) | Lonza | DE17-602E | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | SC-202581 | |
| Nuclease-Free Water (not DEPC-Treated) | Ambion | AM9937 | |
| T75 flask | Sarstedt | 833911002 | |
| Trypsin/EDTA Solution | Lonza | CC-5012 | |
| PBS tablets | Gibco | 18912-014 | |
| 1.5 ml microcentrifuge tubes | Sigma-Aldrich | T9661-1000EA | |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich | CLS430791 | |
| 6-well plate | Sarstedt | 83.3920 | |
| 24-well plate | Sarstedt | 83.3922 | |
| 13mm round coverslips | Sarstedt | 83.1840.002 | |
| Steriflip | Merck Chemicals | SCGP00525 | |
| Cesium137-source | IBL 637 Cesium-137γ-ray machine | ||
| UV radiation chamber | Opsytec, Dr. Göbel BS-02 | ||
| Doxorubicin dihydrochloride | BioAustralis Fine Chemicals | BIA-D1202-1 | |
| Hydrogen peroxide solution | Sigma-Aldrich | 7722-84-1 | |
| 5-aza-2’-deoxycytidine | Sigma-Aldrich | A3656 | |
| SAHA | Sigma-Aldrich | SML0061 | |
| Sodium Butyrate | Sigma-Aldrich | B5887 | |
| X-gal (5-Bromo-4-chloro-3-indolyl-β-D-galactopyranoside) | Fisher Scientific | 7240-90-6 | |
| Citric acid monohydrate | Sigma-Aldrich | 5949-29-1 | |
| Sodium dibasic phosphate | Acros organics | 7782-85-6 | |
| Potassium ferrocyanide | Fisher Scientific | 14459-95-1 | |
| Potassium ferricyanide | Fisher Scientific | 13746-66-2 | |
| Sodium Chloride | Merck Millipore | 7647-14-5 | |
| Magnesium Chloride | Fisher Chemicals | 7791-18-6 | |
| 25% glutaraldehyde | Fisher Scientific | 111-30-8,7732-18-5 | |
| 16% formaldehyde (w/v) | Thermo-Fisher Scientific | 28908 | |
| EdU (5-ethynyl-2’-deoxyuridine) | Lumiprobe | 10540 | |
| Sulfo-Cyanine3 azide (Sulfo-Cy3-Azide) | Lumiprobe | D1330 | |
| Sodium ascorbate | Sigma-Aldrich | A4034 | |
| Copper(II) sulfate pentahydrate (Cu(II)SO4.5H2O) | Sigma-Aldrich | 209198 | |
| Triton X-100 | Acros organics | 215682500 | |
| TRIS base | Roche | 11814273001 | |
| LightCycler 480 Multiwell Plate 384, white | Roche | 4729749001 | |
| Lightcycler 480 sealing foil | Roche | 4729757001 | |
| Sensifast Probe Lo-ROX kit | Bioline | BIO-84020 | |
| UPL Probe Library | Sigma-Aldrich | Various | |
| Human IL-6 DuoSet ELISA | R&D | D6050 | |
| Bio-Rad TC20 | Bio-Rad | ||
| Counting slides | Bio-Rad | 145-0017 | |
| Dry incubator | Thermo-Fisher Scientific | Heratherm | |
| Dimethylformamide | Merck Millipore | 1.10983 | |
| Parafilm 'M' laboratory film | Bemis | #PM992 | |
| Tweezers | |||
| Needles |
Referências
- Hayflick, L., Moorhead, P. S. The serial cultivation of human diploid cell strains. Experimental Cell Research. 25, 585-621 (1961).
- Muñoz-Espín, D., Serrano, M. Cellular senescence: from physiology to pathology. Nature reviews. Molecular cell biology. 15, 482-496 (2014).
- Sharpless, N. E., Sherr, C. J. Forging a signature of in vivo senescence. Nature Reviews Cancer. 15 (7), 397-408 (2015).
- Correia-Melo, C., et al. Mitochondria are required for pro-ageing features of the senescent phenotype. The EMBO Journal. 10, e201592862 (2016).
- Loaiza, N., Demaria, M. Cellular senescence and tumor promotion: Is aging the key?. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. , (2016).
- Coppe, J. P., et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biology. 6 (12), 2853-2868 (2008).
- Baker, D. J., et al. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature. 530 (7589), 184-189 (2016).
- Xu, M., et al. Targeting senescent cells enhances adipogenesis and metabolic function in old age. Elife. 4, e12997 (2015).
- Baker, D. J., et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479 (7372), 232-236 (2011).
- Jeon, O. H., et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nature Medicine. 23 (6), 775-781 (2017).
- Demaria, M., et al. Cellular Senescence Promotes Adverse Effects of Chemotherapy and Cancer Relapse. Cancer Discovery. 7 (2), 165-176 (2017).
- Chang, J., et al. Clearance of senescent cells by ABT263 rejuvenates aged hematopoietic stem cells in mice. Nature Medicine. 22 (1), 78-83 (2016).
- Soto-Gamez, A., Demaria, M. Therapeutic interventions for aging: the case of cellular senescence. Drug Discov Today. 22 (5), 786-795 (2017).
- Childs, B. G., et al. Senescent cells: an emerging target for diseases of ageing. Nature Reviews Drug Discovery. 16 (10), 718-735 (2017).
- Marthandan, S., et al. Conserved genes and pathways in primary human fibroblast strains undergoing replicative and radiation induced senescence. Biological Research. 49, 34 (2016).
- Marthandan, S., et al. Conserved Senescence Associated Genes and Pathways in Primary Human Fibroblasts Detected by RNA-Seq. PLoS One. 11 (5), e0154531 (2016).
- Hernandez-Segura, A., et al. Unmasking Transcriptional Heterogeneity in Senescent Cells. Current Biology. 27 (17), 2652-2660 (2017).
- Le, O. N., et al. Ionizing radiation-induced long-term expression of senescence markers in mice is independent of p53 and immune status. Aging Cell. 9 (3), 398-409 (2010).
- Hall, J. R., et al. C/EBPalpha regulates CRL4(Cdt2)-mediated degradation of p21 in response to UVB-induced DNA damage to control the G1/S checkpoint. Cell Cycle. 13 (22), 3602-3610 (2014).
- Nitiss, J. L. Targeting DNA topoisomerase II in cancer chemotherapy. Nature Reviews Cancer. 9 (5), 338-350 (2009).
- Pazolli, E., et al. Chromatin remodeling underlies the senescence- associated secretory phenotype of tumor stromal fibroblasts that supports cancer progression. Cancer Research. 72, 2251-2261 (2012).
- Venturelli, S., et al. Differential induction of apoptosis and senescence by the DNA methyltransferase inhibitors 5-azacytidine and 5-aza-2'-deoxycytidine in solid tumor cells. Molecular Cancer Therapeutics. 12, 2226-2236 (2013).
- Tennant, J. R. Evaluation of the Trypan Blue Technique for Determination of Cell Viability. Transplantation. 2, 685-694 (1964).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Lee, B. Y., et al. Senescence-associated β-galactosidase is lysosomal β-galactosidase. Aging Cell. 5, 187-195 (2006).
- Kopp, H. G., Hooper, A. T., Shmelkov, S. V., Rafii, S. Beta-galactosidase staining on bone marrow. The osteoclast pitfall. Histology and Histopathology. 22 (9), 971-976 (2007).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences. 92 (20), 9363-9367 (1995).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proceedings of the National Academy of Sciences. 105 (7), 2415-2420 (2008).
- Sherr, C. J., McCormick, F. The RB and p53 pathways in cancer. Cancer Cell. 2 (2), 103-112 (2002).
- Bunz, F., et al. Requirement for p53 and p21 to sustain G2 arrest after DNA damage. Science. 282 (5393), 1497-1501 (1998).
- Severino, J., Allen, R. G., Balin, S., Balin, A., Cristofalo, V. J. Is beta-galactosidase staining a marker of senescence in vitro and in vivo. Experimental Cell Research. 257 (1), 162-171 (2000).
- Stolzing, A., Coleman, N., Scutt, A. Glucose-induced replicative senescence in mesenchymal stem cells. Rejuvenation Research. 9 (1), 31-35 (2006).
- Blazer, S., et al. High glucose-induced replicative senescence: point of no return and effect of telomerase. Biochemical and Biophysical Research Communications. 296 (1), 93-101 (2002).
- Wiley, C. D., Campisi, J. From Ancient Pathways to Aging Cells-Connecting Metabolism and Cellular Senescence. Cell Metabolism. 23 (6), 1013-1021 (2016).
- Kumar, R., Gont, A., Perkins, T. J., Hanson, J. E. L., Lorimer, I. A. J. Induction of senescence in primary glioblastoma cells by serum and TGFbeta. Scientific Reports. 7 (1), 2156 (2017).
- Hypoxia Blagosklonny, M. V. MTOR and autophagy: converging on senescence or quiescence. Autophagy. 9 (2), 260-262 (2013).
- Meuter, A., et al. Markers of cellular senescence are elevated in murine blastocysts cultured in vitro: molecular consequences of culture in atmospheric oxygen. Journal of Assisted Reproduction and Genetics. 31 (10), 1259-1267 (2014).
- Coppe, J. P., et al. A human-like senescence-associated secretory phenotype is conserved in mouse cells dependent on physiological oxygen. PLoS One. 5 (2), e9188 (2010).
- van Deursen, J. M. The role of senescent cells in ageing. Nature. 509 (7501), 439-446 (2014).
- Kim, Y. M., et al. Implications of time-series gene expression profiles of replicative senescence. Aging Cell. 12, 622-634 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.
