Method Article
ひと初代細胞における細胞老化の誘導性
要約
ここでは、一連の誘発のためのプロトコルおよび培養細胞の細胞老化の検証について述べる。私たちはさまざまな老化を誘発する刺激に焦点を当てるし、一般的な老化関連マーカーの定量化を記述します。私たちはモデルとして線維芽細胞を使用して技術的な詳細を提供するが、プロトコルは、さまざまな携帯電話モデルに合わせることができます。
要約
細胞の老化は、さまざまな有害な刺激への応答でアクティブに永久的な細胞周期の停止の状態です。細胞の老化の活性化は、腫瘍の抑制、組織改造と高齢化を含むさまざまな病態生理学的条件の特徴です。生体内で細胞老化の誘導はまだよく特徴付けられます。ただし、 ex vivo細胞老化を促進する刺激の数を使用できます。その中で、最も一般的な老化誘導が複製枯渇、電離放射線し非電離放射線、遺伝毒性薬、酸化ストレスと demethylating とエージェントをアセチル化します。ここでは、これらの刺激を使用して老化に線維芽細胞を誘導する方法で詳細な指示いたします。このプロトコルは、簡単に、初代培養細胞やがん細胞を含む細胞の種類ごとに適応できます。老化誘導の検証するための異なる方法についても述べる。特に、我々 はライソゾーム酵素老化関連 β ガラクトシダーゼ (SA β gal) 細胞周期の表現のレベル 5-エチニル-2'-デオキシウリジン (EdU) 取り込みアッセイを用いた DNA 合成率の活性の測定に焦点を当てるp16 の阻害剤と p21 と表情やメンバーの Senescence-Associated 分泌形質 (SASP) の分泌。最後に、私達は例の結果を提供し、これらのプロトコルのアプリケーションをさらに議論。
概要
1961 年、ヘイフリック、ムーアヘッドは、文化の主要な線維芽細胞が連続通路1の後の増殖の可能性を失うことを報告します。このプロセスは、各細胞分裂後シーケンシャル テロメア短縮が原因です。テロメア批判的に短い長さに達する、増殖の不可逆的な停止を活性化する DNA 損傷応答 (DDR) によって認識されます-複製老化としても定義されています。複製老化細胞のマイトジェンとアポトーシス シグナル2,3の両方に依存しないレンダリングする永久的な細胞周期の停止の状態を誘導するために知られている多くの刺激の 1 つされて。老化プログラムは通常高リソソーム活動、ミトコンドリア、核変化、クロマチン再編成、小胞体ストレス、DNA の損傷と老化関連を含む追加の機能によって特徴付けられる分泌型表現型 (SASP)3,4。老化細胞体に複数の機能がある: 開発、創傷治癒およびがん抑制2。同様に、彼らは高齢化と、逆説的に、腫瘍の進行5で重要な役割を再生する知られています。老化の負の値、および部分的に矛盾した効果は、SASP6頻繁に原因です。
最近では、マウスから老化細胞の除去が寿命延長し老化機能7,8,9,10、11,の多くの除去につながることを示した12します。 同じ方法で複数の薬を老化細胞 (senolytics) を排除するか、または SASP13,14を対象に開発されています。アンチエイジング治療の可能性は、フィールドに多くの注目を集めている最近。
細胞の老化に関連したメカニズムの研究と薬理学的介入の上映前のヴィヴォモデルでは、特に主線維芽細胞上に依存します。老化の表現型の変化は観察と細胞の種類、刺激および時間ポイント3,15を含む様々 な要因に依存して多様な老化誘導因子によって活性化されるいくつかの一般的な機能がありますが、 16,17。勉強し、老化細胞をターゲットの不均一性を考慮することが不可欠です。したがって、このプロトコルは一連のさまざまな治療法を使用して、主に線維芽細胞老化を誘導するために使用されるメソッドを提供するために目指しています。それで説明しますが、メソッドは他の細胞型に適応できます。
別に複製老化老化を誘発する他の 5 つの治療について述べる: 電離放射線、紫外線 (UV)、ドキソルビシン、酸化ストレスおよびエピジェネティックな変化 (すなわち DNA 脱メチル化やヒストンのアセチル化の推進).電離放射線と紫外線の両方、直接 DNA 損傷を引き起こすし、適切な用量でトリガー老化18,19。ドキソルビシンまた間を DNA にインターカ レートによって DNA の損傷によって主に老化を引き起こすし、トポイソメラーゼ II の機能を中断、中止 DNA 修復機構20。老化に不可欠な遺伝子の発現は、DNA メチル化とヒストンのアセチル化によって制御されます通常。結果として、ヒストン脱アセチル化酵素阻害剤 (例えば、酪酸ナトリウム、サハ) と DNA demethylating (例えば5 字) エージェントは、正常細胞21,22老化をトリガーします。
最後に、4 つの老化細胞に関連付けられている最も一般的なマーカーの説明される: 老化関連-β-ガラクトシダーゼ (SA β gal) EdU 取り込みアッセイ、細胞周期調節因子の過剰発現による DNA 合成率の活動とサイクリン依存性キナーゼ阻害剤 p16 と p21 と、SASP のメンバーの分泌の過剰発現
プロトコル
1. 一般準備
- D10 メディアを準備します。10 %fbs と 1% ペニシリン/ストレプトマイシンを DMEM 培地 Glutamax を補う (最終濃度: 100 U/mL)。
- 滅菌 PBS を準備します。製造元の指示に従って水の錠剤を溶解します。オートクレーブで滅菌します。
- 1 x トリプシンを準備します。トリプシン Versene EDTA/10 の 5 mL の希釈 1:10 45 mL の滅菌 PBS で x。
注: プロトコルを通して我々 使用に近い培養条件、生理学的な主線維芽細胞のための条件。これは、「標準」20 %o ではなく通常やったが、 5% O2 37 ° C、5% CO2で細胞を我々 孵化させなさいことを意味2. - 層流フード、白衣、手袋を使用して無菌状態ですべてのサンプルを処理します。20% O2 (部屋条件) で処理されている間だけ細胞を保ちます。
2. 老化の誘導
- 複製老化
- 細胞またはそれら接触する任意の材料を処理する間 (pipets、フラスコ、メディア、等) は、層流フード、白衣、手袋を使用して無菌条件の下で動作します。20% O2 (部屋条件) で処理されている間だけ細胞を保ちます。
- シード 7 × 105実行可能な主な線維芽細胞 D10 の 10 mL を含む T75 フラスコ (~9.3 x 103セル/cm2) で低倍加 (PD)。
- 5% CO2と 5% O2の 37 ° C でセル インキュベーター内のセルは、70-80% 合流点 (低 PD で増殖培養 3 – 4 日) に達するまでに成長します。
- 3 mL のトリプシンとインキュベート ~ 5-7 x 1 を使用してセルをデタッチ 5% CO2と 5% O2の 37 ° C で細胞文化のインキュベーターで分。脱着プロセスをチェックする細胞培養顕微鏡で細胞を定期的に監視します。
- 細胞は球形、D10 の 9 つの mL を追加することによってトリプシン反応を停止します。10 分以上孵化しないで。
- 残骸および小さい粒子が上清に残したまま、5 分セルは、管の下部にペレットを形成の 300 x gでセルをスピンします。
- 上澄みを除去し D10 の 1 mL の細胞ペレットを溶解し、手動カウントの製造元またはノイバウアー商工会議所によると自動化された細胞カウンターを使用してセル数を実行します。カウントしながらチェック (例えば、トリパン ブルー排除23) 細胞の試金が含まれます。
- この式を使用して累積的な PD を計算します。
新しいPD = 3.32* (LOG(cell number total)-(ログ (播種細胞数)) + PDold
携帯番号総カウントのすべてのセルを =: 死者と生きています。
携帯番号シード = 生菌シード (8 x 10 の5セル) の数。
PD古い現時点ではシードの倍加を =。
PD の新しい(インキュベーション) 後のカウントの時点で 2 倍の人口を =。
注: 7 x 105主な線維芽細胞 (PD 35.2) T-75 フラスコに播種し、4 日後、彼らは 80% の合流点に達するし、再度分割されます、カウント 106合計セル x 1.3 今 (死んだ + 生きている)。
PD の新しい3.32* を = (LOG(1,300,000 cells)-LOG(700,000)) + 35.2
新しいPD = 36.1 - 手順 2.1.2–2.1.8 を繰り返し新しい T75 の 8 × 105セルを再シードします。
注: 複数の連続継代後文化かかりますセルをすべて分割停止まで合流させる。細胞は分裂を停止、一度老化マーカーのテストおよび/または下流のアプリケーションのための収穫します。 - 老化細胞の大きいサイズがフルターンしてまだ低細胞数文化を引き起こす可能性があることを検討してください。PD が安定した文化に他の老化マーカー表示されますと老化が想定される、(見なさいプロトコル 3.1-3.5)。
メモ: を使用してコントロールとして主に線維芽細胞を増殖します。
- 電離放射線による老化
- セルまたは (pipets、フラスコ、メディア、等) に接触する任意の材料を処理中、層流フード、白衣、手袋を使用して無菌条件の下で働きます。20% O2 (部屋条件) で処理されている間だけ細胞を保ちます。
- シード 7 × 105実行可能な主な線維芽細胞 T75 フラスコ (~9.3 x 103セル/cm2) で低 PD で D10 の 10 mL を含みます。
- 5% CO2と 5% O2の 37 ° C で細胞文化のインキュベーターで一晩細胞を孵化させなさい。
- 使用中マシンの指示に従ってガンマ照射10 灰色のセルを公開します。
- 細胞から培地を吸引し、D10 の 10 mL に置き換えます。
- 10 日間、媒体を定期的に交換、3 日間に約別のセル D10 の 10 ml の 5% CO2と 5% O2の 37 ° C で細胞文化のインキュベーターで孵化させなさい。
- 10 日後老化マーカーのテストおよび/または下流用セルを使用します。
注: 使用 (照射) の前にコントロールとしての同じ PD の主な線維芽細胞を増殖します。
- Uv (紫外線) 照射の老化
- セルまたは (pipets、フラスコ、メディア、等) に接触する任意の材料を処理中、層流フード、白衣、手袋を使用して無菌条件の下で働きます。20% O2 (部屋条件) で処理されている間だけ細胞を保ちます。
- シード 1.5-2 x 105実行可能な主な線維芽細胞 6 ウェル プレート (1.5-2.0 × 104セル/cm2) の 1 つも低い PD は、D10 培地 2 mL を追加します。
- 5% CO2と 5% O2の 37 ° C で細胞文化のインキュベーターでセルを置き、少なくとも 5 h 用プラスチックに付着するそれらを許可します。
- セル培地を離陸します。紫外線照射室の真ん中に 6 ウェル プレートを置き、プラスチック製のふたを取る。UVB、20-30 mJ/cm2を照射します。
- ウェルあたり培地 2 mL を追加します。
- 別の媒体を定期的に交換の 7 日間、3 日間に約 5% CO2と 5% O2の 37 ° C で細胞文化のインキュベーターで D10 の 2 mL のセルを孵化させなさい。
注: 7 日後細胞老化マーカーのためにテストして使用できるダウン ストリーム アプリケーションの。(照射) の前に同じ PD の増殖一次繊維芽細胞をコントロールとして使用します。
- ドキソルビシン誘発老化
- ドキソルビシン原液 x 1,000 の準備: 1 × PBS でドキソルビシンの 250 μ M 在庫を作る、フィルター殺菌ソリューションそして生殖不能の管あたり 500 μ L の因数。-80 ° C でドキソルビシン車両を格納します。
- セルまたは (pipets、フラスコ、メディア、等) に接触する任意の材料を処理中、層流フード、白衣、手袋を使用して無菌条件の下で働きます。20% O2 (部屋条件) で処理されている間だけ細胞を保ちます。
- シード 7 × 105実行可能な主な線維芽細胞 T75 フラスコ (~9.3 x 103セル/cm2) で低 PD で D10 の 10 mL を含みます。
- 5% CO2と 5% O2の 37 ° C で細胞文化のインキュベーターで一晩細胞を孵化させなさい。
- ドキソルビシンの最終的な集中に D10 の 11 mL の原液 x 1,000 の 11 μ L を希釈250 nM.
- 細胞から培地を吸引し、D10 + ドキソルビシンの 10 mL に置き換えます。
- 5% CO2と 5% O2の 37 ° C で細胞文化のインキュベーターで 24 時間正確に細胞を孵化させなさい。
- 細胞から培地を吸引し、慎重に D10 の 10 mL で 1 回洗浄します。
- 6 日間媒体を定期的に交換、3 日間に約別のセル D10 の 10 の mL で孵化させなさい。
- 7 日で老化マーカーのテストおよび/または下流のアプリケーションで使用します。
注: コントロール、D10 の車両 (PBS) 縮尺で 24 時間処理した同じ PD の主な線維芽細胞の増殖の使用として。
- 酸化ストレスによる老化
- 細胞またはそれら接触する任意の材料を処理する間 (pipets、フラスコ、メディア、等) は、層流フード、白衣、手袋を使用して無菌条件の下で動作します。20% O2 (部屋条件) で処理されている間だけ細胞を保ちます。
- シード 7 × 105実行可能な主な線維芽細胞 T75 フラスコ (~9.3 x 103セル/cm2) で低 PD で D10 の 10 mL を含みます。
- 5% CO2と 5% O2の 37 ° C でセルのインキュベーターで一晩細胞を孵化させなさい。
- D10 11 ml 30% 過酸化水素の 22.6 μ L の追加によって D10 中 〜 200 μ M の過酸化水素のソリューションを準備します。
注: は、毒性を評価する用量反応曲線を興味のセルの種類の治療を最適化します。 - 細胞から培地を吸引し、作りたて D10 ミディアム + 過酸化水素の 10 mL を追加します。5% CO2と 5% O2の 37 ° C で 2 時間インキュベートします。
- 細胞から培地を吸引し、過酸化水素せず新鮮な D10 で 1 回洗浄します。
- 過酸化水素なしD10 の 10 mL を追加します。
- 48 h 5% CO2と 5% O2の 37 ° C で細胞文化のインキュベーターで孵化させなさい。
- 3 つのトリートメントの合計の 2 倍以上の手順 2.5.4–2.5.8 を繰り返します。
- 老化マーカーまたは下流のアプリケーションのための収穫を確認します。
注: としての制御、2 h の D10 の滅菌水の 22.6 μ L で扱われる同じ PD の細胞増殖を使用。
- Epigenetically 誘起老化
- 在庫との表 1に従って使用する小さなせず作業ソリューションを準備します。フィルター滅菌するソリューション。生殖不能の管に因数。-20 ° C にてストア
- 細胞またはそれら接触する任意の材料を処理する間 (pipets、フラスコ、メディア、等) の下で働く滅菌条件たとえば、層流フード、白衣、手袋を使用しています。20% O2 (部屋条件) で処理されている間だけ細胞を保ちます。
- シード 7 × 105実行可能な主な線維芽細胞 T75 フラスコ (~9.3 x 103セル/cm2) で低 PD で D10 の 10 mL を含みます。
- 5% CO2と 5% O2の 37 ° C で細胞文化のインキュベーターで一晩細胞を孵化させなさい。
- 目的の治療のため 11 mL D10 ミディアム + 作業ソリューションを準備します。表1 治療あたり正確な希釈を見ることができます。
- 11 μ D10 11 mL に 1 mM サハ実用的なソリューションを準備します。
- 44 μ L 1 M ナトリウム酪酸作業 D10 11 mL の溶液を準備します。
- D10 の 11 mL の 10 mM 5 字作業ソリューションの 11 μ L を準備します。
注: 最適化によって、興味のセルの種類の治療法、例えば、毒性を評価する用量反応曲線を作るします。
- 文化に D10 ミディアム + 目的の治療のため実用的なソリューションを追加します。
- 5% CO2と 5% O2の 37 ° C で細胞文化のインキュベーターで 24 時間インキュベートします。
- 3 つのトリートメントの合計の 2 倍以上、手順 2.6.4–2.6.6 を繰り返します。
- 薬なしの単純な D10 の媒体を変更します。
- 3 日以上後細胞は老化と老化マーカーと下流のアプリケーションのテストの準備になります。
注: コントロール、D10 ミディアム + 車で 3 日間の治療を同じ PD の主な線維芽細胞の増殖の使用として。D10 ミディアム + 車両は更新がそれらの 3 日間のすべての 24 h する必要があります。車両によって異なります使用治療: 酪酸ナトリウムのサハと 5 字 1: 250 の滅菌水の DMSO 縮尺。
3. 老化マーカー
- 準備
- 20 mg/ml X gal: X gal ジメチルホルムアミドや DMSO の 1 mL に 20 mg を溶解します。光から保護-20 ° C で保存します。
- 0.1 M クエン酸溶液を準備: 水 100 mL にクエン酸一水和物の 2.1 g を溶かします。常温で保存します。
- 0.2 M リン酸ナトリウム溶液を準備: 塩基リン酸ナトリウムの溶解 2.84 g または塩基リン酸ナトリウムの 3.56 g を水 100 mL で脱水します。常温で保存します。
- 0.2 M クエン酸ナトリウム/リン酸塩 pH 6.0 の準備: 36.85 mL 0.1 M クエン酸溶液、0.2 M リン酸ナトリウム 63.15 mL を溶かします。PH 6.0 と正確に調整します。常温で保存します。
- フェロシアン化カリウム 100 mM を準備: 50 mL の水にフェロシアン化カリウムの 2.1 g を溶かします。光から保護 4 ° C で保存します。
- フェリシアン化カリウム 100 mM を準備: 50 mL の水にフェリシアン化カリウムの 1.7 g を溶かします。光から保護 4 ° C で保存します。
- 5 M の塩化ナトリウムを準備: 14.6 g 水 50 mL の塩化ナトリウムの溶解します。常温で保存します。
- 1m 塩化マグネシウムを準備: 50 mL の水に塩化マグネシウムの 4.8 g を溶かします。常温で保存します。
- 2% のホルムアルデヒド + PBS で 0.2% グルタルアルデヒドの準備: 25% グルタルアルデヒドと 12.5 μ L の PBS 100 μ L で 16% のホルムアルデヒドの分解 800 μ L。光から保護された常温で保存します。
- 染色液の準備新鮮なによると表 2.
- 老化関連 β ガラクトシダーゼの染色
- 各サンプルの細胞が疎 1 x 10 の4セル D10 の 24 ウェル プレート (5.2 × 103セル/cm2) 含む 500 μ L の少なくとも 1 つの井戸での種子します。このプレートで直接トリートメント (該当する場合) を実行できるまたは、代わりに、既に細胞が 24 ウェル プレートに再シードすることができます。
- 5% CO2と 5% O2の 37 ° C で一晩細胞を孵化させなさい。
- 500 μ L の PBS で 2 回細胞を洗浄します。
- PBS で 2% のホルムアルデヒド + 0.2% グルタルアルデヒドの 500 μ L/ウェルを利用して常温で 3-5 分を修正します。
- 500 μ L の PBS で 2 回細胞を洗浄します。
- 新鮮な染色液を染色するサンプルの数によると準備します。
- 染色液 (500 μ L/ウェル) を追加し、パラフィルム蒸発を避けるためにプレートをシールします。
注: 蒸発は結晶の形成を引き起こすし、顕微鏡下で観察を妨げる可能性があります。 - 12-16 時間 (CO2) なしドライ インキュベーターで 37 ° C で (例えばアルミホイルで覆われた) 暗闇の中で細胞を孵化させなさい。
注: CO2可能性があります pH に影響を与える、したがって結果を変更します。ある細胞のタイプは、インキュベーション時間を短縮を必要があります。 - 500 μ L の PBS で 2 回を洗ってください。
- 結果を評価します。陽性細胞提示青通常光学顕微鏡 (図 1 a) で周囲 (主に)。
- 定量化, サンプルあたり少なくとも 100 細胞観察し、陽性細胞の数をカウントします。老化細胞がシェイプを変更だよくセルの境界を定義するセルをカウントすることは困難。可視化と個々 の細胞 (図 1 b) の定量化を容易にするために DAPI で対比染色。サンプル (セルの合計額対陽性細胞の割合) を定量化する蛍光顕微鏡 (図 1) を使用します。最後には、少なくとも 100 シングル セルをカウントし、それらの SA β gal 陽性細胞の割合を評価できますように、同じサンプルの複数の画像を取る.
- 使用治療のための適切な制御と老化細胞の結果を比較します。
注: は同じサンプルのエドゥと共同染色可能です。セルが coverslips にシード処理する必要がありますし、検討してください。
- エドゥ取り込みアッセイ
- Coverslip/ウェルを評価するサンプルの数によると 24 ウェル プレートに入れてください。
- D10 の 500 μ L を含む細胞が疎な条件あたり 24 ウェル プレート (5.2 × 103セル/cm2) の少なくとも 1 つの井戸の種子 1 x 104セルします。このプレートで直接トリートメント (該当する場合) を実行できるまたは、代わりに、既に扱われた細胞は 24 ウェル プレートに再シードすることができます。
- 5% CO2と 5% O2の 37 ° C で一晩細胞を孵化させなさい。
- D10 のエドゥの 20 μ M 溶液を作成 (1: 250) (サンプルあたり 250 μ L) を治療するためにサンプル数による。
- 治療し、D10 + エドゥに置き換える各ウェルから媒体 (250 μ L) の半分を削除だけが準備されたソリューション。エドゥの最終濃度は 10 μ M です。
- 18-24 h 5% CO2と 5% O2 37 ° C で細胞文化のインキュベーターで孵化させなさい。制御と老化細胞の同時培養を使用します。
- 2 倍の 500 μ L の PBS で洗浄します。
- 500 μ L の PBS で 4% のホルムアルデヒドと 10 分のセルを修復します。
- 100 mm トリス (pH 7.6) 500 μ L で 5 分間インキュベートします。
- 0.1% の 500 μ L で 10 分間セルを permeabilize PBS でトリトン X-100。
- PBS の 3 x を洗います。
- 次の順序で、コンポーネントの追加、各 coverslip のラベルの組合せの 50 μ L を準備: 44.45 μ L の PBS、0.5 μ の銅 (II) など4、スルホ Cy3 アジの 0.05 μ L、5 μ L - アスコルビン酸ナトリウムの。
- パラフィルムの部分にラベルの組合せの 50 μ L を入れてください。ピンセットと針のペアの助けを借りて coverslip を持ち上げ、下向きセルを含む表面ラベル ミックスの上に休ませてください。泡がないことと、カバーガラスの表面全体がラベル ミックスに触れていることを確認します。暗闇の中で 30 分間インキュベートします。
- 24 ウェル プレートの井戸に戻ってセルを入れて、PBS で 3 回洗ってください。
- スライド ガラスに (核を視覚化する DAPI を含む) メディアのマウントでマウントし、一晩乾燥させます。
- 蛍光顕微鏡を用いたエドゥ定款を視覚化します。Cy3 の適切なフィルターを使用して (励起/蛍光: 552/570 nm)。
- 1 つの条件 (Cy3 および DAPI) セルが少なくとも 100 の後で定量化のためのセルの複数の写真を撮る。
- エドゥを組み込まれ、次の数式を使用してセルの割合を数値化します。
エドゥ陽性細胞 (%) = (EdU 陽性細胞数 (Cy3)/セルの総数 (DAPI)) * 100 - 使用治療のための適切な制御と老化細胞の結果を比較します。
注: は同じサンプルの SA β gal と共同染色可能です。セルが coverslips にシード処理する必要がありますまだすることを検討してください。
- P16、p21、SASP の遺伝子発現
- 興味の遺伝子 (各 50 μ M プライマー) のプライマー セットを準備します。
注: p16、p21 およびいくつかの関連する SASP 要因の qPCR 老化状態の有益です。プロトコル説明ここではリアルタイム PCR を使用して相対的な定量化のための普遍的なプローブ ライブラリ (UPL) システムを使用します。チューブリンとアクチン、試金のための参照の遺伝子としてだけでなく、CDK 阻害剤 p16 と p21 の最も関連性の高い SASP メンバーの検出のために使用されるプライマーの概要を表 3に示します。表 3の最後の列は、各測定に使用する特定の UPL プローブを参加させます。 - 目的の試金のため別の qPCR 反応混合物を準備します。常に同様の表 4によると参照の遺伝子があります。
- 重複した、または 3 通ですべてのサンプルを実行します。
- 負荷 7.5 μ L/ウェルの 384 ウェル プレートの qPCR 反応混合物の。
- 〜 5 を追加 cDNA の ng は RNase フリー水の 2.5 μ L に溶解しました。
注: それは比較するすべてのサンプルのための cDNA の同じような量を有することが望ましいです。これは逆のトランスクリプションの RNA の同量を使用して達成することができます。 - シール付きプレートをカバーし、皿の上に均等にすべての井戸を正しくカバー貫くことを確認してください。
- 1 分の 2,000 x gでプレートをスピンします。
- 40 サイクルの次のプロトコルを使用して、Lightcycler でプレートを実行します。
7 分の 95 ° C
40 サイクル 95 ° C の 5 s の 60 ° C、30 秒
1 分の 37 ° C - 結果の分析のためには、Livak および同僚のための手法を使用して、qPCR データ24を分析します。チューブリンやアクチンを使用して、参照の遺伝子、ΔCt を計算する値を計算する適切なコントロールを使用すると、特定の老化を誘発する治療法の ΔΔCt 値を示す。
- 興味の遺伝子 (各 50 μ M プライマー) のプライマー セットを準備します。
- 蛋白質の表現および il-6 分泌
- D10 の 2 mL を含む条件あたり 6 ウェル プレート (5.2-10.5 × 103セル/cm2) の少なくとも 1 つの井戸の 10 の4セル × 種子 5-10。このプレートで直接トリートメント (該当する場合) を実行できるまたは、代わりに、既に細胞が 24 ウェル プレートに再シードすることができます。それ播種後一晩立ってみましょう。
- メディアを取り外し、2 ml DMEM 培地FBS なしの。24 h の通常の状態で孵化させなさい。
- 15 mL チューブ内のメディアを収集します。
- 遠心分離機サンプル 300 x g で 5 分中は-80 ° c を処理するまで格納できます。
- Elisa 法を実行するための製造元の指示に従います。
- 固有老化誘導治療のための適切な制御と老化細胞の結果を比較します。
結果
SA β gal 染色老化線維芽細胞の濃縮
Β-ガラクトシダーゼ (β gal) すべての細胞で発現していること、最適な pH 4.025,26のライソゾーム酵素であります。ただし、老化、中にリソソームのサイズが大きく、その結果、老化細胞蓄積 β gal。この酵素の増加量は、最適 pH 6.025,27もその活性を検出することが可能。図 1 aは、老化の主な線維芽細胞と増殖の SA β gal 染色の代表的なイメージを示しています。セルには、拡大と不規則な細胞体も見てください。前述のように、こと個々 の細胞を区別するは難しい、共同 DAPI 染色容易に可視化と細胞 (図 1 b) をカウントするようです。DAPI 染色を観察することができる蛍光顕微鏡で写真を撮るべきです。これは SA β gal の「青」染色写真を黒で表示されますので、黒/白、明るいフィールド チャンネルで写真を撮影することを意味します。注記のうち、サンプル内のすべてのセルが β gal 陽性です。老化誘導の効率は、刺激およびセル型/ひずみ使用に大きく依存です。ここで説明したプロトコルをもたらした > 私たちの手で、一次繊維芽細胞 (BJ と WI-38) で 50% β gal 陽性細胞。
少ない細胞老化の誘導後エドゥを組み込む
エドゥは、アクティブな DNA 合成時に DNA28に組み込まれるヌクレオシド チミジンのアナログです。エドゥ、アルキン グループ28が欠けているために、通常チミジンで実行できない反応する Copper-Catalyzed アジ化物アルキンの環化付加 (CuAAC) を実行した後は、エドゥの DNA への取り込みを視覚化できます。この特定のプロトコルでスルホ Cy3 アジ化物を使用されています。アジド、アルキンへの結合が行われると、セルは Cy3 フィルター (図 2 a) の下で蛍光が表示されます。エドゥ取り込みアッセイを行い、増殖、細胞と区別できる非増殖細胞を考慮することが重要です。非増殖細胞はエドゥ取り込みアッセイこれら 2 種類の細胞周期の停止の間で区別できない静止または、老齢の意味をすることができます。
老化線維芽細胞のリポタンパクリパーゼ CDK 阻害剤 p16 と p21
老化細胞を作る29細胞周期を停止する、Cdk 阻害剤の使用します。特に p16 と p21 は多くの場合、老化細胞3のマーカーとして測定します。いずれか 1 つまたは両方のマーカーは、通常の老化細胞で亢進し、アップレギュレーション転写レベルで計測することも。いくつかの細胞を転写レベルでないリポタンパクリパーゼ p16 行い p21 老化15,17,30ユニバーサルですがない特定のマーカーであるので、同時に両方のマーカーを使用することをお勧めします。図 3は、p16 の代表的な相対的な数量を示し p21 mRNA 線維芽細胞老化を誘導しました。免疫染色またはウェスタンブロッティング蛋白を検出するなどの手法も可能です。
老化線維芽細胞、SASP を表示します。
最も老化細胞転写活性を上昇させるいくつかの遺伝子の分泌性タンパク質、SASP6と呼ばれる現象。SASP には炎症、例えばインターロイキン、ケモカイン、関与する因子が含まれています。 または細胞外マトリックス (ECM) の劣化などMmp、しかし、それは極めて不均一です。SASP 因子の誘導は、qPCR による mRNA 発現レベルまたは分泌蛋白質酵素免疫吸着測定法 (ELISA) 経由でのレベルを測定することによって評価できます。図 4は、転写と分泌のレベルで両方 IL6 のアップレギュレーションを示す代表的なイメージを示しています。我々 は、表現としてのみ IL6 を使用ただし、SASP プロトコル 3.4 に候補者のリストからの複数のメンバーを測定することをお勧めします。
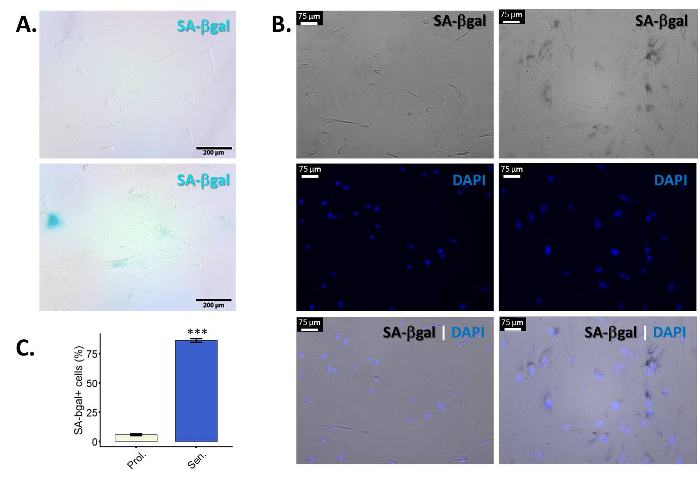
図 1: SA β gal 染色老齢主線維芽細胞の濃縮します。BJ プライマリ包皮線維芽細胞 (PD 34.1) は、電離放射線 (10 Gy) にそれらを公開することで老化に誘導されました。照射後 10 日 SA βgal の細胞は真っ黒。BJ 主線維芽細胞 (アップ) 未処理または (下) 電離放射線にさらされる SA βgal の汚損のため (A) 代表的な結果。最終倍率: 100 X。(B) SA β gal の代表的な図共同染色 DAPI で BJ 主線維芽細胞の未処理 (3 左パネル) や (3 つの右パネル) の電離放射線にさらされます。(青) を汚す DAPI は、定量化を促進する個々 のセルを視覚化するのに役立ちます。明視野で撮影した画像は、黒/白で表示されます。したがって、これらの特定の写真 SA β gal で染色になります黒核斑点のような。最終倍率: 100 X。SA β gal 陽性細胞の増殖 (Prol ホワイト) の (C) 定量化電離照射治療対応 (上院議員、青) 対 BJ 線維芽細胞。誤差、平均値の標準誤差を示す 3 つの生物学的複製を用いた定量化を行った。統計的有意性はデルタ CT 値、対になっていない 2 スチューデントの t 検定によって決定されました。(n = 3、± SEM * * * p値を = < 0.01)。この図の拡大版を表示するのにはここをクリックしてください。
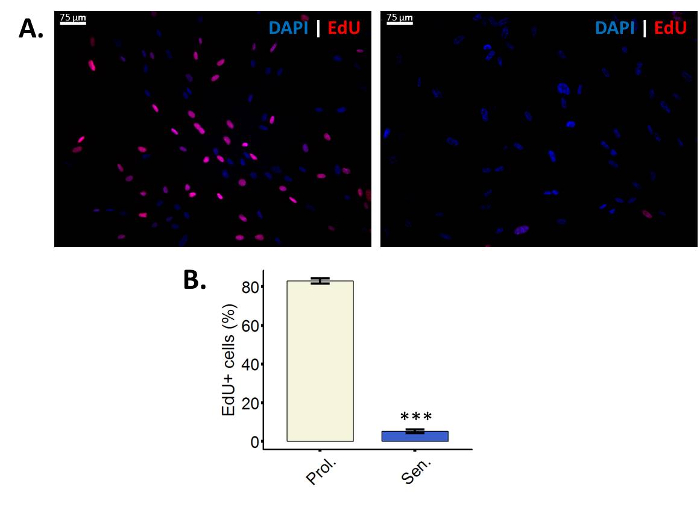
図 2: 少ない細胞老化の誘導後エドゥを組み込むことです。(A) 増殖 WI 38 線維芽細胞 (左) PD 43.86 と電離照射対応 (右) でエドゥ取り込みアッセイの代表的なイメージ。最終倍率: 100 X。エドゥ陽性細胞の増殖 (Prol ホワイト) の (B) の定量化 (上院議員、ブルー) の照射相手対 BJ 繊維芽細胞 (PD 38.7)。誤差、平均値の標準誤差を示す 3 つの生物学的複製を用いた定量化を行った。統計的有意性はデルタ CT 値、対になっていない 2 スチューデントの t 検定によって定められた (n = 3、± SEM * * * p値を = < 0.01)。この図の拡大版を表示するのにはここをクリックしてください。
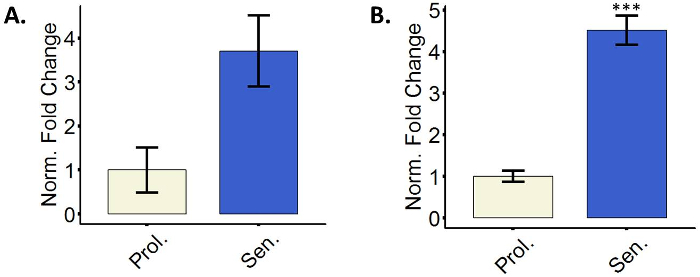
図 3: 老化線維芽細胞のリポタンパクリパーゼ CDK 阻害剤 p16 と p21 。増殖 (Prol.、ホワイト、PD で 35.3) p16 mRNA 発現または 5 字処理 BJ 細胞 (上院議員、ブルー) の (A) の定量化。増殖 (Prol.、ホワイト、PD で 35.3) p21 発現 (B) 数量または 5 字扱われる BJ は細胞 (上院議員、青) です。誤差、平均値の標準誤差を示す (それぞれ 2 つの技術を持つレプリケートされます) 3 つの生物学的複製を用いた定量化を行った。統計的有意性はデルタ CT 値、対になっていない 2 スチューデントの t 検定によって定められた (n = 3、± SEM * * * p =値 < 0.01)。この図の拡大版を表示するのにはここをクリックしてください。
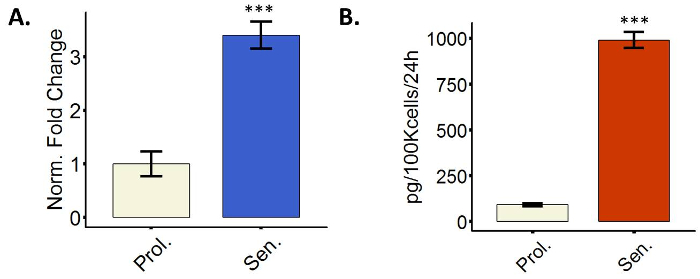
図 4: 老化線維芽細胞が分泌形質 (SASP) を表示します。BJ 線維芽細胞 (A) IL6 定量化 mRNA 式 (Prol、白、パラジウム 38.7) を増殖中または電離放射線 (上院議員、青) によって老化を誘発します。IL6 発現増殖 PD 38.6 (Prol.、白) または電離放射線治療 WI38 繊維芽細胞 (上院議員、ブルー) の (B) の定量化。誤差、平均値の標準誤差を示す 3 つの生物学的複製を用いた定量化を行った。QPCR データの場合は、各生物の複製は 2 つの技術的な重複を持っていた。統計的有意性はデルタ CT 値、対になっていない 2 スチューデントの t 検定によって定められた (n = 3、± SEM * * *p値を = < 0.01)。この図の拡大版を表示するのにはここをクリックしてください。
| 希釈剤 | 原液 | 実用的なソリューション | 治療のため希釈 | 最終濃度 | |
| サハ | DMSO | 100 mM | 1 mM | 縮尺 | 1 Μ M |
| 酪酸ナトリウム | 滅菌水 | --- | 1 M | 1: 250 | 4 mM |
| 5 字 2'-デオキシシチジン (5 字) | DMSO | 100 mM | 10 mM | 縮尺 | 10 Μ M |
表 1: ストックと Epigenetically が誘導する老化の使用別の処置のためのソリューションの作業します。
| コンポーネント | ボリューム | 最終濃度 |
| 20 mg/mL X ギャル | 1 mL | 1 mg/mL |
| 0.2 M クエン酸ナトリウム リン酸バッファー ph 6.0 | 4 mL | 40 mM |
| フェロシアン化カリウム 100 mM | 1 mL | 5 mM |
| フェリシアン化カリウム 100 mM | 1 mL | 5 mM |
| 5 M の塩化ナトリウム | 0.6 mL | 150 mM |
| 1m 塩化マグネシウム | 0.04 mL | 2 mM |
| 水 | 12.4 mL | - |
| 合計 | 20 mL |
表 2: 老化関連 (SA) - β gal 染色用の染色液の組成物。
| ターゲット | プライマー (5' → 3') を転送します。 | 逆プライマー (5' → 3') | UPL プローブ | ||
| チューブリン | CTTCGTCTCCGCCATCAG | CGTGTTCCAGGCAGTAGAGC | # 40 | ||
| アクチン B | ccaaccgcgagaagatga | ccagaggcgtacagggatag | # 64 | ||
| P16 | GAGCAGCATGGAGCCTTC | CGTAACTATTCGGTGCGTTG | # 67 | ||
| P21 | tcactgtcttgtacccttgtgc | ggcgtttggagtggtagaaa | # 32 | ||
| IL6 | CAGGAGCCCAGCTATGAACT | GAAGGCAGCAGGCAACAC | # 45 | ||
| IL8 | GAGCACTCCATAAGGCACAAA | ATGGTTCCTTCCGGTGGT | # 72 | ||
| IL1a | GGTTGAGTTTAAGCCAATCCA | TGCTGACCTAGGCTTGATGA | # 6 | ||
| CXCL1 | CATCGAAAAGATGCTGAACAGT | ATAAGGGCAGGGCCTCCT | # 83 | ||
| CXCL10 | GAAAGCAGTTAGCAAGGAAAGGT | GACATATACTCCATGTAGGGAAGTGA | # 34 | ||
| CCL2 | AGTCTCTGCCGCCCTTCT | GTGACTGGGGCATTGATTG | # 40 | ||
| CCL20 | GCTGCTTTGATGTCAGTGCT | GCAGTCAAAGTTGCTTGCTG | # 39 | ||
| PAI1 | AAGGCACCTCTGAGAACTTCA | CCCAGGACTAGGCAGGTG | # 19 | ||
| MMP1 | GCTAACCTTTGATGCTATAACTACGA | TTTGTGCGCATGTAGAATCTG | # 7 | ||
| MMP3 | CCAGGTGTGGAGTTCCTGAT | CATCTTTTGGCAAATCTGGTG | # 72 | ||
| MMP9 | GAACCAATCTCACCGACAGG | GCCACCCGAGTGTAACCATA | # 53 | ||
表 3: プライマー シーケンスとひと由来の試料中の老化マーカーの mRNA を検出するための対応する UPL プローブ。
| コンポーネント | ボリューム/サンプル |
| Sensifast プローブ Lo Rox ミックス | 5 Μ L |
| プライマー セット (50 μ M) | 0.1 Μ L |
| UPL プローブ | 0.1 Μ L |
| ヌクレアーゼ フリー水 | 2.3 Μ L |
| cDNA (~ 4 ng) | 2.5 Μ L |
| 合計 | 7.5 Μ L |
表 4: qPCR 反応の組成は、UPL システムのミックスします。
ディスカッション
ここで説明したプロトコル最適化した一次線維芽細胞、特に BJ と WI-38 細胞。複製老化、電離放射線、ドキソルビシンのためのプロトコルは (HCA2 および IMR90) 線維芽細胞と他の細胞型 (すなわち新生児メラノサイトとケラチノ サイトまたは iPSC 由来心筋細胞) の他のタイプに正常に適用されています。本研究室では。ただし、その他の細胞のタイプのための適応は、シード細胞、メソッドおよびプラスチック サポートにアタッチ/デタッチの細胞を助ける化学物質の番号や毒性を避けるために治療の投与量などいくつかの詳細を調整することによって最適化できます。
主線維芽細胞の使用もポーズの課題の数です。老化細胞が通常増殖より、デタッチするのには難しく、trypsinization をより敏感またはデタッチ メソッド、デタッチ後生存率のものよりわずかに低いことを意味の他のタイプが多い増殖細胞。さまざまな老化誘導方法に適切なコントロールの選択は困難です。例えば、ドキソルビシンなど薬物による治療、車両と短い治療お勧め: ドキソルビシン処理細胞の対照サンプルの場合 24 時間 PBS に続いてすぐ収穫・加工。それは老化する細胞が治療 (6 日間文化のドキソルビシン治療細胞) が適用された後拡張された文化時間を通過して、制御の細胞が培養の同じ長さの PBS を除去した後の時間をする必要がありますと主張する可能性があります。しかし、このような長い文化を使えば、さらに分割、過剰の合流になる、さらに継を必要とする細胞と討過剰合流させる老化マーカー、細胞維持にもかかわらず表示されます SA β gal などを引き起こす可能性があります、潜在的な31の増殖。PD の増加がのレプリケーション制限 (と複製老化) 近い方のそれらを得るし、ドキソルビシン処理の相手するより少なく対等させます。似たような状況は、他の治療のために適用されます。我々 は、我々 検討ケースごとに適切なコントロールを示唆しています。
老化に細胞を誘導するための技術のほとんどに見える比較的簡単かつ直感的で、実験の結果に影響することができます多くの要因。例えば、従来の細胞培養媒体の線維芽細胞の正常なブドウ糖濃度が 4.5 g/l. です。ただし、幹細胞など一部の細胞の種類、ブドウ糖の濃度は他の高濃度の早期老化33する可能性があります中の増殖潜在的な32に拡張します。また、老化細胞は高い代謝と分泌因子34を生成するエネルギーの高い金額を費やす、他の老化を伴う表現型をグルコース濃度の振動によって影響される可能性があります。
セル培地の別の潜在的な変数が血清です。血清の組成は、定義されていない通常、動物のソースとバッチによって異なります。特に、成長因子および炎症性蛋白質の量35老化に影響を与えます。血清の同じバッチが不要となり、交絡の変動を避けるために全体の実験に使用することをお勧めします。まだ、いくつかの elisa 法を用いたプロトコル用無血清培地を使用するなどいくつかの必然的な技術的な条件は SASP 式を減らすことができます。
酸素分圧は、完全な老化誘導のため重要です。低酸素血症は、細胞は増殖しないが、不可逆的逮捕された36ではない geroconversion を抑えることができます。ただし、実験のセットアップで最も一般的な問題は低酸素症、酸素ではないです。確かに、標準培養条件はしばしば「常」として 20% の酸素を使用が、ほとんど種類細胞の生理的条件が低い。マウス胚盤胞存在老化 (SA βgal と DNA 損傷) のマーカーとは異なり生体内での酸素 20% で培養した場合-対応または 5% 酸素37で、同じ細胞に派生します。さらに、マウスの線維芽細胞培養より生理学的条件 (酸素 3%) と従来のもの (20% の酸素) 表示ではなく SASP38。ここでは、我々 はすべての文化の 5% 酸素を使用し、実験と私たちを促す研究者興味の特定のセル型で使用される酸素濃度を再考します。
最後に、考慮する別の要因は、老化細胞の本質的な不均一性です。一方では、異なる種類の細胞、細胞株も老化を伴う表現型の違いを表示します。例えば、線維芽細胞のいくつかの系統に老化誘導15,16,17, 転写レベルでないリポタンパクリパーゼ p16 を行うのアップレギュレーションを見てもどこに示されている図 3 aではまたp16 のこれは統計的に有意ではなかった。蛋白質のレベルを測定する可能性がありますいくつかのケースで示すこの CDK インヒビター活性の上昇、P16 も並進・翻訳後修飾のレベルで制御されます。ただし、一部のセルは、単に p21 のような他の CDK 阻害剤に頼ることがあります。それらの両方の転写レベルの測定をお勧めします。SASP の正確な組成物は、それに3を生産する細胞によっても異なります。さらに、いくつかの細胞は恒常 β-ガラクトシダーゼ、SA β gal を汚す老化3必ずしも示唆するものではないため肯定的な結果を与えることの高レベルを表現します。いくつかのケースでは、SA β gal の汚損のプロトコルの中に染色液と培養時間を減らすことによってこの問題を克服する可能性があります。前述のように、過剰合流セル可能性があります SA β gal とまばらこの染色を行うため培養細胞の研究者を促すよう老齢31, それらなしも染色。その一方で、自身の老化の表現型は安定した39ではありません。SASP の組成と老化の他のマーカーの外観は、時間依存17,40です。ここでは、我々 は、セルのそれぞれの治療後時間ポイントが完全に老化と見なされ、当研究室で日常的に使用されているを示唆しています。重要なは、不完全な老化40のための否定的な結果をレンダリング可能性があります短い時点でマーカーを測定します。また、治療のほとんどの細胞の割合はならない老齢、以来長い時間ポイントを使用して展開し、老化マーカーの発現を減らす文化をオーバー テイクするいくつかの非老化細胞に十分な時間を与えるかもしれない。老化細胞の多様性と異なるマーカーの複数の注意事項のビュー、同じサンプル内の複数の老化マーカーを使用する研究者を強く奨励します。
開示事項
N/A
謝辞
実りある議論のため管理者にラボと Thijmen ヴァン Vliet と紫外線による老化のプロトコルのデータを共有するためのメンバーに感謝いたします。
資料
| Name | Company | Catalog Number | Comments |
| DMEM Media - GlutaMAX | Gibco | 31966-047 | |
| Fetal Bovine Serum | Hyclone | SV30160.03 | |
| Penicillin-Streptomycin (P/S; 10,000 U/ml) | Lonza | DE17-602E | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | SC-202581 | |
| Nuclease-Free Water (not DEPC-Treated) | Ambion | AM9937 | |
| T75 flask | Sarstedt | 833911002 | |
| Trypsin/EDTA Solution | Lonza | CC-5012 | |
| PBS tablets | Gibco | 18912-014 | |
| 1.5 ml microcentrifuge tubes | Sigma-Aldrich | T9661-1000EA | |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich | CLS430791 | |
| 6-well plate | Sarstedt | 83.3920 | |
| 24-well plate | Sarstedt | 83.3922 | |
| 13mm round coverslips | Sarstedt | 83.1840.002 | |
| Steriflip | Merck Chemicals | SCGP00525 | |
| Cesium137-source | IBL 637 Cesium-137γ-ray machine | ||
| UV radiation chamber | Opsytec, Dr. Göbel BS-02 | ||
| Doxorubicin dihydrochloride | BioAustralis Fine Chemicals | BIA-D1202-1 | |
| Hydrogen peroxide solution | Sigma-Aldrich | 7722-84-1 | |
| 5-aza-2’-deoxycytidine | Sigma-Aldrich | A3656 | |
| SAHA | Sigma-Aldrich | SML0061 | |
| Sodium Butyrate | Sigma-Aldrich | B5887 | |
| X-gal (5-Bromo-4-chloro-3-indolyl-β-D-galactopyranoside) | Fisher Scientific | 7240-90-6 | |
| Citric acid monohydrate | Sigma-Aldrich | 5949-29-1 | |
| Sodium dibasic phosphate | Acros organics | 7782-85-6 | |
| Potassium ferrocyanide | Fisher Scientific | 14459-95-1 | |
| Potassium ferricyanide | Fisher Scientific | 13746-66-2 | |
| Sodium Chloride | Merck Millipore | 7647-14-5 | |
| Magnesium Chloride | Fisher Chemicals | 7791-18-6 | |
| 25% glutaraldehyde | Fisher Scientific | 111-30-8,7732-18-5 | |
| 16% formaldehyde (w/v) | Thermo-Fisher Scientific | 28908 | |
| EdU (5-ethynyl-2’-deoxyuridine) | Lumiprobe | 10540 | |
| Sulfo-Cyanine3 azide (Sulfo-Cy3-Azide) | Lumiprobe | D1330 | |
| Sodium ascorbate | Sigma-Aldrich | A4034 | |
| Copper(II) sulfate pentahydrate (Cu(II)SO4.5H2O) | Sigma-Aldrich | 209198 | |
| Triton X-100 | Acros organics | 215682500 | |
| TRIS base | Roche | 11814273001 | |
| LightCycler 480 Multiwell Plate 384, white | Roche | 4729749001 | |
| Lightcycler 480 sealing foil | Roche | 4729757001 | |
| Sensifast Probe Lo-ROX kit | Bioline | BIO-84020 | |
| UPL Probe Library | Sigma-Aldrich | Various | |
| Human IL-6 DuoSet ELISA | R&D | D6050 | |
| Bio-Rad TC20 | Bio-Rad | ||
| Counting slides | Bio-Rad | 145-0017 | |
| Dry incubator | Thermo-Fisher Scientific | Heratherm | |
| Dimethylformamide | Merck Millipore | 1.10983 | |
| Parafilm 'M' laboratory film | Bemis | #PM992 | |
| Tweezers | |||
| Needles |
参考文献
- Hayflick, L., Moorhead, P. S. The serial cultivation of human diploid cell strains. Experimental Cell Research. 25, 585-621 (1961).
- Muñoz-Espín, D., Serrano, M. Cellular senescence: from physiology to pathology. Nature reviews. Molecular cell biology. 15, 482-496 (2014).
- Sharpless, N. E., Sherr, C. J. Forging a signature of in vivo senescence. Nature Reviews Cancer. 15 (7), 397-408 (2015).
- Correia-Melo, C., et al. Mitochondria are required for pro-ageing features of the senescent phenotype. The EMBO Journal. 10, e201592862 (2016).
- Loaiza, N., Demaria, M. Cellular senescence and tumor promotion: Is aging the key?. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. , (2016).
- Coppe, J. P., et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biology. 6 (12), 2853-2868 (2008).
- Baker, D. J., et al. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature. 530 (7589), 184-189 (2016).
- Xu, M., et al. Targeting senescent cells enhances adipogenesis and metabolic function in old age. Elife. 4, e12997 (2015).
- Baker, D. J., et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479 (7372), 232-236 (2011).
- Jeon, O. H., et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nature Medicine. 23 (6), 775-781 (2017).
- Demaria, M., et al. Cellular Senescence Promotes Adverse Effects of Chemotherapy and Cancer Relapse. Cancer Discovery. 7 (2), 165-176 (2017).
- Chang, J., et al. Clearance of senescent cells by ABT263 rejuvenates aged hematopoietic stem cells in mice. Nature Medicine. 22 (1), 78-83 (2016).
- Soto-Gamez, A., Demaria, M. Therapeutic interventions for aging: the case of cellular senescence. Drug Discov Today. 22 (5), 786-795 (2017).
- Childs, B. G., et al. Senescent cells: an emerging target for diseases of ageing. Nature Reviews Drug Discovery. 16 (10), 718-735 (2017).
- Marthandan, S., et al. Conserved genes and pathways in primary human fibroblast strains undergoing replicative and radiation induced senescence. Biological Research. 49, 34 (2016).
- Marthandan, S., et al. Conserved Senescence Associated Genes and Pathways in Primary Human Fibroblasts Detected by RNA-Seq. PLoS One. 11 (5), e0154531 (2016).
- Hernandez-Segura, A., et al. Unmasking Transcriptional Heterogeneity in Senescent Cells. Current Biology. 27 (17), 2652-2660 (2017).
- Le, O. N., et al. Ionizing radiation-induced long-term expression of senescence markers in mice is independent of p53 and immune status. Aging Cell. 9 (3), 398-409 (2010).
- Hall, J. R., et al. C/EBPalpha regulates CRL4(Cdt2)-mediated degradation of p21 in response to UVB-induced DNA damage to control the G1/S checkpoint. Cell Cycle. 13 (22), 3602-3610 (2014).
- Nitiss, J. L. Targeting DNA topoisomerase II in cancer chemotherapy. Nature Reviews Cancer. 9 (5), 338-350 (2009).
- Pazolli, E., et al. Chromatin remodeling underlies the senescence- associated secretory phenotype of tumor stromal fibroblasts that supports cancer progression. Cancer Research. 72, 2251-2261 (2012).
- Venturelli, S., et al. Differential induction of apoptosis and senescence by the DNA methyltransferase inhibitors 5-azacytidine and 5-aza-2'-deoxycytidine in solid tumor cells. Molecular Cancer Therapeutics. 12, 2226-2236 (2013).
- Tennant, J. R. Evaluation of the Trypan Blue Technique for Determination of Cell Viability. Transplantation. 2, 685-694 (1964).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Lee, B. Y., et al. Senescence-associated β-galactosidase is lysosomal β-galactosidase. Aging Cell. 5, 187-195 (2006).
- Kopp, H. G., Hooper, A. T., Shmelkov, S. V., Rafii, S. Beta-galactosidase staining on bone marrow. The osteoclast pitfall. Histology and Histopathology. 22 (9), 971-976 (2007).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences. 92 (20), 9363-9367 (1995).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proceedings of the National Academy of Sciences. 105 (7), 2415-2420 (2008).
- Sherr, C. J., McCormick, F. The RB and p53 pathways in cancer. Cancer Cell. 2 (2), 103-112 (2002).
- Bunz, F., et al. Requirement for p53 and p21 to sustain G2 arrest after DNA damage. Science. 282 (5393), 1497-1501 (1998).
- Severino, J., Allen, R. G., Balin, S., Balin, A., Cristofalo, V. J. Is beta-galactosidase staining a marker of senescence in vitro and in vivo. Experimental Cell Research. 257 (1), 162-171 (2000).
- Stolzing, A., Coleman, N., Scutt, A. Glucose-induced replicative senescence in mesenchymal stem cells. Rejuvenation Research. 9 (1), 31-35 (2006).
- Blazer, S., et al. High glucose-induced replicative senescence: point of no return and effect of telomerase. Biochemical and Biophysical Research Communications. 296 (1), 93-101 (2002).
- Wiley, C. D., Campisi, J. From Ancient Pathways to Aging Cells-Connecting Metabolism and Cellular Senescence. Cell Metabolism. 23 (6), 1013-1021 (2016).
- Kumar, R., Gont, A., Perkins, T. J., Hanson, J. E. L., Lorimer, I. A. J. Induction of senescence in primary glioblastoma cells by serum and TGFbeta. Scientific Reports. 7 (1), 2156 (2017).
- Hypoxia Blagosklonny, M. V. MTOR and autophagy: converging on senescence or quiescence. Autophagy. 9 (2), 260-262 (2013).
- Meuter, A., et al. Markers of cellular senescence are elevated in murine blastocysts cultured in vitro: molecular consequences of culture in atmospheric oxygen. Journal of Assisted Reproduction and Genetics. 31 (10), 1259-1267 (2014).
- Coppe, J. P., et al. A human-like senescence-associated secretory phenotype is conserved in mouse cells dependent on physiological oxygen. PLoS One. 5 (2), e9188 (2010).
- van Deursen, J. M. The role of senescent cells in ageing. Nature. 509 (7501), 439-446 (2014).
- Kim, Y. M., et al. Implications of time-series gene expression profiles of replicative senescence. Aging Cell. 12, 622-634 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved