Method Article
Inducción y validación de senescencia celular en las células humanas primarias
En este artículo
Resumen
Aquí, discutimos una serie de protocolos para la inducción y validación de senescencia celular en células cultivadas. Nos enfocamos en diferentes estímulos de inducción de senescencia y describir la cuantificación de los marcadores comunes asociados a senescencia. Proporcionamos detalles técnicos utilizando fibroblastos como modelo, pero los protocolos se adaptan a varios modelos de celulares.
Resumen
Senescencia celular es un estado de detención permanente ciclo celular activado en respuesta a diversos estímulos nocivos. Activación de la senescencia celular es una de varias condiciones fisiopatológicas, incluyendo supresión tumoral, remodelación y el envejecimiento del tejido. Los inductores de la senescencia celular en vivo se caracterizan todavía mal. Sin embargo, un número de estímulos puede utilizarse para promover la senescencia celular ex vivo. Entre ellos, inductores de senescencia más comunes son agotamiento replicativa, ionizantes y no ionizantes, drogas genotóxicas, estrés oxidativo y desmetilantes y acetylating agentes. Aquí, daremos instrucciones detalladas sobre cómo usar estos estímulos para inducir a los fibroblastos en senescencia. Este protocolo puede ser fácilmente adaptado para diferentes tipos de líneas celulares, incluyendo las células cancerosas y células primarias. También se describen diferentes métodos para la validación de la inducción de senescencia. En particular, nos centramos en la medida de la actividad de la enzima lisosomal asociada a la senescencia de β-galactosidasa (SA-β-gal), la tasa de síntesis de ADN usando 5-ethynyl-2'-desoxiuridina (EdU) incorporación análisis, los niveles de expresión del ciclo celular inhibidores de la p16 y p21 y la expresión y secreción de los miembros del fenotipo secretor Senescence-Associated (spas). Por último, proporcionamos resultados de ejemplo y discutir otras aplicaciones de estos protocolos.
Introducción
En 1961 Hayflick y Moorhead informaron que primaria fibroblastos en cultivo pierden su potencial proliferativo después de pasajes sucesivos1. Este proceso es causado por la reducción secuencial de telómeros después de cada división celular. Cuando los telómeros alcanzan una longitud crítica corta, son reconocidos por la respuesta al daño del ADN (DDR) que activa una detención irreversible de la proliferación, también denominado senescencia replicativa. Senescencia replicativa es actualmente uno de los muchos estímulos que son conocidos por inducir un estado de detención permanente ciclo celular que hace que las células insensibles a los mitógenos y a apoptosis señales2,3. El programa de senescencia se caracteriza normalmente por características adicionales incluyendo alta actividad lisosomal, la disfunción mitocondrial, cambios nucleares, los cambios de la cromatina, estrés de retículo endoplasmático, daño de la DNA y una senescencia asociada fenotipo secretor (spas)3,4. Las células senescentes tienen múltiples funciones en el cuerpo: el desarrollo, la herida cura y tumor supresión2. Igualmente, se sabe que desempeñan un papel importante en el envejecimiento y, paradójicamente, en la progresión de tumor5. Los efectos negativos y parcialmente contradictorios, de senescencia se atribuyen a menudo a los spas6.
Recientemente, fue demostrado que la eliminación de células senescentes en ratones conduce a la extensión de vida útil y a la eliminación de muchos de los envejecimiento características7,8,9,10,11, 12. de la misma manera, se han desarrollado varios fármacos o eliminar las células senescentes (senolytics) o a los spas13,14. El potencial terapéutico contra el envejecimiento recientemente ha atraído más atención al campo.
El estudio de los mecanismos asociados a senescencia celular y las proyecciones para las intervenciones farmacológicas dependen en gran medida en modelos ex vivo , especialmente en fibroblastos humanos primarios. Si bien existen algunas características comunes activados por inductores de senescencia diversos, una gran variabilidad en el fenotipo de senescencia es observado y depende de varios factores incluyendo la célula tipo, estímulo y tiempo punto3,15, 16,17. Es imprescindible considerar la heterogeneidad para estudiar y que dirigida a las células senescentes. Por lo tanto, este protocolo pretende ofrecer una serie de métodos utilizados para inducir la senescencia en fibroblastos primarios mediante el uso de diferentes tratamientos. Como se explicará, los métodos fácilmente adaptables a otros tipos celulares.
Aparte de senescencia replicativa, Describimos cinco otros tratamientos de inducción de senescencia: radiaciones ionizantes, radiación, radiación ultravioleta (UV), la doxorrubicina, el estrés oxidativo y cambios epigenéticos (es decir, la promoción de la acetilación de las histonas o la desmetilación del ADN) . Tanto, la radiación ionizante y la radiación UV causan daño directo del ADN y, en la dosis apropiada, desencadenan senescencia18,19. Doxorrubicina también causa senescencia principalmente por daños en el ADN por intercalando en la DNA y alterar la función de Topoisomerasa II y así detener la DNA reparación mecanismos20. La expresión de genes esenciales para la senescencia es controlada normalmente por la acetilación de las histonas y la metilación del ADN. Como consecuencia, los inhibidores de la histona deacetilasa (p. ej., butirato y SAHA) y ADN desmetilantes (e.g., 5-aza) agentes gatillo senescencia de las células normales21,22.
Por último, cuatro de los marcadores más comunes asociados a las células senescentes se explicará: actividad del senescencia asociada-β-galactosidase (SA-β-gal), tasa de síntesis de ADN por análisis de la incorporación de EdU, la sobreexpresión de los reguladores del ciclo celular y inhibidores de quinasa dependiente de ciclina p16 y p21 y sobreexpresión y secreción de miembros de lo spas.
Protocolo
1. general preparación
- Preparar medio de D10. Suplemento medio-Glutamax DMEM con 10% de SBF y el 1% de penicilina/estreptomicina (concentración Final: 100 U/mL).
- Preparación de PBS estéril. Disolver las tabletas en agua según las instrucciones del fabricante. Esterilizar por autoclave.
- Preparar tripsina x 1. Diluir 5 mL de tripsina-Versene EDTA/10 x 1:10 en 45 mL de PBS estéril.
Nota: En el protocolo, usamos las condiciones de cultivo de células que están más cercanos las fisiológicas condiciones para fibroblastos primarios. Esto significa que nos Incube las células a 37 ° C y 5% CO2 como es normalmente hecho pero con 5% O2 en lugar del "estándar" 20% O2. - Manipular las muestras en condiciones estériles utilizando una campana de flujo laminar, guantes y bata de laboratorio. Mantener las células en 20% O2 (condiciones de la sala) sólo mientras está siendo manipulado.
2. inducción de la senescencia
- Senescencia replicativa
- Durante la manipulación de las células o cualquier material que estará en contacto con ellos (pipetas, matraces, medios de comunicación, etc.) trabajan en condiciones estériles, utilizando una campana de flujo laminar, guantes y bata de laboratorio. Mantener las células en 20% O2 (condiciones de la sala) sólo mientras está siendo manipulado.
- De siembra 7 x 105 viable fibroblastos primarios de una población bajo doble (PD) en un frasco de T75 (~9.3 x 103 células/cm2) que contenga 10 mL de D10.
- Crecen las células en una incubadora a 37 ° C con 5% CO2 y de 5% O2 de celular hasta llegar a 70-80% de confluencia (3 a 4 días para la proliferación de culturas en un PD bajo).
- Separar las células usando 3 mL de 1 x tripsina e incubar durante ~ 5 – 7 minutos en una incubadora de cultivo celular a 37 ° C con 5% CO2 y de 5% O2. Monitorear regularmente las células con un microscopio de la cultura de célula para verificar el proceso de desprendimiento.
- Cuando las células son esféricas, detener la reacción de tripsina añadiendo 9 mL de D10. No incubar más de 10 minutos.
- Girar las células a 300 x g por 5 minutos las células formarán un balín en la parte inferior del tubo, mientras escombros y partículas más pequeñas se quedan en el sobrenadante.
- Quite el sobrenadante y disolver el precipitado de células en 1 mL de D10 y realizar un conteo usando un contador de células automatizado según las instrucciones del fabricante o una cámara de Neubauer para el recuento manual. Mientras cuenta, incluyen un análisis para comprobar la viabilidad de las células (por ejemplo, azul de tripán exclusión23).
- Calcular el PD acumulativa mediante esta fórmula:
PDnuevo = 3.32* (LOG(cell number total)-(LOG (número de células sembrada)) + PDold
Número total de células = todas las células contadas: muertos y vivos.
Número de semillas de células = número de células viables sembradas (8 x 105 células).
PDviejo = población duplicando en el momento de la siembra.
Nuevo PD = población duplicando en el momento de la cuenta (después de la incubación).
Nota: Si 7 x 105 fibroblastos primarios (PD 35.2) fueron sembrados en un frasco de T-75 y, después de 4 días alcanzan el 80% de confluencia y se dividen otra vez, contando ahora 1.3 x 106 células total (muerta + viva).
PDnuevo = 3.32* (LOG(1,300,000 cells)-LOG(700,000)) + 35.2
Nuevo PD = 36.1 - 8 x 105 células en un nuevo T75, repitiendo los pasos 2.1.2–2.1.8 de contaminar.
Nota: Después de varios pasos consecutivos, la cultura tardará más en llegar confluentes hasta que las células dejen de dividir a todos. Una vez que la células deje de dividirse, prueba para los marcadores de senescencia o cosecha para aplicaciones posteriores. - Considerar que el mayor tamaño de las células senescentes puede causar la cultura aparezca completo y sin embargo tienen un bajo conteo. Así, puede suponerse la senescencia cuando el DP es estable y otros marcadores de senescencia aparecen en la cultura (ver protocolos de 3.1 a 3.5).
Nota: Use proliferación fibroblastos primarios como control.
- Senescencia inducida por radiaciones ionizantes
- Durante la manipulación de las células o cualquier material que estará en contacto con ellos (pipetas, matraces, medios de comunicación, etc.), trabajar bajo condiciones estériles utilizando una campana de flujo laminar, guantes y bata de laboratorio. Mantener las células en 20% O2 (condiciones de la sala) sólo mientras está siendo manipulado.
- Semilla 7 x 105 viable primarios fibroblastos en un PD baja en un matraz T75 (~9.3 x 103 células/cm2) que contiene 10 mL de D10.
- Incube las células durante la noche en una incubadora de cultivo celular a 37 ° C con 5% CO2 y de 5% O2.
- Exponer las células a 10 gray de radiación gamma según las instrucciones de la máquina en uso.
- Aspire el medio de las células y reemplazar con 10 mL de D10.
- Incubar las células en 10 mL de D10 en una incubadora de cultivo celular a 37 ° C con 5% CO2 y de 5% O2 por otros 10 días sustituyendo el medio regularmente, aproximadamente cada 3 días.
- Tras 10 días de prueba para los marcadores de senescencia o utilizar las células para aplicaciones posteriores.
Nota: Use proliferación fibroblastos primarios de la misma EP (antes de la irradiación) como control.
- ULTRAVIOLETA (UV) radiación inducida por senescencia
- Durante la manipulación de las células o cualquier material que estará en contacto con ellos (pipetas, matraces, medios de comunicación, etc.), trabajar bajo condiciones estériles utilizando una campana de flujo laminar, guantes y bata de laboratorio. Mantener las células en 20% O2 (condiciones de la sala) sólo mientras está siendo manipulado.
- Semilla de 1.5 a 2 x 105 viable fibroblastos primarios en un PD baja en un pozo de una placa de 6 pozos (1.5-2.0 x 104 células/cm2), agrega 2 mL de medio de D10.
- Colocar las células en una incubadora de cultivo celular a 37 ° C con 5% CO2 y de 5% O2 y les permiten adherirse al plástico de al menos 5 horas.
- Sacar el medio de las células. Coloque la placa de 6 pozos en medio de la cámara de UV-radiation y sacar la tapa de plástico. Irradiar con UVB, 20 – 30 mJ/cm2.
- Añadir 2 mL de medio por pozo.
- Incubar las células en 2 mL de D10 en una incubadora de cultivo celular a 37 ° C con 5% CO2 y de 5% O2 por otros 7 días, sustituyendo el medio regularmente, aproximadamente cada 3 días.
Nota: Después de 7 días, las células pueden ser probadas para marcadores de senescencia y utilizadas para los usos aguas abajo. Usar proliferación fibroblastos primarios de la misma EP (antes de la irradiación) como control.
- Senescencia inducida por la doxorrubicina
- Preparar 1.000 x solución doxorrubicina: hacer un stock de 250 μm de la doxorrubicina en PBS 1 x, filtro-esterilizar la solución y la alícuota de 500 μl por tubo estéril. Almacenar el stock de doxorrubicina a-80 ° C.
- Durante la manipulación de las células o cualquier material que estará en contacto con ellos (pipetas, matraces, medios de comunicación, etc.), trabajar bajo condiciones estériles utilizando una campana de flujo laminar, guantes y bata de laboratorio. Mantener las células en 20% O2 (condiciones de la sala) sólo mientras está siendo manipulado.
- Semilla 7 x 105 viable primarios fibroblastos en un PD baja en un matraz T75 (~9.3 x 103 células/cm2) que contiene 10 mL de D10.
- Incube las células durante la noche en una incubadora de cultivo celular a 37 ° C con 5% CO2 y de 5% O2.
- Diluir 11 μl de 1.000 x solución doxorrubicina en 11 mL de D10 a una concentración final de 250 nM.
- Aspire el medio de las células y reemplazar con 10 mL de D10 + doxorrubicina.
- Incube las células exactamente 24 h en una incubadora de cultivo celular a 37 ° C con 5% CO2 y de 5% O2.
- Aspire el medio de las células y lavarse una vez con 10 mL de D10.
- Incubar las células en 10 mL de D10 por otros 6 días sustituyendo el medio regularmente, aproximadamente cada 3 días.
- En el día 7, prueba para los marcadores de senescencia y/o utilizar para aplicaciones posteriores.
Nota: como control, uso proliferación fibroblastos primarios de la misma EP tratados durante 24 h con el vehículo (PBS) 1:1,000 en D10.
- Senescencia inducida por estrés oxidativa
- Durante la manipulación de las células o cualquier material que estará en contacto con ellos (pipetas, matraces, medios de comunicación, etc.) trabajan en condiciones estériles utilizando una campana de flujo laminar, guantes y bata de laboratorio. Mantener las células en 20% O2 (condiciones de la sala) sólo mientras está siendo manipulado.
- Semilla 7 x 105 viable primarios fibroblastos en un PD baja en un matraz T75 (~9.3 x 103 células/cm2) que contiene 10 mL de D10.
- Incube las células durante la noche en un incubador de células a 37 ° C con 5% CO2 y de 5% O2.
- Preparar una solución de ~ 200 μM del peróxido de hidrógeno en medio D10 agregando 22.6 μL de peróxido de hidrógeno 30% en 11 mL de D10.
Nota: Optimizar el tratamiento para el tipo de la célula de interés haciendo una curva dosis-respuesta para evaluar toxicidad. - Aspire el medio de las células y añadir 10 mL de la recién preparada D10 medio + peróxido de hidrógeno. Incubar por 2 h a 37 ° C con 5% CO2 y el 5% O2.
- Aspirar el medio de las células y lavar una vez con D10 fresco sin el peróxido de hidrógeno.
- Añadir 10 mL de D10 sin peróxido de hidrógeno.
- Incubar durante 48 h en una incubadora de cultivo celular a 37 ° C con 5% CO2 y de 5% O2.
- Repita los pasos 2.5.4–2.5.8 dos veces más para un total de tres tratamientos.
- Busque marcadores de senescencia o cosecha para aplicaciones posteriores.
Nota: Como control, uso de proliferar las células de la misma EP tratados con 22.6 μl de agua estéril en D10 por 2 h.
- Senescencia inducida epigenéticamente
- Preparar acciones y soluciones de trabajo para la pequeña molécula (s) a utilizar según la tabla 1. Filtro-esterilizar las soluciones. Alicuotar en tubos estériles. Almacenar a-20 ° C.
- Durante la manipulación de las células o cualquier material que estará en contacto con ellos (pipetas, matraces, medios de comunicación, etc.) trabajan en condiciones estériles, por ejemplo, utilizando una campana de flujo laminar, guantes y bata de laboratorio. Mantener las células en 20% O2 (condiciones de la sala) sólo mientras está siendo manipulado.
- Semilla 7 x 105 viable primarios fibroblastos en un PD baja en un matraz T75 (~9.3 x 103 células/cm2) que contiene 10 mL de D10.
- Incube las células durante la noche en una incubadora de cultivo celular a 37 ° C con 5% CO2 y de 5% O2.
- Preparar 11 mL de medio de D10 + solución de trabajo para el tratamiento deseado. La dilución exacta por tratamiento puede verse en la tabla 1.
- Preparar 11 μl de solución de trabajo de SAHA de 1 mM en 11 mL de D10.
- Preparar 44 μl de solución de trabajo de butirato sódico de 1 M en 11 mL de D10.
- Preparar 11 μl de solución de trabajo 10 mM 5-aza en 11 mL de D10.
Nota: Optimizar los tratamientos para el tipo de la célula de interés, por ejemplo, haciendo una curva dosis-respuesta para evaluar toxicidad.
- Añadir medio D10 + solución de trabajo para el tratamiento deseado a la cultura.
- Incubar durante 24 h en una incubadora de cultivo celular a 37 ° C con 5% CO2 y de 5% O2.
- Repita los pasos 2.6.4–2.6.6 dos veces más, para un total de tres tratamientos.
- Cambiar el medio para D10 simple sin drogas.
- Después de 3 días más, las células se convierten en senescentes y listo para la prueba de marcadores de senescencia y aplicaciones posteriores.
Nota: como control, uso proliferación fibroblastos primarios de la misma EP tratados durante tres días con D10 medio + vehículo. El D10 medio + vehículo debe actualizarse cada 24 h durante esos tres días. El vehículo depende del tratamiento usado: 1:1,000 DMSO para SAHA y aza 5 y 1: 250 de agua estéril para el butirato de sodio.
3. marcadores de senescencia
- Preparación
- Preparar 20 mg/mL X-gal: disolver 20 mg de X-gal en 1 mL de dimetilformamida o DMSO. Almacenar a-20 ° C, protegido de la luz.
- Preparar la solución de ácido cítrico de 0.1 M: disolver 2,1 g de ácido cítrico puro monohidratado en 100 mL de agua. Almacenar a temperatura ambiente.
- Preparar la solución de fosfato de sodio de 0,2 M: disolver 2.84 g de fosfato dibásico de sodio o 3,56 g de fosfato dibásico de sodio deshidratado en 100 mL de agua. Almacenar a temperatura ambiente.
- Preparar 0,2 M ácido cítrico/sodio fosfato pH 6.0: 36,85 mL de solución de ácido cítrico de 0,1 M y 63,15 mL 0.2 M de fosfato de sodio se disuelven. Ajustar exactamente a pH 6.0. Almacenar a temperatura ambiente.
- Preparación de ferrocianuro de potasio de 100 mM: disolver 2,1 g de ferrocianuro de potasio en 50 mL de agua. Almacenar a 4 ° C protegido de la luz.
- Preparación de Ferricianuro de potasio 100 mM: disolver 1,7 g de Ferricianuro de potasio en 50 mL de agua. Almacenar a 4 ° C protegido de la luz.
- Preparación de cloruro de sodio de 5 M: disolver 14,6 g de cloruro de sodio en 50 mL de agua. Almacenar a temperatura ambiente.
- Preparación de cloruro de magnesio de 1 M: disolver 4,8 g de cloruro de magnesio en 50 mL de agua. Almacenar a temperatura ambiente.
- Preparar 2% formaldehído glutaraldehido 0.2% en PBS: disolver 800 μl de glutaraldehido 25% y 12,5 μl de formaldehído al 16% en 100 μL de PBS. Almacenar a temperatura ambiente protegido de la luz.
- Preparar la solución de tinción fresco según tabla 2.
- Asociada a la senescencia de β-galactosidasa de tinción
- Para cada muestra de semillas 1 x 104 células en por lo menos un pozo de una placa de 24 pozos (5.2 x 103 células/cm2) conteniendo 500 μl de D10 para que las células son escasas. Tratamientos (si corresponde) pueden realizarse directamente en esta placa o, alternativamente, las células tratadas ya puede volver a sembrados en una placa de 24 pocillos.
- Incube las células durante la noche a 37 ° C con 5% CO2 y de 5% O2.
- Lavar las células dos veces con 500 μL de PBS.
- Fijar 3 – 5 min a temperatura ambiente utilizando 500 μL/pocillo de formaldehído al 2% + 0.2% glutaraldehído en PBS.
- Lavar las células dos veces con 500 μL de PBS.
- Preparar fresca coloración de la solución, según el número de muestras a la mancha.
- La solución de tinción (500 μL/pocillo) y sellar la placa con parafilm para evitar la evaporación.
Nota: Evaporación puede causar cristales para formar y dificultar la observación bajo el microscopio. - Incubar las células en la oscuridad (por ejemplo, cubierta en papel de aluminio) a 37 ° C en un incubador seco (sin CO2) de 12 a 16 h.
Nota: CO2 puede afectar el pH y por lo tanto modificar los resultados. Algunos tipos de células pueden requerir tiempos de incubación más cortos. - Lavar dos veces con 500 μL de PBS.
- Evaluar los resultados. Las células positivas presentan un azul (sobre todo) perinuclear tinción bajo un microscopio de luz normal (figura 1A).
- Para la cuantificación, por lo menos 100 células por muestra de observar y contar el número de células positivas. Puesto que las células senescentes cambian forma, a menudo es difícil definir los límites de celda y contar las células. Contratinción con DAPI para facilitar la visualización y cuantificación de células individuales (figura 1B). Cuantificar las muestras (porcentaje de células positivas versus la cantidad total de células) utilizando un microscopio de fluorescencia (figura 1). Tomar varias fotografías de la misma muestra para que al final puedan contar por lo menos 100 células solo y evaluar el porcentaje de células positivas SA-β-gal en ellos.
- Comparar los resultados de las células senescentes frente a su control adecuado para el tratamiento.
Nota: Una tinción conjuntamente con EdU en la misma muestra es posible. Tener en cuenta que luego se siembran las células sobre cubreobjetos.
- Análisis de la incorporación de EdU
- Poner un cubreobjetos/pozo de una placa de 24 pocillos según el número de muestras a evaluar.
- Semillas de 1 x 104 células en por lo menos un pozo de una placa de 24 pocillos (5.2 x 103 células/cm2) por condición conteniendo 500 μl de D10 para que las células son escasas. Tratamientos (si corresponde) pueden realizarse directamente en esta placa o, alternativamente, células tratadas ya puede volver a sembrados en una placa de 24 pocillos.
- Incube las células durante la noche a 37 ° C con 5% CO2 y de 5% O2.
- Hacer una solución de 20 μm de EdU en D10 (1: 250) según el número de muestras a tratar (250 μL por muestra).
- Quitar la mitad del medio (250 μL) de cada bien para tratar y sustituirla por la D10 + EdU solución que sólo fue preparado. Concentración final de EdU es 10 μm.
- Incubar 18-24 h en una incubadora de cultivo celular a 37 ° C con 5% CO2 y el 5% O2. Uso el mismo tiempo de incubación en el control y las células senescentes.
- Lavar 2 x con 500 μL de PBS.
- Fije las células durante 10 min con 500 μL de formaldehído al 4% en PBS.
- Incubar 5 minutos en 500 μL de 100 mM Tris (pH 7.6).
- Permeabilizar las células durante 10 minutos en 500 μL de 0,1% Tritón X-100 en PBS.
- Lavar 3 veces con PBS.
- Preparar 50 μL de mezcla de etiqueta para cada cubreobjetos, agregando los componentes en el siguiente orden: 44,45 μl de PBS, 0,5 μl de Cu (II) SO4, 0.05 μl de sulfo-Cy3-azida, 5 μl de ascorbato de sodio.
- Colocar 50 μL de la mezcla etiqueta sobre un trozo de parafilm. Levantar el cubreobjetos con la ayuda de un par de pinzas y una aguja y se deja reposar en la parte superior la mezcla de etiqueta, con la superficie que contiene las celdas hacia abajo. Asegúrese de que no hay ninguna burbuja y que toda la superficie del cubreobjetos esté tocando la mezcla de etiqueta. Incubar por 30 min en la oscuridad.
- Vuelva a colocar las células en los pocillos de la placa de 24 pocillos y lávelos tres veces con PBS.
- Montar con los medios de comunicación (incluyendo DAPI para visualizar núcleos) de montaje en portaobjetos de vidrio y deje secar durante la noche.
- Visualizar la incorporación de EdU con un microscopio de fluorescencia. Utilizar un filtro apropiado para Cy3 (excitación/emisión: 552/570 nm).
- Tomar varias fotografías de las células para la cuantificación posterior de al menos 100 células por condición (Cy3 y DAPI).
- Cuantificar el porcentaje de células que incorporan EdU utilizando la siguiente fórmula:
Las células positivas de EdU (%) = (recuento de células positivas de EdU (Cy3) / total de conteo (DAPI)) * 100 - Comparar los resultados de las células senescentes frente a su control adecuado para el tratamiento.
Nota: Una tinción conjuntamente con SA-β-gal en la misma muestra es posible. Considerar que todavía se siembran las células sobre cubreobjetos.
- Expresión del gen de la p16, p21 y spas
- Preparar el primer sets de Genes de interés (cartilla de 50 μm).
Nota: Una qPCR de p16, p21 y algunos factores relevantes de spas es informativo del estado de senescencia. El protocolo aquí descrito hace uso del sistema de biblioteca de sonda Universal (UPL) para la cuantificación relativa usando un PCR de tiempo real. La tabla 3 muestra un resumen de los cebadores utilizados para la detección de inhibidores CDK p16 y p21 y de los miembros más relevantes de spas, así como para la tubulina y actina, que sirven como genes de referencia para el análisis. La última columna de la tabla 3 incluye la sonda UPL particular para cada ensayo. - Preparar mezcla de reacción de qPCR separado para los análisis deseados. Siempre incluyen el gen de referencia así como según la tabla 4.
- Ejecutar todas las muestras en duplicado o triplicado.
- Carga 7.5 μL/pocillo de la mezcla de reacción de qPCR en una placa de 384 pozos.
- Añadir ~ 5 ng de cDNA disueltos en 2.5 μl de agua libre de ARNasa.
Nota: Es preferible tener cantidades similares de cDNA para todas las muestras a comparar. Esto puede lograrse mediante el uso de cantidades iguales de ARN por transcripción reversa. - Cubra la placa con un sello y asegúrese de que se pega correctamente, cubriendo uniformemente todos los pozos en la placa.
- Haga girar la placa a 2.000 x g durante 1 minuto.
- Ejecutar la placa en el Lightcycler para 40 ciclos con el siguiente protocolo:
95 ° C por 7 min
40 ciclos de 95 ° C para 5 s y 60 ° C durante 30 s
37 ° C durante 1 min. - Para el análisis de los resultados, utilizar el método propuesto por Livak y colegas para analizar datos de qPCR24. Utilizar tubulina o actina como genes de referencia para calcular el ΔCt del valor y utilizan el control apropiado para calcular el valor ΔΔCt para el tratamiento específico de la inducción de senescencia.
- Preparar el primer sets de Genes de interés (cartilla de 50 μm).
- Expresión de la proteína y la secreción de IL6
- Semilla 5-10 x 104 células en por lo menos un pozo de una placa de 6 pozos (5.2 – 10.5 x 103 células/cm2) por condición que contiene 2 mL de D10. Tratamientos (si corresponde) pueden realizarse directamente en esta placa o, alternativamente, las células tratadas ya puede volver a sembrados en una placa de 24 pocillos. Dejar reposar durante la noche después de la siembra.
- Quite el medio y reemplazar por 2 mL de DMEM medio sin SFB. Incubar en condiciones normales durante 24 h.
- Recoger el medio en un tubo de 15 mL.
- Centrifugar la muestra a 300 x g durante 5 min medio puede almacenarse a-80 ° C hasta su procesado.
- Siga las instrucciones del fabricante para realizar el ELISA.
- Comparar los resultados de las células senescentes versus el control apropiado para el tratamiento específico de la inducción de senescencia
Resultados
Enriquecimiento de tinción SA-β-gal en fibroblastos senescentes
Β-galactosidasa (β-gal) es una enzima lisosomal que se expresa en todas las células y que tiene un pH óptimo de 4.025,26. Sin embargo, durante la senescencia, lisosomas aumentan de tamaño y, en consecuencia, las células senescentes acumulan a β-gal. La mayor cantidad de esta enzima hace posible detectar su actividad incluso a un pH subóptimo 6.025,27. Figura 1A muestra imágenes representativas de la tinción de SA-β-gal en proliferación versus senescentes fibroblastos primarios. Las células también se ven agrandados y con un cuerpo de la célula irregular. Como se mencionó, puede ser difícil de distinguir de las células individuales, para que co tinción con DAPI facilita la visualización y la célula contando (figura 1B). Es necesario tomar fotografías en un microscopio de fluorescencia para observar la tinción DAPI. Esto significa que se tomarán fotos en el canal de campo brillante en blanco y negro, por lo que la tinción "azul" de la SA-β-gal aparecerán negra en las imágenes. De la nota, no todas las celdas dentro de una muestra son positivas para β-gal. La eficacia de la inducción de senescencia es altamente dependiente de la célula y estímulo tipo, cepa utilizada. Los protocolos descritos aquí rindieron > 50% células positivas de β-gal en fibroblastos primarios (BJ y WI-38) en nuestras manos.
Menos las células incorporan EdU después de la inducción de la senescencia
EdU es un análogo de la timidina análogos de los nucleósidos que, durante la síntesis activa de ADN, será incorporado en el ADN28. La incorporación de EdU en el ADN puede visualizarse después de realizar la cicloadición Copper-Catalyzed azida-alquino (CuAAC) a EdU, reacción que no se puede realizar en timidina regular porque carece el alquino grupo28. En este protocolo en particular, se utiliza una Sulfo-Cy3-azida. Si el acoplamiento de la azida para la alquino ha tenido lugar, las células muestra fluorescencia bajo un filtro Cy3 (figura 2A). Es importante tener en cuenta que al realizar el análisis de la incorporación de EdU, las células que proliferan pueden distinguirse de las células no proliferantes. Las células no proliferantes pueden ser quieto o senescente, lo que significa que el análisis de la incorporación de EdU no puede discriminar entre estos dos tipos de detención del ciclo celular.
Alza de fibroblastos senescente el CDK inhibidores p16 y p21
Las células senescentes hacen uso de los inhibidores de las CDKs para detener el ciclo celular29. Particularmente p16 y p21 se miden a menudo como marcadores de las células senescentes3. Uno o ambos marcadores normalmente son upregulated en las células senescentes, y la regulación al alza a menudo se mide a nivel transcripcional. Se recomienda utilizar ambos marcadores simultáneamente ya que algunas células no alza p16 a nivel transcripcional y p21 es un marcador universal pero no específico de senescencia15,17,30. La figura 3 muestra representativas cuantificaciones relativas de p16 y p21 mRNA en fibroblastos induce a la senescencia. Otras técnicas como la inmunotinción o western blot para la detección de niveles de proteína también son posibles.
Fibroblastos senescentes mostrar un SASP
Las células senescentes más transcripcionalmente alza secretan varios genes que codifican para proteínas, un fenómeno llamado spas6. La spas incluye factores que intervienen en la inflamación, por ejemplo, interleucinas y quimiocinas, o en la degradación de la matriz extracelular (ECM), por ejemplo, MMPs, pero es altamente heterogénea. Inducción de factores de spas puede evaluarse mediante la medición de niveles de expresión de mRNA mediante qPCR o niveles de la proteína secretada por genitals inmuno Sorbent ensayo (ELISA). La figura 4 muestra una imagen representativa que muestra el upregulation de IL6 a nivel transcripcional y secretada. Utilizamos IL6 sólo como representación; sin embargo, se recomienda medir varios miembros de lo spas de la lista sugerida de protocolo 3.4.
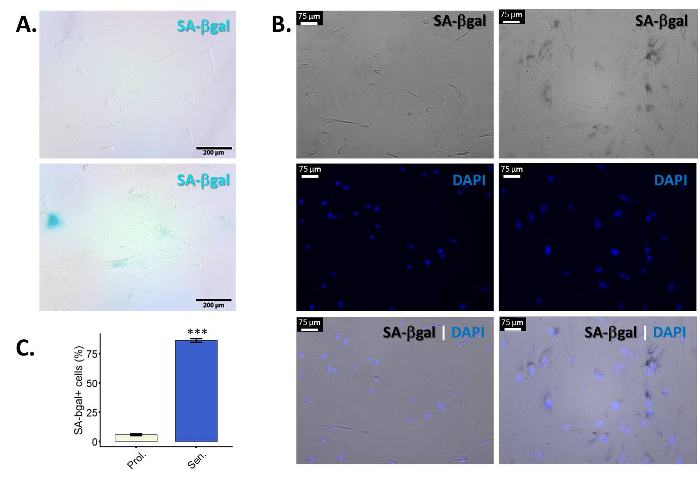
Figura 1: enriquecimiento de la SA-β-gal tinción en senescentes fibroblastos primarios de. Fibroblastos de prepucio primaria BJ (PD 34.1) fueron inducidos a la senescencia mediante la exposición a la radiación ionizante (10 Gy). Las células fueron manchadas para SA-βgal diez días después de la irradiación. (A) resultados representativos para la tinción de SA-βgal en fibroblastos primarios de BJ sin tratamiento (arriba) o expuestos a la radiación ionizante (abajo). Ampliación final: 100 X. (B) figura representativa de SA-β-gal Co teñido con DAPI para fibroblastos primarios de BJ o sin tratamiento (tres paneles izquierdos) o expuestos a la radiación ionizante (tres paneles derecho). El DAPI (azul) la coloración permite para visualizar células individuales, facilitando la cuantificación. Fotografías tomadas en campo brillante aparecen en blanco y negro. Por lo tanto, en estas fotos particular SA-β-gal la coloración se verá como puntos negro perinuclear. Ampliación final: 100 X. (C) cuantificación de las células positivas SA-β-gal en proliferación (Prol., blanco) fibroblastos BJ contra radiaciones ionizantes homólogos tratados irradiado (senador, azul). Cuantificación se realizó utilizando tres réplicas biológicas con barras de error mostrando el error estándar de la media. Significación estadística fue determinada por un impar dos colas prueba t de Student-valores delta-CT. (n = 3, ± SEM, *** = valor de p < 0.01). Haga clic aquí para ver una versión más grande de esta figura.
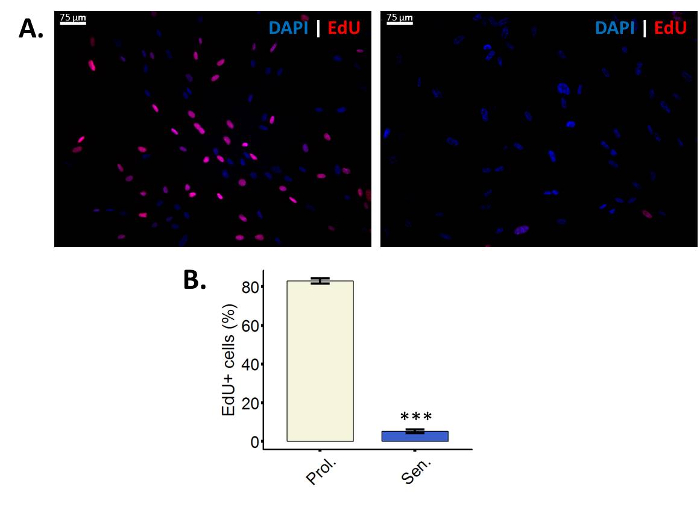
Figura 2: células menos incorporan EdU después de la inducción de la senescencia. (A) imagen representativa del ensayo de incorporación de EdU en proliferación fibroblastos WI-38 43,86 PD (izquierda) y sus homólogos irradiación ionizantes (derecha). Ampliación final: 100 X. (B) cuantificación de EdU positivo células en proliferación (Prol., blanco) fibroblastos BJ (PD 38.7) versus sus homólogos irradiados (senador, azul). Cuantificación se realizó utilizando tres réplicas biológicas con barras de error mostrando el error estándar de la media. Significación estadística fue determinada por un impar dos colas prueba t de Student-valores delta-CT (n = 3, ± SEM, *** = valor de p < 0.01). Haga clic aquí para ver una versión más grande de esta figura.
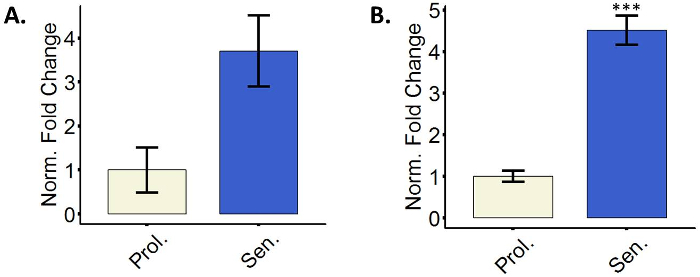
Figura 3: fibroblastos senescentes alza el CDK inhibidores p16 y p21. (A) la cuantificación de la expresión de mRNA de p16 en proliferación (Prol., blanco, PD 35,3) o las células tratadas con 5-aza BJ (senador, azul). (B) cuantificación de la expresión de mRNA de p21 en proliferación (Prol., blanco, PD 35,3) o tratados con aza 5 BJ células (senador, azul). Cuantificación se realizó utilizando tres réplicas biológicas (cada uno con dos técnicos replica) con barras de error mostrando el error estándar de la media. Significación estadística fue determinada por un impar dos colas prueba t de Student-valores delta-CT (n = 3, ± SEM, *** = p valor < 0,01). Haga clic aquí para ver una versión más grande de esta figura.
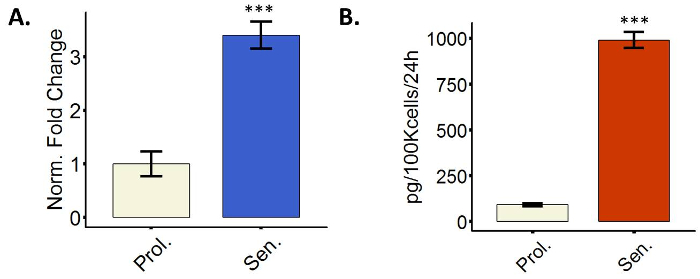
Figura 4: fibroblastos senescentes mostrar un fenotipo secretorio (SASP). (A) la cuantificación de IL6 mRNA expresión en fibroblastos BJ ya sea proliferando (Prol., blanco, PD 38.7) o inducido a senescencia por radiación ionizante (senador, azul). (B) cuantificación de la expresión de la proteína de IL6 en proliferación PD 38.6 (Prol., blanco) o tratado con radiación ionizante WI38 fibroblastos (senador, azul). Cuantificación se realizó utilizando tres réplicas biológicas con barras de error mostrando el error estándar de la media. En el caso de los datos de la qPCR, cada repetición biológico tuvo dos técnicos duplicados. Significación estadística fue determinada por un impar dos colas prueba t de Student-valores delta-CT (n = 3, ± SEM, *** = valor dep < 0.01). Haga clic aquí para ver una versión más grande de esta figura.
| Diluyente | Solución madre de | Solución de trabajo | Dilución para el tratamiento | Concentración final | |
| SAHA | DMSO | 100 mM | 1 mM | 1:1,000 | 16:00 |
| Butirato de sodio | Agua estéril | --- | 1 M | 1: 250 | 4 mM |
| 5-aza-2'-desoxicitidina (5-aza) | DMSO | 100 mM | 10 mM | 1:1,000 | 10 ΜM |
Tabla 1: Acciones y soluciones de trabajo para los diferentes tratamientos utilizados para la senescencia inducida epigenéticamente.
| Componente | Volumen | Concentración final |
| 20 mg/mL X-gal | 1 mL | 1 mg/mL |
| 0,2 M ácido cítrico/sodio fosfato tampón, ph 6.0 | 4 mL | 40 mM |
| ferrocianuro de potasio de 100 mM | 1 mL | 5 mM |
| Ferricianuro de potasio 100 mM | 1 mL | 5 mM |
| Cloruro de sodio de 5 M | 0,6 mL | 150 mM |
| Cloruro de magnesio de 1 M | 0,04 mL | 2 mM |
| Agua | 12,4 mL | - |
| Total | 20 mL |
Tabla 2: Composición de la solución de tinción utilizada para la senescencia asociada (SA) - β - gal la coloración.
| Blanco | Avance Primer (5'--> 3') | Reverse Primer (5'--> 3') | Sonda UPL | ||
| Tubulina | CTTCGTCTCCGCCATCAG | CGTGTTCCAGGCAGTAGAGC | #40 | ||
| Actina B | ccaaccgcgagaagatga | ccagaggcgtacagggatag | #64 | ||
| P16 | GAGCAGCATGGAGCCTTC | CGTAACTATTCGGTGCGTTG | #67 | ||
| P21 | tcactgtcttgtacccttgtgc | ggcgtttggagtggtagaaa | #32 | ||
| IL6 | CAGGAGCCCAGCTATGAACT | GAAGGCAGCAGGCAACAC | #45 | ||
| IL8 | GAGCACTCCATAAGGCACAAA | ATGGTTCCTTCCGGTGGT | #72 | ||
| IL1a | GGTTGAGTTTAAGCCAATCCA | TGCTGACCTAGGCTTGATGA | #6 | ||
| CXCL1 | CATCGAAAAGATGCTGAACAGT | ATAAGGGCAGGGCCTCCT | #83 | ||
| CXCL10 | GAAAGCAGTTAGCAAGGAAAGGT | GACATATACTCCATGTAGGGAAGTGA | #34 | ||
| CCL2 | AGTCTCTGCCGCCCTTCT | GTGACTGGGGCATTGATTG | #40 | ||
| CCL20 | GCTGCTTTGATGTCAGTGCT | GCAGTCAAAGTTGCTTGCTG | #39 | ||
| PAI1 | AAGGCACCTCTGAGAACTTCA | CCCAGGACTAGGCAGGTG | #19 | ||
| MMP1 | GCTAACCTTTGATGCTATAACTACGA | TTTGTGCGCATGTAGAATCTG | #7 | ||
| MMP3 | CCAGGTGTGGAGTTCCTGAT | CATCTTTTGGCAAATCTGGTG | #72 | ||
| MMP9 | GAACCAATCTCACCGACAGG | GCCACCCGAGTGTAACCATA | #53 | ||
Tabla 3: Secuencias de la cartilla y su correspondiente sonda UPL para la detección de ARNm de marcadores de senescencia en muestras de origen humano.
| Componente | Volumen de la muestra |
| Sensifast sonda Lo-Rox mix | 5 ΜL |
| Primer conjunto (50 μm) | 0.1 ΜL |
| Sonda UPL | 0.1 ΜL |
| Agua libre de nucleasas | 2.3 ΜL |
| cDNA (~ 4 ng) | 2,5 ΜL |
| Total | ΜL DE 7.5 |
Tabla 4: Composición de la reacción de qPCR de la mezcla para el sistema UPL.
Discusión
Los protocolos explicados aquí fueron optimizados para fibroblastos primarios humanos, particularmente las células BJ y WI-38. Los protocolos para la senescencia replicativa, radiaciones ionizantes y doxorrubicina, se han aplicado con éxito a otros tipos de fibroblastos (HCA2 y IMR90) y en otros tipos celulares (es decir neonatales melanocitos y queratinocitos o cardiomiocitos derivados de iPSC) en nuestro laboratorio. Sin embargo, las adaptaciones de los tipos de células adicionales pueden optimizarse ajustando algunos detalles como el número de células sembradas, los métodos y productos químicos para ayudar a las células para colocar y quitar para soportes de plástico y la dosis del tratamiento para evitar la toxicidad.
Incluso el uso de fibroblastos primarios plantea una serie de desafíos. Las células senescentes son generalmente más difíciles de soltar que sus contrapartes de proliferación, y suelen ser más sensible a la tripsinización o cualquier otro tipo de extracción método, lo que significa que la viabilidad después de separar es ligeramente inferior a la de células proliferantes. La elección del control adecuado de los diferentes métodos de inducción de senescencia es difícil. Por ejemplo, para los tratamientos basados en drogas como la doxorubicina, sugerimos un tratamiento corto con el vehículo: PBS durante 24 h en el caso de las muestras de control para células tratadas con doxorrubicina seguida de cosecha y procesamiento inmediato. Podría aducirse que induce a la senescencia de las células pasan por un tiempo extendido de la cultura después de que el tratamiento fue aplicado (seis días adicionales de cultivo para células tratadas con doxorrubicina) y que las células del control deben ser cultivada igual cantidad de tiempo después del retiro de PBS. Sin embargo, una cultura tan largo le permitiría a las células para dividir aún más, a convertirse en confluentes excesiva o exigir más pases y aumentar PD. confluencia excesiva puede causar marcadores de senescencia, como SA-β-gal a aparecer a pesar de las células manteniendo sus potencial de proliferación31. El mayor PD conseguir más cercano a su límite de replicación (y a la senescencia replicativa) y hacerlas menos comparables a sus homólogos tratados con doxorrubicina. Una situación similar se aplicaría para los otros tratamientos. Hemos sugerido los controles que consideremos más apropiados para cada caso.
La mayoría de las técnicas utilizadas para inducir las células en senescencia parece relativamente fácil y sencilla, pero muchos factores pueden afectar el resultado de los experimentos. Por ejemplo, la concentración de glucosa normal célula convencional de medios de cultivo de fibroblastos es de 4,5 g. Sin embargo, para algunos tipos de células como las células madre, concentraciones menores de glucosa extienden su potencial proliferativo32, mientras que para otros concentraciones más altas pueden conducir a envejecimiento prematuro33. Por otra parte, las células senescentes son altamente metabólicas y gastan grandes cantidades de energía para producir factores secretados34, otros fenotipos asociados a senescencia puedan verse afectados por las oscilaciones en las concentraciones de glucosa.
Otra variable de potencial en el medio de cultivo celular es suero. La composición del suero normalmente no está definida y varía según la fuente de animales y el lote. Particularmente, la cantidad de proteínas proinflamatorias y factores de crecimiento puede influir en la senescencia35. Recomendamos que el mismo lote de suero se utiliza para el experimento entero para evitar variabilidad innecesaria y confusión. Sin embargo, algunas inevitables condiciones técnicas como el uso de medio sin suero utilizado para algunos protocolos basados en ELISA pueden reducir la expresión de spas.
Tensión de oxígeno es importante para la inducción de senescencia completa. La hipoxia puede inhibir la geroconversion, para que las células no proliferan pero no irreversible arrestado36. Sin embargo, el problema más común en la configuración experimental no es hipoxia pero hiperoxia. De hecho, las condiciones de cultivo estándar suelen ser de 20% de oxígeno como "normoxia", pero las condiciones fisiológicas para más tipos de células son menores. Blastocistos de ratón presentan marcadores de senescencia (SA-βgal y DNA daños) cuando cultivadas en el 20% de oxígeno, a diferencia de los ines vivo-derivados homólogos o las mismas células cultivadas en el 5% oxígeno37. Además, los fibroblastos de ratón cultivan en condiciones más fisiológicas (3% de oxígeno) y no en pantalla de unos (20% oxígeno) convencional un SASP38. Aquí, utilizamos el 5% de oxígeno para todas las culturas y experimentos y nos instan a los investigadores a reconsiderar las concentraciones de oxígeno utilizadas para el tipo de célula particular de interés.
Finalmente, otro factor a considerar es la heterogeneidad intrínseca de las células senescentes. Por un lado, incluso células cepas y diferentes tipos de células muestran diferencias en los fenotipos asociados a senescencia. Por ejemplo, algunas cepas de fibroblastos hacen no alza p16 a nivel transcripcional sobre inducción de senescencia15,16,17, como también se muestra en la Figura 3A, donde a pesar de ver un upregulation de P16, esto no fue estadísticamente significativo. P16 también se controla a nivel traduccional y poste-de translación, por lo que la medición de los niveles de proteína podría en algunos casos demuestran un aumento de la actividad de este inhibidor de la CDK. Sin embargo, es posible que algunas células simplemente dependen de otros inhibidores CDK, como p21. Se recomienda medir los niveles transcripcionales de ambos. La composición exacta de la spas también depende de la célula que lo produce3. Además, algunas células constitutivamente expresan altos niveles de β-galactosidasa, dando un resultado positivo para la tinción de SA-β-gal que no es necesariamente indicativa de senescencia3. En algunos casos, este problema puede ser superado reduciendo el tiempo de incubación con solución de tinción durante el protocolo de tinción SA-β-gal. Como se mencionó, las células confluentes sobre también podrían mancha con SA-β-gal sin ellos siendo senescentes31, por lo que instamos a los investigadores a células en cultivo escasamente para realizar esta tinción. Por otra parte, el fenotipo de envejecimiento sí mismo no es estable39. La composición de la spas y la aparición de otros marcadores de senescencia son dependientes del tiempo17,40. Aquí, hemos sugerido los puntos del tiempo después de cada tratamiento en el que las células se consideran totalmente senescentes y que se utilizan habitualmente en nuestro laboratorio. Lo importante es medir los marcadores en un punto del tiempo más corto puede hacer resultados negativos debido a la senescencia incompleta40. Por otra parte, ya que en la mayoría de los tratamientos de un porcentaje de células no se convierten en senescentes, utilizando un punto de tiempo más largo puede dar tiempo suficiente para que las pocas células no senescentes ampliar y superar a la cultura, reducción de la expresión de marcadores de senescencia. En vista de la heterogeneidad de las células senescentes y las múltiples advertencias de los diferentes marcadores, altamente animamos a los investigadores a utilizar múltiples marcadores de senescencia dentro de la misma muestra.
Divulgaciones
N / A
Agradecimientos
Agradecemos a los miembros del laboratorio Demaria para discusiones fructíferas y Thijmen van Vliet para compartir datos y protocolo en la senescencia inducida por UV.
Materiales
| Name | Company | Catalog Number | Comments |
| DMEM Media - GlutaMAX | Gibco | 31966-047 | |
| Fetal Bovine Serum | Hyclone | SV30160.03 | |
| Penicillin-Streptomycin (P/S; 10,000 U/ml) | Lonza | DE17-602E | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | SC-202581 | |
| Nuclease-Free Water (not DEPC-Treated) | Ambion | AM9937 | |
| T75 flask | Sarstedt | 833911002 | |
| Trypsin/EDTA Solution | Lonza | CC-5012 | |
| PBS tablets | Gibco | 18912-014 | |
| 1.5 ml microcentrifuge tubes | Sigma-Aldrich | T9661-1000EA | |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich | CLS430791 | |
| 6-well plate | Sarstedt | 83.3920 | |
| 24-well plate | Sarstedt | 83.3922 | |
| 13mm round coverslips | Sarstedt | 83.1840.002 | |
| Steriflip | Merck Chemicals | SCGP00525 | |
| Cesium137-source | IBL 637 Cesium-137γ-ray machine | ||
| UV radiation chamber | Opsytec, Dr. Göbel BS-02 | ||
| Doxorubicin dihydrochloride | BioAustralis Fine Chemicals | BIA-D1202-1 | |
| Hydrogen peroxide solution | Sigma-Aldrich | 7722-84-1 | |
| 5-aza-2’-deoxycytidine | Sigma-Aldrich | A3656 | |
| SAHA | Sigma-Aldrich | SML0061 | |
| Sodium Butyrate | Sigma-Aldrich | B5887 | |
| X-gal (5-Bromo-4-chloro-3-indolyl-β-D-galactopyranoside) | Fisher Scientific | 7240-90-6 | |
| Citric acid monohydrate | Sigma-Aldrich | 5949-29-1 | |
| Sodium dibasic phosphate | Acros organics | 7782-85-6 | |
| Potassium ferrocyanide | Fisher Scientific | 14459-95-1 | |
| Potassium ferricyanide | Fisher Scientific | 13746-66-2 | |
| Sodium Chloride | Merck Millipore | 7647-14-5 | |
| Magnesium Chloride | Fisher Chemicals | 7791-18-6 | |
| 25% glutaraldehyde | Fisher Scientific | 111-30-8,7732-18-5 | |
| 16% formaldehyde (w/v) | Thermo-Fisher Scientific | 28908 | |
| EdU (5-ethynyl-2’-deoxyuridine) | Lumiprobe | 10540 | |
| Sulfo-Cyanine3 azide (Sulfo-Cy3-Azide) | Lumiprobe | D1330 | |
| Sodium ascorbate | Sigma-Aldrich | A4034 | |
| Copper(II) sulfate pentahydrate (Cu(II)SO4.5H2O) | Sigma-Aldrich | 209198 | |
| Triton X-100 | Acros organics | 215682500 | |
| TRIS base | Roche | 11814273001 | |
| LightCycler 480 Multiwell Plate 384, white | Roche | 4729749001 | |
| Lightcycler 480 sealing foil | Roche | 4729757001 | |
| Sensifast Probe Lo-ROX kit | Bioline | BIO-84020 | |
| UPL Probe Library | Sigma-Aldrich | Various | |
| Human IL-6 DuoSet ELISA | R&D | D6050 | |
| Bio-Rad TC20 | Bio-Rad | ||
| Counting slides | Bio-Rad | 145-0017 | |
| Dry incubator | Thermo-Fisher Scientific | Heratherm | |
| Dimethylformamide | Merck Millipore | 1.10983 | |
| Parafilm 'M' laboratory film | Bemis | #PM992 | |
| Tweezers | |||
| Needles |
Referencias
- Hayflick, L., Moorhead, P. S. The serial cultivation of human diploid cell strains. Experimental Cell Research. 25, 585-621 (1961).
- Muñoz-Espín, D., Serrano, M. Cellular senescence: from physiology to pathology. Nature reviews. Molecular cell biology. 15, 482-496 (2014).
- Sharpless, N. E., Sherr, C. J. Forging a signature of in vivo senescence. Nature Reviews Cancer. 15 (7), 397-408 (2015).
- Correia-Melo, C., et al. Mitochondria are required for pro-ageing features of the senescent phenotype. The EMBO Journal. 10, e201592862 (2016).
- Loaiza, N., Demaria, M. Cellular senescence and tumor promotion: Is aging the key?. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. , (2016).
- Coppe, J. P., et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biology. 6 (12), 2853-2868 (2008).
- Baker, D. J., et al. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature. 530 (7589), 184-189 (2016).
- Xu, M., et al. Targeting senescent cells enhances adipogenesis and metabolic function in old age. Elife. 4, e12997 (2015).
- Baker, D. J., et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479 (7372), 232-236 (2011).
- Jeon, O. H., et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nature Medicine. 23 (6), 775-781 (2017).
- Demaria, M., et al. Cellular Senescence Promotes Adverse Effects of Chemotherapy and Cancer Relapse. Cancer Discovery. 7 (2), 165-176 (2017).
- Chang, J., et al. Clearance of senescent cells by ABT263 rejuvenates aged hematopoietic stem cells in mice. Nature Medicine. 22 (1), 78-83 (2016).
- Soto-Gamez, A., Demaria, M. Therapeutic interventions for aging: the case of cellular senescence. Drug Discov Today. 22 (5), 786-795 (2017).
- Childs, B. G., et al. Senescent cells: an emerging target for diseases of ageing. Nature Reviews Drug Discovery. 16 (10), 718-735 (2017).
- Marthandan, S., et al. Conserved genes and pathways in primary human fibroblast strains undergoing replicative and radiation induced senescence. Biological Research. 49, 34 (2016).
- Marthandan, S., et al. Conserved Senescence Associated Genes and Pathways in Primary Human Fibroblasts Detected by RNA-Seq. PLoS One. 11 (5), e0154531 (2016).
- Hernandez-Segura, A., et al. Unmasking Transcriptional Heterogeneity in Senescent Cells. Current Biology. 27 (17), 2652-2660 (2017).
- Le, O. N., et al. Ionizing radiation-induced long-term expression of senescence markers in mice is independent of p53 and immune status. Aging Cell. 9 (3), 398-409 (2010).
- Hall, J. R., et al. C/EBPalpha regulates CRL4(Cdt2)-mediated degradation of p21 in response to UVB-induced DNA damage to control the G1/S checkpoint. Cell Cycle. 13 (22), 3602-3610 (2014).
- Nitiss, J. L. Targeting DNA topoisomerase II in cancer chemotherapy. Nature Reviews Cancer. 9 (5), 338-350 (2009).
- Pazolli, E., et al. Chromatin remodeling underlies the senescence- associated secretory phenotype of tumor stromal fibroblasts that supports cancer progression. Cancer Research. 72, 2251-2261 (2012).
- Venturelli, S., et al. Differential induction of apoptosis and senescence by the DNA methyltransferase inhibitors 5-azacytidine and 5-aza-2'-deoxycytidine in solid tumor cells. Molecular Cancer Therapeutics. 12, 2226-2236 (2013).
- Tennant, J. R. Evaluation of the Trypan Blue Technique for Determination of Cell Viability. Transplantation. 2, 685-694 (1964).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Lee, B. Y., et al. Senescence-associated β-galactosidase is lysosomal β-galactosidase. Aging Cell. 5, 187-195 (2006).
- Kopp, H. G., Hooper, A. T., Shmelkov, S. V., Rafii, S. Beta-galactosidase staining on bone marrow. The osteoclast pitfall. Histology and Histopathology. 22 (9), 971-976 (2007).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences. 92 (20), 9363-9367 (1995).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proceedings of the National Academy of Sciences. 105 (7), 2415-2420 (2008).
- Sherr, C. J., McCormick, F. The RB and p53 pathways in cancer. Cancer Cell. 2 (2), 103-112 (2002).
- Bunz, F., et al. Requirement for p53 and p21 to sustain G2 arrest after DNA damage. Science. 282 (5393), 1497-1501 (1998).
- Severino, J., Allen, R. G., Balin, S., Balin, A., Cristofalo, V. J. Is beta-galactosidase staining a marker of senescence in vitro and in vivo. Experimental Cell Research. 257 (1), 162-171 (2000).
- Stolzing, A., Coleman, N., Scutt, A. Glucose-induced replicative senescence in mesenchymal stem cells. Rejuvenation Research. 9 (1), 31-35 (2006).
- Blazer, S., et al. High glucose-induced replicative senescence: point of no return and effect of telomerase. Biochemical and Biophysical Research Communications. 296 (1), 93-101 (2002).
- Wiley, C. D., Campisi, J. From Ancient Pathways to Aging Cells-Connecting Metabolism and Cellular Senescence. Cell Metabolism. 23 (6), 1013-1021 (2016).
- Kumar, R., Gont, A., Perkins, T. J., Hanson, J. E. L., Lorimer, I. A. J. Induction of senescence in primary glioblastoma cells by serum and TGFbeta. Scientific Reports. 7 (1), 2156 (2017).
- Hypoxia Blagosklonny, M. V. MTOR and autophagy: converging on senescence or quiescence. Autophagy. 9 (2), 260-262 (2013).
- Meuter, A., et al. Markers of cellular senescence are elevated in murine blastocysts cultured in vitro: molecular consequences of culture in atmospheric oxygen. Journal of Assisted Reproduction and Genetics. 31 (10), 1259-1267 (2014).
- Coppe, J. P., et al. A human-like senescence-associated secretory phenotype is conserved in mouse cells dependent on physiological oxygen. PLoS One. 5 (2), e9188 (2010).
- van Deursen, J. M. The role of senescent cells in ageing. Nature. 509 (7501), 439-446 (2014).
- Kim, Y. M., et al. Implications of time-series gene expression profiles of replicative senescence. Aging Cell. 12, 622-634 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados