Method Article
Induction et la Validation de la sénescence cellulaire dans les cellules humaines primaires
Dans cet article
Résumé
Ici, nous discutons une série de protocoles pour l’induction et la validation de la sénescence cellulaire dans les cellules cultivées. Nous nous concentrons sur différents stimulus induisant la sénescence et décrire la quantification de marqueurs communs liés à la sénescence. Nous fournissons des détails techniques à l’aide de fibroblastes comme modèle, mais les protocoles peuvent être adaptés aux différents modèles cellulaires.
Résumé
Sénescence cellulaire est un état d’arrêt permanent cycle cellulaire activé en réponse à différents stimuli nocifs. Activation de la sénescence cellulaire est une caractéristique de diverses conditions physiopathologiques, y compris la suppression tumorale, remodelage et le vieillissement des tissus. Les inducteurs de la sénescence cellulaire in vivo sont encore mal caractérisés. Toutefois, un certain nombre de stimuli peut servir à promouvoir la sénescence cellulaire ex vivo. Parmi eux, les plus courantes de sénescence-inducteurs sont réplicative épuisement, ionisant et non ionisant, génotoxique drogues, stress oxydatif et demethylation et agents d’acétylation. Ici, nous fournirons des instructions détaillées sur l’utilisation de ces stimuli pour induire des fibroblastes en sénescence. Ce protocole peut être facilement adapté pour différents types de piles et de lignées cellulaires, y compris les cellules cancéreuses. Nous décrivons également différentes méthodes pour la validation de l’induction de la sénescence. En particulier, nous nous concentrons sur la mesure de l’activité de l’enzyme lysosomale associés à la sénescence β-galactosidase (SA-β-gal), le taux de synthèse de l’ADN à l’aide d’analyse 5-éthynyl-2'-déoxyuridine (EdU), les niveaux d’expression du cycle cellulaire inhibiteurs p16 et p21 et l’expression et la sécrétion des membres de la phénotype sécrétoire Senescence-Associated (SASP). Enfin, nous fournir les résultats de l’exemple et en discuter plus les applications de ces protocoles.
Introduction
En 1961, Hayflick et Moorhead a signalé que les fibroblastes en culture primaires perdent leur potentiel prolifératif après passages successifs1. Ce processus est provoqué par le séquentiel raccourcissement des télomères après chaque division cellulaire. Quand les télomères atteignent une critique courte longueur, ils sont reconnus par la réponse de lésions de l’ADN (DDR) qui active un arrêt irréversible de prolifération — aussi défini comme la sénescence réplicative. La sénescence réplicative est actuellement l’un des nombreux stimuli qui sont connus pour induire un état de l’arrestation de cycle de cellules permanentes qui rend les cellules insensibles aux mitogènes tant des signaux apoptotic2,3. Le programme de sénescence est normalement caractérisé par des fonctionnalités supplémentaires, y compris la forte activité lysosomale, dysfonctionnement mitochondrial, modifications nucléaires, réarrangements de la chromatine, stress du réticulum endoplasmique, dommages à l’ADN et associée à une sénescence phénotype sécrétoire (SASP)3,4. Les cellules sénescentes ont de multiples fonctions dans le corps : développement, wound healing et tumeur suppression2. De même, ils sont connus pour jouer un rôle important dans le vieillissement et, paradoxalement, en progression de tumeur5. Les effets négatifs et partiellement contradictoires, de sénescence sont souvent attribués à la SASP6.
Récemment, il a été démontré qu’élimination des cellules sénescentes de souris conduit à la prolongation de la durée de vie et à l’élimination d’un grand nombre du vieillissement caractéristiques7,8,9,10,11, 12. de la même façon, plusieurs médicaments ont été développés pour soit éliminer les cellules sénescentes (senolytics) ou de cibler les SASP13,14. Le potentiel thérapeutique de l’anti-aging a récemment attiré plus d’attention au champ.
L’étude des mécanismes liés à la sénescence cellulaire et les projections pour les interventions pharmacologiques insistent beaucoup sur les modèles ex vivo , particulièrement sur les fibroblastes humains primaires. Bien qu’il existe certaines caractéristiques communes activés par des inducteurs de sénescence divers, une grande variabilité dans le phénotype de la sénescence est observée et dépend de divers facteurs, notamment la cellule type, stimulation et temps point3,15, 16,17. Il est impératif de tenir compte de l’hétérogénéité pour l’étude et le ciblage des cellules sénescentes. Par conséquent, ce protocole vise à fournir une série de méthodes utilisées pour induire la sénescence dans des fibroblastes de primaires à l’aide de différents traitements. Comme il sera expliqué, les méthodes peuvent facilement être adaptés à d’autres types de cellules.
En dehors de la sénescence réplicative, les auteurs décrivent cinq autres traitements induisant la sénescence : rayonnement ionisant rayonnement, rayonnement ultraviolet (UV), doxorubicine, le stress oxydatif et les changements épigénétiques (à savoir la promotion de l’acétylation des histones ou de déméthylation de l’ADN) . Rayonnements ionisants et rayonnement UV endommager directe de l’ADN et, à la dose appropriée, déclenchent la sénescence18,19. Doxorubicine provoque également la sénescence principalement par le biais de dommages à l’ADN par intercalation dans l’ADN et perturbent la fonction de topoisomérase II et ainsi mettre un terme à l’ADN réparation mécanismes20. L’expression des gènes essentiels à la sénescence est normalement contrôlée par l’acétylation des histones et la méthylation de l’ADN. En conséquence, les inhibiteurs d’histone déacétylase (p. ex., le butyrate de sodium et SAHA) et ADN demethylating (p. ex., 5-aza) agents déclenchent sénescence dans les cellules normales sinon21,22.
Enfin, quatre des marqueurs plus communs associés aux cellules sénescentes sera expliqué : l’activité de la sénescence associés-β-galactosidase (SA-β-gal), taux de synthèse de l’ADN par EdU analyse, la surexpression des régulateurs de cycle cellulaire et p16 inhibiteurs de kinase cycline-dépendante et p21 et surexpression et la sécrétion des membres de la SASP.
Protocole
1. préparation générale
- Préparer D10 milieu. Supplément du moyen-Glutamax DMEM avec 10 % de SVF et 1 % la pénicilline/streptomycine (concentration finale : 100 U/mL).
- Préparer une solution PBS stérile. Dissoudre les comprimés dans de l’eau selon les instructions du fabricant. Stériliser à l’autoclave.
- Préparer la trypsine x 1. Diluer 5 mL de trypsine-Versene EDTA/10 x 01:10 dans 45 mL de PBS stérile.
Remarque : Dans tout le protocole, nous utilisons les conditions de culture cellulaire qui sont plus proches de la physiologique conditions de fibroblastes primaires. Cela signifie que nous Incuber les cellules à 37 ° C et 5 % de CO2 , comme c’est normalement fait, mais en utilisant 5 % O2 au lieu de la « norme » 20 % O2. - Manipuler tous les échantillons dans des conditions stériles en utilisant une hotte à flux laminaire, blouse et gants. Gardez les cellules à 20 % O2 (des conditions ambiantes) seulement tout en étant gérée.
2. l’induction de la sénescence
- Sénescence réplicative
- Lors de la manipulation des cellules ou tout matériel qui sera en contact avec eux (pipettes, flacons, médias, etc.) fonctionnent dans des conditions stériles, en utilisant une hotte à flux laminaire, blouse et des gants. Gardez les cellules à 20 % O2 (des conditions ambiantes) seulement tout en étant gérée.
- Graines de 7 x 105 fibroblastes primaire viable dans une faible population doublement (DP) dans une fiole de T75 (~9.3 x 103 cellules/cm2) contenant 10 mL de D10.
- Cultiver les cellules dans un incubateur à 37 ° C, avec 5 % de CO2 et 5 % O2 à cellule jusqu'à ce qu’ils atteignent 70 – 80 % confluence (3 à 4 jours pour les cultures proliférants dans une DP faible).
- Détacher les cellules à l’aide de 3 mL de 1 x de la trypsine et en incubant pendant ~ 5 – 7 min dans un incubateur de culture cellulaire à 37 ° C, avec 5 % de CO2 et 5 % O2. Surveiller régulièrement les cellules avec un microscope de culture cellulaire pour vérifier le processus de déconnexion.
- Lorsque les cellules sont sphériques, arrêter la réaction de la trypsine en ajoutant 9 mL de D10. Incuber pas plus de 10 min.
- Faire tourner les cellules à 300 g pour 5 min. cellules formeront un culot au fond du tube, alors que les débris et particules plus petites resteront dans le surnageant.
- Retirez le surnageant et dissoudre le culot dans 1 mL de D10 et effectuer un nombre de cellules à l’aide d’un compteur de cellules automatisées selon les instructions du fabricant ou d’une chambre de Neubauer pour le comptage manuel. Lors du décompte, notamment un test afin de vérifier la viabilité des cellules (par exemple, le bleu Trypan exclusion23).
- Calculer la periode cumulative à l’aide de cette formule :
PDnouvelle = 3.32* (LOG(cell number total)-(LOG (nombre de cellules ensemencée)) + PDold
Nombre total de cellules = toutes les cellules comptées : morts ou vivants.
Nombre de graines de cellules = nombre de cellules viables épépiné (8 x 105 cellules).
PDvieux = population doubler au moment de l’ensemencement.
PDnouvelle = population doubler au moment du comptage (après incubation).
Remarque : Si 7 x 10,5 primaires fibroblastes (35,2 PD) ont été ensemencées sur une fiole de T-75 et, après 4 jours, ils atteignent 80 % confluence et sont divisent encore, comptant maintenant 1,3 x 106 cellules total (+ morts vivants).
PDnouvelle = 3.32* (LOG(1,300,000 cells)-LOG(700,000)) + 35,2
PDnouvelle = 36,1 - Réamorcez 8 x 105 cellules dans un nouveau T75, répéter les étapes 2.1.2–2.1.8.
NOTE : Après plusieurs passages consécutifs, la culture prendra plus de temps pour obtenir confluentes, jusqu'à ce que les cellules arrêtent de division du tout. Une fois que les cellules arrêtent de diviser, vérifier pour les marqueurs de sénescence et/ou récolter pour applications en aval. - Considérer que la plus grande taille de cellules sénescentes peut causer la culture s’affichent complet et ont encore une faible de globules. Ainsi, la sénescence peut présumer que lorsque le DP est stable et d’autres marqueurs de sénescence apparaissent dans la culture (voir protocoles 3.1 à 3.5).
Remarque : Utilisez la prolifération des fibroblastes primaires comme contrôle.
- Sénescence induite par le rayonnement ionisant
- Lors de la manipulation des cellules ou tout matériel qui sera en contact avec eux (pipettes, flacons, médias, etc.), travailler dans des conditions stériles en utilisant une hotte à flux laminaire, blouse et gants. Gardez les cellules à 20 % O2 (des conditions ambiantes) seulement tout en étant gérée.
- Graines de 7 x 105 viable primaire fibroblastes dans une faible DP dans une fiole de T75 (~9.3 x 103 cellules/cm2) contenant 10 mL de D10.
- Incuber les cellules pendant la nuit dans un incubateur de culture cellulaire à 37 ° C, avec 5 % de CO2 et 5 % O2.
- Exposer les cellules à 10 gris de l’irradiation gamma conformément aux instructions de la machine en cours d’utilisation.
- Aspirer le milieu des cellules et remplacer par 10 mL de D10.
- Incuber les cellules dans 10 mL de D10 dans un incubateur de culture cellulaire à 37 ° C, avec 5 % de CO2 et 5 % O2 pendant encore 10 jours remplaçant le milieu régulièrement, environ tous les 3 jours.
- Après 10 jours, vérifier pour les marqueurs de sénescence et/ou utiliser les cellules pour les applications en aval.
Remarque : Utilisez la prolifération des fibroblastes primaires le PD même (avant l’irradiation) comme témoin.
- Ultraviolets (UV) radio-induit la sénescence
- Lors de la manipulation des cellules ou tout matériel qui sera en contact avec eux (pipettes, flacons, médias, etc.), travailler dans des conditions stériles en utilisant une hotte à flux laminaire, blouse et gants. Gardez les cellules à 20 % O2 (des conditions ambiantes) seulement tout en étant gérée.
- Semences 1,5 – 2 x 105 viable primaire fibroblastes dans une DP faible dans un puits d’une plaque de 6 puits (de 1,5 à 2,0 x 104 cellules/cm2), ajoutent 2 mL de milieu de D10.
- Placer les cellules dans un incubateur de culture cellulaire à 37 ° C, avec 5 % de CO2 et 5 % O2 et leur permettre d’adhérer au plastique pendant au moins 5 h.
- Décoller le support des cellules. Placer la plaque de 6 puits au milieu de la chambre de rayonnement UV et retirer le couvercle en plastique. Irradier avec UVB, 20 à 30 mJ/cm2.
- Ajouter 2 mL de milieu / puits.
- Incuber les cellules dans 2 mL de D10 dans un incubateur de culture cellulaire à 37 ° C, avec 5 % de CO2 et 5 % O2 pendant encore 7 jours remplaçant le milieu régulièrement, environ tous les 3 jours.
Remarque : Après 7 jours, les cellules peuvent être testés pour les marqueurs de sénescence et utilisés pour des applications en aval. Prolifération des fibroblastes primaires le PD même (avant l’irradiation) servir de contrôle.
- Sénescence induite par la doxorubicine
- Préparer 1 000 x solution stock de doxorubicine : faire un stock de 250 µM de la doxorubicine dans du PBS 1 x, filtre-stériliser la solution et l’aliquote dans 500 µL par tube stérile. Magasin le stock de doxorubicine à-80 ° C.
- Lors de la manipulation des cellules ou tout matériel qui sera en contact avec eux (pipettes, flacons, médias, etc.), travailler dans des conditions stériles en utilisant une hotte à flux laminaire, blouse et gants. Gardez les cellules à 20 % O2 (des conditions ambiantes) seulement tout en étant gérée.
- Graines de 7 x 105 viable primaire fibroblastes dans une faible DP dans une fiole de T75 (~9.3 x 103 cellules/cm2) contenant 10 mL de D10.
- Incuber les cellules pendant la nuit dans un incubateur de culture cellulaire à 37 ° C, avec 5 % de CO2 et 5 % O2.
- Diluer 11 µL des 1000 x solution doxorubicine dans 11 mL de D10 à une concentration finale de 250 nM.
- Aspirer le milieu des cellules et remplacer par 10 mL de D10 + doxorubicine.
- Incuber les cellules pendant exactement 24 h dans un incubateur de culture cellulaire à 37 ° C, avec 5 % de CO2 et 5 % O2.
- Aspirer le milieu des cellules et se laver soigneusement une fois avec 10 mL de D10.
- Incuber les cellules dans 10 mL de D10 pour un autre 6 jours remplaçant le milieu régulièrement, environ tous les 3 jours.
- Au jour 7, vérifier pour les marqueurs de sénescence et/ou utiliser pour des applications en aval.
NOTE : dans le contrôle, utilisation, prolifération des fibroblastes primaires le même parkinsoniens traités pendant 24 h avec véhicule (PBS) 1 : 1 000 D10.
- Sénescence induite par le Stress oxydative
- Lors de la manipulation des cellules ou tout matériel qui sera en contact avec eux (pipettes, flacons, médias, etc.) fonctionnent dans des conditions stériles en utilisant une hotte à flux laminaire, blouse et des gants. Gardez les cellules à 20 % O2 (des conditions ambiantes) seulement tout en étant gérée.
- Graines de 7 x 105 viable primaire fibroblastes dans une faible DP dans une fiole de T75 (~9.3 x 103 cellules/cm2) contenant 10 mL de D10.
- Incuber les cellules pendant la nuit dans un incubateur à cellules à 37 ° C, avec 5 % de CO2 et 5 % O2.
- Préparer une solution de ~ 200 μM de peroxyde d’hydrogène dans un milieu D10 en ajoutant 22,6 μL de peroxyde d’hydrogène 30 % dans 11 mL de D10.
NOTE : Optimiser le traitement pour le type de cellule d’intérêt en faisant une courbe dose-réponse pour évaluer la toxicité. - Aspirer le milieu des cellules et ajouter 10 mL de fraîchement préparée D10 moyen + peroxyde d’hydrogène. Incuber pendant 2 h à 37 ° C, avec 5 % de CO2 et 5 % O2.
- Aspirer le milieu des cellules et laver une fois frais D10 sans peroxyde d’hydrogène.
- Ajouter 10 mL de D10 sans peroxyde d’hydrogène.
- Incuber pendant 48 h dans un incubateur de culture cellulaire à 37 ° C, avec 5 % de CO2 et 5 % O2.
- Répétez les étapes 2.5.4–2.5.8 deux fois plus pour un total de trois traitements.
- Recherchez les marqueurs de sénescence ou la récolte pour les applications en aval.
Remarque : Que de contrôle, les cellules en prolifération utilisation le PD même traités avec 22,6 µL d’eau stérile en D10 pendant 2 h.
- Épigénétiques induites par la sénescence
- Préparer le stock et les solutions de travail pour les petites molécules à utiliser selon le tableau 1. Filtre-stériliser les solutions. Aliquote dans des tubes stériles. Conserver à-20 ° C.
- Lors de la manipulation des cellules ou tout matériel qui sera en contact avec eux (pipettes, flacons, médias, etc.) fonctionnent dans des conditions stériles, par exemple, en utilisant une hotte à flux laminaire, blouse et des gants. Gardez les cellules à 20 % O2 (des conditions ambiantes) seulement tout en étant gérée.
- Graines de 7 x 105 viable primaire fibroblastes dans une faible DP dans une fiole de T75 (~9.3 x 103 cellules/cm2) contenant 10 mL de D10.
- Incuber les cellules pendant la nuit dans un incubateur de culture cellulaire à 37 ° C, avec 5 % de CO2 et 5 % O2.
- Préparer 11 mL de milieu de D10 + solution de travail pour le traitement souhaité. La dilution exacte par le traitement peut être vu dans le tableau 1.
- Préparer 11 µL de solution de travail de SAHA de 1 mM à 11 mL de D10.
- Préparer les 44 µL de solution de travail de butyrate de sodium de 1 M dans 11 mL de D10.
- Préparer 11 µL de solution de travail 5-aza de 10 mM à 11 mL de D10.
Remarque : Optimiser les traitements pour le type de cellule d’intérêt, par exemple, en faisant une courbe dose-réponse pour évaluer la toxicité.
- Ajouter moyen D10 + solution de travail pour le traitement souhaité à la culture.
- Incuber pendant 24 h dans un incubateur de culture cellulaire à 37 ° C, avec 5 % de CO2 et 5 % O2.
- Répétez les étapes 2.6.4–2.6.6 deux fois plus, pour un total de trois traitements.
- Moyen de changement pour D10 simple sans drogue.
- Après 3 jours de plus, les cellules deviennent sénescentes et prêt pour le test des marqueurs de sénescence et applications en aval.
NOTE : dans le contrôle, utilisation, prolifération des fibroblastes primaires le PD même traitée pendant trois jours avec D10 moyen + véhicule. Le D10 moyen + véhicule doit être actualisé toutes les 24 h durant ces trois jours. Le véhicule repose sur le traitement utilisé : 1 : 1 000 DMSO pour SAHA et aza-5 et 1/250 eau stérile pour le Butyrate de Sodium.
3. les marqueurs de sénescence
- Préparation
- Préparation de 20 mg/mL X-gal : dissoudre 20 mg de X-gal dans 1 mL de diméthylformamide ou le DMSO. Conserver à-20 ° C, abri de la lumière.
- Préparer la solution 0,1 M d’acide citrique : dissoudre 2,1 g d’acide citrique pur monohydraté dans 100 mL d’eau. Conserver à température ambiante.
- Préparer une solution de phosphate de sodium 0,2 M : dissoudre 2,84 g de phosphate dibasique de sodium ou de 3,56 g de phosphate dibasique de sodium déshydrater dans 100 mL d’eau. Conserver à température ambiante.
- Préparer les 0,2 M citrique acide/base phosphate pH 6.0 : dissoudre 36,85 mL de solution d’acide citrique 0,1 M et 63,15 mL de phosphate de sodium 0,2 M. Réduire/agrandir exactement à pH 6.0. Conserver à température ambiante.
- Préparer le ferrocyanure de potassium 100 mM : dissoudre 2,1 g de ferrocyanure de potassium dans 50 mL d’eau. Conserver à 4 ° C, abri de la lumière.
- Préparer le ferricyanure de potassium 100 mM : dissoudre 1,7 g de ferrocyanure de potassium dans 50 mL d’eau. Conserver à 4 ° C, abri de la lumière.
- Préparer les 5 M de chlorure de sodium : dissoudre 14,6 g de chlorure de sodium dans 50 mL d’eau. Conserver à température ambiante.
- Préparer le chlorure de magnésium 1 M : dissoudre 4,8 g de chlorure de magnésium dans 50 mL d’eau. Conserver à température ambiante.
- Préparer les 2 % de formaldéhyde + 0,2 % de glutaraldéhyde dans du PBS : dissoudre 800 µL de glutaraldéhyde 25 % et de 12,5 µL de 16 % de formaldéhyde dans 100 μl de PBS. Conserver à température ambiante, abrie de la lumière.
- Préparer la solution colorante frais selon tableau 2.
- Coloration de la β-galactosidase associée à la sénescence
- Pour chaque échantillon, graines 1 x 104 cellules dans au moins un puits d’une plaque 24 puits (5.2 x 103 cellules/cm2) contenant 500 µL de D10 afin que les cellules sont rares. Traitements (le cas échéant) peuvent être effectuées directement sur cette plaque, ou, les cellules traitées déjà peuvent également être ré-ensemencés dans une plaque de 24 puits.
- Incuber les cellules pendant la nuit à 37 ° C, avec 5 % de CO2 et 5 % O2.
- Laver les cellules deux fois avec 500 μl de PBS.
- Difficulté 3 à 5 min à température ambiante à l’aide de 500 μL/puits de formaldéhyde 2 % + 0,2 % de glutaraldéhyde dans du PBS.
- Laver les cellules deux fois avec 500 μl de PBS.
- Préparer les frais coloration solution, selon le nombre d’échantillons sur la tache.
- Ajouter la solution colorante (500 µL/puits) et sceller la plaque avec du parafilm pour éviter l’évaporation.
NOTE : Évaporation peut causer des cristaux de forme et gênent l’observation au microscope. - Incuber les cellules dans l’obscurité (p. ex. couvert de papier d’aluminium) à 37 ° C dans une étuve sèche (sans CO2) pendant 12 à 16 h.
Remarque : CO2 peuvent influer sur le pH et donc modifier les résultats. Certains types de cellules peuvent exiger des temps d’incubation plus courtes. - Laver deux fois avec 500 μl de PBS.
- Évaluer les résultats. Les cellules positives présentent un bleu (pour la plupart) périnucléaire coloration sous un microscope à lumière normal (Figure 1 a).
- Pour la quantification, observer au moins 100 cellules par exemple et de dénombrer les cellules positives. Puisque les cellules sénescentes modifie la forme, il est souvent difficile de définir les limites d’une cellule et de compter les cellules. Contre-coloration au DAPI pour faciliter la visualisation et la quantification des cellules individuelles (Figure 1 b). Quantifier les échantillons (pourcentage de cellules positives par rapport à un montant total de cellules) à l’aide d’un microscope à fluorescence (Figure 1). Prendre plusieurs photos du même échantillon afin qu’à la fin, vous pouvez compter au moins 100 single-cellules et évaluer le pourcentage de cellules positives SA-β-gal en eux.
- Comparer les résultats des cellules sénescentes contre leur contrôle approprié pour le traitement utilisé.
Remarque : Une coloration conjointement avec EdU sur le même échantillon est possible. Considérer que les cellules devraient ensuite être semées sur lamelles couvre-objet.
- Analyse EdU
- Mettre un lamelle couvre-objet/puits dans une plaque 24 puits selon le nombre d’échantillons à évaluer.
- Graines de 1 x 104 cellules dans au moins un puits d’une plaque de 24 puits (5.2 x 103 cellules/cm2) par condition contenant 500 µL de D10 afin que les cellules sont rares. Traitements (le cas échéant) peuvent être effectuées directement sur cette plaque ou cellules déjà traitées peuvent également être ré-ensemencés dans une plaque de 24 puits.
- Incuber les cellules pendant la nuit à 37 ° C, avec 5 % de CO2 et 5 % O2.
- Préparer une solution de 20 µM de EdU D10 (1/250) selon le nombre d’échantillons à traiter (250 μL / échantillon).
- Retirer la moitié de la moyenne (250 μL) de chaque puits pour traiter et remplacez-la par la D10 + EdU solution préparée juste. Concentration finale de EdU est 10 µM.
- Incuber 18-24h dans un incubateur de culture cellulaire à 37 ° C, avec 5 % de CO2 et 5 % d’O2. Utilisez le même temps d’incubation dans le contrôle et les cellules sénescentes.
- Laver 2 x avec 500 μl de PBS.
- Fixer les cellules pendant 10 min avec 500 μL de 4 % de formaldéhyde dans du PBS.
- Incuber 5 min à 500 μL de 100 mM Tris (pH 7,6).
- Permeabilize les cellules pendant 10 min à 500 μL de 0,1 % Triton X-100 dans du PBS.
- Laver 3 fois avec du PBS.
- Préparer 50 μL de mélange d’étiquette pour chaque lamelle, en ajoutant les composants dans l’ordre suivant : 44,45 µL de PBS, 0,5 µL du Cu (II) SO4, 0,05 µL de sulfo-Cy3-azide, 5 µL d’ascorbate de sodium.
- Mettre 50 μL de la combinaison de label sur un morceau de parafilm. Soulevez la lamelle à l’aide d’une paire de pinces à épiler et une aiguille et laissez-la reposer sur le dessus de la composition de l’étiquette avec la surface contenant les cellules vers le bas. S’assurer qu’il n’y a pas de bulles et que toute la surface de la lamelle est en contact avec le mélange de l’étiquette. Incuber 30 min à l’obscurité.
- Remettre les cellules dans les puits de la plaque 24 puits et laver trois fois avec du PBS.
- Monter avec montage des médias (y compris le DAPI pour visualiser les noyaux) sur lames de verre et laissez-les sécher pendant la nuit.
- Visualiser l’incorporation de EdU à l’aide d’un microscope à fluorescence. Utiliser un filtre approprié pour Cy3 (excitation/émission : 552/570 nm).
- Prenez plusieurs photos des cellules pour la quantification ultérieure d’au moins 100 cellules par État (Cy3 et DAPI).
- Quantifier le pourcentage de cellules incorporé EdU en utilisant la formule suivante :
EdU cellules positives (%) = (nombre d’éléments positifs de EdU (Cy3) / nombre total de globules (DAPI)) * 100 - Comparer les résultats des cellules sénescentes contre leur contrôle approprié pour le traitement utilisé.
Remarque : Une coloration conjointement avec SA-β-gal sur le même échantillon est possible. Considérer que les cellules devraient toujours être semées sur les lamelles.
- Expression des gènes de p16, p21 et SASP
- Préparer les amorces des gènes d’intérêt (amorce de 50 µM de chaque).
Remarque : Un qPCR de p16, p21 et certains facteurs pertinents de la SASP est informatif de l’état de sénescence. Le protocole décrit ici fait utilisent le système de bibliothèque de sonde universelle (UPL) pour la quantification relative à l’aide d’une PCR en temps réel. Le tableau 3 présente un aperçu des amorces utilisées pour la détection des CDK inhibiteurs p16 et p21 et des membres SASP plus pertinents, ainsi que pour la tubuline et l’actine, qui servent de gènes de référence pour le dosage. La dernière colonne du tableau 3 s’inscrit la sonde UPL particulière à utiliser pour chaque dosage. - Préparer mélange réactionnel de qPCR distinct pour les dosages désirées. Incluez toujours le gène de référence aussi bien selon le tableau 4.
- Exécutez tous les échantillons en double ou triple exemplaire.
- Charge 7,5 µL/puits du mélange sur une plaque 384 puits réaction qPCR.
- Ajouter ~ 5 ng de l’ADNc dissous dans 2,5 µL d’eau exempte de RNase.
Remarque : Il est préférable d’avoir des quantités similaires de cDNA de tous les échantillons à comparer. Ceci peut être réalisé en utilisant des quantités égales d’ARN pour la transcriptase inverse. - Couvrir la plaque avec un sceau et s’assurer qu’il colle correctement couvrant uniformément tous les puits de la plaque.
- Faites tourner la plaque à 2 000 x g pendant 1 min.
- Exécuter la plaque dans le Lightcycler pendant 40 cycles en utilisant le protocole suivant :
95 ° C pendant 7 min
40 cycles de 95 ° C pour 5 s et 60 ° C pendant 30 s
37 ° C pendant 1 min - Pour l’analyse des résultats, utilisez la méthode proposée pour Livak et ses collègues pour analyser qPCR données24. Utiliser la tubuline ou actine comme gènes de référence pour calculer la ΔCt valeur et utilisent le contrôle approprié pour calculer la pour la valeur de ΔΔCt pour le traitement spécifique induisant la sénescence.
- Préparer les amorces des gènes d’intérêt (amorce de 50 µM de chaque).
- Expression des protéines et la sécrétion d’IL6
- Semences 5-10 x 104 cellules dans au moins un puits d’une plaque de 6 puits (5.2 – 10,5 x 103 cellules/cm2) par condition contenant 2 mL de D10. Traitements (le cas échéant) peuvent être effectuées directement sur cette plaque, ou, les cellules traitées déjà peuvent également être ré-ensemencés dans une plaque de 24 puits. Laissez reposer toute la nuit après l’ensemencement.
- Enlever le support et le remplacer pour 2 mL de DMEM moyen sans FBS. Incuber dans des conditions normales pendant 24 h.
- Recueillir le milieu dans un tube de 15 mL.
- Centrifuger l’échantillon à 300 x g pendant 5 min moyenne peut être stockée à-80 ° C jusqu'à ce que les traités.
- Suivez les instructions du fabricant pour effectuer le test ELISA.
- Comparer les résultats des cellules sénescentes versus le contrôle approprié pour le traitement spécifique induisant la sénescence
Résultats
Enrichissement de SA-β-gal de coloration dans les fibroblastes sénescents
Β-galactosidase (β-gal) est une enzyme lysosomiale qui s’exprime dans toutes les cellules et qui a un pH optimum de 4,025,26. Cependant, au cours de la sénescence, les lysosomes augmentent en taille et, par conséquent, les cellules sénescentes accumulent β-gal. Les quantités accrues de cette enzyme permettent de détecter son activité même à un sous-optimale pH 6,025,27. Figure 1 a montre des images représentatives de la coloration de SA-β-gal en proliférant versus les fibroblastes sénescents primaires. Cellules semblent aussi élargie et avec un corps cellulaire irrégulière. Comme mentionné, il peut être difficile de distinguer les cellules individuelles, pour qu’un co marquage au DAPI facilite la visualisation et la cellule de comptage (Figure 1 b). Il est nécessaire de prendre des photos dans un microscope à fluorescence pour pouvoir observer la coloration DAPI. Cela signifie que des photos sur le canal de champ lumineux seront prises en noir et blanc, afin que la coloration « bleu » de la SA-β-gal apparaîtra en noire sur les photos. Noter, pas toutes les cellules au sein d’un échantillon sont positifs pour le β-gal. L’efficacité de l’induction de la sénescence est fortement tributaire de la relance - et cellule type/souche utilisée. Les protocoles décrits ici ont donné > 50 % β-gal cellules positives dans les fibroblastes primaires (BJ et WI-38) dans nos mains.
Moins de cellules incorporent EdU après l’induction de la sénescence
EdU est un analogue de la thymidine nucléoside qui, au cours de la synthèse de l’ADN active, est incorporée dans l’ADN de28. L’incorporation de l’Education dans l’ADN peut être visualisée après avoir effectué la cycloaddition Copper-Catalyzed azoture-alcyne (CuAAC) à l’UDE, réaction qui ne peut être effectuée en thymidine ordinaire parce qu’il manque l’alcyne groupe28. Dans ce protocole particulier, un Sulfo-Cy3-azoture est utilisé. Si l’accouplement de l’azoture de l’alcyne a eu lieu, les cellules seront affiche fluorescence sous un filtre Cy3 (Figure 2 a). Il est important de tenir compte du fait que les cellules qui sont multiplient en effectuant l’analyse EdU, se distingués des cellules non-proliférantes. Les cellules non-proliférantes peuvent être soit quiescent ou sénescent, sens que l’analyse EdU ne peuvent pas distinguer entre ces deux types d’arrêt du cycle cellulaire.
Réguler positivement les fibroblastes sénescent le CDK inhibiteurs p16 et p21
Les cellules sénescentes faire utiliser des inhibiteurs de la cdk2 pour arrêter le cycle cellulaire29. Particulièrement p16 et p21 sont souvent mesurés comme des marqueurs de cellules sénescentes3. Une ou les deux marqueurs sont normalement surexprimés dans les cellules sénescentes, et la stimulation de l’expression est souvent mesurée au niveau transcriptionnel. Il est recommandé d’utiliser les deux marqueurs simultanément puisque certaines cellules ne pas réguler positivement p16 au niveau transcriptionnel et p21 est un marqueur universel mais non spécifique de sénescence15,17,30. La figure 3 illustre représentant quantitatives relatives de p16 et p21 ARNm dans les fibroblastes amenées à la sénescence. Autres techniques telles que l’immunomarquage et/ou western blot pour détecter des concentrations en protéines sont également possibles.
Les fibroblastes sénescents affichent une SASP
Les cellules sénescentes plus transcriptionnellement réguler positivement plusieurs gènes codant pour sécrétée des protéines, un phénomène appelé SASP6. La SASP inclut des facteurs impliqués dans l’inflammation, par exemple, interleukines et chimiokines, ou dégradation de la matrice extracellulaire (ECM), par exemple, MMP, mais c’est très hétérogène. Induction des facteurs de la SASP peut être évaluée en mesurant les niveaux d’expression ARNm via qPCR ou niveaux de protéine sécrétée par enzyme-linked Immuno Sorbent Assay (ELISA). La figure 4 montre une image représentative montrant l’upregulation de IL6 tant au niveau transcriptionnel et sécrété. Nous avons utilisé IL6 uniquement comme une représentation ; Toutefois, il est encouragé à mesurer plusieurs membres de la SASP depuis la liste suggérée sur protocole 3.4.
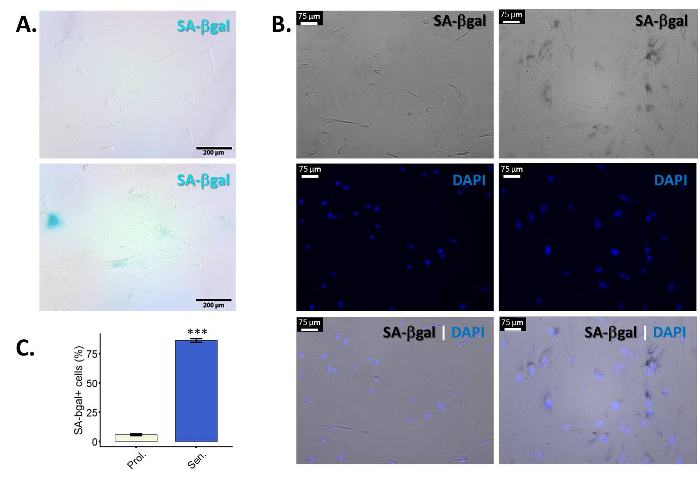
Figure 1 : enrichissement des SA-β-gal de coloration dans les fibroblastes sénescents primaires. Les fibroblastes de prépuce primaire BJ (PD 34.1) ont été amenées à la sénescence en les exposant à des rayonnements ionisants (10 Gy). Les cellules ont été colorés pour SA-βgal dix jours après l’irradiation. (A) les résultats représentatifs pour la coloration de SA-βgal dans les fibroblastes primaires BJ, soit non traitées (vers le haut) ou exposés à des rayonnements ionisants (en bas). Grossissement final : 100 X. (B) figure représentative de SA-β-gal co colorées au DAPI pour fibroblastes primaires BJ soit non traités (trois panneaux de gauche) ou exposés à des rayonnements ionisants (trois panneaux de droite). Le DAPI (bleu) la coloration permet de visualiser les cellules individuelles, faciliter la quantification. Photos prises sur le vif-champ apparaissent en noir/blanc. Par conséquent, dans ces photos notamment le SA-β-gal coloration ressemblera à taches noires périnucléaire. Grossissement final : 100 X. (C) Quantification des SA-β-gal positives cellules en prolifération (Prol., blanc) fibroblastes BJ contre ionisant homologues traités irradiés (Sen, bleu). Quantification a été réalisée à l’aide de trois réplicats biologiques avec des barres d’erreur indiquant l’erreur-type de la moyenne. Signification statistique a été déterminée par t-test un non-appariés à deux points de l’étudiant sur les valeurs de delta-CT. (n = 3, ± SEM, *** = valeur p < 0,01). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
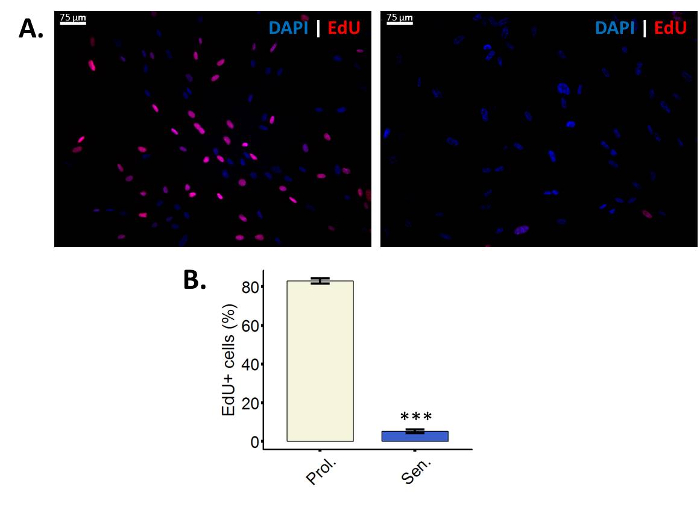
Figure 2 : moins de cellules incorporent EdU après l’induction de la sénescence. (A) image représentative de l’essai d’incorporation EdU en proliférants fibroblastes WI-38 43,86 PD (à gauche) et leurs homologues irradiés ionisantes (à droite). Grossissement final : 100 X. (B) Quantification de EdU positives cellules en prolifération (Prol., blanc) fibroblastes BJ (PD 38,7) par rapport à leurs homologues irradiés (Sen, bleu). Quantification a été réalisée à l’aide de trois réplicats biologiques avec des barres d’erreur indiquant l’erreur-type de la moyenne. Signification statistique a été déterminée par t-test un non-appariés à deux points de l’étudiant sur les valeurs de delta-CT (n = 3, ± SEM, *** = valeur p < 0,01). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
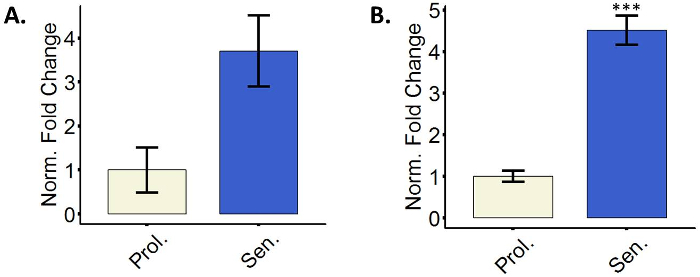
Figure 3 : les fibroblastes sénescents réguler positivement le CDK inhibiteurs p16 et p21. (A) Quantification de l’expression de l’ARNm p16 en prolifération (Prol., blanc, DP 35,3) ou cellules BJ 5-aza-traitées (Sen, bleu). (B) Quantification de l’expression de l’ARNm p21 en prolifération (Prol., blanc, DP 35,3) ou traités à la 5-aza BJ cellules (Sen, bleu). Quantification a été réalisée à l’aide de trois réplicats biologiques (chacune avec deux techniques réplique) avec des barres d’erreur indiquant l’erreur-type de la moyenne. Signification statistique a été déterminée par t-test un non-appariés à deux points de l’étudiant sur les valeurs de delta-CT (n = 3, ± SEM, *** = p valeur < 0,01). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
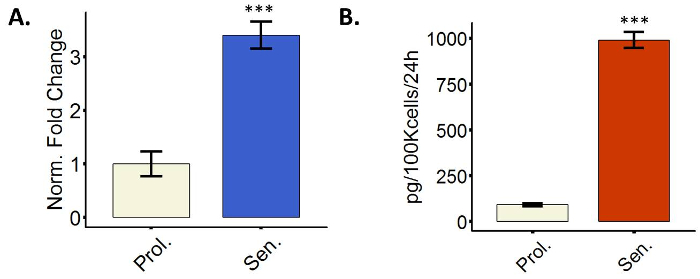
Figure 4 : les fibroblastes sénescents affichent un phénotype sécrétoire (SASP). (A), à la Quantification de l’IL6 mRNA expression dans les fibroblastes BJ soit prolifèrent (Prol., blanc, PD 38,7) ou induites à la sénescence par rayonnement ionisant (Sen, bleu). (B) la Quantification de l’expression de protéines IL6 en proliférant PD 38,6 (Prol., blanc) ou imprégnées sur les rayonnements ionisants WI38 fibroblastes (Sen, bleu). Quantification a été réalisée à l’aide de trois réplicats biologiques avec des barres d’erreur indiquant l’erreur-type de la moyenne. Dans le cas des données de qPCR, chaque réplicat biologique avait deux doublons techniques. Signification statistique a été déterminée par t-test un non-appariés à deux points de l’étudiant sur les valeurs de delta-CT (n = 3, ± SEM, *** = valeurp < 0,01). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Diluant | Solution mère | Solution de travail | Dilution pour traitement | Concentration finale | |
| SAHA | DMSO | 100 mM | 1 mM | 1 : 1 000 | 1 ΜM |
| Butyrate de sodium | Eau stérile | --- | 1 M | 1/250 | 4 mM |
| 5-aza-2'-désoxycytidine (5-aza) | DMSO | 100 mM | 10 mM | 1 : 1 000 | 10 ΜM |
Tableau 1 : Stock et des Solutions de travail pour les différents traitements utilisés pour épigénétiques induites par la sénescence.
| Composant | Volume | Concentration finale |
| 20 mg/mL X-gal | 1 mL | 1 mg/mL |
| 0,2 M acide citrique/sodium, tampon phosphate ph 6.0 | 4 mL | 40 mM |
| ferrocyanure de potassium 100 mM | 1 mL | 5 mM |
| ferricyanure de potassium 100 mM | 1 mL | 5 mM |
| Chlorure de sodium 5 M | 0,6 mL | 150 mM |
| Chlorure de magnésium 1 M | 0,04 mL | 2 mM |
| Eau | 12,4 mL | - |
| Total | 20 mL |
Tableau 2 : Composition de la Solution de coloration utilisée pour la sénescence associés (SA) - β - gal de coloration.
| Objectif | Avant l’amorce (5' -> 3') | Reverse Primer (5' -> 3') | Sonde de l’UPL | ||
| Tubuline | CTTCGTCTCCGCCATCAG | CGTGTTCCAGGCAGTAGAGC | #40 | ||
| Actine B | ccaaccgcgagaagatga | ccagaggcgtacagggatag | #64 | ||
| P16 | GAGCAGCATGGAGCCTTC | CGTAACTATTCGGTGCGTTG | #67 | ||
| P21 | tcactgtcttgtacccttgtgc | ggcgtttggagtggtagaaa | #32 | ||
| IL6 | CAGGAGCCCAGCTATGAACT | GAAGGCAGCAGGCAACAC | #45 | ||
| IL8 | GAGCACTCCATAAGGCACAAA | ATGGTTCCTTCCGGTGGT | #72 | ||
| Il1a | GGTTGAGTTTAAGCCAATCCA | TGCTGACCTAGGCTTGATGA | #6 | ||
| CXCL1 | CATCGAAAAGATGCTGAACAGT | ATAAGGGCAGGGCCTCCT | #83 | ||
| CXCL10 | GAAAGCAGTTAGCAAGGAAAGGT | GACATATACTCCATGTAGGGAAGTGA | #34 | ||
| CCL2 | AGTCTCTGCCGCCCTTCT | GTGACTGGGGCATTGATTG | #40 | ||
| CCL20 | GCTGCTTTGATGTCAGTGCT | GCAGTCAAAGTTGCTTGCTG | #39 | ||
| PAI1 | AAGGCACCTCTGAGAACTTCA | CCCAGGACTAGGCAGGTG | #19 | ||
| MMP1 | GCTAACCTTTGATGCTATAACTACGA | TTTGTGCGCATGTAGAATCTG | #7 | ||
| MMP3 | CCAGGTGTGGAGTTCCTGAT | CATCTTTTGGCAAATCTGGTG | #72 | ||
| MMP9 | GAACCAATCTCACCGACAGG | GCCACCCGAGTGTAACCATA | #53 | ||
Tableau 3 : Séquences d’amorces et leur sonde UPL correspondante pour la détection des ARNm des marqueurs de sénescence dans les échantillons d’origine humaine.
| Composant | Volume/échantillon |
| Mélange de Sensifast la sonde Lo-Rox | 5 ΜL |
| D’amorces (50 µM) | 0.1 ΜL |
| Sonde de l’UPL | 0.1 ΜL |
| Eau exempte de nucléase | 2.3 ΜL |
| ADNc (~ 4 ng) | 2,5 ΜL |
| Total | 7,5 ΜL |
Tableau 4 : Composition de la réaction de qPCR mix pour le système de l’UPL.
Discussion
Les protocoles expliqués ici ont été optimisées pour des fibroblastes humains primaires, en particulier les cellules BJ et WI-38. Les protocoles pour la sénescence réplicative, rayonnements ionisants et la doxorubicine, ont été appliquées avec succès à d’autres types de fibroblastes (HCA2 et IMR90) et dans d’autres types de cellules (à savoir néonatales mélanocytes et kératinocytes ou cardiomyocytes dérivés iPSC) dans notre laboratoire. Toutefois, des adaptations pour les types de cellules supplémentaires peuvent être optimisées en ajustant certains détails comme le nombre de cellules ensemencées, les méthodes et les produits chimiques pour aider les cellules pour y attacher/détacher pour supports plastiques et la posologie du traitement pour éviter la toxicité.
Même l’utilisation de fibroblastes primaires pose un certain nombre de défis. Les cellules sénescentes sont généralement plus difficiles à détacher que leurs homologues prolifèrent, et ils sont souvent plus sensibles à la trypsinisation ou tout autre type de détacher la méthode, ce qui signifie que la viabilité après avoir détaché est légèrement inférieure à celle de cellules en prolifération. Le choix du contrôle approprié aux différentes méthodes induisant la sénescence est difficile. Par exemple, pour les traitements médicamenteux comme la doxorubicine, nous vous proposons un traitement court avec le véhicule : PBS pendant 24 h pour les échantillons de contrôle pour les cellules traités à la doxorubicine suivie de récolte/transformation immédiate. On pourrait prétendre qu’induites à la sénescence des cellules passent par un temps de culture prolongée après que le traitement a été appliqué (six jours supplémentaires de culture pour cellules traités à la doxorubicine) et d’hématies cultivée quantité égale de temps après le retrait de PBS. Toutefois, une telle culture longue permettrait les cellules à diviser davantage, à devenir trop anastomosé ou d’exiger davantage de passage et pour augmenter PD. confluent excessive peut causer des marqueurs de sénescence, comme SA-β-gal à comparaître malgré le maintien des cellules leur prolifération de potentiels31. Le parti démocrate accru serait amener plus près à leur limite de réplication (et à la sénescence réplicative) et les rendre moins comparables à leurs homologues traités à la doxorubicine. Une situation similaire s’applique pour les autres traitements. Nous avons proposé les contrôles que nous considérons comme le plus appropriés pour chaque cas.
La plupart des techniques utilisées pour induire les cellules en sénescence semblent relativement simple et directe, mais plusieurs facteurs peuvent influencer le résultat des expériences. Par exemple, la concentration de glucose normal de milieux de culture cellulaire conventionnel pour les fibroblastes est 4,5 g/L. Cependant, pour certains types de cellules comme les cellules souches, des concentrations plus faibles de glucose s’étendent leur potentiel prolifératif32, tandis que pour d’autres la sénescence prématurée33peuvent entraîner des concentrations plus élevées. En outre, les cellules sénescentes sont hautement métaboliques et dépensent des quantités élevées d’énergie pour produire des facteurs sécrétés34, autres phénotypes associés à la sénescence pourraient affectés par l’oscillations de concentrations de glucose.
Une autre variable potentielle dans le milieu de culture cellulaire est le sérum. La composition du sérum n’est normalement pas définie et varie en fonction de la source animale et le lot. En particulier, la quantité de facteurs de croissance et de protéines pro-inflammatoires peut influencer la sénescence35. Nous recommandons que le même lot de sérum est utilisé pour l’expérience entière afin d’éviter d’inutile et confondant de variabilité. Pourtant, certaines conditions techniques inévitables comme l’utilisation d’un milieu sans sérum utilisé pour certains protocoles par ELISA peuvent réduire l’expression de la SASP.
Tension en oxygène est importante pour l’induction de la sénescence complète. L’hypoxie peut inhiber geroconversion, afin que les cellules ne prolifèrent pas mais ne sont pas irréversiblement arrêté36. Toutefois, le problème le plus fréquent dans le montage expérimental n’est pas une hypoxie mais hyperoxie. En effet, les conditions de culture standard utilisent souvent les 20 % d’oxygène comme « normoxie », mais conditions physiologiques pour la plupart des types de cellules sont plus faibles. Les blastocystes de souris présentent des marqueurs de sénescence (dommage SA-βgal et ADN) lorsqu’il est cultivé à 20 % d’oxygène, contrairement à leur en vivo-dérivés homologues ou les mêmes cellules cultivées à 5 % d’oxygène37. En outre, les fibroblastes de souris cultivées dans des conditions physiologiques plus (3 % d’oxygène) et non à affichage conventionnel ones (20 % d’oxygène) une SASP38. Ici, nous avons utilisé 5 % d’oxygène pour toutes les cultures et expériences et nous invite les chercheurs à reconsidérer les concentrations d’oxygène utilisées pour le type de cellule spécifique d’intérêt.
Enfin, un autre facteur à considérer est l’hétérogénéité intrinsèque des cellules sénescentes. D’une part, les différents types de cellules et même de cellules souches présentent des différences dans les phénotypes associés à la sénescence. Par exemple, certaines souches de fibroblastes ne font pas réguler positivement p16 au niveau transcriptionnel à la sénescence induction15,16,17, comme il est illustré à la Figure 3 a, où malgré le voyant une upregulation de p16, ce n’était pas statistiquement significatif. P16 est également contrôlée au niveau traductionnel et poteau-de translation, afin de mesurer les niveaux de la protéine pourrait dans certains cas démontrer une augmentation de l’activité de cet inhibiteur CDK. Toutefois, il peut être que certaines cellules simplement comptent sur les autres inhibiteurs CDK comme p21. Il est recommandé de mesurer les niveaux de transcription des deux d'entre eux. La composition exacte de la SASP dépend également de la cellule qui le produit3. En outre, certaines cellules expriment constitutivement des niveaux élevés de β-galactosidase, donnant un résultat positif pour une coloration qui n’est pas nécessairement indicative de sénescence3SA-β-gal. Dans certains cas, ce problème peut être surmonté en réduisant le temps d’incubation avec solution colorante pendant le protocole de coloration SA-β-gal. Comme mentionné, cellules anastomosé excessive peuvent également tacher avec le SA-β-gal sans eux être sénescentes31, donc nous demandons aux chercheurs de cellules de culture de faible densité permettant d’effectuer cette coloration. En revanche, le phénotype de sénescence lui-même n’est pas stable39. La composition de la SASP et l’apparition d’autres marqueurs de sénescence sont dépendantes du temps17,40. Ici, nous avons proposé les points dans le temps après chaque traitement dans lesquels les cellules sont considérés comme entièrement sénescentes et qui sont habituellement utilisées par notre laboratoire. Ce qui est important, marqueurs à un court moment de mesure susceptibles de rendre des résultats négatifs à cause de la sénescence incomplète40. En outre, étant donné que dans la plupart des traitements un pourcentage de cellules ne deviennent sénescentes, à l’aide d’un point de temps plus longs pourrait donner suffisamment de temps pour les quelques cellules non sénescentes élargir et dépasser la culture, en réduisant l’expression des marqueurs de sénescence. Vues de l’hétérogénéité des cellules sénescentes et les multiples mises en garde des marqueurs différents, nous recommandons aux chercheurs d’utiliser des marqueurs de sénescence multiples au sein d’un même échantillon.
Déclarations de divulgation
N/A
Remerciements
Nous remercions les membres du laboratoire Demaria pour des discussions fructueuses et Thijmen van Vliet pour le partage de données et protocole sur la sénescence induite par l’UV.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM Media - GlutaMAX | Gibco | 31966-047 | |
| Fetal Bovine Serum | Hyclone | SV30160.03 | |
| Penicillin-Streptomycin (P/S; 10,000 U/ml) | Lonza | DE17-602E | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | SC-202581 | |
| Nuclease-Free Water (not DEPC-Treated) | Ambion | AM9937 | |
| T75 flask | Sarstedt | 833911002 | |
| Trypsin/EDTA Solution | Lonza | CC-5012 | |
| PBS tablets | Gibco | 18912-014 | |
| 1.5 ml microcentrifuge tubes | Sigma-Aldrich | T9661-1000EA | |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich | CLS430791 | |
| 6-well plate | Sarstedt | 83.3920 | |
| 24-well plate | Sarstedt | 83.3922 | |
| 13mm round coverslips | Sarstedt | 83.1840.002 | |
| Steriflip | Merck Chemicals | SCGP00525 | |
| Cesium137-source | IBL 637 Cesium-137γ-ray machine | ||
| UV radiation chamber | Opsytec, Dr. Göbel BS-02 | ||
| Doxorubicin dihydrochloride | BioAustralis Fine Chemicals | BIA-D1202-1 | |
| Hydrogen peroxide solution | Sigma-Aldrich | 7722-84-1 | |
| 5-aza-2’-deoxycytidine | Sigma-Aldrich | A3656 | |
| SAHA | Sigma-Aldrich | SML0061 | |
| Sodium Butyrate | Sigma-Aldrich | B5887 | |
| X-gal (5-Bromo-4-chloro-3-indolyl-β-D-galactopyranoside) | Fisher Scientific | 7240-90-6 | |
| Citric acid monohydrate | Sigma-Aldrich | 5949-29-1 | |
| Sodium dibasic phosphate | Acros organics | 7782-85-6 | |
| Potassium ferrocyanide | Fisher Scientific | 14459-95-1 | |
| Potassium ferricyanide | Fisher Scientific | 13746-66-2 | |
| Sodium Chloride | Merck Millipore | 7647-14-5 | |
| Magnesium Chloride | Fisher Chemicals | 7791-18-6 | |
| 25% glutaraldehyde | Fisher Scientific | 111-30-8,7732-18-5 | |
| 16% formaldehyde (w/v) | Thermo-Fisher Scientific | 28908 | |
| EdU (5-ethynyl-2’-deoxyuridine) | Lumiprobe | 10540 | |
| Sulfo-Cyanine3 azide (Sulfo-Cy3-Azide) | Lumiprobe | D1330 | |
| Sodium ascorbate | Sigma-Aldrich | A4034 | |
| Copper(II) sulfate pentahydrate (Cu(II)SO4.5H2O) | Sigma-Aldrich | 209198 | |
| Triton X-100 | Acros organics | 215682500 | |
| TRIS base | Roche | 11814273001 | |
| LightCycler 480 Multiwell Plate 384, white | Roche | 4729749001 | |
| Lightcycler 480 sealing foil | Roche | 4729757001 | |
| Sensifast Probe Lo-ROX kit | Bioline | BIO-84020 | |
| UPL Probe Library | Sigma-Aldrich | Various | |
| Human IL-6 DuoSet ELISA | R&D | D6050 | |
| Bio-Rad TC20 | Bio-Rad | ||
| Counting slides | Bio-Rad | 145-0017 | |
| Dry incubator | Thermo-Fisher Scientific | Heratherm | |
| Dimethylformamide | Merck Millipore | 1.10983 | |
| Parafilm 'M' laboratory film | Bemis | #PM992 | |
| Tweezers | |||
| Needles |
Références
- Hayflick, L., Moorhead, P. S. The serial cultivation of human diploid cell strains. Experimental Cell Research. 25, 585-621 (1961).
- Muñoz-Espín, D., Serrano, M. Cellular senescence: from physiology to pathology. Nature reviews. Molecular cell biology. 15, 482-496 (2014).
- Sharpless, N. E., Sherr, C. J. Forging a signature of in vivo senescence. Nature Reviews Cancer. 15 (7), 397-408 (2015).
- Correia-Melo, C., et al. Mitochondria are required for pro-ageing features of the senescent phenotype. The EMBO Journal. 10, e201592862 (2016).
- Loaiza, N., Demaria, M. Cellular senescence and tumor promotion: Is aging the key?. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. , (2016).
- Coppe, J. P., et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biology. 6 (12), 2853-2868 (2008).
- Baker, D. J., et al. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature. 530 (7589), 184-189 (2016).
- Xu, M., et al. Targeting senescent cells enhances adipogenesis and metabolic function in old age. Elife. 4, e12997 (2015).
- Baker, D. J., et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479 (7372), 232-236 (2011).
- Jeon, O. H., et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nature Medicine. 23 (6), 775-781 (2017).
- Demaria, M., et al. Cellular Senescence Promotes Adverse Effects of Chemotherapy and Cancer Relapse. Cancer Discovery. 7 (2), 165-176 (2017).
- Chang, J., et al. Clearance of senescent cells by ABT263 rejuvenates aged hematopoietic stem cells in mice. Nature Medicine. 22 (1), 78-83 (2016).
- Soto-Gamez, A., Demaria, M. Therapeutic interventions for aging: the case of cellular senescence. Drug Discov Today. 22 (5), 786-795 (2017).
- Childs, B. G., et al. Senescent cells: an emerging target for diseases of ageing. Nature Reviews Drug Discovery. 16 (10), 718-735 (2017).
- Marthandan, S., et al. Conserved genes and pathways in primary human fibroblast strains undergoing replicative and radiation induced senescence. Biological Research. 49, 34 (2016).
- Marthandan, S., et al. Conserved Senescence Associated Genes and Pathways in Primary Human Fibroblasts Detected by RNA-Seq. PLoS One. 11 (5), e0154531 (2016).
- Hernandez-Segura, A., et al. Unmasking Transcriptional Heterogeneity in Senescent Cells. Current Biology. 27 (17), 2652-2660 (2017).
- Le, O. N., et al. Ionizing radiation-induced long-term expression of senescence markers in mice is independent of p53 and immune status. Aging Cell. 9 (3), 398-409 (2010).
- Hall, J. R., et al. C/EBPalpha regulates CRL4(Cdt2)-mediated degradation of p21 in response to UVB-induced DNA damage to control the G1/S checkpoint. Cell Cycle. 13 (22), 3602-3610 (2014).
- Nitiss, J. L. Targeting DNA topoisomerase II in cancer chemotherapy. Nature Reviews Cancer. 9 (5), 338-350 (2009).
- Pazolli, E., et al. Chromatin remodeling underlies the senescence- associated secretory phenotype of tumor stromal fibroblasts that supports cancer progression. Cancer Research. 72, 2251-2261 (2012).
- Venturelli, S., et al. Differential induction of apoptosis and senescence by the DNA methyltransferase inhibitors 5-azacytidine and 5-aza-2'-deoxycytidine in solid tumor cells. Molecular Cancer Therapeutics. 12, 2226-2236 (2013).
- Tennant, J. R. Evaluation of the Trypan Blue Technique for Determination of Cell Viability. Transplantation. 2, 685-694 (1964).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Lee, B. Y., et al. Senescence-associated β-galactosidase is lysosomal β-galactosidase. Aging Cell. 5, 187-195 (2006).
- Kopp, H. G., Hooper, A. T., Shmelkov, S. V., Rafii, S. Beta-galactosidase staining on bone marrow. The osteoclast pitfall. Histology and Histopathology. 22 (9), 971-976 (2007).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences. 92 (20), 9363-9367 (1995).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proceedings of the National Academy of Sciences. 105 (7), 2415-2420 (2008).
- Sherr, C. J., McCormick, F. The RB and p53 pathways in cancer. Cancer Cell. 2 (2), 103-112 (2002).
- Bunz, F., et al. Requirement for p53 and p21 to sustain G2 arrest after DNA damage. Science. 282 (5393), 1497-1501 (1998).
- Severino, J., Allen, R. G., Balin, S., Balin, A., Cristofalo, V. J. Is beta-galactosidase staining a marker of senescence in vitro and in vivo. Experimental Cell Research. 257 (1), 162-171 (2000).
- Stolzing, A., Coleman, N., Scutt, A. Glucose-induced replicative senescence in mesenchymal stem cells. Rejuvenation Research. 9 (1), 31-35 (2006).
- Blazer, S., et al. High glucose-induced replicative senescence: point of no return and effect of telomerase. Biochemical and Biophysical Research Communications. 296 (1), 93-101 (2002).
- Wiley, C. D., Campisi, J. From Ancient Pathways to Aging Cells-Connecting Metabolism and Cellular Senescence. Cell Metabolism. 23 (6), 1013-1021 (2016).
- Kumar, R., Gont, A., Perkins, T. J., Hanson, J. E. L., Lorimer, I. A. J. Induction of senescence in primary glioblastoma cells by serum and TGFbeta. Scientific Reports. 7 (1), 2156 (2017).
- Hypoxia Blagosklonny, M. V. MTOR and autophagy: converging on senescence or quiescence. Autophagy. 9 (2), 260-262 (2013).
- Meuter, A., et al. Markers of cellular senescence are elevated in murine blastocysts cultured in vitro: molecular consequences of culture in atmospheric oxygen. Journal of Assisted Reproduction and Genetics. 31 (10), 1259-1267 (2014).
- Coppe, J. P., et al. A human-like senescence-associated secretory phenotype is conserved in mouse cells dependent on physiological oxygen. PLoS One. 5 (2), e9188 (2010).
- van Deursen, J. M. The role of senescent cells in ageing. Nature. 509 (7501), 439-446 (2014).
- Kim, Y. M., et al. Implications of time-series gene expression profiles of replicative senescence. Aging Cell. 12, 622-634 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon