Method Article
Induzione e convalida della senescenza cellulare in cellule umane primarie
In questo articolo
Riepilogo
Andremo a discutere una serie di protocolli per l'induzione e la convalida della senescenza cellulare in cellule coltivate. Ci concentriamo sui diversi stimoli che inducono la senescenza e descrivere la quantificazione degli indicatori comuni di senescenza-collegata. Forniamo dettagli tecnici usando i fibroblasti come un modello, ma i protocolli possono essere adattati a vari modelli di cellulari.
Abstract
La senescenza cellulare è uno stato di arresto del ciclo cellulare permanente attivato in risposta a diversi stimoli dannosi. Attivazione della senescenza cellulare è un marchio di garanzia di varie condizioni fisiopatologiche, tra cui la soppressione del tumore, tessuto che ritocca e invecchiamento. Gli induttori di senescenza cellulare in vivo sono ancora poco caratterizzati. Tuttavia, un numero di stimoli utilizzabile per promuovere la senescenza cellulare ex vivo. Fra loro, senescenza-induttori più comuni sono esaurimento replicativa, radiazioni ionizzanti e radiazioni non ionizzanti, farmaci genotossici, stress ossidativo e di demethylating e acetilante agenti. Qui, vi forniremo istruzioni dettagliate su come utilizzare questi stimoli per indurre i fibroblasti nella senescenza. Questo protocollo può essere facilmente adattato per diversi tipi di cellule primarie e linee cellulari, comprese le cellule tumorali. Descriviamo anche diversi metodi per la convalida di induzione di senescenza. In particolare, ci concentriamo sulla misurazione dell'attività dell'enzima lisosomiale β-galattosidasi senescenza-collegata (SA-β-gallone), il tasso di sintesi di DNA mediante analisi di incorporazione di 5-Etinil-2'-deoxyuridine (EdU), i livelli di espressione del ciclo cellulare inibitori p16 e p21 e l'espressione e la secrezione dei membri del fenotipo secretivo Senescence (SASP). Infine, forniamo risultati di esempio e discutere ulteriori applicazioni di questi protocolli.
Introduzione
Nel 1961, Hayflick e Moorhead segnalato che fibroblasti primari nella cultura perdono il loro potenziale proliferativo dopo successivi passaggi1. Questo processo è causato dalla riduzione sequenza dei telomeri dopo ogni divisione cellulare. Quando i telomeri raggiungono una lunghezza criticamente corta, sono riconosciuti dalla risposta di danno del DNA (DDR) che attiva un arresto irreversibile della proliferazione — anche definito come senescenza replicativa. Senescenza replicativa è attualmente uno dei molti stimoli che sono noti per indurre uno stato di arresto permanente del ciclo cellulare che esegue il rendering di cellule insensibili ai mitogeni sia a segnali apoptotici2,3. Il programma di senescenza è normalmente caratterizzato da funzionalità aggiuntive tra cui alta attività lisosomiale, la disfunzione mitocondriale, cambiamenti nucleari, le riorganizzazioni della cromatina, stress del reticolo endoplasmico, danno del DNA e una senescenza-collegata fenotipo secretivo (SASP)3,4. Le cellule senescenti hanno molteplici funzioni nel corpo: sviluppo, ferita di soppressione del tumore e guarigione2. Allo stesso modo, essi sono noti per svolgere un ruolo importante nell'invecchiamento e, paradossalmente, in progressione di tumore5. Gli effetti negativi e parzialmente contraddittori, di senescenza sono spesso attribuiti alla SASP6.
Recentemente, è stato indicato che l'eliminazione delle cellule senescenti dai topi conduce alla estensione della durata della vita e alla eliminazione di molti l'invecchiamento caratteristiche7,8,9,10,11, 12. allo stesso modo, le droghe multiple sono state sviluppate per eliminare sia le cellule senescenti (senolytics) o per mirare le SASP13,14. Il potenziale terapeutico di anti-invecchiamento ha recentemente attirato più attenzione al campo.
Lo studio dei meccanismi associati a senescenza cellulare e le proiezioni per gli interventi farmacologici si basano pesantemente su modelli ex vivo , particolarmente sui fibroblasti primari umani. Mentre ci sono alcune caratteristiche comuni attivati da induttori di senescenza diversificata, una grande variabilità nel fenotipo di senescenza è osservata e dipende da vari fattori tra cui cella tipo, stimolo e tempo punto3,15, 16,17. È assolutamente necessario prendere in considerazione l'eterogeneità per studiare e targeting cellule senescenti. Di conseguenza, questo protocollo mira a fornire una serie di metodi utilizzati per indurre senescenza in fibroblasti primari utilizzando diversi trattamenti. Come verrà spiegato, i metodi possono essere facilmente adattati ad altri tipi di cella.
Oltre a senescenza replicativa, descriviamo cinque altri trattamenti che induce senescenza: ionizzante radiazione, radiazione ultravioletta (UV), doxorubicina, stress ossidativo ed i cambiamenti epigenetici (vale a dire la promozione di acetilazione dell'istone o demetilazione del DNA) . Entrambi, radiazioni ionizzanti e UV-radiazione causano danni diretti del DNA e, presso la dose appropriata, trigger senescenza18,19. Doxorubicina causa anche senescenza principalmente attraverso il danno del DNA da intercalanti nel DNA e interrompere la funzione di topoisomerasi II e fermando così il DNA riparazione meccanismi20. L'espressione di geni essenziali per la senescenza è normalmente controllato da acetilazione dell'istone e metilazione del DNA. Di conseguenza, gli inibitori dell'istone deacetilasi (ad es., sodio butirrato e SAHA) e DNA demetilanti (ad es., 5-aza) agenti innescano senescenza in cellule altrimenti normali21,22.
Infine, quattro degli indicatori più comuni associati a cellule senescenti sarà spiegato: attività della senescenza associati-β-galattosidasi (SA-β-gallone), tasso di sintesi del DNA dall'analisi di incorporazione di EdU, sovraespressione di regolatori del ciclo cellulare e p16 inibitori di chinasi ciclina-dipendente e p21 e sovraespressione e secrezione dei membri della SASP.
Protocollo
1. generale preparazione
- Preparare il supporto di D10. Supplemento DMEM medio-Glutamax con 10% FBS e 1% di penicillina/streptomicina (concentrazione finale: 100 U/mL).
- Preparare PBS sterile. Sciogliere le compresse in acqua secondo le istruzioni del produttore. Sterilizzare in autoclave.
- Preparare 1 tripsina di x. Diluire 5 mL di tripsina-Versene EDTA/10 x 01:10 in 45 mL di PBS sterile.
Nota: In tutto il protocollo, usiamo condizioni di coltura delle cellule che sono più vicini alle fisiologiche condizioni per i fibroblasti primari. Questo significa che abbiamo Incubare le cellule a 37 ° C e 5% CO2 come viene normalmente fatto ma usando 5% O2 invece lo "standard" del 20% O2. - Maneggiare tutti i campioni in condizioni sterili utilizzando una cappa a flusso laminare, camice e guanti. Mantenere le cellule al 20% O2 (camera condizioni) solo mentre viene gestito.
2. induzione della senescenza
- Senescenza replicativa
- Durante la manipolazione di cellule o qualsiasi materiale che sarà in contatto con loro (pipette, fiasche, media, ecc.) lavorano in condizioni sterili, utilizzando una cappa a flusso laminare, camice e guanti. Mantenere le cellule al 20% O2 (camera condizioni) solo mentre viene gestito.
- Fibroblasti primari vitali di seme 7 x 105 in una popolazione bassa raddoppio (PD) in un matraccio di T75 (~9.3 x 103 cellule/cm2) contenente 10 mL di D10.
- Crescere le cellule in un'incubatrice di cellulare a 37 ° C con 5% CO2 e 5% O2 fino a quando non raggiungono la confluenza di 70 – 80% (3-4 giorni per proliferazione culture in un PD basso).
- Staccare le celle utilizzando 3 mL di 1x tripsina e incubando per ~ 5 – 7 min in un'incubatrice di coltura cellulare a 37 ° C con 5% CO2 e 5% O2. Monitorare regolarmente le cellule con un microscopio di coltura cellulare per controllare il processo di scollegamento.
- Quando le cellule sono sferiche, fermare la reazione di tripsina aggiungendo 9 mL di D10. Incubare non più di 10 min.
- Girare le cellule a 300 x g per 5 min. cellule formeranno una pallina nella parte inferiore del tubo, mentre i detriti e particelle più piccole rimarrà nel surnatante.
- Rimuovere il supernatante e sciogliere il pellet cellulare in 1 mL di D10 ed eseguire un conteggio delle cellule utilizzando un contatore di cellule automatizzato secondo le istruzioni del produttore o di una camera di Neubauer per il conteggio manuale. Mentre il conteggio, includere un test per verificare la vitalità delle cellule (ad esempio, il blu Trypan esclusione23).
- Calcolare la PD cumulativo utilizzando questa formula:
PDnuovo = 3.32* (LOG(cell number total)-(LOG (numero delle cellule seminata)) + PDold
Numero totale di cella = tutte le cellule contate: morti e vivi.
Testa di serie numero cellulare = numero di cellule vitali seminato (8 x 105 cellule).
PDvecchio = al momento della semina di raddoppiamento della popolazione.
PDnuovo = al momento del conteggio (dopo incubazione) di raddoppiamento della popolazione.
Nota: Se 7 x 105 fibroblasti primari (PD 35,2) sono state seminate su un pallone da T-75 e, dopo 4 giorni raggiungono 80% confluenza e dividere di nuovo, contando ora 1.3 x 106 cellule totali (morto + vivo).
PDnuovo = 3.32* (LOG(1,300,000 cells)-LOG(700,000)) + 35,2
PDnuovo = 36,1 - Reinizializzare 8 x 105 celle in un nuovo T75, ripetendo la procedura 2.1.2–2.1.8.
Nota: Dopo molteplici passaggi consecutivi, la cultura ci vorrà più tempo per ottenere confluenti fino a quando le cellule smettono di dividersi affatto. Una volta che le cellule smettono di dividersi, test per i marcatori di senescenza e/o raccolto per applicazioni a valle. - Considera che la dimensione più grande delle cellule senescenti può causare la cultura ad apparire completo e ancora avere un conteggio basso delle cellule. Così, la senescenza può essere presupposto quando il PD è stabile e altri indicatori di senescenza appaiono nella cultura (Vedi protocolli 3.1 – 3,5).
Nota: Utilizzare i fibroblasti primari di proliferazione come controllo.
- Senescenza indotta da radiazioni ionizzanti
- Durante la manipolazione di cellule o qualsiasi materiale che sarà in contatto con loro (pipette, fiasche, media, ecc.), lavorare in condizioni di sterilità usando una cappa a flusso laminare, camice e guanti. Mantenere le cellule al 20% O2 (camera condizioni) solo mentre viene gestito.
- Seme 7 x 105 vitale primarie fibroblasti in un PD basso in una boccetta di T75 (~9.3 x 103 cellule/cm2) contenente 10 mL di D10.
- Incubare le cellule durante la notte in un'incubatrice di coltura cellulare a 37 ° C con 5% CO2 e 5% O2.
- Esporre le cellule a 10 grigio di irradiazione gamma secondo le istruzioni della macchina in uso.
- Aspirare il mezzo dalle cellule e sostituire con 10 mL di D10.
- Incubare le cellule in 10 mL di D10 in un'incubatrice di coltura cellulare a 37 ° C con 5% CO2 e 5% O2 per un altro 10 giorni sostituendo il mezzo regolarmente, circa ogni 3 giorni.
- Dopo 10 giorni, test per i marcatori di senescenza e/o utilizzare le celle per applicazioni a valle.
Nota: Utilizzare fibroblasti proliferanti primari del PD stesso (prima di irradiazione) come controllo.
- Raggi ultravioletti (UV) indotta da radiazioni senescenza
- Durante la manipolazione di cellule o qualsiasi materiale che sarà in contatto con loro (pipette, fiasche, media, ecc.), lavorare in condizioni di sterilità usando una cappa a flusso laminare, camice e guanti. Mantenere le cellule al 20% O2 (camera condizioni) solo mentre viene gestito.
- Sementi di 1,5 – 2 x 105 vitali fibroblasti primari in un PD basso in un pozzetto di una piastra a 6 pozzetti (1,5 – 2,0 x 104 cellule/cm2), aggiungere 2 mL di terreno di D10.
- Posizionare le cellule in un'incubatrice di coltura cellulare a 37 ° C con 5% CO2 e 5% O2 e permettere loro di aderire alla plastica per almeno 5 ore.
- Togliere il mezzo dalle cellule. Posizionare la piastra 6-pozzo al centro della camera di UV-radiazione e togliere il coperchio di plastica. Irradiare con UVB, 20 – 30 mJ/cm2.
- Aggiungere 2 mL di terreno per pozzetto.
- Incubare le cellule in 2 mL di D10 in un'incubatrice di coltura cellulare a 37 ° C con 5% CO2 e 5% O2 per altri 7 giorni sostituendo il mezzo regolarmente, circa ogni 3 giorni.
Nota: Dopo 7 giorni, cellule possono essere testate per gli indicatori di senescenza e utilizzate per applicazioni a valle. Utilizzare fibroblasti proliferanti primari del PD stesso (prima di irradiazione) come controllo.
- Senescenza indotta da doxorubicina
- Preparare 1.000 x soluzione stock di doxorubicina: fare un magazzino di 250 µM di doxorubicina in PBS 1X, filtro-sterilizzare la soluzione e l'aliquota in 500 µ l per provetta sterile. Conservare lo stock di doxorubicina a-80 ° C.
- Durante la manipolazione di cellule o qualsiasi materiale che sarà in contatto con loro (pipette, fiasche, media, ecc.), lavorare in condizioni di sterilità usando una cappa a flusso laminare, camice e guanti. Mantenere le cellule al 20% O2 (camera condizioni) solo mentre viene gestito.
- Seme 7 x 105 vitale primarie fibroblasti in un PD basso in una boccetta di T75 (~9.3 x 103 cellule/cm2) contenente 10 mL di D10.
- Incubare le cellule durante la notte in un'incubatrice di coltura cellulare a 37 ° C con 5% CO2 e 5% O2.
- Diluire 11 µ l di 1.000 x soluzione stock di doxorubicina in 11 mL di D10 a una concentrazione finale di 250 nM.
- Aspirare il mezzo dalle cellule e sostituire con 10 mL di D10 + doxorubicina.
- Incubare le cellule per esattamente 24 h in un'incubatrice di coltura cellulare a 37 ° C con 5% CO2 e 5% O2.
- Aspirare il mezzo dalle cellule e lavare accuratamente una volta con 10 mL di D10.
- Incubare le cellule in 10 mL di D10 per altri 6 giorni sostituendo il mezzo regolarmente, circa ogni 3 giorni.
- Al giorno 7, test per i marcatori di senescenza e/o utilizzare per applicazioni a valle.
Nota: come controllo, uso proliferazione fibroblasti primari del PD stesso trattati per 24 h con veicolo (PBS) 1:1,000 in D10.
- Senescenza indotta da Stress ossidativa
- Durante la manipolazione di cellule o qualsiasi materiale che sarà in contatto con loro (pipette, fiasche, media, ecc.) lavorano in condizioni sterili utilizzando una cappa a flusso laminare, camice e guanti. Mantenere le cellule al 20% O2 (camera condizioni) solo mentre viene gestito.
- Seme 7 x 105 vitale primarie fibroblasti in un PD basso in una boccetta di T75 (~9.3 x 103 cellule/cm2) contenente 10 mL di D10.
- Incubare le cellule durante la notte in un'incubatrice di cellulare a 37 ° C con 5% CO2 e 5% O2.
- Preparare una soluzione di perossido di idrogeno di ~ 200 μM in mezzo D10 aggiungendo 22,6 μL di perossido di idrogeno 30% in 11 mL di D10.
Nota: Ottimizzare il trattamento per il tipo di cella di interesse facendo una curva dose-risposta per valutare la tossicità. - Aspirare il mezzo dalle cellule e aggiungere 10 mL di preparati D10 medio + ossigenata. Incubare per 2 ore a 37 ° C con 5% CO2 e 5% O2.
- Aspirare il mezzo dalle cellule e lavare una volta con D10 fresca senza perossido di idrogeno.
- Aggiungere 10 mL di D10 senza perossido di idrogeno.
- Incubare per 48 h in un'incubatrice di coltura cellulare a 37 ° C con 5% CO2 e 5% O2.
- Ripetere i passaggi 2.5.4–2.5.8 due volte di più per un totale di tre trattamenti.
- Verificare gli indicatori senescenza o raccolto per applicazioni a valle.
Nota: Come controllo, uso le cellule di proliferazione del PD stesso trattato con 22,6 µ l di acqua sterile in D10 per 2 h.
- Epigeneticamente-indotta senescenza
- Preparare il brodo e soluzioni di lavoro per la piccola molecola da utilizzare secondo la tabella 1. Filtro-sterilizzare le soluzioni. Aliquota in provette sterili. Conservare a-20 ° C.
- Durante la manipolazione di cellule o qualsiasi materiale che sarà in contatto con loro (pipette, fiasche, media, ecc.) lavorano in condizioni di sterilità, per esempio, utilizzando una cappa a flusso laminare, camice e guanti. Mantenere le cellule al 20% O2 (camera condizioni) solo mentre viene gestito.
- Seme 7 x 105 vitale primarie fibroblasti in un PD basso in una boccetta di T75 (~9.3 x 103 cellule/cm2) contenente 10 mL di D10.
- Incubare le cellule durante la notte in un'incubatrice di coltura cellulare a 37 ° C con 5% CO2 e 5% O2.
- Preparare 11 mL di medium di D10 + soluzione di lavoro per il trattamento desiderato. La diluizione esatta per ogni trattamento può essere visto nella tabella 1.
- Preparare 11 µ l di soluzione di lavoro di 1 mM SAHA in 11 mL di D10.
- Preparare 44 µ l di soluzione di lavoro di 1 M sodio butirrato in 11 mL di D10.
- Preparare 11 µ l di soluzione di lavoro di 5-aza 10 mM in 11 mL di D10.
Nota: Ottimizzare i trattamenti per il tipo di cella di interesse di, per esempio, facendo una curva dose-risposta per valutare la tossicità.
- Aggiungere D10 medium + soluzione di lavoro per il trattamento desiderato alla cultura.
- Incubare per 24 h in un'incubatrice di coltura cellulare a 37 ° C con 5% CO2 e 5% O2.
- Ripetere i passaggi 2.6.4–2.6.6 due volte di più, per un totale di tre trattamenti.
- Sostituire il terreno per D10 semplice senza droga.
- Dopo 3 giorni in più, le cellule diventano senescenti e pronta per il test di marcatori di senescenza e applicazioni a valle.
Nota: come controllo, uso fibroblasti primari del PD stesso trattati per tre giorni con D10 medio + veicolo di proliferazione. Il D10 medio + veicolo deve essere aggiornata ogni 24 ore, durante quei tre giorni. Il veicolo dipende dal trattamento utilizzato: 1:1,000 DMSO per SAHA e 5-aza e 1: 250 acqua sterile per sodio butirrato.
3. gli indicatori della senescenza
- Preparazione
- Preparare 20mg/mL X-gal: sciogliere 20 mg del X-gal in 1 mL di dimetilformammide o DMSO. Conservare a-20 ° C al riparo dalla luce.
- Preparare soluzione 0,1 M di acido citrico: sciogliere 2,1 g di acido citrico monoidrato in 100 mL di acqua. Conservare a temperatura ambiente.
- Preparare la soluzione di fosfato di sodio 0,2 M: 2,84 sciogliere g di fosfato di sodio bibasico o 3,56 g di fosfato di sodio bibasico disidratare in 100 mL di acqua. Conservare a temperatura ambiente.
- Preparare 0,2 M acido citrico/sodio fosfato pH 6.0: sciogliere 36,85 mL di soluzione 0,1 M di acido citrico e 63,15 mL di fosfato di sodio 0,2 M. Regolare esattamente a pH 6.0. Conservare a temperatura ambiente.
- Preparare il ferrocianuro di potassio 100 mM: sciogliere 2,1 g di ferrocianuro di potassio in 50 mL di acqua. Conservare a 4 ° C al riparo dalla luce.
- Preparare il ferricianuro di potassio 100 mM: sciogliere 1,7 g di ferricianuro di potassio in 50 mL di acqua. Conservare a 4 ° C al riparo dalla luce.
- Preparare 5 M di cloruro di sodio: sciogliere 14,6 g di cloruro di sodio in 50 mL di acqua. Conservare a temperatura ambiente.
- Preparare 1 M di cloruro di magnesio: sciogliere 4,8 g di cloruro di magnesio in 50 mL di acqua. Conservare a temperatura ambiente.
- Preparare 2% formaldeide + 0,2% glutaraldeide in PBS: sciogliere 800 µ l di 25% di glutaraldeide e 12,5 µ l del 16% formaldeide in 100 μL di PBS. Conservare a temperatura ambiente al riparo dalla luce.
- Preparare soluzione colorante fresco secondo tabella 2.
- Macchiatura di β-galattosidasi senescenza-collegata
- Per ogni campione, seme 1 x 104 cellule in almeno un pozzetto di una piastra a 24 pozzetti (5,2 x 103 cellule/cm2) contenente 500 µ l di D10 affinché le cellule sono sparse. Trattamenti (se applicabile) possono essere eseguiti direttamente su questo piatto o, in alternativa, le cellule trattate già possono essere ri-seminate in una piastra a 24 pozzetti.
- Incubare le cellule durante la notte a 37 ° C con 5% CO2 e 5% O2.
- Lavare le cellule due volte con 500 μL di PBS.
- Difficoltà: 3 – 5 min a temperatura ambiente utilizzando 500 μL/pozzetto di 2% formaldeide + 0,2% glutaraldeide in PBS.
- Lavare le cellule due volte con 500 μL di PBS.
- Preparare fresco soluzione, secondo il numero di campioni da macchie di colorazione.
- Aggiungere la soluzione colorante (500 µ l/pozzetto) e sigillare la piastra con parafilm per evitare l'evaporazione.
Nota: Evaporazione può causare cristalli a forma e ostacolare l'osservazione al microscopio. - Incubare le cellule al buio (ad es. rivestito in lamina di alluminio) a 37 ° C in un incubatore a secco (senza CO2) per 12 – 16 h.
Nota: CO2 può influenzare il pH e quindi modificare i risultati. Alcuni tipi di cellule possono richiedere tempi di incubazione. - Lavare due volte con 500 μL di PBS.
- Valutare i risultati. Cellule positive presentano un blu (principalmente) perinucleare macchiatura sotto un microscopio a luce normale (Figura 1A).
- Per la quantificazione, osservare almeno 100 cellule per campione e contare il numero di cellule positive. Poiché le cellule senescenti cambiano forma, è spesso difficile per definire i bordi della cella e per contare le celle. Colorante di contrasto con DAPI per facilitare la visualizzazione e quantificazione delle singole celle (Figura 1B). Quantificare i campioni (percentuale di cellule positive rispetto al totale delle cellule) utilizzando un microscopio a fluorescenza (Figura 1). Prendere più immagini dello stesso campione in modo che alla fine si possono contare almeno 100 single-celle e valutare la percentuale di cellule positive SA-β-gallone in loro.
- Confrontare i risultati delle cellule senescenti contro loro controllo appropriato per il trattamento utilizzato.
Nota: Un co-macchiatura con EdU sullo stesso campione è possibile. Considera che le cellule devono essere seminate sulle lamelle.
- Analisi di incorporazione di EdU
- Mettere un vetrino coprioggetti/pozzo in una piastra a 24 pozzetti secondo il numero di campioni da valutare.
- 1 x 104 cellule in almeno un pozzetto di una piastra a 24 pozzetti (5,2 x 103 cellule/cm2) a condizione contenente 500 µ l di D10, in modo che le cellule sono sparse del seme. Trattamenti (se applicabile) possono essere eseguiti direttamente su questo piatto o, in alternativa, le cellule già trattate possono essere ri-seminate in una piastra a 24 pozzetti.
- Incubare le cellule durante la notte a 37 ° C con 5% CO2 e 5% O2.
- Fare una soluzione di 20 µM di EdU in D10 (1: 250) in base al numero di campioni da trattare (250 µ l per campione).
- Rimuovere la metà del mezzo (250 μL) da ogni pozzetto per trattare e sostituirlo con il D10 + EdU soluzione che è stato appena preparato. Concentrazione finale di EdU è 10 µM.
- Incubare per 18 – 24 h in un'incubatrice di coltura cellulare a 37 ° C con 5% CO2% e 5% O2. Utilizzare gli stessi tempi d'incubazione in controllo e cellule senescenti.
- Lavare 2x con 500 μL di PBS.
- Fissare le cellule per 10 min con 500 μL di formaldeide 4% in PBS.
- Incubare 5 min in 500 μL di 100 mM Tris (pH 7,6).
- Permeabilize le cellule per 10 min in 500 μL di 0.1% Triton X-100 in PBS.
- Lavare 3 volte con PBS.
- Preparare 50 μL di miscela di etichetta per ogni vetrino coprioggetti, aggiungendo i componenti nel seguente ordine: 44.45 µ l di PBS, 0,5 µ l di Cu (II) SO4, 0,05 µ l di sulfo-Cy3-azide, 5 µ l di ascorbato di sodio.
- Mettere 50 µ l della miscela etichetta su un pezzo di parafilm. Sollevare il coprioggetto con l'ausilio di un paio di pinzette e un ago e lasciarlo riposare in cima il mix di etichetta, con la superficie che contiene le cellule rivolto verso il basso. Assicurarsi che non ci sono bolle e che l'intera superficie del coprivetrino sta toccando il mix di etichetta. Incubare per 30 min al buio.
- Rimettere le cellule in pozzetti della piastra 24 pozzetti e lavarli tre volte con PBS.
- Montare con montaggio media (compreso DAPI per visualizzare i nuclei) su vetrini e lasciarli asciugare durante la notte.
- Visualizzare l'incorporazione di EdU utilizzando un microscopio a fluorescenza. Utilizzare un filtro appropriato per Cy3 (eccitazione/emissione: 552/570 nm).
- Scattare più Foto delle cellule per la successiva quantificazione di almeno 100 cellule per condizione (Cy3 e DAPI).
- Quantificare la percentuale di cellule che incorporava EdU utilizzando la seguente formula:
Le cellule positive di EdU (%) = (conteggio di EdU positivo delle cellule (Cy3) / totale numero di celle (DAPI)) * 100 - Confrontare i risultati delle cellule senescenti contro loro controllo appropriato per il trattamento utilizzato.
Nota: Un co-macchiatura con SA-β-gallone sullo stesso campione è possibile. Considera che le cellule ancora dovrebbero essere seminate sulle lamelle.
- Espressione genica di p16, p21 e SASP
- Preparare il primer-set di geni di interesse (iniettore di 50 µM ciascuna).
Nota: Un qPCR di p16, p21 e alcuni fattori rilevanti SASP è informativo sullo stato di senescenza. Il protocollo descritto qui fa uso del sistema universale sonda biblioteca (UPL) per quantificazione relativa utilizzando una PCR in tempo reale. La tabella 3 Mostra una panoramica dei primer utilizzato per il rilevamento delle CDK inibitori p16 e p21 e dei membri SASP più rilevanti, nonché per la tubulina e actina, che servono come geni di riferimento per il dosaggio. L'ultima colonna della tabella 3 si inserisce la sonda UPL particolare da utilizzare per ogni dosaggio. - Preparare mix di reazione qPCR separato per le analisi desiderate. Includere sempre il gene di riferimento anche secondo la tabella 4.
- Eseguire tutti i campioni in doppio o triplice copia.
- Carico 7,5 µ l/pozzetto del mix di reazione qPCR su una piastra 384 pozzetti.
- Aggiungi ~ 5 ng di cDNA disciolto in 2,5 µ l di acqua RNAsi-libera.
Nota: È preferibile avere simili quantità di cDNA per tutti i campioni da confrontare. Ciò può essere ottenuto utilizzando quantità uguali di RNA per la trascrizione d'inversione. - Coprire la piastra con un sigillo e assicurarsi che si attacca correttamente che copre in modo uniforme tutti i pozzi sulla piastra.
- Girare la piastra a 2.000 x g per 1 min.
- Eseguire la piastra nel Lightcycler per 40 cicli utilizzando il seguente protocollo:
95 ° C per 7 min
40 cicli di 95 ° C per 5 s e 60 ° C per 30 s
37 ° C per 1 min - Per l'analisi dei risultati, utilizzare il metodo proposto per Livak e colleghi per analizzare qPCR dati24. Utilizzare la tubulina o actina come geni di riferimento per calcolare la ΔCt valore e utilizzano il controllo appropriato per calcolare il per il valore di ΔΔCt per il trattamento di induzione della senescenza specifico.
- Preparare il primer-set di geni di interesse (iniettore di 50 µM ciascuna).
- Espressione della proteina e la secrezione di IL6
- Seme: 5 – 10 x 104 celle in almeno un pozzetto di una piastra a 6 pozzetti (5.2-10,5 x 103 cellule/cm2) a condizione contenente 2 mL di D10. Trattamenti (se applicabile) possono essere eseguiti direttamente su questo piatto o, in alternativa, le cellule trattate già possono essere ri-seminate in una piastra a 24 pozzetti. Lasciate riposare durante la notte dopo la semina.
- Rimuovere il supporto e sostituire per 2 mL di DMEM medio senza FBS. Incubare in condizioni normali per 24 h.
- Raccogliere il mezzo in una provetta da 15 mL.
- Centrifugare il campione a 300 x g per 5 min medio sono memorizzabili a-80 ° C fino all'elaborazione.
- Seguire le istruzioni del produttore per eseguire il test ELISA.
- Confrontare i risultati delle cellule senescenti contro il controllo appropriato per il trattamento di induzione della senescenza specifico
Risultati
Arricchimento di SA-β-gallone macchiatura in fibroblasti senescenti
Β-galattosidasi (β-gallone) è un enzima lisosomiale che si esprime in tutte le cellule e che ha un pH ottimale di 4,025,26. Tuttavia, durante la senescenza, lysosomes aumentano di dimensioni e, di conseguenza, le cellule senescenti si accumulano β-gallone. La maggiore quantità di questo enzima rendono possibile rilevare la sua attività anche a un non ottimale pH 6.025,27. Figura 1A Mostra immagini rappresentative della colorazione SA-β-gallone in proliferazione contro fibroblasti senescenti primari. Cellule guardare anche allargata e con un corpo cellulare irregolare. Come accennato, può essere difficile distinguere le singole celle, così che un co-colorazione con DAPI facilita la visualizzazione e cella conteggio (Figura 1B). È necessario scattare foto in un microscopio a fluorescenza per poter osservare la colorazione DAPI. Ciò significa che verranno eseguite delle fotografie sul canale campo luminoso in bianco/nero, in modo che la colorazione "blu" del SA-β-gallone apparirà nera sulle immagini. Di nota, non tutte le cellule all'interno di un campione sono positive per β-gallone. L'efficienza dell'induzione di senescenza dipende fortemente lo stimolo - e cella tipo/ceppo utilizzato. I protocolli descritti qui ha reso > 50% β-gallone cellule positive nei fibroblasti primari (BJ e WI-38) nelle nostre mani.
Meno cellule incorporano EdU dopo induzione della senescenza
EdU è un analogo della timidina nucleosidici che, durante la sintesi del DNA attiva, sarà incorporato nel DNA28. L'incorporazione di EdU in DNA può essere visualizzato dopo aver eseguito la cicloaddizione Copper-Catalyzed Azide-alchino (CuAAC) all'UDE, reazione che non può essere eseguita in timidina regolare perché manca l'alchino gruppo28. In questo particolare protocollo, viene utilizzato un Sulfo-Cy3-azide. Se l'accoppiamento di azide per l'alchino ha avuto luogo, celle verranno visualizzato fluorescenza sotto un filtro di Cy3 (Figura 2A). È importante tener conto che eseguendo l'analisi di incorporazione di EdU, cellule che stanno proliferando possono essere distinto da cellule non proliferanti. Le cellule non proliferanti possono essere sia quiescente o senescente, significato che l'analisi di incorporazione di EdU non può discriminare tra questi due tipi di arresto del ciclo cellulare.
Upregulate di fibroblasti senescenti il CDK inibitori p16 e p21
Le cellule senescenti fanno uso di inibitori delle CDKs per interrompere il ciclo cellulare29. Particolarmente p16 e p21 sono spesso misurati come marcatori di cellule senescenti3. Uno o entrambi i marcatori sono normalmente upregulated in cellule senescenti, e il upregulation è spesso misurato al livello trascrizionale. È incoraggiato a utilizzare contemporaneamente entrambi gli indicatori dal momento che alcune celle non non upregulate p16 al livello trascrizionale e p21 è un indicatore universale ma non specifico per senescenza15,17,30. La figura 3 Mostra il relativi rappresentante quantificazioni di p16 e p21 mRNA nei fibroblasti indotti a senescenza. Sono possibili anche altre tecniche quali immunostaining e/o macchiarsi occidentale per rilevare i livelli della proteina.
Fibroblasti senescenti visualizzare un SASP
Cellule più senescenti trascrizionalmente upregulate diversi geni che codificano per secreto proteine, un fenomeno chiamato SASP6. La SASP include fattori coinvolti nell'infiammazione, ad esempio, le interleuchine e chemochine, o nella degradazione della matrice extracellulare (ECM), ad esempio, MMPs, ma è molto eterogenea. Induzione di fattori SASP può essere valutato misurando i livelli di espressione di mRNA via qPCR o livelli di proteina secreta via Enzyme-Linked Immuno Sorbent Assay (ELISA). La figura 4 Mostra un'immagine rappresentativa mostrando il upregulation di IL6 sia a livello trascrizionale e secreto. Abbiamo usato IL6 solo come una rappresentazione; Tuttavia, è incoraggiato a misurare più membri di SASP dall'elenco suggerito sul protocollo 3.4.
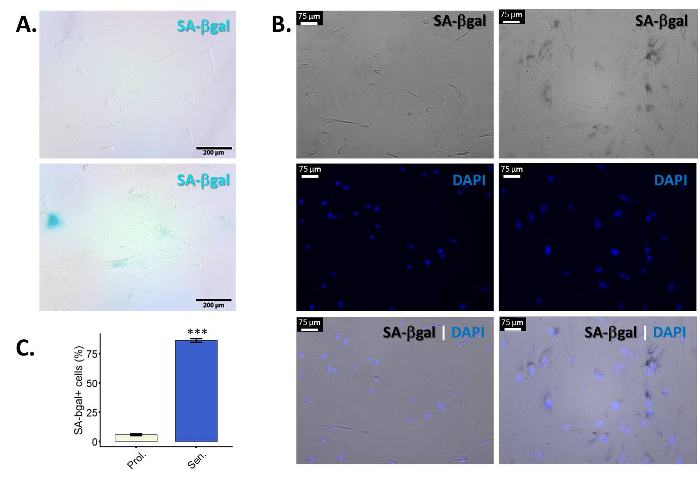
Figura 1: arricchimento di SA-β-gallone macchiatura in fibroblasti senescenti primarie. Fibroblasti BJ primario del prepuzio (34,1 PD) sono stati indotti a senescenza mediante esposizione a radiazioni ionizzanti (10 Gy). Le cellule sono state macchiate per SA-βgal dieci giorni dopo irradiazione. (A) risultati rappresentativi per la colorazione di SA-βgal nei fibroblasti primari BJ non trattata (up) o esposti a radiazioni ionizzanti (giù). Ingrandimento finale: 100 X. (B) figura rappresentativa della SA-β-gallone co-tinto con DAPI per i fibroblasti primari BJ o non trattati (pannelli a sinistra tre) o esposti a radiazioni ionizzanti (tre pannelli di destra). Il DAPI colorazione (blu) consente di visualizzare le singole celle facilitando la quantificazione. Le foto scattate sul campo chiaro appaiono in bianco/nero. Di conseguenza, in queste immagini particolare SA-β-gallone colorazione sarà simile a macchie nere perinucleare. Ingrandimento finale: 100 X. (C) quantificazione di SA-β-gallone positive cellule in proliferazione (Prol., bianco) fibroblasti BJ contro radiazioni ionizzanti controparti irradiati-trattati (SEN., blu). Quantificazione è stata eseguita utilizzando tre replicati biologici con barre di errore mostrando l'errore standard della media. Significatività statistica è stata determinata da un non accoppiati a due code test t di Student-sui valori di delta-CT. (n = 3, ± SEM, * * * = valore p < 0.01). Clicca qui per visualizzare una versione più grande di questa figura.
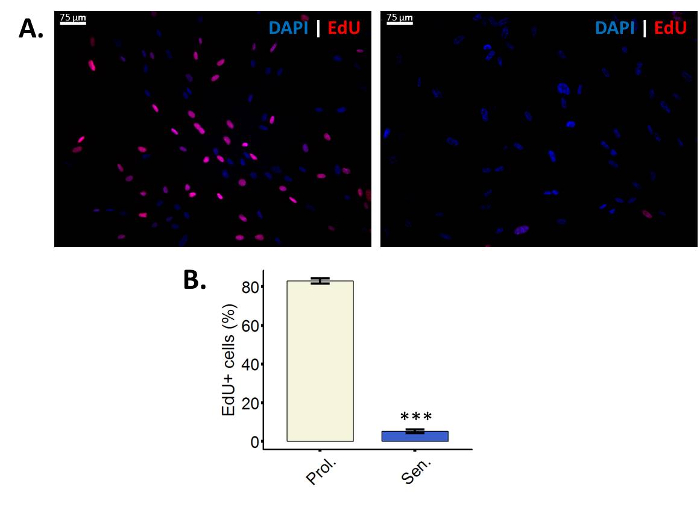
Figura 2: meno cellule incorporano EdU dopo induzione della senescenza. (A) immagine rappresentativa del dosaggio EdU incorporazione in fibroblasti di proliferazione WI-38 PD 43,86 (a sinistra) e le loro controparti irradiati ionizzante (a destra). Ingrandimento finale: 100 X. (B) quantificazione di EdU positive cellule in proliferazione (Prol., bianco) fibroblasti BJ (PD 38,7) contro loro controparti irradiati (SEN., blu). Quantificazione è stata eseguita utilizzando tre replicati biologici con barre di errore mostrando l'errore standard della media. Significatività statistica è stata determinata da un non accoppiati a due code test t di Student-sui valori di delta-CT (n = 3, ± SEM, * * * = valore p < 0.01). Clicca qui per visualizzare una versione più grande di questa figura.
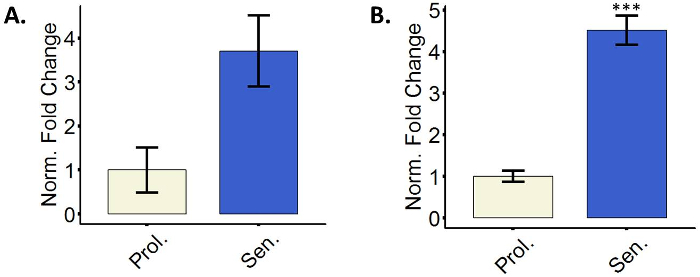
Figura 3: fibroblasti senescenti upregulate il CDK inibitori p16 e p21. (A) quantificazione dell'espressione del mRNA di p16 in proliferazione (Prol., bianco, PD 35,3) o cellule BJ 5-aza-trattate (SEN., blu). (B) quantificazione dell'espressione di mRNA di p21 in proliferazione (Prol., bianco, PD 35,3) o 5-aza-trattati BJ cellule (SEN., blu). Quantificazione è stata eseguita utilizzando tre replicati biologici (ognuno con due tecnici replica) con barre di errore mostrando l'errore standard della media. Significatività statistica è stata determinata da un non accoppiati a due code test t di Student-sui valori di delta-CT (n = 3, ± SEM, * * * = p valore < 0.01). Clicca qui per visualizzare una versione più grande di questa figura.
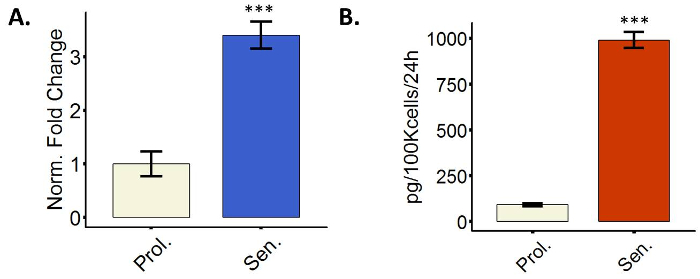
Figura 4: fibroblasti senescenti visualizzare un fenotipo secretivo (SASP). (A) quantificazione di IL6 mRNA espressione nei fibroblasti BJ entrambi proliferare (Prol., bianco, PD 38,7) o alla senescenza indotta da radiazioni ionizzanti (SEN., blu). (B) quantificazione dell'espressione della proteina IL6 nei proliferanti PD 38,6 (Prol., bianco) o trattati con radiazioni ionizzanti nei fibroblasti di WI38 (SEN., blu). Quantificazione è stata eseguita utilizzando tre replicati biologici con barre di errore mostrando l'errore standard della media. Nel caso i dati di qPCR, ogni replica biologica aveva due tecnici duplicati. Significatività statistica è stata determinata da un non accoppiati a due code test t di Student-sui valori di delta-CT (n = 3, ± SEM, * * * = valorep < 0.01). Clicca qui per visualizzare una versione più grande di questa figura.
| Diluente | Soluzione di riserva | Soluzione di lavoro | Diluizione per il trattamento | Concentrazione finale | |
| SAHA | DMSO | 100 mM | 1 mM | 1:1,000 | 1 ΜM |
| Butirrato di sodio | Acqua sterile | --- | 2. | 1: 250 | 4 mM |
| 5-aza-2'-deoxycytidine (5-aza) | DMSO | 100 mM | 10 mM | 1:1,000 | 10 ΜM |
Tabella 1: Stock e soluzioni di lavoro per i diversi trattamenti utilizzati per epigeneticamente-indotta senescenza.
| Componente | Volume | Concentrazione finale |
| 20 mg/mL X-gal | 1 mL | 1 mg/mL |
| 0,2 M acido citrico/sodio fosfato tampone ph 6.0 | 4 mL | 40 mM |
| ferrocianuro di potassio 100 mM | 1 mL | 5 mM |
| ferricianuro di potassio 100 mM | 1 mL | 5 mM |
| Cloruro di sodio 5 M | 0,6 mL | 150 mM |
| 1 M di cloruro di magnesio | 0,04 mL | 2 mM |
| Acqua | 12,4 mL | - |
| Totale | 20 mL |
Tabella 2: Composizione della soluzione di macchiatura usato per senescenza associati (SA) - β - gallone macchiatura.
| Destinazione | Forward Primer (5'--> 3') | Reverse Primer (5'--> 3') | Sonda UPL | ||
| Tubulina | CTTCGTCTCCGCCATCAG | CGTGTTCCAGGCAGTAGAGC | #40 | ||
| Actina B | ccaaccgcgagaagatga | ccagaggcgtacagggatag | #64 | ||
| P16 | GAGCAGCATGGAGCCTTC | CGTAACTATTCGGTGCGTTG | #67 | ||
| P21 | tcactgtcttgtacccttgtgc | ggcgtttggagtggtagaaa | #32 | ||
| IL6 | CAGGAGCCCAGCTATGAACT | GAAGGCAGCAGGCAACAC | #45 | ||
| IL8 | GAGCACTCCATAAGGCACAAA | ATGGTTCCTTCCGGTGGT | #72 | ||
| IL1a | GGTTGAGTTTAAGCCAATCCA | TGCTGACCTAGGCTTGATGA | #6 | ||
| CXCL1 | CATCGAAAAGATGCTGAACAGT | ATAAGGGCAGGGCCTCCT | #83 | ||
| CXCL10 | GAAAGCAGTTAGCAAGGAAAGGT | GACATATACTCCATGTAGGGAAGTGA | #34 | ||
| CCL2 | AGTCTCTGCCGCCCTTCT | GTGACTGGGGCATTGATTG | #40 | ||
| CCL20 | GCTGCTTTGATGTCAGTGCT | GCAGTCAAAGTTGCTTGCTG | #39 | ||
| PAI1 | AAGGCACCTCTGAGAACTTCA | CCCAGGACTAGGCAGGTG | #19 | ||
| MMP1 | GCTAACCTTTGATGCTATAACTACGA | TTTGTGCGCATGTAGAATCTG | #7 | ||
| MMP3 | CCAGGTGTGGAGTTCCTGAT | CATCTTTTGGCAAATCTGGTG | #72 | ||
| MMP9 | GAACCAATCTCACCGACAGG | GCCACCCGAGTGTAACCATA | #53 | ||
Tabella 3: Sequenze Primer e loro corrispondenti UPL sonda per il rilevamento di mRNA di senescenza marcatori in campioni di origine umana.
| Componente | Volume/campione |
| Sensifast sonda Lo-Rox mix | 5 Μ l |
| Set di primer (50 µM) | 0,1 Μ l |
| Sonda UPL | 0,1 Μ l |
| Acqua priva di nucleasi | 2,3 Μ l |
| cDNA (~ 4 ng) | 2,5 Μ l |
| Totale | 7.5 Μ l |
Tabella 4: Composizione della reazione qPCR mix per il sistema UPL.
Discussione
I protocolli spiegati qui sono stati ottimizzati per i fibroblasti primari umani, specialmente cellule BJ e WI-38. I protocolli per la senescenza replicativa, radiazioni ionizzanti e doxorubicina, sono stati applicati con successo ad altri tipi di fibroblasti (HCA2 e IMR90) e in altri tipi cellulari (vale a dire neonatali melanociti e cheratinociti o cardiomiociti derivati iPSC) nel nostro laboratorio. Tuttavia, gli adattamenti per i tipi di cellule supplementari possono essere ottimizzati regolando alcuni dettagli come il numero di cellule di teste di serie, i metodi e prodotti chimici per aiutare le cellule per collegamento/scollegamento di supporti in plastica e il dosaggio del trattamento per evitare la tossicità.
Anche l'uso dei fibroblasti primari pone una serie di sfide. Le cellule senescenti sono solitamente più difficili da staccare rispetto ai loro omologhi proliferanti, e sono spesso più sensibile alla trypsinization o qualsiasi altro tipo di disconnessione metodo, significa che la redditività dopo lo scollegamento è leggermente inferiore a quello di proliferazione delle cellule. La scelta del controllo appropriato per i diversi metodi di induzione della senescenza è difficile. Per esempio, per i trattamenti a base di droga come la doxorubicina, suggeriamo un breve trattamento con veicolo: PBS per 24 h nel caso di campioni di controllo per cellule trattate con doxorubicina seguita da raccolta/elaborazione immediata. Si potrebbe sostenere che le cellule indotte a senescenza passare attraverso un momento di cultura estesa dopo il trattamento è stato applicato (sei giorni extra di coltura per cellule trattate con doxorubicina) e che le cellule di controllo dovrebbero essere colta pari quantità di tempo dopo la rimozione di PBS. Tuttavia, tale cultura lungo avrebbe permesso le cellule per dividere ulteriormente, di diventare sovra- confluenti o per richiedere ulteriore passaggio e aumentare PD. sovra-confluenza può causare marcatori di senescenza, come SA-β-gallone ad apparire nonostante le cellule mantenere loro potenziale proliferazione31. Il PD maggiore sarebbe farli più vicino al loro limite di replica (e senescenza replicativa) e renderli meno comparabili alle loro controparti trattati con doxorubicina. Una situazione simile si applicherebbe per gli altri trattamenti. Abbiamo suggerito i controlli che riteniamo più appropriati per ciascun caso.
La maggior parte delle tecniche utilizzate per indurre le cellule in senescenza sembrano relativamente facile e semplice, ma molti fattori possono influenzare il risultato degli esperimenti. Per esempio, la concentrazione nel glucosio normale di terreni di coltura cellulare convenzionale per i fibroblasti è 4,5 g/L. Tuttavia, per alcuni tipi di cellule come le cellule staminali, le concentrazioni più basse di glucosio estendono loro potenziale proliferativo32, mentre per altri le più alte concentrazioni possono portare a senescenza prematura33. Inoltre, come le cellule senescenti sono altamente metaboliche e spendono quantità elevate di energia per produrre fattori secreti34, altri fenotipi senescenza-collegata potrebbero essere influenzati dalle oscillazioni nelle concentrazioni nel glucosio.
Un'altra potenziale variabile nel medium di coltura delle cellule è siero. La composizione del siero normalmente non è definita e varia a seconda dell'origine animale e il batch. In particolare, la quantità di fattori di crescita e di proteine pro-infiammatorie possa influenzare senescenza35. Si consiglia che lo stesso batch del siero viene utilizzato per l'intero esperimento per evitare inutili e confondenti variabilità. Eppure, alcuni inevitabili condizioni tecniche quali l'uso di medium senza siero utilizzato per alcuni protocolli basati su ELISA possono ridurre SASP espressione.
Tensione dell'ossigeno è importante per l'induzione completa senescenza. Ipossia può inibire geroconversion, in modo che le cellule non proliferano ma non sono irreversibilmente arrestato36. Tuttavia, il problema più comune nel setup sperimentale non è ipossia ma iperossia. Infatti, le condizioni di coltura standard spesso usano ossigeno 20% come "normoxia", ma condizioni fisiologiche per la maggior parte delle cellule sono più bassi. Blastocisti mouse presentano marcatori della senescenza (SA-βgal e DNA danni) quando coltivate a 20% di ossigeno, a differenza del loro in vivo-derivato controparti o le stesse cellule coltivate a 5% ossigeno37. Inoltre, fibroblasti di topo coltivate a altre condizioni fisiologiche (3% di ossigeno) e non a quelli (20% di ossigeno) visualizzazione convenzionale un SASP38. Qui, abbiamo usato 5% ossigeno per tutte le culture e gli esperimenti e abbiamo sollecitare ricercatori a riconsiderare le concentrazioni di ossigeno utilizzate per il tipo di cella specifica di interesse.
Infine, un altro fattore da considerare è l'eterogeneità intrinseca delle cellule senescenti. Da un lato, diversi tipi di cellule e anche i ceppi cellulari mostrano differenze nella senescenza-collegata fenotipi. Ad esempio, alcuni ceppi di fibroblasti non non upregulate p16 al livello trascrizionale su senescenza induzione15,16,17, come è anche mostrato in Figura 3A, dove nonostante vedendo un upregulation di P16, questo non era statisticamente significativo. P16 è controllata anche a livello post-traduzionale e post-traduzionali, quindi i livelli di proteina di misurazione potrebbe in alcuni casi dimostrare un'attività aumentata di questo inibitore CDK. Tuttavia, può essere che alcune cellule semplicemente fare affidamento su altri inibitori delle CDK come p21. Si consiglia di misurare i livelli trascrizionali di entrambi. La composizione esatta della SASP dipende anche la cellula che lo produce3. Inoltre, alcune cellule esprimono costitutivamente alti livelli di β-galattosidasi, dando un risultato positivo per la SA-β-gallone colorazione che non è necessariamente indicativa di senescenza3. In alcuni casi, questo problema potrebbe essere superato riducendo il tempo di incubazione con soluzione colorante durante il protocollo di colorazione di SA-β-gallone. Come accennato, cellule confluenti eccessiva potrebbero anche macchiare con il SA-β-gallone senza di loro essendo senescenti31, quindi invitiamo i ricercatori alle cellule di cultura scarsamente per l'esecuzione di questa colorazione. D'altra parte, il fenotipo di senescenza in sé non è stabile39. La composizione della SASP e la comparsa di altri marcatori della senescenza sono dipendenti dal tempo17,40. Qui, abbiamo suggerito i punti di tempo dopo ogni trattamento in cui le cellule sono considerati completamente senescenti e che sono abitualmente utilizzati nel nostro laboratorio. D'importanza, marcatori a un punto di tempo più breve di misurazione potrebbe rendere risultati negativi a causa di senescenza incompleta40. Inoltre, poiché nella maggior parte dei trattamenti una percentuale di cellule non diventano senescenti, utilizzando un punto di tempo più lungo potrebbe dare abbastanza tempo per poche cellule non senescenti espandere e superare la cultura, riducendo l'espressione di marcatori senescenti. In vista l'eterogeneità delle cellule senescenti e le avvertenze più dei marcatori diversi, consigliamo vivamente ai ricercatori di utilizzare più indicatori di senescenza nello stesso campione.
Divulgazioni
N/A
Riconoscimenti
Ringraziamo i membri del laboratorio Demaria per discussioni fruttuose e Thijmen van Vliet per la condivisione di dati e protocollo sulla senescenza indotta da UV.
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM Media - GlutaMAX | Gibco | 31966-047 | |
| Fetal Bovine Serum | Hyclone | SV30160.03 | |
| Penicillin-Streptomycin (P/S; 10,000 U/ml) | Lonza | DE17-602E | |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | SC-202581 | |
| Nuclease-Free Water (not DEPC-Treated) | Ambion | AM9937 | |
| T75 flask | Sarstedt | 833911002 | |
| Trypsin/EDTA Solution | Lonza | CC-5012 | |
| PBS tablets | Gibco | 18912-014 | |
| 1.5 ml microcentrifuge tubes | Sigma-Aldrich | T9661-1000EA | |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich | CLS430791 | |
| 6-well plate | Sarstedt | 83.3920 | |
| 24-well plate | Sarstedt | 83.3922 | |
| 13mm round coverslips | Sarstedt | 83.1840.002 | |
| Steriflip | Merck Chemicals | SCGP00525 | |
| Cesium137-source | IBL 637 Cesium-137γ-ray machine | ||
| UV radiation chamber | Opsytec, Dr. Göbel BS-02 | ||
| Doxorubicin dihydrochloride | BioAustralis Fine Chemicals | BIA-D1202-1 | |
| Hydrogen peroxide solution | Sigma-Aldrich | 7722-84-1 | |
| 5-aza-2’-deoxycytidine | Sigma-Aldrich | A3656 | |
| SAHA | Sigma-Aldrich | SML0061 | |
| Sodium Butyrate | Sigma-Aldrich | B5887 | |
| X-gal (5-Bromo-4-chloro-3-indolyl-β-D-galactopyranoside) | Fisher Scientific | 7240-90-6 | |
| Citric acid monohydrate | Sigma-Aldrich | 5949-29-1 | |
| Sodium dibasic phosphate | Acros organics | 7782-85-6 | |
| Potassium ferrocyanide | Fisher Scientific | 14459-95-1 | |
| Potassium ferricyanide | Fisher Scientific | 13746-66-2 | |
| Sodium Chloride | Merck Millipore | 7647-14-5 | |
| Magnesium Chloride | Fisher Chemicals | 7791-18-6 | |
| 25% glutaraldehyde | Fisher Scientific | 111-30-8,7732-18-5 | |
| 16% formaldehyde (w/v) | Thermo-Fisher Scientific | 28908 | |
| EdU (5-ethynyl-2’-deoxyuridine) | Lumiprobe | 10540 | |
| Sulfo-Cyanine3 azide (Sulfo-Cy3-Azide) | Lumiprobe | D1330 | |
| Sodium ascorbate | Sigma-Aldrich | A4034 | |
| Copper(II) sulfate pentahydrate (Cu(II)SO4.5H2O) | Sigma-Aldrich | 209198 | |
| Triton X-100 | Acros organics | 215682500 | |
| TRIS base | Roche | 11814273001 | |
| LightCycler 480 Multiwell Plate 384, white | Roche | 4729749001 | |
| Lightcycler 480 sealing foil | Roche | 4729757001 | |
| Sensifast Probe Lo-ROX kit | Bioline | BIO-84020 | |
| UPL Probe Library | Sigma-Aldrich | Various | |
| Human IL-6 DuoSet ELISA | R&D | D6050 | |
| Bio-Rad TC20 | Bio-Rad | ||
| Counting slides | Bio-Rad | 145-0017 | |
| Dry incubator | Thermo-Fisher Scientific | Heratherm | |
| Dimethylformamide | Merck Millipore | 1.10983 | |
| Parafilm 'M' laboratory film | Bemis | #PM992 | |
| Tweezers | |||
| Needles |
Riferimenti
- Hayflick, L., Moorhead, P. S. The serial cultivation of human diploid cell strains. Experimental Cell Research. 25, 585-621 (1961).
- Muñoz-Espín, D., Serrano, M. Cellular senescence: from physiology to pathology. Nature reviews. Molecular cell biology. 15, 482-496 (2014).
- Sharpless, N. E., Sherr, C. J. Forging a signature of in vivo senescence. Nature Reviews Cancer. 15 (7), 397-408 (2015).
- Correia-Melo, C., et al. Mitochondria are required for pro-ageing features of the senescent phenotype. The EMBO Journal. 10, e201592862 (2016).
- Loaiza, N., Demaria, M. Cellular senescence and tumor promotion: Is aging the key?. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. , (2016).
- Coppe, J. P., et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biology. 6 (12), 2853-2868 (2008).
- Baker, D. J., et al. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature. 530 (7589), 184-189 (2016).
- Xu, M., et al. Targeting senescent cells enhances adipogenesis and metabolic function in old age. Elife. 4, e12997 (2015).
- Baker, D. J., et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479 (7372), 232-236 (2011).
- Jeon, O. H., et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nature Medicine. 23 (6), 775-781 (2017).
- Demaria, M., et al. Cellular Senescence Promotes Adverse Effects of Chemotherapy and Cancer Relapse. Cancer Discovery. 7 (2), 165-176 (2017).
- Chang, J., et al. Clearance of senescent cells by ABT263 rejuvenates aged hematopoietic stem cells in mice. Nature Medicine. 22 (1), 78-83 (2016).
- Soto-Gamez, A., Demaria, M. Therapeutic interventions for aging: the case of cellular senescence. Drug Discov Today. 22 (5), 786-795 (2017).
- Childs, B. G., et al. Senescent cells: an emerging target for diseases of ageing. Nature Reviews Drug Discovery. 16 (10), 718-735 (2017).
- Marthandan, S., et al. Conserved genes and pathways in primary human fibroblast strains undergoing replicative and radiation induced senescence. Biological Research. 49, 34 (2016).
- Marthandan, S., et al. Conserved Senescence Associated Genes and Pathways in Primary Human Fibroblasts Detected by RNA-Seq. PLoS One. 11 (5), e0154531 (2016).
- Hernandez-Segura, A., et al. Unmasking Transcriptional Heterogeneity in Senescent Cells. Current Biology. 27 (17), 2652-2660 (2017).
- Le, O. N., et al. Ionizing radiation-induced long-term expression of senescence markers in mice is independent of p53 and immune status. Aging Cell. 9 (3), 398-409 (2010).
- Hall, J. R., et al. C/EBPalpha regulates CRL4(Cdt2)-mediated degradation of p21 in response to UVB-induced DNA damage to control the G1/S checkpoint. Cell Cycle. 13 (22), 3602-3610 (2014).
- Nitiss, J. L. Targeting DNA topoisomerase II in cancer chemotherapy. Nature Reviews Cancer. 9 (5), 338-350 (2009).
- Pazolli, E., et al. Chromatin remodeling underlies the senescence- associated secretory phenotype of tumor stromal fibroblasts that supports cancer progression. Cancer Research. 72, 2251-2261 (2012).
- Venturelli, S., et al. Differential induction of apoptosis and senescence by the DNA methyltransferase inhibitors 5-azacytidine and 5-aza-2'-deoxycytidine in solid tumor cells. Molecular Cancer Therapeutics. 12, 2226-2236 (2013).
- Tennant, J. R. Evaluation of the Trypan Blue Technique for Determination of Cell Viability. Transplantation. 2, 685-694 (1964).
- Livak, K. J., Schmittgen, T. D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25 (4), 402-408 (2001).
- Lee, B. Y., et al. Senescence-associated β-galactosidase is lysosomal β-galactosidase. Aging Cell. 5, 187-195 (2006).
- Kopp, H. G., Hooper, A. T., Shmelkov, S. V., Rafii, S. Beta-galactosidase staining on bone marrow. The osteoclast pitfall. Histology and Histopathology. 22 (9), 971-976 (2007).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences. 92 (20), 9363-9367 (1995).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proceedings of the National Academy of Sciences. 105 (7), 2415-2420 (2008).
- Sherr, C. J., McCormick, F. The RB and p53 pathways in cancer. Cancer Cell. 2 (2), 103-112 (2002).
- Bunz, F., et al. Requirement for p53 and p21 to sustain G2 arrest after DNA damage. Science. 282 (5393), 1497-1501 (1998).
- Severino, J., Allen, R. G., Balin, S., Balin, A., Cristofalo, V. J. Is beta-galactosidase staining a marker of senescence in vitro and in vivo. Experimental Cell Research. 257 (1), 162-171 (2000).
- Stolzing, A., Coleman, N., Scutt, A. Glucose-induced replicative senescence in mesenchymal stem cells. Rejuvenation Research. 9 (1), 31-35 (2006).
- Blazer, S., et al. High glucose-induced replicative senescence: point of no return and effect of telomerase. Biochemical and Biophysical Research Communications. 296 (1), 93-101 (2002).
- Wiley, C. D., Campisi, J. From Ancient Pathways to Aging Cells-Connecting Metabolism and Cellular Senescence. Cell Metabolism. 23 (6), 1013-1021 (2016).
- Kumar, R., Gont, A., Perkins, T. J., Hanson, J. E. L., Lorimer, I. A. J. Induction of senescence in primary glioblastoma cells by serum and TGFbeta. Scientific Reports. 7 (1), 2156 (2017).
- Hypoxia Blagosklonny, M. V. MTOR and autophagy: converging on senescence or quiescence. Autophagy. 9 (2), 260-262 (2013).
- Meuter, A., et al. Markers of cellular senescence are elevated in murine blastocysts cultured in vitro: molecular consequences of culture in atmospheric oxygen. Journal of Assisted Reproduction and Genetics. 31 (10), 1259-1267 (2014).
- Coppe, J. P., et al. A human-like senescence-associated secretory phenotype is conserved in mouse cells dependent on physiological oxygen. PLoS One. 5 (2), e9188 (2010).
- van Deursen, J. M. The role of senescent cells in ageing. Nature. 509 (7501), 439-446 (2014).
- Kim, Y. M., et al. Implications of time-series gene expression profiles of replicative senescence. Aging Cell. 12, 622-634 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon