Method Article
Métodos de estadiamento Pupal períodos e medição de asa pigmentação da Drosophila guttifera
Neste Artigo
Resumo
Protocolos para encenar o período pupal e medição de pigmentação de asa de Drosophila guttifera são descritos. Preparação e quantificação de pigmentação fornecem uma base sólida para estudar os mecanismos do desenvolvimento dos traços adultos e habilitar interespecífica comparação do desenvolvimento de traço.
Resumo
Diversificadas espécies de Drosophila (mosca de fruta) fornecem oportunidades para estudar os mecanismos de desenvolvimento e alterações genéticas responsáveis por mudanças evolutivas. Em particular, a fase adulta é uma fonte rica de traços morfológicos para comparação interespecífica, incluindo comparação de pigmentação de asa. Para estudar as diferenças de desenvolvimento entre as espécies, a observação detalhada e preparo adequado são necessários para comparação precisa. Aqui descrevemos os protocolos para preparo dos períodos pupal e quantificação de pigmentação da asa de uma mosca de fruta bolinhas, Drosophila guttifera. Primeiro, descrevemos o método por observação morfológica detalhada e definição dos estágios pupal baseado em morfologias. Este método inclui uma técnica para remover o casulo, que é o caso de quitinoso exterior da pupa, para permitir a observação detalhada de morfologias pupal. Em segundo lugar, descrevemos o método para medir a duração da fase pupal definido. Finalmente, descrevemos o método para a quantificação de pigmentação de asa com base na análise de imagem usando imagens digitais e o software ImageJ. Com esses métodos, podemos estabelecer uma base sólida para a comparação de processos de desenvolvimento de traços adultos durante estágios pupal.
Introdução
Alguns dos traços morfológicos da drosófila são diversificados entre espécies1,2,3,4,5. Vamos aproximar-na questão da diversidade morfológica como surge, comparando os mecanismos de geração destas morfologias. Exemplos de tais morfologias são tricomas larvas, pentes de sexo adulto, aparelho genital externo, pigmentação abdominal e asa pigmentação6,7,8,9, 10 , 11 , 12 , 13 , 14 , 15. para estudar diferenças morfológicas entre os adultos, observação e análise da fase de pupa são importantes, porque o destino dos traços adultos é determinado na fase larval atrasado e subsequente morfogênese continua durante o período pupal.
Em estudos de biologia do desenvolvimento da Drosophila melanogaster, "horas APF" (horas depois da formação de pupa) é o método comum para indicar uma fase de pupa,16. Este sistema emprega o tempo absoluto após formação de pupa e é muito conveniente para experimentos de rotina. No entanto, velocidade do desenvolvimento pode diferir entre pupas e pode ser afectada por pequenas diferenças genéticas, epigenéticas ou microenvironmental, e, portanto, tendo o mesmo tempo absoluto após formação pupal não garante que as pupas são ao mesmo estágio do desenvolvimento. Em muitos casos, estágios definidos por características morfológicas são preferíveis para comparar vários indivíduos. Especialmente, uma comparação entre espécies requer preparo preciso e a comparação entre os estágios (homólogos) correspondentes.
Reconhecido de Bainbridge e Bownes17 20 estágios pupal (P1 a P15(ii)) baseada em características morfológicas das pupas de Drosophila melanogaster . Esta plataforma é o mais utilizado sistema de preparo do desenvolvimento morfológico18. Em um estudo anterior, realizamos encenando pupal de Drosophila guttifera para estabelecer uma base para asa pigmentação estudos19. D. guttifera tem um padrão de bolinhas pretas nas asas e é uma das espécies modelo para asa pigmentação formação20. Embora nós referidos os critérios morfológicos descritos na Bainbridge e 'Bownes pesquisa17, medimos diretamente durações de palco por observações serial19, em vez de usando Bainbridge e 'Bownes estimativa de durações de palco observava a frequência. Aqui descrevemos o método de preparo pupal e medição de durações dos estágios pupal de Drosophila usado em Fukutomi et al.19.
Para estudar o mecanismo do desenvolvimento de pigmentação de asa, precisamos saber quando nas fases de pupa ou adultos a pigmentação ocorre. Fukutomi et al. 19 quantificada densidades ópticas (ODs) de pigmentação durante estágios pupal e adultos por análise de imagem de imagens de asa. A pigmentação da drosófila asas é pensada para ser causado pelo acúmulo de melanina negra21. Para quantificação de ODs, foram utilizadas imagens de escala de cinza e ImageJ software (https://imagej.nih.gov/ij/)22 . Para reconhecer e quantificar a pigmentação local-específicos (ΔOD), subtraímos o OD fora de um local o OD dentro de um lugar. Para tornar este método reprodutível e objetiva, os locais de medição de OD devem ser determinados utilizando as veias da asa como Marcos. Neste artigo, descrevemos detalhadamente este método de quantificação de pigmentação de asa em Drosophila guttifera.
Protocolo
1. estoque de voar
- Use Drosophila guttifera para todos os protocolos a seguintes.
- Usar frascos plásticos (diâmetro 25 mm x altura 96mm) e tampões de celulose (diâmetro 23 milímetros x altura 26 mm) para a manutenção de estoque. Usar um padrão alimentar de farinha de milho/açúcar/levedura/agar e siga uma publicação descreveu três outras receitas alternativas para esta espécie2.
Nota: d. guttifera (número conservado em estoque 15130-1971.10) é fornecido pelo espécie Drosophila Stock Center da Universidade da Califórnia, San Diego. Embora d. guttifera pertence a immigrans-tripunctata radiação, que é parente de d. melanogaster dentro do género de23, tem muitas propriedades biológicas em comum com D. melanogaster . Nesse sentido, o presente protocolo pode ser aplicado para muitas espécies de Drosophila , embora algumas espécies exigem alimentos específicos e/ou técnicas dicas para mantê-los2.
2. observação de pupa e definição dos estágios pupal
Nota: A pupa para observação é retirada o mosca estoque mantido com um 12:12 h claro/escuro ciclo a 25 ° C. Bainbridge e Bownes17 descrito um baixo risco de mover d. melanogaster pupas do local original de pupação em um pedaço de papel de tecido umedecido (sobrevivência de 97% de 946 pupas movidas). D. guttifera pupas podem ser preparadas por essencialmente o mesmo método.
- Coloque adultos saudáveis de Drosophila em alimentos frescos (alimentação de farinha de milho/açúcar/levedura/ágar padrão) em um frasco plástico (diâmetro 25 mm x altura 96mm) e deixá-los a pôr ovos. Espere 7 dias para obter a tarde 3º ínstares.
- Coloque 1 mL de padrão alimentar de farinha de milho/açúcar/levedura/agar para cada microtubo de 1,5 mL. Faça 3 furos com espaçamento de 2 mm em tampas de microtubos por penetrante com um pino de pressão para permitir a respiração.
- Centrifugue os microtubos com comida para 7 s numa microcentrifuga mini (860 x g).
- Inverter e frascos para remover todos os adultos do frasco.
- Despeje a 5-10 mL de DDQ2O (ou reverter a água de osmose) dentro do frasco.
- Deite fora as larvas com água em um prato de Petri de plástico (diâmetro 90 mm x altura 15 mm). Identifica tarde 3º ínstares por seu tamanho de corpo grande (3 a 4 mm de comprimento).
- Movimente suavemente tarde 3º ínstar larvas com pinça em microtubos com comida (10 larvas / microtubo). Incube-los durante a noite, a 25 ° C.
- Mover a pupa recém formada em um pedaço de papel de tecido que foi umedecido por ddH2O e colocado em uma placa de Petri de plástico (diâmetro 35 milímetros x altura 10 mm).
- Coloque o prato de Petri em uma câmara úmida (contendo 10 mL de DDQ2O na parte inferior) e espere até que as pupas desenvolvem-se para a fase desejada.
- Mover-se pupas em um pedaço de papel de tecido umedecido em uma placa de Petri de plástico (diâmetro 60 mm x altura 15 mm).
Nota: A definição dos estágios pode principalmente ser feita com base na fase de d. melanogaster17. Normalmente, o período pupal de Drosophila pode ser categorizado em P1 - P15(ii), apesar de algumas modificações da definição do estágio seria necessárias dependendo da espécie utilizada. Se possível, remover o casulo permite a observação precisa e detalhada. Ver detalhes abaixo (etapa 3). - Observe a pupas sob um microscópio estéreo. Tira fotografias utilizando uma câmera digital conectada ao microscópio estéreo.
3. remover o casulo
Nota: Pupas de drosófila são cobertas por uma estrutura chamada o casulo. Um inseto do Muscomorpha (moscas) não derramou sua cutícula larval em pupa; em vez disso, ele endurece a cutícula depois de apolysis e usa-lo como uma capa protetora da pupa, o casulo24. Uma pupa que residem dentro de um casulo tem uma cutícula pupal verdadeira, que é muito macia e frágil. Antes de apolysis ocorre em torno de P4(ii), epitélios e casulo estão ligados juntos, e, portanto, remover o casulo sem danos é muito difícil. Depois P5, remover o casulo é trabalhoso, mas útil para observação morfológica e definição dos estágios pupal. O processo é realizado da seguinte forma.
- Afixe um pedaço de fita dupla-face em um pedaço de papel toalha.
- Coloque uma pupa sobre a fita dupla-face ventral para cima (figura 1A).
- Localize o espaço entre o lado anterior do casulo e a pupa interna. Segure e remover o casulo em torno desta lacuna usando fórceps e expor o lado anterior da cabeça da pupa.
- Introduza a ponta de uma pinça, movendo-se paralelamente ao eixo ântero-posterior. Levante a ponta da pinça para quebrar localmente o casulo. Repita essa ação até que a ruptura atinja a parte posterior do casulo. Certifique-se de que uma lacuna é também formada entre o casulo e pernas pupal e quebrar o lado ventral do casulo e minimizar os danos que a pupa interno (figura 1B).
- Depois de quebrar o casulo tanto quanto possível, tire a pupa usando um pincel fino (#5/0) (Figura 1).
- Coloque um pedaço de papel de tecido que foi umedecido com DDQ2O e colocado em uma placa de Petri de plástico a pupa (diâmetro 60 mm x altura 15 mm). Tira fotografias mais rápido possível, porque a pupa exposta é vulnerável e facilmente torna-se seco.
Nota: Pupas sem um casulo não são adequadas para medir a duração do período pupal (etapa 4), porque stress (como dessecação) e danos físicos podem interferir no desenvolvimento normal.
4. duração dos estágios pupal de medição
- Prepare-se pupas para medir a duração dos estágios pupal conforme descrito na etapa 2. Colete pupas de 1-2, 2-3 e 3-4 dias após a formação de pupa (20 pupas cada). Dar números de identificação individual (1-60) para pupas para identificação. Continue coletando recém formado pupas durante as etapas a seguir, para obter 20 mais jovens pupas. Dar números de identificação individual (61-80) para as recém-formado pupas. Coloque uma pupa num pedaço de DDQ2embebida em O papel de tecido em um poço (3,9 cm2), de uma placa de cultura de células de 12-poços (1 pupa/bem, pupas 12/placa). Preencha o espaço inter bem de placas com DDQ2O para manter a umidade, colocar as tampas e colocar as placas em 25 ° C, as condições de luz constante (24:0 h claro/escuro).
Nota: Pupas sem um casulo não são adequadas para medir a duração do período pupal. Por favor, não remova o casulo. - Observe as características morfológicas incluindo cor do corpo, cerdas, túbulos de Malpighi e corpo amarelo de pupas de todos, uma vez a cada 30 min e recorde observaram fases (P1 - P15(ii), com base em referências17,19) em uma folha de registro.
- Continue gravando ao longo de quatro dias seguidos (96 h) por uma mudança de rotação de três (ou mais) pessoas.
- Contar números de registros de cada estágio específico e os média (média de contagem de observações / pupas). Então multiplicá-los por 0,5 (h), resultando em comprimentos estimados das fases (h).
5. medida da intensidade das manchas pretas na asa
Nota: A intensidade das manchas pretas na asa pupa ou adulta pode ser quantificada através da medição de densidade óptica (OD). Um filtro de vidro com conhecidos ODs (filtro de densidade escalonado) é usado para calibração de25, para que se pode calcular o OD de uma determinada área de uma imagem digital de uma asa. Medem-se a OD em um ponto e o OD fora do local, e o último é subtraído de primeira para obter a intensidade do spot (ΔOD). Aqui, descrevemos o método de dissecação, medição e cálculo de ΔOD. Este procedimento pode ser feito depois do passo 2, independente da etapa 3 e a etapa 4. Uma vez que executou o passo 2 e compreende todas as fases de pupa, um diretamente pode iniciar ou repita o passo 5.
- Preparação de imagem
- Prepare uma nova pupa de um palco focal, conforme descrito na etapa 2. Remova a parte anterior de um casulo com fórceps. Retire a pupa usando a pinça e coloque-o no soro de tampão fosfato (PBS, tabela 2) em uma placa de Petri de plástico (diâmetro 35 milímetros x altura 10 mm).
- Cortar a articulação basal de uma asa (articulação basal é parte proximal estreita da asa). Como a asa é dobrada, coloque-o em um prato de Petri de plástico (diâmetro 35 milímetros x altura 10mm) repleto de DDQ2O para estendê-lo por pressão osmótica (ala se desenrola por si só).
- Colete recém eclosed adultos uma vez a cada 10 min de um frasco de estoque. Anestesiar uma mosca com CO2 usando uma almofada de anestésico CO2 , confirmar anesthetization pela imobilidade e cortar a articulação basal de uma asa.
- Lugar 10 µ l de PBS sobre uma lâmina de vidro, coloque a asa lá e cubra com uma lamínula (18 x 18 mm).
- Acenda a luz do microscópio estéreo. Defina a luz para estar no nível máximo. Conjunto da lente objetiva 11,5 X. Defina o diafragma para ser o estado mais aberto. Ligue a câmera. Ajustar a câmera para ser (ISO: 100, modo SHQ 3136 x 2352 pixéis, velocidade do obturador: 1/20 s). Concentre-se na amostra, movendo o botão de foco do microscópio.
- Aperte o botão do obturador da unidade de controle remoto para ter uma imagem. Com 3 imagens por asa, cada um dos quais deve ser centrado em um sensillum de campaniform, veia longitudinal posterior ou ponto crossvein, posicionando a parte distal da asa do lado esquerdo e a parte anterior da asa do lado superior.
- Calibração
- Com imagens de 9 partes de um filtro de densidade escalonado, usando as mesmas configurações de câmera usadas para obter a imagem da asa.
- Inicie o ImageJ software (https://imagej.nih.gov/ij/)22.
- Clique em arquivo de | Aberto | e selecione uma das imagens do filtro densidade escalonado.
- Clique na imagem | Tipo | 8-bit | para converter a imagem para uma imagem de 8 bits.
- Clique em Editar | Seleção | Especificar | e verifique a coluna Oval e centralizado . Escreva 100 (pixels) na coluna de largura , 100 (pixels) na coluna de altura , 1568 na coluna X coordenar e 1176 na coluna Y coordenar . Clique Okey.
- Clique em analisar | Medida |. O valor de cinza "significa" de áreas selecionadas é medidos.
- 5.2.3 repetição. para 5.2.6. para os 8 restantes imagens.
- Clique em analisar | Calibrar o e selecione Rodbard25 em função de coluna e escreva o número seguinte na coluna à direita no meio (0.04, 0.336, 0.632, 0.928, 1.224, 1.52, 1.816, 2.112, 2.408; esses números dependem da densidade da pisou o filtro de densidade).
- Verificar calibração Global coluna e clique Okey.
Nota: Ao executar este procedimento, "significa o valor cinza" é convertido para "densidade óptica (OD)" usando a função Rodbard. Após esta etapa, a densidade óptica pode ser calculada para uma determinada área selecionada no software ImageJ.
- Escolhendo a área das medições
Nota: Os pontos são tipicamente associados com Marcos, tais como campaniform sensilas, dicas de veia longitudinal e crossveins. Estes e outros pontos de interesse em uma asa podem ser usados para escolher a região das medições. Aqui, um exemplo emD. guttifera(Figura 2) é descrito.- Definição do ponto A, ponto de sensillum de campaniform.
- Abra uma imagem no qual um ponto de sensillum de campaniform está no centro da imagem. Clique na imagem | Tipo | 8-bit | para converter a imagem para uma imagem de 8 bits.
- Clique em retângulo na Área de ferramentas de seleção e desenhe um retângulo. Definido o vértice superior esquerdo do retângulo que é anexado à linha posterior da veia longitudinal terceira e mais distal de um ponto de sensillum de campaniform. Defina o lado direito do retângulo para que está localizado à direita do sensillum de campaniform local.
- Clique em Editar | Seleção | Adicionar ao Gerenciador |. Verifique a coluna Mostrar tudo .
- Clique em ferramenta de ângulo na Linha de ferramentas de seleção. Desenhe a primeira linha na linha posterior de terceira veia longitudinal. Defina os pontos de extremidade esquerdos da linha no vértice do retângulo desenhado na etapa 1. Desenhe a segunda linha na parte superior do retângulo. Pressione a tecla "m" para medir o ângulo entre as duas linhas desenhadas nesta etapa. Clique na janela da imagem na tela do computador.
- Clique em Editar | Seleção | Adicionar ao Gerenciador |.
- Clique em retângulo na Área de ferramentas de seleção e desenhe um retângulo de aproximadamente 1/9 o tamanho da janela de imagem. Clique em Editar | Seleção | Gire |. Escreva os graus negativos do ângulo medido na etapa 5.3.1.4. na coluna de ângulo e clique em Okey para girar o retângulo desenhado nesta etapa.
- Mova o retângulo desenhado na etapa 5.3.1.6. usando as teclas de seta. Defina o ponto de extremidade da linha posterior da veia longitudinal segunda no lado esquerdo do retângulo e o lado inferior do retângulo anexado à linha posterior da terceira veia longitudinal. Confirme que uma linha perpendicular do ponto final da veia longitudinal segundo a linha posterior da veia longitudinal terceira é desenhada neste procedimento. Defina o pé da linha perpendicular como ponto A (Figura 2A).
- Gravar a coordenada x e a coordenada y do ponto A, indicado abaixo Ferramentas de seleção de área , ao colocar o cursor no ponto A.
- Definição do ponto B, ponto de ponta veia longitudinal
- Abra uma imagem em que uma veia longitudinal dica local está no centro da imagem. Clique na imagem | Tipo | 8-bit | para converter a imagem para uma imagem de 8 bits.
- Repita o mesmo procedimento descrito na etapa 5.3.1. (Definição do ponto A, campaniform sensillum local) para encontrar o ponto A na imagem.
- Clique em Editar | Seleção | Adicionar ao Gerenciador |.
- Clique em retângulo na Área de ferramentas de seleção e desenhe um retângulo. Defina o vértice superior esquerdo do retângulo no ponto final da linha posterior da terceira veia longitudinal.
- Clique em Editar | Seleção | Adicionar ao Gerenciador |.
- Clique em ferramenta de ângulo na Linha de ferramentas de seleção. Desenhe a primeira linha para conectar o ponto A e o ponto final da linha posterior da terceira veia longitudinal. Defina esta linha como linha A. desenhar a segunda linha na parte superior do retângulo desenhado na etapa 5.3.2.4. Pressione a tecla "m" para medir o ângulo entre as duas linhas.
- Clique em Editar | Seleção | Adicionar ao Gerenciador |.
- Clique em retângulo na Área de ferramentas de seleção e desenhe um retângulo de aproximadamente 1/9 o tamanho da janela de imagem. Clique em Editar | Seleção | Gire |. Escreva os graus negativos do ângulo medido na etapa 5.3.2.6. na coluna de ângulo e clique em Okey para girar o retângulo desenhado nesta etapa. Mova o retângulo usando as teclas de seta. Definido o lado superior do retângulo que é anexado a linha A e o ponto final da linha anterior da veia longitudinal quarta para que fique do lado esquerdo do retângulo.
- Clique em Editar | Seleção | Adicionar ao Gerenciador |.
- Clique em retângulo na Área de ferramentas de seleção e desenhe um retângulo de aproximadamente 1/9 o tamanho da janela de imagem. Clique em Editar | Seleção | Gire |. Escrever os graus negativos do ângulo medido na etapa 6, na coluna de ângulo e clique em Okey para girar o retângulo desenhado nesta etapa. Mova o retângulo usando as teclas de seta. Definir o vértice inferior esquerdo do retângulo para que está no vértice superior esquerdo do retângulo desenhado na etapa 5.3.2.8., resultando na obtenção da linha perpendicular do ponto final da linha anterior da veia longitudinal quarta linha A. definir o ponto de intersecção da linha perpendicular e a linha posterior da veia longitudinal terceira como ponto B (Figura 2B).
- Gravar a coordenada x e a coordenada y do ponto B, indicado abaixo Ferramentas de seleção de área , ao colocar o cursor no ponto B.
- Definição do ponto C, ponto de crossvein posterior
- Abra uma imagem no qual um ponto de crossvein posterior está no centro da imagem. Clique na imagem | Tipo | 8-bit | para converter a imagem para uma imagem de 8 bits.
- Defina o ponto C como o ponto mais posterior da linha anterior de quarta veia longitudinal na área de interseção da crossvein posterior e a quarta veia longitudinal (Figura 2).
- Gravar a coordenada x e a coordenada y do ponto C, indicado abaixo Ferramentas de seleção de área , ao colocar o cursor no ponto C.
- Definição do ponto D, área de controle
- Abra uma imagem no qual um ponto de sensillum de campaniform está no centro da imagem. Clique na imagem | Tipo | 8-bit | para converter a imagem para uma imagem de 8 bits.
- Clique em linha reta em Ferramentas de seleção de linha e desenha uma linha conectando o ponto final da linha anterior da segunda veia longitudinal e o ponto final da linha posterior da veia longitudinal quarta. Defina ponto D como o ponto de passagem da linha e a linha posterior da terceira veia longitudinal (Figura 2D).
- Gravar a coordenada x e a coordenada y do ponto D, indicado abaixo Ferramentas de seleção de área , ao colocar o cursor no ponto D.
- Definição do ponto A, ponto de sensillum de campaniform.
- Medições
- Abra uma das imagens de manchas de asa (para medição do ponto A, abra a imagem com um ponto no centro). Clique na imagem | Tipo | 8-bit | para converter a imagem para uma imagem de 8 bits.
- Clique em retângulo na Área de ferramentas de seleção e desenhe um retângulo de aproximadamente 1/9 tamanho da janela de imagem.
- Clique em Editar | Seleção | Especificar |. Verifique a coluna Oval e centralizado . Escreva 100 (pixels) em colunas de largura e altura , escrever as coordenadas de x do ponto A (ou B ponto ou ponto C) e D na coluna X coordenar e gravar o y coordenadas do ponto A (ou B ponto ou ponto C) e D na coluna Y coordenar . Clique Okey.
- Clique em analisar | Medida |. Se a calibração descrita em 5.2 já foi terminada, ODs são indicados na coluna quer dizer .
- Calcular ΔODs subtraindo OD do ponto D do ODs dos pontos A, B e C.
Nota: Ponto D é em uma parte transparente da ala não inclui pigmentação e, portanto, é apropriado para um controle de fundo.
Resultados
O período pupal de d. guttifera é dividido em 17 estágios (P1 - P15(ii); imagens de representante de três estágios (P1, P5 - 6, P10) são mostrados a Figura 3e todas as 17 fases estão ilustradas na Figura 4). Embora Bainbridge e Bownes17 reconhecido 20 fases no d. melanogaster, alguns destes estágios não poderiam ser aplicado a d. guttifera. A ordem dos dois eventos do desenvolvimento, a aparência do corpo amarelo (massa de células de galpão dentro do intestino26) e o timing de túbulos de Malpighi, ficando verde, não são estritamente controlados em guttifera d., e, portanto, nós não pode separar P5 (i ), P5(ii) e P6. Também, ao contrário de d. melanogaster, o timing de enegrecimento das cerdas torácicas e abdominais foi sincronizado, e, portanto, nós não pode separar P11(i) e P11(ii)19.
Nós poderia medir o comprimento dos estágios pupal de d. guttifera (tabela 3, de Fukutomi et al.19). Todo o período pupal é mais do que d. melanogaster em 25 ° C17aproximadamente 20 h. Calculamos o ΔODs das áreas ao redor de um campaniform sensillum, dica de veia longitudinal e posterior crossvein. Aqui, nós mostramos o ODs e ΔODs em adultos 7 dias após a eclosão (tabela 4). Comparando os dados de múltiplos estágios, encontramos que o palco P12(i) é a hora de início da pigmentação, e essa pigmentação é completada por 24 h após a eclosão (Figura 5, as medições original usado em Fukutomi et al. 19).
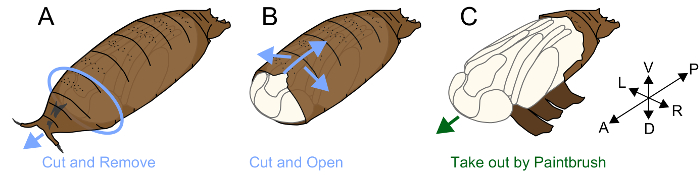
Figura 1. Ilustração de remoção casulo. (A) Coloque um lado ventral crisálidas em um pedaço de fita dupla-face. Remova a parte anterior do casulo. (B) quebre o casulo com pinça do lado ventral. (C) depois de quebrar o casulo, tire a pupa usando um pincel. Clique aqui para ver uma versão maior desta figura.

Figura 2. Definição da área de medição pigmentação. (A) o ponto A para um lugar associado com um sensillum de campaniform. (B) o ponto B por um ponto associado com uma ponta de veia longitudinal. (C) o ponto C para um local associado a uma posterior crossvein. (D) ponto D para uma área de controle. Escala barras indicam 250 µm. clique aqui para ver uma versão maior desta figura.

Figura 3. Exemplos de estágios pupal definidos. (A) pupa do palco coberto de P1 com o casulo. (B) pupa da fase P5 - 6. (C) Pupa do palco P10. Os casulos são removidos antes de observação em (B) e (C). Escala barras indicam 500 µm. clique aqui para ver uma versão maior desta figura.
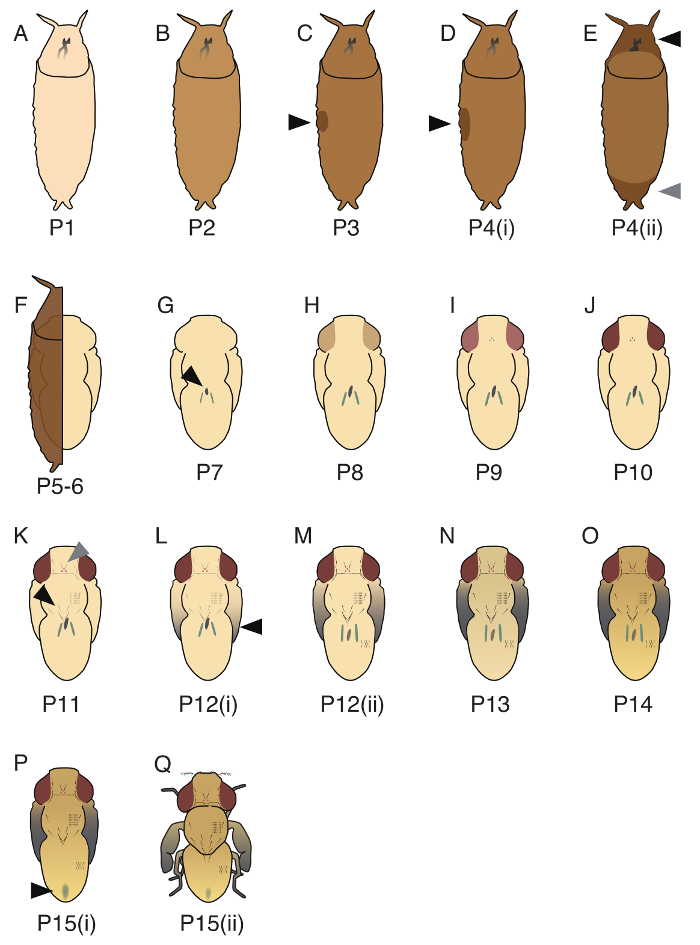
Figura 4. Ilustrações de 17 estágios pupal identificados em d. guttifera. (A) P1, o casulo é branco. (B) P2, a cor do casulo é marrom claro. (C) P3, uma bolha é observada no lado lateral (seta preta). (D) P4(i), a bolha é maior do que em P3 (seta preta), e a pupa é flutuante em PBS. (E) P4(ii), uma lacuna é observada em parte anterior (seta preta) e a parte posterior (seta cinza). (F) P5 - 6, Malpighi túbulos migram (difícil de ver se coberto por casulo). A forma de pupa é formada por epitélio pupal e cutícula pupal. (G) P7, o corpo amarelo pode ser observado no lado dorsal (seta preta). (H) P8, os olhos são amarelos. (I) P9, os olhos são âmbar. (J) P10, os olhos estão vermelhos. (K) P11, cerdas Orbital e ocellar (seta cinza), vibrissae, macrochaetae torácica (seta preta) e do Tarso cerdas são preto e visível. (L) P12(i), as pontas das asas são cinza. (M) P12(ii), todas as partes das asas são cinza (seta preta). (N) P13, as asas são completamente pretas. (O) P14, a cabeça e as pernas estão completamente escurecidas. (P) P15(i), o mecônio pode ser observado no abdômen dorsal (seta preta). (Q) P15(ii), a mosca é eclosing. Detalhes destes estágios foram descritos em Fukutomi et al. 19 Clique aqui para ver uma versão maior desta figura.

Figura 5. Desenvolvimento de pigmentação ao redor de um sensillum de companiform numa asa. Círculos indicam ΔODs individuais, e barras horizontais indicam médias. P10: n = 10, P11: n = 10, 12(i): n = 10, P15(i): n = 11, 3 h: n = 8, 24 h: n = 7, 7 dias: n = 10. Clique aqui para ver uma versão maior desta figura.
| Componente de | |
| Açúcar branco macio | 51,6 g |
| Farinha de milho | g 172,4 |
| Grãos de milho - C | g 86,4 |
| Levedura de cerveja seca | 106 g |
| Pó de ágar-ágar | g 35,28 |
| ddH2O | 4000 mL |
| Ferva por 30 min e deixe esfriar até 70 ° C. | |
| Adicione 4 g de p-hidroxibenzoato de butilo dissolvido em 40 mL de etanol. | |
| Misture bem e despeje 9 mL cada frascos plásticos (diâmetro 25 mm x altura 96 mm). | |
Tabela 1. A composição dos alimentos de farinha de milho/açúcar/levedura/ágar padrão.
| Componente de | Quantidade |
| NaCl | 80 g |
| KCl | 2 g |
| Na2HPO4·12H2, O | 29 g |
| KH2PO4 | 2 g |
| ddH2O | até 10 L |
| definir pH 7,4 |
Tabela 2. A composição de PBS (1x).
| Estágio | Quer dizer de duração (h) | s.d. | n |
| P1 - 2 | 1.7 | 0.65 | 16 |
| P3 | 2.1 | 0.65 | 16 |
| P4(i) | 2.1 | 1,69 | 19 |
| P4(II) | 0.3 | 0.28 | 29 |
| P5 - 6 | 5.0 | 3,07 | 30 |
| P7 | 31,9 | 7,22 | 46 |
| P8 | 9.6 | 2,81 | 57 |
| P9 | 10.9 | 2.66 | 55 |
| P10 | 11,7 | 2,96 | 39 |
| P11 | 4.4 | 2,81 | 44 |
| P12(i) | 1.1 | 0.76 | 44 |
| P12(II) | 2.0 | 0.70 | 43 |
| P13 | 2.2 | 0,68 | 10 |
| P14 - 15(i) | 28,6 | 2.75 | 10 |
| P15(II) | 1.4 | 0.87 | 10 |
| Total | 121.7 |
Tabela 3. Medido durações dos estágios pupal de guttifera d..
| OD | ΔOD | |||||||
| Campaniform sensilum | Dica de veia longitudinal | Crossvein posterior | Controle | Campaniform sensilum | Dica de veia longitudinal | Crossvein posterior | ||
| Indivíduo | (Ponto A) | (Ponto B) | (Ponto C) | (Ponto D) | (Ponto A - ponto D) | (Ponto B - ponto D) | (Ponto C - ponto D) | |
| 1 | 0,549 | 0.484 | 0.515 | 0.256 | 0,293 | 0.228 | 0,259 | |
| 2 | 0.529 | 0.489 | 0.516 | 0.254 | 0.275 | 0,235 | 0.262 | |
| 3 | 0.546 | 0,48 | 0.533 | 0,255 | 0.291 | 0,225 | 0.278 | |
| 4 | 0.583 | 0.496 | 0.566 | 0,255 | 0.328 | 0,241 | 0,311 | |
| 5 | 0.523 | 0.479 | 0.528 | 0,235 | 0,288 ponto | 0.244 | 0,293 | |
| 6 | 0.572 | 0.509 | 0.546 | 0,265 | 0,307 | 0.244 | 0,281 | |
| 7 | 0.568 | 0,511 | 0,56 | 0.256 | 0,312 | 0,255 | 0.304 | |
| 8 | 0,56 | 0.507 | 0.562 | 0,27 | 0,29 | 0,237 | 0.292 | |
| 9 | 0.551 | 0,485 | 0.569 | 0,259 | 0.292 | 0,226 | 0.31 |
Tabela 4. Medido ODs e ΔODs de d. guttifera adultos 7 dias após a eclosão.
Discussão
Aqui descrevemos os protocolos para definição dos estágios pupal, removendo o casulo para observação detalhada, medindo durações dos estágios pupal e a medida da intensidade das manchas de preto em uma ala em d. guttifera. Esses protocolos podem ser aplicados para muitos Drosophila e relacionados a moscas espécies, especialmente com pigmentação de asa.
Observação em profundidade e descrição de eventos mais detalhados do desenvolvimento permitiria mais subdivisão dos estágios. Em muitos casos, um evento do desenvolvimento, exigindo dissecação ou seccionamento de uma pupa não é adequado para definição de estágio, porque um tem que matar uma pupa para estadiamento e posterior utilização de que o indivíduo é difícil. Para o uso de uma nova espécie de drosófila , um deve empregar distinguíveis de fora o casulo do desenvolvimento eventos como o primeiro passo. Dependendo da finalidade do estudo, um pode então subdividir mais fases baseadas em particular organogênese ou outros eventos do desenvolvimento.
Para comparação interespecífica de múltiplos estágios, uma dificuldade potencial é uma inversão da ordem do desenvolvimento eventos entre espécies (heterocronia27). Por exemplo, em d. melanogaster, o túbulo de Malpighi torna-se verde e em seguida o corpo amarelo se torna visível, Considerando que esta ordem pode ser invertida em algumas pupas de guttifera d.19. Nesse caso, a comparação estrita entre fases homólogas é difícil. Dependendo o fenômeno de interesse, um pode precisar de re-definir ou subdividir um estágio particular com base em um evento do desenvolvimento. Por exemplo, podemos mais ou menos selecione pupas de P5 - 6 e fazer comparação interespecífica de expressões de gene em asas pupal usando morfologia da asa como um indicador de temporização do desenvolvimento14.
Normalmente, demora de 10-30 min para remover o casulo. Se alguém quiser observar uma fase curta, pupas devem ser preparadas tendo em conta o tempo que passa durante a remoção do casulo. Por exemplo, se você quiser observar a P12(i) de d. guttifera, que tem apenas 1,1 h duração, preparando-se pupas no P11 daria um bom resultado.
Em nosso protocolo, papel de tecido umedecido é usado para o fundo das imagens pupal. Dependendo do estágio de observação e de estruturas quer mostrar em uma figura, pode-se usar papel de tecido branco ou preto. Para o P3 para a transição de P4(ii), a posição da bolha em pupa é importante para distinguir fases, e papel de tecido preto ajuda a observar a posição da bolha. Para as fases após P5, papel de tecido branco é melhor porque ajuda a observar o corpo amarelo, a cor dos olhos, cerdas e cor do corpo.
Bainbridge e Bownes17 calcula-se a duração da fase pupal da sua frequência de aparecimento. Sua mesa de preparo é o mais amplamente utilizado por d. melanogaster18. Para o seu método, eles preparados quatro garrafas de alimentos contendo cinco fêmeas adultas e cinco adultos do sexo masculino e os manteve no escuro, e em seguida pupas foram aleatoriamente retiradas uma garrafa a cada 11, 12, 13 e 14 dias após o início da postura de ovos. Eles contado o número de pupas em estágios particulares e calculadas as médias. O comprimento de cada fase de pupa pode ser estimado com base em dados da duração total do período pupal e estes dados de frequência. Um problema com este método é que não pode ser usada para estimar a duração exacta dos estágios pupal se cronometrando do desenvolvimento tende a ser sincronizada entre pupas.
Na verdade, nós tentamos Bainbridge e do Bownes método em d. guttifera, e obtivemos dados tendenciosos devido à sincronização entre pupas. Nós não pôde identificar a causa deste fenômeno, mas algumas possibilidades são pupas 1) manteve o ritmo circadiano de sua fase jovem e/ou 2) reagiram para as exposições à luz que ocorreu em observação. Portanto, decidimos para medir a duração do estágio real pela observação direta. Isso minimiza a polarização causada pelo ritmo circadiano.
O método descrito aqui é um método para quantificar o acúmulo extra de melanina, em manchas, em comparação com seus arredores de controle (ΔOD), subtraindo-se do OD da área de controle do OD da área local. Este método foi inspirado por um método para quantificar o conteúdo de DNA nuclear por coloração de Feulgen coloração e análise de imagem (densitometria28,.29). Como um dos potenciais problemas para a aplicação deste método para pigmentação de asa, ΔOD pode ser um valor negativo, especialmente quando uma pupa é muito jovem e não tem quase nenhuma pigmentação. Em fases mais tardias, pode haver alguma pigmentação na área de controle. O uso do OD simples da área local em si pode ser apropriado em vez de ΔOD dependendo da finalidade do estudo. No caso de d. guttifera, uso do OD simples em vez de ΔOD não alterou a tendência dos dados ou as conclusões do estudo.
Divulgações
Os autores não têm nenhum conflito de interesses.
Agradecimentos
Agradecemos a Sean B. Carroll e Thomas Werner para fornecer estoques voar, Naoyuki fusível para equipamentos, Byung Seok Jin por sua assistência na filmagem, Kiyokazu Agata para tutoria e Elizabeth Nakajima para edição inglesa. Este trabalho foi financiado pelo KAKENHI 17K 19427 e Takeda Science Foundation.
Materiais
| Name | Company | Catalog Number | Comments |
| Drosophila guttifera | The Drosophila Species Stock Center at the U.C. San Diego | 15130-1971.10 | Drosophila guttifera, a fruit fly species used in this article |
| Plastic vial | Hightech | MKC-30 | Plastic vial, for fly stock maintenance |
| Buzz plugs vial and bottle closures for glass vials | Fisher Scientific | AS-271 | Cellulose plug, for fly stock maintenance |
| White soft sugar | Mitsui Sugar | J-500g | White soft sugar, for standard cornmeal/sugar/yeast/agar food |
| Corn flour | Nippon Flour Mills | F | Corn flour, for standard cornmeal/sugar/yeast/agar food |
| Corn grits - C | Nippon Flour Mills | GC | Corn grits - C, for standard cornmeal/sugar/yeast/agar food |
| Agar powder | Matsuki Kanten Sangyo | No.602 | Agar powder, for standard cornmeal/sugar/yeast/agar food |
| Dry beer yeast | Asahi Food & Healthcare | Y2A | Dry beer yeast, for standard cornmeal/sugar/yeast/agar food |
| Butyl p-hydroxybenzoate | Nacalai Tesque | 06327-02 | Butyl p-hydroxybenzoate, for standard cornmeal/sugar/yeast/agar food |
| Ethanol | Wako | 057-00456 | Ethanol, for standard cornmeal/sugar/yeast/agar food |
| Flat bottom microtube | Ina Optica | CF-0150 | 1.5 mL microtube, for collecting pupae |
| CAPSULEFUGE | Tomy | PMC-060 | Mini microcentrifuge, for collecting pupae |
| Sterilized Schale NB | Sansei Medical | 01-013 | Plastic Petri dish (diameter 90 mm x height 15 mm) |
| Serum tube rack | Iwaki | 9796-050 | Used as a moist chamber, for observation of pupa |
| Corning Falcon Easy-Grip tissue culture dish | Corning | 353001 | Plastic Petri dish (diameter 35 mm x height 10 mm) |
| Falcon standard tissue culture dish | Corning | 353002 | Plastic Petri dish (diameter 60 mm x height 15 mm) |
| Push-pin | Kokuyo | 51233709 | Push-pin, for making pinholes on the microtube lid |
| Stereomicroscope | Olympus | SZX16 | Stereomicroscope, for morphological observation |
| Digital camera | Olympus | DSE-330-A | Digital camera, for imaging |
| NICETACK double sided tape | Nichiban | NW-15SF | Double sided tape, for removing puparium |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | Forceps, for removing puparium |
| Van Gogh VISUAL Paint brush | Talens Japan | GWVR-#5/0 | Paint brush, for removing puparium |
| Greiner CELLSTAR 12 well cell culture plate | Merck | 665-180 | 12-well cell culture plate, for measuring durations of pupal periods |
| NaCl | Wako | 191-01665 | NaCl, for PBS |
| KCl | Nacalai Tesque | 285-14 | KCl, for PBS |
| Na2HPO4·12H2O | Wako | 196-02835 | Na2HPO4·12H2O, for PBS |
| KH2PO4 | Nacalai Tesque | 28721-55 | KH2PO4, for PBS |
| Stepped Neutral Density (ND) Filter 0.04 - 3.0 | Edmund Optics | 64-384 | Stepped density filter, for calibration of pigmentation measurement |
| ImageJ software | NIH | 1.8.0-101 | ImageJ software, for measurement of intensity of black spots on a wing (https://imagej.nih.gov) |
| FINE FROST glass slide | Matsunami Glass Ind | FF-001 | Glass slide, for measurement of intensity of black spots on a wing |
| Square microscope cover glass 18 x 18 | Matsunami Glass Ind | C018181 | Cover slip, for measurement of intensity of black spots on a wing |
Referências
- Carson, H. L., Hardy, D. E., Spieth, H. T., Stone, W. S. The evolutionary biology of the Hawaiian Drosophilidae. Essays in evolution and genetics in honor of Theodosius Dobzhansky. Hecht, M. K., Steere, W. C. , Springer (Meredith Corporation). New York. 437-543 (1970).
- Markow, T. A., O'Grady, P. M. Drosophila: a guide to species identification and use. , Academic Press. New York. (2006).
- Patterson, J. T. The Drosophilidae of the southwest. 4313, University of Texas Publication. 7-216 (1943).
- Setoguchi, S., Takamori, H., Aotsuka, T., Sese, J., Ishikawa, Y., Matsuo, T. Sexual dimorphism and courtship behavior in Drosophila prolongata. J Ethol. 32 (2), 91-102 (2014).
- Werner, T., Jaenike, J. Drosophilids of the Midwest and Northeast. , River Campus Libraries, University of Rochester. Rochester. (2017).
- Arnoult, L., et al. Emergence and diversification of fly pigmentation through evolution of a gene regulatory module. Science. 339 (6126), 1423-1426 (2013).
- Camino, E. M., Butts, J. C., Ordway, A., Vellky, J. E., Rebeiz, M., Williams, T. M. The evolutionary origination and diversification of a dimorphic gene regulatory network through parallel innovations in cis and trans. PLoS Genet. 11 (4), e1005136(2015).
- Gompel, N., Prud'homme, B., Wittkopp, P. J., Kassner, V. A., Carroll, S. B. Chance caught on the wing: cis-regulatory evolution and the origin of pigment patterns in Drosophila. Nature. 433 (7025), 481-487 (2005).
- Glassford, W. J., et al. Co-option of an ancestral Hox-regulated network underlies a recently evolved morphological novelty. Dev. Cell. 34 (5), 520-531 (2015).
- Koshikawa, S. Enhancer modularity and the evolution of new traits. Fly. 9 (4), 155-159 (2015).
- Koshikawa, S., et al. Gain of cis-regulatory activities underlies novel domains of wingless gene expression in Drosophila. Proc Natl Acad Sci U S A. 112 (24), 7524-7529 (2015).
- McGregor, A. P., et al. Morphological evolution through multiple cis-regulatory mutations at a single gene. Nature. 448 (7153), 587-590 (2007).
- Tanaka, K., Barmina, O., Kopp, A. Distinct developmental mechanisms underlie the evolutionary diversification of Drosophila sex combs. Proc Natl Acad Sci U S A. 106 (12), 4764-4769 (2009).
- Werner, T., Koshikawa, S., Williams, T. M., Carroll, S. B. Generation of a novel wing colour pattern by the Wingless morphogen. Nature. 464 (7292), 1143-1148 (2010).
- Wittkopp, P. J., et al. Intraspecific polymorphism to interspecific divergence: genetics of pigmentation in Drosophila. Science. 326 (5952), 540-544 (2009).
- Lawrence, P. A., Morata, G. Compartments in the wing of Drosophila: a study of the engrailed gene. Dev Biol. 50 (2), 321-337 (1976).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. J. Embryol. Exp. Morphol. 66, 57-80 (1981).
- Ashburner, M., Golic, K. G., Hawley, R. S. Drosophila: A Laboratory Handbook. , 2nd ed, Cold Spring Harbor Laboratory Press. New York. (2005).
- Fukutomi, Y., Matsumoto, K., Agata, K., Funayama, N., Koshikawa, S. Pupal development and pigmentation process of a polka-dotted fruit fly, Drosophila guttifera (Insecta, Diptera). Dev Genes Evol. 227 (3), 171-180 (2017).
- Koshikawa, S., Fukutomi, Y., Matsumoto, K. Drosophila guttifera as a model system for unraveling color pattern formation. Diversity and evolution of butterfly wing patterns: an integrative approach. Sekimura, T., Nijhout, H. F. , Springer. New York. in press (2017).
- True, J. R., Edwards, K. A., Yamamoto, D., Carroll, S. B. Drosophila wing melanin patterns form by vein-dependent elaboration of enzymatic prepatterns. Curr Biol. 9 (23), 1382-1391 (1999).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Izumitani, H. F., Kusaka, Y., Koshikawa, S., Toda, M. J., Katoh, T. Phylogeography of the Subgenus Drosophila (Diptera: Drosophilidae): evolutionary history of faunal divergence between the Old and the New Worlds. PLoS ONE. 11 (7), e0160051(2016).
- Resh, V. H., Cardé, R. T. Encyclopedia of Insects. , 2nd ed, Academic Press. Burlington. (2009).
- DeLean, A., Munson, P. J., Rodbard, D. Simultaneous analysis of families of sigmoidal curves: application to bioassay, radioligand assay, and physiological dose-response curves. Am J Physiol. 235 (2), E97-E102 (1978).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological changes. J Morphol. 59 (2), 351-399 (1936).
- McKinney, M. L., McNamara, K. Heterochrony: the evolution of ontogeny. , Plenum Press. New York. (1991).
- Hardie, D. C., Gregory, T. R., Hebert, P. D. From pixels to picograms: a beginners' guide to genome quantification by Feulgen image analysis densitometry. J Histochem Cytochem. 50 (6), 735-749 (2002).
- Koshikawa, S., Miyazaki, S., Cornette, R., Matsumoto, T., Miura, T. Genome size of termites (Insecta, Dictyoptera, Isoptera) and wood roaches (Insecta, Dictyoptera, Cryptocercidae). Naturwissenschaften. 95 (9), 859-867 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados