Method Article
果蝇 guttifera的分期蛹期和机翼色素沉着的测量方法
摘要
介绍了果蝇 guttifera的分期蛹周期和机翼色素沉着的测量方法。色素沉着的分期和量化为研究成人性状的发育机制提供了坚实的基础, 并使性状发育的种间比较得以实现。
摘要
不同种类的果蝇(水果蝇) 提供了研究进化机制和遗传变化的机会。特别是, 成人阶段是一个丰富的形态特征来源的种间比较, 包括翼色素沉着比较。为了研究物种间的发育差异, 需要进行细致的观察和适当的分期, 以便进行精确的比较。在这里, 我们描述的蛹周期的分期和量化的翅膀色素在一个波尔卡斑点果蝇,果蝇 guttifera的协议。首先, 我们描述了详细的形态学观察方法和定义的蛹阶段基于形态。该方法包括一种去除蛹外壳的蛹的技术, 以便对蛹形态进行细致观察。其次, 我们描述了测量定义的蛹阶段的持续时间的方法。最后, 我们用数字图像和 ImageJ 软件描述了基于图像分析的机翼色素沉着定量方法。通过这些方法, 我们可以为比较蛹阶段成人性状的发育过程奠定坚实的基础。
引言
果蝇的某些形态特征在种类中是多种多样的1,2,3,4,5。我们可以通过比较这些形态的生成机制来探讨形态多样性的产生问题。这种形态的例子有幼体毛、成人性梳子、外生殖器、腹部色素沉着和翅膀色素沉着6、7、8、9、10,11,12,13,14,15. 为了研究成人之间的形态学差异, 观察和分析蛹阶段是很重要的, 因为成虫性状的命运决定于晚期幼体阶段, 随后的形态发生在蛹时期。
在果蝇的发育生物学研究中, "小时 APF" (蛹形成后的小时) 是表示蛹阶段16的常用方法。该系统采用蛹形成后的绝对时间, 便于常规实验。但是, 蛹的发育速度可能不同, 可能会受到轻微的遗传、后生或微差异的影响, 因此在蛹形成后同样的绝对时间不保证蛹在同一发展阶段。在许多情况下, 由形态学特征定义的阶段比比较多个个体更可取。特别是, 物种之间的比较需要精确的分期和相应的 (同源) 阶段之间的比较。
班布里奇和 Bownes17根据果蝇蛹的形态学特征, 认可了20蛹阶段 (P1 至 P15 (ii))。这种分期是最广泛使用的系统形态发育分期18。在先前的研究中, 我们进行了蛹分期的果蝇 guttifera , 以建立一个基础的机翼色素沉着研究19。D. guttifera的翅膀上有一个黑色的圆点图案, 它是机翼色素沉着形成的模型物种之一20。虽然我们提到了班布里奇和 Bownes 的研究17中描述的形态学标准, 但我们直接用串行观测19来测量阶段的持续时间, 而不是使用班布里奇和 Bownes 的阶段工期估计从观察的频率。在这里, 我们描述了在卜et al19中使用的果蝇的蛹阶段的蛹分期和测量的方法。
研究翼色素沉着的发育机制, 需要了解蛹或成年期色素沉着的发生。卜et al。19通过对机翼图像进行图像分析, 在蛹和成人阶段对色素沉着进行量化的光学密度 (ODs)。果蝇翅膀的色素沉着被认为是由黑黑色素堆积引起的21。为量化 ODs, 使用了灰度图像和 ImageJ 软件 (https://imagej.nih.gov/ij/)22 。为了识别和量化斑点特定的色素沉着 (ΔOD), 我们从一个斑点内的 od 中减去外径。为了使这种方法重现性和客观, OD 测量的地方应该确定使用翼静脉作为地标。在这篇文章中, 我们详细描述了这种定量的方法, 机翼色素在果蝇 guttifera。
研究方案
1. 飞行股票
- 对下列所有协议使用果蝇 guttifera 。
- 使用塑料瓶 (直径25毫米 x 高度96毫米) 和纤维素插头 (直径 23 mm x 高度 26 mm) 进行库存维护。使用标准的玉米面/糖/酵母/琼脂食品, 并遵循一个出版物描述了这个物种的三其他替代食谱2。
注: D. guttifera (股票编号 15130-1971.10) 由加州大学圣地亚哥分校的果蝇物种储备中心提供。尽管D. guttifera属于immigranstripunctata辐射, 它与23中的 "黑腹" 有很密切的关系, 但它有许多与d。.因此, 该协议可以适用于许多果蝇物种, 尽管有些物种需要特定的食物和/或技术提示来保持它们的2。
2. 蛹的观察和蛹阶段的定义
注意: 观察的蛹取自在25° c 的12:12 小时光/暗循环中保持的苍蝇。班布里奇和 Bownes17描述了从原始位置蛹到一块湿润的组织纸 (97% 存活946个移动的蛹) 的低风险. D. guttifera蛹可以通过本质上相同的方法进行准备。
- 在一个塑料瓶 (直径25毫米 x 高 96 mm) 的新鲜食品 (标准玉米面/糖/酵母/琼脂食品) 中放置健康的成人, 让它们产卵. 等待7天, 以获得第三晚龄。
- 将1毫升标准玉米面/糖/酵母/琼脂食品放入每1.5 毫升微。3针孔与2毫米间距在管内的盖子, 通过穿透一个图钉, 让呼吸。
- 离心管内与食物 7 s 在一个迷你离心 (860 x g)。
- 倒置和自来水瓶, 以消除所有成人的瓶子。
- 将 5-10 毫升的 ddH2O (或反渗透水) 倒入小瓶。
- 将幼虫用水倒入塑料培养皿 (直径90毫米 x 高15毫米)。确定第三晚龄由他们的大身体大小 (3-4 毫米在长度)。
- 将第三龄幼虫用镊子轻轻移入管内, 用食物 (10 只幼虫/微)。在25° c 的夜间孵育。
- 将新形成的蛹移到一张已被 ddH2O 的纸巾上, 并放置在塑料培养皿中 (直径 35 mm x 高度 10 mm)。
- 将培养皿放在潮湿的室内 (含10毫升的 ddH2O 在底部), 并等待蛹发育到所需的阶段。
- 将蛹移到一个塑料培养皿 (直径60毫米 x 高 15 mm) 的纸巾上。
注意: 阶段的定义主要可以根据四腹果蝇17的各个阶段进行。通常,果蝇的蛹期可以归类为 P1-P15 (ii), 尽管根据所使用的物种需要对阶段定义进行一些修改。如果可能, 删除蛹可以精确而细致地观察。请参见下面的详细信息 (步骤 3)。 - 用立体显微镜观察蛹。拍摄的照片使用数码相机连接到立体显微镜。
3. 去除蛹
注意:果蝇的蛹被称为蛹的结构所覆盖。昆虫的 Muscomorpha (苍蝇) 不脱落它的幼虫角质层在蛹;相反, 它硬化后的角质层 apolysis, 并使用它作为一个保护的蛹, 蛹24。寄生在蛹内的蛹有一个真正的蛹角质层, 这是非常柔软和脆弱的。在 apolysis 发生附近 P4 (ii) 之前, 上皮细胞和蛹被连接在一起, 因此去除蛹没有损伤是非常困难的。P5 后, 除去蛹是费力的, 但对形态学观察和蛹阶段的定义有用。这一过程的执行如下。
- 在一块纸巾上贴一块双面胶带。
- 将蛹放在双面磁带的腹侧上 (图 1A)。
- 找到蛹前侧与内蛹之间的空间。用镊子抓住并除去这个缝隙周围的蛹, 并露出蛹头部的前侧。
- 将镊子的尖端与前后轴线平行移动, 将其插入。提起镊子的尖端, 使其局部折断蛹。重复此操作, 直到破损到达蛹的后部。确保蛹和蛹腿之间也形成间隙, 并打破蛹的腹侧, 并尽量减少内部蛹的损伤 (图 1B)。
- 在打破蛹尽可能多, 取出蛹使用一个精美的画笔 (#5/0) (图 1C)。
- 将蛹放在一张纸巾上, 用 ddH 的2O 放置在一个塑料培养皿中 (直径 60 mm x 高度 15 mm)。尽快拍照, 因为裸露的蛹易受伤害, 容易变干。
注意: 没有蛹的蛹不适合测量蛹期 (步骤 4), 因为压力 (如脱水) 和物理损伤可能会干扰正常的发育。
4. 蛹阶段的测量
- 如步骤2所述, 准备蛹以测量蛹阶段的持续时间。收集蛹 1-2, 2-3, 3-4 天后, 蛹形成 (20 蛹每)。给蛹识别的个体识别号 (1-60)。在以下步骤中继续收集新形成的蛹, 以获得20多的幼蛹。给新形成的蛹提供个人识别号 (61-80)。将蛹放在一块 ddH 的2O 湿纸巾上 (3.9 厘米2) 的12孔细胞培养板 (1 蛹/井, 12 蛹/板)。用 ddH2O 填充板的内部空间, 以保持湿度, 将盖子盖上, 并将板材置于25° c、恒定光 (24:0 小时/暗) 条件下。
注意: 没有蛹的蛹不适合测量蛹期的长短。请不要删除蛹。 - 每30分钟观察一次所有蛹的体色、刚毛、氏管和黄体的形态特征, 并记录观察阶段 (P1-P15 (ii), 根据在一个计数表中的参考17,19)。
- 通过三 (或更多) 人的旋转移动, 继续记录超过四天 (96 小时)。
- 统计每个特定阶段的记录数, 并计算平均值 (观察/蛹的平均计数)。然后乘以 0.5 (h), 导致估计的阶段长度 (h)。
5. 测量机翼上黑斑的强度
注意: 蛹或成人翼上的黑点的强度可以通过测量光学密度 (OD) 来量化。使用已知的 ODs (阶梯密度滤镜) 的玻璃过滤器用于校准25, 这样就可以从机翼的数字图像中计算出特定区域的外径。测量现场外径和外径, 并从前者中减去后者以获得光斑强度 (ΔOD)。本文介绍了ΔOD 的解剖、测量和计算方法。此过程可以在步骤2之后完成, 独立于步骤3和步骤4。一旦你执行了步骤2并且了解了所有的蛹阶段, 你可以直接开始或重复步骤5。
- 图像准备
- 如步骤2所述, 准备一个新的蛹的焦点阶段。用镊子取出蛹的前部。用镊子取出蛹, 并将其放入磷酸盐缓冲盐水 (PBS,表 2) 在一个塑料培养皿 (直径35毫米 x 高度 10 mm)。
- 剪下机翼的基底关节 (基底关节是机翼的狭窄下部)。当机翼折叠时, 将其放入塑料培养皿中 (直径 35 mm x 高 10 mm), 填充 ddH2O 以渗透压延伸它 (机翼自行展开)。
- 每10分钟从一个小瓶里收集新 eclosed 的成年人。麻醉与 co2的苍蝇使用 co2麻醉垫, 确认麻醉不动, 并削减了机翼的基础关节。
- 将 PBS 的10µL 放在玻璃滑梯上, 将机翼放在那里, 盖上盖子滑块 (18 mm x 18 mm)。
- 打开立体声显微镜的光。将光源设置为最高水平。设置物镜11.5X。将膜片设置为最开放状态。打开摄像机将相机设置为 (ISO: 100, 模式魁北克省 3136 x 2352 像素, 快门速度: 1/二十年代)。把焦点放在样品上, 移动显微镜的焦点旋钮。
- 按下遥控装置的快门按钮以拍摄图像。每翼拍摄3张照片, 每个机翼必须以 campaniform 触角、纵静脉点或后 crossvein 为中心, 将机翼的远端部分定位在左侧, 机翼的前部位于上部。
- 校准
- 拍摄的9部分的阶梯密度滤镜使用相同的相机设置获得的机翼图像。
- 启动 ImageJ 软件 (https://imagej.nih.gov/ij/)22。
- 单击文件 |打开 |并选择阶梯密度滤波器的图像之一。
- 单击图像 |类型 |8位 |将图像转换为8位图像。
- 单击编辑 |选择 |指定 |并检查椭圆形和居中列。在宽度列中写入 100 (像素), 在高度列中 100 (像素), 1568 在X 坐标列和1176在Y 坐标列中。单击确定。
- 单击分析 |度量值 |。对选定区域的 "平均灰色值" 进行了测量。
- 重复5.2.3。5.2.6。8剩余的图像。
- 单击分析 |在函数列中校准并选择Rodbard25 , 并在中间的右侧列中写入以下数字 (0.04、0.336、0.632、0.928、1.224、1.52、1.816、2.112、2.408; 这些数字取决于阶梯式密度过滤器)。
- 检查全局校准列, 然后单击确定。
注意: 通过执行此过程, "平均灰度值" 将使用 Rodbard 函数转换为 "光学密度 (OD)"。在此步骤之后, 可以为 ImageJ 软件中的特定选定区域计算光学密度。
- 选择测量面积
注意: 斑点通常与地标相关, 如 campaniform 器、纵静脉提示和 crossveins。机翼上的这些和其他地标可以用来选择测量区域。这里, 一个例子D. guttifera(图2) 进行了描述。- 定义点 A, campaniform 触角点。
- 打开 campaniform 触角斑点位于图像中心的图像。单击图像 |类型 |8位 |将图像转换为8位图像。
- 在区域选择工具中单击矩形, 然后绘制一个矩形。设置矩形的左上角, 使其附着在第三条纵静脉的后线上, 更远地从 campaniform 触角点。设置矩形的右侧, 使其位于 campaniform 触角点的右侧。
- 单击编辑 |选择 |添加到管理器 |。检查全部显示列。
- 在行选择工具中单击角度工具。在第三纵静脉的后线上画第一条线。设置在步骤1中绘制的矩形顶点上线条的左端点。在矩形的上侧绘制第二行。按 "m" 键来测量这一步中绘制的两条线之间的角度。在计算机屏幕上单击图像的窗口。
- 单击编辑 |选择 |添加到管理器 |。
- 在区域选择工具中单击矩形, 并绘制一个大约1/9 图像窗口大小的矩形。单击编辑 |选择 |旋转 |。写入步骤5.3.1.4 中测量的角度的负度数。在角度列中, 单击确定以旋转此步骤中绘制的矩形。
- 移动在步骤5.3.1.6 中绘制的矩形。使用箭头键。将第二纵脉后线的端点设置在矩形的左侧, 并将矩形的下侧连接到第三条纵静脉的后线。确定在该过程中, 从第二纵静脉的终点到第三纵静脉的后线的垂直线。将垂直线的脚定义为点 A (图 2A)。
- 在将光标放在点 a 上时, 记录点 a 的 x 坐标和 y 坐标, 在区域选择工具下面指示。
- 点 B 的定义, 纵静脉尖点
- 打开一个纵向静脉尖点位于图像中心的图像。单击图像 |类型 |8位 |将图像转换为8位图像。
- 重复步骤5.3.1 中描述的相同过程。(定义点 a, campaniform 触角点) 在图像中找到点 a。
- 单击编辑 |选择 |添加到管理器 |。
- 在区域选择工具中单击矩形, 然后绘制一个矩形。设置矩形的左上角顶点, 位于第三条纵静脉的后线的终点。
- 单击编辑 |选择 |添加到管理器 |。
- 在行选择工具中单击角度工具。绘制第一线连接点 A 和第三纵脉后线的终点。将此行定义为直线 a. 在步骤5.3.2.4 中绘制的矩形的上侧绘制第二行。按 "m" 键测量两条线之间的角度。
- 单击编辑 |选择 |添加到管理器 |。
- 在区域选择工具中单击矩形, 并绘制一个大约1/9 图像窗口大小的矩形。单击编辑 |选择 |旋转 |。写入步骤5.3.2.6 中测量的角度的负度数。在角度列中, 单击确定以旋转此步骤中绘制的矩形。使用箭头键移动矩形。设置矩形的上侧, 使其连接到直线 A 和第四纵脉前线的终点, 使其位于矩形的左侧。
- 单击编辑 |选择 |添加到管理器 |。
- 在区域选择工具中单击矩形, 并绘制一个大约1/9 图像窗口大小的矩形。单击编辑 |选择 |旋转 |。在角度列中, 写入在步骤6中测量的角度的减号度数, 然后单击确定以旋转此步骤中绘制的矩形。使用箭头键移动矩形。设置矩形的左下角, 使其位于在步骤5.3.2.8 中绘制的矩形的左上顶点, 从而获得从第四纵脉的前线终点到直线的垂直线. 定义垂直线的交点和第三纵静脉的后线作为点 B (图 2B)。
- 在将光标放在 b 点上时, 记录点 b 的 x 坐标和 y 坐标, 在区域选择工具下面指示。
- 点 C、后 crossvein 斑的定义
- 打开一个图像, 其中后 crossvein 点位于图像的中心。单击图像 |类型 |8位 |将图像转换为8位图像。
- 在后 crossvein 和第四纵静脉的交叉区 (图 2C) 中, 将点 C 定义为第四纵脉前线的后最点。
- 将光标放在点 c 上时, 在区域选择工具下面, 记录点 c 的 x 坐标和 y 坐标。
- 点 D 的定义, 控制区域
- 打开 campaniform 触角斑点位于图像中心的图像。单击图像 |类型 |8位 |将图像转换为8位图像。
- 在行选择工具中单击直, 并绘制一条连接第二纵静脉前线终点和第四纵静脉后线终点的直线。将点 D 定义为这条线的交点和第三纵静脉的后线 (图 2D)。
- 将光标放在点 d 上时, 在区域选择工具下面, 记录 d 点的 x 坐标和 y 坐标。
- 定义点 A, campaniform 触角点。
- 测量
- 打开一个机翼斑点的图像 (为测量点 a, 打开图像与点 a 在中心)。单击图像 |类型 |8位 |将图像转换为8位图像。
- 在区域选择工具中单击矩形, 并绘制图像窗口大约1/9 大小的矩形。
- 单击编辑 |选择 |指定 |。检查椭圆形和居中列。在宽度和高度列中写入 100 (像素), 在x 坐标列中写入点 a (或点 b 或点 c) 和 d 的 x 坐标, 并在y 坐标列中写入点 a (或点 b 或点 c) 和 d 的 y 坐标。单击确定。
- 单击分析 |度量值 |。如果5.2 中描述的校准已经完成, 则 ODs 在平均值列中指示。
- 用点 A、B 和 C 的 ODs 减去点 D 的外径计算ΔODs。
注意: D 点在机翼的透明部分, 不包括色素沉着, 因此适用于背景控制。
结果
将D. guttifera的蛹期划分为17阶段 (P1-P15 (ii); 三个具有代表性的阶段 (P1、P5-6、P10) 的图像显示图 3, 所有17阶段都在图 4中说明。虽然班布里奇和 Bownes17在d. 黑腹中识别了20阶段, 但这些阶段中的某些步骤无法应用于d. guttifera。两个发育事件的顺序, 黄色身体的出现 (在中肠26内的大量脱落细胞) 和氏小管的定时变绿, 在D. guttifera中没有严格控制, 因此我们不能分开 P5 (我)、P5 (ii) 和 P6。另外, 与在四腹中不同, 胸部和腹部刚毛的发黑时间是同步的, 因此我们不能分离 P11 (i) 和 P11 (ii)19。
我们可以测量D. guttifera的蛹阶段的长度 (表 3, 从卜 et al.19)。在25° c17中, 整个蛹周期比四腹果蝇长约 20 h。我们计算了 campaniform 触角、纵静脉尖和后 crossvein 的ΔODs 面积。在这里, 我们显示的 ODs 和ΔODs 在成人后7天羽化 (表 4)。通过比较多个阶段的数据, 我们发现阶段 P12 (i) 是色素沉着的起始时间, 而色素沉着则是在羽化 (图 5) 后的24小时内完成的, 这是卜et al中使用的原始测量结果.19)。
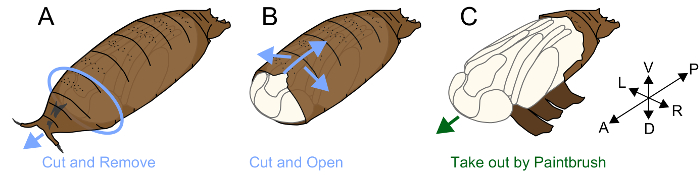
图1。删除蛹的插图.(a) 将蛹腹侧放在一条双面胶带上。取出蛹的前部。(B) 用钳从腹侧折断蛹。(C) 打破蛹后, 用画笔取出蛹。请单击此处查看此图的较大版本.

图2。用于测量色素沉着的区域的定义.(a) 与 campaniform 触角相关联的点 a。(b) b 点与纵向静脉尖端有关的斑点。(c) c 点与后 crossvein 相关联的斑点。(d) 控制区的 d 点。刻度线表示250µm.请单击此处查看此图的较大版本.

图3。定义的蛹阶段的示例.(A) P1 覆盖的蛹的蛹。(B) P5 阶段的蛹-6。(C) 阶段 P10 蛹。蛹在观察 (B) 和 (C) 之前被移除。刻度线表示500µm.请单击此处查看此图的较大版本.
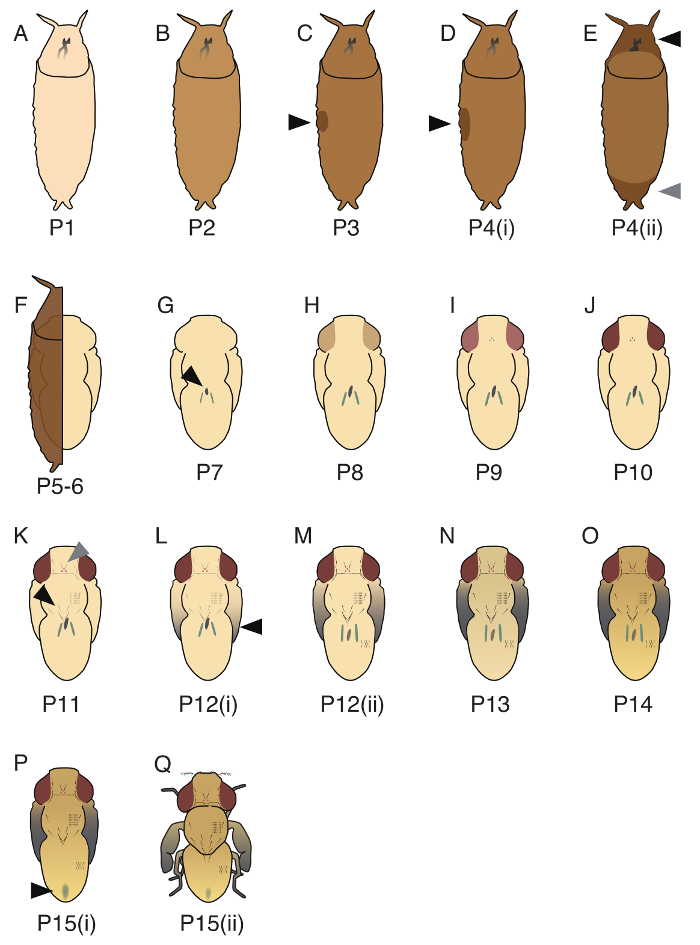
图4。在D. guttifera中确定的17蛹阶段的插图.(A) P1, 蛹是白色的。(B) P2, 蛹的颜色为浅褐色。(C) P3, 在侧边 (黑色箭头) 观察气泡。(D) P4 (i), 气泡比 P3 (黑箭头) 大, 而蛹在 PBS 中具有浮力。(E) P4 (ii), 在前部 (黑色箭头) 和后部 (灰色箭头) 上观察到间隙。(F) P5-6, 氏小管迁移 (难以看到, 如果覆盖蛹)。蛹形态由蛹上皮和蛹角质层形成。(G) P7, 黄色的身体可以在背侧观察 (黑色箭头)。(H) P8, 眼睛是黄色的。(I) P9, 眼睛是琥珀色的。(J) P10, 眼睛是红色的。(K) P11、眼眶和 ocellar 刚毛 (灰色箭头)、触须、胸 macrochaetae (黑箭头) 和跗毛都是黑色和可见的。(L) P12 (一), 翅膀的尖端是灰色的。(M) P12 (ii), 机翼的所有部分都是灰色 (黑色箭头)。(N) P13, 机翼完全是黑色的。(O) P14, 头部和腿部完全变暗。(P) P15 (i), 胎粪可观察到背腹 (黑色箭头)。(Q) P15 (ii), 苍蝇 eclosing。卜et al中描述了这些阶段的详细信息。19请单击此处查看此图的较大版本.

图5。companiform 触角在机翼上的色素沉着的发展.圆圈表示单个ΔODs, 水平条表示平均值。P10: n = 10, P11: n = 10, 12 (i): ñ = 10, P15 (i): n = 11, 3 h: n = 8, 24 h: n = 7, 7 天: n = 10。请单击此处查看此图的较大版本.
| 组件 | |
| 白色软糖 | 51.6 克 |
| 玉米粉 | 172.4 克 |
| 玉米磨料-C | 86.4 克 |
| 干啤酒酵母 | 106克 |
| 琼脂粉 | 35.28 克 |
| ddH2O | 4000毫升 |
| 煮沸30分钟, 然后离开冷却到70° c。 | |
| 在40毫升乙醇中加入4克羟基苯甲酸丁酯。 | |
| 混合好, 并倒入9毫升每个塑料瓶 (直径25毫米 x 高度96毫米)。 | |
表1。标准玉米面/糖/酵母/琼脂食品的组成。
| 组件 | 量 |
| nacl | 80克 |
| 氯化钾 | 2克 |
| Na2HPO4· 12H2O | 29克 |
| 2PO4 | 2克 |
| ddH2O | 高达10升 |
| 设置 pH 值7。4 |
表2。PBS (1X) 的组成。
| 阶段 | 平均持续时间 (h) | 法令 | n |
| P1-2 | 1。7 | 0.65 | 16 |
| P3 | 2。1 | 0.65 | 16 |
| P4 (一) | 2。1 | 1.69 | 19 |
| P4 (ii) | 0。3 | 0.28 | 29 |
| P5-6 | 5。0 | 3.07 | 30 |
| P7 | 31。9 | 7.22 | 46 |
| P8 | 9。6 | 2.81 | 57 |
| P9 | 10。9 | 2.66 | 55 |
| P10 | 11。7 | 2.96 | 39 |
| P11 | 4。4 | 2.81 | 44 |
| P12 (一) | 1。1 | 0.76 | 44 |
| P12 (ii) | 2。0 | 0.70 | 43 |
| P13 | 2。2 | 0.68 | 10 |
| P14-15 (i) | 28。6 | 2.75 | 10 |
| P15 (ii) | 1。4 | 0.87 | 10 |
| 总 | 121。7 |
表3。 D. guttifera的蛹阶段的已测量工期.
| od | ΔOD | |||||||
| Campaniform sensilum | 纵脉尖 | 后 crossvein | 控制 | Campaniform sensilum | 纵脉尖 | 后 crossvein | ||
| 个人 | (点 A) | (点 B) | (点 C) | (点 D) | (点 A 点 D) | (点 B 点 D) | (点 C 点 D) | |
| 1 | 0.549 | 0.484 | 0.515 | 0.256 | 0.293 | 0.228 | 0.259 | |
| 2 | 0.529 | 0.489 | 0.516 | 0.254 | 0.275 | 0.235 | 0.262 | |
| 3 | 0.546 | 0.48 | 0.533 | 0.255 | 0.291 | 0.225 | 0.278 | |
| 4 | 0.583 | 0.496 | 0.566 | 0.255 | 0.328 | 0.241 | 0.311 | |
| 5 | 0.523 | 0.479 | 0.528 | 0.235 | 0.288 | 0.244 | 0.293 | |
| 6 | 0.572 | 0.509 | 0.546 | 0.265 | 0.307 | 0.244 | 0.281 | |
| 7 | 0.568 | 0.511 | 0.56 | 0.256 | 0.312 | 0.255 | 0.304 | |
| 8 | 0.56 | 0.507 | 0.562 | 0.27 | 0.29 | 0.237 | 0.292 | |
| 9 | 0.551 | 0.485 | 0.569 | 0.259 | 0.292 | 0.226 | 0.31 |
表4。已测量的 ODs 和 ΔODs D. guttifera 成人后7天羽化.
讨论
我们在这里描述蛹阶段的定义的协议, 去除蛹为详细的观察, 测量蛹阶段的期间和测量黑斑点的强度在翼在D. guttifera。这些协议可以适用于许多果蝇和相关的蝇类, 特别是具有翼色素沉着的物种。
深入观察和描述更详细的发展事件将使阶段进一步细分。在许多情况下, 需要解剖或切片的蛹的发展事件不适合阶段定义, 因为一个人必须杀死一个蛹的分期, 并进一步使用该个体是困难的。为了使用一个新的果蝇物种, 你应该在第一步的时候采用与蛹之外的发展活动。根据研究的目的, 你可以根据特定的器官发生或其他发育事件进一步细分阶段。
对于多个阶段的种间比较, 潜在的困难是物种之间的发育事件顺序的反转 (heterochrony27)。例如, 在氏中, 该小管变为绿色, 然后黄色的主体变为可见, 而此顺序可在 d. guttifera19的某些蛹中反转。在这种情况下, 严格比较同源阶段是困难的。根据感兴趣的现象, 人们可能需要根据发展事件重新定义或细分一个特定的阶段。例如, 我们可以粗略地选择 P5-6 的蛹, 并利用机翼形态学作为发育时序14的指标, 对蛹翅的基因表达进行种间比较。
通常, 需要 10-30 分钟才能删除蛹。如果你想观察一个短的阶段, 蛹应准备考虑到的时间, 通过在蛹清除。例如, 如果你想观察 P12 (i) 的D. guttifera, 它只有1.1 小时的时间, 准备蛹在 P11 会给一个好的结果。
在本协议中, 湿纸巾是用于蛹图像的背景。根据观察和结构的阶段你想要显示在图, 你可以使用白色或黑色组织纸。对于 P3 到 P4 (ii) 的转变, 蛹中气泡的位置对于区分阶段是很重要的, 而黑色组织纸有助于观察气泡的位置。对于 P5 后的阶段, 白色组织纸是更好的, 因为它有助于观察黄色的身体, 眼睛的颜色, 刚毛, 和身体的颜色。
班布里奇和 Bownes17从其出现频率上估计蛹阶段的持续时间。它们的临时表是四腹果蝇18中使用最广泛的一个。为他们的方法, 他们准备了四个食物瓶包含五成年女性和五成年男性并且保留他们在黑暗中, 然后蛹从一个瓶子被随机地拿出从每个在 11, 12, 13, 和14天在产卵以后的开始。他们计算了特定阶段的蛹数, 并算出了平均数。根据蛹周期的总持续时间和这些频率数据, 可以估计每个蛹阶段的长度。这种方法的一个问题是, 它不能用于估计蛹阶段的精确持续时间, 如果发育时间趋于同步之间的蛹。
实际上, 我们在guttifera中尝试了班布里奇和 Bownes 的方法, 由于蛹之间的同步, 我们得到了偏置数据。我们不能确定这一现象的原因, 但有些可能性是 1) 蛹保留了他们的年轻阶段和/或2的昼夜节律, 他们的反应对光的曝光发生在观察。因此, 我们决定通过直接观察来测量实际阶段的持续时间。这就减少了由昼夜节律引起的偏倚。
这里描述的方法是一种方法, 以量化的额外积累黑色素的斑点相比, 他们周围的控制面积 (ΔOD), 减去 od 的控制区的 od 的现场。该方法是由孚染色和图像分析 (密度测量28,29) 来量化细胞核 DNA 含量的方法启发的。作为应用这种方法的潜在问题之一的翅膀色素沉着, ΔOD 可以是一个负值, 特别是当一个蛹很年轻, 几乎没有色素沉着。在以后的阶段, 可能会有一些色素沉着的控制区。使用的简单 OD 的现货区本身可能是适当的, 而不是ΔOD 取决于研究的目的。在D. guttifera的情况下, 使用简单 OD 代替ΔOD 没有改变数据或研究结论的倾向。
披露声明
作者没有利益冲突。
致谢
我们感谢肖恩·卡罗尔和托马斯. 沃纳为您提供飞行股票、设备的直保险丝、在拍摄中的帮助、清阿加塔的指导和伊丽莎白中岛的英语编辑。这项工作得到了 KAKENHI 17K19427 和武田科学基金会的支持。
材料
| Name | Company | Catalog Number | Comments |
| Drosophila guttifera | The Drosophila Species Stock Center at the U.C. San Diego | 15130-1971.10 | Drosophila guttifera, a fruit fly species used in this article |
| Plastic vial | Hightech | MKC-30 | Plastic vial, for fly stock maintenance |
| Buzz plugs vial and bottle closures for glass vials | Fisher Scientific | AS-271 | Cellulose plug, for fly stock maintenance |
| White soft sugar | Mitsui Sugar | J-500g | White soft sugar, for standard cornmeal/sugar/yeast/agar food |
| Corn flour | Nippon Flour Mills | F | Corn flour, for standard cornmeal/sugar/yeast/agar food |
| Corn grits - C | Nippon Flour Mills | GC | Corn grits - C, for standard cornmeal/sugar/yeast/agar food |
| Agar powder | Matsuki Kanten Sangyo | No.602 | Agar powder, for standard cornmeal/sugar/yeast/agar food |
| Dry beer yeast | Asahi Food & Healthcare | Y2A | Dry beer yeast, for standard cornmeal/sugar/yeast/agar food |
| Butyl p-hydroxybenzoate | Nacalai Tesque | 06327-02 | Butyl p-hydroxybenzoate, for standard cornmeal/sugar/yeast/agar food |
| Ethanol | Wako | 057-00456 | Ethanol, for standard cornmeal/sugar/yeast/agar food |
| Flat bottom microtube | Ina Optica | CF-0150 | 1.5 mL microtube, for collecting pupae |
| CAPSULEFUGE | Tomy | PMC-060 | Mini microcentrifuge, for collecting pupae |
| Sterilized Schale NB | Sansei Medical | 01-013 | Plastic Petri dish (diameter 90 mm x height 15 mm) |
| Serum tube rack | Iwaki | 9796-050 | Used as a moist chamber, for observation of pupa |
| Corning Falcon Easy-Grip tissue culture dish | Corning | 353001 | Plastic Petri dish (diameter 35 mm x height 10 mm) |
| Falcon standard tissue culture dish | Corning | 353002 | Plastic Petri dish (diameter 60 mm x height 15 mm) |
| Push-pin | Kokuyo | 51233709 | Push-pin, for making pinholes on the microtube lid |
| Stereomicroscope | Olympus | SZX16 | Stereomicroscope, for morphological observation |
| Digital camera | Olympus | DSE-330-A | Digital camera, for imaging |
| NICETACK double sided tape | Nichiban | NW-15SF | Double sided tape, for removing puparium |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | Forceps, for removing puparium |
| Van Gogh VISUAL Paint brush | Talens Japan | GWVR-#5/0 | Paint brush, for removing puparium |
| Greiner CELLSTAR 12 well cell culture plate | Merck | 665-180 | 12-well cell culture plate, for measuring durations of pupal periods |
| NaCl | Wako | 191-01665 | NaCl, for PBS |
| KCl | Nacalai Tesque | 285-14 | KCl, for PBS |
| Na2HPO4·12H2O | Wako | 196-02835 | Na2HPO4·12H2O, for PBS |
| KH2PO4 | Nacalai Tesque | 28721-55 | KH2PO4, for PBS |
| Stepped Neutral Density (ND) Filter 0.04 - 3.0 | Edmund Optics | 64-384 | Stepped density filter, for calibration of pigmentation measurement |
| ImageJ software | NIH | 1.8.0-101 | ImageJ software, for measurement of intensity of black spots on a wing (https://imagej.nih.gov) |
| FINE FROST glass slide | Matsunami Glass Ind | FF-001 | Glass slide, for measurement of intensity of black spots on a wing |
| Square microscope cover glass 18 x 18 | Matsunami Glass Ind | C018181 | Cover slip, for measurement of intensity of black spots on a wing |
参考文献
- Carson, H. L., Hardy, D. E., Spieth, H. T., Stone, W. S. The evolutionary biology of the Hawaiian Drosophilidae. Essays in evolution and genetics in honor of Theodosius Dobzhansky. Hecht, M. K., Steere, W. C. , Springer (Meredith Corporation). New York. 437-543 (1970).
- Markow, T. A., O'Grady, P. M. Drosophila: a guide to species identification and use. , Academic Press. New York. (2006).
- Patterson, J. T. The Drosophilidae of the southwest. 4313, University of Texas Publication. 7-216 (1943).
- Setoguchi, S., Takamori, H., Aotsuka, T., Sese, J., Ishikawa, Y., Matsuo, T. Sexual dimorphism and courtship behavior in Drosophila prolongata. J Ethol. 32 (2), 91-102 (2014).
- Werner, T., Jaenike, J. Drosophilids of the Midwest and Northeast. , River Campus Libraries, University of Rochester. Rochester. (2017).
- Arnoult, L., et al. Emergence and diversification of fly pigmentation through evolution of a gene regulatory module. Science. 339 (6126), 1423-1426 (2013).
- Camino, E. M., Butts, J. C., Ordway, A., Vellky, J. E., Rebeiz, M., Williams, T. M. The evolutionary origination and diversification of a dimorphic gene regulatory network through parallel innovations in cis and trans. PLoS Genet. 11 (4), e1005136(2015).
- Gompel, N., Prud'homme, B., Wittkopp, P. J., Kassner, V. A., Carroll, S. B. Chance caught on the wing: cis-regulatory evolution and the origin of pigment patterns in Drosophila. Nature. 433 (7025), 481-487 (2005).
- Glassford, W. J., et al. Co-option of an ancestral Hox-regulated network underlies a recently evolved morphological novelty. Dev. Cell. 34 (5), 520-531 (2015).
- Koshikawa, S. Enhancer modularity and the evolution of new traits. Fly. 9 (4), 155-159 (2015).
- Koshikawa, S., et al. Gain of cis-regulatory activities underlies novel domains of wingless gene expression in Drosophila. Proc Natl Acad Sci U S A. 112 (24), 7524-7529 (2015).
- McGregor, A. P., et al. Morphological evolution through multiple cis-regulatory mutations at a single gene. Nature. 448 (7153), 587-590 (2007).
- Tanaka, K., Barmina, O., Kopp, A. Distinct developmental mechanisms underlie the evolutionary diversification of Drosophila sex combs. Proc Natl Acad Sci U S A. 106 (12), 4764-4769 (2009).
- Werner, T., Koshikawa, S., Williams, T. M., Carroll, S. B. Generation of a novel wing colour pattern by the Wingless morphogen. Nature. 464 (7292), 1143-1148 (2010).
- Wittkopp, P. J., et al. Intraspecific polymorphism to interspecific divergence: genetics of pigmentation in Drosophila. Science. 326 (5952), 540-544 (2009).
- Lawrence, P. A., Morata, G. Compartments in the wing of Drosophila: a study of the engrailed gene. Dev Biol. 50 (2), 321-337 (1976).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. J. Embryol. Exp. Morphol. 66, 57-80 (1981).
- Ashburner, M., Golic, K. G., Hawley, R. S. Drosophila: A Laboratory Handbook. , 2nd ed, Cold Spring Harbor Laboratory Press. New York. (2005).
- Fukutomi, Y., Matsumoto, K., Agata, K., Funayama, N., Koshikawa, S. Pupal development and pigmentation process of a polka-dotted fruit fly, Drosophila guttifera (Insecta, Diptera). Dev Genes Evol. 227 (3), 171-180 (2017).
- Koshikawa, S., Fukutomi, Y., Matsumoto, K. Drosophila guttifera as a model system for unraveling color pattern formation. Diversity and evolution of butterfly wing patterns: an integrative approach. Sekimura, T., Nijhout, H. F. , Springer. New York. in press (2017).
- True, J. R., Edwards, K. A., Yamamoto, D., Carroll, S. B. Drosophila wing melanin patterns form by vein-dependent elaboration of enzymatic prepatterns. Curr Biol. 9 (23), 1382-1391 (1999).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Izumitani, H. F., Kusaka, Y., Koshikawa, S., Toda, M. J., Katoh, T. Phylogeography of the Subgenus Drosophila (Diptera: Drosophilidae): evolutionary history of faunal divergence between the Old and the New Worlds. PLoS ONE. 11 (7), e0160051(2016).
- Resh, V. H., Cardé, R. T. Encyclopedia of Insects. , 2nd ed, Academic Press. Burlington. (2009).
- DeLean, A., Munson, P. J., Rodbard, D. Simultaneous analysis of families of sigmoidal curves: application to bioassay, radioligand assay, and physiological dose-response curves. Am J Physiol. 235 (2), E97-E102 (1978).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological changes. J Morphol. 59 (2), 351-399 (1936).
- McKinney, M. L., McNamara, K. Heterochrony: the evolution of ontogeny. , Plenum Press. New York. (1991).
- Hardie, D. C., Gregory, T. R., Hebert, P. D. From pixels to picograms: a beginners' guide to genome quantification by Feulgen image analysis densitometry. J Histochem Cytochem. 50 (6), 735-749 (2002).
- Koshikawa, S., Miyazaki, S., Cornette, R., Matsumoto, T., Miura, T. Genome size of termites (Insecta, Dictyoptera, Isoptera) and wood roaches (Insecta, Dictyoptera, Cryptocercidae). Naturwissenschaften. 95 (9), 859-867 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。