Method Article
שיטות מדידה של אגף פיגמנטציה של דרוזופילה guttifera ותקופות הגולמי הזמני
In This Article
Summary
פרוטוקולים עבור היערכות תקופות הגולמי ומדידה של אגף פיגמנטציה של דרוזופילה guttifera מתוארים. האחסון הזמני, כימות של פיגמנטציה לספק בסיס מוצק לימוד מנגנוני התפתחותית של תכונות למבוגרים ולאפשר השוואה interspecific של תכונה הפיתוח.
Abstract
מגוונת מיני דרוזופילה (זבוב הפירות) מספקים הזדמנויות ללמוד מנגנונים של פיתוח, שינויים גנטיים אחראים שינויים אבולוציוניים. בפרט, השלב למבוגרים הוא מקור עשיר של תכונות מורפולוגיות להשוואה interspecific, כולל השוואה פיגמנטציה כנף. במחקר התפתחותי הבדלים בין המינים, התבוננות מפורטת ובימוי המתאים נדרשים עבור השוואה מדויקת. כאן נתאר פרוטוקולים הזמני של תקופות הגולמי, כימות של אגף פיגמנטציה של זבוב פירות מנוקד, guttifera דרוזופילה. ראשית, אנו מתארים את שיטת עבור ההגדרה של שלבים הגולמי בהתבסס על מורפולוגיות ופיקוח מורפולוגי מפורט. שיטה זו כוללת טכניקה עבור הסרת את puparium, כמו במקרה chitinous החיצוני של הגולם, כדי לאפשר התבוננות מפורטת מורפולוגיות הגולמי. שנית, אנו מתארים שיטה למדידת משך שלבים מוגדרים הגולמי. לבסוף, אנו מתארים את השיטה על כימות של פיגמנטציה כנף בהתבסס על ניתוח התמונה באמצעות תמונות דיגיטליות ותוכנה ImageJ. באמצעות שיטות אלה, אנו יכולים להקים בסיס מוצק להשוואת תהליכים התפתחותיים של תכונות למבוגרים בשלבים הגולמי.
Introduction
חלק תכונות מורפולוגיות דרוזופילה מגוונים בין המינים1,2,3,4,5. עלינו לגשת לשאלה של גיוון איך מורפולוגי נשאלת על ידי השוואת את המנגנונים של דור מורפולוגיות אלה. דוגמאות כאלה מורפולוגיות הם trichomes זחל, מסרקים המין למבוגרים, המנגנון איברי המין החיצוניים, פיגמנטציה בטן ואגף פיגמנטציה6,7,8,9, 10 , 11 , 12 , 13 , 14 , 15. ללמוד הבדלים מורפולוגיים בין מבוגרים, התבוננות וניתוח של השלבים הגולמי הם חשובים, כי גורלו של תכונות למבוגרים נקבע לפי הזחל מאוחר וממשיך מורפוגנזה הבאים במהלך תקופת הגולמי.
בלימודי ביולוגיה התפתחותית דרוזופילה melanogaster, "שעות APF" (שעות לאחר היווצרות הגולמי) היא השיטה הנפוצה כדי לציין גולמי16. מערכת זו מעסיקה זמן מוחלט לאחר היווצרות הגולמי, והוא מאוד נוח עבור ניסויים שגרתית. עם זאת, מהירות התפתחותי עשויים להיות שונים בין הגלמים, עשוי להיות מושפע הבדל גנטי, epigenetic או microenvironmental ואת ולכן נתקל באותו זמן מוחלט לאחר היווצרות הגולמי אינה מבטיחה כי הגלמים הם באותו שלב התפתחותי. במקרים רבים, שלבים מוגדרים על-ידי תכונות מורפולוגיות עדיפים להשוואת בכמה אנשים. במיוחד, השוואה בין מינים דורש היערכות מדויק השוואה בין שלבים (הומולוגיים) המתאים.
Bainbridge ו- Bownes17 מוכר 20 שלבים הגולמי (P1 כדי P15(ii)) מבוסס על תכונות מורפולוגיות של הגלמים melanogaster דרוזופילה . לביום היא השיטה הנפוצה ביותר של מורפולוגי הזמני התפתחותית18. במחקר הקודם, ביצענו staging הגולמי של דרוזופילה guttifera להקים בסיס הכנף פיגמנטציה מחקרים19. Guttifera ד יש דפוס שחור עם נקודות על הכנפיים והוא אחד המינים מודל עבור אגף פיגמנטציה היווצרות20. למרות הפננו את הקריטריונים מורפולוגי שמתואר Bainbridge של Bownes' מחקר17, מדדנו ישירות משכים הבמה על ידי תצפיות טורי19, במקום להשתמש שערוך Bainbridge ו Bownes' הבמה המשכים מתדר שנצפו. כאן נתאר את השיטה של היערכות הגולמי ואת מדידה של המשכים של הגולמי שלבי דרוזופילה בשימוש ואחFukutomi19.
ללמוד מנגנון התפתחותית של אגף פיגמנטציה, עלינו לדעת מתי בשלבים הגולמי או למבוגרים הפיגמנטציה. Fukutomi et al. 19 לכמת צפיפות אופטית (נחמד) של פיגמנטציה בשלבים הגולמי ומבוגרים על-ידי ניתוח תמונות של תמונות כנף. הפיגמנטציה של כנפיים דרוזופילה נחשב נגרמת על ידי הצטברות של מלנין שחור21. על כימות של מקרי מוות ממנת יתר, שימשו תמונות גווני אפור ו- ImageJ תוכנה (https://imagej.nih.gov/ij/)22 . כדי לזהות ולכמת את הפיגמנטציה במקום ספציפי (ΔOD), אנחנו להחסיר OD מחוץ נקודה OD בתוך מקום. כדי להפוך שיטה זו אובייקטיבית הדירים, המקומות יתר המידה צריך להיות נחוש באמצעות אגף ורידים כמו ציוני דרך. במאמר זה נתאר בפירוט שיטה זו של כימות של פיגמנטציה כנף ב דרוזופילה guttifera.
Protocol
1. לטוס מניות
- השתמש דרוזופילה guttifera עבור כל הפרוטוקולים הבאים.
- השתמש צלוחיות פלסטיק (בקוטר 25 מ מ x גובה 96 מ מ) והשקעים תאית (קוטר 23 מ מ x גובה 26 מ מ) לצורך תחזוקה מניות. השתמש מאכל קמח תירס/סוכר/שמרים/אגר רגיל, בעקבות פרסום תיאר שלושה מתכונים חלופיים אחרים זה מינים2.
הערה: guttifera ד (מספר מניות 15130-1971.10) הינו מסופק על ידי המרכז מניות דרוזופילה מינים באוניברסיטת קליפורניה, סן דייגו. למרות guttifera ד שייך immigrans-tripunctata קרינה, אשר קשור melanogaster ד בתוך סוג23, יש לו תכונות ביולוגיות רבות במשותף עם ד melanogaster . בהתאם לכך, פרוטוקול זה יכול להיות מיושם עבור מינים רבים דרוזופילה , למרות מינים מסוימים דורשים מזון מסוים ו/או טיפים טכניים כדי לשמור אותם2.
2. תצפית של גולם בחדות שלבים הגולמי
הערה: הגולם להשגחה נלקח מן המלאי לטוס עם 12:12 h/כהה מחזור ב 25 º C. Bainbridge ו- Bownes17 תיאר סיכון נמוך של העברת melanogaster ד הגלמים מהמקום המקורי של התגלמות על חתיכת נייר טישו בטעימת (97% הישרדות של הגלמים הועברו 946). Guttifera ד הגלמים ניתן להכין למעשה באותה שיטה.
- במקום והבריאים של זבוב החומץ על מזון טרי (מזון קמח תירס/סוכר/שמרים/אגר רגיל) בבקבוקון פלסטיק (בקוטר 25 מ מ x גובה 96 מ מ) ולתת להם להטיל ביצים. לחכות 7 ימים כדי להשיג את הזחל השלישית מאוחר.
- מניחים 1 מ"ל של מזון קמח תירס/סוכר/שמרים/אגר רגיל microtube 1.5 מ ל כל אחד. להפוך pinholes 3 עם 2 מ מ עובי המרווח עפעפיו של microtubes על ידי החדרת עם דחיפה-pin כדי לאפשר נשימה.
- Centrifuge את microtubes עם אוכל עבור 7 s ב- microcentrifuge מיני (860 x g).
- היפוך והקש על הבקבוקונים להסיר את כולנו מבוגרים המבחנה.
- יוצקים 5-10 מ ל- ddH2O (או מים אוסמוזה הפוכה) לתוך הבקבוקון.
- שופכים הזחלים עם מים לתוך פלסטיק פטרי (בקוטר 90 מ מ x גובה 15 מ מ). לזהות הזחל השלישית מאוחר לפי גודלם גוף גדולים (3-4 מ מ אורך).
- הניעי בעדינות הזחלים לחלל השלישית מאוחר עם מלקחיים לתוך microtubes עם האוכל (הזחלים 10 / microtube). דגירה אותם בן לילה ב 25 º C.
- להזיז הגלמים שהוקם על גבי פיסת נייר טישו לחלח ב- ddH2O, להציב פלסטיק פטרי (קוטר 35 מ מ x גובה 10 מ מ).
- הכנס הפטרי תא לחה (מכיל 10 מ"ל של ddH2O בחלק התחתון), והמתן עד הגלמים לפתח לבמה הרצוי.
- כנסו גלמים על חתיכת נייר טישו בטעימת פלסטיק פטרי (קוטר 60 מ מ x גובה 15 מ מ).
הערה: ההגדרה של שלבים בעיקר שניתן יהיה מבוסס על במות melanogaster ד17. בדרך כלל, תקופת הגולמי דרוזופילה ניתן לסווג P1 - P15(ii), למרות מספר שינויים בהגדרת הבמה יהיה צורך בהתאם למין, בשימוש. במידת האפשר, הסרת את puparium מאפשר התבוננות מדויק ומפורט. ראה פרטים להלן (שלב 3). - להתבונן הגלמים תחת מיקרוסקופ סטריאו. צלמו תמונות באמצעות מצלמה דיגיטלית המחוברים המיקרוסקופ סטריאו.
3. הסרת puparium
הערה: גלמי של דרוזופילה מכוסים במבנה הנקרא את puparium. חרק של Muscomorpha (זבובים) תזילו שלה לציפורן זחל-להתגלמות; במקום זאת, זה מחזק את הקוטיקולה לאחר apolysis, ואני משתמש בו בתור כיסוי מגן של הגולם, puparium24. גולם המתגוררים בתוך puparium יש לציפורן הגולמי האמיתי, וזה מאוד רכה ושבירה. לפני apolysis מתקיים סביב P4(ii), epithelia ו- puparium מחוברים יחד, ולכן הסרת את puparium ללא נזק קשה מאוד. לאחר P5, הסרת את puparium היא מייגעת, אבל שימושי עבור ההגדרה של שלבים הגולמי ופיקוח מורפולוגי. התהליך מתבצע כדלקמן.
- מוספית נייר-דבק דו צדדי על פיסת נייר מגבת.
- במקום גולם על הצד הבטני סרט הדבקה דו-צדדי למעלה (איור 1 א').
- אתר הרווח בין הצד הקדמי של puparium הגולם פנימי. לתפוס, להסיר את puparium סביב הפער באמצעות מלקחיים, לחשוף את הצד הקדמי של הראש של הגולם.
- הכנס את קצה המלקחיים על-ידי הזזתה במקביל הציר הקדמי-את ישבנה. הרם את קצה המלקחיים לשבור את puparium באופן מקומי. חזור על פעולה זו עד הנזק מגיע החלק האחורי puparium. להבטיח כי פער נוצרת גם בין puparium לבין הרגליים הגולמי, לשבור את הצד הבטני של puparium, למזער את הנזק הגולם פנימי (איור 1B).
- לאחר שבירת את puparium ככל האפשר, להוציא הגולם שימוש במכחול בסדר (#5/0) (איור 1C).
- במקום הגולם על פיסת נייר טישו לחלח עם ddH2O, להציב פלסטיק פטרי (קוטר 60 מ מ x גובה 15 מ מ). צלמו תמונות בהקדם האפשרי כי הגולם החשוף פגיע ולא בקלות הופך להיות יבש.
הערה: גלמי ללא puparium אינם מתאימים למדידת משך תקופות הגולמי (שלב 4), כי הלחץ (כגון לייבוש) ונזק פיזי עשוי להפריע להתפתחות התקינה.
4. מדידת המשכים של שלבים הגולמי
- להכין הגלמים למדידת המשכים של שלבים הגולמי, כפי שמתואר בשלב 2. איסוף הגלמים של 1-2, 2-3, 3-4 ימים לאחר היווצרות הגולמי (20 הגלמים כל). לתת מספרי זיהוי אישי (1-60) גלמי לצורך זיהוי. המשך איסוף שזה עתה נוצר הגלמים במהלך השלבים הבאים, כדי להשיג 20 הגלמים צעיר יותר. לתת מספרי זיהוי אישי (61-80) שהוקם הגלמים. במקום גולם על ddH2O לחלח רקמת נייר בטוב (3.9 ס מ2) של צלחת תרבות. ובכן 12 תאים (גולם 1/טוב, גלמי 12/צלחת). למלא את החלל הבין-טוב של צלחות ddH2O כדי לשמור על לחות, לשים את המכסים, ולמקם את הצלחות ב- 25 ° C, לתנאי תאורה קבועה (24:0 h/כהה).
הערה: גלמי ללא puparium אינם מתאימים למדידת משך תקופות הגולמי. אנא אל תסיר את puparium - להתבונן תכוניות מורפולוגיות כולל צבע הגוף, זיפים, בקוריאנית Malpighian והגוף צהוב של הגלמים כל פעם אחת כל 30 דקות, שיא נצפתה שלבים (P1 - P15(ii), מבוסס על17,הפניות19) גיליון החישוב.
- להמשך ההקלטה על ארבעה ימים רצופים (96 שעות) על ידי סיבוב משמרת בני שלוש (או יותר).
- לספור מספרים של רשומות של כל שלב מסוים, ולחשב ממוצע אותם (ממוצע ספירה של תצפיות / הגלמים). ואז להכפיל אותם על ידי 0.5 (ח), וכתוצאה מכך האורכים המשוערת של שלבים (h).
5. מידת האינטנסיביות של כתמים שחורים על כנף
הערה: ניתן לכמת את עוצמת כתמים שחורים על כנף הגולמי או למבוגרים על ידי מדידת צפיפות אופטית (OD). מסנן זכוכית עם לקיחת ידוע (צפיפות מדורגת מסנן) משמש כיול25, כך ניתן לחשב את יתר של אזור מסויים של תמונה דיגיטלית של האגף. OD במקום ו- OD מחוץ במקום נמדדים ולאחר שהאחרון יופחת מ לשעבר כדי לקבל את העוצמה של המקום (ΔOD). כאן, אנו מתארים את השיטה של דיסקציה, מדידה וחישוב של ΔOD. הליך זה יכול להיעשות לאחר שלב 2, עצמאית שלב 3, שלב 4. וברגע אחד הופיעה בשלב 2 ומבין כל השלבים הגולמי, ניתן ישירות להתחיל או חזור על שלב 5.
- הכנת תמונה
- להכין גולם חדש של שלב מוקד כפי שמתואר בשלב 2. הסר את החלק הקדמי של puparium עם מלקחיים. להוציא את הגולם באמצעות מלקחיים ולמקם אותו לתוך פוספט buffered תמיסת מלח (PBS, בטבלה 2) פלסטיק פטרי (קוטר 35 מ מ x גובה 10 מ מ).
- לחתוך את המקום הבזליים של האגף (מפרק הבזליים הוא החלק הצר הפרוקסימלית של האגף). כמו האגף הוא מקופל, למקם אותו לתוך פלסטיק פטרי (קוטר 35 מ מ x גובה 10 מ מ) מלא עם ddH2O כדי להאריך את זה על ידי לחץ אוסמוטי (האגף נפרש בפני עצמו).
- לאסוף לאחרונה eclosed מבוגרים פעם אחת בכל 10 דקות בקבוקון מניות. עזים ומתנגד זבוב עם CO2 באמצעות כרית בהרדמת של2 CO, לאשר את ההרדמה נייחות וחותכים את הג'וינט הבזליים של האגף.
- מקום 10 µL של PBS על משטח זכוכית, התרחשו האגף, ולכסות עם מכסה (18 מ מ x 18 מ"מ).
- להדליק את האור של המיקרוסקופ סטריאו. הגדר את האור כדי להיות ברמה מקסימלית. הגדר את העדשה המטרה 11.5 X. הגדר את הסרעפת להיות המדינה הפתוח ביותר. הפעל את המצלמה. להגדיר את המצלמה כדי להיות (ISO: 100, מצב SHQ 3136 x פיקסלים 2352, מהירות צמצם: 1/20 s). מתמקדים המדגם על-ידי הזזת הידית המוקד על המיקרוסקופ.
- לחצו על הכפתור תריס של יחידת שלט לקחת תמונה. לקחת 3 תמונות לכל כנף, שכל אחד מהם חייב להיות מרוכז על sensillum campaniform, crossvein ספוט או האחורי האורך וריד, מיצוב החלק הדיסטלי של האגף בצד שמאל ואת החלק הקדמי של הזרוע בצד העליון.
- כיול
- קח תמונות של 9 חלקים של מסנן צפיפות מדורגת באמצעות אותן הגדרות המצלמה והשיג את התמונה כנף.
- ליזום תוכנה (https://imagej.nih.gov/ij/) ImageJ22.
- לחץ על קובץ | פתוח | ובחר באחת התמונות של המסנן צפיפות מדורגת.
- לחץ על התמונה | סוג | 8-bit | כדי להמיר את התמונה לתמונה 8 סיביות.
- לחץ על ערוך | בחירה | לציין | בדוק את העמודה סגלגל , ממורכז . כתוב 100 (פיקסלים) בעמודה רוחב , 100 (פיקסלים) בעמודה גובה , 1568 בעמודה לתאם X ו- 1176 בעמודה Y לתאם . לחץ על אישור.
- לחץ על ניתוח | מדד |. "מתכוון ערך האפור" של אזורים נבחרים נמדדים.
- 5.2.3. אני חוזר. כדי 5.2.6. עבור 8 שנותר תמונות.
- לחץ על ניתוח | כיול , בחר Rodbard25 בעמודה פונקציה ולכתוב מספר להלן בעמודה השמאלית באמצע (מספרים 0.04, 0.336, 0.632, 0.928, 1.224, 1.52, 1.816, 2.112, 2.408; אלה תלויים הצפיפויות של דרך מסנן צפיפות).
- בדיקת כיול הכללית עמודה ולחץ על ' אישור'.
הערה: על-ידי ביצוע הליך זה, "מתכוון ערך האפור" מומר "צפיפות אופטית (OD)" באמצעות הפונקציה Rodbard. לאחר שלב זה, צפיפות אופטית ניתן לחשב אזור נבחר מסוים בתוכנה ImageJ.
- בחירת אזור של מדידות
הערה: כתמים קשורים בדרך כלל עם האטרקציות, כגון campaniform sensilla, טיפים האורך וריד ו- crossveins. אלה וציוני אחרים על כנף יכול לשמש כדי לבחור את האזור של מדידות. כאן, למשל ב-D. guttifera(איור 2) מתואר.- הגדרת נקודה A, campaniform sensillum ספוט.
- פתח תמונה שבה מקום sensillum campaniform הוא במרכז התמונה. לחץ על התמונה | סוג | 8-bit | כדי להמיר את התמונה לתמונה 8 סיביות.
- לחץ על מלבן בכלי בחירה באזור , צייר מלבן. הגדר הקודקוד הימנית העליונה של המלבן כך שהוא מחובר לקו האחורי של הווריד האורך השלישי ו דיסטלי יותר מכל מקום sensillum campaniform. להגדיר את הצד הימני של המלבן כך הוא ממוקם מימין sensillum campaniform ספוט.
- לחץ על ערוך | בחירה | להוסיף מנהל |. בדוק בעמודה הצג הכל .
- לחצו על הכלי זווית בכלי בחירת קו. לצייר את השורה הראשונה על הקו האחורי של וריד האורך השלישי. הגדר את הקצה השמאלי של הקו על הקודקוד של המלבן נמשך בשלב 1. ציירו את הקו השני בחלק העליון של המלבן. הקש על מקש "m" כדי למדוד את הזווית בין שני הקווים נמשך בשלב זה. לחץ על החלון של התמונה על המסך של המחשב.
- לחץ על ערוך | בחירה | להוסיף מנהל |.
- לחץ על מלבן בכלי בחירת האזור וצייר מלבן של-1/9 הגודל של החלון. לחץ על ערוך | בחירה | לסובב |. לכתוב את מעלות מינוס של הזווית שנמדדה בשלב 5.3.1.4. זווית בעמודה, לחץ על אישור כדי לסובב את המלבן נמשך בשלב זה.
- הזז את המלבן נמשך בשלב 5.3.1.6. באמצעות מקשי החצים. להגדיר את נקודת הקצה של הקו האחורי של הווריד האורך השני על הצד השמאלי של המלבן, בצד התחתון של המלבן מחוברת לקו האחורי של הווריד האורך השלישי. אשר שבו משורטט קו אנכי מנקודת הקצה של הווריד האורך השני של הקו האחורי של הווריד האורך השלישי של בהליך זה. מגדירים למרגלות לקו המוזז מתקצר מנקודה א (איור 2 א).
- רשומת ה-x וקואורדינטת ה y של הנקודה, המצוין להלן כלי בחירה באזור בעת הצבת הסמן על נקודה א
- ההגדרה של נקודה B, וריד האורך העצה ספוט
- פתח תמונה שבה מקום עצה וריד האורך הוא במרכז התמונה. לחץ על התמונה | סוג | 8-bit | כדי להמיר את התמונה לתמונה 8 סיביות.
- חזור על הפעולות באותו שמתואר בשלב 5.3.1. (ההגדרה של נקודה A, campaniform sensillum ספוט) למצוא מנקודה A בתמונה.
- לחץ על ערוך | בחירה | להוסיף מנהל |.
- לחץ על מלבן בכלי בחירה באזור , צייר מלבן. לקבוע הקודקוד הימנית העליונה של המלבן נקודת הקצה של הקו האחורי של הווריד האורך השלישי.
- לחץ על ערוך | בחירה | להוסיף מנהל |.
- לחצו על הכלי זווית בכלי בחירת קו. לצייר את השורה הראשונה להתחבר מנקודה A ונקודת הסיום של הקו האחורי של הווריד האורך השלישי. להגדיר קו זה כמו לצייר קו א השורה השניה בצד העליון של המלבן נמשך בשלב 5.3.2.4. הקש על מקש "m" כדי למדוד את הזווית בין שני הקווים.
- לחץ על ערוך | בחירה | להוסיף מנהל |.
- לחץ על מלבן בכלי בחירת האזור וצייר מלבן של-1/9 הגודל של החלון. לחץ על ערוך | בחירה | לסובב |. לכתוב את מעלות מינוס של הזווית שנמדדה בשלב 5.3.2.6. זווית בעמודה, לחץ על אישור כדי לסובב את המלבן נמשך בשלב זה. להזיז את המלבן באמצעות מקשי החצים. להגדיר את הצד העליון של המלבן כך שהוא מחובר קו A, את נקודת הקצה של הקו הקדמי של הווריד האורך הרביעי של זה בצד שמאל של המלבן.
- לחץ על ערוך | בחירה | להוסיף מנהל |.
- לחץ על מלבן בכלי בחירת האזור וצייר מלבן של-1/9 הגודל של החלון. לחץ על ערוך | בחירה | לסובב |. לכתוב את מעלות מינוס של זווית נמדד לשלב 6 זווית עמודה ולחץ על אישור כדי לסובב את המלבן נמשך בשלב זה. להזיז את המלבן באמצעות מקשי החצים. הגדרת הקודקוד הימנית התחתונה של המלבן, כך היא הקודקוד הימנית העליונה של המלבן נמשך בשלב 5.3.2.8., וכתוצאה מכך קבלת לקו המוזז מתקצר מ נקודת הקצה של הקו הקדמי של הווריד האורך הרביעי של קו א להגדיר נקודת ההצטלבות של קו המוזז מתקצר לבין הקו האחורי של הווריד האורך השלישי כמו הנקודה B (איור 2B).
- רשומת ה-x וקואורדינטת ה y של נקודה B, המצוין להלן כלי בחירה באזור בעת הנחת המצביע לנקודה ב
- ההגדרה של הנקודה C, crossvein האחורי ספוט
- פתח תמונה שבה מקום crossvein האחורי הוא במרכז התמונה. לחץ על התמונה | סוג | 8-bit | כדי להמיר את התמונה לתמונה 8 סיביות.
- הגדרת נקודה C כנקודת האחורי ביותר של הקו הקדמי של הווריד האורך הרביעי באזור צומת crossvein האחורי, את הווריד האורך הרביעי (איור 2C).
- להקליט קואורדינטת x ואת קואורדינטת y של הנקודה C, המצוין להלן כלי בחירה באזור בעת הצבת הסמן על הנקודה C...
- ההגדרה של הנקודה D, אזור שליטה
- פתח תמונה שבה מקום sensillum campaniform הוא במרכז התמונה. לחץ על התמונה | סוג | 8-bit | כדי להמיר את התמונה לתמונה 8 סיביות.
- לחץ על ישר בכלי בחירת קו , לצייר קו המחבר את נקודת הקצה של הקו הקדמי של הווריד האורך השני, את נקודת הקצה של הקו האחורי של הווריד האורך הרביעי. הגדרת נקודה D כנקודת מעבר זה ובין הקו האחורי של הווריד האורך השלישי של (איור דו-ממדי).
- רשומת ה-x וקואורדינטת ה y של הנקודה D, המצוין להלן כלי בחירה באזור בעת הצבת הסמן על נקודת ד
- הגדרת נקודה A, campaniform sensillum ספוט.
- מדידות
- פתח את אחת של תמונות המקומות כנף (לפי מדידה של נקודת A, פתחו את התמונה עם מנקודה א במרכז). לחץ על התמונה | סוג | 8-bit | כדי להמיר את התמונה לתמונה 8 סיביות.
- לחץ על מלבן בכלי בחירת האזור וצייר מלבן של-1/9 בגודל של החלון.
- לחץ על ערוך | בחירה | לציין |. בדוק את העמודה סגלגל , ממורכז . לכתוב 100 (פיקסלים) עמודות רוחב וגובה , לכתוב את הקואורדינטות x מנקודה A (או לנקודה ב' או הנקודה C) ו D לתאם X בעמודה, כתיבה y קואורדינטות של נקודות A (או לנקודה ב' או הנקודה C) ו- D Y לתאם עמודה. לחץ על אישור.
- לחץ על ניתוח | מדד |. אם הכיול שמתואר 5.2 הסתיימה כבר, לקיחת נקובים בעמודה מתכוון .
- לחשב את ΔODs על-ידי חיסור OD של הנקודה D של מקרי מוות ממנת יתר של נקודות A, B ו- C.
הערה: נקודה D נמצא חלק שקוף של האגף, אינם כוללים פיגמנטציה, ולכן מתאים לשימוש עבור פקד רקע.
תוצאות
תקופת guttifera ד הגולמי מחולק 17 שלבים (P1 - P15(ii); תמונות של נציג שלושה שלבים (P1, P5 - 6, P10) מוצגים באיור 3, בכל שלבי 17 מומחשים איור 4). למרות Bainbridge ו- Bownes17 מזוהה 20 שלבים melanogaster ד, חלק השלבים האלה לא היתה אפשרות להחיל כדי guttifera ד. את הסדר של שני אירועים התפתחותיים, את המראה של הגוף הצהוב (מסה של תאים לשפוך בתוך פיתול26) ואת העיתוי של בקוריאנית Malpighian הופכת לירוקה, הם לא תחת פיקוח קפדני ב guttifera ד, ומכאן אנו יכולים לא נפרד P5 (i ), P5(ii) ו- P6. כמו כן, בניגוד ב ד melanogaster, העיתוי של השחרה של בית החזה והבטן סומרות סונכרן, ולכן אנחנו יכולים לא נפרד P11(i) ו- P11(ii)19.
אנו יכולים למדוד את אורך השלבים הגולמי של guttifera ד (טבלה 3, Fukutomi et al.19). כל התקופה הגולמי הוא ארוך יותר מזה של melanogaster ד בגיל 25 ° C17כ 20 h. אנחנו מחושבים ΔODs של האזורים מסביב campaniform sensillum, עצה וריד האורך, crossvein אחורי. כאן, אנו מראים את לקיחת ΔODs אצל מבוגרים 7 ימים לאחר וגיחתו (טבלה 4). על ידי השוואת הנתונים של שלבים רבים, מצאנו כי שלב P12(i) הוא התזמון של היווצרות פיגמנטציה, פיגמנטציה הזאת הושלמה על ידי 24 שעות לאחר וגיחתו (איור 5, מן המדידות המקורי בשימוש Fukutomi et al. 19).
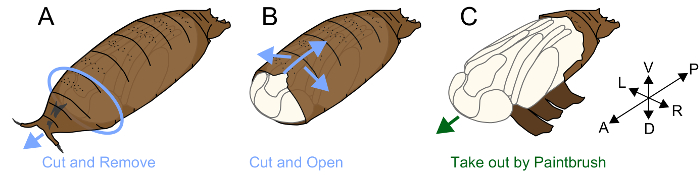
איור 1. איור של הסרת puparium. (א) במקום צדדי הגחון גולם למעלה על נייר-דבק דו צדדי. הסר את החלק הקדמי של puparium. (ב) לשבור את puparium עם מלקחיים מן הצד הבטני. (ג) לאחר שבירת את puparium, להוציא הגולם שימוש במכחול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

באיור 2. ההגדרה של אזור למדידת פיגמנטציה. (א) מנקודה A עבור נקודה המשויכת של sensillum campaniform. (B) B נקודה על נקודה המשויכת טיפ וריד האורך. (ג) הנקודה C עבור נקודה המשויכת crossvein האחורי. (ד) נקודה D עבור אזור הבקרה. סולם מציינות 250 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 3. דוגמאות לשלבים הגולמי מוגדרים. (א) גולם של שלב P1 מכוסה puparium. (ב) גולם של שלב P5 - 6. (ג) גולם של שלב P10. Puparia יוסרו לפני התצפית (ב') ו- (ג). סולם מציינות 500 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
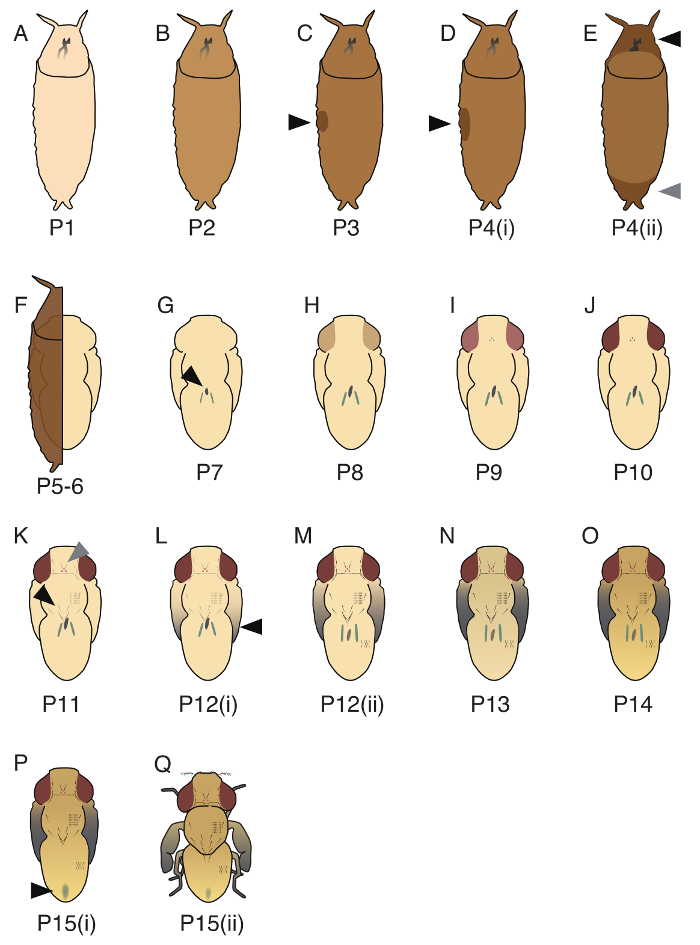
באיור 4. איורים של 17 שלבים הגולמי שתוארה guttifera ד. (א) P1, puparium הוא לבן. (ב) P2, צבע puparium הוא חום בהיר. (ג) P3, בועה הוא ציין הצד הלטראלי (חץ שחור). (ד) P4(i), הבועה הוא גדול יותר מאשר ב- P3 (חץ שחור), הגולם הוא קליל ב- PBS. (ה) P4(ii), פער הוא ציין החלק הקדמי (חץ שחור), החלק האחורי (ראש חץ אפור). (ו) P5 - 6, Malpighian בקוריאנית להעביר (קשה לראות אם מכוסה על ידי puparium). הצורה הגולמי נוצר על ידי האפיתל הגולמי ואת לציפורן הגולמי. (ז) P7, יכול להיות שנצפו הגוף צהוב בצד הגבי (חץ שחור). (ח) P8, העיניים הן צהוב. (I) P9, העיניים הן אמבר. (י) P10, העיניים אדומות (K) P11 סומרות מסלולית ו- ocellar (ראש חץ אפור), vibrissae, macrochaetae בית החזה (חץ שחור), סומרות tarsal הינם שחור גלויה. (יב) P12(i), קצות הכנפיים הן אפורות. (ז) P12(ii), כל חלקי הכנפיים הם אפור (חץ שחור). (N) P13, הכנפיים הם שחור לגמרי. (טו) P14, הראש והרגליים לחלוטין החשוך. (טז) P15(i), meconium יכול להיות שנצפו על הבטן הגבי (חץ שחור). (יז) P15(ii), הזבוב הוא eclosing. פירוט השלבים האלה מתוארים Fukutomi et al. 19 אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 5. פיתוח של פיגמנטציה סביב sensillum companiform על כנף. חוגים מציינים ΔODs בודדים, אופקיות מציינים ממוצעים. P10: n = 10, P11: n = 10, 12(i): n = 10, P15(i): n = 11, 3 ח': n = 8, 24 ח': n = 7, 7 ימים: n = 10. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| רכיב | |
| סוכר לבן רך | 51.6 g |
| קמח תירס | 172.4 g |
| גריסים תירס - C | 86.4 גרם |
| שמרים בירה יבשה | 106 g |
| אבקת אגר | 35.28 g |
| ddH2O | 4000 mL |
| מרתיחים 30 דקות ומניחים להצטנן עד 70 מעלות צלזיוס. | |
| להוסיף 4 g של בוטיל p-hydroxybenzoate מומס 40 מ"ל אתנול. | |
| מערבבים היטב ויוצקים 9 מ ל כל אחד לתוך צלוחיות פלסטיק (בקוטר 25 מ מ x גובה 96 מ מ). | |
טבלה 1. ההרכב של מזון קמח תירס/סוכר/שמרים/אגר רגיל.
| רכיב | כמות |
| NaCl | 80 גר' |
| אשלגן כלורי | דור 2 |
| נה2HPO4·12H2O | ג'י 29 |
| 2פו ח'4 | דור 2 |
| ddH2O | עד 10 L |
| ערכת pH 7.4 |
בטבלה 2. ההרכב של PBS (1 X).
| הבמה | זאת אומרת של משך (h) | ש | n |
| P1 - 2 | 1.7 | 0.65 | 16 |
| P3 | 2.1 | 0.65 | 16 |
| P4(i) | 2.1 | 1.69 | 19 |
| P4(ii) | 0.3 | 0.28 | 29 |
| P5 - 6 | 5.0 | 3.07 | 30 |
| P7 | 31.9 | 7.22 | 46 |
| P8 | 9.6 | סיכון 2.81 | 57 |
| P9 | 10.9 | 2.66 | 55 |
| P10 | 11.7 | 2.96 | 39 |
| P11 | 4.4 | סיכון 2.81 | 44 |
| P12(i) | 1.1 | 0.76 | 44 |
| P12(ii) | 2.0 | 0.70 | 43 |
| P13 | 2.2 | 0.68 | 10 |
| P14 - 15(i) | 28.6 | 2.75 | 10 |
| P15(ii) | 1.4 | 0.87 | 10 |
| סה | 121.7 |
בטבלה 3. נמדד המשכים של שלבים הגולמי של guttifera ד.
| OD | ΔOD | |||||||
| Campaniform sensilum | וריד האורך עצה | Crossvein האחורי | שליטה | Campaniform sensilum | וריד האורך עצה | Crossvein האחורי | ||
| הפרט | (נקודה A) | (הנקודה B) | (נקודה C) | (נקודה D) | (נקודה A - נקודה D) | (הנקודה B - נקודה D) | (נקודה C - נקודה D) | |
| 1 | 0.549 | 0.484 | 0.515 | 0.256 | 0.293 | 0.228 | 0.259 | |
| 2 | 0.529 | 0.489 | 0.516 | 0.254 | 0.275 | 0.235 | 0.262 | |
| 3 | 0.546 | 0.48 | 0.533 | 0.255 | 0.291 | 0.225 | 0.278 | |
| 4 | 0.583 | 0.496 | 0.566 | 0.255 | 0.328 | 0.241 | 0.311 | |
| 5 | 0.523 | 0.479 | 0.528 | 0.235 | 0.288 | 0.244 | 0.293 | |
| 6 | 0.572 | 0.509 | 0.546 | 0.265 | 0.307 | 0.244 | 0.281 | |
| 7 | 0.568 | 0.511 | 0.56 | 0.256 | 0.312 | 0.255 | 0.304 | |
| 8 | 0.56 | 0.507 | 0.562 | 0.27 | 0.29 | 0.237 | 0.292 | |
| 9 | 0.551 | 0.485 | 0.569 | 0.259 | 0.292 | 0.226 | 0.31 |
בטבלה 4. נמדד מקרי מוות ממנת יתר של ΔODs של guttifera ד מבוגרים 7 ימים לאחר וגיחתו.
Discussion
נתאר כאן את הפרוטוקולים עבור ההגדרה של שלבים הגולמי, הסרת את puparium להשגחה מפורט, מדידת המשכים של שלבים הגולמי, מידת האינטנסיביות של כתמים שחורים על כנף ב guttifera ד. פרוטוקולים אלה יכול להיות מיושם עבור רבים דרוזופילה , הקשורות לטוס זן במיוחד עם כנף פיגמנטציה.
התבוננות מעמיקה ותיאור מפורט יותר אירועים התפתחותיים תאפשר בהמשך חלוקת משנה של שלבים. במקרים רבים, אירוע התפתחותיות הדורשות ניתוח או חלוקתה של גולם אינה מתאימה להגדרת הבמה, כי אחד צריך להרוג גולם עבור האחסון הזמני, ושימוש נוסף של אותו אדם היא קשה. לשימוש של זן דרוזופילה חדש, אחד צריך להעסיק שקירב מחוץ puparium התפתחותי אירועים בשלב הראשון. בהתאם למטרת המחקר, אחד יכול אז עוד יותר לסעף שלבים בהתבסס על organogenesis מסוים או אירועים התפתחותיים אחרים.
לשם השוואה interspecific שלבים מרובים, קושי פוטנציאלי הוא היפוך סדר אירועים התפתחותיים בין מינים (heterochrony27). לדוגמה, ב- ד melanogaster, צנורית Malpighian הופך ירוק, ואז הגוף הצהוב הופך גלוי, ואילו צו זה יכול. להיות הפוך כמה הגלמים של guttifera ד19. במקרה כזה, קשה השוואה קפדנית בין שלבים הומולוגיים. בהתאם התופעה של עניין, אחד ייתכן שתצטרך להגדיר מחדש או משנית שלב מסוים מבוסס על ארוע התפתחותי. לדוגמה, אנו יכולים בערך בחר הגלמים של P5 - 6, לעשות השוואה interspecific של ג'ין ביטויים באגפים הגולמי באמצעות אגף מורפולוגיה כמחוון של תזמון התפתחותית14.
בדרך כלל, זה לוקח 10-30 דקות כדי להסיר את puparium. אם אדם רוצה להתבונן במה קצר, גלמי צריך להיות מוכן לקחת בחשבון הזמן שעובר במהלך ההסרה puparium. לדוגמה, אם אדם רוצה לצפות P12(i) של guttifera ד, אשר רק משך 1.1 h, הכנת הגלמים ב P11 ייתן תוצאה טובה.
ב פרוטוקול שלנו, נייר טישו בטעימת משמש עבור הרקע של תמונות הגולמי. בהתאם שלב התצפית ומבנים אחד רוצה להראות דמות, אחד באפשרותך להשתמש נייר טישו לבן או שחור. עבור P3 למעבר P4(ii), העמדה של בועת גולם חשובה להבחנה בין שלבים, נייר טישו השחור מועיל לבחון את המיקום של הבועה. עבור השלבים לאחר P5, נייר טישו לבן עדיף כי זה מועיל לבחון את גוף צהוב, צבע עיניים, סומרות וצבע הגוף.
Bainbridge Bownes17 מוערך משך שלבים הגולמי מן התדר שלהם של המראה. הטבלה הזמני שלהם היא הנפוצה ביותר עבור melanogaster ד18. עבור השיטה שלהם, הם מוכנים ארבע בקבוקים מזון המכיל חמש נשים בוגרות, חמישה גברים מבוגרים שמר אותם בחושך ו ואז הגלמים באקראי הוצאו מן בקבוק אחד כל 11, 12, 13 ו- 14 ימים לאחר תחילתה של הנחת הביצה. הם נספרים מספר הגלמים בשלבים מסוימים, לחשב את הממוצעים. האורך של כל שלב הגולמי יכול להיות מוערך בהתבסס על הנתונים של משך הזמן הכולל של התקופה הגולמי ונתונים אלה תדר. בעיה אחת עם שיטה זו היא כי זה לא ניתן להשתמש כדי להעריך את משך הזמן המדויק של שלבים הגולמי אם התזמון התפתחותית נוטה להיות מסונכרנים בין הגלמים.
למעשה, ניסינו Bainbridge שיטת של Bownes ב guttifera ד, השגנו נתונים משוחד בגלל סינכרון בין הגלמים. אנחנו לא יוכל לזהות את הגורם לתופעה, אך כמה אפשרויות 1) גלמי נשמר שעון ביולוגי מהשלב הצעיר שלהם ו/או 2) הם הגיבו החשיפה לאור שהתרחשה תצפית. לכן, החלטנו למדוד את משך שלב בפועל על ידי תצפית ישירה. פעולה זו ממזערת הטיה הנגרמת על ידי שעון ביולוגי.
השיטה המתוארת כאן היא שיטה לכמת הצטברות נוספת של מלנין בעור כתמים בהשוואה שלהם שליטה והסביבה (ΔOD), על-ידי חיסור OD של אזור הבקרה מ OD של האזור ספוט. שיטה זו בהשראת שיטה לכימות תוכן ה-DNA גרעיני על-ידי Feulgen מכתים ותמונה ניתוח (28,densitometry29). כאחת הבעיות האפשריות עבור יישום שיטה זו כנף פיגמנטציה, ΔOD יכול להיות ערך שלילי, במיוחד כאשר גולם צעיר מאוד ויש לו כמעט שום פיגמנטציה. בשלבים יותר, יתכנו קצת פיגמנטציה באזור הבקרה. השימוש OD פשוטה של האזור ספוט עצמה הולמת במקום ΔOD בהתאם למטרת המחקר. במקרה של guttifera ד, השימוש OD פשוטה במקום ΔOD לא שינתה את הנטייה של נתוני או את המסקנות של המחקר.
Disclosures
המחברים יש אין ניגוד אינטרסים.
Acknowledgements
אנו מודים קרול B. שון וורנר תומאס על מתן מניות לעוף, Naoyuki הפתיל עבור ציוד, ביונג ג'ין סוק על עזרתו מצלם אגאטה Kiyokazu על הייעוץ, נקאג'ימה אליזבת לצורך עריכה באנגלית. עבודה זו נתמכה על ידי KAKENHI 17K 19427 ו טקדה למדע.
Materials
| Name | Company | Catalog Number | Comments |
| Drosophila guttifera | The Drosophila Species Stock Center at the U.C. San Diego | 15130-1971.10 | Drosophila guttifera, a fruit fly species used in this article |
| Plastic vial | Hightech | MKC-30 | Plastic vial, for fly stock maintenance |
| Buzz plugs vial and bottle closures for glass vials | Fisher Scientific | AS-271 | Cellulose plug, for fly stock maintenance |
| White soft sugar | Mitsui Sugar | J-500g | White soft sugar, for standard cornmeal/sugar/yeast/agar food |
| Corn flour | Nippon Flour Mills | F | Corn flour, for standard cornmeal/sugar/yeast/agar food |
| Corn grits - C | Nippon Flour Mills | GC | Corn grits - C, for standard cornmeal/sugar/yeast/agar food |
| Agar powder | Matsuki Kanten Sangyo | No.602 | Agar powder, for standard cornmeal/sugar/yeast/agar food |
| Dry beer yeast | Asahi Food & Healthcare | Y2A | Dry beer yeast, for standard cornmeal/sugar/yeast/agar food |
| Butyl p-hydroxybenzoate | Nacalai Tesque | 06327-02 | Butyl p-hydroxybenzoate, for standard cornmeal/sugar/yeast/agar food |
| Ethanol | Wako | 057-00456 | Ethanol, for standard cornmeal/sugar/yeast/agar food |
| Flat bottom microtube | Ina Optica | CF-0150 | 1.5 mL microtube, for collecting pupae |
| CAPSULEFUGE | Tomy | PMC-060 | Mini microcentrifuge, for collecting pupae |
| Sterilized Schale NB | Sansei Medical | 01-013 | Plastic Petri dish (diameter 90 mm x height 15 mm) |
| Serum tube rack | Iwaki | 9796-050 | Used as a moist chamber, for observation of pupa |
| Corning Falcon Easy-Grip tissue culture dish | Corning | 353001 | Plastic Petri dish (diameter 35 mm x height 10 mm) |
| Falcon standard tissue culture dish | Corning | 353002 | Plastic Petri dish (diameter 60 mm x height 15 mm) |
| Push-pin | Kokuyo | 51233709 | Push-pin, for making pinholes on the microtube lid |
| Stereomicroscope | Olympus | SZX16 | Stereomicroscope, for morphological observation |
| Digital camera | Olympus | DSE-330-A | Digital camera, for imaging |
| NICETACK double sided tape | Nichiban | NW-15SF | Double sided tape, for removing puparium |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | Forceps, for removing puparium |
| Van Gogh VISUAL Paint brush | Talens Japan | GWVR-#5/0 | Paint brush, for removing puparium |
| Greiner CELLSTAR 12 well cell culture plate | Merck | 665-180 | 12-well cell culture plate, for measuring durations of pupal periods |
| NaCl | Wako | 191-01665 | NaCl, for PBS |
| KCl | Nacalai Tesque | 285-14 | KCl, for PBS |
| Na2HPO4·12H2O | Wako | 196-02835 | Na2HPO4·12H2O, for PBS |
| KH2PO4 | Nacalai Tesque | 28721-55 | KH2PO4, for PBS |
| Stepped Neutral Density (ND) Filter 0.04 - 3.0 | Edmund Optics | 64-384 | Stepped density filter, for calibration of pigmentation measurement |
| ImageJ software | NIH | 1.8.0-101 | ImageJ software, for measurement of intensity of black spots on a wing (https://imagej.nih.gov) |
| FINE FROST glass slide | Matsunami Glass Ind | FF-001 | Glass slide, for measurement of intensity of black spots on a wing |
| Square microscope cover glass 18 x 18 | Matsunami Glass Ind | C018181 | Cover slip, for measurement of intensity of black spots on a wing |
References
- Carson, H. L., Hardy, D. E., Spieth, H. T., Stone, W. S. The evolutionary biology of the Hawaiian Drosophilidae. Essays in evolution and genetics in honor of Theodosius Dobzhansky. Hecht, M. K., Steere, W. C. , Springer (Meredith Corporation). New York. 437-543 (1970).
- Markow, T. A., O'Grady, P. M. Drosophila: a guide to species identification and use. , Academic Press. New York. (2006).
- Patterson, J. T. The Drosophilidae of the southwest. 4313, University of Texas Publication. 7-216 (1943).
- Setoguchi, S., Takamori, H., Aotsuka, T., Sese, J., Ishikawa, Y., Matsuo, T. Sexual dimorphism and courtship behavior in Drosophila prolongata. J Ethol. 32 (2), 91-102 (2014).
- Werner, T., Jaenike, J. Drosophilids of the Midwest and Northeast. , River Campus Libraries, University of Rochester. Rochester. (2017).
- Arnoult, L., et al. Emergence and diversification of fly pigmentation through evolution of a gene regulatory module. Science. 339 (6126), 1423-1426 (2013).
- Camino, E. M., Butts, J. C., Ordway, A., Vellky, J. E., Rebeiz, M., Williams, T. M. The evolutionary origination and diversification of a dimorphic gene regulatory network through parallel innovations in cis and trans. PLoS Genet. 11 (4), e1005136(2015).
- Gompel, N., Prud'homme, B., Wittkopp, P. J., Kassner, V. A., Carroll, S. B. Chance caught on the wing: cis-regulatory evolution and the origin of pigment patterns in Drosophila. Nature. 433 (7025), 481-487 (2005).
- Glassford, W. J., et al. Co-option of an ancestral Hox-regulated network underlies a recently evolved morphological novelty. Dev. Cell. 34 (5), 520-531 (2015).
- Koshikawa, S. Enhancer modularity and the evolution of new traits. Fly. 9 (4), 155-159 (2015).
- Koshikawa, S., et al. Gain of cis-regulatory activities underlies novel domains of wingless gene expression in Drosophila. Proc Natl Acad Sci U S A. 112 (24), 7524-7529 (2015).
- McGregor, A. P., et al. Morphological evolution through multiple cis-regulatory mutations at a single gene. Nature. 448 (7153), 587-590 (2007).
- Tanaka, K., Barmina, O., Kopp, A. Distinct developmental mechanisms underlie the evolutionary diversification of Drosophila sex combs. Proc Natl Acad Sci U S A. 106 (12), 4764-4769 (2009).
- Werner, T., Koshikawa, S., Williams, T. M., Carroll, S. B. Generation of a novel wing colour pattern by the Wingless morphogen. Nature. 464 (7292), 1143-1148 (2010).
- Wittkopp, P. J., et al. Intraspecific polymorphism to interspecific divergence: genetics of pigmentation in Drosophila. Science. 326 (5952), 540-544 (2009).
- Lawrence, P. A., Morata, G. Compartments in the wing of Drosophila: a study of the engrailed gene. Dev Biol. 50 (2), 321-337 (1976).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. J. Embryol. Exp. Morphol. 66, 57-80 (1981).
- Ashburner, M., Golic, K. G., Hawley, R. S. Drosophila: A Laboratory Handbook. , 2nd ed, Cold Spring Harbor Laboratory Press. New York. (2005).
- Fukutomi, Y., Matsumoto, K., Agata, K., Funayama, N., Koshikawa, S. Pupal development and pigmentation process of a polka-dotted fruit fly, Drosophila guttifera (Insecta, Diptera). Dev Genes Evol. 227 (3), 171-180 (2017).
- Koshikawa, S., Fukutomi, Y., Matsumoto, K. Drosophila guttifera as a model system for unraveling color pattern formation. Diversity and evolution of butterfly wing patterns: an integrative approach. Sekimura, T., Nijhout, H. F. , Springer. New York. in press (2017).
- True, J. R., Edwards, K. A., Yamamoto, D., Carroll, S. B. Drosophila wing melanin patterns form by vein-dependent elaboration of enzymatic prepatterns. Curr Biol. 9 (23), 1382-1391 (1999).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Izumitani, H. F., Kusaka, Y., Koshikawa, S., Toda, M. J., Katoh, T. Phylogeography of the Subgenus Drosophila (Diptera: Drosophilidae): evolutionary history of faunal divergence between the Old and the New Worlds. PLoS ONE. 11 (7), e0160051(2016).
- Resh, V. H., Cardé, R. T. Encyclopedia of Insects. , 2nd ed, Academic Press. Burlington. (2009).
- DeLean, A., Munson, P. J., Rodbard, D. Simultaneous analysis of families of sigmoidal curves: application to bioassay, radioligand assay, and physiological dose-response curves. Am J Physiol. 235 (2), E97-E102 (1978).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological changes. J Morphol. 59 (2), 351-399 (1936).
- McKinney, M. L., McNamara, K. Heterochrony: the evolution of ontogeny. , Plenum Press. New York. (1991).
- Hardie, D. C., Gregory, T. R., Hebert, P. D. From pixels to picograms: a beginners' guide to genome quantification by Feulgen image analysis densitometry. J Histochem Cytochem. 50 (6), 735-749 (2002).
- Koshikawa, S., Miyazaki, S., Cornette, R., Matsumoto, T., Miura, T. Genome size of termites (Insecta, Dictyoptera, Isoptera) and wood roaches (Insecta, Dictyoptera, Cryptocercidae). Naturwissenschaften. 95 (9), 859-867 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved