Method Article
Métodos para pupa períodos de prueba y medición de pigmentación de ala de Drosophila guttifera
En este artículo
Resumen
Se describen los protocolos de presentar períodos de pupas y medición de la pigmentación de ala de Drosophila guttifera . Puesta en escena y cuantificación de pigmentación proporcionan una base sólida para el estudio de los mecanismos del desarrollo de rasgos adultos y permiten la comparación interespecífica de desarrollo rasgo.
Resumen
Diversificada especies de Drosophila (mosca de la fruta) proporcionan oportunidades para el estudio de mecanismos de desarrollo y los cambios genéticos responsables de cambios evolutivos. En particular, la etapa adulta es una rica fuente de caracteres morfológicos para la comparación interespecífica, incluyendo ala pigmentación comparación. Para estudiar las diferencias del desarrollo entre especies, observación detallada y adecuada puesta en escena se requiere para la comparación exacta. Aquí describimos protocolos de puesta en escena de períodos pupas y cuantificación de la pigmentación de ala en una lunares mosca de la fruta Drosophila guttifera. En primer lugar, describimos el método de observación morfológica detallada y definición de etapas de pupal basadas en morfologías. Este método incluye una técnica para quitar del pupario, que es la carcaza externa quitinosa de la pupa, para permitir la observación detallada de la morfología pupal. En segundo lugar, describimos el método para medir la duración de etapas pupas definidas. Finalmente, describimos el método para la cuantificación de la pigmentación ala basada en análisis de imágenes mediante imágenes digitales y el software ImageJ. Con estos métodos, podemos establecer una base sólida para comparar procesos de desarrollo de rasgos adultos durante etapas de pupal.
Introducción
Algunos de los rasgos morfológicos de Drosophila se diversifican entre especies1,2,3,4,5. Podemos abordar la cuestión de la diversidad morfológica cómo surge mediante la comparación de los mecanismos de generación de estas morfologías. Ejemplos de tales morfologías son tricomas larvarias, peines sexuales para adultos, aparato genital externo, pigmentación abdominal y ala pigmentación6,7,8,9, 10 , 11 , 12 , 13 , 14 , 15. para estudiar las diferencias morfológicas entre los adultos, observación y análisis de las etapas de pupas son importantes, porque el destino de rasgos adultos se determina en las últimas etapas larvales y morfogénesis posterior procede durante el período de pupa.
En estudios de Biología del desarrollo de Drosophila melanogaster, 'horas APF' (horas después de la formación pupal) es el método común para indicar una etapa pupal16. Este sistema emplea tiempo absoluto después de la formación pupal y es muy conveniente para los experimentos de la rutina. Sin embargo, velocidad de desarrollo puede diferir entre pupas, puede verse afectada por pequeñas diferencias genéticas, epigenéticas o microambiental, y por lo tanto, con el mismo tiempo absoluto después de la formación pupal no garantiza que las pupas son al mismo etapa de desarrollo. En muchos casos, son preferibles para comparar a varios individuos etapas definidas por características morfológicas. Sobre todo, una comparación entre especies requiere precisa puesta en escena y la comparación entre correspondientes (homólogos).
Bainbridge y Bownes17 reconoce 20 etapas de pupal (P1 a P15(ii)) basado en las características morfológicas de pupas de Drosophila melanogaster . Esta puesta en escena es el sistema más ampliamente utilizado de la puesta en escena del desarrollo morfológico18. En un estudio anterior, se realizó estadificación pupal de Drosophila guttifera para establecer una base para ala pigmentación estudios19. D. guttifera tiene un patrón de lunares negros en sus alas y es una de las especies modelo de ala pigmentación formación20. Aunque nos referimos a los criterios morfológicos descritos en el Bainbridge y 'Bownes investigación17, directamente midiendo duraciones de etapa observaciones serie19, en lugar de utilizar Bainbridge y 'Bownes estimación de las duraciones de la fase de de frecuencia observada. Aquí describimos el método de puesta en escena pupal y medición de duración de etapas de pupal de Drosophila en Fukutomi et al19.
Para estudiar el mecanismo del desarrollo de la pigmentación de ala, que necesitamos saber cuando en estadios de pupas o adulto se produce la pigmentación. Fukutomi et al. 19 había cuantificado densidades ópticas (ODs) de la pigmentación durante etapas de pupas y adulto por análisis de imágenes de imágenes de ala. La pigmentación de las alas de Drosophila se piensa para ser causado por la acumulación de melanina negra21. Para la cuantificación de Sao, se utilizaron imágenes de escala de grises y ImageJ software (https://imagej.nih.gov/ij/)22 . Para reconocer y cuantificar la pigmentación específica de lugar (ΔOD), restamos el OD fuera de un lugar de la do dentro de un lugar. Para hacer este método reproducible y objetiva, se deben determinar los lugares de medición de OD con venas de las alas como puntos de referencia. En este artículo, describimos en detalle este método de cuantificación de la pigmentación de ala de Drosophila guttifera.
Protocolo
1. acción de volar
- Uso de Drosophila guttifera para todos de los siguientes protocolos.
- Utilizar frascos de plástico (diámetro 25 mm x alto 96 mm) y celulosa (diámetro 23 mm x altura 26 mm) para el mantenimiento de stock. Utilizar un alimento de harina de maíz/azúcar/levadura/agar estándar y siga una publicación describió tres otras recetas alternativas para esta especie2.
Nota: D. guttifera (número común 15130-1971.10) es proporcionado por el centro de acción de especies de Drosophila de la Universidad de California, San Diego. Aunque guttifera D. pertenece a la immigrans-tripunctata radiación, que está lejanamente relacionada con D. melanogaster dentro el género23, tiene muchas propiedades biológicas en común con D. melanogaster . Por consiguiente, este protocolo se puede aplicar para muchas especies de Drosophila , aunque algunas especies requieren alimentos específicos o consejos técnicos a mantener2.
2. observación de pupa y la definición de etapas de pupal
Nota: La pupa para la observación se toma de la población de mosca mantenida con un 12:12 h luz/oscuridad ciclo a 25 ° C. Bainbridge y Bownes17 describe un riesgo bajo de pupas de D. melanogaster en movimiento desde el lugar original de pupación en un pedazo de papel húmedo (supervivencia del 97% de pupas movidos 946). Pupas de D. guttifera pueden ser preparados por esencialmente el mismo método.
- Lugar de adultos sanos de Drosophila en alimentos frescos (harina/azúcar/levadura/agar alimentos) en un frasco de plástico (diámetro 25 mm x alto 96 mm) y poner huevos. Espere 7 días para obtener fines 3 estadios.
- Coloque 1 mL de harina/azúcar/levadura/agar alimentos en cada microtubo de 1.5 mL. Hacer 3 agujeros de alfiler con separación de 2 mm en los párpados de microtubos penetrando con un alfiler para permitir la respiración.
- Centrifugar microtubos con comida para los 7 s en una microcentrífuga mini (860 x g).
- Invertir y aprovechar los frascos para eliminar a todos los adultos de la cubeta.
- Verter 5-10 mL de ddH2O (o agua de ósmosis) en el frasco.
- Vierta las larvas con agua en un plato de Petri de plástico (diámetro de 90 mm x altura 15 mm). Identificar estadios 3 finales por su tamaño de cuerpo grande (3-4 mm de longitud).
- Mueva suavemente finales 3er instar larvas con pinzas en los microtubos con alimentos (10 larvas / microtubos). Incúbelos durante la noche a 25 ° C.
- Mover la pupa recién formada sobre un trozo de papel de seda que ha sido humedecido por ddH2O y colocar en una placa de Petri de plástico (diámetro 35 mm x alto 10 mm).
- Coloque la placa de Petri en una cámara húmeda (contiene 10 mL de ddH2O en la parte inferior) y espere hasta que las pupas se convierten a la etapa deseada.
- Pupas en un pedazo húmedo de papel de seda se mueven en una placa de Petri de plástico (diámetro 60 mm x altura 15 mm).
Nota: La definición de etapas en su mayoría es posible basada en las etapas de D. melanogaster17. Por lo general, el período pupal de Drosophila puede categorizarse en P1 - P15(ii), aunque algunas modificaciones de la definición de etapa serían necesarios dependiendo de la especie utilizada. Si es posible, eliminar el pupario permite la observación precisa y detallada. Ver detalles a continuación (paso 3). - Observar pupas bajo un microscopio estéreo. Tomar fotografías con una cámara digital acoplada al microscopio estéreo.
3. eliminación de la mosca
Nota: Pupas de Drosophila están cubiertos por una estructura llamada pupario. Un insecto de Muscomorpha (moscas) no arrojar su cutícula larval en pupación; en cambio, se endurece la cutícula después apolysis y utiliza como una cubierta protectora de la pupa, la mosca24. Una pupa que residen dentro de un pupario tiene una verdadera cutícula pupal, que es muy suave y frágil. Antes apolysis ocurre alrededor P4(ii), epitelios y pupario están conectados juntos, y por lo tanto la eliminación del pupario sin daño es muy difícil. Después de P5, quitando el pupario es laborioso, pero útil para la observación morfológica y definición de etapas de pupal. El proceso se lleva a cabo como sigue.
- Pegue un pedazo de cinta de doble cara en un pedazo de toalla de papel.
- Coloque una pupa en el lado ventral de la cinta de doble cara arriba (figura 1A).
- Localizar el espacio entre la parte anterior del pupario y la pupa interna. Agarre y quitar la mosca alrededor de este vacío mediante fórceps y exponer el lado anterior de la cabeza de la pupa.
- Inserte la punta de unas pinzas moviendo paralelo al eje antero-posterior. Levante la punta de las pinzas para romper localmente del pupario. Repita esta acción hasta que la rotura alcanza la parte posterior del pupario. Asegurar que una brecha se forma también entre el pupario y piernas pupas y romper el lado ventral del pupario y minimizar el daño a la pupa interno (figura 1B).
- Después de romper el pupario tanto como sea posible, sacar la pupa con un pincel fino (#5/0) (figura 1).
- Coloque la pupa en un pedazo de papel de seda que ha sido humedecido con ddH2O y colocar en una placa de Petri de plástico (diámetro 60 mm x altura 15 mm). Tomar fotografías tan pronto como sea posible porque la pupa expuesta es vulnerable y fácilmente llega a ser seca.
Nota: Pupas sin un pupario no son adecuados para medir la duración de los períodos de pupas (paso 4), debido a estrés (por ejemplo, desecación) y daño físico podrían interferir con el normal desarrollo.
4. medir las duraciones de las etapas de pupal
- Preparar pupas para medir duración de etapas de pupal tal como se describe en el paso 2. Recoger el pupas de 1-2, 2-3 y 3-4 días después de la formación pupal (20 pupas). Dar los números de identificación individual (1-60) a pupas para identificación. Continuar recogiendo recién formado pupas durante los pasos siguientes, para obtener 20 pupas jóvenes más. Dar los números de identificación individual (61-80) a las pupas recién formadas. Coloque una pupa en un pedazo de ddH2humedecido O pañuelo de papel en un pozo (3,9 cm2) de una placa de cultivo celular 12-bien (pupa/1 pozo, placa de pupas 12). Llene el espacio entre bien de placas con ddH2O para mantener la humedad, poner las tapas en y colocar las placas en 25 ° C, condiciones de iluminación constante (24:0 h luz/oscuridad).
Nota: Pupas sin un pupario no son adecuados para medir la duración de períodos de pupas. No retire el pupario. - Observar las características morfológicas incluyendo color de la carrocería, las cerdas, los túbulos de Malpighi y cuerpo amarillo de pupas de todos, una vez cada 30 minutos y registro observan etapas (P1 - P15(ii), basado en referencias17,19) en una hoja de recuento.
- Continuar la grabación en cuatro días consecutivos (96 h) por un cambio rotativo de tres (o más) personas.
- Contar números de registros de cada etapa particular y les promedio (promedio cuenta de observaciones / pupas). Luego multiplicarlas por 0.5 (h), dando por resultado la longitud estimada de etapas (h).
5. medición de intensidad de manchas negras sobre un ala
Nota: La intensidad de manchas negras sobre un ala pupa o adulto se puede cuantificar midiendo la densidad óptica (OD). Un filtro de cristal con ODs conocidos (densidad escalonada del filtro) se utiliza para calibración25, por lo que se puede calcular el OD de un área particular de una imagen digital de un ala. Se miden la do en un lugar y el OD fuera de la mancha, y este último se restará del primero para obtener la intensidad de la mancha (ΔOD). Aquí, describimos el método de disección, medición y cálculo de ΔOD. Este procedimiento se puede hacer después del paso 2, independiente del paso 3 y paso 4. Una vez que uno ha realizado el paso 2 y comprende todas las etapas pupas, directamente puede iniciar o repetir paso 5.
- Preparación de imagen
- Preparar una nueva pupa de una etapa focal como se describe en el paso 2. Quite la parte anterior de un pupario con fórceps. Sacar la pupa con unas pinzas y colocar en tampón fosfato salino (PBS, tabla 2) en una placa de Petri de plástico (diámetro 35 mm x alto 10 mm).
- Cortar la articulación basal de un ala (articulación basal es la parte proximal estrecha del ala). Como el ala está plegado, colóquelo en un plato de Petri de plástico (diámetro 35 mm x alto 10 mm) con ddH2O para extenderlo por la presión osmótica (la mariposa se desarrolla por sí mismo).
- Recoger nuevamente eclosed adultos una vez cada 10 minutos de un frasco de stock. Anestesiar una mosca con CO2 usando un CO2 anestesia, anestesia para confirmar inmovilidad y cortar la articulación basal de un ala.
- Lugar 10 μl de PBS en un portaobjetos de vidrio, colocar allí el ala y cubrir con un cubreobjetos (18 x 18 mm).
- Encender la luz del microscopio estéreo. Programar la luz para estar al máximo nivel. Establecer el objetivo 11.5 X. Ajuste el diafragma al ser el estado más abierto. Encender la cámara. Ajustar la cámara para ser (ISO: 100, modo SHQ 3136 x 2352 píxeles, velocidad de obturación: 1/20 s). Se centran en la muestra moviendo la perilla de enfoque del microscopio.
- Presione el botón disparador de la unidad de control remoto para tomar una imagen. Tomar 3 imágenes por ala, cada uno de los cuales debe estar centrado en una sensillum de campaniformes, vena punto o posterior vena longitudinal, colocación de la parte distal del ala en el lado izquierdo y la parte anterior del ala en la parte superior.
- Calibración
- Tomar imágenes de 9 partes de un filtro de densidad escalonada con la misma configuración de cámara para obtener la imagen de ala.
- Iniciar el ImageJ software (https://imagej.nih.gov/ij/)22.
- Haga clic en archivo de | Abierto | y seleccione una de las imágenes del filtro densidad escalonada.
- Haga clic en imagen | Tipo | 8 bits | para convertir la imagen a una imagen de 8 bits.
- Haga clic en Editar | Selección | Especificar | y columna Oval y centrado . Escribir 100 (píxeles) en la columna de anchura , 100 (píxeles) en la columna de altura , de 1568 en columna X coordinar y 1176 en columna Y coordinar . Haga clic en Aceptar.
- Haga clic en analizar | Medida |. El "valor medio de gris" de las áreas se mide.
- 5.2.3 repetición. a 5.2.6. para los 8 restantes imágenes.
- Haga clic en analizar | Calibre y seleccione Rodbard25 en función de columna y escriba el siguiente número en la columna derecha en el medio (0.04, 0,336, 0.632, 0.928, 1.224, 1.52, 1.816, 2.112, 2.408; estos números dependen de la densidad de la caminó la densidad del filtro).
- Verificar calibración Global de columna y haga clic en Aceptar.
Nota: Al realizar este procedimiento, "significa valor gris" se convierte en "densidad óptica (OD)" utilizando la función de Rodbard. Después de este paso, se puede calcular densidad óptica de un particular área seleccionada en el software ImageJ.
- Elegir zona de mediciones
Nota: Puntos son típicamente asociados con puntos de referencia, como sensilla campaniformes, consejos de vena longitudinal y crossveins. Estos y otros puntos de interés en un ala se pueden utilizar para elegir la región de las mediciones. Aquí, un ejemplo enD. guttifera(Figura 2) se describe.- Definición del punto A, punto de sensillum campaniformes.
- Abra una imagen en la que un punto de sensillum campaniformes es en el centro de la imagen. Haga clic en imagen | Tipo | 8 bits | para convertir la imagen a una imagen de 8 bits.
- Haga clic en rectángulo en el Área de selección de herramientas y dibuje un rectángulo. Establece el vértice superior izquierdo del rectángulo para que se adjunta a la línea posterior de la tercera vena longitudinal y más distal desde un punto de sensillum campaniformes. Ajustar el lado derecho del rectángulo que se encuentra a la derecha de lo campaniformes sensillum punto.
- Haga clic en Editar | Selección | Añadir a gerente de |. Compruebe la columna Mostrar todo .
- Haga clic en herramienta de ángulo en la Línea de herramientas de selección. Dibujar la primera línea en la línea posterior de la tercera vena longitudinal. Fijar los extremos izquierdos de la línea en el vértice del rectángulo dibujado en el paso 1. Trazar la segunda línea en el lado superior del rectángulo. Presione la tecla "m" para medir el ángulo entre las dos líneas dibujadas en este paso. Haga clic en la ventana de la imagen en la pantalla de la computadora.
- Haga clic en Editar | Selección | Añadir a gerente de |.
- Haga clic en rectángulo en el Área de selección de herramientas y dibuje un rectángulo de aproximadamente 1/9 del tamaño de la ventana de imagen. Haga clic en Editar | Selección | Gire |. Escriba el signo menos grados del ángulo medido en el paso 5.3.1.4. en ángulo de columna y haga clic en OK para rotar el rectángulo dibujado en este paso.
- Mover el rectángulo dibujado en el paso 5.3.1.6. utilizando las teclas de flecha. Establecer el punto final de la línea posterior de la segunda vena longitudinal en el lado izquierdo del rectángulo y el lado inferior del rectángulo conectado a la línea posterior de la tercera vena longitudinal. Confirmar que se dibuja una línea perpendicular desde el punto final de la segunda vena longitudinal a la línea posterior de la tercera vena longitudinal en este procedimiento. Definen a los pies de la línea perpendicular como punto A (figura 2A).
- Grabar la coordenada x y la coordenada y del punto A, indicado debajo de las Herramientas de selección de área al colocar el cursor en el punto A.
- Definición de la letra B, punto de punta longitudinal de la vena
- Abra una imagen en la que un lugar de punta de vena longitudinal es en el centro de la imagen. Haga clic en imagen | Tipo | 8-bit | para convertir la imagen a una imagen de 8 bits.
- Repita el mismo procedimiento descrito en el paso 5.3.1. (Definición del punto A, campaniformes sensillum spot) para encontrar un punto en la imagen.
- Haga clic en Editar | Selección | Añadir a gerente de |.
- Haga clic en rectángulo en el Área de selección de herramientas y dibuje un rectángulo. Encuentra el vértice superior izquierdo del rectángulo en el punto final de la línea posterior de la tercera vena longitudinal.
- Haga clic en Editar | Selección | Añadir a gerente de |.
- Haga clic en herramienta de ángulo en la Línea de herramientas de selección. Dibujar la primera línea para conectar el punto A y el punto final de la línea posterior de la tercera vena longitudinal. Definir esta línea como línea A. dibujar la segunda línea en el lado superior del rectángulo dibujado en el paso 5.3.2.4. La tecla "m" para medir el ángulo entre las dos líneas.
- Haga clic en Editar | Selección | Añadir a gerente de |.
- Haga clic en rectángulo en el Área de selección de herramientas y dibuje un rectángulo de aproximadamente 1/9 del tamaño de la ventana de imagen. Haga clic en Editar | Selección | Gire |. Escriba el signo menos grados del ángulo medido en el paso 5.3.2.6. en ángulo de columna y haga clic en OK para rotar el rectángulo dibujado en este paso. Mover el rectángulo usando las teclas de flecha. Fijar la parte superior del rectángulo que está conectado a la línea A y el punto final de la línea anterior de la cuarta vena longitudinal por lo que es en el lado izquierdo del rectángulo.
- Haga clic en Editar | Selección | Añadir a gerente de |.
- Haga clic en rectángulo en el Área de selección de herramientas y dibuje un rectángulo de aproximadamente 1/9 del tamaño de la ventana de imagen. Haga clic en Editar | Selección | Gire |. Escriba el signo menos grados del ángulo medido en el paso 6 en la columna de ángulo y haga clic en OK para rotar el rectángulo dibujado en este paso. Mover el rectángulo usando las teclas de flecha. Establecer el vértice inferior izquierdo del rectángulo que está en el vértice superior izquierdo del rectángulo dibujado en el paso 5.3.2.8., resultando en la obtención de la línea perpendicular desde el punto de final de la línea anterior de la cuarta vena longitudinal a la línea A. definir el punto de intersección de la perpendicular y la línea posterior de la tercera vena longitudinal como punto B (figura 2B).
- Grabar la coordenada x y la coordenada y del punto B, indicado debajo de las Herramientas de selección de área al colocar el cursor en el punto B.
- Definición del punto C, punto posterior de la vena
- Abra una imagen en la que un punto posterior de la vena está en el centro de la imagen. Haga clic en imagen | Tipo | 8-bit | para convertir la imagen a una imagen de 8 bits.
- Punto C se define como el punto más posterior de la línea anterior de la cuarta vena longitudinal en la zona de intersección de la vena posterior y la cuarta vena longitudinal (figura 2).
- Grabar la coordenada x y la coordenada y del punto C, indicado debajo de las Herramientas de selección de área al colocar el cursor en el punto C.
- Definición de punto D, área de control
- Abra una imagen en la que un punto de sensillum campaniformes es en el centro de la imagen. Haga clic en imagen | Tipo | 8 bits | para convertir la imagen a una imagen de 8 bits.
- Haga clic derecho en Línea herramientas de selección y dibuje una línea conectando el punto final de la línea anterior de la segunda vena longitudinal y el punto final de la línea posterior de la cuarta vena longitudinal. Definir punto D como el punto de intersección de esta línea y la línea posterior de la tercera vena longitudinal (Figura 2D).
- Grabar la coordenada x y la coordenada y del punto D, indicado debajo de las Herramientas de selección de área al colocar el cursor en el punto D.
- Definición del punto A, punto de sensillum campaniformes.
- Mediciones de
- Abra una de las imágenes de puntos del ala (para medición de punto A, abre la imagen con un punto en el centro). Haga clic en imagen | Tipo | 8 bits | para convertir la imagen a una imagen de 8 bits.
- Haga clic en rectángulo en el Área de selección de herramientas y dibujar un rectángulo de aproximadamente 1/9 tamaño de la ventana de imagen.
- Haga clic en Editar | Selección | Especificar |. Compruebe la columna Oval y centrado . Escribe 100 (píxeles) en altura y anchura de columnas, escriba las coordenadas x del punto A (o punto B o C del punto) y D en la columna X coordinar y escribir la y coordenadas del punto A (punto B o punto C) y D en la columna Y coordinar . Haga clic en Aceptar.
- Haga clic en analizar | Medida |. Si ya se ha terminado la calibración descrita en 5.2, Sao figuran en la columna media .
- Calcular ΔODs restando OD del punto D de ODs de puntos A, B y C.
Nota: Punto D está en una parte transparente de la hoja y no incluye pigmentación y por lo tanto es conveniente para un control de fondo.
Resultados
El período pupal de D. guttifera se divide en 17 etapas (P1 - P15(ii); imágenes de representante de tres etapas (P1, P5 - 6, P10) se muestran la figura 3y 17 todas las etapas se ilustran en la figura 4). Aunque Bainbridge y Bownes17 reconocidas 20 etapas en D. melanogaster, algunas de estas etapas pueden no aplicarse a D. guttifera. El orden de los dos eventos del desarrollo, la aparición del cuerpo amarillo (masa de células de la vertiente en el midgut26) y el momento de los túbulos de Malpighi vuelta verde, no son estrictamente controlados en guttifera D., y por lo tanto, no podríamos separar P5 (i ), P5(ii) y P6. También, a diferencia de en D. melanogaster, fue sincronizado el calendario de ennegrecimiento de cerdas torácicas y abdominales, y por lo tanto no podríamos separar P11(i) y P11(ii)19.
Podríamos medir la duración de etapas de pupal de D. guttifera (tabla 3, de Fukutomi et al19). El período pupal es más largo que el de D. melanogaster a 25 ° C1720 h aproximadamente. Se calcularon los ΔODs de los alrededores de una sensillum de campaniformes, punta longitudinal de la vena y vena posterior. Aquí, mostramos el Sao y ΔODs en los adultos 7 días después de la eclosión (tabla 4). Comparando los datos de múltiples etapas, encontramos que la etapa P12(i) es el momento del inicio de la pigmentación, y que la pigmentación se completa con 24 h después de la eclosión (figura 5, de las medidas originales utilizadas en Fukutomi et al. 19).
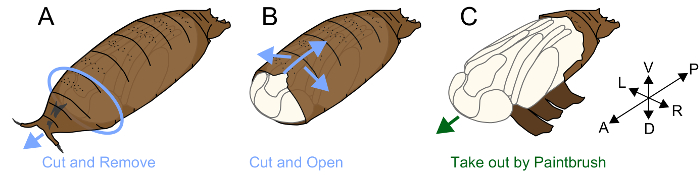
Figura 1. Ilustración de quitar pupario. (A) Coloque un lado ventral pupa hacia arriba sobre un trozo de cinta de doble cara. Quite la parte anterior del pupario. (B) rotura del pupario con pinzas de la parte ventral. (C) después de romper el pupario, sacar la pupa con un pincel. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Definición de área para medir pigmentación. (A) el punto A de un punto asociado a un sensillum campaniformes. (B) el punto B de un lugar asociado con una punta de vena longitudinal. (C) el punto C para un lugar asociado con una vena posterior. (D) punto D para una zona de control. Barras de escala indican 250 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Ejemplos de etapas de pupal definidos. (A) pupa de etapa que P1 cubierto con pupario. (B) pupa de etapa P5 - 6. (C) Pupa de escenario P10. Los valores se eliminan antes de observación en (B) y (C). Barras de escala indican 500 μm. haga clic aquí para ver una versión más grande de esta figura.
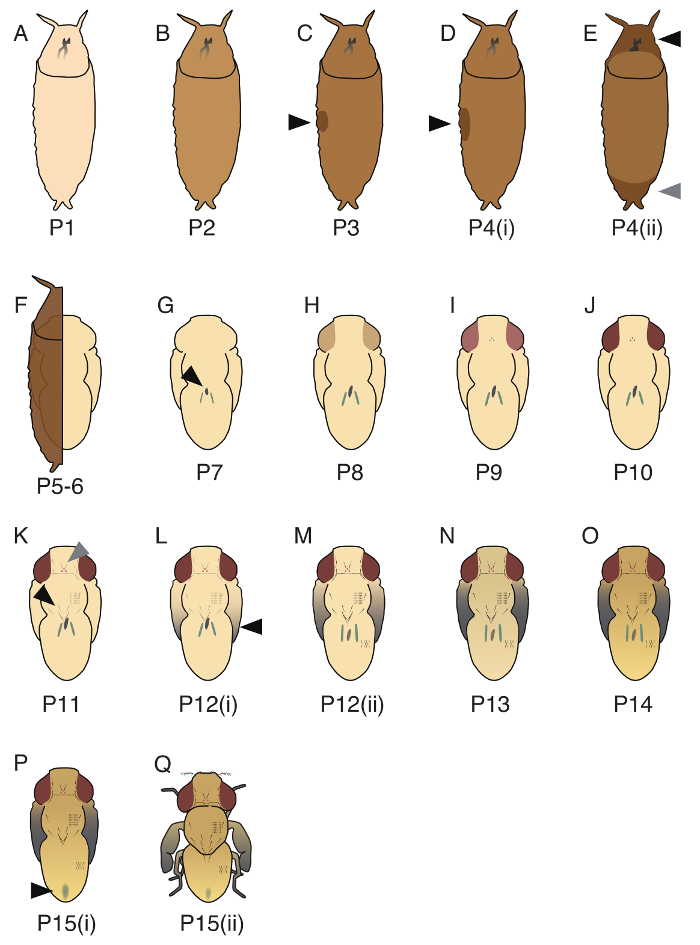
Figura 4. Ilustraciones de 17 etapas de pupal en D. guttifera. (A) P1, el pupario es blanco. (B) P2, el color de la mosca es marrón claro. (C) P3, una burbuja se observa en la parte lateral (flecha negra). (D) P4(i), la burbuja es más grande que en P3 (flecha negra), y la pupa es boyante en PBS. (E) P4(ii), una brecha se observa en la parte anterior (flecha negra) y la parte posterior (flecha gris). (F) P5 - 6, Malpighi túbulos migran (difícil de ver si cubierto por pupario). La pupa es formada por epitelio pupal y cutícula pupal. (G) P7, el cuerpo amarillo se puede observar en el lado dorsal (flecha negra). (H) P8, los ojos son de color amarillos. (I) P9, los ojos son color ámbar. (J) P10, los ojos son de color rojos. (K) P11, Orbital y ocellar cerdas (flecha gris), vibrissae, macrochaetae torácica (flecha negra) y cerdas tarsales son negros y visible. (L) P12(i), las puntas de las alas son grises. (M) P12(ii), todas las partes de las alas son grises (flecha negra). (N) P13, las alas son completamente negras. (O) P14, la cabeza y las piernas están totalmente oscurecidas. (P) P15(i), el meconio se observa en el abdomen dorsal (flecha negra). (Q) P15(ii), la mosca es eclosing. Detalles de estas etapas se describen en Fukutomi et al. 19 Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. Desarrollo de la pigmentación alrededor de un sensillum de companiform en un ala de. Círculos indican ΔODs individuales, y las barras horizontales indican promedios. P10: n = 10, P11: n = 10, 12(i): n = 10, P15(i): n = 11, 3 h n = 8, 24 h n = 7, 7 días: n = 10. Haga clic aquí para ver una versión más grande de esta figura.
| Componente | |
| Azúcar blando blanco | g 51,6 |
| Harina de maíz | g 172,4 |
| Sémola de maíz - C | g 86,4 |
| Levadura de cerveza seca | 106 g |
| Polvo de agar | g 35,28 |
| ddH2O | 4000 mL |
| Hervir durante 30 min y dejar enfriar hasta 70 ° C. | |
| Agregar 4 g de p-hidroxibenzoato de butilo disueltos en 40 mL de etanol. | |
| Mezcle bien y vierta 9 mL en frascos de plástico (diámetro de 25 mm x altura 96 mm). | |
Tabla 1. La composición de los alimentos de harina/azúcar/levadura/agar estándar.
| Componente | Cantidad |
| NaCl | 80 g |
| JCM | 2 g |
| Na2HPO4·12H2O | 29 g |
| KH2PO4 | 2 g |
| ddH2O | hasta 10 L |
| ajustar a pH 7.4 |
Tabla 2. La composición de PBS (1 X).
| Etapa | Media de duración (h) | Dakota del sur | n |
| P1 - 2 | 1.7 | 0.65 | 16 |
| P3 | 2.1 | 0.65 | 16 |
| P4(i) | 2.1 | 1.69 | 19 |
| P4(II) | 0.3 | 0.28 | 29 |
| P5 - 6 | 5.0 | 3.07 | 30 |
| P7 | 31.9 | 7.22 | 46 |
| P8 | 9.6 | 2.81 | 57 |
| P9 | 10.9 | 2,66 | 55 |
| P10 | 11.7 | 2.96 | 39 |
| P11 | 4.4 | 2.81 | 44 |
| P12(i) | 1.1 | 0,76 | 44 |
| P12(II) | 2.0 | 0.70 | 43 |
| P13 | 2.2 | 0,68 | 10 |
| P14 - 15(i) | 28.6 | 2.75 | 10 |
| P15(II) | 1.4 | 0.87 | 10 |
| Total | 121.7 |
Tabla 3. Medir las duraciones de las etapas pupas de D. guttifera.
| OD | ΔOD | |||||||
| Sensilum campaniformes | Vena longitudinal de punta | Vena posterior | Control | Sensilum campaniformes | Vena longitudinal de punta | Vena posterior | ||
| Individual | (Punto A) | (Punto B) | (Punto C) | (Punto D) | (Punto A - punto D) | (Punto B - punto D) | (Punto C - punto D) | |
| 1 | 0.549 | 0.484 | 0.515 | 0.256 | 0.293 | 0.228 | 0.259 | |
| 2 | 0,529 | 0.489 | 0.516 | 0.254 | 0.275 | 0.235 | 0.262 | |
| 3 | 0.546 | 0.48 | 0.533 | 0.255 | 0,291 | 0.225 | 0.278 | |
| 4 | 0.583 | 0.496 | 0.566 | 0.255 | 0.328 | 0.241 | 0,311 | |
| 5 | 0.523 | 0.479 | 0.528 | 0.235 | 0.288 | 0.244 | 0.293 | |
| 6 | 0.572 | 0.509 | 0.546 | 0.265 | 0.307 | 0.244 | 0.281 | |
| 7 | 0.568 | 0.511 | 0,56 | 0.256 | 0.312 | 0.255 | 0.304 | |
| 8 | 0,56 | 0.507 | 0.562 | 0.27 | 0.29 | 0.237 | 0.292 | |
| 9 | 0.551 | 0,485 | 0.569 | 0.259 | 0.292 | 0.226 | 0.31 |
Tabla 4. Mide Sao y ΔODs de D. guttifera adultos 7 días después de la eclosión.
Discusión
Describimos aquí los protocolos para la definición de etapas de pupal, eliminación del pupario de observación detallada, duración de etapas de pupal de medición medición de la intensidad de manchas negras sobre un ala en D. guttifera. Estos protocolos pueden ser aplicados para muchos Drosophila y relacionados con mosca de especies, especialmente con la pigmentación de la mariposa.
Profunda observación y descripción de los eventos del desarrollo más detallados permitiría mayor subdivisión de etapas. En muchos casos, un evento del desarrollo que requieren disección o seccionamiento de una pupa no es adecuado para la determinación del escenario, porque uno tiene que matar a una pupa de puesta en escena y más uso de ese individuo es difícil. Para el uso de una nueva especie de Drosophila , uno debe emplear desarrollo eventos distinguibles desde fuera de la mosca como el primer paso. Dependiendo de la finalidad del estudio, uno puede entonces subdividir aún más etapas basadas en organogénesis particular u otros eventos del desarrollo.
Para la comparación interespecífica de etapas múltiples, una dificultad potencial es una inversión del orden de los eventos del desarrollo entre especies (heterocronía27). Por ejemplo, en D. melanogaster, los túbulos de Malpighi se convierte en verde y luego el cuerpo amarillo se hace visible, mientras que este orden puede ser invertida en algunas pupas de D. guttifera19. En tal caso, la comparación estricta entre fases homólogas es difícil. Según el fenómeno de interés, uno puede necesitar volver a definir o subdividir una etapa particular basada en un evento del desarrollo. Por ejemplo, aproximadamente podemos seleccionar pupas de P5 - 6 y hacer comparación interespecífica de expresiones gen alas pupas utilizando morfología alar como un indicador de sincronización del desarrollo14.
Por lo general, tarda 10-30 min para eliminar el pupario. Si uno quiere cumplir con una etapa corta, pupas deben elaborarse teniendo en cuenta el tiempo que transcurre durante retiro del pupario. Por ejemplo, si uno quiere observar P12(i) de guttifera D., que tiene sólo 1,1 hora de autonomía, preparación de pupas en P11 daría un buen resultado.
En nuestro protocolo, papel de tejido humedecido se utiliza para el fondo de imágenes de la pupas. Dependiendo de la etapa de observación y las estructuras que desea mostrar en una figura, se puede utilizar papel de seda blanco o negro. Para el P3 a la transición de P4(ii), la posición de la burbuja en pupa es importante para distinguir las etapas y papel de tejido negro ayuda a observar la posición de la burbuja. Para las etapas después de P5, papel de seda blanco es mejor porque ayuda a observar el cuerpo amarillo, color de ojos, cerdas y color de la carrocería.
Bainbridge y Bownes17 calcula la duración de etapas de pupal de su frecuencia de aparición. La mesa puesta en escena es el más ampliamente utilizado para D. melanogaster18. Su método, prepararon cuatro botellas de alimentos que contienen cinco hembras y cinco machos adultos y mantiene en la oscuridad, y luego pupas se tomaron al azar de una botella en el 11, 12, 13 y 14 días después del inicio de la puesta de huevos. Cuenta el número de pupas en etapas y calcular los promedios. La longitud de cada etapa pupal podría ser estimada en base a los datos de la duración total del período pupal y los datos de frecuencia. Un problema con este método es que no puede utilizarse para estimar la duración exacta de etapas de pupal si sincronización del desarrollo tiende a ser sincronizada entre pupas.
De hecho, intentamos método de Bainbridge y de Bownes en guttifera D., y obtuvimos datos sesgados debido a la sincronización entre pupas. No podemos identificar la causa de este fenómeno, pero algunas posibilidades son 1) pupas conservan del ritmo circadiano de su etapa joven o 2) reaccionaron a la exposición a la luz ocurrida en observación. Por lo tanto, se decidió medir la duración de la etapa real por observación directa. Esto minimiza el sesgo causado por el ritmo circadiano.
El método descrito aquí es un método para cuantificar la extra acumulación de melanina en puntos en comparación con sus alrededores de control (ΔOD), restando el OD de la zona de control de la do de la zona de la mancha. Este método fue inspirado por un método para cuantificar el contenido de ADN nuclear por análisis de imagen y tinción Feulgen (densitometría28,29). Como uno de los problemas potenciales para aplicar este método a la pigmentación de la mariposa, ΔOD puede ser un valor negativo, especialmente cuando una pupa es muy joven y no tiene casi ninguna pigmentación. En etapas más avanzadas, podría haber cierta pigmentación en el área de control. El uso de la do simple del área del lugar sí mismo podría ser apropiado en lugar de ΔOD dependiendo de la finalidad del estudio. En el caso de D. guttifera, uso de la do simple en lugar de ΔOD no cambió la tendencia de los datos o las conclusiones del estudio.
Divulgaciones
Los autores no tienen conflicto de interés.
Agradecimientos
Agradecemos a Sean B. Carroll y Thomas Werner para proporcionar acciones mosca, Naoyuki fusible para el equipo, Byung Seok Jin para su asistencia en rodaje, Kiyokazu Agata para tutoría y Elizabeth Nakajima para la edición de inglés. Este trabajo fue apoyado por KAKENHI 17K 19427 y Takeda Science Foundation.
Materiales
| Name | Company | Catalog Number | Comments |
| Drosophila guttifera | The Drosophila Species Stock Center at the U.C. San Diego | 15130-1971.10 | Drosophila guttifera, a fruit fly species used in this article |
| Plastic vial | Hightech | MKC-30 | Plastic vial, for fly stock maintenance |
| Buzz plugs vial and bottle closures for glass vials | Fisher Scientific | AS-271 | Cellulose plug, for fly stock maintenance |
| White soft sugar | Mitsui Sugar | J-500g | White soft sugar, for standard cornmeal/sugar/yeast/agar food |
| Corn flour | Nippon Flour Mills | F | Corn flour, for standard cornmeal/sugar/yeast/agar food |
| Corn grits - C | Nippon Flour Mills | GC | Corn grits - C, for standard cornmeal/sugar/yeast/agar food |
| Agar powder | Matsuki Kanten Sangyo | No.602 | Agar powder, for standard cornmeal/sugar/yeast/agar food |
| Dry beer yeast | Asahi Food & Healthcare | Y2A | Dry beer yeast, for standard cornmeal/sugar/yeast/agar food |
| Butyl p-hydroxybenzoate | Nacalai Tesque | 06327-02 | Butyl p-hydroxybenzoate, for standard cornmeal/sugar/yeast/agar food |
| Ethanol | Wako | 057-00456 | Ethanol, for standard cornmeal/sugar/yeast/agar food |
| Flat bottom microtube | Ina Optica | CF-0150 | 1.5 mL microtube, for collecting pupae |
| CAPSULEFUGE | Tomy | PMC-060 | Mini microcentrifuge, for collecting pupae |
| Sterilized Schale NB | Sansei Medical | 01-013 | Plastic Petri dish (diameter 90 mm x height 15 mm) |
| Serum tube rack | Iwaki | 9796-050 | Used as a moist chamber, for observation of pupa |
| Corning Falcon Easy-Grip tissue culture dish | Corning | 353001 | Plastic Petri dish (diameter 35 mm x height 10 mm) |
| Falcon standard tissue culture dish | Corning | 353002 | Plastic Petri dish (diameter 60 mm x height 15 mm) |
| Push-pin | Kokuyo | 51233709 | Push-pin, for making pinholes on the microtube lid |
| Stereomicroscope | Olympus | SZX16 | Stereomicroscope, for morphological observation |
| Digital camera | Olympus | DSE-330-A | Digital camera, for imaging |
| NICETACK double sided tape | Nichiban | NW-15SF | Double sided tape, for removing puparium |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | Forceps, for removing puparium |
| Van Gogh VISUAL Paint brush | Talens Japan | GWVR-#5/0 | Paint brush, for removing puparium |
| Greiner CELLSTAR 12 well cell culture plate | Merck | 665-180 | 12-well cell culture plate, for measuring durations of pupal periods |
| NaCl | Wako | 191-01665 | NaCl, for PBS |
| KCl | Nacalai Tesque | 285-14 | KCl, for PBS |
| Na2HPO4·12H2O | Wako | 196-02835 | Na2HPO4·12H2O, for PBS |
| KH2PO4 | Nacalai Tesque | 28721-55 | KH2PO4, for PBS |
| Stepped Neutral Density (ND) Filter 0.04 - 3.0 | Edmund Optics | 64-384 | Stepped density filter, for calibration of pigmentation measurement |
| ImageJ software | NIH | 1.8.0-101 | ImageJ software, for measurement of intensity of black spots on a wing (https://imagej.nih.gov) |
| FINE FROST glass slide | Matsunami Glass Ind | FF-001 | Glass slide, for measurement of intensity of black spots on a wing |
| Square microscope cover glass 18 x 18 | Matsunami Glass Ind | C018181 | Cover slip, for measurement of intensity of black spots on a wing |
Referencias
- Carson, H. L., Hardy, D. E., Spieth, H. T., Stone, W. S. The evolutionary biology of the Hawaiian Drosophilidae. Essays in evolution and genetics in honor of Theodosius Dobzhansky. Hecht, M. K., Steere, W. C. , Springer (Meredith Corporation). New York. 437-543 (1970).
- Markow, T. A., O'Grady, P. M. Drosophila: a guide to species identification and use. , Academic Press. New York. (2006).
- Patterson, J. T. The Drosophilidae of the southwest. 4313, University of Texas Publication. 7-216 (1943).
- Setoguchi, S., Takamori, H., Aotsuka, T., Sese, J., Ishikawa, Y., Matsuo, T. Sexual dimorphism and courtship behavior in Drosophila prolongata. J Ethol. 32 (2), 91-102 (2014).
- Werner, T., Jaenike, J. Drosophilids of the Midwest and Northeast. , River Campus Libraries, University of Rochester. Rochester. (2017).
- Arnoult, L., et al. Emergence and diversification of fly pigmentation through evolution of a gene regulatory module. Science. 339 (6126), 1423-1426 (2013).
- Camino, E. M., Butts, J. C., Ordway, A., Vellky, J. E., Rebeiz, M., Williams, T. M. The evolutionary origination and diversification of a dimorphic gene regulatory network through parallel innovations in cis and trans. PLoS Genet. 11 (4), e1005136(2015).
- Gompel, N., Prud'homme, B., Wittkopp, P. J., Kassner, V. A., Carroll, S. B. Chance caught on the wing: cis-regulatory evolution and the origin of pigment patterns in Drosophila. Nature. 433 (7025), 481-487 (2005).
- Glassford, W. J., et al. Co-option of an ancestral Hox-regulated network underlies a recently evolved morphological novelty. Dev. Cell. 34 (5), 520-531 (2015).
- Koshikawa, S. Enhancer modularity and the evolution of new traits. Fly. 9 (4), 155-159 (2015).
- Koshikawa, S., et al. Gain of cis-regulatory activities underlies novel domains of wingless gene expression in Drosophila. Proc Natl Acad Sci U S A. 112 (24), 7524-7529 (2015).
- McGregor, A. P., et al. Morphological evolution through multiple cis-regulatory mutations at a single gene. Nature. 448 (7153), 587-590 (2007).
- Tanaka, K., Barmina, O., Kopp, A. Distinct developmental mechanisms underlie the evolutionary diversification of Drosophila sex combs. Proc Natl Acad Sci U S A. 106 (12), 4764-4769 (2009).
- Werner, T., Koshikawa, S., Williams, T. M., Carroll, S. B. Generation of a novel wing colour pattern by the Wingless morphogen. Nature. 464 (7292), 1143-1148 (2010).
- Wittkopp, P. J., et al. Intraspecific polymorphism to interspecific divergence: genetics of pigmentation in Drosophila. Science. 326 (5952), 540-544 (2009).
- Lawrence, P. A., Morata, G. Compartments in the wing of Drosophila: a study of the engrailed gene. Dev Biol. 50 (2), 321-337 (1976).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. J. Embryol. Exp. Morphol. 66, 57-80 (1981).
- Ashburner, M., Golic, K. G., Hawley, R. S. Drosophila: A Laboratory Handbook. , 2nd ed, Cold Spring Harbor Laboratory Press. New York. (2005).
- Fukutomi, Y., Matsumoto, K., Agata, K., Funayama, N., Koshikawa, S. Pupal development and pigmentation process of a polka-dotted fruit fly, Drosophila guttifera (Insecta, Diptera). Dev Genes Evol. 227 (3), 171-180 (2017).
- Koshikawa, S., Fukutomi, Y., Matsumoto, K. Drosophila guttifera as a model system for unraveling color pattern formation. Diversity and evolution of butterfly wing patterns: an integrative approach. Sekimura, T., Nijhout, H. F. , Springer. New York. in press (2017).
- True, J. R., Edwards, K. A., Yamamoto, D., Carroll, S. B. Drosophila wing melanin patterns form by vein-dependent elaboration of enzymatic prepatterns. Curr Biol. 9 (23), 1382-1391 (1999).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Izumitani, H. F., Kusaka, Y., Koshikawa, S., Toda, M. J., Katoh, T. Phylogeography of the Subgenus Drosophila (Diptera: Drosophilidae): evolutionary history of faunal divergence between the Old and the New Worlds. PLoS ONE. 11 (7), e0160051(2016).
- Resh, V. H., Cardé, R. T. Encyclopedia of Insects. , 2nd ed, Academic Press. Burlington. (2009).
- DeLean, A., Munson, P. J., Rodbard, D. Simultaneous analysis of families of sigmoidal curves: application to bioassay, radioligand assay, and physiological dose-response curves. Am J Physiol. 235 (2), E97-E102 (1978).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological changes. J Morphol. 59 (2), 351-399 (1936).
- McKinney, M. L., McNamara, K. Heterochrony: the evolution of ontogeny. , Plenum Press. New York. (1991).
- Hardie, D. C., Gregory, T. R., Hebert, P. D. From pixels to picograms: a beginners' guide to genome quantification by Feulgen image analysis densitometry. J Histochem Cytochem. 50 (6), 735-749 (2002).
- Koshikawa, S., Miyazaki, S., Cornette, R., Matsumoto, T., Miura, T. Genome size of termites (Insecta, Dictyoptera, Isoptera) and wood roaches (Insecta, Dictyoptera, Cryptocercidae). Naturwissenschaften. 95 (9), 859-867 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados