Method Article
ステージング蛹期間およびショウジョウバエ guttiferaの翼色素沈着測定のためのメソッド
要約
ステージングの蛹期間およびショウジョウバエ guttiferaの翼色素沈着の測定のためのプロトコルを説明します。ステージングと色素沈着の定量化アダルト形質の発達のメカニズムを研究するための強固な基盤を提供して形質の開発に関する種間比較を有効にします。
要約
ショウジョウバエ(ミバエ) の多様な種は、開発および進化的変化の責任遺伝子の変化のメカニズムを勉強する機会を提供します。特に、大人の段階は翼色素沈着比較を含む種間の比較形態学的形質の豊富なソースです。種の発達の違いを研究する、詳細な観察と適切なステージングが正確な比較のため必要です。ここで蛹期間のステージングと水玉フルーツ フライ、ショウジョウバエの guttiferaで翼色素沈着の定量化のプロトコルについて述べる。まず、詳細な形態学的観察と形態に基づく蛹のステージの定義の方法について述べる。このメソッドには、蛹の形態の詳細な観察を可能にする、蛹の外側キチン質ケースでは蛹殻を除去するための技術が含まれています。第二に、定義された蛹の期間の測定方法について述べる。最後に、デジタル画像や ImageJ ソフトウェアを用いた画像解析に基づく翼色素の定量法について述べる。これらのメソッドは、蛹大人形質の発達プロセスを比較するための強固な基盤を確立できます。
概要
ショウジョウバエの形態学的特性のいくつかは種1,2,3,4、5の中で多様化します。質問をアプローチすることができますどの形態の多様性のこれらの形態の発生のメカニズムを比較することによって発生します。このような形態の例として、幼虫の毛、大人のセックスの櫛、外部生殖器装置、腹部色素沈着翼色素沈着6,7,8,9,10,11,12,13,14,15. 大人の間で形態学的差異を研究する蛹の段階の観察と解析、ので、重要後期幼虫段階で大人の特性の運命を決定し、その後形態蛹の期間中。
ショウジョウバエ、発達生物学で「時間 APF」(蛹形成後の時間) 蛹のステージ16を示す一般的な方法です。このシステムは蛹形成後の絶対時間を採用、日常的実験のため非常に便利です。しかし、発達速度、蛹の間で異なる場合があり、エピジェネティックな遺伝子またはアイソレータケージのわずかな違いによって影響を受ける可能性があります、したがって、同じ蛹形成後の絶対時間は保証しません蛹は、同時に発達段階。多くの場合、形態学的特徴によって定義される段階は複数の個人を比較することをお勧めです。特に、正確なステージングと対応する (相同) 段階間の比較、種の比較が必要です。
ベイン ブリッジと Bownes17認識 20 蛹化 (P15(ii)) に P1 はショウジョウバエ蛹の形態学的特徴に基づきます。このステージングは、形態学的発達ステージング18の最も広く使われているシステムです。以前の研究では、翼の色素沈着研究19のための基礎を確立するショウジョウバエ guttiferaの蛹ステージングを行った。D. guttiferaは黒の水玉柄は、その翼、翼色素形成20のモデル種の 1 つです。記載されている形態学的基準に紹介がベイン ブリッジと Bownes の研究17、我々 は、シリアル観察19、ベイン ブリッジと Bownes の段階の期間の推定を使用する代わりに、ステージの期間を直接測定周波数を観察しました。ここで蛹のステージングのメソッドと福富ら19で使用されるショウジョウバエの蛹の段階の期間の測定について述べる。
翼の色素沈着の発生機序を研究、蛹または大人の段階で色素沈着が発生するときに知っている必要があります。福富ら。19は、翼画像の画像解析による蛹および大人の段階で色素の光学密度 (ODs) を定量化します。ショウジョウバエ翼の色素沈着は、黒いメラニン21の蓄積に起因すると考えられます。ODs の定量化, グレイ スケール画像や ImageJ のソフトウェア (https://imagej.nih.gov/ij/) の22が使用されました。認識してスポット特有の色素沈着 (ΔOD) を定量化、我々 はスポット内 OD からスポット外 OD を減算します。この方法をするためには、再現性と客観的ランドマークとして翼静脈を用いる OD 測定場所を決定してください。この資料でこのショウジョウバエ guttiferaの翼色素形成の定量化の方法くわしく述べる。
プロトコル
1. フライ ストック
- 次のプロトコルのすべてのショウジョウバエ guttiferaを使用します。
- プラスチック バイアルを使用 (直径 25 mm × 高さ 96 mm) とセルロース プラグ (直径 23 mm × 高さ 26 mm) 在庫メンテナンスのため。標準的なコーンミール、砂糖、酵母、寒天食品を使用し、従って文書説明この種2の他の 3 つの代替レシピ。
注: D. guttifera (在庫数 15130 1971.10) は、カリフォルニア大学サン ディエゴ校ショウジョウバエ種ストック センターによって提供されます。D. guttiferaが属する、オオショウジョウバエ- は遠縁キイロショウジョウバエ属23内、tripunctata放射線+ キイロショウジョウバエと共通の多くの生物学的特性が、します。.したがって、このプロトコルはいくつかの種は、特定の食品やそれらの2を維持するために技術的なヒントを必要とするが、多くのショウジョウバエ種の適用できます。
2. 蛹と蛹化の定義の観察
注: 観測用蛹、12:12 h 明暗サイクル 25 ° C で維持フライのストックから取得されます。ベイン ブリッジと Bownes17は、キイロショウジョウバエの蛹を湿らせたティッシュ ペーパー (946 移動蛹の 97% 生存率) の部分に蛹化の元の場所から移動の低リスクを説明します。D. guttiferaの蛹は、本質的に同じ方法で作成できます。
- プラスチック瓶で生鮮食品 (標準的なコーンミール、砂糖、酵母、寒天食品) にショウジョウバエの健康な成人を配置 (直径 25 mm × 高さ 96 mm) させ、卵を産みます。後半 3 日齢を取得する 7 日間を待ちます。
- 各 1.5 mL のマイクロ チューブに 1 mL の標準的なコーンミール、砂糖、酵母、寒天食品を配置します。呼吸できるようにピンを貫通でマイクロ チューブの蓋に 2 mm 間隔で 3 ピンホールを作る。
- 7 のための食糧とマイクロ チューブを遠心分離機ミニ遠心機 (860 x g) で s。
- 反転し、瓶バイアルからすべての大人を削除するをタップします。
- DdH2O 5-10 mL を注ぐ (または逆浸透水) バイアルに。
- 幼虫プラスチック シャーレに水を注ぐ (直径 90 mm × 高さ 15 mm)。大きな体の大きさ (長さ 3-4 mm)、後半 3 日齢を識別します。
- 優しく食物と一緒にチューブ鉗子で 3 齢幼虫後期に移動 (10 幼虫/マイクロ チューブ)。25 ° C でそれらを一晩インキュベートします。
- DdH2O によって湿らさおよびプラスチック シャーレに配置された組織の紙の上に新しく形成された蛹を移動 (直径 35 mm × 高さ 10 mm)。
- (DdH2下部 O の 10 mL を含む) 湿った室内、ペトリ皿、蛹が必要な段階に開発されるまでを待ちます。
- プラスチック シャーレに湿らせたティッシュ ペーパー作品に蛹を移動 (直径 60 mm × 高さ 15 mm)。
注: 段階の定義主ことに基づいて行うことがキイロショウジョウバエ17の段階。通常、使用される種に応じて必要となる段階の定義のいくつかの変更が、ショウジョウバエの蛹期間は P1 の-P15(ii) に分類できます。正確かつ詳細な観察が可能な場合、蛹の殻を取り外しできます。(ステップ 3) の下の詳細を参照してください。 - ステレオの顕微鏡の下で蛹を観察します。ステレオの顕微鏡に接続されているデジタル カメラを使用して写真を撮る。
3. 蛹殻を削除します。
注:ショウジョウバエの蛹は、蛹の殻と呼ばれる構造によって覆われています。Muscomorpha (ハエ) の昆虫は、幼虫蛹化; キューティクルを流さないでください。代わりに、それは apolysis 後、キューティクルを硬化し、蛹、蛹殻24の保護カバーとして使用します。蛹、蛹の殻の中の存在が真蛹外皮は非常に柔らかく、壊れやすい。Apolysis が起こる P4(ii) の周り、前に上皮と囲蛹が一緒に添付され、したがって損傷することがなく蛹殻の取り外しは非常に困難。P5 の後、蛹の殻を取り外しは、面倒ですが形態学的観察と蛹の定義に便利です。プロセスは、次のとおり実行されます。
- 一枚のペーパー タオルの部分に両面テープを貼ります。
- (図 1 a) を両面テープの腹側に蛹を配置します。
- 蛹殻の前方側と内部の蛹の間領域を見つけます。把握し鉗子を使用してこのギャップを囲蛹を削除し、蛹の頭の前方側を公開します。
- 前後軸に平行移動することによって、鉗子の先端を挿入します。ローカルで、蛹の殻を破るに鉗子の先端を持ち上げ。破損、蛹の殻の後部に達するまでは、この操作を繰り返します。囲蛹と蛹の足の間のギャップが形成することを確認し、蛹の殻の腹側を破る (図 1 b) の内部の蛹へのダメージを最小限に抑えます。
- 可能な限り、蛹の殻を破り後、罰金絵筆 (#5/0) (図 1) を使用して蛹を取り出してください。
- DdH2O で湿らせたおよびプラスチック シャーレに配置されたティッシュ ペーパーの部分で蛹を配置 (直径 60 mm × 高さ 15 mm)。露出の蛹は脆弱になります、簡単に乾燥になるので、できるだけ早く写真を撮る。
注: 蛹、蛹の殻なし、蛹期間 (ステップ 4) の期間の測定に適したため (乾燥) などのストレスや物理的な損傷は通常発展を妨げる可能性があります。
4. 蛹の期間の測定
- ステップ 2 で説明したように、蛹の期間を測定するため、蛹を準備します。1-2、2-3、および蛹形成 (20 蛹) 後 3-4 日の蛹を収集します。識別のため蛹に個体識別番号 (1-60) を与えます。20 のより多くの若い蛹を取得する、次の手順の中に蛹を形成新しく収集を続けます。新しく形成された蛹に個体識別番号 (61-80) を与えます。DdH2O でぬらしたティッシュ ペーパー 12 ウェルの細胞培養プレート (1 蛹/まあ、12 蛹/プレート) の井戸 (3.9 cm2) の部分で蛹を配置します。DdH2O 湿度を維持の蓋を入れて、25 ° c で、一定の光 (24:0 h/暗) 条件プレートを配置するとプレートの間ものスペースを埋めます。
注: 蛹の殻なし蛹、蛹期間の継続時間を測定するため適していません。蛹の殻を削除しないでください。 - すべての 30 分と記録集計シート (P1 - P15(ii)、に基づいて参照17,19) 段階を観察したら車体色、毛、キイロショウジョウバエマルピギー管、すべて蛹の黄色のボディを含む形態学的特徴を観察します。
- 3 つ (またはそれ以上) の人の回転シフトを 4 日連続 (96 h) の記録が再開します。
- それぞれ特定のステージのレコード数をカウントし、それらの平均 (観測数を平均/蛹)。それらが 0.5 (h)、(h) の段階の推定長さの結果を乗算します。
5. 翼に黒い斑点の強度の測定
注: 蛹または大人の羽に黒い斑点の強度は光学濃度 (OD) を測定することによって定量化することができます。知られている ODs (段密度フィルター) でガラス フィルターは、1 つは翼のデジタル画像から特定の領域の外径を計算できるようにキャリブレーション25に使用されます。スポットで OD とスポット外外径を測定、後者はスポット (ΔOD) の強度を取得する前から差し引かれます。ここでは、解離、測定、ΔOD の計算法について述べる.ステップ 2、ステップ 3 とステップ 4 から独立した後、この手順を行うことができます。1 つはステップ 2 を実行しているし、すべて蛹の段階を理解し、一度直接開始できる 1 つまたは、手順 5 を繰り返します。
- イメージの準備
- ステップ 2 で説明したように焦点ステージの新しい蛹を準備します。鉗子で、蛹殻の前方の部分を削除します。鉗子を使用して蛹を取り出してプラスチック シャーレにリン酸緩衝生理食塩水 (PBS,表 2) に配置 (直径 35 mm × 高さ 10 mm)。
- 翼の根元のジョイントをカット (基底部は翼の近位部分の狭い)。翼は折り畳まれ、プラスチック シャーレに入れます (直径 35 mm × 高さ 10 mm) 満ちている ddH2O (翼はそれ自体で繰り広げられる) 浸透圧によってそれを拡張します。
- ストック バイアルから新しくこの大人 10 分毎を収集します。CO2 CO2麻酔パッドを使用してフライを麻酔、不動で anesthetization を確認し、翼の基部ジョイントをカットします。
- スライド ガラスに場所の 10 μ L の PBS は、翼を配置、カバー スリップ (18 mm × 18 mm) でカバーします。
- ステレオの顕微鏡の光をオンにします。最大レベルで光を設定します。11.5 X 対物レンズを設定します。最も開いた状態に絞りを設定します。カメラをオンにします。カメラを設定 (ISO: 100、2352 ピクセル x SHQ 3136 モード シャッター速度: 1/20 秒)。顕微鏡のフォーカスノブを移動することによって、サンプルに焦点を当てます。
- 画像を取るためリモコンのシャッター ボタンをプッシュします。Campaniform ゴキブリ、縦静脈スポットまたは後部の crossvein、左側の翼の遠位部と上部側翼の前方の部分の位置を中心にされる必要がありますそれぞれの翼あるごとの 3 つの画像を取る。
- 校正
- 翼のイメージを取得するために使用同じカメラ設定を使用して段密度フィルターの 9 部分の画像を取る。
- ImageJ のソフトウェア (https://imagej.nih.gov/ij/) の22を開始します。
- ファイルをクリックして |オープン |段密度フィルターのイメージの 1 つを選択します。
- 画像をクリックして |種類 |8 ビット |8 ビット イメージにイメージを変換します。
- [編集] |選択 |指定 |オーバルと中央揃えの列を確認してください。Y 座標の列の幅の列で 100 (ピクセル)、高さ欄 100 (ピクセル)、 X 座標列で 1568、1176 を記述します。[Ok]をクリックします。
- [分析 |メジャー |。選択した領域の「平均グレー値」を測定します。
- 5.2.3 を繰り返します。5.2.6 を。8 の残りの画像を実行します。
- [分析 |調整関数列でRodbard25を選択し、真ん中の右の列で、次の番号を書く (0.04、0.336、0.632、0.928、1.224、1.52、1.816、2.112、2.408 を; これらの番号によって異なりますの密度、密度フィルターを辞任した)。
- グローバル校正列を確認し、 [ok]をクリックします。
注: この手順を実行すると、「光学濃度 (OD)」Rodbard 関数を使用してに変換されます「平均グレー値」。この手順の後 ImageJ ソフトウェアで特定の選択した領域の光学密度を計算できます。
- 測定の領域を選択します。
注: スポットは campaniform 触角、縦静脈のヒントは、crossveins などのランドマークに通常関連付けられます。これらは、翼の他のランドマークは、測定領域を選択する使用できます。ここでは、例D. guttifera(図 2) については、説明します。- Campaniform ゴキブリ スポット ポイント A の定義。
- Campaniform ゴキブリ スポット画像の中心でイメージを開きます。画像をクリックして |種類 |8 ビット |8 ビット イメージにイメージを変換します。
- 領域選択ツールで長方形をクリックし、四角形を描画します。それが 3 番目の縦方向の静脈の後方のラインに接続されていてより遠位 campaniform ゴキブリ スポットから、四角形の左上の頂点を設定します。四角形の右側にあるを設定すると、スポットの campaniform ゴキブリの右側に位置しています。
- [編集] |選択 |マネージャーに追加 |。[すべての列を確認します。
- 行選択ツールの角度ツールをクリックします。3 番目の縦方向の静脈の後方の行に最初の行を描画します。ステップ 1 で描画される四角形の頂点の行の左エンドポイントを設定します。四角形の上側の 2 番目の行を描画します。この手順では 2 つの線の間の角度を測定する"m"キーを押します。コンピューターの画面上の画像のウィンドウをクリックします。
- [編集] |選択 |マネージャーに追加 |。
- 領域選択ツールで長方形をクリックし、約 1/9 の長方形を描くイメージ ウィンドウのサイズ。[編集] |選択 |回転 |。5.3.1.4 の手順で測定された角度のマイナス度を記述します。角列でこの手順で描画された四角形を回転する[ok]をクリックします。
- 5.3.1.6 のステップで描画された四角形を移動します。矢印キーを使用します。四角形の左側と 3 番目の縦方向の静脈の後方のラインに接続されている四角形の底辺に 2 番目の縦方向の静脈の後方線の終点を設定します。この手順では、3 番目の縦方向の静脈の後方の行に 2 番目の縦方向の静脈の終了点から垂直線を描画することを確認します。垂線の足を点 A (図 2 a) として定義します。
- X 座標と y 座標点、A 点にカーソルを配置するとき、領域選択ツールを下記を記録します。
- 縦静脈先端スポット B 点の定義
- 縦静脈先端スポット画像の中心でイメージを開きます。画像をクリックして |種類 |8 ビット |8 ビット イメージにイメージを変換します。
- 5.3.1 の手順で説明する同じ手順を繰り返します。点 A の定義 (campaniform ゴキブリ スポット) イメージのポイントを検索します。
- [編集] |選択 |マネージャーに追加 |。
- 領域選択ツールで長方形をクリックし、四角形を描画します。3 番目の縦方向の静脈の後方線の終点で、四角形の左上の頂点を設定します。
- [編集] |選択 |マネージャーに追加 |。
- 行選択ツールの角度ツールをクリックします。点 A と 3 番目の縦方向の静脈の後方の線の端点を接続する最初の行を描画します。5.3.2.4 のステップで描画される四角形の上側の 2 番目の行ライン A. 描画としてこの行を定義します。2 つの線分間の角度を測定する"m"キーを押します。
- [編集] |選択 |マネージャーに追加 |。
- 領域選択ツールで長方形をクリックし、約 1/9 の長方形を描くイメージ ウィンドウのサイズ。[編集] |選択 |回転 |。5.3.2.6 の手順で測定された角度のマイナス度を記述します。角列でこの手順で描画された四角形を回転する[ok]をクリックします。四角形を移動するには、矢印キーを使用します。四角形の左側にあるようにそれが A 線、第 4 縦脈の前の線の終点に接続されるので、四角形の上部を設定します。
- [編集] |選択 |マネージャーに追加 |。
- 領域選択ツールで長方形をクリックし、約 1/9 の長方形を描くイメージ ウィンドウのサイズ。[編集] |選択 |回転 |。角度の角度] 列で手順 6 で測定値のマイナス度を書くし、この手順で描画された四角形を回転する[ok]をクリックします。四角形を移動するには、矢印キーを使用します。手順 5.3.2.8 で描画される四角形の左上の頂点は、四角形の左下の頂点を設定します行 a. を定義する第 4 縦脈の前の線の終点から垂直線を得ることに結果として得られる、、。垂直線と B 点 (図 2 b) として 3 番目の縦静脈の後方の線の交点。
- X 座標と y 座標地点、B 地点にカーソルを配置するとき、領域選択ツールを下記を記録します。
- ポイント C、後部 crossvein スポットの定義
- 後部 crossvein スポット画像の中心でイメージを開きます。画像をクリックして |種類 |8 ビット |8 ビット イメージにイメージを変換します。
- 後部 crossvein 積で 4 縦静脈および第 4 縦脈 (図 2) の前部のラインの後ほとんどのポイントとして、ポイント C を定義します。
- X 座標と y 座標点 C、C 点にカーソルを配置するとき、領域選択ツールを下記を記録します。
- ポイント D、コントロール領域の定義
- Campaniform ゴキブリ スポット画像の中心でイメージを開きます。画像をクリックして |種類 |8 ビット |8 ビット イメージにイメージを変換します。
- ストレートライン選択ツールでクリックし、2 番目の縦方向の静脈の前方ライン、第 4 縦脈の後の線の端点の終点を結ぶ線を描画します。この行と 3 番目の縦静脈 (図 2 D) の後の線の交差するポイントとして点 D を定義します。
- X 座標と y 座標点 D、点 D にカーソルを配置するとき、領域選択ツールを下記を記録します。
- Campaniform ゴキブリ スポット ポイント A の定義。
- 測定
- (測定点は、中心点と画像を開く) の翼スポットのイメージの 1 つを開きます。画像をクリックして |種類 |8 ビット |8 ビット イメージにイメージを変換します。
- 領域選択ツールで長方形をクリックし、画像ウィンドウの約 1/9 サイズの四角形を描画します。
- [編集] |選択 |指定 |。オーバルと中央揃えの列を確認します。幅と高さの列で 100 (ピクセル) を書き込み、ポイント A (または B 点または C ポイント) の x 座標を書くとX 座標列と書き込み、y 点 A の座標 (点 B または C ポイント) D とY 座標列で D。[Ok]をクリックします。
- [分析 |メジャー |。5.2 で説明されているキャリブレーションは既に完了して、ODs が意味] 列に示されます。
- ポイント A、B、および C の ODs から点 D の OD を差し引くことによって ΔODs を計算します。
注: ポイント D 翼の透明部分し色素沈着は含まれません、したがってバック グラウンド コントロールに適しています。
結果
D. guttiferaの蛹の期間は (P1 - P15(ii); (P1、P5 の - 6、P10) の段階は図 3、およびすべての 17 段階を図 4に示すとおり 3 つ代表の画像) 17 段階に分けられます。ベイン ブリッジと Bownes17は、キイロショウジョウバエの 20 段階を認識、 d. guttiferaにいくつかこれらの段階のない適用でした。2 つの発生イベントの発生順序、黄色のボディ (小屋26腸内細胞の固まり) の外観と緑を回してマルピギー氏管のタイミングがd. guttiferaで厳密に制御しない、したがって我々 は P5 を分離できる (i)、P5(ii) および P6。またとは異なりキイロショウジョウバエ、胸部および腹部の毛の黒染めのタイミングが同期だった、したがって我々 は P11(i) と P11(ii)19を分離できます。
我々 はd. guttifera (表 3、福富ら19から) の蛹の段階の長さを測定できます。蛹期間は約 20 時間以上であるキイロショウジョウバエの 25 ° C17 です。Campaniform ゴキブリ、縦静脈先端と後部の crossvein 周辺の ΔODs を計算した.ここで、紹介 ODs と ΔODs 大人の羽化 (表 4) 後 7 日。複数のステージのデータを比較すると、ステージ P12(i) は、色素沈着の発症のタイミングとその色素沈着は羽化後 24 時間で完成品がわかった (図 5、福富らで使用される元の測定から。19)。
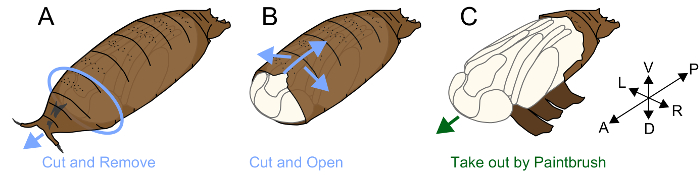
図 1。蛹殻を取り外しの図です。(A) 上蛹腹側に両面テープの部分に置きます。蛹殻の前方の部分を削除します。(B) 腹側から鉗子で、蛹の殻を破る。(C)、蛹の殻を破り、絵筆を使って蛹を取り出してください。この図の拡大版を表示するのにはここをクリックしてください。

図 2。色素沈着の測定領域の定義します。(A) ポイント A campaniform ゴキブリに関連付けられているスポット。(B) ポイント B 縦静脈先端に関連付けられているスポット。(C) 点 C スポットの後部 crossvein に関連付けられています。(D) ポイント D コントロール領域。スケール バーを示す 250 μ mこの図の拡大版を表示するのにはここをクリックしてください。

図 3。蛹化定義の例です。(A) 段階の蛹 P1 蛹殻で覆われています。(B) P5 の-6 のステージの蛹。(C) ステージ P10 の蛹。(B) で観察する前に、puparia を削除および (C)。スケール バーを示す 500 μ m.この図の拡大版を表示するのにはここをクリックしてください。
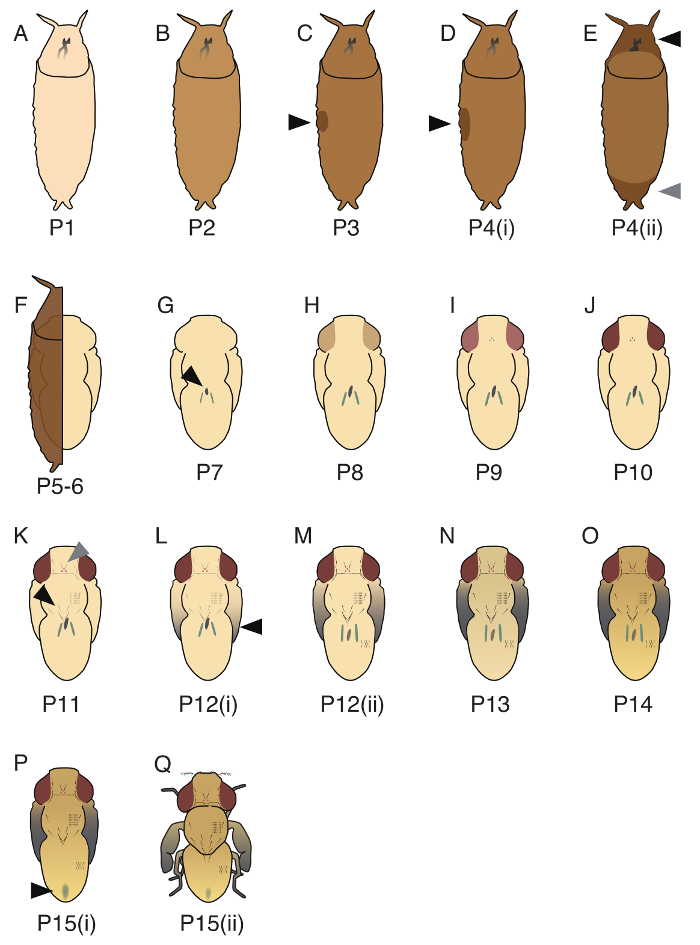
図 4。D. guttiferaで識別される 17 蛹段階のイラスト。(A)、P1、蛹の殻は白です。(B) P2、蛹の殻の色は明るい茶色。(C) P3、バブルは、側面 (黒矢印) で観察されます。(D) P4(i)、バブルが P3 よりも大きい (黒矢印) と蛹は PBS の浮力です。(E) P4(ii)、ギャップは前部 (黒い矢印) と後部 (灰色の矢印) で観察されます。(F) P5 の-6、キイロショウジョウバエマルピギー細管移行 (蛹殻で覆われている場合を参照してくださいすることは困難)。蛹の形状は、上皮の蛹と蛹外皮によって形成されます。(G) P7、黄色のボディは、背側 (黒矢印) で観察できます。(H) P8、目は黄色です。(I) P9、目は黄色。(J) P10、目は赤です。(K) P11、軌道と単眼剛毛 (灰色の矢印)、ヒゲ、胸部 macrochaetae (黒い矢印) と瞼の毛は黒と表示されます。(L) P12(i)、翼の先端が灰色です。(M) P12(ii)、翼のすべての部分がグレー (黒矢印です)。(N) P13、翼は完全に黒です。(O) P14、頭と足は完全に暗くなります。(P) P15(i)、胎便を背側腹部 (黒矢印) に観察できます。(Q) P15(ii)、eclosing が。これらの段階の詳細は、福富らで記述されていた。19この図の拡大版を表示するのにはここをクリックしてください。

図 5。Companiform ゴキブリ翼の周囲に色素沈着の開発。印は個々 の ΔODs、横棒は平均値を示します。P10 の: n = 10、P11: n = 10、12(i): n = 10、P15(i): n = 11、3 h: n = 8、24 h: n = 7、7 日: n = 10。この図の拡大版を表示するのにはここをクリックしてください。
| コンポーネント | |
| 白い砂糖 | 51.6 g |
| トウモロコシの粉 | 172.4 g |
| ひき割りトウモロコシ - C | 86.4 g |
| 乾燥ビール酵母 | 106 g |
| 粉寒天 | 35.28 g |
| ddH2O | 4000 mL |
| 30 分、70 ° C まで冷却するまま煮る | |
| パラオキシ安息香酸ブチルの 4 グラムのエタノール 40 mL に溶解を追加します。 | |
| よく混合し、プラスチック瓶 9 mL を注ぎ (直径 25 mm × 高さ 96 mm)。 | |
表 1。標準的なコーンミール、砂糖、酵母、寒天食品の組成物。
| コンポーネント | 量 |
| 塩化ナトリウム | 80 g |
| KCl | 2 g |
| ナ2HPO4·12H2O | 29 g |
| KH2PO4 | 2 g |
| ddH2O | 10 L まで |
| pH 7.4 に設定します。 |
表 2。PBS (1 X) の組成物。
| ステージ | 期間 (h) の意味します。 | エスディ | n |
| P1 - 2 | 1.7 | 0.65 | 16 |
| P3 | 2.1 | 0.65 | 16 |
| P4(i) | 2.1 | 1.69 | 19 |
| P4(ii) | 0.3 | 0.28 | 29 |
| P5 の-6 | 5.0 | 3.07 | 30 |
| P7 | 31.9 | 7.22 | 46 |
| P8 | 9.6 | 2.81 | 57 |
| P9 | 10.9 | 2.66 | 55 |
| P10 | 11.7 | 2.96 | 39 |
| P11 | 4.4 | 2.81 | 44 |
| P12(i) | 1.1 | 0.76 | 44 |
| P12(ii) | 2.0 | 0.70 | 43 |
| P13 | 2.2 | 0.68 | 10 |
| P14 - 15(i) | 28.6 | 2.75 | 10 |
| P15(ii) | 1.4 | 0.87 | 10 |
| 合計 | 121.7 |
表 3。蛹の期間を測定 d. guttifera.
| OD | ΔOD | |||||||
| Campaniform sensilum | 縦静脈先端 | 後部 crossvein | コントロール | Campaniform sensilum | 縦静脈先端 | 後部 crossvein | ||
| 個人 | (点 A) | (B) | (C 点) | (D 点) | (ポイント A のポイント D) | (ポイント B - ポイント D) | (ポイント C - ポイント D) | |
| 1 | 0.549 | 0.484 | 0.515 | 0.256 | 0.293 | 0.228 | 0.259 | |
| 2 | 0.529 | 0.489 | 0.516 | 0.254 | 0.275 | 0.235 | 0.262 | |
| 3 | 0.546 | 0.48 | 0.533 | 0.255 | 0.291 | 0.225 | 0.278 | |
| 4 | 0.583 | 0.496 | 0.566 | 0.255 | 0.328 | 0.241 | 0.311 | |
| 5 | 0.523 | 0.479 | 0.528 | 0.235 | 0.288 | 0.244 | 0.293 | |
| 6 | 0.572 | 0.509 | 0.546 | 0.265 | 0.307 | 0.244 | 0.281 | |
| 7 | 0.568 | 0.511 | 0.56 | 0.256 | 0.312 | 0.255 | 0.304 | |
| 8 | 0.56 | 0.507 | 0.562 | 0.27 | 0.29 | 0.237 | 0.292 | |
| 9 | 0.551 | 0.485 | 0.569 | 0.259 | 0.292 | 0.226 | 0.31 |
表 4。ODs を測定し、 の ΔODs d. guttifera 大人羽化後 7 日。
ディスカッション
ここで述べたい蛹の段階の定義のプロトコル削除の詳細な観察は、囲蛹、蛹の期間とd. guttiferaの翼に黒い斑点の強度の測定を測定します。これらのプロトコルは、多くのショウジョウバエのため適用することができ、フライ種、特に翼色素沈着との関連。
詳細な観察と発達するより詳細なイベントの説明により、さらに段階の細分化。多くの場合、郭清を必要とするまたは蛹のセクショニング発達イベントはステージ定義に適していない、その個人は難しい、ステージングの蛹を殺すために、それ以上の使用があるため。新しいショウジョウバエ種の使用は、最初のステップとして発達するイベント、蛹の殻の外から区別を採用すべき一つ。研究の目的に応じて、特定の器官または他の発達のイベントに基づいて段階をさらに細かく分割することができますは。
潜在的な難しさは、複数段階の種間比較種 (立て27) 発達のイベントの順序の反転です。たとえば、キイロショウジョウバエ、マルピギー氏管が緑になるし、 d. guttifera19のいくつかの蛹でこの順序を反転するのに対し、黄色のボディが表示されます。このような場合に、同種の段階の間の厳密な比較は難しいです。興味という現象によって 1 つは再定義または発達のイベントに基づいて特定の段階を細分化する必要があります。たとえば、約 P5 の-6 蛹を選択し、発生時期14の指標としての翼の形態を使用して蛹の翼内の遺伝子発現の種間の比較を行う私たちことができます。
通常、それは、蛹の殻を削除する 10 〜 30 分かかります。1 つは短いステージを観察する場合は、蛹は、蛹殻除去中に経過する時間を考慮準備必要があります。たとえば、P12(i) d. guttifera、唯一 1.1 h の期間を持っているを観察したい P11 で蛹を準備して、良い結果を与えるでしょう。
プロトコル、湿らせたティッシュ ペーパーは蛹の画像の背景に使用されます。観察と構造図で示したいと 1 つのステージ、によって 1 つは白または黒のティッシュ ペーパーを使用できます。P4(ii) 移行する P3 の蛹のバブルの位置は、段階を区別するために重要と黒のティッシュ ペーパーの泡の位置を観察することができます。P5 の後の段階、黄色の体、目の色、毛、ボディの色を観察することができますので、白いティッシュ ペーパーが良い。
ベイン ブリッジと Bownes17の出現頻度から蛹の期間を推定しました。ステージング テーブルは、ショージョーバエ ・18のための最も広く使用されているものです。彼らの方法の 5 成人女性と 5 成人男性を含む 4 つの食品ボトルを準備して、暗闇の中でそれらを保ったし、蛹がランダムに撮影ボトル 1 本から 11、12、13、および 14 日産卵の発症後に。彼らは特定の段階で蛹の数をカウント、平均値を計算しました。各蛹期の長さは、蛹の期間の合計時間のデータとこれらの周波数のデータに基づいて推定でした。この方法の 1 つの問題は、それが使えないことが発生時期は蛹の間で同期する傾向がある場合、蛹の正確な期間を推定します。
実際には、 d. guttifera、ベイン ブリッジと Bownes の法を試みたし、蛹の間で同期のため偏りのある情報を得た。我々 はこの現象の原因を識別できませんでしたが、いくつかの可能性は、1) 蛹は彼らの若い段階から概日リズムを保持または 2) 彼らは観察で発生した光への露出に反応します。したがって、直接観察による実際のステージ時間を測定することにしました。これは、概日リズムによるバイアスを最小限に抑えます。
ここで説明する方法はスポット エリアの OD からコントロール領域の OD を差し引くことによって彼らの周辺のコントロール エリア (ΔOD) と比較してのスポットでメラニンの余分な蓄積を定量化する手法です。このメソッドは、フォイルゲン染色と画像解析 (デンシトメトリー28,29) による核 DNA 量を定量化するための方法に触発されました。蛹は非常に若いと色素沈着がほとんどないときに特に翼色素沈着にこのメソッドを適用するための潜在的な問題のひとつとして、ΔOD は負の値をすることができます。後の段階で、コントロールの領域にいくつかの色素沈着があります。スポット エリア自体の単純な OD の使用は研究の目的に応じて ΔOD の代わりに適切なかもしれません。D. guttiferaの場合のデータの傾向または研究の結論、ΔOD ではなく単純な OD の使用は変わらなかった。
開示事項
著者は利害の対立があります。
謝辞
直行用ヒューズ、秉ソクジン撮影、メンタリングの阿形とエリザベス中島英語を編集するための彼の援助のためのはえの在庫を提供する、ショーン b. キャロルとヴェルナー ・ トーマスに感謝します。この仕事は、費によって支えられた 17 K 19427 と武田科学振興財団。
資料
| Name | Company | Catalog Number | Comments |
| Drosophila guttifera | The Drosophila Species Stock Center at the U.C. San Diego | 15130-1971.10 | Drosophila guttifera, a fruit fly species used in this article |
| Plastic vial | Hightech | MKC-30 | Plastic vial, for fly stock maintenance |
| Buzz plugs vial and bottle closures for glass vials | Fisher Scientific | AS-271 | Cellulose plug, for fly stock maintenance |
| White soft sugar | Mitsui Sugar | J-500g | White soft sugar, for standard cornmeal/sugar/yeast/agar food |
| Corn flour | Nippon Flour Mills | F | Corn flour, for standard cornmeal/sugar/yeast/agar food |
| Corn grits - C | Nippon Flour Mills | GC | Corn grits - C, for standard cornmeal/sugar/yeast/agar food |
| Agar powder | Matsuki Kanten Sangyo | No.602 | Agar powder, for standard cornmeal/sugar/yeast/agar food |
| Dry beer yeast | Asahi Food & Healthcare | Y2A | Dry beer yeast, for standard cornmeal/sugar/yeast/agar food |
| Butyl p-hydroxybenzoate | Nacalai Tesque | 06327-02 | Butyl p-hydroxybenzoate, for standard cornmeal/sugar/yeast/agar food |
| Ethanol | Wako | 057-00456 | Ethanol, for standard cornmeal/sugar/yeast/agar food |
| Flat bottom microtube | Ina Optica | CF-0150 | 1.5 mL microtube, for collecting pupae |
| CAPSULEFUGE | Tomy | PMC-060 | Mini microcentrifuge, for collecting pupae |
| Sterilized Schale NB | Sansei Medical | 01-013 | Plastic Petri dish (diameter 90 mm x height 15 mm) |
| Serum tube rack | Iwaki | 9796-050 | Used as a moist chamber, for observation of pupa |
| Corning Falcon Easy-Grip tissue culture dish | Corning | 353001 | Plastic Petri dish (diameter 35 mm x height 10 mm) |
| Falcon standard tissue culture dish | Corning | 353002 | Plastic Petri dish (diameter 60 mm x height 15 mm) |
| Push-pin | Kokuyo | 51233709 | Push-pin, for making pinholes on the microtube lid |
| Stereomicroscope | Olympus | SZX16 | Stereomicroscope, for morphological observation |
| Digital camera | Olympus | DSE-330-A | Digital camera, for imaging |
| NICETACK double sided tape | Nichiban | NW-15SF | Double sided tape, for removing puparium |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | Forceps, for removing puparium |
| Van Gogh VISUAL Paint brush | Talens Japan | GWVR-#5/0 | Paint brush, for removing puparium |
| Greiner CELLSTAR 12 well cell culture plate | Merck | 665-180 | 12-well cell culture plate, for measuring durations of pupal periods |
| NaCl | Wako | 191-01665 | NaCl, for PBS |
| KCl | Nacalai Tesque | 285-14 | KCl, for PBS |
| Na2HPO4·12H2O | Wako | 196-02835 | Na2HPO4·12H2O, for PBS |
| KH2PO4 | Nacalai Tesque | 28721-55 | KH2PO4, for PBS |
| Stepped Neutral Density (ND) Filter 0.04 - 3.0 | Edmund Optics | 64-384 | Stepped density filter, for calibration of pigmentation measurement |
| ImageJ software | NIH | 1.8.0-101 | ImageJ software, for measurement of intensity of black spots on a wing (https://imagej.nih.gov) |
| FINE FROST glass slide | Matsunami Glass Ind | FF-001 | Glass slide, for measurement of intensity of black spots on a wing |
| Square microscope cover glass 18 x 18 | Matsunami Glass Ind | C018181 | Cover slip, for measurement of intensity of black spots on a wing |
参考文献
- Carson, H. L., Hardy, D. E., Spieth, H. T., Stone, W. S. The evolutionary biology of the Hawaiian Drosophilidae. Essays in evolution and genetics in honor of Theodosius Dobzhansky. Hecht, M. K., Steere, W. C. , Springer (Meredith Corporation). New York. 437-543 (1970).
- Markow, T. A., O'Grady, P. M. Drosophila: a guide to species identification and use. , Academic Press. New York. (2006).
- Patterson, J. T. The Drosophilidae of the southwest. 4313, University of Texas Publication. 7-216 (1943).
- Setoguchi, S., Takamori, H., Aotsuka, T., Sese, J., Ishikawa, Y., Matsuo, T. Sexual dimorphism and courtship behavior in Drosophila prolongata. J Ethol. 32 (2), 91-102 (2014).
- Werner, T., Jaenike, J. Drosophilids of the Midwest and Northeast. , River Campus Libraries, University of Rochester. Rochester. (2017).
- Arnoult, L., et al. Emergence and diversification of fly pigmentation through evolution of a gene regulatory module. Science. 339 (6126), 1423-1426 (2013).
- Camino, E. M., Butts, J. C., Ordway, A., Vellky, J. E., Rebeiz, M., Williams, T. M. The evolutionary origination and diversification of a dimorphic gene regulatory network through parallel innovations in cis and trans. PLoS Genet. 11 (4), e1005136(2015).
- Gompel, N., Prud'homme, B., Wittkopp, P. J., Kassner, V. A., Carroll, S. B. Chance caught on the wing: cis-regulatory evolution and the origin of pigment patterns in Drosophila. Nature. 433 (7025), 481-487 (2005).
- Glassford, W. J., et al. Co-option of an ancestral Hox-regulated network underlies a recently evolved morphological novelty. Dev. Cell. 34 (5), 520-531 (2015).
- Koshikawa, S. Enhancer modularity and the evolution of new traits. Fly. 9 (4), 155-159 (2015).
- Koshikawa, S., et al. Gain of cis-regulatory activities underlies novel domains of wingless gene expression in Drosophila. Proc Natl Acad Sci U S A. 112 (24), 7524-7529 (2015).
- McGregor, A. P., et al. Morphological evolution through multiple cis-regulatory mutations at a single gene. Nature. 448 (7153), 587-590 (2007).
- Tanaka, K., Barmina, O., Kopp, A. Distinct developmental mechanisms underlie the evolutionary diversification of Drosophila sex combs. Proc Natl Acad Sci U S A. 106 (12), 4764-4769 (2009).
- Werner, T., Koshikawa, S., Williams, T. M., Carroll, S. B. Generation of a novel wing colour pattern by the Wingless morphogen. Nature. 464 (7292), 1143-1148 (2010).
- Wittkopp, P. J., et al. Intraspecific polymorphism to interspecific divergence: genetics of pigmentation in Drosophila. Science. 326 (5952), 540-544 (2009).
- Lawrence, P. A., Morata, G. Compartments in the wing of Drosophila: a study of the engrailed gene. Dev Biol. 50 (2), 321-337 (1976).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. J. Embryol. Exp. Morphol. 66, 57-80 (1981).
- Ashburner, M., Golic, K. G., Hawley, R. S. Drosophila: A Laboratory Handbook. , 2nd ed, Cold Spring Harbor Laboratory Press. New York. (2005).
- Fukutomi, Y., Matsumoto, K., Agata, K., Funayama, N., Koshikawa, S. Pupal development and pigmentation process of a polka-dotted fruit fly, Drosophila guttifera (Insecta, Diptera). Dev Genes Evol. 227 (3), 171-180 (2017).
- Koshikawa, S., Fukutomi, Y., Matsumoto, K. Drosophila guttifera as a model system for unraveling color pattern formation. Diversity and evolution of butterfly wing patterns: an integrative approach. Sekimura, T., Nijhout, H. F. , Springer. New York. in press (2017).
- True, J. R., Edwards, K. A., Yamamoto, D., Carroll, S. B. Drosophila wing melanin patterns form by vein-dependent elaboration of enzymatic prepatterns. Curr Biol. 9 (23), 1382-1391 (1999).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Izumitani, H. F., Kusaka, Y., Koshikawa, S., Toda, M. J., Katoh, T. Phylogeography of the Subgenus Drosophila (Diptera: Drosophilidae): evolutionary history of faunal divergence between the Old and the New Worlds. PLoS ONE. 11 (7), e0160051(2016).
- Resh, V. H., Cardé, R. T. Encyclopedia of Insects. , 2nd ed, Academic Press. Burlington. (2009).
- DeLean, A., Munson, P. J., Rodbard, D. Simultaneous analysis of families of sigmoidal curves: application to bioassay, radioligand assay, and physiological dose-response curves. Am J Physiol. 235 (2), E97-E102 (1978).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological changes. J Morphol. 59 (2), 351-399 (1936).
- McKinney, M. L., McNamara, K. Heterochrony: the evolution of ontogeny. , Plenum Press. New York. (1991).
- Hardie, D. C., Gregory, T. R., Hebert, P. D. From pixels to picograms: a beginners' guide to genome quantification by Feulgen image analysis densitometry. J Histochem Cytochem. 50 (6), 735-749 (2002).
- Koshikawa, S., Miyazaki, S., Cornette, R., Matsumoto, T., Miura, T. Genome size of termites (Insecta, Dictyoptera, Isoptera) and wood roaches (Insecta, Dictyoptera, Cryptocercidae). Naturwissenschaften. 95 (9), 859-867 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved