Method Article
Metodi per la gestione temporanea Pupal periodi e misura di ala pigmentazione della Drosophila guttifera
In questo articolo
Riepilogo
Protocolli per la gestione temporanea di pupal periodi e misurazione della pigmentazione ala della Drosophila guttifera sono descritti. Staging e quantificazione della pigmentazione forniscono una solida base per lo studio di meccanismi di tratti di adulti e consentire interspecifico confronto tra lo sviluppo del tratto.
Abstract
Diversificato specie di Drosophila (moscerino della frutta) offrono l'opportunità di studiare i meccanismi di sviluppo e cambiamenti genetici responsabili di cambiamenti evolutivi. In particolare, la fase adulta è una fonte ricca di tratti morfologici per confronto interspecifico, compreso il raffronto di pigmentazione di ala. Per studiare le differenze di sviluppo tra specie, osservazione dettagliata e gestione temporanea appropriata sono necessari per confronto preciso. Qui descriviamo i protocolli per la stadiazione dei periodi pupal e quantificazione della pigmentazione di ala a pois moscerino della frutta, Drosophila guttifera. In primo luogo, descriviamo il metodo di osservazione morfologica dettagliata e definizione di fasi pupal basato sulle morfologie. Questo metodo include una tecnica per la rimozione del pupario, che è il caso di chitinoso esterno della pupa, per consentire l'osservazione dettagliata delle morfologie pupale. In secondo luogo, descriviamo il metodo per misurare la durata delle fasi di pupal definite. Infine, descriviamo il metodo per la quantificazione della pigmentazione di ala sulla base di analisi di immagine utilizzando immagini digitali e software ImageJ. Con questi metodi, possiamo stabilire una solida base per il confronto di processi di sviluppo dei tratti adulti durante fasi pupal.
Introduzione
Alcune delle caratteristiche morfologiche di Drosophila sono diversificate tra specie1,2,3,4,5. Noi possiamo affrontare la questione della diversità come morfologica si pone confrontando i meccanismi di generazione di queste morfologie. Esempi di tali morfologie sono larvale Tricomi, sesso adulto pettini, apparato genitale esterno, pigmentazione addominale e ala pigmentazione6,7,8,9, 10 , 11 , 12 , 13 , 14 , 15. per studiare le differenze morfologiche tra gli adulti, osservazione e analisi delle fasi pupale sono importanti, perché il destino dell'adulti tratti è determinato nelle ultime fasi larvali e successiva morfogenesi procede durante il periodo pupa.
Negli studi di biologia dello sviluppo di Drosophila melanogaster, "ore APF" (ore dopo formazione pupal) è il metodo comune per indicare una fase pupal16. Questo sistema impiega tempo assoluto dopo formazione pupal e molto comodo per gli esperimenti di routine. Tuttavia, velocità inerente allo sviluppo possono differire tra pupe e può essere influenzata da lievi differenze genetiche, epigenetiche o microambientali, e quindi avere lo stesso tempo assoluto dopo formazione pupal non garantisce che le pupe sono allo stesso Stadio di sviluppo. In molti casi, fasi definite da caratteristiche morfologiche sono preferibili per il confronto di più individui. Soprattutto, un confronto tra specie richiede stadiazione precisa e confronto tra le fasi (omologhi) corrispondente.
Bainbridge e Bownes17 riconosciuto 20 fasi pupal (P1 a P15(ii)) basata su caratteristiche morfologiche di Drosophila melanogaster pupe. Questa messa in scena è il sistema più diffuso di gestione temporanea dello sviluppo morfologico18. In uno studio precedente, abbiamo effettuato pupal messa in scena di Drosophila guttifera per stabilire una base per ala pigmentazione studi19. D. guttifera ha un modello di pois neri sulle ali ed è una delle specie modello per ala pigmentazione formazione20. Anche se abbiamo fatto riferimento ai criteri morfologici descritti nella Bainbridge e 'Bownes ricerca17, abbiamo misurato direttamente le durate fase di osservazioni di serie19, invece di utilizzare Bainbridge e 'Bownes stima delle durate di fase da frequenza osservata. Qui descriviamo il metodo di stadiazione pupal e misurazione delle durate delle fasi pupal di Drosophila utilizzato Fukutomi et al.19.
Per studiare il meccanismo inerente allo sviluppo della pigmentazione di ala, abbiamo bisogno di sapere quando nelle fasi di pupal o adulti la pigmentazione si verifica. Fukutomi et al. 19 quantificato densità ottica (ODs) di pigmentazione, pupa e adulto nella fase di analisi dell'immagine di immagini di ala. La pigmentazione delle ali di Drosophila è pensata per essere causato da accumulo di melanina nera21. Per la quantificazione dell'ODs, immagini in scala di grigio e ImageJ software (https://imagej.nih.gov/ij/)22 sono stati usati. Per riconoscere e quantificare la pigmentazione posto specifico (ΔOD), sottraiamo il OD di fuori di un posto dal OD all'interno di un punto. Per rendere questo metodo riproducibile ed obiettivo, dovrebbero essere determinati i posti di misura OD utilizzando le vene ala come punti di riferimento. In questo articolo, descriviamo in dettaglio questo metodo di quantificazione della pigmentazione di ala in Drosophila guttifera.
Protocollo
1. volare stock
- Utilizzare Drosophila guttifera per tutti i protocolli seguenti.
- Utilizzare fiale di plastica (diametro 25 mm x altezza 96 mm) e spine di cellulosa (diametro 23 mm x altezza 26 mm) per la manutenzione d'archivio. Utilizzare un cibo di farina di mais/zucchero/lievito/agar standard e seguire una pubblicazione descritto tre altre ricette alternative per questa specie2.
Nota: d. guttifera (numero di azioni 15130-1971.10) è fornito da drosofila specie Stock Center presso la University of California, San Diego. Anche se d. guttifera appartiene il immigrans-tripunctata radiazione, che è legato alla lontana d. melanogaster all'interno del genus23, ha molte proprietà biologiche in comune con D. melanogaster . Di conseguenza, questo protocollo può essere applicato per molte specie di Drosophila , sebbene alcune specie richiedono alimenti specifici e/o suggerimenti tecnici per mantenere loro2.
2. osservazione della pupa e definizione delle fasi pupal
Nota: La pupa per l'osservazione è preso dal magazzino Vola mantenuto con un 12:12 ciclo di luce/buio h a 25 ° C. Bainbridge e Bownes17 descritto un basso rischio di d. melanogaster pupe in movimento dal posto originale di impupamento su un pezzo di carta velina inumidito (97% sopravvivenza di 946 pupe spostati). D. guttifera pupe possono essere preparati con essenzialmente lo stesso metodo.
- Posto adulti sani di Drosophila su cibi freschi (cibo di farina di mais/zucchero/lievito/agar standard) in un flaconcino di plastica (diametro 25 mm x altezza 96 mm) e lasciarli a deporre le uova. Attendere 7 giorni per ottenere postembrionale 3rd tardi.
- Posizionare 1 mL di cibo di farina di mais/zucchero/lievito/agar standard in ogni microprovetta 1,5 mL. Fare 3 fori con 2 mm di distanza nei coperchi di microprovette penetrando con una puntina per consentire la respirazione.
- Centrifugare la provetta con cibo per 7 s in una microcentrifuga mini (860 x g).
- Capovolgere e toccare fiale per rimuovere tutti gli adulti dal flaconcino.
- Versare 5-10 mL di ddH2O (o acqua di osmosi inversa) nel flaconcino.
- Riversare le larve con acqua in una plastica di Petri (diametro 90 mm x altezza 15 mm). Identificare postembrionale 3rd tardi dalla loro dimensione corporea grande (3-4 mm di lunghezza).
- Spostare delicatamente fine 3 ° instar larve con il forcipe in microprovette con cibo (10 larve / conetti). Incubare per una notte a 25 ° C.
- Spostare la neonata pupe su un pezzo di carta velina che è stato inumidito di ddH2O e collocato in una capsula di Petri di plastica (diametro 35 mm x altezza 10 mm).
- Posizionare la piastra di Petri in una camera umida (contenente 10 mL di ddH2O nella parte inferiore) e attendere che le pupe sviluppano fino alla lavorazione.
- Spostare le pupe su un pezzo inumidito di carta velina in una capsula di Petri di plastica (diametro 60 mm x altezza 15 mm).
Nota: La definizione delle fasi può principalmente essere fatto a basato sulle fasi di d. melanogaster17. In genere, il periodo pupa di Drosophila possa essere classificato in P1 - P15(ii), anche se alcune modifiche di definizione del piano sarebbe necessarie a seconda della specie utilizzata. Se possibile, rimuovere il pupario consente osservazione precisa e dettagliata. Vedi i dettagli qui di seguito (passaggio 3). - Osservare pupe sotto un microscopio stereo. Scattare fotografie utilizzando una fotocamera digitale collegata al microscopio stereo.
3. rimozione pupario
Nota: Pupe di Drosophila sono coperti da una struttura denominata il pupario. Un insetto dei Muscomorpha (mosche) non lasci sua cuticola larvale all'impupamento; invece, indurisce la cuticola dopo apolysis e lo utilizza come un coperchio di protezione della pupa, il pupario24. Una pupa che risiedono all'interno di un pupario ha una cuticola Pupa vera, che è molto morbido e fragile. Prima apolysis si svolge attorno P4(ii), epiteli e pupario sono legati insieme, e quindi rimuovere il pupario senza danni è molto difficile. Dopo P5, rimuovendo il pupario è laboriosa, ma utile per l'osservazione morfologica e definizione delle fasi pupal. Il processo è effettuato come segue.
- Apporre un pezzo di nastro biadesivo su un pezzo di carta assorbente.
- Posizionare una pupa sul lato ventrale di nastro biadesivo a (Figura 1A).
- Individuare lo spazio tra il lato anteriore del pupario e la pupa interna. Afferrare e rimuovere il pupario intorno a questa lacuna utilizzando forcipe ed esporre il lato anteriore della testa della pupa.
- Inserire la punta di un forcipe con un movimento parallelo all'asse antero-posteriore. Sollevare la punta della pinza per rompere localmente il pupario. Ripetere l'operazione fino a quando la rottura raggiunge la parte posteriore del pupario. Garantire che un divario è inoltre formato tra il pupario e gambe pupale e rompere il lato ventrale del pupario e minimizzare i danni alla pupa interno (Figura 1B).
- Dopo la rottura del pupario per quanto possibile, estrarre la pupa con un pennello fine (n. 5/0) (Figura 1).
- Posizionare la pupa su un pezzo di carta velina che è stato inumidito con ddH2O e collocato in una capsula di Petri di plastica (diametro 60 mm x altezza 15 mm). Scattare fotografie appena possibile perché la pupa esposta è vulnerabile e facilmente diventa secca.
Nota: Pupe senza un pupario non sono adatti a misurare le durate dei periodi pupale (passaggio 4), perché lo stress (ad esempio di essiccazione) e danni fisici potrebbero interferire con il normale sviluppo.
4. misurare le durate delle fasi pupal
- Preparare delle crisalidi per misurare durate delle fasi pupal come descritto nel passaggio 2. Raccogliere le pupe di 1-2, 2-3 e 3-4 giorni dopo la formazione pupale (20 delle crisalidi). Dare numeri di identificazione individuale (1-60) di pupe per identificazione. Continuare la raccolta appena formata pupe durante la procedura seguente, per ottenere 20 più giovane pupe. Dare numeri di identificazione individuale (61-80) per la neonata pupe. Posizionare una pupa su un pezzo di ddH2inumidito O carta velina in un pozzo (3,9 cm2) di una piastra di coltura delle cellule 12-pozzetti (1 pupa/pozzetto, 12 pupe/piatto). Riempire lo spazio inter-bene di piastre con ddH2O per mantenere l'umidità, mettere i coperchi e posizionare le piastre a 25 ° C, condizioni di luce costante (24:0 h chiaro/scuro).
Nota: Pupe senza un pupario non sono adatti a misurare le durate dei periodi pupal. Si prega di non rimuovere il pupario. - Osservare le caratteristiche morfologiche compreso colore corpo, setole, tubuli malpighiani e corpo giallo di tutte le pupe, una volta ogni 30 min e record osservato fasi (P1 - P15(ii), basato sui riferimenti17,19) in un foglio di conteggio.
- Continuare a registrare oltre quattro giorni di fila (96h) da uno spostamento di rotazione di tre (o più) persone.
- Contare i numeri dei record di ogni particolare fase e la loro media (media conte di osservazioni / pupe). Quindi le moltiplica per 0,5 (h), conseguente la lunghezza stimata delle fasi (h).
5. misurazione dell'intensità delle macchie nere su un ala
Nota: L'intensità delle macchie nere su un'ala pupa o adulta può essere quantificato misurando la densità ottica (OD). Viene utilizzato un filtro di vetro con noti ODs (filtro a densità gradini) per taratura25, così che si può calcolare il diametro esterno di un'area particolare da un'immagine digitale di un'ala. OD in un posto e l'OD di fuori del posto sono misurati, e quest'ultimo viene sottratto dal precedente per ottenere l'intensità della macchia (ΔOD). Qui, descriviamo il metodo della dissezione, misurazione e calcolo di ΔOD. Questa procedura può essere fatto dopo il passaggio 2, indipendente dal passaggio 3 e passaggio 4. Una volta che uno ha eseguito il passaggio 2 e comprende tutte le fasi di pupal, si può direttamente iniziare o ripetere il passaggio 5.
- Preparazione immagine
- Preparare una nuova pupa di una fase focale come descritto nel passaggio 2. Rimuovere la parte anteriore di un pupario con le pinzette. Estrarre la pupa usando il forcipe e posizionarlo in tampone fosfato salino (PBS, tabella 2) in una capsula di Petri di plastica (diametro 35 mm x altezza 10 mm).
- Tagliare l'articolazione basale di un'ala (articolazione basale è la stretta parte prossimale dell'ala). Come l'ala è piegata, metterlo in una capsula di Petri di plastica (diametro 35 mm x altezza 10mm) riempito con ddH2O di estenderla di pressione osmotica (l'ala si sviluppa da sè).
- Raccogliere appena obtecta adulti una volta ogni 10 min da un flaconcino stock. Anestetizzare una Mosca con CO2 utilizzando un pad anestetizzante di CO2 , confermare amputate dall'immobilità e tagliare l'articolazione basale di un'ala.
- Posto 10 µ l di PBS su un vetrino, posizionare l'ala c'e coprire con un vetrino coprioggetto (18 x 18 mm).
- Accendere la luce del microscopio stereo. Impostare la luce per essere al massimo livello. Impostare la lente dell'obiettivo 11.5 X. Impostare il diaframma per essere stato più aperto. Accendere la fotocamera. Impostare la fotocamera per essere (ISO: 100, modalità SHQ 3136 x 2352 pixel, velocità otturatore: 1/20 s). Concentrarsi sull'esempio spostando la manopola di messa a fuoco del microscopio.
- Spingere il pulsante di scatto dell'unità telecomando per prendere un'immagine. Prendere 3 immagini per ala, ognuno dei quali deve essere centrato su un campaniform sensillum, nervatura trasversale spot o posteriore della vena longitudinale, posizionamento la parte distale dell'ala sul lato sinistro e la parte anteriore dell'ala sul lato superiore.
- Calibrazione
- Prendere le immagini di 9 parti di un filtro di densità con gradino utilizzando le stesse impostazioni di fotocamera utilizzate per ottenere l'immagine di ala.
- Avviare ImageJ software (https://imagej.nih.gov/ij/)22.
- Fare clic su File | Aperto | e selezionare una delle immagini del filtro densità gradini.
- Fare clic su immagine di | Tipo | 8 bit | per convertire l'immagine in un'immagine a 8 bit.
- Fare clic su modifica | Selezione | Specificare | e controllare la colonna ovale e centrato . Scrivere 100 (pixel) nella larghezza colonna, 100 (pixel) in altezza colonna, 1568 nella colonna coordinata X e 1176 nella colonna coordinata Y . Fare clic su OK.
- Fare clic su analisi | Misura |. Il "valore grigio medio" delle aree selezionate è misurati.
- 5.2.3 ripetere. a 5.2.6. per 8 immagini in alto.
- Fare clic su analisi | Calibrare selezionare Rodbard25 nella colonna funzione e scrivere il numero riportato nella colonna di destra nel mezzo (0,04, 0,336, 0.632, 0.928, 1.224, 1,52, 1.816, 2.112, 2,408; questi numeri dipendono dalla densità del filtro a densità a scalino).
- Verifica taratura globale colonna e fare clic su OK.
Nota: Eseguendo questa procedura, "valore di grigio medio" viene convertiti in "densità ottica (OD)" utilizzando la funzione di Rodbard. Dopo questo passaggio, densità ottica può essere calcolato per una particolare area selezionata nel software ImageJ.
- Scegliere area di misurazioni
Nota: Le macchie sono in genere associati a punti di riferimento, come campaniform sensilli, vena longitudinale suggerimenti e nervature trasversali. Questi e altri punti di riferimento su un'ala può essere utilizzati per scegliere la regione di misurazioni. Qui, un esempio inD. guttifera(Figura 2) è descritto.- Definizione del punto A, punto sensillum campaniform.
- Aprire un'immagine in cui un posto di sensillum campaniform è al centro dell'immagine. Fare clic su immagine di | Tipo | 8 bit | per convertire l'immagine in un'immagine a 8 bit.
- Fare clic su rettangolo nell'Area strumenti di selezione e disegnare un rettangolo. Impostare il vertice superiore sinistro del rettangolo in modo che è attaccato alla linea posteriore della vena longitudinale terza e più distale da un punto di sensillum campaniform. Impostare il lato destro del rettangolo in modo che si trova a destra della sensillum campaniform spot.
- Fare clic su modifica | Selezione | Aggiungere al gestore |. Controllare la colonna Mostra tutto .
- Fare clic su strumento angolo in Linea strumenti di selezione. Disegnare la prima linea su linea posteriore della terza vena longitudinale. Impostare gli endpoint sinistro della linea sul vertice del rettangolo disegnato nel passaggio 1. Disegnare la seconda linea sul lato superiore del rettangolo. Premere il tasto "m" per misurare l'angolo tra le due linee disegnate in questo passaggio. Fare clic sulla finestra dell'immagine sullo schermo del computer.
- Fare clic su modifica | Selezione | Aggiungere al gestore |.
- Fare clic su rettangolo nell'Area strumenti di selezione e disegnare un rettangolo di circa 1/9 la dimensione della finestra immagine. Fare clic su modifica | Selezione | Ruotare |. Scrivere i gradi meno dell'angolo misurato al punto 5.3.1.4. nella colonna angolo e fare clic su OK per ruotare il rettangolo disegnato in questo passaggio.
- Spostare il rettangolo disegnato nel passaggio 5.3.1.6. utilizzando i tasti freccia. Impostare il punto finale della linea posteriore della seconda vena longitudinale sul lato sinistro del rettangolo e il lato inferiore del rettangolo attaccato alla linea posteriore della terza vena longitudinale. Confermare che in questa procedura viene disegnata una linea perpendicolare dal punto finale della seconda vena longitudinale alla linea posteriore della terza vena longitudinale. Definire il piede della linea perpendicolare come punto A (Figura 2A).
- Registrare la coordinata x e la coordinata y del punto A, indicato di seguito Area strumenti di selezione quando si posiziona il cursore sul punto A.
- Definizione del punto B, vena longitudinale punta spot
- Aprire un'immagine in cui un posto di punta di vena longitudinale è al centro dell'immagine. Fare clic su immagine di | Tipo | 8-bit | per convertire l'immagine in un'immagine a 8 bit.
- Ripetere la stessa procedura descritta al punto 5.3.1. (Definizione del punto A, campaniform sensillum spot) per trovare il punto A nell'immagine.
- Fare clic su modifica | Selezione | Aggiungere al gestore |.
- Fare clic su rettangolo nell'Area strumenti di selezione e disegnare un rettangolo. Impostare il vertice superiore sinistro del rettangolo nel punto finale della linea posteriore della terza vena longitudinale.
- Fare clic su modifica | Selezione | Aggiungere al gestore |.
- Fare clic su strumento angolo in Linea strumenti di selezione. Disegnare la prima linea per collegare il punto A e il punto finale della linea posteriore della terza vena longitudinale. Definire questa linea come linea A. tracciare la seconda linea sul lato superiore del rettangolo disegnato nel passaggio 5.3.2.4. Premere il tasto "m" per misurare l'angolo tra le due linee.
- Fare clic su modifica | Selezione | Aggiungere al gestore |.
- Fare clic su rettangolo nell'Area strumenti di selezione e disegnare un rettangolo di circa 1/9 la dimensione della finestra immagine. Fare clic su modifica | Selezione | Ruotare |. Scrivere i gradi meno dell'angolo misurato nel passaggio 5.3.2.6. nella colonna angolo e fare clic su OK per ruotare il rettangolo disegnato in questo passaggio. Spostare il rettangolo utilizzando i tasti freccia. Impostare il lato superiore del rettangolo in modo che è collegato alla linea A e il punto finale della linea anteriore della quarta vena longitudinale che è sul lato sinistro del rettangolo.
- Fare clic su modifica | Selezione | Aggiungere al gestore |.
- Fare clic su rettangolo nell'Area strumenti di selezione e disegnare un rettangolo di circa 1/9 la dimensione della finestra immagine. Fare clic su modifica | Selezione | Ruotare |. Scrivere i gradi meno dell'angolo misurato nel passaggio 6 nella colonna angolo e fare clic su OK per ruotare il rettangolo disegnato in questo passaggio. Spostare il rettangolo utilizzando i tasti freccia. Impostare il vertice inferiore sinistro del rettangolo in modo che è al vertice superiore sinistro del rettangolo disegnato nel passaggio 5.3.2.8., risultante nell'ottenere la linea perpendicolare dal punto finale della linea anteriore della quarta vena longitudinale per linea A. definire il punto di intersezione della linea perpendicolare e la linea posteriore della terza vena longitudinale come punto B (Figura 2B).
- Registrare la coordinata x e la coordinata y del punto B, sotto Area strumenti di selezione indicato quando si posiziona il cursore sul punto B.
- Definizione del punto C, nervatura trasversale posteriore posto
- Aprire un'immagine in cui un posto di nervatura trasversale posteriore è al centro dell'immagine. Fare clic su immagine di | Tipo | 8-bit | per convertire l'immagine in un'immagine a 8 bit.
- Definire punto C come il punto più posteriore della linea anteriore della quarta vena longitudinale nell'area di intersezione della nervatura trasversale posteriore e la quarta vena longitudinale (Figura 2).
- Registrare la coordinata x e la coordinata y del punto C, indicato di seguito Area strumenti di selezione quando si posiziona il cursore sul punto C.
- Definizione del punto D, zona di controllo
- Aprire un'immagine in cui un posto di sensillum campaniform è al centro dell'immagine. Fare clic su immagine di | Tipo | 8 bit | per convertire l'immagine in un'immagine a 8 bit.
- Fare clic su dritto in Linea selezione strumenti e disegnare una linea che collega il punto finale della linea anteriore della seconda vena longitudinale e il punto finale della linea posteriore della quarta vena longitudinale. Definire il punto D come il punto di incrocio di questa linea e la linea posteriore della terza vena longitudinale (Figura 2D).
- Registrare la coordinata x e la coordinata y del punto D, sotto Area strumenti di selezione indicato quando si posiziona il cursore sul punto D.
- Definizione del punto A, punto sensillum campaniform.
- Misure
- Aprire una delle immagini di spot di ala (per misurazione del punto A, aprire l'immagine con un punto nel centro). Fare clic su immagine di | Tipo | 8 bit | per convertire l'immagine in un'immagine a 8 bit.
- Fare clic su rettangolo nell'Area strumenti di selezione e disegnare un rettangolo di circa 1/9 di dimensione della finestra immagine.
- Fare clic su modifica | Selezione | Specificare |. Controllare la colonna ovale e centrato . Aggiungere 100 (pixel) in colonne di larghezza e altezza , scrivere le coordinate x del punto A (o punto B o punto C) e D nella colonna coordinata X e scrittura il y le coordinate del punto A (o punto B o punto C) e D nella colonna coordinata Y . Fare clic su OK.
- Fare clic su analisi | Misura |. Se già terminata la calibrazione descritta al punto 5.2, ODs sono indicati nella colonna di dire .
- Calcolare ΔODs sottraendo OD del punto D da ODs di punti A, B e C.
Nota: Punto D si trova in una parte trasparente dell'ala e non include la pigmentazione e quindi è adatto per un controllo di sfondo.
Risultati
Il periodo pupa di d. guttifera è diviso in 17 tappe (P1 - P15(ii); immagini del rappresentante tre fasi (P1, P5 - 6, P10) sono mostrati nella figura 3e 17 tutte le fasi sono illustrate nella Figura 4). Anche Bainbridge e Bownes17 riconosciuto 20 tappe in d. melanogaster, alcune di queste fasi non poteva essere applicata a d. guttifera. L'ordine di due eventi inerenti allo sviluppo, l'aspetto del corpo giallo (massa di cellule capannone all'interno del midgut26) e la tempistica di tubuli malpighiani svolta verde, non sono rigorosamente controllati in d. guttifera, e quindi non abbiamo potuto separare P5 (i ), P5(ii) e P6. Inoltre, a differenza di in d. melanogaster, la tempistica di annerimento delle setole toraciche ed addominale è stata sincronizzata, e pertanto non abbiamo potuto separare P11(i) e P11(ii)19.
Abbiamo potuto misurare la lunghezza delle fasi pupal di d. guttifera (tabella 3, da Fukutomi et al.19). L'intero periodo pupa è più lungo di quello di d. melanogaster a 25 ° C17circa 20 h. Abbiamo calcolato ΔODs delle zone intorno a un campaniform sensillum, la punta di vena longitudinale e la nervatura trasversale posteriore. Qui, indichiamo l'ODs e ΔODs negli adulti 7 giorni dopo eclosion (tabella 4). Confrontando i dati di varie tappe, abbiamo trovato che la fase P12(i) è la tempistica di insorgenza della pigmentazione, e quella pigmentazione è completata da 24 h dopo eclosion (Figura 5, dalle misure di originale utilizzato in Fukutomi et al. 19).
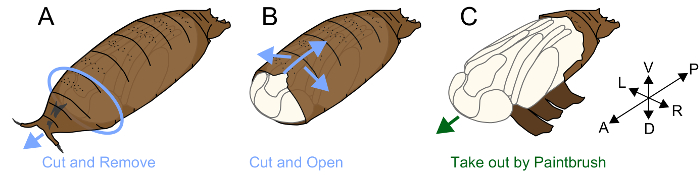
Figura 1. Illustrazione di rimozione pupario. (A) posto un lato ventrale di pupa fino su un pezzo di nastro biadesivo. Rimuovere la parte anteriore del pupario. (B) rompere il pupario con forcipe dal lato ventrale. (C) dopo la rottura del pupario, estrarre la pupa con un pennello. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2. Definizione della zona per la misurazione della pigmentazione. (A) punto A per un posto connesso con un sensillum campaniform. (B) il punto B per un posto connesso con una punta di vena longitudinale. (C) la lettera C per un posto connesso con una vena trasversale posteriore. (D) lettera D per una zona di controllo. Barre della scala indicano 250 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3. Esempi di precise fasi pupal. (A) la pupa della fase P1 è ricoperta di pupario. (B) pupa della fase P5 - 6. (C) Pupa della fase P10. Il puparia vengono rimossi prima dell'osservazione in (B) e (C). Barre della scala indicano 500 µm. Clicca qui per visualizzare una versione più grande di questa figura.
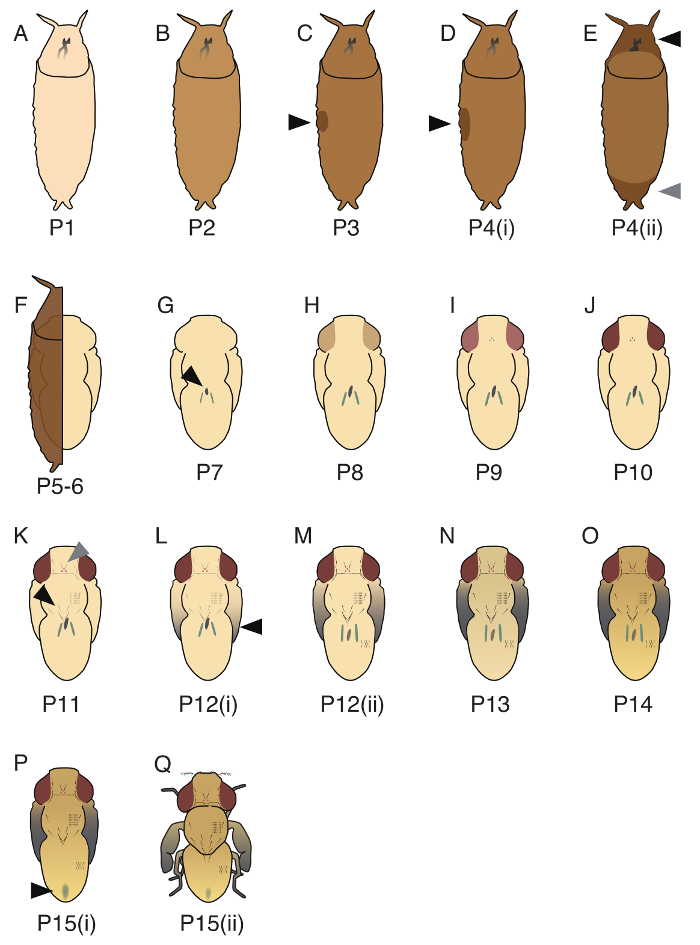
Nella figura 4. Illustrazioni di 17 fasi pupal identificati in d. guttifera. (A) P1, il pupario è bianco. (B) P2, il colore del pupario è marrone chiaro. (C) P3, una bolla è osservata nella parte laterale (freccia nera). (D) P4(i), la bolla è più grande di quello in P3 (freccia nera), e la pupa è capace di galleggiare in PBS. (E) P4(ii), un divario si osserva nella parte anteriore (punta di freccia nera) e la parte posteriore (triangolino grigio). (F) P5 - 6, Malpighian tubuli migrano (difficile da vedere se coperto da pupario). La forma pupal è formata da epitelio pupal e cuticola pupa. (G) P7, il corpo giallo può essere osservato nella parte dorsale (freccia nera). (H) P8, gli occhi sono gialli. (I) P9, gli occhi sono ambra. (J) P10, gli occhi sono di colore rossi. (K) P11, orbitale e ocellare setole (triangolino grigio), vibrisse, macrochaetae toracica (freccia nera) e setole tarsali sono neri e visibili. (L) P12(i), le punte delle ali sono grigie. (M) P12(ii), tutte le parti delle ali sono di colore grigio (freccia nera). (N) P13, le ali sono completamente nere. (O) P14, la testa e le gambe sono completamente oscurabile. (P) P15(i), il meconio può essere osservato sulla parte dorsale dell'addome (freccia nera). (Q) P15(ii), la Mosca è schiusura. Dettagli di queste fasi sono stati descritti in Fukutomi et al. 19 Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5. Sviluppo della pigmentazione intorno un sensillum companiform su un'ala. Cerchi indicano singoli ΔODs e barre orizzontali indicano medie. P10: n = 10, P11: n = 10, 12(i): n = 10, P15(i): n = 11, 3 h: n = 8, 24 h: n = 7, 7 giorni: n = 10. Clicca qui per visualizzare una versione più grande di questa figura.
| Componente | |
| Zucchero bianco morbido | 51,6 g |
| Farina di mais | 172,4 g |
| Granulosità di cereale - C | 86,4 g |
| Lievito di birra secco | 106 g |
| Agar in polvere | 35,28 g |
| ddH2O | 4000 mL |
| Far bollire per 30 min e lasciar raffreddare fino a 70 ° C. | |
| Aggiungere 4 g di butile p-idrossibenzoato di sodio disciolto in 40 mL di etanolo. | |
| Mescolare bene e versare 9 mL ciascuno in fiale di plastica (diametro 25 mm x altezza 96 mm). | |
Tabella 1. La composizione del cibo di farina di mais/zucchero/lievito/agar standard.
| Componente | Importo |
| NaCl | 80 g |
| KCl | 0% |
| Na2HPO4·12H2O | 29 g |
| KH2PO4 | 0% |
| ddH2O | fino a 10 L |
| impostare pH 7,4 |
Tabella 2. La composizione del PBS (1x).
| Fase | Dire di durata (h) | s.d. | n |
| P1 - 2 | 1.7 | 0.65 | 16 |
| P3 | 2.1 | 0.65 | 16 |
| P4(i) | 2.1 | 1.69 | 19 |
| P4(II) | 0.3 | 0.28 | 29 |
| P5 - 6 | 5.0 | 3.07 | 30 |
| P7 | 31,9 | 7,22 | 46 |
| P8 | 9.6 | 2.81 | 57 |
| P9 | 10,9 | 2,66 | 55 |
| P10 | 11,7 | 2.96 | 39 |
| P11 | 4.4 | 2.81 | 44 |
| P12(i) | 1.1 | 0,76 | 44 |
| P12(II) | 2.0 | 0.70 | 43 |
| P13 | 2.2 | 0,68 | 10 |
| P14 - 15(i) | 28,6 | 2,75 | 10 |
| P15(II) | 1.4 | 0,87 | 10 |
| Totale | 121.7 |
Tabella 3. Misurate le durate delle fasi pupal di guttifera d..
| OD | ΔOD | |||||||
| Campaniform sensilum | Suggerimento di vena longitudinale | Nervatura trasversale posteriore | Controllo | Campaniform sensilum | Suggerimento di vena longitudinale | Nervatura trasversale posteriore | ||
| Individuo | (Punto A) | (Punto B) | (Punto C) | (Punto D) | (Punto A - punto D) | (Punto B - punto D) | (Punto C - lettera D) | |
| 1 | 0,549 | 0.484 | 0.515 | 0,256 | 0,293 | 0.228 | 0,259 | |
| 2 | 0,529 | 0,489 | 0.516 | 0,254 | 0,275 | 0.235 | 0.262 | |
| 3 | 0,546 | 0,48 | 0.533 | 0,255 | 0.291 | 0,225 | 0,278 | |
| 4 | 0.583 | 0.496 | 0,566 | 0,255 | 0,328 | 0.241 | 0,311 | |
| 5 | 0.523 | 0,479 | 0.528 | 0.235 | 0.288 | 0,244 | 0,293 | |
| 6 | 0,572 | 0.509 | 0,546 | 0,265 | 0.307 | 0,244 | 0,281 | |
| 7 | 0.568 | 0,511 | 0,56 | 0,256 | 0,312 | 0,255 | 0.304 | |
| 8 | 0,56 | 0.507 | 0,562 | 0,27 | 0,29 | 0.237 | 0.292 | |
| 9 | 0.551 | 0,485 | 0,569 | 0,259 | 0.292 | 0.226 | 0,31 |
Tabella 4. Misurato ODs e ΔODs di guttifera d. adulti 7 giorni dopo eclosion.
Discussione
Descriviamo qui i protocolli per la definizione delle fasi pupal, rimuovendo il pupario per osservazione dettagliata, misurano la durate delle fasi pupal e misurazione dell'intensità delle macchie nere su un'ala a d. guttifera. Questi protocolli possono essere applicati per molti Drosophila e relative specie volare, soprattutto con la pigmentazione di ala.
Descrizione degli eventi inerenti allo sviluppo più dettagliati e approfondita osservazione consentirebbe ulteriore suddivisione delle fasi. In molti casi, un evento inerente allo sviluppo che richiede la dissezione o sezionamento di una pupa non è adatto per la definizione del piano, perché uno deve uccidere una pupa per la stadiazione e continuare ad utilizzare quell'individuo è difficile. Per l'utilizzo di una nuova specie di Drosophila , uno dovrebbe impiegare distinguibili da fuori il pupario eventi dello sviluppo come il primo passo. A seconda dello scopo dello studio, uno può quindi suddividere ulteriormente le fasi basato sul particolare organogenesi o altri eventi inerenti allo sviluppo.
Per confronto interspecifica delle fasi multiple, una potenziale difficoltà è un'inversione dell'ordine di eventi dello sviluppo tra specie (eterocronia27). Ad esempio, in d. melanogaster, l'anatomista diventa verde e poi il corpo giallo diventa visibile, considerando che questo ordine può essere invertito in alcune pupe di guttifera d.19. In tal caso, è difficile confronto strict tra fasi omologhe. A seconda il fenomeno di interesse, uno potrebbe essere necessario ri-definire o suddividere una fase particolare basata su un evento inerente allo sviluppo. Ad esempio, possiamo approssimativamente selezionare pupe di P5 - 6 e fare interspecifico confronto di espressioni geniche nelle ali pupale utilizzando morfologia alare come indicatore di temporizzazione dello sviluppo14.
In genere, ci vogliono 10-30 min per rimuovere il pupario. Se si vuole osservare una tappa breve, pupe dovrebbero essere preparati tenendo conto del tempo che passa durante la rimozione del pupario. Ad esempio, se si vuole osservare P12(i) di d. guttifera, che ha solo 1,1 h durata, preparazione di pupe a P11 darebbe un buon risultato.
Nel nostro protocollo, inumidito carta velina viene utilizzato per lo sfondo delle immagini pupal. A seconda della fase di osservazione e strutture uno vuole mostrare in una figura, uno può usare la carta velina bianca o nera. Per il P3 per la transizione di P4(ii), la posizione della bolla in pupa è importante per distinguere fasi e carta velina nera aiuta a rispettare la posizione della bolla. Per le fasi dopo P5, carta velina bianca è meglio perché aiuta a osservare il corpo giallo, colore degli occhi, setole e colore del corpo.
Bainbridge e Bownes17 stima la durata delle fasi pupal dalla loro frequenza di comparsa. La tabella di gestione temporanea è quello più ampiamente usato per d. melanogaster18. Per il loro metodo, hanno preparato quattro bottiglie di cibo contenente cinque femmine e cinque maschi adulti e li ha tenuti al buio, e quindi pupe sono state prese a caso da una bottiglia ogni alle 11, 12, 13 e 14 giorni dopo l'inizio della deposizione delle uova. Hanno contato il numero di pupe in fasi particolari e calcolate le medie. La lunghezza di ogni stadio pupale potrebbe essere stimata in base i dati della durata totale del periodo pupa e questi dati di frequenza. Un problema con questo metodo è che non può essere utilizzato per stimare la durata precisa di fasi pupal se la tempistica dello sviluppo tende a essere sincronizzato tra pupe.
In realtà, abbiamo provato il metodo Bainbridge e di Bownes in d. guttifera, e abbiamo ottenuto dati distorto a causa della sincronizzazione tra pupe. Non potremmo identificare la causa di questo fenomeno, ma alcune possibilità sono 1) pupe mantenuto ritmo circadiano dal loro stadio giovane e/o 2) hanno reagito alle esposizioni alla luce che si è verificato in osservazione. Pertanto, abbiamo deciso di misurare la durata reale della fase di osservazione diretta. Questo riduce al minimo il pregiudizio causato da ritmo circadiano.
Il metodo qui descritto è un metodo per quantificare supplementare accumulo di melanina nei punti rispetto alla loro circostante zona di controllo (ΔOD), sottraendo il diametro esterno della zona di controllo dal OD della zona spot. Questo metodo è stato ispirato da un metodo per quantificare il contenuto di DNA nucleare di Feulgen macchiatura e analisi delle immagini (densitometria28,29). Come uno dei potenziali problemi per l'applicazione di questo metodo alla pigmentazione ala, ΔOD può essere un valore negativo, soprattutto quando una pupa è molto giovane e non ha quasi nessuna pigmentazione. Nelle fasi successive, ci potrebbero essere alcuni pigmentazione nell'area di controllo. L'uso del semplice OD della zona spot stesso potrebbe essere appropriato anziché ΔOD a seconda dello scopo dello studio. Nel caso di d. guttifera, uso del semplice OD invece di ΔOD non ha cambiato la tendenza dei dati o le conclusioni dello studio.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi.
Riconoscimenti
Ringraziamo Sean B. Carroll e Thomas Werner per fornire scorte volare, Naoyuki fusibile per attrezzature, Byung Seok Jin per la sua assistenza nella contaminazione, Kiyokazu Agata per tutoraggio ed Elizabeth Nakajima per l'editing di inglese. Questo lavoro è stato supportato da KAKENHI 17K 19427 e Takeda Science Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| Drosophila guttifera | The Drosophila Species Stock Center at the U.C. San Diego | 15130-1971.10 | Drosophila guttifera, a fruit fly species used in this article |
| Plastic vial | Hightech | MKC-30 | Plastic vial, for fly stock maintenance |
| Buzz plugs vial and bottle closures for glass vials | Fisher Scientific | AS-271 | Cellulose plug, for fly stock maintenance |
| White soft sugar | Mitsui Sugar | J-500g | White soft sugar, for standard cornmeal/sugar/yeast/agar food |
| Corn flour | Nippon Flour Mills | F | Corn flour, for standard cornmeal/sugar/yeast/agar food |
| Corn grits - C | Nippon Flour Mills | GC | Corn grits - C, for standard cornmeal/sugar/yeast/agar food |
| Agar powder | Matsuki Kanten Sangyo | No.602 | Agar powder, for standard cornmeal/sugar/yeast/agar food |
| Dry beer yeast | Asahi Food & Healthcare | Y2A | Dry beer yeast, for standard cornmeal/sugar/yeast/agar food |
| Butyl p-hydroxybenzoate | Nacalai Tesque | 06327-02 | Butyl p-hydroxybenzoate, for standard cornmeal/sugar/yeast/agar food |
| Ethanol | Wako | 057-00456 | Ethanol, for standard cornmeal/sugar/yeast/agar food |
| Flat bottom microtube | Ina Optica | CF-0150 | 1.5 mL microtube, for collecting pupae |
| CAPSULEFUGE | Tomy | PMC-060 | Mini microcentrifuge, for collecting pupae |
| Sterilized Schale NB | Sansei Medical | 01-013 | Plastic Petri dish (diameter 90 mm x height 15 mm) |
| Serum tube rack | Iwaki | 9796-050 | Used as a moist chamber, for observation of pupa |
| Corning Falcon Easy-Grip tissue culture dish | Corning | 353001 | Plastic Petri dish (diameter 35 mm x height 10 mm) |
| Falcon standard tissue culture dish | Corning | 353002 | Plastic Petri dish (diameter 60 mm x height 15 mm) |
| Push-pin | Kokuyo | 51233709 | Push-pin, for making pinholes on the microtube lid |
| Stereomicroscope | Olympus | SZX16 | Stereomicroscope, for morphological observation |
| Digital camera | Olympus | DSE-330-A | Digital camera, for imaging |
| NICETACK double sided tape | Nichiban | NW-15SF | Double sided tape, for removing puparium |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | Forceps, for removing puparium |
| Van Gogh VISUAL Paint brush | Talens Japan | GWVR-#5/0 | Paint brush, for removing puparium |
| Greiner CELLSTAR 12 well cell culture plate | Merck | 665-180 | 12-well cell culture plate, for measuring durations of pupal periods |
| NaCl | Wako | 191-01665 | NaCl, for PBS |
| KCl | Nacalai Tesque | 285-14 | KCl, for PBS |
| Na2HPO4·12H2O | Wako | 196-02835 | Na2HPO4·12H2O, for PBS |
| KH2PO4 | Nacalai Tesque | 28721-55 | KH2PO4, for PBS |
| Stepped Neutral Density (ND) Filter 0.04 - 3.0 | Edmund Optics | 64-384 | Stepped density filter, for calibration of pigmentation measurement |
| ImageJ software | NIH | 1.8.0-101 | ImageJ software, for measurement of intensity of black spots on a wing (https://imagej.nih.gov) |
| FINE FROST glass slide | Matsunami Glass Ind | FF-001 | Glass slide, for measurement of intensity of black spots on a wing |
| Square microscope cover glass 18 x 18 | Matsunami Glass Ind | C018181 | Cover slip, for measurement of intensity of black spots on a wing |
Riferimenti
- Carson, H. L., Hardy, D. E., Spieth, H. T., Stone, W. S. The evolutionary biology of the Hawaiian Drosophilidae. Essays in evolution and genetics in honor of Theodosius Dobzhansky. Hecht, M. K., Steere, W. C. , Springer (Meredith Corporation). New York. 437-543 (1970).
- Markow, T. A., O'Grady, P. M. Drosophila: a guide to species identification and use. , Academic Press. New York. (2006).
- Patterson, J. T. The Drosophilidae of the southwest. 4313, University of Texas Publication. 7-216 (1943).
- Setoguchi, S., Takamori, H., Aotsuka, T., Sese, J., Ishikawa, Y., Matsuo, T. Sexual dimorphism and courtship behavior in Drosophila prolongata. J Ethol. 32 (2), 91-102 (2014).
- Werner, T., Jaenike, J. Drosophilids of the Midwest and Northeast. , River Campus Libraries, University of Rochester. Rochester. (2017).
- Arnoult, L., et al. Emergence and diversification of fly pigmentation through evolution of a gene regulatory module. Science. 339 (6126), 1423-1426 (2013).
- Camino, E. M., Butts, J. C., Ordway, A., Vellky, J. E., Rebeiz, M., Williams, T. M. The evolutionary origination and diversification of a dimorphic gene regulatory network through parallel innovations in cis and trans. PLoS Genet. 11 (4), e1005136(2015).
- Gompel, N., Prud'homme, B., Wittkopp, P. J., Kassner, V. A., Carroll, S. B. Chance caught on the wing: cis-regulatory evolution and the origin of pigment patterns in Drosophila. Nature. 433 (7025), 481-487 (2005).
- Glassford, W. J., et al. Co-option of an ancestral Hox-regulated network underlies a recently evolved morphological novelty. Dev. Cell. 34 (5), 520-531 (2015).
- Koshikawa, S. Enhancer modularity and the evolution of new traits. Fly. 9 (4), 155-159 (2015).
- Koshikawa, S., et al. Gain of cis-regulatory activities underlies novel domains of wingless gene expression in Drosophila. Proc Natl Acad Sci U S A. 112 (24), 7524-7529 (2015).
- McGregor, A. P., et al. Morphological evolution through multiple cis-regulatory mutations at a single gene. Nature. 448 (7153), 587-590 (2007).
- Tanaka, K., Barmina, O., Kopp, A. Distinct developmental mechanisms underlie the evolutionary diversification of Drosophila sex combs. Proc Natl Acad Sci U S A. 106 (12), 4764-4769 (2009).
- Werner, T., Koshikawa, S., Williams, T. M., Carroll, S. B. Generation of a novel wing colour pattern by the Wingless morphogen. Nature. 464 (7292), 1143-1148 (2010).
- Wittkopp, P. J., et al. Intraspecific polymorphism to interspecific divergence: genetics of pigmentation in Drosophila. Science. 326 (5952), 540-544 (2009).
- Lawrence, P. A., Morata, G. Compartments in the wing of Drosophila: a study of the engrailed gene. Dev Biol. 50 (2), 321-337 (1976).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. J. Embryol. Exp. Morphol. 66, 57-80 (1981).
- Ashburner, M., Golic, K. G., Hawley, R. S. Drosophila: A Laboratory Handbook. , 2nd ed, Cold Spring Harbor Laboratory Press. New York. (2005).
- Fukutomi, Y., Matsumoto, K., Agata, K., Funayama, N., Koshikawa, S. Pupal development and pigmentation process of a polka-dotted fruit fly, Drosophila guttifera (Insecta, Diptera). Dev Genes Evol. 227 (3), 171-180 (2017).
- Koshikawa, S., Fukutomi, Y., Matsumoto, K. Drosophila guttifera as a model system for unraveling color pattern formation. Diversity and evolution of butterfly wing patterns: an integrative approach. Sekimura, T., Nijhout, H. F. , Springer. New York. in press (2017).
- True, J. R., Edwards, K. A., Yamamoto, D., Carroll, S. B. Drosophila wing melanin patterns form by vein-dependent elaboration of enzymatic prepatterns. Curr Biol. 9 (23), 1382-1391 (1999).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Izumitani, H. F., Kusaka, Y., Koshikawa, S., Toda, M. J., Katoh, T. Phylogeography of the Subgenus Drosophila (Diptera: Drosophilidae): evolutionary history of faunal divergence between the Old and the New Worlds. PLoS ONE. 11 (7), e0160051(2016).
- Resh, V. H., Cardé, R. T. Encyclopedia of Insects. , 2nd ed, Academic Press. Burlington. (2009).
- DeLean, A., Munson, P. J., Rodbard, D. Simultaneous analysis of families of sigmoidal curves: application to bioassay, radioligand assay, and physiological dose-response curves. Am J Physiol. 235 (2), E97-E102 (1978).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological changes. J Morphol. 59 (2), 351-399 (1936).
- McKinney, M. L., McNamara, K. Heterochrony: the evolution of ontogeny. , Plenum Press. New York. (1991).
- Hardie, D. C., Gregory, T. R., Hebert, P. D. From pixels to picograms: a beginners' guide to genome quantification by Feulgen image analysis densitometry. J Histochem Cytochem. 50 (6), 735-749 (2002).
- Koshikawa, S., Miyazaki, S., Cornette, R., Matsumoto, T., Miura, T. Genome size of termites (Insecta, Dictyoptera, Isoptera) and wood roaches (Insecta, Dictyoptera, Cryptocercidae). Naturwissenschaften. 95 (9), 859-867 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon