Method Article
준비 번데기 기간 및 초파리 guttifera 의 날개 색소 측정 방법
요약
번데기 기간 및 측정 초파리 guttifera 의 날개 염색의 준비에 대 한 프로토콜을 설명 합니다. 준비와 염색의 정량화 성인 특성의 발달 기계 장치를 공부에 대 한 견고한 기초를 제공 하 고 특성 개발의 interspecific 비교 사용.
초록
다양 한 종의 초파리 (과일 파리) 개발 및 유전자 변화 진화 변화에 대 한 책임의 메커니즘을 연구 하는 기회를 제공 합니다. 특히, 성인 무대 날개 착 색 비교를 포함 하 여 interspecific 비교 형태학 상 특성의 풍부한 원천입니다. 공부 하 고 종 간의 발달 차이, 자세한 관찰과 적절 한 준비는 정확한 비교 필요 합니다. 여기 우리가 번데기 기간의 준비 및 폴카 점 과일 파리, 초파리 guttifera착 색 날개의 정량화에 대 한 프로토콜을 설명합니다. 첫째, 자세한 형태 관찰 및 형태학에 따라 번데기 단계의 정의 방법을 설명 합니다. 이 방법은 외부 chitinous 사건의 번데기, 번데기 형태학의 상세한 관측을 사용 하는 puparium를 제거 하기 위한 기술을 포함 합니다. 둘째, 우리는 정의 된 번데기 단계 기간을 측정 하기 위한 방법을 설명 합니다. 마지막으로, 디지털 이미지 및 ImageJ 소프트웨어를 사용 하 여 이미지 분석에 따라 날개 염색의 정량화에 대 한 방법을 설명 합니다. 이러한 방법으로, 우리는 번데기 단계 동안 성인 특성의 발달 과정을 비교 하기 위한 견고한 기초를 설정할 수 있습니다.
서문
초파리 의 형태학 특성 중 일부는 종1,2,3,,45중 다양. 우리는 질문에 접근할 수 있다 어떻게 형태학 상 다양성의이 형태학의 세대의 메커니즘을 비교 하 여 발생. 이러한 형태학의 예로 애벌레 trichomes, 성인 섹스 빗, 외부 생식 기 기구, 복 부 착 색, 및 날개 염색6,7,,89, 10 , 11 , 12 , 13 , 14 , 15. 성인 간의 형태학 적 차이 연구, 관찰 및 번데기 단계 분석, 때문에 중요 하다 성인 특성의 운명을 후반 애벌레 단계에서 결정 되 고 후속 morphogenesis 번데기 기간 동안 진행.
초파리 melanogaster의 발달 생물학 연구에서 "시간 APF" (번데기 형성 후 시간)16번데기 단계 표시 하는 일반적인 방법입니다. 이 시스템 번데기 형성 후 절대 시간을 고용 하 고 일상적인 실험에 대 한 매우 편리 하다. 그러나, 발달 속도 pupae, 사이 다를 수 있습니다 약간의 유전적, 후 또는 microenvironmental 차이 의해 영향을 받을 수 있고 따라서 같은 데 번데기 형성 후 절대 시간을 보장 하지 않습니다 pupae 동시는 발달 단계입니다. 대부분의 경우, 형태학 상 특징에 의해 정의 하는 단계는 여러 개인 비교를. 특히, 종 사이 비교에 해당 (동종) 단계 중 비교 정확한 준비 필요합니다.
베인 브리지 및 Bownes17 인식 20 번데기 단계 (P15(ii)) P1 초파리 melanogaster pupae의 형태학 적 특징에 따라. 이 발판은 형태학 상 발달 준비18의 가장 널리 사용 되는 시스템 이다. 이전 연구에서 우리는 날개 염색 연구19에 대 한 기초 확립 초파리 guttifera 의 번데기 준비 수행. D. guttifera 그것의 날개에 검은 물방울 패턴 있으며 날개 색소 형성20모델 종 중 하나입니다. 우리가 형태학 기준에 설명 된 간주 브릿지 Bownes' 연구17, 우리는 직접 직렬 관찰19, 베인 브리지 및 Bownes의 추정 단계 기간을 사용 하는 대신 단계 기간을 측정 주파수를 관찰 했다. 여기 우리가 번데기 준비의 방법 및 측정의 Fukutomi 외19에 사용 되는 초파리 의 번데기 단계의 기간을 설명 합니다.
날개 착 색의 개발 메커니즘 연구, 번데기 또는 성인 단계에서 색소 발생 시 알아야 합니다. Fukutomi 외. 19 날개 이미지의 이미지 분석에 의해 번데기 및 성인 단계 동안 착 색의 광학 밀도 (ODs)을 측정할. 초파리 날개의 착 색 검은 멜 라 닌21의 축적으로 인 한 것으로 생각 된다. ODs의 정량화, 그레이 스케일 이미지와 ImageJ 소프트웨어 (https://imagej.nih.gov/ij/)22 사용 되었다. 인식 하 고 계량 자리 전용 착 색 (ΔOD), 우리는 세 자리 세 자리 내부에서 외부 감. 확인 하려면이 방법을 재현 하 고 객관적인, OD 측정의 랜드마크로 서 날개 정 맥을 사용 하 여 결정 한다. 이 문서에서는, 우리가 자세히 설명 초파리 guttifera착 색 날개의 정량화의이 방법.
프로토콜
1. 비행 사진
- 초파리 guttifera 를 사용 하 여 다음과 같은 프로토콜의 모든.
- 플라스틱 튜브를 사용 하 여 (직경 25 m m x 높이 96 m m) 및 셀 루 로스 플러그 (직경 mm x 높이 23 26 m m) 재고 유지 보수에 대 한. 표준 옥수수 가루/설탕/효 모/천 식품을 사용 하 고 따라 발행물이 종의23 다른 대체 조리법 설명.
참고: D. guttifera (재고 번호 15130 1971.10) 초파리 종 재고 센터, 샌디에고가 주 대학에 의해 제공 됩니다. D. guttifera 는 immigrans-먼 관련이 D. melanogaster 내 속23,tripunctata 방사선에 속해 있지만 그것이 D. melanogaster 공통점이 많은 생물 속성 . 이 따라,이 프로토콜 일부 종 특정 음식 및 기술 팁 그들에 게2를 유지 하기 위해 필요 하지만 많은 초파리 종에 대 한 적용할 수 있습니다.
2. 번데기와 번데기 단계의 정의의 관찰
참고: 관측 번데기 25 ° c.에서 h 명암 주기 12:12 유지 비행 주식에서 가져온 것입니다. 베인 브리지 및 Bownes17 D. melanogaster pupae pupation moistened 휴지 (946 이동된 pupae의 97% 생존)의 조각에의 원래 장소에서 이동의 낮은 위험을 설명 합니다. D. guttifera pupae 본질적으로 같은 방법으로 준비 될 수 있다.
- 플라스틱 병에 신선한 음식 (표준 옥수수 가루/설탕/효 모/천 식품)에 초파리 의 건강 한 성인을 배치 (직경 25 m m x 높이 96 m m) 고 알. 7 일 늦은 3 instars를 기다립니다.
- 각 1.5 mL microtube에 표준 옥수수 가루/설탕/효 모/천 식품의 1 mL를 놓습니다. 호흡 수 있도록 푸시 핀 관통에 의해 microtubes의 뚜껑에 2 mm 간격으로 3 핀 홀을 확인 합니다.
- 7 음식 microtubes 원심 미니 microcentrifuge (860 x g)에 s.
- 반전 하 고 유리병에서 모든 성인을 제거 하는 튜브를 누릅니다.
- DdH2O의 5-10 mL를 붓고 (또는 역방향 삼 투 물) 유리병에.
- 애벌레는 플라스틱 페 트리 접시에 물으로 밖으로 부 어 (직경 90 mm x 높이 15 m m). 그들의 큰 신체 크기 (길이 3-4 m m)에 의해 늦은 3 instars를 식별 합니다.
- 부드럽게 늦은 3 탈피 애벌레 집게와 음식 microtubes 이동 (10 애벌레 / microtube). 25 ° c.에서 그들을 밤새 품 어
- DdH2O로 습 하 게 되 고 플라스틱 페 트리 접시에에서 배치 된 티슈 페이퍼의 조각에 새로 형성된 된 pupae 이동 (직경 35 mm x 높이 10 m m).
- 습 한 챔버 (ddH2O 하단에서의 10 mL를 포함), 페 트리 접시를 놓고 번데기 원하는 단계에 개발 될 때까지 기다립니다.
- 플라스틱 페 트리 접시에에서 moistened 휴지 조각에 번데기를 이동 (직경 60 m m x 높이 15 m m).
참고: 단계 정의 주로 만들 수 있습니다 기반으로 D. melanogaster17의 단계에. 일반적으로, 초파리 의 번데기 기간 단계 정의의 일부 수정 사용 하는 종류에 따라 필요한 것 P1-P15(ii)로 분류 될 수 있다. 만약에 가능 하다 면, 제거는 puparium 정확 하 고 상세한 관측을 수 있습니다. (3 단계) 아래 내용을 참조 하십시오. - 스테레오 현미경 pupae를 관찰 합니다. 스테레오 현미경에 부착 된 디지털 카메라를 사용 하 여 사진을 가져가 라.
3. 제거 puparium
주: 초파리 의 번데기는 puparium 라고 하는 구조에 의해 적용 됩니다. Muscomorpha (파리)의 곤충 pupation;에서 애벌레의 표 피를 흘리지 않는 대신, 그것은 apolysis, 후 표 피를 견고 하 고 번데기, puparium24의 보호 커버로 사용. puparium 안에 있는 번데기는 매우 부드러운이 고 불안정 한 진정한 번데기 표 피가 있다. Apolysis P4(ii) 주위 일어나기 전에 epithelia 및 puparium 함께, 연결 그리고 그러므로 손상 없이 puparium를 제거 하는 것은 매우 어렵습니다. P5, 후 제거는 puparium 이지만 힘 드는, 형태학 관찰과 번데기 단계를 정의 하는 데 유용. 과정은 다음과 같이 실시 됩니다.
- 한 조각의 종이 타월의 조각에 양면 테이프 부착
- 이중 면 테이프 복 부 쪽 (그림 1A)에 번데기를 놓습니다.
- puparium의 앞쪽 측면 및 내부 번데기 사이 공간을 찾습니다. 파악 및 집게를 사용 하 여이 간격 주위 puparium를 제거 하 고 번데기의 머리의 앞쪽 측면을 노출.
- 이전 후부 축에 평행 이동 하 여는 집게의 끝을 삽입 합니다. puparium를 로컬로 집게 끝을 들어올립니다. 파손은 puparium의 후부 부분에 도달할 때까지이 작업을 반복 합니다. 격차 또한 puparium와 번데기 다리 사이 형성 했다 확인 하 고 브레이크는 puparium의 복 부 측 내부 번데기 (그림 1B)에 피해를 최소화.
- puparium을 가능한 한 많이 깨는 후 좋은 붓 (#5/0) (그림 1C)을 사용 하 여 번데기를 꺼내.
- DdH2O 적신 되었으며 플라스틱 페 트리 접시에 휴지 조각에 번데기를 배치 (직경 60 m m x 높이 15 m m). 걸릴 사진을 최대한 빨리 노출 된 번데기는 취약 하 고 쉽게 건조 된다.
참고:는 puparium 없이 Pupae 적합 하지 않습니다 번데기 기간 (4 단계)의 기간을 측정 하기 때문에 스트레스 (예: 건조) 및 물리적 손상 정상적인 발달을 방해할 수 있습니다.
4. 번데기 단계의 기간을 측정
- 2 단계에서에서 설명한 대로 번데기 단계의 기간을 측정 하기 위한 pupae를 준비 합니다. 1-2, 2-3, 및 번데기 형성 (각 20 pupae) 후 3-4 일의 번데기를 수집 합니다. 확인을 위해 pupae를 개별 식별 번호 (1-60)를 제공 합니다. 20 더 젊은 pupae를 얻으려면 다음 단계 동안 번데기를 형성 하는 새로 수집 계속. 새로 형성된 된 pupae를 개별 식별 번호 (61-80)를 제공 합니다. DdH2O moistened 티슈 페이퍼 (1 번데기/글쎄, 12 pupae/접시) 12-잘 셀 문화 판의 잘 (3.9 c m2)의 조각에는 번데기를 놓습니다. DdH2O 습도 유지, 뚜껑, 위에 판 25 ° C, 지속적인 빛 (24:0 h 명암) 조건에에서 배치 하로 판 간 잘 공간을 채우십시오.
참고:는 puparium 없이 번데기는 번데기 기간의 기간을 측정 하기 위한 적합 하지 않습니다. puparium를 제거 하지 마십시오. - 형태학 기능 등 색, bristles, 말 tubules 노란색 신체의 모든 pupae 일단 매 30 분, 그리고 기록 관찰 집계 시트에서 (P1-P15(ii), 참조17,19에 따라) 하는 단계를 관찰 합니다.
- 계속 3 개의 (또는 그 이상)의 회전 변화에 의해 4 일 연속 (96 h)를 기록 합니다.
- 특정 단계의 각 레코드의 숫자를 계산 하 고 그들의 평균 (관측의 수 평균 / pupae). 다음 단계 (h)의 예상된 길이 결과 0.5 (h)에 의해 그들을 곱하면 됩니다.
5. 날개에 검은 반점의 강도 측정
참고: 번데기 또는 성인 날개에 검은 반점의 광학 밀도 (OD)를 측정 하 여 측정할 수 있습니다. 하나는 날개의 디지털 이미지에서 특정 영역의 OD를 계산할 수 있도록 교정25, 알려진된 ODs (단계별된 밀도 필터)와 유리 필터 사용 됩니다. 자리에서 세 자리 밖에 OD 측정, 그리고 후자는 자리 (ΔOD)의 강도를 전에서 뺍니다. 여기, 해 부, 측정 및 ΔOD의 계산 방법을 설명합니다. 2 단계, 3 단계 및 4 단계에서 독립 후이 절차를 수행할 수 있습니다. 일단 하나 2 단계 수행 하 고 모든 번데기 단계를 이해 하 고, 하나 직접 시작 하거나 5 단계를 반복 수 있습니다.
- 이미지 준비
- 2 단계에서에서 설명한 대로 초점 무대의 새로운 번데기를 준비 합니다. 집게로는 puparium의 앞쪽 부분을 제거 합니다. 집게를 사용 하 여 번데기를 꺼내와 플라스틱 페 트리 접시에에서 버퍼링 하는 인산 염 (PBS, 표 2)에 배치 (직경 35 mm x 높이 10 m m).
- 날개의 기저 관절을 잘라 (기저 합동은 날개의 좁은 인접 부분). 날개 접혀 플라스틱 페 트리 접시에 배치 (직경 35 mm x 높이 10 m m) ddH2O (날개 자체로 펼쳐져) 삼투성 압력에 의해 확장으로 가득.
- 재고 유리병에서 새로 eclosed 성인 10 분에 한 번 수집 합니다. CO2 CO2 anesthetizing 패드를 사용 하 여 비행 anesthetize, 부동에 의해 anesthetization를 확인 하 고 날개의 기저 관절을 잘라.
- 유리 슬라이드에 PBS의 장소 10 µ L 날개, 놓고 커버 슬립 (18 x 18 mm)와 함께 커버 합니다.
- 스테레오 현미경의 빛을 켜십시오. 빛이 최대 수준 수를 설정 합니다. 목표 렌즈 11.5 X 설정 합니다. 가장 열린 상태 수 다이어 프 램을 설정 합니다. 카메라를 켭니다. 카메라 설정 (ISO: 100, 2352 픽셀 x 3136 SHQ 모드 셔터 속도: 1/20 s). 현미경의 초점 손잡이 이동 하 여 샘플에 초점.
- 원격 제어 단위는 이미지의 셔터 버튼을 눌러. Campaniform sensillum, 경도 정 맥 자리 또는 후부 crossvein, 위치는 왼쪽에 날개의 원심 부분 및 상부에 날개의 앞쪽 부분에 중심 해야 합니다 각각의 날개 당 3 이미지를 가져가 라.
- 교정
- 날개 이미지를 가져오는 데 사용 하는 동일한 카메라 설정을 사용 하 여 단계별된 밀도 필터의 9 부품의 이미지를 가져가 라.
- ImageJ 소프트웨어 (https://imagej.nih.gov/ij/)22를 시작 합니다.
- 파일을 클릭 | 오픈 | 그리고 단계별된 밀도 필터의 이미지 중 하나를 선택 합니다.
- 이미지 클릭 | 유형 | 8 비트 | 8 비트 이미지에는 이미지를 변환 합니다.
- 편집을 클릭 합니다 | 선택 | 지정 | 그리고 타원형 및 가운데 열을 확인 하십시오. Y 좌표 열에서 폭 열에 100 (픽셀), 100 (픽셀) 높이 열에서 X 좌표 열에 1568 및 1176를 작성 합니다. 확인을 클릭 합니다.
- 클릭 분석 | 측정 |. 선택 된 영역의 "의미 회색 값" 측정 됩니다.
- 5.2.3를 반복 합니다. 5.2.6 하. 8 이미지 나머지.
- 클릭 분석 | 보정 Rodbard25 함수 열에서 선택 하 고 중간에 오른쪽 열에 다음 번호를 작성 (0.04, 0.336, 0.632, 0.928, 1.224, 1.52, 1.816, 2.112, 2.408;이 숫자의 밀도에 따라 달라는 밟은 밀도 필터).
- 세계 교정 열을 확인 하 고 확인을 클릭 합니다.
참고:이 절차를 수행 하 여 "회색 값 의미"로 변환 됩니다 "광학 밀도 (OD)" Rodbard 함수를 사용 하 여. 이 단계 후에 ImageJ 소프트웨어에서 특정 선택된 영역에 대 한 광학 밀도 계산할 수 있습니다.
- 측정의 영역을 선택
참고: 관광 명소는 일반적으로 campaniform sensilla, 경도 정 맥 팁, 및 crossveins 같은 연관 된다. 이들과 다른 명소는 날개에 측정의 영역을 선택 하려면 사용할 수 있습니다. 여기에 예D. guttifera(그림 2)은 설명.- A, campaniform sensillum 자리의 정의입니다.
- Campaniform sensillum 자리는 이미지의 중앙에 이미지를 엽니다. 이미지 클릭 | 유형 | 8 비트 | 8 비트 이미지에는 이미지를 변환 합니다.
- 사각형 영역 선택 도구 를 클릭 하 고 사각형을 그립니다. 그것은 세 번째 경도 정 맥의 후부 라인에 연결 된 더 원심 campaniform sensillum 자리에서 사각형의 왼쪽된 위 꼭지점을 설정 합니다. 그것은 자리 campaniform sensillum의 오른쪽에 있는 사각형의 오른쪽 면을 설정 합니다.
- 편집을 클릭 합니다 | 선택 | 관리자에 추가 |. 모두 표시 열을 확인 합니다.
- 각 도구 라인 선택 도구에서 클릭 합니다. 3 경도 정 맥의 후부 라인에 첫 번째 줄을 그립니다. 1 단계에서에서 그린 사각형의 꼭지점에 선의 왼쪽된 끝점을 설정 합니다. 사각형의 위쪽 면에 두 번째 줄을 그립니다. 이 단계에서 그려진 두 선 사이의 각도 측정 하는 "m" 키를 누릅니다. 컴퓨터의 화면에 이미지의 창을 클릭 합니다.
- 편집을 클릭 합니다 | 선택 | 관리자에 추가 |.
- 사각형 영역 선택 도구 를 클릭 하 고 약 1/9의 사각형을 그릴 이미지 창의 크기. 편집을 클릭 합니다 | 선택 | 회전 |. 작성 단계 5.3.1.4에서에서 측정 하는 각도의 빼기도 합니다. 각 열에이 단계에서 그린 사각형을 회전 하려면 확인 을 클릭 합니다.
- 5.3.1.6 단계에서 그린 사각형을 이동 합니다. 사용 하 여 화살표 키. 사각형의 왼쪽 및 세 번째 경도 정 맥의 후부 라인에 연결 된 사각형의 하단 측면에 두 번째 경도 정 맥의 후부 선의 끝점을 설정 합니다. 확인 두 번째 경도 정 맥의 끝 지점에서 수직 라인 3 경도 정 맥의 후부 라인을이 절차에서 그려집니다. A (그림 2A)으로 수직 라인의 발을 정의 합니다.
- X 좌표와 y 좌표 점 A, 점 대답에 커서를 배치할 때 영역 선택 도구 아래 표시의 기록
- 경도 정 맥 팁 자리 포인트 B의 정의
- 경도 정 맥 끝 자리는 이미지의 중앙에 이미지를 엽니다. 이미지 클릭 | 유형 | 8-비트 | 8 비트 이미지에는 이미지를 변환.
- 5.3.1 단계에 설명 된 동일한 절차를 반복 합니다. (포인트 A의 정의 campaniform sensillum 자리) 이미지에 A를 찾을 수 있습니다.
- 편집을 클릭 합니다 | 선택 | 관리자에 추가 |.
- 사각형 영역 선택 도구 를 클릭 하 고 사각형을 그립니다. 3 경도 정 맥의 후부 선의 끝점에서 사각형의 왼쪽된 위 꼭지점을 설정 합니다.
- 편집을 클릭 합니다 | 선택 | 관리자에 추가 |.
- 각 도구 라인 선택 도구에서 클릭 합니다. 지점 A와 3 경도 정 맥의 후부 선의 끝점을 연결 하는 첫 번째 줄을 그립니다. 정의이 선 라인 A. 그릴로 두 번째 줄 단계 5.3.2.4에서에서 그린 사각형의 상단에. 두 선 사이의 각도 측정 하는 "m" 키를 누릅니다.
- 편집을 클릭 합니다 | 선택 | 관리자에 추가 |.
- 사각형 영역 선택 도구 를 클릭 하 고 약 1/9의 사각형을 그릴 이미지 창의 크기. 편집을 클릭 합니다 | 선택 | 회전 |. 작성 단계 5.3.2.6에서에서 측정 하는 각도의 빼기도 합니다. 각 열에이 단계에서 그린 사각형을 회전 하려면 확인 을 클릭 합니다. 화살표 키를 사용 하 여 사각형을 이동 합니다. 그것은 사각형의 왼쪽된 면에 있도록 A 라인과 4 경도 정 맥의 앞쪽 라인의 끝점에 연결 된 사각형의 위쪽 면을 설정 합니다.
- 편집을 클릭 합니다 | 선택 | 관리자에 추가 |.
- 사각형 영역 선택 도구 를 클릭 하 고 약 1/9의 사각형을 그릴 이미지 창의 크기. 편집을 클릭 합니다 | 선택 | 회전 |. 각 열에서 6 단계에서에서 측정 하는 각도의 빼기도 작성 하 고이 단계에서 그린 사각형을 회전 하려면 확인 을 클릭 합니다. 화살표 키를 사용 하 여 사각형을 이동 합니다. 그것은 단계 5.3.2.8에서에서 그린 사각형의 왼쪽된 위 꼭지점에 사각형의 하단 왼쪽된 꼭지점 설정., 결과 선 A. 정의 4 경도 정 맥의 앞쪽 라인의 끝점에서 수직 라인을 얻기에 수직 라인과 포인트 B (그림 2B)로 제 3 경도 정 맥의 후부 라인의 교차로 지점.
- X 좌표와 y 좌표 지점 B, B 지점에 커서를 배치할 때 영역 선택 도구 아래 표시의 기록
- 포인트 C, 후부 crossvein 자리의 정의
- 후부 crossvein 자리는 이미지의 중앙에 이미지를 엽니다. 이미지 클릭 | 유형 | 8-비트 | 8 비트 이미지에는 이미지를 변환.
- 후부 crossvein의 교차 영역에서 4 경도 정 맥 및 4 경도 정 맥 (그림 2C)의 앞쪽 라인의 후부 맨 지점으로 포인트 C를 정의 합니다.
- X 좌표와 y 좌표 포인트 C, 포인트 c에서 커서를 배치할 때 영역 선택 도구 아래 표시의 기록
- 점 d, 컨트롤 영역 정의
- Campaniform sensillum 자리는 이미지의 중앙에 이미지를 엽니다. 이미지 클릭 | 유형 | 8 비트 | 8 비트 이미지에는 이미지를 변환 합니다.
- 스트레이트 라인 선택 도구에서를 클릭 하 고 두 번째 경도 정 맥의 앞쪽 라인과 4 경도 정 맥의 후부 선의 끝점의 끝점을 연결 하는 선은 그립니다. 이 라인과 3 경도 정 맥 (그림 2D)의 후부 라인의 교차점으로 점 D를 정의 합니다.
- X 좌표와 y 좌표 포인트 D, 커서 포인트 d 배치할 때 영역 선택 도구 아래 표시의 기록
- A, campaniform sensillum 자리의 정의입니다.
- 측정
- (대 한 점 A의 측정 센터에서 포인트와 이미지를 열고) 날개 명소의 이미지 중 하나를 엽니다. 이미지 클릭 | 유형 | 8 비트 | 8 비트 이미지에는 이미지를 변환 합니다.
- 사각형 영역 선택 도구 를 클릭 하 고 이미지 창의 약 1/9 크기의 사각형을 그립니다.
- 편집을 클릭 합니다 | 선택 | 지정 |. 타원형 및 가운데 열을 확인 합니다. 너비 와 높이 열에 100 (픽셀)를 작성, A (또는 B 지점 또는 지점 C)의 x 좌표를 작성 및 X 좌표 열 및 쓰기 y A 지점의 좌표 (포인트 B 또는 포인트 C) D와 D Y 좌표 열에. 확인을 클릭 합니다.
- 클릭 분석 | 측정 |. 5.2에서 설명한 보정 이미 완료 되었습니다, ODs 의미 열에 표시 됩니다.
- ΔODs 점 A, B 및 c.의 ODs에서 OD의 점 D를 빼서 계산
참고: 포인트 D 날개의 투명 한 부분에 착 색, 포함 되지 않습니다 고 따라서 배경 컨트롤을 위해 적당 하다.
결과
D. guttifera 의 번데기 기간 17 단계 (P1-P15(ii), 단계 (P1, P5-6, P10) 그림 3, 그리고 모든 17 단계는 그림 4에 나와 있는 표시 됩니다 3 명의 대표자의 이미지)으로 나누어져 있습니다. 베인 브리지 및 Bownes17 20 단계 D. melanogaster인정, 이러한 단계 중 일부 수 하지에 적용할 D. guttifera. 2 개의 발달 이벤트의 순서, 노란 몸 (midgut26내 창 고 세포의 질량)의 모양 및 녹색, 터 닝 말 tubules의 타이밍 제어 되지 않습니다 엄격 하 게 D. guttifera에 그리고 그러므로 우리가 P5를 분리할 수 없었다 (i ), P5(ii) 및 P6. 또한, 달리 D. melanogaster, 흉부 및 복 부 bristles의 흑의 타이밍은 동기화, 그리고 그러므로 우리 P11(i)과 P11(ii)19를 분리할 수 없었다.
우리 디 guttifera (Fukutomi 외.19에서 표 3)의 번데기 단계의 길이 측정할 수 있습니다. 전체 번데기 기간은 약 20 h 25 ° C17에 D. melanogaster 의 그것 보다 더 이상 이다. 우리는 주변 지역 campaniform sensillum, 경도 정 맥 팁 그리고 후부 crossvein의 ΔODs를 계산합니다. 여기, 우리가 보여줍니다 ODs 및 ΔODs 성인 일수로 (표 4) 후 7 일. 여러 단계의 데이터를 비교 하 여 우리는 발견 단계 P12(i) 착 색의 개시의 타이밍은 그 염색 일수로 후 24 h에 의해 완료 됩니다 (그림 5, Fukutomi 외에 사용 되는 원래 치수에서. 19).
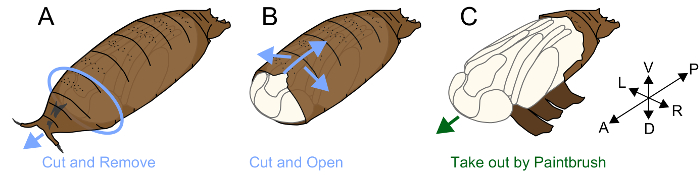
그림 1입니다. 그림 puparium 제거. (A) 번데기 복 부 측 이중 면 테이프의 조각의를 놓습니다. puparium의 앞쪽 부분을 제거 합니다. (B)는 puparium 복 부 측에서 집게와 휴식. (C)는 puparium를 해제 후 그림 붓을 사용 하 여 번데기를 꺼내. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2입니다. 착 색을 측정 하기 위한 영역의 정의. (Campaniform sensillum와 관련 된 자리 A) 점 A. (B) 지점 B 경도 정 맥 팁과 관련 된 장소에 대 한. (C) 지점 C 후부 crossvein와 관련 된 자리. (D) 포인트 D 제어 영역에 대 한. 눈금 막대 표시 250 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3입니다. 정의 된 번데기 단계의 예. (A) 번데기 단계의 P1 puparium 덮여. (B) 단계 P5-6의 번데기. (C) 단계 P10의 번데기입니다. (B)에서 관찰 하기 전에 puparia 제거 및 (C). 눈금 막대 표시 500 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
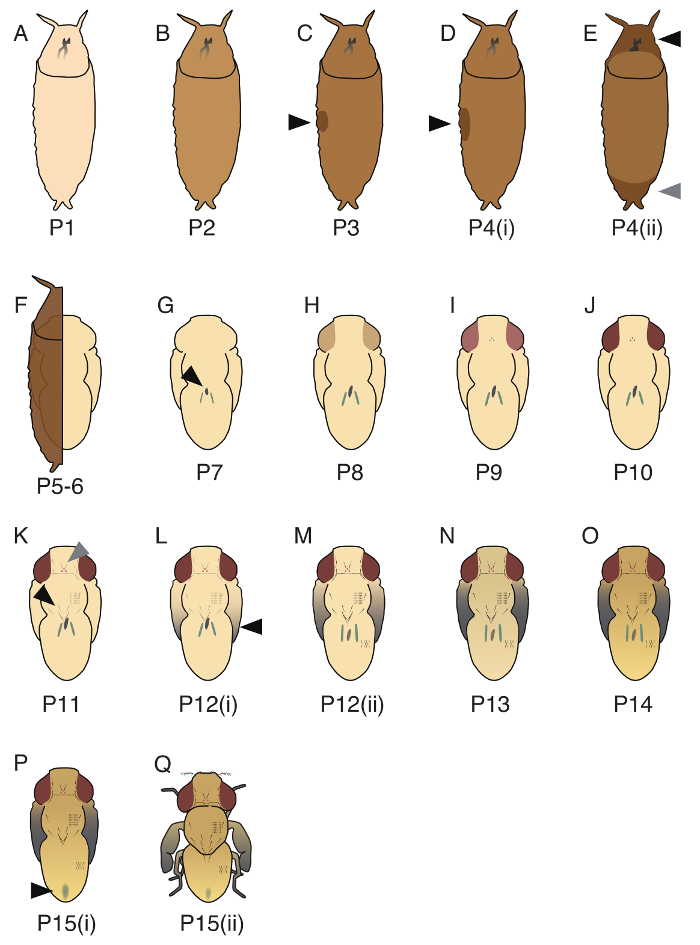
그림 4입니다. D. guttifera에서 확인 된 17 번데기 단계의 그림. (A) P1에 puparium 흰색입니다. (B) P2는 puparium의 색상은 갈색 빛 이다. (C) P3, 거품 측면 사이드 (검은 화살표)에서 관찰 됩니다. (D) P4(i), 거품 P3 보다 크면 (검은 화살표), 번데기는 PBS에 부 력. (E) P4(ii), 간격 앞쪽 부분 (검은 화살표)와 후부 부분 (회색 화살촉)에서 관찰 됩니다. (F) p 5-6, tubules 마이그레이션 (puparium에 의해 덮여 있는지 어려운) 하는 말 번데기 모양은 번데기 상피와 번데기 표 피에 의해 형성 된다. (G) P7, 노란 몸 등 쪽 측 (검은 화살표)에서 관찰할 수 있습니다. (H) P8, 눈은 노란색. (I) P9, 눈은 주황색. (J) P10, 눈은 빨간색. (K) P11, 궤도 및 ocellar bristles (회색 화살촉), 털, 흉부 macrochaetae (검은 화살표), 그리고 tarsal bristles 검 고 볼 수 있습니다. (L) P12(i), 날개의 팁은 회색. (M) P12(ii), 날개의 모든 부분에는 회색 (검은 화살표)입니다. (N) P13, 날개는 완전히 검은색. (P14 O), 머리와 다리는 완전히 어둡게 된다. (P) P15(i)는 meconium 등 쪽 복 부 (검은 화살표)에 관찰할 수 있습니다. (Q) P15(ii), 비행 eclosing입니다. 이 단계의 정보는 Fukutomi 외에 설명 했다. 19 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5입니다. 날개에 companiform sensillum 주위 착 색의 개발. 서클 개별 ΔODs 나타내고 가로 막대 평균을 표시 합니다. P10: n = 10, P11: n = 10, 12(i): n = 10, P15(i): n = 11, 3 h: n = 8, 24 h: n = 7, 7 일: n = 10. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 구성 요소 | |
| 화이트 소프트 설탕 | 51.6 g |
| 옥수수 가루 | 172.4 g |
| 옥수수 밀가루-C | 86.4 g |
| 건조 맥주 효 모 | 106 g |
| 한 천 분말 | 35.28 g |
| ddH2O | mL 4000 |
| 30 분 및 70 ° c.에 아래로 냉각을 위한 종 | |
| 추가 4 g 부 틸 p-hydroxybenzoate의 에탄올 40 mL에 용 해. | |
| 잘 혼합 하 고 플라스틱 튜브 9 mL를 붓고 (직경 25 m m x 높이 96 m m). | |
표 1입니다. 표준 옥수수 가루/설탕/효 모/천 식품의 구성.
| 구성 요소 | 금액 |
| NaCl | 80 g |
| KCl | 2 세대 |
| 나2HPO4·12H2O | 29 g |
| KH2포4 | 2 세대 |
| ddH2O | 최대 10 L |
| pH 7.4를 설정 |
표 2입니다. PBS (X 1) 구성입니다.
| 단계 | 시간 (h)의 의미 | 사 우 스 다코타 | n |
| P1-2 | 1.7 | 0.65 | 16 |
| P3 | 2.1 | 0.65 | 16 |
| P4(i) | 2.1 | 1.69 | 19 |
| P4(ii) | 0.3 | 0.28 | 29 |
| P5-6 | 5.0 | 3.07 | 30 |
| P7 | 31.9 | 7.22 | 46 |
| P8 | 9.6 | 2.81 | 57 |
| P9 | 10.9 | 2.66 | 55 |
| P10 | 11.7 | 2.96 | 39 |
| P11 | 4.4 | 2.81 | 44 |
| P12(i) | 1.1 | 0.76 | 44 |
| P12(ii) | 2.0 | 0.70 | 43 |
| P13 | 2.2 | 0.68 | 10 |
| P14-15(i) | 28.6 | 2.75 | 10 |
| P15(ii) | 1.4 | 0.87 | 10 |
| 총 | 121.7 |
테이블 3입니다. 측정의 번데기 단계의 기간 D. guttifera.
| OD | ΔOD | |||||||
| Campaniform sensilum | 경도 정 맥 팁 | 후부 crossvein | 제어 | Campaniform sensilum | 경도 정 맥 팁 | 후부 crossvein | ||
| 개인 | (A) | (B) | (C 지점) | (포인트 D) | (A-포인트 D) | (B-포인트 D) | (포인트 C-포인트 D) | |
| 1 | 0.549 | 0.484 | 0.515 | 0.256 | 0.293 | 0.228 | 0.259 | |
| 2 | 0.529 | 0.489 | 0.516 | 0.254 | 0.275 | 0.235 | 0.262 | |
| 3 | 0.546 | 0.48 | 0.533 | 0.255 | 0.291 | 0.225 | 0.278 | |
| 4 | 0.583 | 0.496 | 0.566 | 0.255 | 0.328 | 0.241 | 0.311 | |
| 5 | 0.523 | 0.479 | 0.528 | 0.235 | 0.288 | 0.244 | 0.293 | |
| 6 | 0.572 | 0.509 | 0.546 | 0.265 | 0.307 | 0.244 | 0.281 | |
| 7 | 0.568 | 0.511 | 0.56 | 0.256 | 0.312 | 0.255 | 0.304 | |
| 8 | 0.56 | 0.507 | 0.562 | 0.27 | 0.29 | 0.237 | 0.292 | |
| 9 | 0.551 | 0.485 | 0.569 | 0.259 | 0.292 | 0.226 | 0.31 |
표 4입니다. ODs를 측정 하 고 ΔODs D. guttifera 성인 일수로 후 7 일.
토론
설명 여기 번데기 단계의 정의 대 한 프로토콜 번데기 단계의 기간 및 디 guttifera에서 날개에 검은 반점의 강렬의 측정 측정 자세한 관찰에 대 한 puparium를 제거 합니다. 이러한 프로토콜 많은 초파리 에 대 한 적용할 수 있으며 비행 종, 특히 종 날개 색소와 관련.
깊이 있는 관찰과 자세한 개발 이벤트의 설명 것 하위 단계의 추가 사용. 많은 경우에, 요구 해 부 나는 번데기의 단면 발달 이벤트 단계 정의에 적합 하지 않습니다, 그리고 개별 어렵다 하나 준비에 대 한 번데기를 죽 일 하 여 추가의 사용 때문에. 새로운 초파리 의 사용에 대 한 첫 번째 단계로 발달 이벤트는 puparium 외부에서 구별할 수를 고용 해야 하나. 연구의 목적에 따라 하나 수 있습니다 다음 더 세분화 단계 특정 organogenesis 또는 다른 발달 이벤트에 따라.
여러 단계의 interspecific 비교에 대 한 잠재적인 어려움 (heterochrony27) 종 중 개발 이벤트 순서의 반전 이다. 예를 들어 D. melanogaster에서 말 관 된다 녹색 하 고 디 guttifera19의 일부 pupae에이 순서를 거꾸로 수 있습니다 반면 다음 노란색 몸 표시 됩니다 키를 누릅니다. 이러한 경우에 동종 단계 사이 엄격한 비교가 어렵습니다. 관심의 현상에 따라 하나를 다시 정의 하거나 발달 이벤트에 따라 특정 단계를 세분화 해야 합니다. 예를 들어 우리 수 대략 pupae P5-6의 선택한 번데기 날개 날개 형태를 사용 하 여 개발 타이밍14의 지표로 서 진 식의 interspecific 비교.
일반적으로, 그것은 puparium를 제거 하려면 10-30 분 걸립니다. 하나는 짧은 단계를 관찰 하 고 싶다면 pupae puparium 제거 하는 동안 전달 하는 시간을 고려해 준비 되어야 한다. 예를 들어 P12(i) D. guttifera, 유일한 1.1 h 기간에이의 관찰 하 고 싶어 하는 경우 P11에 번데기를 준비 하 고 좋은 결과 줄 것 이다.
우리의 프로토콜에서 moistened 휴지 번데기 이미지의 배경에 사용 됩니다. 관찰과 구조는 그림에 표시 하 고 싶어의 단계에 따라 하나는 흰색 또는 검은색 휴지를 사용할 수 있습니다. P4(ii) 전환 P3에 대 한 번데기에 거품의 위치는 중요 한 단계를 구별 하 고 검은 휴지 거품의 위치를 관찰 하는 데 도움이. P5 후 단계에 대 한 흰색 휴지 때문에 낫다 노란 몸, 눈 색깔, bristles, 그리고 색을 관찰 하는 데 도움이.
베인 브리지 및 Bownes17 외관의 그들의 주파수에서 번데기 단계 기간 추정. 그들의 준비 테이블은 D. melanogaster18하나 가장 널리 사용된. 그들의 방법에 대 한 그들은 5 성인 여성 및 5 명의 성인 남성을 포함 하는 4 개의 식품 병을 준비, 어둠 속에서 그들을 유지 하 고 pupae 무작위로 찍은 한 병에서 달걀 누워의 발병 후 11, 12, 13, 그리고 14 일에. 그들은 특정 단계에서 pupae의 수를 계산 하 고 평균을 계산. 번데기 단계 각의 길이 총 기간의 번데기 기간 데이터 및 이러한 주파수 데이터에 따라 추정 수 있습니다. 이 방법으로 한 문제는 그것은 사용할 수 없습니다 개발 타이밍 pupae 중 동기화 할 하는 경향이 경우 번데기 단계의 정확한 기간을 추정 하는.
사실, 우리 D. guttifera에서 베인 브리지 및 Bownes의 방법을 시도 하 고 우리가 번데기 들 동기화 때문에 편견된 데이터를 얻은. 우리가이 현상의 원인을 식별 하지 수 있지만 몇 가지 가능성은 1) 번데기 그들의 젊은 무대에서 circadian 리듬을 유지 하 고는 그리고/또한 2) 그들은 관찰에서 발생 한 빛에 노출에 반응. 따라서, 우리는 직접 관찰에 의해 실제 단계 기간을 측정 하기로 결정 했습니다. Circadian 리듬으로 인 한 편견을 최소화 됩니다.
여기 설명 하는 방법을 세 자리 지역 마약에서 컨트롤 영역의 빼서 반점 그들의 주변 제어 영역 (ΔOD)에 비해 멜 라 닌의 추가 누적 계량 하는 방법이입니다. 이 메서드는 Feulgen 얼룩 및 이미지 분석 (densitometry28,29) 하 여 핵 DNA 콘텐츠를 측정 하는 방법에 의해 영감을 했다. 날개 염색에이 방법을 적용 하기 위한 잠재적인 문제 중 하나로 서, ΔOD는 번데기는 아주 젊은 있으며 거의 착 색 하는 경우에 특히 음수 값을 수 있습니다. 후기, 컨트롤 영역에서 몇 가지 착 색 될 수 있습니다. 자리 지역 자체의 간단한 OD의 사용은 연구의 목적에 따라 ΔOD 대신 적절 한 수 있습니다. D. guttifera 경우 ΔOD 대신 간단한 OD의 사용 데이터의 추세 또는 연구의 결론 변화 하지 않았다.
공개
저자는 전혀 충돌의 관심이 없다.
감사의 말
우리 감사 Sean B. Carroll와 토마스 베르너 비행 주식, 장비에 대 한 나 오 유키 퓨즈, 촬영, 멘토링에 대 한 Kiyokazu 아가타와 엘리자베스 나카지마 영어 편집을 위한 그의 지원에 대 한 병 석 진 제공. 이 작품은 KAKENHI에 의해 지원 되었다 17 K 19427와 다케다 과학 재단.
자료
| Name | Company | Catalog Number | Comments |
| Drosophila guttifera | The Drosophila Species Stock Center at the U.C. San Diego | 15130-1971.10 | Drosophila guttifera, a fruit fly species used in this article |
| Plastic vial | Hightech | MKC-30 | Plastic vial, for fly stock maintenance |
| Buzz plugs vial and bottle closures for glass vials | Fisher Scientific | AS-271 | Cellulose plug, for fly stock maintenance |
| White soft sugar | Mitsui Sugar | J-500g | White soft sugar, for standard cornmeal/sugar/yeast/agar food |
| Corn flour | Nippon Flour Mills | F | Corn flour, for standard cornmeal/sugar/yeast/agar food |
| Corn grits - C | Nippon Flour Mills | GC | Corn grits - C, for standard cornmeal/sugar/yeast/agar food |
| Agar powder | Matsuki Kanten Sangyo | No.602 | Agar powder, for standard cornmeal/sugar/yeast/agar food |
| Dry beer yeast | Asahi Food & Healthcare | Y2A | Dry beer yeast, for standard cornmeal/sugar/yeast/agar food |
| Butyl p-hydroxybenzoate | Nacalai Tesque | 06327-02 | Butyl p-hydroxybenzoate, for standard cornmeal/sugar/yeast/agar food |
| Ethanol | Wako | 057-00456 | Ethanol, for standard cornmeal/sugar/yeast/agar food |
| Flat bottom microtube | Ina Optica | CF-0150 | 1.5 mL microtube, for collecting pupae |
| CAPSULEFUGE | Tomy | PMC-060 | Mini microcentrifuge, for collecting pupae |
| Sterilized Schale NB | Sansei Medical | 01-013 | Plastic Petri dish (diameter 90 mm x height 15 mm) |
| Serum tube rack | Iwaki | 9796-050 | Used as a moist chamber, for observation of pupa |
| Corning Falcon Easy-Grip tissue culture dish | Corning | 353001 | Plastic Petri dish (diameter 35 mm x height 10 mm) |
| Falcon standard tissue culture dish | Corning | 353002 | Plastic Petri dish (diameter 60 mm x height 15 mm) |
| Push-pin | Kokuyo | 51233709 | Push-pin, for making pinholes on the microtube lid |
| Stereomicroscope | Olympus | SZX16 | Stereomicroscope, for morphological observation |
| Digital camera | Olympus | DSE-330-A | Digital camera, for imaging |
| NICETACK double sided tape | Nichiban | NW-15SF | Double sided tape, for removing puparium |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | Forceps, for removing puparium |
| Van Gogh VISUAL Paint brush | Talens Japan | GWVR-#5/0 | Paint brush, for removing puparium |
| Greiner CELLSTAR 12 well cell culture plate | Merck | 665-180 | 12-well cell culture plate, for measuring durations of pupal periods |
| NaCl | Wako | 191-01665 | NaCl, for PBS |
| KCl | Nacalai Tesque | 285-14 | KCl, for PBS |
| Na2HPO4·12H2O | Wako | 196-02835 | Na2HPO4·12H2O, for PBS |
| KH2PO4 | Nacalai Tesque | 28721-55 | KH2PO4, for PBS |
| Stepped Neutral Density (ND) Filter 0.04 - 3.0 | Edmund Optics | 64-384 | Stepped density filter, for calibration of pigmentation measurement |
| ImageJ software | NIH | 1.8.0-101 | ImageJ software, for measurement of intensity of black spots on a wing (https://imagej.nih.gov) |
| FINE FROST glass slide | Matsunami Glass Ind | FF-001 | Glass slide, for measurement of intensity of black spots on a wing |
| Square microscope cover glass 18 x 18 | Matsunami Glass Ind | C018181 | Cover slip, for measurement of intensity of black spots on a wing |
참고문헌
- Carson, H. L., Hardy, D. E., Spieth, H. T., Stone, W. S. The evolutionary biology of the Hawaiian Drosophilidae. Essays in evolution and genetics in honor of Theodosius Dobzhansky. Hecht, M. K., Steere, W. C. , Springer (Meredith Corporation). New York. 437-543 (1970).
- Markow, T. A., O'Grady, P. M. Drosophila: a guide to species identification and use. , Academic Press. New York. (2006).
- Patterson, J. T. The Drosophilidae of the southwest. 4313, University of Texas Publication. 7-216 (1943).
- Setoguchi, S., Takamori, H., Aotsuka, T., Sese, J., Ishikawa, Y., Matsuo, T. Sexual dimorphism and courtship behavior in Drosophila prolongata. J Ethol. 32 (2), 91-102 (2014).
- Werner, T., Jaenike, J. Drosophilids of the Midwest and Northeast. , River Campus Libraries, University of Rochester. Rochester. (2017).
- Arnoult, L., et al. Emergence and diversification of fly pigmentation through evolution of a gene regulatory module. Science. 339 (6126), 1423-1426 (2013).
- Camino, E. M., Butts, J. C., Ordway, A., Vellky, J. E., Rebeiz, M., Williams, T. M. The evolutionary origination and diversification of a dimorphic gene regulatory network through parallel innovations in cis and trans. PLoS Genet. 11 (4), e1005136(2015).
- Gompel, N., Prud'homme, B., Wittkopp, P. J., Kassner, V. A., Carroll, S. B. Chance caught on the wing: cis-regulatory evolution and the origin of pigment patterns in Drosophila. Nature. 433 (7025), 481-487 (2005).
- Glassford, W. J., et al. Co-option of an ancestral Hox-regulated network underlies a recently evolved morphological novelty. Dev. Cell. 34 (5), 520-531 (2015).
- Koshikawa, S. Enhancer modularity and the evolution of new traits. Fly. 9 (4), 155-159 (2015).
- Koshikawa, S., et al. Gain of cis-regulatory activities underlies novel domains of wingless gene expression in Drosophila. Proc Natl Acad Sci U S A. 112 (24), 7524-7529 (2015).
- McGregor, A. P., et al. Morphological evolution through multiple cis-regulatory mutations at a single gene. Nature. 448 (7153), 587-590 (2007).
- Tanaka, K., Barmina, O., Kopp, A. Distinct developmental mechanisms underlie the evolutionary diversification of Drosophila sex combs. Proc Natl Acad Sci U S A. 106 (12), 4764-4769 (2009).
- Werner, T., Koshikawa, S., Williams, T. M., Carroll, S. B. Generation of a novel wing colour pattern by the Wingless morphogen. Nature. 464 (7292), 1143-1148 (2010).
- Wittkopp, P. J., et al. Intraspecific polymorphism to interspecific divergence: genetics of pigmentation in Drosophila. Science. 326 (5952), 540-544 (2009).
- Lawrence, P. A., Morata, G. Compartments in the wing of Drosophila: a study of the engrailed gene. Dev Biol. 50 (2), 321-337 (1976).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. J. Embryol. Exp. Morphol. 66, 57-80 (1981).
- Ashburner, M., Golic, K. G., Hawley, R. S. Drosophila: A Laboratory Handbook. , 2nd ed, Cold Spring Harbor Laboratory Press. New York. (2005).
- Fukutomi, Y., Matsumoto, K., Agata, K., Funayama, N., Koshikawa, S. Pupal development and pigmentation process of a polka-dotted fruit fly, Drosophila guttifera (Insecta, Diptera). Dev Genes Evol. 227 (3), 171-180 (2017).
- Koshikawa, S., Fukutomi, Y., Matsumoto, K. Drosophila guttifera as a model system for unraveling color pattern formation. Diversity and evolution of butterfly wing patterns: an integrative approach. Sekimura, T., Nijhout, H. F. , Springer. New York. in press (2017).
- True, J. R., Edwards, K. A., Yamamoto, D., Carroll, S. B. Drosophila wing melanin patterns form by vein-dependent elaboration of enzymatic prepatterns. Curr Biol. 9 (23), 1382-1391 (1999).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Izumitani, H. F., Kusaka, Y., Koshikawa, S., Toda, M. J., Katoh, T. Phylogeography of the Subgenus Drosophila (Diptera: Drosophilidae): evolutionary history of faunal divergence between the Old and the New Worlds. PLoS ONE. 11 (7), e0160051(2016).
- Resh, V. H., Cardé, R. T. Encyclopedia of Insects. , 2nd ed, Academic Press. Burlington. (2009).
- DeLean, A., Munson, P. J., Rodbard, D. Simultaneous analysis of families of sigmoidal curves: application to bioassay, radioligand assay, and physiological dose-response curves. Am J Physiol. 235 (2), E97-E102 (1978).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological changes. J Morphol. 59 (2), 351-399 (1936).
- McKinney, M. L., McNamara, K. Heterochrony: the evolution of ontogeny. , Plenum Press. New York. (1991).
- Hardie, D. C., Gregory, T. R., Hebert, P. D. From pixels to picograms: a beginners' guide to genome quantification by Feulgen image analysis densitometry. J Histochem Cytochem. 50 (6), 735-749 (2002).
- Koshikawa, S., Miyazaki, S., Cornette, R., Matsumoto, T., Miura, T. Genome size of termites (Insecta, Dictyoptera, Isoptera) and wood roaches (Insecta, Dictyoptera, Cryptocercidae). Naturwissenschaften. 95 (9), 859-867 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유