Method Article
أساليب لفترات الخوادر التدريج والقياس للجناح تصبغ المورفولوجية جوتيفيرا
In This Article
Summary
ويرد وصف بروتوكولات لتنظيم فترات الخوادر وقياس الجناح تصبغ جوتيفيرا المورفولوجية . التدريج والتحديد الكمي لتصبغ توفر أساسا متينا لدراسة آليات إنمائية من صفات الكبار وتمكن المقارنة التنمية سمة.
Abstract
الأنواع المتنوعة من المورفولوجية (ذبابة الفاكهة) توفير الفرص لدراسة آليات التنمية والتغييرات الوراثية مسؤولة عن التغيرات التطورية. على وجه الخصوص، مرحلة الكبار مصدرا غنيا للصفات المورفولوجية للمقارنة، بما في ذلك الجناح تصبغ المقارنة. لدراسة الفوارق التنموية بين الأنواع، المراقبة المفصلة والتدريج المناسبة مطلوبة للمقارنة الدقيقة. هنا يصف لنا البروتوكولات الخاصة بالتدريج لفترات الخوادر والتحديد الكمي لتصبغ الأجنحة في ذبابة الفاكهة البولكا منقط، جوتيفيرا المورفولوجية. أولاً، نحن تصف طريقة الملاحظة المورفولوجية مفصلة وتعريف المراحل الخوادر استناداً إلى مورفولوجيس. ويشمل هذا الأسلوب أسلوب لإزالة بوباريوم، وهي قضية تشيتينوس الخارجي عذراء، لتمكين المراقبة المفصلة من مورفولوجيس الخوادر. ثانيا، نحن تصف طريقة لقياس مدة محددة المراحل الخوادر. وأخيراً، يصف لنا طريقة للتحديد الكمي للجناح تصبغ استناداً إلى تحليل الصور باستخدام الصور الرقمية والبرمجيات إيماجيج. بهذه الأساليب، علينا إرساء أساس متين لمقارنة العمليات التنموية من سمات الكبار خلال مراحل الخوادر.
Introduction
بعض من الصفات المورفولوجية المورفولوجية هي التنوع بين الأنواع1،2،3،،من45. يمكن أن نتناول المسألة التنوع المورفولوجي كيف ينشأ عن طريق مقارنة آليات توليد هذه مورفولوجيس. أمثلة من هذا القبيل مورفولوجيس trichomes اليرقات وأمشاط الجنس الكبار والجهاز التناسلي الخارجي، تصبغ البطن والجناح تصبغ6،،من78،9، 10 , 11 , 12 , 13 , 14 , 15-لدراسة الاختلافات المورفولوجية بين البالغين، رصد وتحليل المراحل الخوادر مهمة، يتحدد مصير الصفات الكبار في المراحل المتأخرة اليرقات وعائدات morphogenesis اللاحقة خلال فترة الخوادر.
في دراسات علم الأحياء التنموي من melanogaster المورفولوجية، "ساعات الاتحادية" (ساعات بعد تشكيل الخوادر) هو الأسلوب المشترك للإشارة إلى مرحلة الخوادر16. هذا النظام يستخدم الوقت المطلق بعد تشكيل الخوادر ومريحة للغاية للتجارب الروتينية. ومع ذلك، سرعة النمو قد تختلف بين الخوادر، وقد تتأثر بالاختلافات الوراثية أو جينية أو ميكرونفيرونمينتال طفيفة، ولذلك بعد نفس الوقت المطلق بعد تشكيل الخوادر لا يضمن أن الخوادر في الوقت نفسه مرحلة النمو. في كثير من الحالات، مراحل المعرفة بالخصائص المورفولوجية الأفضل للمقارنة بين عدة أفراد. وبخاصة، يتطلب مقارنة بين الأنواع التدريج الدقيق والمقارنة بين المراحل (مثلى) المطابق.
اعترف Bainbridge وبوونيس17 20 مراحل الخوادر (P1 إلى P15(ii)) استناداً إلى الخصائص المورفولوجية الخوادر melanogaster المورفولوجية . هذا التدريج هو النظام الأكثر استخداماً ل انطلاق التنمية المورفولوجية18. وفي دراسة سابقة، أجرينا التدريج الخوادر من جوتيفيرا المورفولوجية لإرساء أساس للجناح تصبغ الدراسات19. دال-جوتيفيرا نمط بولكا-نقطة سوداء على اجنحتها وهو واحد من الأنواع النموذجية للجناح تصبغ تشكيل20. على الرغم من أن أشرنا إلى معايير مورفولوجية الموصوفة في Bainbridge وبونس البحوث17، قمنا بقياس المدد المرحلة مباشرة بالملاحظات المسلسل19، بدلاً من استخدام تقدير المدد المرحلة Bainbridge و بونس من لاحظ تردد. هنا يصف لنا طريقة التدريج الخوادر وقياس المدد الزمنية لمراحل الخوادر المورفولوجية المستخدمة في فوكوتومي وآخرون19.
لدراسة الآلية التنموية لتصبغ الجناح، نحن بحاجة إلى معرفة متى يحدث التصبغ في المراحل الخوادر أو الكبار. فوكوتومي وآخرون. 19 كمياً الكثافة الضوئية (ODs) من التصبغ خلال مراحل الخوادر والكبار بتحليل صورة من صور الجناح. ويعتقد أن تكون ناجمة عن تراكم الميلانين الأسود21تصبغ أجنحة المورفولوجية . للتحديد الكمي للمواد المستنفدة للأوزون، استخدمت الصور تدرج رمادي و البرمجيات (https://imagej.nih.gov/ij/) إيماجيج22 . للاعتراف وقياس التصبغ الخاصة بالموقع (ΔOD)، ونحن طرح OD خارج بقعة من OD داخل بقعة. لجعل هذا الأسلوب استنساخه وموضوعية، ينبغي أن تحدد أماكن قياس OD استخدام عروق الجناح كمعالم. في هذه المقالة، يصف لنا بالتفصيل هذا الأسلوب الكمي لتصبغ الجناح في جوتيفيرا المورفولوجية.
Protocol
1-ذبابة الأوراق المالية
- استخدام جوتيفيرا المورفولوجية لكافة البروتوكولات التالية.
- استخدام قارورة من البلاستيك (قطر 25 مم × الارتفاع 96 مم) والمقابس السليلوز (القطر 23 مم × الارتفاع 26 مم) للمحافظة على المخزون. استخدام طعام دقيق الذرة/السكر/الخميرة/أجار قياسية ومتابعة منشور وصف ثلاث وصفات أخرى بديلة لهذه الأنواع2.
ملاحظة: يتم توفير جوتيفيرا دال (عدد الأسهم 15130-1971.10) بمركز تقييم الأنواع المورفولوجية في جامعة كاليفورنيا، سان دييغو. على الرغم من أن جوتيفيرا دال- ينتمي إلى إيميجرانس-تريبونكتاتا الإشعاع، الذي يرتبط دال melanogaster بعيد داخل جنس23، له العديد من الخصائص البيولوجية مشتركة مع ميلانوجاستير د . وبناء على ذلك، يمكن تطبيق هذا البروتوكول لكثير من الأنواع المورفولوجية ، على الرغم من أن تتطلب بعض أنواع محددة من الأغذية و/أو نصائح تقنية للحفاظ عليها2.
2-المراقبة عذراء وتعريف المراحل الخوادر
ملاحظة: عذراء للمراقبة مأخوذ من المخزون يطير مع 12:12 دورة ح الضوء/الظلام عند 25 درجة مئوية. ووصف Bainbridge وبونس17 خطر منخفض التحرك melanogaster د الخوادر من المكان الأصلي بوبيشن على قطعة من ترطب المناديل الورقية (97 ٪ البقاء على قيد الحياة الخوادر انتقل 946). يمكن إعداد جوتيفيرا د الخوادر أساسا نفس الأسلوب.
- ضع البالغين الأصحاء من المورفولوجية في الأغذية الطازجة (معيار دقيق الذرة/السكر/الخميرة/أجار الأغذية) في قنينة بلاستيكية (قطرها 25 مم × الارتفاع 96 مم) والسماح لهم بوضع البيض. الانتظار 7 أيام للحصول على إينستارس الثالثة مساء.
- ضع 1 مل من معيار دقيق الذرة/السكر/الخميرة/أجار الغذاء إلى كل microtube 1.5 مل. جعل الثقوب 3 مع تباعد 2 مم في أغطية microtubes باختراق مع دبوس للسماح للتنفس.
- الطرد المركزي microtubes مع الغذاء مقابل 7 s في ميكروسينتريفوجي ميني (860 س ز).
- عكس والاستفادة من قنينات لإزالة جميع البالغين من القنينة.
- من أجل 5-10 مل من ddH2س (أو عكس تناضح المياه) إلى القنينة.
- صب اليرقات مع الماء في طبق بتري بلاستيك (قطر 90 مم × الارتفاع 15 ملم). تحديد instars الثالثة مساء حسب حجمها كبير الجسم (3-4 ملم في الطول).
- تحرك بلطف أواخر يرقات الطور الثالث مع الملقط إلى microtubes مع الغذاء (اليرقات 10/microtube). تبني عليها بين عشية وضحاها في 25 درجة مئوية.
- نقل الخوادر المنشأة حديثا على قطعة من المناديل الورقية التي تم مبلل ب ddH2س وتوضع في طبق بتري بلاستيك (قطرها 35 مم × الارتفاع 10 ملم).
- ضع طبق بيتري في غرفة رطبة (التي تحتوي على 10 مل من ddH2س في الجزء السفلي)، وانتظر حتى الخوادر تطوير إلى مرحلة المطلوب.
- نقل الخوادر على قطعة ترطب من المناديل الورقية في بلاستيك طبق بتري (قطرها 60 مم × الارتفاع 15 ملم).
ملاحظة: تعريف مراحل يمكن غالباً يكون على أساس مراحل melanogaster دال-17. عادة، يمكن تصنيف الخوادر فترة المورفولوجية في P1-P15(ii)، على الرغم من بعض التعديلات لتعريف المرحلة سيكون حسب الأنواع المستخدمة. إذا كان ذلك ممكناً، إزالة بوباريوم يتيح مراقبة دقيقة ومفصلة. انظر التفاصيل أدناه (الخطوة 3). - مراقبة الخوادر تحت مجهر ستيريو. التقاط الصور باستخدام كاميرا رقمية المرفقة بالمجهر ستيريو.
3-إزالة بوباريوم
ملاحظة: الخوادر المورفولوجية مشمولة ببنية تسمى بوباريوم. حشرة موسكومورفا (الذباب) لا يلقي به بشرة اليرقات في بوبيشن؛ بدلاً من ذلك، أنه يصلب بشرة بعد أبوليسيس، ويستخدم كغطاء حماية من عذراء، بوباريوم24. وقد عذراء المقيمين داخل بوباريوم بشرة الخوادر حقيقية، ولينة وهشة للغاية. قبل أن يتم أبوليسيس حول P4(ii)، يتم إرفاق ابيثيليا وبوباريوم معا، وإزالة ذلك بوباريوم دون الأضرار من الصعب جداً. بعد P5، إزالة بوباريوم شاقة، ولكنها مفيدة لتعريف مراحل الخوادر والملاحظة المورفولوجية. العملية تجري على النحو التالي.
- إلصاق قطعة من الشريط على الوجهين على قطعة من منشفة ورقية.
- وضع عذراء على الجانب البطني الشريط على الوجهين حتى (الشكل 1A).
- تحديد المسافة بين الجانب الأمامي بوباريوم وعذراء الداخلية. فهم وإزالة بوباريوم حول هذه الفجوة باستخدام الملقط، وفضح على الجانب الأمامي من رئيس الخادرة.
- إدراج تلميح الملقط بنقله موازية للمحور الأمامي الخلفي. رفع طرف الملقط لكسر محلياً في بوباريوم. كرر هذا الإجراء حتى تصل إلى الكسر في الجزء الخلفي من بوباريوم. التأكد من أن هناك فجوة تتشكل أيضا بين بوباريوم والساقين الخوادر، وكسر الجانب البطني بوباريوم والتقليل من الأضرار التي لحقت بعذراء الداخلية (الشكل 1B).
- بعد كسر في بوباريوم إلى أقصى حد ممكن، تأخذ بها عذراء استخدام الرسام غرامة (#5-0) (الشكل 1).
- ضع الخادرة على قطعة من المناديل الورقية التي تم مبلل مع ddH2س وتوضع في طبق بتري بلاستيك (قطرها 60 مم × الارتفاع 15 ملم). التقاط صور فوتوغرافية أقرب لأن عذراء تتعرض الضعيفة وسهولة تصبح جافة.
ملاحظة: الخوادر دون بوباريوم ليست مناسبة لقياس المدد الزمنية لفترات الخوادر (الخطوة 4)، لأن الضغط (مثل جفاف) والأضرار المادية التي قد تتداخل مع التطور الطبيعي.
4-قياس المدد الزمنية لمراحل الخوادر
- إعداد الخوادر لقياس المدد الزمنية لمراحل الخوادر كما هو موضح في الخطوة 2. جمع الخوادر من 1-2 و 2-3، و 3-4 أيام بعد تشكيل الخوادر (20 الخوادر لكل). إعطاء أرقام الهوية الفردية (1-60) إلى الخوادر لتحديد الهوية. مواصلة جمع حديثا شكلت الخوادر خلال الخطوات التالية، للحصول على 20 الخوادر الشباب أكثر. إعطاء أرقام الهوية الفردية (61-80) إلى الخوادر المنشأة حديثا. وضع عذراء على قطعة من ddH2س مبلل المناديل الورقية في بئر (3.9 سم2) صفيحة ثقافة الخلية 12-جيدا (عذراء 1/حسنا، 12 الخوادر/اللوحة). ملء المساحة جيدا بين لوحات مع ddH2س الحفاظ على رطوبة ووضع الأغطية على وضع اللوحات في 25 درجة مئوية، وظروف الإضاءة ثابتة (ح 24:0 الضوء/الظلام).
ملاحظة: الخوادر دون بوباريوم ليست مناسبة لقياس المدد الزمنية لفترات الخوادر. الرجاء لا تقم بإزالة بوباريوم. - ملاحظة السمات المورفولوجية بما في ذلك لون الجسم والأنابيب مالباييان وشعيرات الجسم الأصفر الخوادر لكل مرة واحدة كل 30 دقيقة، وسجل ملاحظة المراحل (P1-P15(ii)، استناداً إلى17،المراجع19) في ورقة تالي.
- تواصل تسجيل أكثر من أربعة أيام على التوالي (96 ساعة) بتحول الدورية للأشخاص الثلاثة (أو أكثر).
- حساب عدد السجلات في كل مرحلة معينة، ومتوسط لهم (متوسط عدد الملاحظات/الخوادر). ثم ضرب لهم من 0.5 (h)، أسفر عن أطوال المقدرة للمراحل (ح).
5-قياس كثافة البقع السوداء على الجناح
ملاحظة: يمكن قياس كثافة البقع السوداء على جناح الخوادر أو الكبار بقياس الكثافة البصرية (OD). مرشح زجاج مع المواد المستنفدة للأوزون معروفة (مرشح الكثافة صعدت) يستخدم لمعايرة25، بحيث واحد يمكن حساب التطوير التنظيمي لمجال معين من صورة رقمية للجناح. تقاس OD في بقعة والتوجيه التشغيلي خارج الموقع، وهذا الأخير هو مطروح من السابق للحصول على كثافة البقعة (ΔOD). هنا، يمكننا وصف طريقة التشريح، وقياس وحساب ΔOD. يمكن أن يتم هذا الإجراء بعد الخطوة 2، مستقلة من الخطوة 3 والخطوة 4. مجرد واحد قد تؤدي الخطوة 2 وتفهم جميع مراحل الخوادر، أحد مباشرة بدء أو كرر الخطوة 5.
- إعداد الصور
- تعد عذراء جديدة من مرحلة التنسيق كما هو موضح في الخطوة 2. إزالة الجزء الأمامي من بوباريوم مع الملقط. تأخذ بها عذراء استخدام الملقط ووضعه في الفوسفات مخزنة المالحة (برنامج تلفزيوني، الجدول 2) في بلاستيك طبق بتري (قطرها 35 مم × الارتفاع 10 ملم).
- قص المشترك القاعدية للجناح (مشترك القاعدية هو الجزء الدانية ضيقة من الجناح). كما يتم طي الجناح، وضعه في بلاستيك طبق بتري (قطرها 35 مم × الارتفاع 10 ملم) مليئة ddH2س على توسيعه بالضغط الاسموزي (الجناح تتكشف بحد ذاته).
- جمع حديثا اكلوسيد الكبار مرة واحدة كل 10 دقيقة من قنينة أسهم. تخدير يطير مع أول أكسيد الكربون2 استخدام لوحة أنيسثيتيزينج CO2 وتأكيد أنيسثيتيزيشن بالجمود وقطع المشترك القاعدية للجناح.
- مكان 10 ميليلتر من برنامج تلفزيوني على شريحة زجاجية، وضع الجناح هناك، وتغطية كشف الغطاء (18 ملم × 18 ملم).
- قم بتشغيل ضوء المجهر ستيريو. مجموعة النور لتكون في مستوى الحد الأقصى. تعيين العدسة الهدف 11.5 X. تعيين الحجاب الحاجز لتكون الدولة الأكثر انفتاحاً. قم بتشغيل الكاميرا. ضبط الكاميرا لتكون (ISO: 100، وضع 3136 العشق 2352 بكسل، سرعة مصراع: 1/20 ثانية). التركيز على العينة بتحريك مقبض التركيز من المجهر.
- اضغط على زر المصراع في وحدة التحكم عن بعد لالتقاط صورة. التقاط صور 3 كل الأجنحة، كل منها يجب أن تتركز على سينسيلوم كامبانيفورم، كروسفين الموضعية أو الخلفي الاتجاه الطولي، وتحديد المواقع في الجزء القاصي من الجناح على الجانب الأيسر والجزء الأمامي من الجناح على الجانب العلوي.
- معايرة
- التقاط صور من 9 أجزاء من عامل تصفية صعدت الكثافة باستخدام نفس إعدادات الكاميرا المستخدمة للحصول على صورة الجناح.
- بدء ImageJ البرمجيات (https://imagej.nih.gov/ij/)22.
- انقر فوق الملف | فتح | وحدد إحدى الصور فلتر الكثافة المتدرجة.
- انقر فوق الصورة | نوع | 8-بت | لتحويل الصورة إلى صورة 8 بت.
- انقر فوق تحرير | اختيار | تحديد | والتحقق من عمود البيضاوي و توسيط . كتابة 100 (بكسل) في عرض العمود، 100 (بكسل) في عمود الطول ، 1568 في عمود تنسيق X و 1176 في عمود تنسيق Y . انقر فوق "موافق".
- انقر فوق تحليل | قياس |. وتقاس القيمة الرمادية "تعني" لمناطق مختارة.
- كرر 5.2.3. ل 5.2.6. 8 المتبقية الصور.
- انقر فوق تحليل | معايرة وحدد رودبارد25 في عمود الدالة وكتابة رقم التالي في العمود الأيمن في الوسط (0.04، 0.336، 0.632، 0.928، 1.224، 1.52، 1.816، 2.112، 2.408؛ وهذه الأرقام تعتمد على الكثافة من صعدت مرشح الكثافة).
- فحص المعايرة العالمية العمود، ثم انقر فوق موافق.
ملاحظة: قبل تنفيذ هذا الإجراء، "تعني القيمة الرمادية" يتم تحويلها إلى "الكثافة البصرية (OD)" باستخدام الدالة رودبارد. بعد هذه الخطوة، يمكن حساب الكثافة البصرية لمنطقة مختارة معينة في برنامج إيماجيج.
- اختيار مجال القياسات
ملاحظة: النقاط ترتبط عادة مع المعالم، مثل سينسيلا كامبانيفورم، ونصائح الاتجاه الطولي، وكروسفينس. يمكن استخدام هذه ومعالم أخرى في جناح لاختيار المنطقة للقياسات. هنا، سبيل مثال فيD. guttifera(الشكل 2) ويرد.- تعريف النقطة أ، بقعة سينسيلوم كامبانيفورم.
- قم بفتح صورة التي بقعة سينسيلوم كامبانيفورم في مركز الصورة. انقر فوق الصورة | نوع | 8-بت | لتحويل الصورة إلى صورة 8 بت.
- انقر فوق المستطيل في مجال أدوات التحديد ورسم مستطيل. تعيين الرأس الأيسر العلوي للمستطيل بحيث أنها متمسكة بخط الخلفي الاتجاه الطولي الثالث والقاصي أكثر من بقعة سينسيلوم كامبانيفورم. تعيين الجانب الأيمن من المستطيل بحيث يقع بحق سينسيلوم كامبانيفورم الموضعية.
- انقر فوق تحرير | اختيار | إضافة إلى إدارة |. تحقق من العمود إظهار الكل .
- انقر فوق أداة زاوية في أدوات التحديد الخط. رسم الخط الأول في السطر اللاحق للاتجاه الطولي الثالث. تعيين نقاط النهاية اليسرى للخط في ذروة المستطيل رسمها في الخطوة 1. رسم السطر الثاني في الجانب العلوي من المستطيل. اضغط على مفتاح "m" لقياس الزاوية بين اثنين الخطوط المرسومة في هذه الخطوة. انقر فوق إطار الصورة على شاشة الكمبيوتر.
- انقر فوق تحرير | اختيار | إضافة إلى إدارة |.
- انقر فوق المستطيل في مجال أدوات التحديد ورسم مستطيل من حوالي 1/9 حجم إطار الصورة. انقر فوق تحرير | اختيار | استدارة |. كتابة درجات ناقص من زاوية قياسها في خطوة 5.3.1.4. في زاوية العمود وانقر فوق موافق لتدوير المستطيل رسمها في هذه الخطوة.
- نقل المستطيل رسمها في خطوة 5.3.1.6. باستخدام مفاتيح الأسهم. تعيين نقطة نهاية السطر اللاحق للاتجاه الطولي الثاني على الجانب الأيمن من المستطيل والجانب السفلي من المستطيل الذي يعلق على خط الخلفي الاتجاه الطولي الثالث. تأكد من أن يتم رسم خط عمودي من نقطة نهاية الاتجاه الطولي الثاني إلى السطر الخلفي في الاتجاه الطولي الثالث في هذا الإجراء. تعريف سيرا على أقدام خط عمودي كنقطة A (الشكل 2A).
- تسجيل اﻻحداثي س والإحداثي ص للنقطة أ، المبينة أدناه مجال اختيار الأدوات عند وضع المؤشر على ألف نقطة
- تعريف النقطة (ب)، بقعة نصيحة الاتجاه الطولي
- قم بفتح صورة التي بقعة نصيحة الاتجاه الطولي في مركز الصورة. انقر فوق الصورة | نوع | 8-بت | لتحويل الصورة إلى صورة 8 بت.
- كرر نفس الإجراء الموضح في الخطوة 5.3.1. (تعريف النقطة A، سينسيلوم كامبانيفورم الموضعية) للبحث عن النقطة أ في الصورة.
- انقر فوق تحرير | اختيار | إضافة إلى إدارة |.
- انقر فوق المستطيل في مجال أدوات التحديد ورسم مستطيل. تعيين الرأس الأيسر العلوي للمستطيل عند نقطة النهاية لخط الاتجاه الطولي الثالث الخلفي.
- انقر فوق تحرير | اختيار | إضافة إلى إدارة |.
- انقر فوق أداة زاوية في أدوات التحديد الخط. رسم السطر الأول للاتصال بنقطة ونقطة النهاية لخط الاتجاه الطولي الثالث الخلفي. تحديد هذا الخط "خط أ رسم" السطر الثاني في الجانب العلوي من المستطيل رسمها في خطوة 5.3.2.4. اضغط على مفتاح "m" لقياس الزاوية بين هذين الخطين.
- انقر فوق تحرير | اختيار | إضافة إلى إدارة |.
- انقر فوق المستطيل في مجال أدوات التحديد ورسم مستطيل من حوالي 1/9 حجم إطار الصورة. انقر فوق تحرير | اختيار | استدارة |. كتابة درجات ناقص من زاوية قياسها في الخطوة 5.3.2.6. في زاوية العمود وانقر فوق موافق لتدوير المستطيل رسمها في هذه الخطوة. نقل المستطيل باستخدام مفاتيح الأسهم. تعيين الجانب العلوي من المستطيل بحيث أنها موصولة إلى الخط A ونقطة نهاية الخط الأمامي للاتجاه الطولي الرابع حيث يكون على الجانب الأيمن من المستطيل.
- انقر فوق تحرير | اختيار | إضافة إلى إدارة |.
- انقر فوق المستطيل في مجال أدوات التحديد ورسم مستطيل من حوالي 1/9 حجم إطار الصورة. انقر فوق تحرير | اختيار | استدارة |. كتابة درجات ناقص من زاوية قياسها في الخطوة 6 في زاوية العمود وانقر فوق موافق لتدوير المستطيل رسمها في هذه الخطوة. نقل المستطيل باستخدام مفاتيح الأسهم. تعيين الذروة الأيسر السفلي من المستطيل بحيث أنها في الذروة الأيسر العلوي من المستطيل رسمها في خطوة 5.3.2.8.، مما أسفر عن الحصول على خط عمودي من نقطة نهاية الخط الأمامي للاتجاه الطولي الرابعة "تحديد خط أ" نقطة تقاطع خط عمودي وخط الخلفي الاتجاه الطولي الثالثة كالنقطة (ب) (الشكل 2).
- سجل اﻻحداثي س والإحداثي ص للنقطة (ب)، المشار إليها أدناه مجال اختيار الأدوات عند وضع المؤشر على النقطة B.
- تعريف نقطة مئوية، بقعة كروسفين الخلفي
- قم بفتح صورة التي بقعة كروسفين الخلفي في مركز الصورة. انقر فوق الصورة | نوع | 8-بت | لتحويل الصورة إلى صورة 8 بت.
- تعريف C نقطة كنقطة معظم الخلفي للخط الأمامي في الاتجاه الطولي الرابعة في مجال تقاطع كروسفين الخلفي وفي الاتجاه الطولي الرابعة (الشكل 2).
- سجل اﻻحداثي س والإحداثي ص للنقطة ج، المبينة أدناه مجال اختيار الأدوات عند وضع المؤشر على النقطة C.
- تعريف النقطة (د)، منطقة التحكم
- قم بفتح صورة التي بقعة سينسيلوم كامبانيفورم في مركز الصورة. انقر فوق الصورة | نوع | 8-بت | لتحويل الصورة إلى صورة 8 بت.
- انقر فوق مستقيم في أدوات التحديد خط ورسم خط توصيل نقطة نهاية الخط الأمامي للاتجاه الطولي الثاني ونقطة النهاية لخط الخلفي الاتجاه الطولي الرابعة. تعريف د نقطة كنقطة عبور لهذا الخط والخط الخلفي للاتجاه الطولي الثالث (الشكل 2D).
- تسجيل اﻻحداثي س والإحداثي ص د نقطة، المبينة أدناه مجال اختيار الأدوات عند وضع المؤشر على النقطة d
- تعريف النقطة أ، بقعة سينسيلوم كامبانيفورم.
- القياسات
- فتح إحدى صور بقع الجناح (للقياس من النقطة (أ)، فتح الصورة مع النقطة (أ) في المركز). انقر فوق الصورة | نوع | 8-بت | لتحويل الصورة إلى صورة 8 بت.
- انقر فوق المستطيل في مجال أدوات التحديد ورسم مستطيل من حوالي 1/9 حجم إطار الصورة.
- انقر فوق تحرير | اختيار | تحديد |. تحقق من العمود البيضاوي و توسيط . كتابة 100 (بكسل) في أعمدة العرض و الارتفاع ، اكتب إحداثيات x للنقطة A (أو النقطة (ب) أو نقطة ج) ودال في العمود X تنسيق وكتابة y إحداثيات النقطة A (أو النقطة (ب) أو نقطة ج) ود في عمود تنسيق Y . انقر فوق "موافق".
- انقر فوق تحليل | قياس |. إذا كان الفعل تم الانتهاء من المعايرة ووصف 5.2، يتم الإشارة إلى المواد المستنفدة للأوزون في عمود يعني .
- حساب ΔODs عن طريق طرح OD د نقطة من المواد المستنفدة للأوزون نقاط ألف، وباء وجيم.
ملاحظة: د نقطة في جزء شفاف الجناح لا تشمل تصبغ وذلك هو مناسبة لعنصر تحكم خلفية.
النتائج
فترة الخوادر من جوتيفيرا دال- ينقسم إلى مراحل 17 (P1-P15(ii)؛ وصور للممثل ثلاث مراحل (P1, P5-6، P10) مبينة في الشكل 3، وجميع مراحل 17 موضحة في الشكل 4). على الرغم من اعتراف Bainbridge وبونس17 مراحل 20 في ميلانوجاستير دال، بعض هذه المراحل تعذر تطبيق إلى جوتيفيرا د. ترتيب الأحداث التنموية اثنين، ومظهر الجسم الأصفر (كتلة من الخلايا سقيفة داخل الأمامي26) وتوقيت الأنابيب Malpighian تحول الخضراء، لا تسيطر تماما في جوتيفيرا دال-، ومن ثم نحن يمكن أن لا تفصل P5 (ط )، P5(ii) و P6. أيضا، على عكس في ميلانوجاستير دال، توقيت تشويه من شعيرات الصدر والبطن كان تزامن، ولذلك يمكن أن نفصل لا P11(i) و P11(ii)19.
ويمكن أن نقيس طول مراحل الخوادر من جوتيفيرا دال (الجدول 3، من فوكوتومي et al.19). طوال فترة الخوادر حوالي 20 ح أطول كثيرا من ميلانوجاستير دال- في17من 25 درجة مئوية. قمنا بحساب ΔODs للمناطق المحيطة سينسيلوم كامبانيفورم ونصيحة الاتجاه الطولي وكروسفين الخلفي. هنا، علينا أن نبدي بالمواد المستنفدة للأوزون و ΔODs في البالغين 7 أيام بعد اكلوسيون (الجدول 4). بمقارنة البيانات الخاصة بمراحل متعددة، وجدنا أن المرحلة P12(i) هو توقيت ظهور تصبغ، وإكمال أن التصبغ قبل 24 ساعة بعد اكلوسيون (الشكل 5، من القياسات الأصلية المستخدمة في فوكوتومي et al. 19).
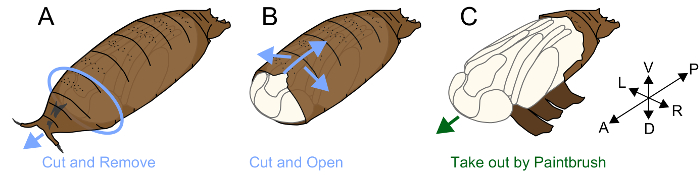
رقم 1. شكل توضيحي لإزالة بوباريوم- (أ) وضع جانب البطني عذراء حتى على قطعة من الشريط على الوجهين. إزالة الجزء الأمامي من بوباريوم. (ب) كسر في بوباريوم مع الملقط من الجانب البطني. (ج) بعد كسر بوباريوم، تأخذ بها عذراء استخدام الرسام. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

رقم 2. تعريف المنطقة لقياس التصبغ. (أ) النقطة أ لبقعة المرتبطة سينسيلوم كامبانيفورم. (ب) النقطة (ب) لبقعة المرتبطة بنصيحة الاتجاه طولي. (ج) النقطة ج لبقعة المقترنة كروسفين الخلفي. (د) نقطة د لمنطقة تحكم. أشرطة مقياس تشير إلى 250 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 3. أمثلة على مراحل محددة الخوادر. (أ) عذراء المرحلة P1 مغطاة بوباريوم. (ب) عذراء المرحلة P5-6. (ج) عذراء المرحلة P10. تتم إزالة بوباريا قبل الملاحظة في (ب) و (ج). الإشارة إلى أشرطة مقياس 500 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
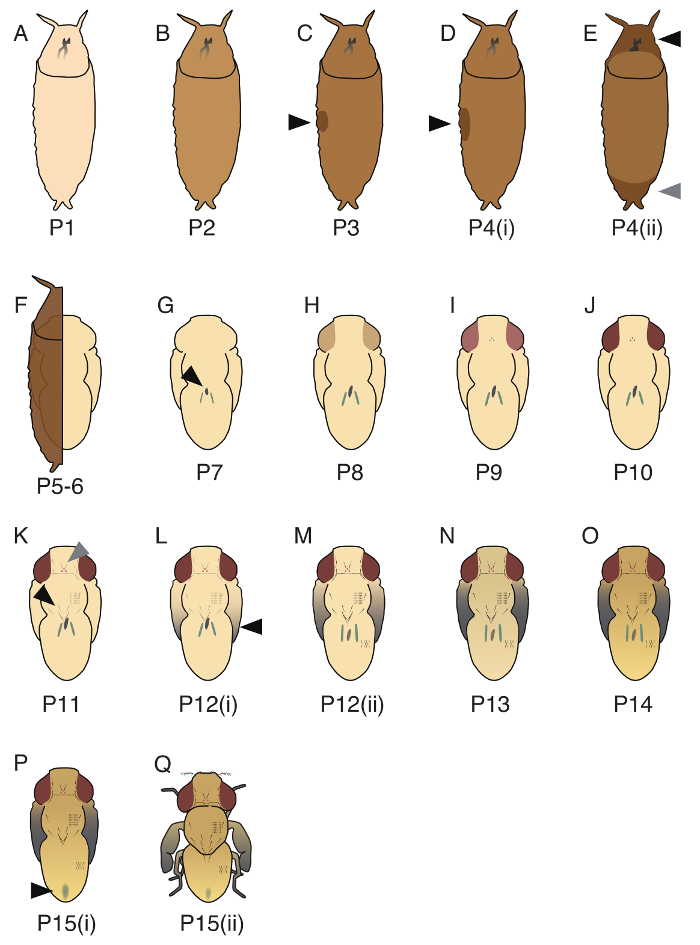
الشكل 4. الرسوم التوضيحية لمراحل الخوادر 17 المحددة في جوتيفيرا د. (أ) P1, بوباريوم الأبيض. (ب) P2، لون بوباريوم خفيفة براون. (ج) P3، لوحظ أن فقاعة في الجانب الأفقي (السهم الأسود). (د) P4(i)، الفقاعة أكبر من ذلك في P3 (السهم الأسود)، والخادره المزدهر في برنامج تلفزيوني. (ه) P4(ii)، لوحظ أن فجوة في الجزء الأمامي (السهم الأسود) والجزء الخلفي (رمادي رأس السهم). (و) P5-6، مالباييان ترحيل الأنابيب (من الصعب معرفة ما إذا كان يشملها بوباريوم). ويتكون الشكل الخوادر ظهارة الخوادر وبشرة الخوادر. (ز) P7، يمكن ملاحظة الجسم الأصفر في الجهة الظهرية (السهم الأسود). (ح) P8، العيون صفراء. (ط) P9، العيون هي العنبر. (ي) P10، العيون حمراء. (ك) P11 وشعيرات المداري وأوسيلار (رأس السهم الرمادي)، بيبرس، ماكروتشايتاي الصدر (السهم الأسود) وشعيرات الرصغي الأسود ومرئية. (ل) P12(i)، نصائح أجنحة رمادية. (م) P12(ii)، كل أجزاء من الأجنحة بالرمادي (السهم الأسود). (ن) P13، الأجنحة سوداء تماما. (س) P14 والرأس والساقين هي مظلمة تماما. (ف) P15(i)، يمكن ملاحظة العقي في البطن الظهرية (السهم الأسود). (ف) P15(ii)، يطير اكلوسينج. ووصفت تفاصيل هذه المراحل في فوكوتومي et al. 19 الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الرقم 5. تطوير تصبغ حول سينسيلوم كومبانيفورم في جناح. الدوائر تشير إلى ΔODs الفردية، وأشرطة أفقية تشير إلى متوسطات. P10: n = 10، P11: n = 10، 12(i): n = 10, P15(i): ن = 11، 3 ح ن = 8، 24 h: n = 7، 7 أيام: ن = 10. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| المكون | |
| السكر الناعم الأبيض | ز 51.6 |
| طحين الذرة | ز 172.4 |
| الذرة الحصى-ج | ز 86.4 |
| خميرة البيرة الجافة | 106 ز |
| مسحوق أجار | ز 35.28 |
| ddH2س | مل 4000 |
| يغلي 30 دقيقة وترك لتبرد وصولاً إلى 70 درجة مئوية. | |
| إضافة 4 غرام من بوتيل فهيدروكسيبينزواتي حله في 40 مل إيثانول. | |
| تخلط جيدا وتصب كل 9 مل في قارورة من البلاستيك (قطر 25 مم × الارتفاع 96 مم). | |
الجدول 1. تكوين معيار دقيق الذرة/السكر/الخميرة/أجار الغذاء.
| المكون | المبلغ |
| كلوريد الصوديوم | ز 80 |
| بوكل | ز 2 |
| غ2هبو4·12H2س | ز 29 |
| خ2ص4 | ز 2 |
| ddH2س | يصل إلى 10 لتر |
| تعيين الأس الهيدروجيني 7.4 |
الجدول 2. تكوين برنامج تلفزيوني (1 X).
| المرحلة | يعني المدة (ح) | التنمية المستدامة | n |
| P1-2 | 1.7 | 0.65 | 16 |
| P3 | 2.1 | 0.65 | 16 |
| P4(i) | 2.1 | 1.69 | 19 |
| P4(ii) | 0.3 | 0.28 | 29 |
| ف-5-6 | 5.0 | 3.07 | 30 |
| P7 | 31.9 | 7.22 | 46 |
| P8 | 9.6 | 2.81 | 57 |
| P9 | 10.9 | 2.66 | 55 |
| P10 | 11.7 | 2.96 | 39 |
| P11 | 4.4 | 2.81 | 44 |
| P12(i) | 1.1 | 0.76 | 44 |
| P12(ii) | 2.0 | 0.70 | 43 |
| P13 | 2.2 | 0.68 | 10 |
| P14-15(i) | 28.6 | 2.75 | 10 |
| P15(ii) | 1.4 | 0.87 | 10 |
| المجموع | 121.7 |
الجدول 3. قياس المدد الزمنية لمراحل الخوادر جوتيفيرا د.
| التطوير التنظيمي | ΔOD | |||||||
| سينسيلوم كامبانيفورم | نصيحة الاتجاه الطولي | كروسفين الخلفي | عنصر التحكم | سينسيلوم كامبانيفورم | نصيحة الاتجاه الطولي | كروسفين الخلفي | ||
| الفرد | (نقطة A) | (النقطة (ب)) | (نقطة ج) | (النقطة د) | (نقطة A-D نقطة) | (النقطة باء-د نقطة) | (نقطة ج-د نقطة) | |
| 1 | 0.549 | 0.484 | 0.515 | 0.256 | 0.293 | 0.228 | 0.259 | |
| 2 | 0.529 | 0.489 | 0.516 | 0.254 | 0.275 | 0.235 | 0.262 | |
| 3 | 0.546 | 0.48 | 0.533 | 0.255 | 0.291 | 0.225 | 0.278 | |
| 4 | 0.583 | 0.496 | 0.566 | 0.255 | 0.328 | 0.241 | 0.311 | |
| 5 | 0.523 | 0.479 | 0.528 | 0.235 | 0.288 | 0.244 | 0.293 | |
| 6 | 0.572 | 0.509 | 0.546 | 0.265 | 0.307 | 0.244 | 0.281 | |
| 7 | 0.568 | 0.511 | 0.56 | 0.256 | 0.312 | 0.255 | 0.304 | |
| 8 | 0.56 | 0.507 | 0.562 | 0.27 | 0.29 | 0.237 | 0.292 | |
| 9 | 0.551 | 0.485 | 0.569 | 0.259 | 0.292 | 0.226 | 0.31 |
الجدول 4. قياس المواد المستنفدة للأوزون و ΔODs من جوتيفيرا د الكبار 7 أيام بعد اكلوسيون-
Discussion
ونحن تصف هنا البروتوكولات لتعريف مراحل الخوادر، إزالة بوباريوم للمراقبة المفصلة، قياس المدد الزمنية لمراحل الخوادر، وقياس كثافة البقع السوداء على جناح في جوتيفيرا د. يمكن تطبيق العديد من المورفولوجية هذه البروتوكولات والمتعلقة بالأنواع يطير، لا سيما مع تصبغ الجناح.
الملاحظة المتعمقة ووصف أكثر تفصيلاً من الأحداث التنموية سيمكن كذلك تقسيم المراحل. في كثير من الحالات، حدثاً التنموية التي تتطلب تشريح أو تمزيقها من عذراء ليست مناسبة لتعريف المرحلة، لأنه يتعين على المرء أن قتل عذراء للانطلاق، واستخدام المزيد من هذا الفرد الصعب. لاستخدام أحد الأنواع المورفولوجية جديدة، ينبغي أن أحد توظيف الأحداث التنموية يمكن تمييزها من خارج بوباريوم كخطوة أولى. استناداً إلى غرض الدراسة، واحد يمكن ثم مواصلة تقسيم المراحل استناداً إلى organogenesis خاصة أو غيرها من الأحداث التنموية.
للمقارنة من مراحل متعددة، إحدى صعوبات محتملة عكس ترتيب الأحداث التنموية بين الأنواع (هيتيروتشروني27). على سبيل المثال، في ميلانوجاستير دال، يصبح أنبوب مالباييان الخضراء وثم يصبح الجسم الأصفر مرئياً، بينما يمكن عكس هذا الترتيب في بعض الخوادر جوتيفيرا دال-19. في هذه حالة، من الصعب مقارنة صارمة بين مراحل مثلى. اعتماداً على ظاهرة الفائدة، واحد قد تحتاج إلى إعادة تعريف أو تقسيم مرحلة معينة استناداً حدث التنموي. على سبيل المثال، نحن تقريبا حدد الخوادر P5-6 والقيام بمقارنة تعبيرات الجين في أجنحة الخوادر استخدام الجناح مورفولوجيا كمؤشر لتوقيت التنموية14.
عادة ما يستغرق 10-30 دقيقة لإزالة بوباريوم. إذا كان أحد يريد لمراقبة مرحلة قصيرة، ينبغي إعداد الخوادر آخذا في الاعتبار الوقت الذي يمر من خلال إزالة بوباريوم. على سبيل المثال، إذا كان أحد يريد لمراقبة P12(i) من جوتيفيرا دال، التي لديها فقط 1.1 ح المدة، إعداد الخوادر في P11 سيعطي نتيجة جيدة.
لدينا بروتوكول، يستخدم ترطب المناديل الورقية لخلفية صور الخوادر. تبعاً لمرحلة المراقبة وهياكل واحدة تريد أن تظهر الشكل، يمكن للمرء استخدام أسود أو أبيض المناديل الورقية. P3 للانتقال P4(ii)، موضع الفقاعة في عذراء مهم للتمييز بين المراحل، والأسود المناديل الورقية تساعد على مراقبة موقف الفقاعة. للمراحل بعد P5، بيضاء المناديل الورقية أفضل لأنه يساعد على مراقبة الجسم الأصفر ولون العينين، وشعيرات، ولون الجسم.
وتقدر مدة مراحل الخوادر من تواتر ظهور Bainbridge وبونس17 . على الجدول المؤقت هو الأكثر استخداماً ل melanogaster دال-18. لطريقتهم، أنها أعدت أربع زجاجات الطعام تحتوي على الخمسة الكبار من الإناث والذكور البالغين خمس والاحتفاظ بها في الظلام، وثم الخوادر عشوائياً أخذت من زجاجة واحدة كل في 11، 12 و 13، و 14 يوما من بداية وضع البيض. أنها تحسب عدد الخوادر في مراحل معينة، وحساب المتوسطات. يمكن تقدير طول كل مرحلة الخوادر استناداً إلى بيانات المدة الإجمالية للفترة الخوادر وهذه البيانات التردد. مشكلة واحدة مع هذا الأسلوب أن فإنه لا يمكن استخدامها لتقدير مدة دقيقة من مراحل الخوادر إذا كان توقيت الإنمائية يميل إلى التزامن بين الخوادر.
في الواقع، حاولنا الأسلوب Bainbridge وفي بونس في جوتيفيرا دال، وحصلنا على البيانات متحيزة بسبب تزامن بين الخوادر. ونحن لم يتمكن من تحديد سبب هذه الظاهرة، ولكن بعض الاحتمالات 1) الخوادر للإبقاء على إيقاع سيركاديان من مرحلة الشباب و/أو 2) أنها رد فعل للتعرض للضوء الذي وقع في المراقبة. ولذلك، قررنا أن قياس مدة المرحلة الفعلية بالملاحظة المباشرة. وهذا يقلل من التحيز الناجم عن إيقاع circadian.
الأسلوب الموصوفة هنا طريقة لقياس تراكم إضافي من الميلانين في المناطق المحيطة بها منطقة التحكم (ΔOD)، بالمقارنة مع بطرح التطوير التنظيمي منطقة التحكم من التطوير التنظيمي لمنطقة البقعة. واستلهم هذا الأسلوب طريقة للتحديد الكمي لمحتوى الحمض النووي Feulgen تلطيخ صورة وتحليل (قياس كثافة28،،29). كواحدة من المشاكل المحتملة لتطبيق هذا الأسلوب لتصبغ الجناح، يمكن ΔOD بقيمة سالبة، خصوصا عندما عذراء الصغار جداً، وتقريبا لا تصبغ. في مراحل لاحقة، يمكن أن يكون هناك بعض التصبغ في منطقة المراقبة. قد يكون من المناسب بدلاً من ΔOD تبعاً لغرض الدراسة استخدام OD بسيطة من منطقة البقعة نفسها. في حالة جوتيفيرا دال، لم تغير استخدام OD بسيطة بدلاً من ΔOD الاتجاه للبيانات أو الاستنتاجات التي خلصت إليها الدراسة.
Disclosures
وقد المؤلفون لا تضارب في المصالح.
Acknowledgements
ونحن نشكر شون كارول باء وتوماس ويرنر لتوفير الأرصدة يطير، ناويوكي الصمامات للمعدات، بيونغ سوك جين لمساعدته في تصوير، اغاتا كييوكازو للتوجيه وإليزابيث ناكاجيما لتحرير اللغة الإنجليزية. هذا العمل كان يدعمها كاكينهي 17 ك 19427 و "مؤسسة العلوم تأكيدا".
Materials
| Name | Company | Catalog Number | Comments |
| Drosophila guttifera | The Drosophila Species Stock Center at the U.C. San Diego | 15130-1971.10 | Drosophila guttifera, a fruit fly species used in this article |
| Plastic vial | Hightech | MKC-30 | Plastic vial, for fly stock maintenance |
| Buzz plugs vial and bottle closures for glass vials | Fisher Scientific | AS-271 | Cellulose plug, for fly stock maintenance |
| White soft sugar | Mitsui Sugar | J-500g | White soft sugar, for standard cornmeal/sugar/yeast/agar food |
| Corn flour | Nippon Flour Mills | F | Corn flour, for standard cornmeal/sugar/yeast/agar food |
| Corn grits - C | Nippon Flour Mills | GC | Corn grits - C, for standard cornmeal/sugar/yeast/agar food |
| Agar powder | Matsuki Kanten Sangyo | No.602 | Agar powder, for standard cornmeal/sugar/yeast/agar food |
| Dry beer yeast | Asahi Food & Healthcare | Y2A | Dry beer yeast, for standard cornmeal/sugar/yeast/agar food |
| Butyl p-hydroxybenzoate | Nacalai Tesque | 06327-02 | Butyl p-hydroxybenzoate, for standard cornmeal/sugar/yeast/agar food |
| Ethanol | Wako | 057-00456 | Ethanol, for standard cornmeal/sugar/yeast/agar food |
| Flat bottom microtube | Ina Optica | CF-0150 | 1.5 mL microtube, for collecting pupae |
| CAPSULEFUGE | Tomy | PMC-060 | Mini microcentrifuge, for collecting pupae |
| Sterilized Schale NB | Sansei Medical | 01-013 | Plastic Petri dish (diameter 90 mm x height 15 mm) |
| Serum tube rack | Iwaki | 9796-050 | Used as a moist chamber, for observation of pupa |
| Corning Falcon Easy-Grip tissue culture dish | Corning | 353001 | Plastic Petri dish (diameter 35 mm x height 10 mm) |
| Falcon standard tissue culture dish | Corning | 353002 | Plastic Petri dish (diameter 60 mm x height 15 mm) |
| Push-pin | Kokuyo | 51233709 | Push-pin, for making pinholes on the microtube lid |
| Stereomicroscope | Olympus | SZX16 | Stereomicroscope, for morphological observation |
| Digital camera | Olympus | DSE-330-A | Digital camera, for imaging |
| NICETACK double sided tape | Nichiban | NW-15SF | Double sided tape, for removing puparium |
| Dumont #5 forceps | Fine Science Tools | 11252-20 | Forceps, for removing puparium |
| Van Gogh VISUAL Paint brush | Talens Japan | GWVR-#5/0 | Paint brush, for removing puparium |
| Greiner CELLSTAR 12 well cell culture plate | Merck | 665-180 | 12-well cell culture plate, for measuring durations of pupal periods |
| NaCl | Wako | 191-01665 | NaCl, for PBS |
| KCl | Nacalai Tesque | 285-14 | KCl, for PBS |
| Na2HPO4·12H2O | Wako | 196-02835 | Na2HPO4·12H2O, for PBS |
| KH2PO4 | Nacalai Tesque | 28721-55 | KH2PO4, for PBS |
| Stepped Neutral Density (ND) Filter 0.04 - 3.0 | Edmund Optics | 64-384 | Stepped density filter, for calibration of pigmentation measurement |
| ImageJ software | NIH | 1.8.0-101 | ImageJ software, for measurement of intensity of black spots on a wing (https://imagej.nih.gov) |
| FINE FROST glass slide | Matsunami Glass Ind | FF-001 | Glass slide, for measurement of intensity of black spots on a wing |
| Square microscope cover glass 18 x 18 | Matsunami Glass Ind | C018181 | Cover slip, for measurement of intensity of black spots on a wing |
References
- Carson, H. L., Hardy, D. E., Spieth, H. T., Stone, W. S. The evolutionary biology of the Hawaiian Drosophilidae. Essays in evolution and genetics in honor of Theodosius Dobzhansky. Hecht, M. K., Steere, W. C. , Springer (Meredith Corporation). New York. 437-543 (1970).
- Markow, T. A., O'Grady, P. M. Drosophila: a guide to species identification and use. , Academic Press. New York. (2006).
- Patterson, J. T. The Drosophilidae of the southwest. 4313, University of Texas Publication. 7-216 (1943).
- Setoguchi, S., Takamori, H., Aotsuka, T., Sese, J., Ishikawa, Y., Matsuo, T. Sexual dimorphism and courtship behavior in Drosophila prolongata. J Ethol. 32 (2), 91-102 (2014).
- Werner, T., Jaenike, J. Drosophilids of the Midwest and Northeast. , River Campus Libraries, University of Rochester. Rochester. (2017).
- Arnoult, L., et al. Emergence and diversification of fly pigmentation through evolution of a gene regulatory module. Science. 339 (6126), 1423-1426 (2013).
- Camino, E. M., Butts, J. C., Ordway, A., Vellky, J. E., Rebeiz, M., Williams, T. M. The evolutionary origination and diversification of a dimorphic gene regulatory network through parallel innovations in cis and trans. PLoS Genet. 11 (4), e1005136(2015).
- Gompel, N., Prud'homme, B., Wittkopp, P. J., Kassner, V. A., Carroll, S. B. Chance caught on the wing: cis-regulatory evolution and the origin of pigment patterns in Drosophila. Nature. 433 (7025), 481-487 (2005).
- Glassford, W. J., et al. Co-option of an ancestral Hox-regulated network underlies a recently evolved morphological novelty. Dev. Cell. 34 (5), 520-531 (2015).
- Koshikawa, S. Enhancer modularity and the evolution of new traits. Fly. 9 (4), 155-159 (2015).
- Koshikawa, S., et al. Gain of cis-regulatory activities underlies novel domains of wingless gene expression in Drosophila. Proc Natl Acad Sci U S A. 112 (24), 7524-7529 (2015).
- McGregor, A. P., et al. Morphological evolution through multiple cis-regulatory mutations at a single gene. Nature. 448 (7153), 587-590 (2007).
- Tanaka, K., Barmina, O., Kopp, A. Distinct developmental mechanisms underlie the evolutionary diversification of Drosophila sex combs. Proc Natl Acad Sci U S A. 106 (12), 4764-4769 (2009).
- Werner, T., Koshikawa, S., Williams, T. M., Carroll, S. B. Generation of a novel wing colour pattern by the Wingless morphogen. Nature. 464 (7292), 1143-1148 (2010).
- Wittkopp, P. J., et al. Intraspecific polymorphism to interspecific divergence: genetics of pigmentation in Drosophila. Science. 326 (5952), 540-544 (2009).
- Lawrence, P. A., Morata, G. Compartments in the wing of Drosophila: a study of the engrailed gene. Dev Biol. 50 (2), 321-337 (1976).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. J. Embryol. Exp. Morphol. 66, 57-80 (1981).
- Ashburner, M., Golic, K. G., Hawley, R. S. Drosophila: A Laboratory Handbook. , 2nd ed, Cold Spring Harbor Laboratory Press. New York. (2005).
- Fukutomi, Y., Matsumoto, K., Agata, K., Funayama, N., Koshikawa, S. Pupal development and pigmentation process of a polka-dotted fruit fly, Drosophila guttifera (Insecta, Diptera). Dev Genes Evol. 227 (3), 171-180 (2017).
- Koshikawa, S., Fukutomi, Y., Matsumoto, K. Drosophila guttifera as a model system for unraveling color pattern formation. Diversity and evolution of butterfly wing patterns: an integrative approach. Sekimura, T., Nijhout, H. F. , Springer. New York. in press (2017).
- True, J. R., Edwards, K. A., Yamamoto, D., Carroll, S. B. Drosophila wing melanin patterns form by vein-dependent elaboration of enzymatic prepatterns. Curr Biol. 9 (23), 1382-1391 (1999).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Izumitani, H. F., Kusaka, Y., Koshikawa, S., Toda, M. J., Katoh, T. Phylogeography of the Subgenus Drosophila (Diptera: Drosophilidae): evolutionary history of faunal divergence between the Old and the New Worlds. PLoS ONE. 11 (7), e0160051(2016).
- Resh, V. H., Cardé, R. T. Encyclopedia of Insects. , 2nd ed, Academic Press. Burlington. (2009).
- DeLean, A., Munson, P. J., Rodbard, D. Simultaneous analysis of families of sigmoidal curves: application to bioassay, radioligand assay, and physiological dose-response curves. Am J Physiol. 235 (2), E97-E102 (1978).
- Robertson, C. W. The metamorphosis of Drosophila melanogaster, including an accurately timed account of the principal morphological changes. J Morphol. 59 (2), 351-399 (1936).
- McKinney, M. L., McNamara, K. Heterochrony: the evolution of ontogeny. , Plenum Press. New York. (1991).
- Hardie, D. C., Gregory, T. R., Hebert, P. D. From pixels to picograms: a beginners' guide to genome quantification by Feulgen image analysis densitometry. J Histochem Cytochem. 50 (6), 735-749 (2002).
- Koshikawa, S., Miyazaki, S., Cornette, R., Matsumoto, T., Miura, T. Genome size of termites (Insecta, Dictyoptera, Isoptera) and wood roaches (Insecta, Dictyoptera, Cryptocercidae). Naturwissenschaften. 95 (9), 859-867 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved