Method Article
In Utero Eletroporação Abordagens para estudar a excitabilidade neuronal subpopulações e Conectividade uma única célula
Neste Artigo
Resumo
Este manuscrito fornece protocolos que usam in utero eletroporação (IUE) para descrever a conectividade estrutural dos neurônios no nível de uma única célula e a excitabilidade dos neurônios marcados com fluorescência. A histologia é utilizado para caracterizar dendrítica e projecções axonais. a gravação de célula inteira em fatias agudas é usado para investigar a excitabilidade.
Resumo
O sistema nervoso é composto de uma enorme variedade de tipos neuronais distintas. Estas subpopulações neuronais são caracterizados por, entre outras características, as suas morfologias dendríticas distintos, os seus padrões específicos de conectividade axonal, e as suas respostas de queima selectivos. Os mecanismos moleculares e celulares responsáveis por estes aspectos da diferenciação durante o desenvolvimento ainda são pouco conhecidos.
Aqui, descrevemos os protocolos combinados para a rotulagem e caracterizar a conectividade estrutural e excitabilidade dos neurônios corticais. Modificação do protocolo in utero eletroporação (IUE) permite a rotulagem de uma escassa população de neurônios. Este, por sua vez, permite a identificação e rastreio dos dendritos e axônios dos neurônios individuais, o caracterização precisa da localização laminar de projeções axonais e análises morfométricas. IUE também pode ser utilizado para investigar mudanças na excitabilidadeDe tipo selvagem (WT) ou neurónios geneticamente modificados, combinando-a com a gravação de células inteiras a partir de fatias de cérebro agudas electroporadas. Estas duas técnicas de contribuir para uma melhor compreensão do acoplamento de conectividade estrutural e funcional e dos mecanismos moleculares que controlam a diversidade neuronal durante o desenvolvimento. Estes processos de desenvolvimento têm implicações importantes sobre fiação axonal, a diversidade funcional de neurónios, e a biologia de distúrbios cognitivos.
Introdução
O desenvolvimento de estruturas dendríticas e axonais é uma faceta importante da regulação circuito no sistema nervoso, incluindo no córtex cerebral. Ela desempenha um papel crítico durante a fiação selectiva das diversas subpopulações neuronais. Um certo número de relatórios recentes têm mostrado que, para além de conectividade, a diversidade molecular dos neurónios é reflectida pela aquisição de modos altamente específicos de disparo. No entanto, os mecanismos que determinam a excitabilidade e a conectividade dos subtipos distintos neuronais durante o desenvolvimento, bem como o seu grau de coordenação, são ainda pouco compreendidos 1, 2.
In vivo deficitária e ganho de função para análises permitem o estudo da relação entre o nível de expressão de genes específicos e a sua influência no desenvolvimento do circuito. Em electroporação útero (IUE) é uma técnica amplamente utilizada para estudara função de um gene de interesse em populações neuronais específicas e para estudar os padrões gerais da sua conectividade. No entanto, para determinar as características morfológicas de axónios e dendritos em camadas corticais em ratinhos vivos, é essencial para rotular neurónios escassamente. Um sistema de recombinação Cre combinado com IUE pode ser usado para marcar uma população esparsa de neurónios a uma densidade suficientemente baixa para resolver as projecções emitidos pelas células individuais das lâminas corticais identificados. Este método etiquetas um número suficiente de neurónios por córtex para obter dados quantitativa após a análise de números razoáveis de cérebros electroporadas (Figura 1). Este manuscrito apresenta um método para tal análise multa de conectividade. Ele também apresenta uma estratégia semelhante para analisar, em experiências separadas, as propriedades elétricas dos neurônios através da realização de gravações de corrente-clamp na proteína verde fluorescente (GFP) -electroporated células de fatias corticais agudas. estes protocóis são versáteis e pode ser aplicada ao estudo da excitabilidade e conectividade dos neurónios de animais transgénicos e WT, e também de neurónios em que os ganhos e perdas de função são introduzidas por plasmídeos adicionais durante IUE.
Embora este protocolo descreve a electroporação de ratinhos no dia embrionário (E) 15,5, esta técnica pode ser realizada em qualquer idade entre 3 e E9.5 dia pós-natal (P) 2 4. Enquanto eletroporação em estágios iniciais como alvo neurônios e precursores do tálamo e camadas profundas do córtex, em fase posterior marcas eletroporação camadas mais superficiais (por exemplo, neurônios E15.5 IUE alvos camada II-III). Em resumo, a combinação de IUE com análise morfológica de células única e electrofisiologia é uma ferramenta útil para elucidar os mecanismos moleculares subjacentes à enorme diversidade estrutural e funcional dos neurónios no sistema nervoso.
Protocolo
Todos os procedimentos com animais foram aprovados pela Comunidade de Madrid Animal Care e Use Committee, em conformidade com a legislação nacional e europeia (PROEX 118/14; PROEX 331/15). Manter condições estéreis durante o procedimento.
1. Em utero electroporação
NOTA: Este protocolo para IUE é adaptado de outros que foram publicados anteriormente 5, 6, 7. Este manuscrito descreve um protocolo para a embriões IUE de E15.5, com modificações na estratégia repórter que permitem o estudo da morfologia de neurónios individuais 8 e as suas propriedades electrofisiológicas Numa experiência separada utilizando os plasmídeos repórter da GFP padrão.
- Preparação do ADN
- Preparar plasmídeos de ADN utilizando um kit de isolamento isento de endotoxinas de acordo com as instruções do fabricante e diluí-los em 1x psolução salina tamponada com hosphate (PBS).
- Para a etiquetagem de uma única célula, preparar 10 L de mistura de ADN por cirurgia (1 mL por embrião) usando as seguintes construções e concentrações finais: plasmídeo que codifica um repórter proteína fluorescente (por exemplo, CAG-DsRed2 9), 1 ug / mL como controlo para a eficiência de electroporação; plasmídeo experimental a ser testado, tipicamente a 1 ug / mL; LoxP-stop-LoxP fluorescente plasmídeo proteína (CALNL-GFP 10), 1 mg / mL; e construir-codifica Cre 10, 1-4 ng / mL. Adicionar 1 mL de 0,1% de Fast Green em água (peso / volume), para visualizar o DNA injectado.
NOTA: Cre recombinação da GFP ocorre apenas em alguns neurónios, que permite a visualização e reconstrução de projecções axonais individuais (Figura 1A). - Para os estudos de patch-clamp padrão, preparar 10 ul de mistura de ADN por cirurgia (1 mL por EMBRyo) dos seguintes plasmídeo que codifica uma proteína fluorescente (por exemplo, GFP CAG-11), 1 ug / mL como controlo repórter; plasmídeo experimental, geralmente, de 1 mg / mL; e 1 uL de 0,1% de Fast Green em água (peso / volume).
NOTA: Estas são as condições de electroporação padrão que analisam fatias agudas que contêm um grande número de neurónios marcados no interior de excitatórios a lâmina desejada. Para realizar os estudos de patch-clamp em células individuais, preparar o DNA como descrito no passo 1.1.1.1.
- Para a etiquetagem de uma única célula, preparar 10 L de mistura de ADN por cirurgia (1 mL por embrião) usando as seguintes construções e concentrações finais: plasmídeo que codifica um repórter proteína fluorescente (por exemplo, CAG-DsRed2 9), 1 ug / mL como controlo para a eficiência de electroporação; plasmídeo experimental a ser testado, tipicamente a 1 ug / mL; LoxP-stop-LoxP fluorescente plasmídeo proteína (CALNL-GFP 10), 1 mg / mL; e construir-codifica Cre 10, 1-4 ng / mL. Adicionar 1 mL de 0,1% de Fast Green em água (peso / volume), para visualizar o DNA injectado.
- Preparar plasmídeos de ADN utilizando um kit de isolamento isento de endotoxinas de acordo com as instruções do fabricante e diluí-los em 1x psolução salina tamponada com hosphate (PBS).
2. preparação para a cirurgia
- Realizar uma cirurgia de sobrevivência, utilizando procedimentos assépticos. Assegurar condições estéreis, incluindo máscaras, luvas, instrumentos e campo cirúrgico. Esterilizar instrumentos cirúrgicos (bisturi, pinças Adson, endurecidos tesoura fina, tesoura curva, fórceps Dumont, e porta-agulha).
- capilares Select de vidro de borosilicato de diâmetro externo / interno 1 / 0,58 mm. cap Pullillaries 3. Alvo para um comprimento de ponta ideal de 1 cm depois de puxar. Corte a ponta da agulha em um ângulo de aproximadamente 30 ° usando uma pinça fina (Figura 1B).
- Preparar 500 mL de uma solução isotónica estéril (PBS 1x ou Hank's Solução Salina Equilibrada (SSHE)). Adicionar penicilina-estreptomicina a 1: 100 e aquecer esta solução a 37 ° C. Ele pode ser armazenado a 4 ° C, após a cirurgia.
- Injectar por via subcutânea numa dose pré-operatória de analgésicos (por exemplo, carprofeno, 5 mg / kg de peso corporal).
- Manter os animais mornos para a cirurgia, colocando-os em uma almofada de aquecimento. Aquecer uma gaiola limpa para 37 ° C durante a recuperação pós-operatória.
3. Cirurgia
- Anestesiar um C57BL / 6 E15.5 rato grávida de isoflurano. Em primeiro lugar, infundir uma câmara fechada com 3% de isoflurano em 0,8 L / min de oxigênio e deixar o mouse dentro até que esteja dormindo. Transferir o mouse para uma almofada de aquecimento e coloque o nariz ea boca dentro de uma máscara para entregary de isoflurano. diminuir gradualmente a anestesia ao longo da cirurgia a 1,5% de isoflurano via máscara. Confirmar anesthetization adequada, observando uma perda do reflexo de pedal (toe pitada). O procedimento ideal demora cerca de 20 minutos e não mais de 45 min.
- Aplicar pomada oftálmica para evitar que os olhos de secar durante o processo.
- Remover os pêlos de uma região ~ 3 cm do abdômen (usando um barbeador elétrico ou creme depilatório). Lave a área cirúrgica com cotonetes infundidos com 70% de etanol, seguido de um cotonete com infusão de iodo. Repita três vezes.
- Cobrir a área cirúrgica com gaze estéril para prevenir infecções.
- Usar o bisturi para fazer uma abertura vertical através da pele de 2 cm de comprimento e paralela à linha média. Separar a pele eo músculo do abdômen utilizando tesoura curva sem corte. Segurar o músculo com os fórceps e cortá-la através da linha alba para expor a cavidade abdominal.
- Localize os embriões com a ajuda of os fórceps. Umedeça dois cotonetes molhados com a solução salina estéril preparada no passo 2.3 e usá-los para manipular um embrião acessível para fora da abertura. Colocar os cotonetes de algodão em todo o embrião e extrair suavemente ambas as trompas uterinas a partir da cavidade abdominal. Manter os embriões e a cavidade abdominal aberta hidratados com solução salina quente durante todo o processo para evitar que sequem.
4. A injecção de ADN e electroporação
- Manipular os embriões suavemente com os dedos para localizar o telencéfalo (pode ser claramente visualizadas por olho como a mais dois vesículas anteriores do cérebro). Coloque um capilar de borosilicato preparado de uma pipeta de boca. Passar a ponta da agulha através do útero, evitando vasos sanguíneos, até atingir um ventrículo lateral. Lentamente injetar cerca de 1 mL de solução de DNA de cor verde rápido até uma grande mancha azul é observada.
- Coloque os eletrodos de platina 7 mm lateralmente em the cabeça do embrião (Figura 1C).
NOTA: ADN é carregado negativamente; portanto, move-se em direcção ao eléctrodo positivo, quando uma voltagem é aplicada entre os eléctrodos de platina. Através da variação da localização dos eléctrodos, diferentes áreas do cérebro pode ser alvejado. - Aplique a tensão através dos eletrodos de platina (por E15.5 embriões:. 5 pulsos, 38 V, 50-ms duração do ciclo de intervalo, pausa de 950 ms intervalo Essas condições variam dependendo do estágio de desenvolvimento) 12.
NOTA: Ver Tabela 1 para condições de tensão e eletrodos para diferentes estágios do embrião. - Repita os passos de 4,1-4,3 para cada embrião.
5. final da cirurgia e pós-operatório
- Use cotonetes para manipular o útero de volta para a mãe. Encher a cavidade abdominal com a solução salina aquecida (adicionar cerca de 2 mL).
- Suturar o músculo com pontos isolados simples ou um ponto contínuo. Use # 6-0s.
- Use agrafos para fechar a ferida externa. Tenha o cuidado de separar a pele do músculo antes de grampeamento. Retire a máscara nariz.
- Permitir que o mouse para se recuperar durante 30 min na gaiola aquecida, limpa antes de colocá-lo na sala de instalações para animais. Não deixe um animal sem supervisão até que tenha recuperado a consciência suficiente para manter decúbito esternal. Não coloque um animal que foi submetido a cirurgia na companhia de outros animais até que esteja totalmente recuperado.
- Supervisionar o animal durante os dias após a cirurgia. Aplicar analgésicos por via subcutânea (carprofeno, 5 mg / kg de peso corporal) a cada 12 h durante 2 dias ou de acordo com a legislação animal. No pós-operatório adicional é necessário para os filhotes.
6. Preparação e análise das amostras
- Opcional: Em P2, para verificar a expressão de fluorescência nos filhotes electroporadas utilizando um microscópio de fluorescência; quando o IUE é bem sucedido, a fluorescência pode ser claramente visto iN, a cabeça 13. Marca ou separar a ratinhos que são positivamente electroporado para utilização nos passos seguintes. Mantenha a mãe e os filhotes em condições de instalações de animais normais.
- Na fase desejada do estudo, os ratinhos perfundir transcardiacamente. Normalmente, a fase mais activa do crescimento dendrítica e axonal corresponde aos primeiros três pós-natais semanas 2, 14, 15.
- Prepare 30 mL de paraformaldeído a 4% (PFA) em 1x PBS por ratinho e chill-lo no gelo.
CUIDADO: PFA é um alérgeno conhecido e cancerígena. É tóxico. Use equipamento de proteção pessoal apropriado.
NOTA: A quantidade de PFA necessária depende da idade do rato (por exemplo, para P16, 20 mL para a perfusão e 10 mL para a postfixation são necessários). - Prepara-se uma mistura de cetamina-xilazina para anestesiar os animais com uma proporção de 1: 8 volumétrico de 100 ug / ml de cetamina:: 1 100 ug / mL xylazine: PBS (preparar cerca de 0,2 mL por rato).
- Anestesiar o rato por via intraperitoneal injecção de 0,2 ml da mistura preparada no passo 6.2.2.
- Coloque o rato anestesiado em sua parte traseira. Adicione uma incisão horizontal acima do tórax usando um bisturi. Cortar o músculo e o diafragma com uma tesoura fina até que o coração pode ser observada.
- Faça uma incisão no átrio direito com a tesoura fina. Injecte lentamente 20 ml de PBS no ventrículo esquerdo com uma agulha de calibre 25, a fim de remover o sangue. Injectar 20 ml PFA (passo 6.2.1) até que o mouse é rígida e os órgãos tornam-se brancas.
- retire imediatamente a cabeça e fazer uma incisão mediana na pele do pescoço ao crânio. Delicadamente descascar o crânio usando uma pinça curva e extrair o cérebro. Tome especial cuidado para não perfurar ou danificar o cérebro durante a remoção do crânio. Coloque o cérebro em 10 mL de PFA a 4% a 4 ° C durante a noite para que postfix.
- Prepare 30 mL de paraformaldeído a 4% (PFA) em 1x PBS por ratinho e chill-lo no gelo.
- Cryoprotect cérebros fixados em 10 mL de 30% de sacarose em PBS a 4 ° C durante 1 - 2 dias, até se afundar. Prepare 1 cm cubos de folha de alumínio 3. Encha os cubos de 2/3 do caminho com outubro Coloque os cérebros dentro e congelá-los, colocando os cubos de gelo seco. Armazenar os cérebros congelados a -80 ° C.
- Ponto de outubro gota sobre a superfície do disco de amostra, descascar a folha de alumínio a partir do cubo de histologia, e posicionar o cubo na orientação desejada para o disco de amostra na parte superior da OCT líquido. Aplique uma pressão firme até que seja corrigido. Insira o disco de amostra no cabeçote de amostra do criostato. Orientar a amostra (movê-lo em uma posição favorável em relação à navalha / lâmina).
- Seção dos cérebros do criostato. Selecione 50 - 100 criosecções flutuantes mm de espessura 16 usando um pincel fino e colocá-los em PBS.
- Mancha se desejado.
NOTA: Para o estudo da morfologia axonal, coloração com um anticorpo GFP é fortemente recomendado 2.- Bloquear as secções durante 1 h a temperatura ambiente com soro de bovino fetal a 5% em PBS contendo 0,5% (solução bloqueadora) Triton-X 100. Incubar durante a noite a 4 ° C com 1: 500 de anticorpo primário (por exemplo, de coelho anti-GFP) diluído em solução de bloqueio.
- Lavam-se as secções em PBS três vezes. Adicionar 1: 500 de anticorpo secundário (por exemplo, anticorpo de cabra anti-coelho Alexa Fluor 488) diluído em solução de bloqueio e incubar durante 1 h à temperatura ambiente. Lavam-se as secções em PBS três vezes.
- Contracoloração com DAPI (1: 10000) em PBS contendo 0,5% de Triton X-100 durante 10 min. Lavar as seções com PBS. Montar as seções em um meio aquoso 16 de montagem.
7. Imaging and Analysis
- A fluorescência ou microscopia confocal
- Para reconstruir neurônios completos, adquirir as imagens com uma ampliação elevada (pelo menos 40X) e alta resolução (mínimo 1.024 x 1.024). Selecione os "verificação da telha "ou a opção equivalente no software de aquisição para cobrir a área de interesse, abrangendo todos os dendritos e processos axonal. Adquirir um número suficiente de pilhas no eixo z para evitar a perda de informações.
NOTA: De um modo geral, o software do microscópio tem uma opção "pilha Optimized", mas se isso não for o caso, o teste manualmente para determinar quantas etapas são necessárias para as imagens a sobrepor-se a fim de definir correctamente as projecções individuais. Dois parâmetros cruciais são a pinhole eo objetivo; levar em conta "maior ampliação, mais resolução e mais z-medidas necessárias."
- Para reconstruir neurônios completos, adquirir as imagens com uma ampliação elevada (pelo menos 40X) e alta resolução (mínimo 1.024 x 1.024). Selecione os "verificação da telha "ou a opção equivalente no software de aquisição para cobrir a área de interesse, abrangendo todos os dendritos e processos axonal. Adquirir um número suficiente de pilhas no eixo z para evitar a perda de informações.
- Análise
Nota: Embora vários parâmetros podem ser analisados, passo 7.2.1 concentra-se em dois: morfologia dendrite e axónio ramificação. Baixar Fiji ( http://fiji.sc/ ).- Abra a imagem, selecione a opção "linha segmentada" a partir do menu. Desenhar uma linha (movendo para cima e para baixo ao longo the eixo z, deslocando o rato) seguindo a estrutura do neurônio. Vá em "Analisar, ferramentas, ROI Manager, Adicionar" (alternativamente, pressione "t") para salvar a linha. Repita esse processo para cada axônio ou dendritos do neurônio analisados 2.
- No pressione Menu ROI Gestor no botão "Measure" para obter o comprimento (ou parâmetros adicionais). Exportar as medições para um arquivo de texto ou planilha para analisá-los.
8. Eletrofisiologia
NOTA: O objetivo deste protocolo é a obtenção de célula inteira gravações corrente-clamp da camada II / III neurônios piramidais celulares identificados visualmente por expressão GFP no cérebro do rato electroporated com GFP (ou qualquer outra proteína fluorescente anteriormente electroporado). Ele é uma adaptação dos métodos anteriormente publicados 17, 18. Usando este protocolo, é possível estudar o efeito de uma modif genéticacação introduzida pelo IUE nas propriedades elétricas do neurônio. A aquisição de modos de disparo específicos é um processo gradual de diferenciação que envolve a expressão dinâmica de um vasto repertório de canais de iões e que resulta na expressão de modos de disparo transientes antes fases tardias pós-natais. Por exemplo, as respostas elétricas maduras não são observadas na camada II / III do córtex somatossensorial rato antes P16 2, 19.
- Pré-requisitos para as fatias aguda
- Preparar as ferramentas de cirurgia estéril para remover os cérebros dos ratinhos: uma guilhotina, para remover a cabeça; uma tesoura pequena, para cortar através do crânio; fórceps, para separar o crânio a partir de tecido; uma espátula, para remover delicadamente o tecido cerebral de seu invólucro; um fatiador metálico, para dissecar o córtex em duas metades iguais; e uma pipeta de Pasteur, para mover as fatias do vibratome (colocá-los em uma solução contendo líquido cefalorraquidiano artificial (ACSF) para inspeção, e depois transferir as fatias de ACSF a uma área de armazenamento de incubação).
- Prepare 1 L de ACSF usando água de alta pureza (a água duplamente destilada) contendo NaCl 119 mM, 26 mM NaHCO3, 11 mM de glucose, 2,5 mM de KCl, MgCl 1,2 mM 2, CaCl2 2,5, e NaH 2 1 mM PO 4. Titula-se o pH a 7,3-7,4 com HCl ou NaOH. Ajustar a osmolaridade a 290 mOsm.
- ACSF bolha com carbogénio (95% O2 / 5% de CO 2) durante 15 - 20 min, utilizando tubos de teflon (~ 1 mm), para estabilizar o pH a 7,3-7,4.
- Congelar 200 mL de solução saturada de ACSF com carbogénio a -80 ° C durante 10 - 15 minutos para gerar uma solução de dissecção lamacento. Coloque um prato de cultura de tecidos 100- x 20 mm em gelo para cortar o cérebro.
- Preparação de 100 ml de solução de agarose 1% de baixo ponto de fusão imediatamente antes do início da experiência. Arrefecer a solução, cortar um pedaço quadrado de agarose (dimensões: 1 x 1 x 0,5 mm), e super cola-lo para ovolta da plataforma, logo atrás de onde o cérebro é cortado (gel de agarose fornece suporte para o cérebro durante o corte). Faça parte da frente o mais plano possível.
- Obtenção de fatias aguda
- Imobilizar o mouse e anestesiar-lo com isoflurano a 2%. Colocar a cabeça na abertura da guilhotina e decapitá-lo rapidamente. Remover seu crânio o mais rápido possível com o uso de guardas de osso ou uma pinça fina. Coloque o cérebro em ACSF gelado.
NOTA: É importante realizar essa etapa rapidamente. - Colocar o cérebro no prato de cultura gelada. Cortar o cerebelo com uma tesoura pequena.
- Pegar o cérebro com uma espátula e apagá-lo seco sobre uma toalha de papel.
- Cole o avião ventrocaudais do cérebro em um suporte vibratome. Colocar o suporte em um vibratome preenchido com ACSF gelado.
- Obter fatias aguda cortando 300 mícrons cortes coronais (garantir carbogenation contínuo durante todo o procedimento, por exemplo, colocar um bubbler (1 mmtubo de politetrafluoretileno) na câmara de vibratome) utilizando as seguintes definições vibratome: 0,06 mm de amplitude e 0,08-0,10-mm / s de velocidade. Definir o avanço à velocidade mais baixa possível (~ 22 s por passe). Modificar estas definições ideais e obter as condições ideais para cada máquina empiricamente, se necessário.
- Incubar as fatias agudas durante pelo menos 60 min em ACSF suplementado com mio-inositol 3 mM, ácido ascórbico 0,4 mM e piruvato de sódio 2 mM enquanto se faz borbulhar com 95% de O2 / 5% de CO 2 gasoso. Manter a temperatura a 25 ° C.
- Execute o procedimento de corte em menos de 15 min. Se desejado, as fatias pode ser armazenado durante 1 - 7 h antes de ser transferida para a câmara de registo para utilização.
- Imobilizar o mouse e anestesiar-lo com isoflurano a 2%. Colocar a cabeça na abertura da guilhotina e decapitá-lo rapidamente. Remover seu crânio o mais rápido possível com o uso de guardas de osso ou uma pinça fina. Coloque o cérebro em ACSF gelado.
- Pré-requisitos para a gravação de célula inteira
- Certifique-se de que a estação de electrofisiologia é equipado com uma câmara de registo, um sistema de perfusão, um microscópio, os eléctrodos (gravação, estimulando, e do solo), macro e micromanipulators, uma vibração resistente rígida de mesa e gaiola de Faraday, um estimulador, um amplificador e um conversor analógico-para-digital (A / D), um computador com software de aquisição, e um GFP (ou qualquer outro fluorocromo) filtrar para analisar neurónios geneticamente modificada 18 (Figura 2A).
- Preparar a solução intracelular, contendo gluconato de potássio 115 mM, MgCl2 2 mM, HEPES 10 mM, KCl 20 mM, 4 de Na 2 mM de ATP, e 0,3 mM de Na 3 GTP, ajustado para pH 7,2 por KOH e a 290 mOsm por KCl.
- Adicione pipetas de patch puxando capilares de vidro de borosilicato. Prepare eletrodos patch usando um extrator micropipeta. Uso de borosilicato capilares (diâmetro externo 1,5 mm, diâmetro interno 0,86 mm, comprimento 10 cm). Faça eletrodos remendo mostrando resistências de 3-10 mohms quando preenchido com solução intracelular.
- Perfundir a câmara de registo com ACSF a uma taxa de 2 ml / min. Manter a temperatura da câmara a aproximdamente 33 ° C.
- a gravação de célula inteira
- Transfira as fatias para a câmara de gravação usando uma pipeta Pasteur (cortar a ponta longa) ou um pincel pequeno. Mantenha pressionada a fatia com uma harpa. Perfundir as fatias constantemente com ACSF a uma taxa de 2 ml / min.
- Remendar um neurônio GFP-positivo.
- Coloque a fatia para a câmara de gravação e encontrar a área de interesse através do microscópio com pequeno aumento (10X). Então, encontrar uma célula GFP-positiva para corrigir usando o objetivo de 60x.
- Encha o eletrodo de registro com a solução intracelular. Use a seringa ligada ao filtro (filtro de 4 mm) e ponta de micro-loader para preencher o eletrodo de registro com a solução intracelular.
- Coloque a pipeta de vidro no suporte da pipeta. Coloque a ponta da pipeta na banheira e se concentrar na ponta. Uma vez que a pipeta está no banho, aplicar pressão positiva através do sistema de controlo de pressão de retorno.
- Remendar um neurônio que é fluorescente (Fig2B URE).
- Aproxime-se da célula de interesse sob orientação visual, mantendo a pressão de retorno na pipeta. Após o aparecimento de uma ondulação pequena na superfície da célula, libertar a pressão. Neste ponto, uma vedação hermética (resistência maior do que 1 GÊ) pode ser formado. Caso contrário, aplicar uma pressão negativa de luz (sucção) para facilitar isso.
- Enquanto o selo está sendo formado, trazer o fixador de tensão de retenção de -60 mV. Uma vez que o selo GÊ é formada, aplicar um impulso de sucção, para romper a membrana da célula por baixo da pipeta e entrar em modo de células inteiras. Ver a referência 20 para mais detalhes.
- Registrar a atividade utilizando as condições de corrente-clamp 21. Uma vez no modo de célula inteira, mudar de tensão-clamp para o modo atual-clamp e inicie a gravação. Por exemplo, para gravar excitabilidade das células, aplicar 500 ms de comprimento despolarização injeções de corrente (100-400 Pa).
- Calcular as taxas de disparo by traçar o número de potenciais de ação ao longo do trem para o aumento da corrente de entrada.
NOTA: Descanso potencial de membrana, resistência de entrada, e capacitância de membrana também pode ser calculada a partir das gravações 21.
- Calcular as taxas de disparo by traçar o número de potenciais de ação ao longo do trem para o aumento da corrente de entrada.
Resultados
Para caracterizar as alterações morfológicas de neurônios em detalhes e ao longo do desenvolvimento, é essencial para rotular neurônios escassamente. Um sistema Cre-recombinase diluída permite a expressão de um gene de interesse em uma população esparsa de neurónios, de modo que apenas os neurónios que incorporam esta enzima expressa GFP (Figura 1A). Usando essa estratégia, a camada II-III é orientada e rotulado por IUE em E15.5. CAG-DsRed2 a 1 ug / mL, é co-electroporado como um controlo e para identificar os cérebros electroporadas positivos em animais vivos. É importante notar, após coloração com anticorpo anti-GFP, o sinal é suficientemente forte para permitir a visualização clara dos seus axónios e morfologias dendríticas (Figura 1D e E).
Após IUE e electrofisiologia, a análise dos parâmetros obtidos a partir de registos de célula completa são utilizados para coMpare as respostas de disparo e excitabilidade das células electroporated em diferentes condições. Vários parâmetros podem ser obtidos. Os parâmetros devem ser adaptados ao estudo particular utilizando um software específico análise de patch-clamp. Figura 2C fornece um exemplo da trama dos potenciais de ação contra a corrente de entrada obtidos a partir de gravações de uma camada de WT II-III neurônio que foi electroporado em E15.5.

Figura 1. A Cre-recombinase Diluído estratégia possibilita uma rotulagem esparsos de neurônios corticais. A. resumo esquemático da estratégia. Nos neurónios que transportam tanto CALNL-GFP e CRE, a cassete LoxP-Stop-LoxP é excisado de CALNL-GFP e GFP é expressa pelo promotor CAG forte. Desenho B. Esquema de um capilar de borosilicato puxado usando um extrator micropipeta. A ponta é cortada por forceps, criando um ângulo de 30 °. Medida 1 cm da ponta para o começo da parte mais estreita do tubo capilar. C. Posição dos eletrodos para atingir o córtex somatossensorial. Os eletrodos de platina são colocados aproximadamente nos ouvidos do embrião. Devido à sua carga negativa, o ADN vai em direcção ao eléctrodo positivo, quando a tensão é aplicada. Variação da posição dos eléctrodos permite a segmentação diferentes áreas do cérebro. D. Imagens obtidas após vetores foram entregues à camada de neurônios II-III por em eletroporação utero no dia embrionário 15,5; secções coronais foram efectuadas no dia pós-natal 16. O vector de CAG-DsRed2 foi co-transfectado como um controlo (esquerda). GFP (centro) é expresso apenas nos neurónios que também incorporou Cre, permitindo a recombinação dos locais loxP no vector CALNL-GFP. A rotulagem esparsos permite que os neurônios individuais a ser distinguido (setas). E. alta ampliação da imagem confocal de tele dendríticas mandris de outro neurônio GFP escassamente rotulada. Barras de escala = 100 pm. Por favor clique aqui para ver uma versão maior desta figura.
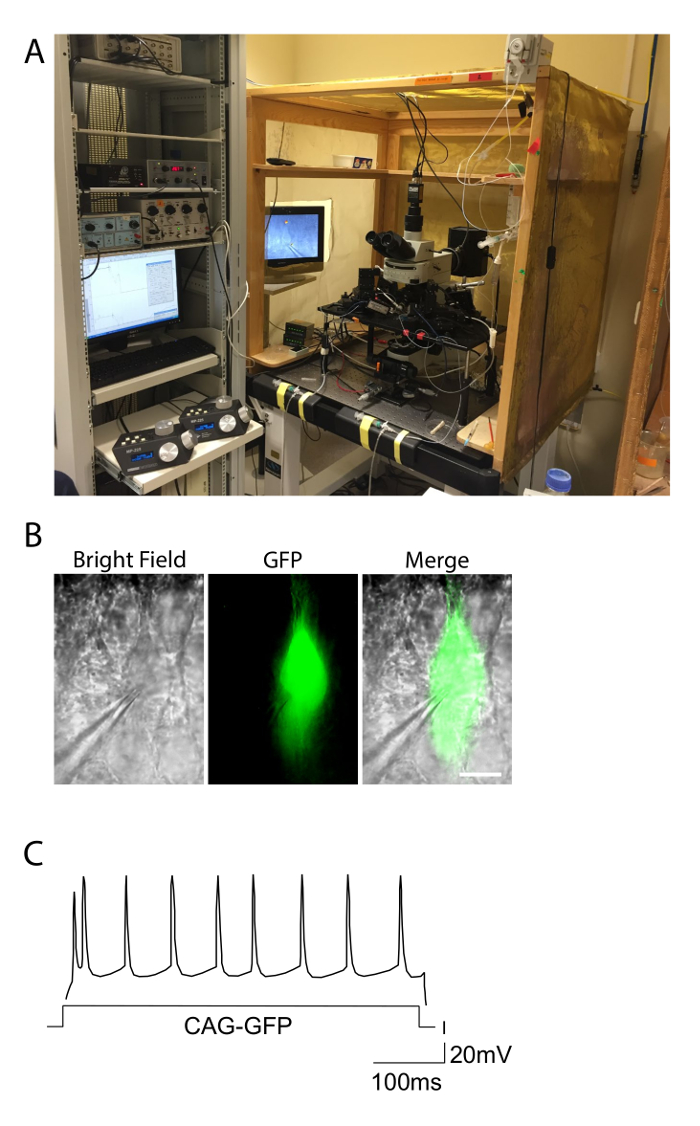
Figura 2. Configurações de Eletrofisiologia e exemplo de uma resposta de queima. Photograph A. mostra a configuração eletrofisiologia usado para experimentos patch clamp em fatias aguda. A configuração está incluído em uma gaiola de Faraday para eliminar o ruído, eo equipamento é em cima de uma mesa de anti-vibração. Controladores de micromanipuladores motorizados para os eléctrodos são observados no lado esquerdo. B. piramidal neurônio de um rato electroporated com GFP, observada sob campo luminoso e condições de fluorescência verde. A pipeta de gravação ligado a uma célula de GFP + é perceptível. Barra de escala = 10 & #181; m. C. padrões de disparo de um CAG-GFP electroporado neurônio camada de controle II-III que mostra a resposta normal-spiking típico. A distribuição de potenciais de acção aproxima-se de uma distribuição regular ao longo da duração da corrente de entrada (eixo X). Por favor clique aqui para ver uma versão maior desta figura.
| Etapa | Voltagem | eletrodos | Referências |
| E9.5 | 7 V, 100 ms, 3 pulsos | Furar eletrodos de platina | Matsui et ai. 2011 3 |
| E12.5 | 30 V, 50 ms, 3 - 5 pulsos | eletrodos pinças-3 mm | Saito, T., 2006 12 |
| E15.5 | 35-48 V, 50 ms, 5 pulsos | eletrodos pinças-5-7 mm | Rodriguez-Tornos et ai. De 2016 2, Saito, T., 2006 12 |
| P2 | 100 V, 50 ms, 5 pulsos | eletrodos pinças-5-7 mm | Sonego et ai. De 2013 4 |
Tabela 1: Condições de tensão e Eletrodos para a Eletroporação de Embriões.
Discussão
Este protocolo descreve em detalhe como rotular os neurônios do córtex somatossensorial de C75BL / 6 ratos, a fim de analisar a sua conectividade e sua excitabilidade. Com relação aos métodos existentes, visualiza aspectos exigentes de conectividade, tais como o número de ramos axonais por neurônio, sua topografia precisa, e sua localização anatômica. Ao alterar a posição dos eléctrodos, é possível atingir outras populações de neurónios, tal como o córtex cingulado (manter o mesmo ângulo entre os eléctrodos e o cérebro, mas alterar a orientação dos pólos) ou o hipocampo 5, e executar semelhante experiências de marcação neurônios individuais ou populações mais amplas, dependendo da estratégia pretendida. No entanto, existem limitações para isso, pois nem todas as populações são igualmente acessíveis ou igualmente marcado de forma seletiva. Por exemplo, no hipocampo, é possível alvejar seletivamente neurônios final-nascido da região de CA1, mas a EAelectroporação rly marca populações heterogéneas de células piramidais interior e exterior. No córtex cerebral, neurônios nascem de uma forma sequencial, de modo que o dia de gestação durante o IUE determina qual camada cortical é afetada. Realizando alvos IUE anteriores neurônios mais profundas (por exemplo, IUE em E14 etiquetas neurônios camada IV) 22.
Para uma IUE bem sucedido, recomenda-se ter em conta certas considerações. Em primeiro lugar, é importante para fazer a cirurgia em menos de 30 minutos, a fim de reduzir a tensão sobre a mãe e para aumentar as hipóteses de sobrevivência das crias. Em segundo lugar, a parte mais difícil do processo é a injecção do ADN-realizar a injecção através de capilares de borosilicato o mais suavemente possível. Se os embriões são pressionadas muito difícil, eles podem ser prejudicados. Em termos de solução de problemas a morte dos embriões durante injeções de DNA, beveling a ponta com um ângulo de 30 ° pode aumentar a eficácia deste processo. Se um chanfrador não está disponível e os capilares são cortadas apenas com uma pinça, o ângulo correcta pode ser confirmada no microscópio de dissecação. Descarte capilares inadequados. Finalmente, adaptando as condições de electroporação à fase de embrião é importante, a fim de aumentar a taxa de sobrevivência (ver Tabela 1).
Algumas considerações são necessárias no que respeita à reconstrução dos axônios e dendritos. Para etiquetar neurónios individuais, a concentração apropriada do plasmídeo Cre são essenciais para se obter uma boa expressão, escasso e para evitar a sobreposição de confusão de projecções neuronais pertencentes a diferentes neurónios. Embora este protocolo propõe a utilização de 4 ng / mL, pode ser necessário ajustar a concentração de plasmídeo para cada experiência, dependendo do promotor utilizado, a qualidade da preparação de DNA, e o método de quantificação de ADN (por exemplo, reduzi-la a 2 ng / mL de a rotulagem muitos neurônios). em additiem diante, para o rastreamento axonal, é importante para reduzir a um ângulo apropriado, a fim de ter todo o neurónio no mesmo plano.
passos críticos para gravações de patch-clamp bem sucedidos são a saúde do tecido das fatias aguda e a localização e abundância de neurônios GFP positivas eletroporados. Se as etapas de aplicação de patches falhar ou respostas aberrantes são encontrados durante as gravações, reduzir o tempo de processamento das fatias aguda. Se neurónios GFP são difíceis de identificar e localizar devido aos seus números reduzidos na fatia aguda, assegurar que suficiente plasmídeo CAG-GFP é incluído na mistura de electroporação. No que diz respeito aos principais limitações das abordagens aqui descritas, a técnica de patch-clamp permite a gravação de muitos parâmetros diferentes que descrevem a excitabilidade de neurónio, mas não avalia os aspectos que dependem de todo o circuito. Além disso, e tal como referido acima, nem todas as subpopulações neuronais são acessíveis através IUE. Em resumo, no the futuro, estas técnicas podem contribuir para a análise posterior da conectividade estrutural e funcional dos diferentes sub-populações neuronais no cérebro.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Somos gratos a R. Gutiérrez e A. Morales por sua excelente assistência técnica e LA Weiss para edição. CGB é financiado pelo Espanhol Ministerio de Ciencia e Innovación (MICINN), FPI-BES-2012-056011. Este trabalho foi financiado por uma bolsa da Fundação BBVA e SAF2014-58598-JIN (MINECO) para M. Navarrete e por uma bolsa da Fundação Areces Ramón e concede SAF2014-52119-R e BFU2014-55738-redt (de MINECO) para M. Nieto.
Materiais
| Name | Company | Catalog Number | Comments |
| pCAG-Cre | Addgene | 13775 | |
| pCALNL-GFP | Addgene | 13770 | |
| pCAG-DsRed2 | Addgene | 15777 | |
| pCAG-GFP | Addgene | 11150 | |
| Fast Green | Carl Roth | 301.1 | |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| Carprofen (Rimadyl) | Pfizer GmbH | 1615 ESP | |
| Isoflurane (IsoFlo) | Abbott (Esteve) | 1385 ESP | |
| Ketamine (Imalgene) | Merial | 2528-ESP | |
| Xylazine (Xilagesic) | Calier | 0682-ESP | |
| Povidone Iodine | Meda | 694109.6 | |
| Eye Ointment (Lipolac) | Angelini | 65.277 | |
| Hanks' Balanced Salt Solution (HBSS) | Gibco by Life Technologies | 24020-091 | |
| Penicillin-Streptomycin | Sigma -Aldrich | P4333 | |
| Scalpel Handle # 3 - 12 cm | Fine Science Tools | 10003-12 | |
| Scalpel Blades # 10 | Fine Science Tools | 10010-00 | |
| Adson Forceps-Serrated - Straight 12 cm | Fine Science Tools | 1106-12 | |
| Hardened Fine Scissors - Straight 11 cm | Fine Science Tools | 14090-11 | |
| Scissors Mezenbaum-Nelson Curved L=14.5 cm | Teleflex | PO143281 | |
| Thin curved tips - Style 7 Dumoxel | Dumont | 0303-7-PO | |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11251-20 | |
| Mathieu Needle Holder - Serrated | Fine Science Tools | 12010-14 | |
| AutoClip Applier | Braintree scientific, Inc | ACS APL | |
| 9 mm AutoClips | MikRon Precision, Inc. | 205016 | |
| Sutures - Polysorb 6-0 | Covidien | UL-101 | |
| Electric Razor | Panasonic | ER 240 | |
| Borosilicate glass capillaries (100 mm, 1.0/0.58 Outer/Inner diameter) | World Precision Instrument Inc. | 1B100F-4 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma -Aldrich | A5177-5EA | |
| Gauze (Aposan) | Laboratorios Indas, S.A.U. | C.N. 482232.8 | |
| Cotton Swabs (Star Cott) | Albasa | - | |
| Needle 25 G (BD Microlance 3) | Becton, Dickinson and Company | 300600 | |
| Sucrose | Sigma -Aldrich | S0389 | |
| Paraformaldehyde | Sigma -Aldrich | 158127 | |
| OCT Compound | Sakura | 4583 | |
| Tissue Culture Dish 100 x 20 mm | Falcon | 353003 | |
| GFP Tag Polyclonal Antibody | Thermo Fisher Scientific | A-11122 | |
| Secondary Antibody, Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11008 | |
| DAPI | Sigma-Aldrich | D9542 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10270106 | |
| Triton X-100 | Sigma-Aldrich | X100-500ML | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0002 | |
| Platinum electrodes 650P 7 mm | Nepagene | CUY650P7 | |
| Microscope for Fluorescent Imaging - MZ10F | Leica | - | |
| VIP 3000 Isofluorane Vaporizer | Matrx | - | |
| TCS-SP5 Laser Scanning System | Leica | - | |
| Axiovert 200 Microscope | Zeiss | - | |
| Cryostat - CM 1950 | Leica | - | |
| P-97 Micropette Puller | Sutter Instrument Company | P-97 | |
| Patch clamp analysis softwarw (p-Clamp Clampfit 10.3) | Molecular Devices | - | |
| Acquisition software (MultiClamp 700B Amplifier) | Molecular Devices | DD1440A | |
| Motorized Micromanipulator + Rotating Base | Sutter Instrument | MP-225 | |
| Air Table | Newport | - | |
| Miniature Peristaltic Pumps | WPI | - |
Referências
- Dehorter, N., et al. Tuning of fast-spiking interneuron properties by an activity-dependent transcriptional switch. Science. 349 (6253), 1216-1220 (2015).
- Rodriguez-Tornos, F. M., et al. Cux1 Enables Interhemispheric Connections of Layer II/III Neurons by Regulating Kv1-Dependent Firing. Neuron. 89 (3), 494-506 (2016).
- Matsui, A., Yoshida, A. C., Kubota, M., Ogawa, M., Shimogori, T. Mouse in utero electroporation: controlled spatiotemporal gene transfection. J Vis Exp. (54), (2011).
- Sonego, M., Zhou, Y., Oudin, M. J., Doherty, P., Lalli, G. In vivo postnatal electroporation and time-lapse imaging of neuroblast migration in mouse acute brain slices. J Vis Exp. (81), (2013).
- Baumgart, J., Baumgart, N. Cortex-, Hippocampus-, Thalamus-, Hypothalamus-,Lateral Septal Nucleus- and Striatum-specific In Utero Electroporation in the C57BL/6 Mouse. J Vis Exp. (107), (2016).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. J Vis Exp. (31), (2009).
- Rice, H., Suth, S., Cavanaugh, W., Bai, J., Young-Pearse, T. L. In utero electroporation followed by primary neuronal culture for studying gene function in subset of cortical neurons. J Vis Exp. (44), (2010).
- Woodworth, M. B., et al. Ctip1 Regulates the Balance between Specification of Distinct Projection Neuron Subtypes in Deep Cortical Layers. Cell Rep. 15 (5), 999-1012 (2016).
- Wickersham, I. R., et al. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53 (5), 639-647 (2007).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104 (3), 1027-1032 (2007).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101 (1), 16-22 (2004).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat Protoc. 1 (3), 1552-1558 (2006).
- Bullmann, T., Arendt, T., Frey, U., Hanashima, C. A transportable, inexpensive electroporator for in utero electroporation. Dev Growth Differ. , (2015).
- Miller, M. Maturation of rat visual cortex. I. A quantitative study of Golgi-impregnated pyramidal neurons. J Neurocytol. 10 (5), 859-878 (1981).
- Miller, M., Peters, A. Maturation of rat visual cortex. II. A combined Golgi-electron microscope study of pyramidal neurons. J Comp Neurol. 203 (4), 555-573 (1981).
- Cubelos, B., et al. Cux-2 controls the proliferation of neuronal intermediate precursors of the cortical subventricular zone. Cereb Cortex. 18 (8), 1758-1770 (2008).
- Kang, J. Y., Kawaguchi, D., Wang, L. Optical Control of a Neuronal Protein Using a Genetically Encoded Unnatural Amino Acid in Neurons. J Vis Exp. (109), (2016).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. J Vis Exp. (49), (2011).
- Maravall, M., Stern, E. A., Svoboda, K. Development of intrinsic properties and excitability of layer 2/3 pyramidal neurons during a critical period for sensory maps in rat barrel cortex. J Neurophysiol. 92 (1), 144-156 (2004).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nat Protoc. 1 (4), 1977-1986 (2006).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev Biol. 240 (1), 237-246 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados