Method Article
La electroporación en el útero métodos para estudiar la excitabilidad de las subpoblaciones neuronales y Conectividad Una sola célula
En este artículo
Resumen
Este manuscrito ofrece protocolos que utilizan en el útero de electroporación (IUE) para describir la conectividad estructural de las neuronas en el nivel de una sola célula y la excitabilidad de las neuronas marcadas con fluorescencia. Histología se utiliza para caracterizar dendríticas y proyecciones axonales. células enteras de grabación en rodajas agudas se utiliza para investigar la excitabilidad.
Resumen
El sistema nervioso se compone de una enorme gama de tipos neuronales distintas. Estas subpoblaciones neuronales se caracterizan por, entre otras características, sus morfologías dendríticas distintas, sus patrones específicos de conectividad axonal, y sus respuestas de disparo selectivo. Los mecanismos moleculares y celulares responsables de estos aspectos de la diferenciación durante el desarrollo son aún poco conocidos.
A continuación, describimos los protocolos combinados para el etiquetado y la caracterización de la conectividad estructural y la excitabilidad de las neuronas corticales. Modificación del protocolo de electroporación en el útero (IUE) permite el etiquetado de una población escasa de las neuronas. Esto, a su vez, permite la identificación y el seguimiento de las dendritas y axones de las neuronas individuales, la caracterización precisa de la ubicación laminar de proyecciones axonales, y el análisis morfométrico. IUE también se puede utilizar para investigar los cambios en la excitabilidad de lasDe tipo salvaje (WT) o neuronas genéticamente modificadas mediante la combinación con células enteras de grabación de rodajas agudas de cerebros electroporación. Estas dos técnicas contribuyen a una mejor comprensión del acoplamiento de la conectividad estructural y funcional y de los mecanismos moleculares que controlan la diversidad neuronal durante el desarrollo. Estos procesos de desarrollo tienen importantes implicaciones en el cableado axonal, la diversidad funcional de las neuronas, y la biología de los trastornos cognitivos.
Introducción
El desarrollo de estructuras dendríticas y axonales es una faceta importante de la regulación del circuito en el sistema nervioso, incluyendo en la corteza cerebral. Desempeña un papel crítico durante el cableado selectiva de las diversas subpoblaciones neuronales. Varios informes recientes han demostrado que, además de la conectividad, la diversidad molecular de las neuronas se refleja por la adquisición de modos muy específicos de disparo. Sin embargo, los mecanismos que determinan la excitabilidad y la conectividad de los subtipos neuronales distintas durante el desarrollo, así como su grado de coordinación, son aún poco conocidos 1, 2.
In vivo deficitaria y ganancia de función analiza permite el estudio de la relación entre el nivel de expresión de genes específicos y su influencia en el desarrollo del circuito. Electroporación en el útero (IUE) es una técnica ampliamente utilizada para estudiarla función de un gen de interés en las poblaciones neuronales específicas y para estudiar los patrones generales de su conectividad. Sin embargo, para determinar las características morfológicas de los axones y dendritas en las capas corticales en ratones vivos, es esencial para etiquetar las neuronas escasamente. Un sistema de recombinación Cre combinado con IUE puede ser utilizado para marcar una población escasa de las neuronas a una densidad suficientemente baja para resolver las proyecciones emitidas por las células individuales de las láminas corticales identificados. Este método etiquetas de un número suficiente de neuronas por la corteza para obtener datos cuantitativos después del análisis de un número razonable de los cerebros de electroporación (Figura 1). Este manuscrito presenta un método para tal análisis fino de la conectividad. También presenta una estrategia similar para analizar, en experimentos separados, las propiedades eléctricas de las neuronas mediante la realización de grabaciones de corriente-clamp en la proteína de fluorescencia verde (GFP) -electroporated células de rodajas corticales agudas. estos protocoles son versátiles y pueden aplicarse al estudio de la excitabilidad y la conectividad de las neuronas de los animales WT y transgénicos, y también de las neuronas en el que las pérdidas y ganancias de la función se introducen por los plásmidos adicionales durante IUE.
Aunque este protocolo describe la electroporación de los ratones en el día embrionario (E) 15,5, esta técnica se puede realizar a cualquier edad entre E9.5 y 3 días postnatal (P) 2 4. Mientras que en las primeras etapas de la electroporación se dirige a las neuronas y los precursores del tálamo y las capas profundas de la corteza, una etapa más avanzada marcas de electroporación capas más superficiales (por ejemplo, neuronas E15.5 IUE capa objetivos II-III). En resumen, la combinación de IUE con análisis morfológico de una sola célula y electrofisiología es una herramienta útil para dilucidar los mecanismos moleculares que subyacen a la enorme diversidad estructural y funcional de las neuronas en el sistema nervioso.
Protocolo
Todos los animales procedimientos fueron aprobados por la Comunidad de Madrid Cuidado de Animales y el empleo Comisión, de conformidad con la legislación nacional y europea (PROEX 118/14; 331/15 PROEX). Mantener condiciones estériles durante el procedimiento.
1. La electroporación en el útero
NOTA: Este protocolo para la IUE es una adaptación de otros que han sido previamente publicados 5, 6, 7. Este manuscrito describe un protocolo para la IUE de E15.5 embriones, con modificaciones en la estrategia reportero que permite el estudio de la morfología de las neuronas individuales 8 y sus propiedades electrofisiológicas en un experimento separado usando plásmidos informadores GFP estándar.
- Preparación de la DNA
- Preparar plásmidos de ADN utilizando un kit de aislamiento libre de endotoxina según las instrucciones del fabricante y diluirlos en 1x psolución salina hosphate-tamponada (PBS).
- Para el etiquetado de una sola célula, preparar 10 l de mezcla de ADN por cirugía (1 l por embrión) utilizando los siguientes constructos y concentraciones finales: plásmido que codifica un reportero proteína fluorescente (por ejemplo, CAG-DsRed2 9), 1 g / l como un control para la eficiencia de la electroporación; plásmido experimental a ensayar, típicamente a 1 g / l; LoxP-stop-LoxP fluorescente plásmido proteína (GFP CALNL-10), 1 g / l; y construir codifica Cre 10, 1 - 4 ng / mL. Añadir 1 l de 0,1% Fast Green en agua (peso / volumen) para visualizar el ADN inyectado.
NOTA: Cre recombinación de la construcción GFP se produce sólo en unas pocas neuronas, lo que permite la visualización y la reconstrucción de las proyecciones axonales individuales (Figura 1A). - Para los estudios estándar de patch-clamp, preparar 10 l de mezcla de ADN por la cirugía (1 l por EMBRyo) de las siguientes plásmido que codifica una proteína fluorescente (por ejemplo, CAG-GFP 11), 1 g / l como un control reportero; plásmido experimental, generalmente 1 g / l; y 1 l de 0,1% Fast Green en agua (peso / volumen).
NOTA: Estas son las condiciones de electroporación estándar que analizan las rebanadas agudas que contienen un gran número de neuronas excitatorias etiquetados dentro de la lámina deseada. Para llevar a cabo estudios de patch-clamp en células individuales, preparar el ADN como se describe en el paso 1.1.1.1.
- Para el etiquetado de una sola célula, preparar 10 l de mezcla de ADN por cirugía (1 l por embrión) utilizando los siguientes constructos y concentraciones finales: plásmido que codifica un reportero proteína fluorescente (por ejemplo, CAG-DsRed2 9), 1 g / l como un control para la eficiencia de la electroporación; plásmido experimental a ensayar, típicamente a 1 g / l; LoxP-stop-LoxP fluorescente plásmido proteína (GFP CALNL-10), 1 g / l; y construir codifica Cre 10, 1 - 4 ng / mL. Añadir 1 l de 0,1% Fast Green en agua (peso / volumen) para visualizar el ADN inyectado.
- Preparar plásmidos de ADN utilizando un kit de aislamiento libre de endotoxina según las instrucciones del fabricante y diluirlos en 1x psolución salina hosphate-tamponada (PBS).
2. Preparación para la Cirugía
- Realizar una cirugía de supervivencia mediante el uso de procedimientos asépticos. Garantizar condiciones estériles, como mascarillas, guantes, instrumentos y campo quirúrgico. Esterilizar instrumentos quirúrgicos (bisturí, pinzas de Adson, tijeras finas endurecidos, tijeras curvas, pinzas Dumont, y el soporte de la aguja).
- Seleccione capilares de vidrio borosilicato de 1 / 0,58 mm de diámetro exterior / interior. casquillo del tirónillaries 3. Orientación para una óptima longitud de la punta de 1 cm después de tirar. Cortar la punta de la aguja en un ángulo de 30 ° utilizando unas pinzas finas (Figura 1B).
- Preparar 500 ml de solución isotónica estéril (1x PBS o solución salina equilibrada de Hank (HBSS)). Añadir penicilina-estreptomicina 1: 100 y calentar esta solución a 37 ° C. Se puede almacenar a 4 ° C después de la cirugía.
- Por vía subcutánea inyectar una dosis preoperatoria de analgésicos (por ejemplo, carprofeno, 5 mg / kg de peso corporal).
- Mantener a los animales calientes para la cirugía que los coloca en una almohadilla térmica. Calentar una jaula limpia a 37 ° C durante la recuperación postoperatoria.
3. Cirugía
- Anestesiar a un ratón embarazadas C57BL / 6 E15.5 con isoflurano. En primer lugar, infundir una cámara cerrada con un 3% de isoflurano en 0,8 L / min de oxígeno y dejar el ratón en el interior hasta que esté dormido. Transferir el ratón a una compresa caliente y colocar la nariz y la boca dentro de una máscara para entregary de isoflurano. Poco a poco disminuir la anestesia durante el transcurso de la cirugía para 1,5% de isoflurano a través de la máscara. Confirmar la anestesia adecuada mediante la observación de una pérdida del reflejo de pedal (puntera pellizco). El procedimiento óptimo tarda aproximadamente 20 min y no más de 45 min.
- Aplicar ungüento para los ojos para evitar que los ojos se sequen durante el procedimiento.
- Eliminar el vello de una región de ~ 3-cm del abdomen (usando una máquina de afeitar eléctrica o crema depilatoria). Lavar el área quirúrgica con hisopos de algodón impregnada de etanol al 70%, seguidos de un hisopo de algodón yodo-infundido. Repetir tres veces.
- Cubrir el área quirúrgica con una gasa estéril para prevenir las infecciones.
- Utilice el bisturí para realizar una abertura vertical a través de la piel de 2 cm de largo y paralelo a la línea media. Separar la piel y el músculo del abdomen usando tijeras curvas romos. Mantenga el músculo con las pinzas y cortar a través de la línea alba para exponer la cavidad abdominal.
- Localizar los embriones con la ayuda of los fórceps. Humedecer dos hisopos de algodón mojado con la solución salina estéril preparada en la etapa 2.3 y utilizarlos para manipular un embrión accesible fuera de la abertura. Coloque los hisopos de algodón en todo el embrión y extraer suavemente ambos cuernos uterinos de la cavidad abdominal. Mantener los embriones y la cavidad abdominal se abrió hidratados con solución salina caliente durante todo el procedimiento para evitar que se sequen.
4. La inyección de DNA y electroporación
- Manipular los embriones suavemente con los dedos para localizar el telencéfalo (puede ser claramente visualizado por el ojo como los dos más vesículas anteriores del cerebro). Coloque un capilar de borosilicato preparado en una pipeta de boca. Pasar la punta de la aguja a través del útero, evitando los vasos sanguíneos, hasta que alcanza un ventrículo lateral. inyectar lentamente aproximadamente 1 l de solución de ADN de color verde rápida hasta que se observa una gran mancha azul.
- Coloque los electrodos de platino-7 mm lateralmente en el the la cabeza del embrión (Figura 1C).
NOTA: El ADN está cargado negativamente; por lo tanto, se mueve hacia el electrodo positivo cuando se aplica voltaje entre los electrodos de platino. Mediante la variación de la ubicación de los electrodos, diferentes áreas del cerebro pueden ser dirigidos. - Aplicar tensión a través de los electrodos de platino (por E15.5 embriones:. 5 pulsos, 38 V, 50-ms intervalo de longitud de ciclo, de pausa 950-ms intervalo Estas condiciones varían dependiendo de la etapa de desarrollo) 12.
NOTA: Véase la Tabla 1 para las condiciones de voltaje y los electrodos para las distintas etapas del embrión. - Repita los pasos 4.1 a 4.3 para cada embrión.
5. Fin de la cirugía y después de la operación
- Utilizar bastoncillos de algodón para manipular el útero de nuevo en la madre. Rellenar la cavidad abdominal con la solución salina calentada (añadir aproximadamente 2 ml).
- Suturar el músculo con puntos interrumpidos simples o una puntada continua. El uso de sutura # 6-0s.
- Utilice grapas para cerrar la herida externa. Tenga cuidado de separar la piel del músculo antes de grapado. Retire la máscara de la nariz.
- Deje que el ratón para recuperar durante 30 minutos en la jaula limpia calienta antes de colocarlo en la sala de instalación para animales. No deje un animal sin vigilancia hasta que se haya recuperado el conocimiento suficiente para mantener decúbito esternal. No coloque un animal que ha sido sometido a cirugía en compañía de otros animales hasta que esté completamente recuperado.
- Supervisar el animal durante los días siguientes a la cirugía. Aplicar analgésicos por vía subcutánea (carprofeno, 5 mg / kg de peso corporal) cada 12 h durante 2 días o de acuerdo con la legislación animal. No se requiere cuidados postoperatorios adicional para los cachorros.
6. Preparación y análisis de las muestras
- Opcional: En P2, la verificación de la expresión de fluorescencia en las crías sometidas a electroporación utilizando un microscopio de fluorescencia; cuando la IUE es exitosa, la fluorescencia se puede ver claramente in la cabeza 13. Marca o separar los ratones que están a electroporación positivamente para su uso en los siguientes pasos. Mantenga la presa y las crías en condiciones de instalación para animales estándar.
- En la fase de estudio deseado, la perfusión de los ratones transcardially. Típicamente, la fase más activa de crecimiento dendrítico y axonal corresponde a las tres primeras semanas posnatales 2, 14, 15.
- Preparar 30 ml de paraformaldehído al 4% (PFA) en 1x PBS por ratón y enfriar en hielo.
PRECAUCIÓN: PFA es un alérgeno y conocido carcinógeno. Es tóxico. Use equipo de protección personal adecuado.
NOTA: La cantidad de PFA necesaria depende de la edad del ratón (por ejemplo, para P16, 20 ml para la perfusión y 10 ml para la post-fijación se necesitan). - Preparar una mezcla de ketamina-xilazina para anestesiar al animal con una proporción de 1: 8 volumétrico de 100 mg / ml de ketamina:: 1 100 mg / ml xylazine: PBS (preparar alrededor de 0,2 ml por ratón).
- Anestesiar el ratón mediante la inyección intraperitoneal de 0,2 ml de la mezcla preparada en el paso 6.2.2.
- Coloque el ratón anestesiado en su parte posterior. Hacer una incisión horizontal por encima del tórax utilizando un bisturí. Cortar el músculo y el diafragma con tijeras finas hasta que se observa el corazón.
- Hacer una incisión en la aurícula derecha con las tijeras finas. inyectar lentamente 20 ml de PBS en el ventrículo izquierdo con una aguja de calibre 25 con el fin de eliminar la sangre. Inyectar 20 ml de PFA (paso 6.2.1) hasta que el ratón es rígido y los órganos se convierten en blanco.
- Retire inmediatamente la cabeza y hacer una incisión en la línea media en la piel desde el cuello hasta el cráneo. Tienes que despegar el cráneo utilizando pinzas curvas y extraer el cerebro. Tenga especial cuidado de no perforar o dañar el cerebro durante la eliminación del cráneo. Ponga el cerebro en 10 ml de 4% PFA a 4 ° C durante la noche a Postfix ella.
- Preparar 30 ml de paraformaldehído al 4% (PFA) en 1x PBS por ratón y enfriar en hielo.
- CryoProtect fijado cerebros en 10 ml de sacarosa al 30% en PBS a 4 ° C durante 1 - 2 días, hasta que se hunden. Preparar 1 cm cubos de papel de aluminio 3. Llenar los cubos de 2/3 del camino mediante OCT. Poner el cerebro en el interior y congelarlos por poner los cubos de hielo seco. Almacenar los cerebros congelados a -80 ° C.
- Lugar caída de la OCT en la superficie de la platina, pelar la lámina de aluminio del cubo de la histología, y colocar el cubo en la orientación deseada en el disco muestra en la parte superior de la OCT líquido. Aplique una presión firme hasta que esté arreglado. Insertar la platina en el cabezal porta-muestras del criostato. Orientar la muestra (moverlo a una posición favorable con respecto a la cuchilla / cuchilla).
- Sección de los cerebros en el criostato. Seleccionar 50 - 100 cryosections flotantes micras de espesor 16 utilizando un pincel fino y colocarlos en PBS.
- Manchar si se desea.
NOTA: Para el estudio de la morfología axonal, se recomienda encarecidamente la tinción con un anticuerpo GFP 2.- Bloquear las secciones durante 1 hora a temperatura ambiente con suero bovino fetal al 5% en PBS que contenía 0,5% (solución de bloqueo) Triton X-100. Incubar durante la noche a 4 ° C con 1: 500 de anticuerpo primario (por ejemplo, de conejo anti-GFP) diluido en solución de bloqueo.
- Lavar las secciones tres veces en PBS. Añadir 1: 500 de anticuerpo secundario (por ejemplo, cabra anti-conejo Alexa Fluor 488) diluido en solución de bloqueo y se incuba durante 1 h a temperatura ambiente. Lavar las secciones tres veces en PBS.
- Contratinción con DAPI (1: 10.000) en PBS que contenía 0,5% de Triton X-100 durante 10 minutos. Enjuague las secciones con PBS. Montar las secciones en un medio 16 de montaje acuoso.
7. Análisis de Imágenes e
- La fluorescencia o microscopía confocal
- Para reconstruir las neuronas completas, adquirir las imágenes con un gran aumento (al menos 40 veces) y alta resolución (mínimo de 1.024 x 1.024). Selecciona el "exploración de baldosas "o la opción equivalente en el software de adquisición para cubrir el área de interés, que abarca todas las dendritas y los procesos axonales. adquirir un número suficiente de pilas en el eje z para evitar una pérdida de información.
NOTA: Por lo general, el software del microscopio tiene una opción "pila optimizado", pero si esto no es el caso, la prueba manualmente para determinar la cantidad de pasos necesarios para que las imágenes se superponen con el fin de definir correctamente las proyecciones individuales. Dos parámetros importantes son el agujero y el objetivo; tener en cuenta "un aumento mayor, más resolución y más z medidas necesarias."
- Para reconstruir las neuronas completas, adquirir las imágenes con un gran aumento (al menos 40 veces) y alta resolución (mínimo de 1.024 x 1.024). Selecciona el "exploración de baldosas "o la opción equivalente en el software de adquisición para cubrir el área de interés, que abarca todas las dendritas y los procesos axonales. adquirir un número suficiente de pilas en el eje z para evitar una pérdida de información.
- Análisis
NOTA: A pesar de que varios parámetros pueden ser analizados, el paso 7.2.1 se centra en dos: la morfología de las dendritas y el axón de ramificación. Descargar Fiji ( http://fiji.sc/ ).- Abra la imagen, seleccionar la opción "línea segmentada" del menú. Dibujar una línea (que se mueve arriba y abajo a lo largo de THe eje z desplazando el ratón) después de la estructura de la neurona. Ir a "Analizar, Herramientas, Administrador de retorno de la inversión, Add" (alternativamente, pulse "t") para guardar la línea. Repita este proceso para cada axón o la dendrita de la neurona analizado 2.
- En el Administrador de retorno de la inversión pulse el botón Menú "Medida" para conseguir la longitud (o parámetros adicionales). Exportar las mediciones en un archivo de texto u hoja de cálculo para analizarlos.
8. Electrofisiología
NOTA: El objetivo de este protocolo es la obtención de células enteras grabaciones de corriente-clamp de la capa II / III neuronas piramidales de células identificados visualmente por la expresión de GFP en los cerebros de ratones GFP-a electroporación (o cualquier otra proteína fluorescente previamente a electroporación). Es una adaptación de los métodos publicados previamente 17, 18. El uso de este protocolo, es posible estudiar el efecto de un modif genéticaicación introducido por IUE en las propiedades eléctricas de la neurona. La adquisición de modos de disparo específicas es un proceso gradual de la diferenciación que implica la expresión dinámica de un amplio repertorio de canales de iones y que resulta en la expresión de modos de disparo transitorios antes etapas postnatales finales. Por ejemplo, respuestas eléctricas maduros no se observan en la capa II / III de la corteza somatosensorial ratón antes de P16 2, 19.
- Requisitos previos para las rodajas agudas
- Preparar herramientas de cirugía estéril para eliminar los cerebros de los ratones: una guillotina, para eliminar la cabeza; pequeñas tijeras, para cortar el cráneo; fórceps, para separar el cráneo a partir de tejido; una espátula, para quitar delicadamente el tejido cerebral de su carcasa; una máquina de cortar metal, para diseccionar la corteza en dos mitades iguales; y una pipeta Pasteur, para mover las rebanadas de la vibratome (colocarlos en una solución que contiene el líquido cefalorraquídeo artificial (ACSF) para su inspección, y luego transferir las rebanadas de ACSF a una zona de espera de incubación).
- Preparar 1 L de ACSF utilizando agua de alta pureza (agua doblemente destilada) que contiene NaCl mM 119, 26 mM de NaHCO3, glucosa 11 mM, KCl 2,5 mM, 1,2 mM MgCl 2, 2,5 mM CaCl 2, y NaH 1 mM 2 PO 4. Valorar el pH a 7.3 a 7.4 con HCl o NaOH. Ajustar la osmolaridad de 290 mOsm.
- ACSF burbujas con Carbógeno (95% O2 / 5% de CO2) durante 15 - 20 min usando tubos de teflón (~ 1 mm), para estabilizar el pH de 7.3 a 7.4.
- Congelación de 200 ml de solución saturada de ACSF con carbógeno a -80 ° C durante 10 - 15 min para generar una solución disección fangosa. Colocar una placa de cultivo tisular de 100 x 20 mm en el hielo para cortar el cerebro.
- Preparar 100 ml de solución de agarosa de bajo punto de fusión al 1% justo antes del inicio del experimento. Se enfría la solución, cortar un trozo cuadrado de agarosa (dimensiones: 1 x 1 x 0,5 mm), y superglue a laparte posterior de la plataforma, justo detrás de donde se corta el cerebro (en gel de agarosa proporciona soporte para el cerebro durante el rebanado). Hacer la parte delantera lo más plana posible.
- La obtención de las rebanadas agudas
- Inmovilizar el ratón y anestesiar con isoflurano al 2%. Coloque la cabeza en la abertura de la guillotina y decapitar a ella con rapidez. Retire el cráneo tan rápido como sea posible con el uso de guardas de hueso o unas pinzas finas. Poner el cerebro en ACSF enfriado.
NOTA: Es importante realizar este paso rápidamente. - Coloque el cerebro en la placa de cultivo frío. Cortar el cerebelo con unas tijeras pequeñas.
- Recoger el cerebro con una espátula y séquelo con una toalla de papel.
- Pegar el plano ventrocaudal del cerebro en un soporte vibratome. Coloque el soporte en un vibratome lleno de ACSF enfriado en hielo.
- Obtener rebanadas agudas mediante la reducción de 300 micras secciones coronales (carbogenation asegurar la continua durante todo el procedimiento, por ejemplo, colocar un pelele (1 mmtubo de politetrafluoroetileno) en la cámara de vibratome) con la siguiente configuración vibratome: amplitud de 0,06 mm y 0,08 - / s velocidad de 0,10 mm. Ajuste el avance a la velocidad más lenta posible (~ 22 s por paso). Modificar estos ajustes óptimos y obtener condiciones óptimas para cada máquina empíricamente si es necesario.
- Incubar las rebanadas agudas durante al menos 60 min en ACSF suplementado con myo -inositol 3 mM, ácido ascórbico 0,4 mM, y piruvato de sodio 2 mM mientras se burbujeaba con 95% O2 / 5% de CO 2 gas. Mantener la temperatura a 25 ° C.
- Realice el procedimiento de corte en menos de 15 min. Si se desea, las rodajas se pueden almacenar durante 1 - 7 h antes de ser transferido a la cámara de grabación para su uso.
- Inmovilizar el ratón y anestesiar con isoflurano al 2%. Coloque la cabeza en la abertura de la guillotina y decapitar a ella con rapidez. Retire el cráneo tan rápido como sea posible con el uso de guardas de hueso o unas pinzas finas. Poner el cerebro en ACSF enfriado.
- Requisitos previos para la grabación de células enteras
- Asegúrese de que la estación de electrofisiología está equipado con una cámara de registro, un sistema de perfusión, un microscopio, los electrodos (grabación, estimulante, y tierra), macro y micromanipulators, una vibración resistente rígido de sobremesa y la jaula de Faraday, un estimulador, un amplificador y de analógico a digital (A / D), un ordenador con software de adquisición, y una GFP (o cualquier otro fluorocromo) filtrado para el análisis genéticamente modificado neuronas 18 (Figura 2A).
- Preparar la solución intracelular, que contiene 115 mM de gluconato de potasio, 2 mM de MgCl 2 mM, HEPES 10, KCl 20 mM, 4 mM de Na 2 ATP, y 0,3 mM Na 3 GTP, se ajustó a pH 7,2 por KOH y 290 mOsm por KCl.
- Hacer pipetas de parche tirando capilares de vidrio de borosilicato. Preparar electrodos de parche utilizando un extractor de micropipeta. Uso capilares de borosilicato (1,5 mm de diámetro exterior, de 0,86 mm de diámetro interno, longitud 10 cm). Hacen electrodos de parche que muestra las resistencias de 3-10 mO cuando se llena con solución intracelular.
- Perfundir la cámara de grabación con ACSF a una tasa de 2 ml / min. Mantener la temperatura de la cámara a aproximtamente 33 ° C.
- células enteras de grabación
- Transferir las rebanadas en la cámara de grabación con una pipeta Pasteur (cortar la punta larga) o un cepillo pequeño. Mantenga pulsada la tecla en el sector con un arpa. Perfundir las rodajas constantemente con ACSF a una tasa de 2 ml / min.
- Parchear una neurona GFP-positivas.
- Ponga la rebanada en la cámara de grabación y encontrar el área de interés a través del microscopio a bajo aumento (10X). A continuación, encontrará una célula GFP-positivas para parchear utilizando el objetivo 60x.
- Llenar el electrodo de registro con la solución intracelular. Utilice la jeringa ligada al filtro (filtro de 4 mm) y la punta de micro-loader para llenar el electrodo de registro con la solución intracelular.
- Coloque la pipeta de vidrio en el soporte de la pipeta. Coloque la punta de la pipeta en el baño y se centran en la punta. Una vez que la pipeta está en el baño, aplicar presión positiva a través del sistema de control de presión de retorno.
- Parche una neurona que es fluorescente (Fig2B URE).
- Acercarse a la célula de interés bajo control visual, manteniendo la contrapresión en la pipeta. Tras la aparición de un pequeño hoyuelo en la superficie celular, liberar la presión. En este punto, un cierre hermético (resistencia mayor que 1 GΩ) se puede formar. De lo contrario, aplicar una ligera presión negativa (succión) para facilitarlo.
- Mientras se está formando el sello, llevar la tensión de la abrazadera de sujeción a -60 mV. Una vez que se forma el sello GΩ, aplicar un pulso de succión a la ruptura de la membrana celular por debajo de la pipeta y entrar en el modo de células enteras. Véase la referencia 20 para más detalles.
- Registrar la actividad utilizando condiciones de corriente de agarre 21. Una vez en el modo de células enteras, cambiar de fijación de voltaje de modo de corriente-clamp y empezar a grabar. Por ejemplo, para registrar la excitabilidad celular, aplicar 500 ms de duración de despolarización inyecciones de corriente (100 - 400 Pa).
- Calcular las tasas de disparo by trazar el número de potenciales de acción a lo largo del tren para el aumento de las corrientes de entrada.
NOTA: Descansando potencial de membrana, resistencia de entrada, y la capacitancia de la membrana también pueden calcularse a partir de las grabaciones 21.
- Calcular las tasas de disparo by trazar el número de potenciales de acción a lo largo del tren para el aumento de las corrientes de entrada.
Resultados
Para caracterizar los cambios morfológicos de las neuronas en detalle y en todo el desarrollo, es esencial para etiquetar las neuronas escasamente. Un sistema Cre-recombinasa diluido permite la expresión de un gen de interés en una población escasa de las neuronas, de modo que sólo aquellas neuronas que incorporan esta enzima expresan GFP (Figura 1A). Con esta estrategia, la capa II-III está dirigido y etiquetado por IUE en E15.5. CAG-DsRed2 en 1 g / l, es co-electroporación como control y para identificar cerebros electroporadas positivos en animales vivos. Es importante destacar que, después de la tinción con anticuerpo anti-GFP, la señal es lo suficientemente fuerte para permitir la visualización clara de sus morfologías dendríticas y los axones (Figura 1D y E).
Después de IUE y electrofisiología, el análisis de los parámetros obtenidos a partir de células enteras grabaciones se utilizan para coMpare las respuestas de disparo y la excitabilidad de las células sometidas a electroporación en diferentes condiciones. Varios parámetros pueden ser obtenidos. Los parámetros deben adaptarse al estudio particular, el uso de software específico de análisis de patch-clamp. La figura 2C es un ejemplo de la trama de los potenciales de acción en contra de la corriente de entrada obtenidos a partir de grabaciones de una II-III neurona capa WT que se sometió a electroporación en E15.5.

Figura 1. Una recombinasa Cre-diluido estrategia permite Etiquetado minimalista de las neuronas corticales. A. Resumen esquemático de la estrategia. En las neuronas que llevan tanto CALNL-GFP y CRE, el casete LoxP-STOP-LoxP se escinde de CALNL-GFP y GFP se expresa por el promotor CAG fuerte. B. Esquema dibujo de un capilar de borosilicato retiró usando un extractor de micropipeta. La punta es cortado por forceps, creando un ángulo de 30 °. Medida 1 cm desde la punta hasta el comienzo de la parte más estrecha del capilar. C. Posición de los electrodos para orientar la corteza somatosensorial. Los electrodos de platino se colocan aproximadamente a lo largo de los oídos del embrión. Debido a su carga negativa, el ADN va hacia el electrodo positivo cuando se aplica el voltaje. La variación en la posición de los electrodos permite dirigidos a diferentes áreas del cerebro. D. Las imágenes obtenidas después de vectores fueron entregados a la capa de neuronas II-III por electroporación en el útero en el día embrionario 15,5; secciones coronales se realizaron en el día postnatal 16. El vector CAG-DsRed2 se co-transfectadas como control (izquierda). GFP (medio) se expresa sólo en las neuronas que también incorporan Cre, lo que permite la recombinación de los sitios LoxP en el vector CALNL-GFP. El etiquetado escasa permite a las neuronas individuales pueden distinguir (puntas de flecha). E. de alta magnificación de la imagen confocal de tque dendríticas pérgolas de otra neurona GFP escasamente marcado. Barras de escala = 100 m. Haga clic aquí para ver una versión más grande de esta figura.
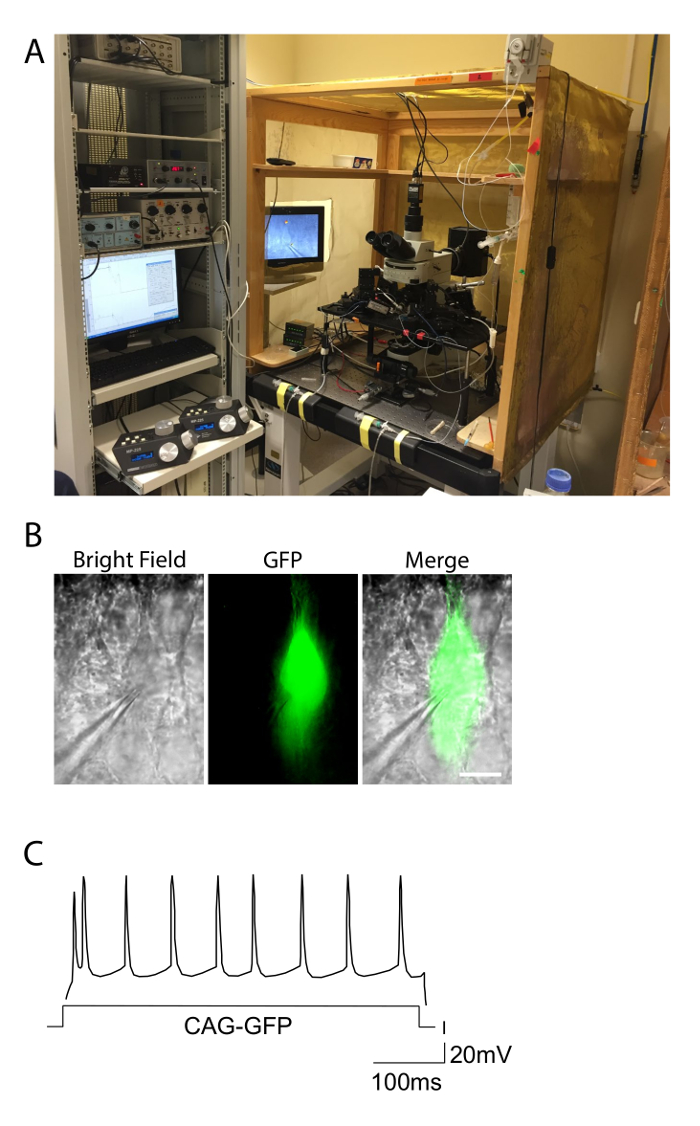
Figura 2. Configuración de Electrofisiología y ejemplo de una respuesta de disparo. A. La fotografía muestra la configuración utilizada para experimentos de electrofisiología de pinzamiento zonal en rodajas agudas. La configuración se incluye en una jaula de Faraday para eliminar el ruido, y el equipo está en la parte superior de una mesa de anti-vibración. Controladores de los micromanipulador motorizados para los electrodos se observan a la izquierda. B. piramidal neuronas de un ratón a electroporación con GFP observada, en condiciones de campo claro y fluorescencia verde. La pipeta de grabación unido a una célula GFP + es notable. Barra de escala = 10 & #181; m. C. patrones de disparo de un CAG-GFP a electroporación capa de control de II-III de la neurona que muestra la respuesta enriquecidas regulares típico. La distribución de los potenciales de acción se aproxima a una distribución regular a lo largo de la duración de la corriente de entrada (eje X). Haga clic aquí para ver una versión más grande de esta figura.
| Escenario | voltaje | Los electrodos | referencias |
| E9.5 | 7 V, 100 ms, 3 pulsos | Se adhieren electrodos de platino | Matsui et al. 2011 3 |
| E12.5 | 30 V, 50 ms, 3 - 5 pulsos | electrodos de tipo fórceps 3 mm | Saito, T., 2006 12 |
| E15.5 | 35-48 V, 50 ms, 5 pulsos | electrodos de tipo fórceps 5-7 mm | Rodríguez-Tornos et al. 2016 2, Saito, T., 2006 12 |
| P2 | 100 V, 50 ms, 5 pulsos | electrodos de tipo fórceps 5-7 mm | Sonego et al. 2013 4 |
Tabla 1: Condiciones de tensión y Electrodos para la electroporación de embriones.
Discusión
Este protocolo describe con detalle cómo etiquetar las neuronas de la corteza somatosensorial de / 6 ratones C75BL con el fin de analizar su conectividad y su excitabilidad. Con respecto a los métodos existentes, visualiza los aspectos discriminatorios de conectividad, tales como el número de ramas axonales por neurona, su topografía precisa, y su localización anatómica. Mediante la alteración de la posición de los electrodos, es posible apuntar a otras poblaciones de neuronas, tales como la corteza cingulada (mantener el mismo ángulo entre los electrodos y el cerebro, pero cambiar la orientación de los polos) o el hipocampo 5, y llevar a cabo semejante experimentos de marcaje neuronas individuales o poblaciones más amplias, en función de la estrategia deseada. Sin embargo, existen limitaciones a este, ya que no todas las poblaciones son igualmente accesibles o igualmente marcado de forma selectiva. Por ejemplo, en el hipocampo, es posible atacar selectivamente las neuronas nacidos a finales de la región CA1, pero eaelectroporación rly marca poblaciones heterogéneas de células piramidales interior y exterior. En la corteza cerebral, neuronas nacen de una manera secuencial, por lo que el día de gestación durante la IUE determina qué capa cortical se ve afectada. La realización de los objetivos anteriores IUE neuronas más profundas (por ejemplo, en la IUE E14 etiquetas de neuronas de la capa IV) 22.
Para una IUE éxito, se recomienda tener en cuenta ciertas consideraciones. En primer lugar, es importante para realizar la cirugía en menos de 30 minutos con el fin de reducir el estrés en la madre y para aumentar las posibilidades de supervivencia de las crías. En segundo lugar, la parte más difícil del procedimiento es la inyección del ADN de realizar la inyección a través de los capilares de borosilicato lo más suavemente posible. Si los embriones se presionan demasiado duro, que pueden ser perjudicados. En cuanto a la solución de problemas de la muerte de los embriones durante las inyecciones de ADN, biselado de la punta con un ángulo de 30 ° puede aumentar la eficacia de este proimpuesto. Si un beveller no está disponible y los capilares se cortan únicamente con fórceps, el ángulo correcto puede confirmarse en el microscopio de disección. Desechar los capilares inadecuados. Por último, la adaptación de las condiciones de electroporación a la etapa del embrión es importante con el fin de aumentar la tasa de supervivencia (véase la Tabla 1).
Son necesarias algunas consideraciones con respecto a la reconstrucción de los axones y dendritas. Para etiquetar las neuronas individuales, la concentración adecuada del plásmido Cre son esenciales para obtener una buena expresión, escaso y evitar la superposición de confusión de proyecciones neuronales que pertenecen a diferentes neuronas. Aunque este protocolo propone el uso de 4 ng / l, puede ser necesario ajustar la concentración de plásmido para cada experimento, dependiendo del promotor usado, la calidad de la preparación de ADN, y el método de cuantificación de ADN (por ejemplo, la reducen a 2 ng / l Si el etiquetado demasiadas neuronas). en additien adelante, para el seguimiento de axonal, es importante para cortar en un ángulo apropiado con el fin de tener toda la neurona en el mismo plano.
Los pasos críticos para patch-clamp grabaciones exitosas son la salud de los tejidos de las rodajas agudas y la ubicación y la abundancia de las neuronas positivas para GFP electroporadas. Si los pasos de parcheo fallan o respuestas aberrantes se encuentran durante las grabaciones, reducir el tiempo para procesar las rodajas agudas. Si las neuronas GFP son difíciles de identificar y localizar debido a sus números reducidos de la rebanada aguda, asegurar que suficiente plásmido CAG-GFP se incluye en la mezcla de electroporación. Con respecto a las principales limitaciones de los enfoques descritos en el presente documento, la técnica de patch-clamp permite la grabación de muchos parámetros diferentes que describen la excitabilidad de la neurona, pero no evalúa aspectos que dependen de todo el circuito. Además, y como se dijo anteriormente, no todas las subpoblaciones neuronales son accesibles a través de IUE. En resumen, THfuturo e, estas técnicas pueden contribuir al análisis adicional de la conectividad estructural y funcional de las diferentes subpoblaciones neuronales en el cerebro.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Estamos muy agradecidos a R. Gutiérrez y A. Morales por su excelente asistencia técnica y a LA Weiss para su edición. CGB está financiado por el Ministerio español de Ciencia e Innovación (MICINN), FPI-BES-2012-056011. Este trabajo fue financiado por una beca de la Fundación BBVA y SAF2014-58598-JIN (MINECO) para M. Navarrete y por una beca de la Fundación Ramón Areces y subvenciones SAF2014-52119-R y BFU2014-55738-Redt (de MINECO) a M. Nieto.
Materiales
| Name | Company | Catalog Number | Comments |
| pCAG-Cre | Addgene | 13775 | |
| pCALNL-GFP | Addgene | 13770 | |
| pCAG-DsRed2 | Addgene | 15777 | |
| pCAG-GFP | Addgene | 11150 | |
| Fast Green | Carl Roth | 301.1 | |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| Carprofen (Rimadyl) | Pfizer GmbH | 1615 ESP | |
| Isoflurane (IsoFlo) | Abbott (Esteve) | 1385 ESP | |
| Ketamine (Imalgene) | Merial | 2528-ESP | |
| Xylazine (Xilagesic) | Calier | 0682-ESP | |
| Povidone Iodine | Meda | 694109.6 | |
| Eye Ointment (Lipolac) | Angelini | 65.277 | |
| Hanks' Balanced Salt Solution (HBSS) | Gibco by Life Technologies | 24020-091 | |
| Penicillin-Streptomycin | Sigma -Aldrich | P4333 | |
| Scalpel Handle # 3 - 12 cm | Fine Science Tools | 10003-12 | |
| Scalpel Blades # 10 | Fine Science Tools | 10010-00 | |
| Adson Forceps-Serrated - Straight 12 cm | Fine Science Tools | 1106-12 | |
| Hardened Fine Scissors - Straight 11 cm | Fine Science Tools | 14090-11 | |
| Scissors Mezenbaum-Nelson Curved L=14.5 cm | Teleflex | PO143281 | |
| Thin curved tips - Style 7 Dumoxel | Dumont | 0303-7-PO | |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11251-20 | |
| Mathieu Needle Holder - Serrated | Fine Science Tools | 12010-14 | |
| AutoClip Applier | Braintree scientific, Inc | ACS APL | |
| 9 mm AutoClips | MikRon Precision, Inc. | 205016 | |
| Sutures - Polysorb 6-0 | Covidien | UL-101 | |
| Electric Razor | Panasonic | ER 240 | |
| Borosilicate glass capillaries (100 mm, 1.0/0.58 Outer/Inner diameter) | World Precision Instrument Inc. | 1B100F-4 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma -Aldrich | A5177-5EA | |
| Gauze (Aposan) | Laboratorios Indas, S.A.U. | C.N. 482232.8 | |
| Cotton Swabs (Star Cott) | Albasa | - | |
| Needle 25 G (BD Microlance 3) | Becton, Dickinson and Company | 300600 | |
| Sucrose | Sigma -Aldrich | S0389 | |
| Paraformaldehyde | Sigma -Aldrich | 158127 | |
| OCT Compound | Sakura | 4583 | |
| Tissue Culture Dish 100 x 20 mm | Falcon | 353003 | |
| GFP Tag Polyclonal Antibody | Thermo Fisher Scientific | A-11122 | |
| Secondary Antibody, Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11008 | |
| DAPI | Sigma-Aldrich | D9542 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10270106 | |
| Triton X-100 | Sigma-Aldrich | X100-500ML | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0002 | |
| Platinum electrodes 650P 7 mm | Nepagene | CUY650P7 | |
| Microscope for Fluorescent Imaging - MZ10F | Leica | - | |
| VIP 3000 Isofluorane Vaporizer | Matrx | - | |
| TCS-SP5 Laser Scanning System | Leica | - | |
| Axiovert 200 Microscope | Zeiss | - | |
| Cryostat - CM 1950 | Leica | - | |
| P-97 Micropette Puller | Sutter Instrument Company | P-97 | |
| Patch clamp analysis softwarw (p-Clamp Clampfit 10.3) | Molecular Devices | - | |
| Acquisition software (MultiClamp 700B Amplifier) | Molecular Devices | DD1440A | |
| Motorized Micromanipulator + Rotating Base | Sutter Instrument | MP-225 | |
| Air Table | Newport | - | |
| Miniature Peristaltic Pumps | WPI | - |
Referencias
- Dehorter, N., et al. Tuning of fast-spiking interneuron properties by an activity-dependent transcriptional switch. Science. 349 (6253), 1216-1220 (2015).
- Rodriguez-Tornos, F. M., et al. Cux1 Enables Interhemispheric Connections of Layer II/III Neurons by Regulating Kv1-Dependent Firing. Neuron. 89 (3), 494-506 (2016).
- Matsui, A., Yoshida, A. C., Kubota, M., Ogawa, M., Shimogori, T. Mouse in utero electroporation: controlled spatiotemporal gene transfection. J Vis Exp. (54), (2011).
- Sonego, M., Zhou, Y., Oudin, M. J., Doherty, P., Lalli, G. In vivo postnatal electroporation and time-lapse imaging of neuroblast migration in mouse acute brain slices. J Vis Exp. (81), (2013).
- Baumgart, J., Baumgart, N. Cortex-, Hippocampus-, Thalamus-, Hypothalamus-,Lateral Septal Nucleus- and Striatum-specific In Utero Electroporation in the C57BL/6 Mouse. J Vis Exp. (107), (2016).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. J Vis Exp. (31), (2009).
- Rice, H., Suth, S., Cavanaugh, W., Bai, J., Young-Pearse, T. L. In utero electroporation followed by primary neuronal culture for studying gene function in subset of cortical neurons. J Vis Exp. (44), (2010).
- Woodworth, M. B., et al. Ctip1 Regulates the Balance between Specification of Distinct Projection Neuron Subtypes in Deep Cortical Layers. Cell Rep. 15 (5), 999-1012 (2016).
- Wickersham, I. R., et al. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53 (5), 639-647 (2007).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104 (3), 1027-1032 (2007).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101 (1), 16-22 (2004).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat Protoc. 1 (3), 1552-1558 (2006).
- Bullmann, T., Arendt, T., Frey, U., Hanashima, C. A transportable, inexpensive electroporator for in utero electroporation. Dev Growth Differ. , (2015).
- Miller, M. Maturation of rat visual cortex. I. A quantitative study of Golgi-impregnated pyramidal neurons. J Neurocytol. 10 (5), 859-878 (1981).
- Miller, M., Peters, A. Maturation of rat visual cortex. II. A combined Golgi-electron microscope study of pyramidal neurons. J Comp Neurol. 203 (4), 555-573 (1981).
- Cubelos, B., et al. Cux-2 controls the proliferation of neuronal intermediate precursors of the cortical subventricular zone. Cereb Cortex. 18 (8), 1758-1770 (2008).
- Kang, J. Y., Kawaguchi, D., Wang, L. Optical Control of a Neuronal Protein Using a Genetically Encoded Unnatural Amino Acid in Neurons. J Vis Exp. (109), (2016).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. J Vis Exp. (49), (2011).
- Maravall, M., Stern, E. A., Svoboda, K. Development of intrinsic properties and excitability of layer 2/3 pyramidal neurons during a critical period for sensory maps in rat barrel cortex. J Neurophysiol. 92 (1), 144-156 (2004).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nat Protoc. 1 (4), 1977-1986 (2006).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev Biol. 240 (1), 237-246 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados