Method Article
Elettroporazione in utero approcci per studiare l'eccitabilità neuronale sottopopolazioni e connettività single-cell
In questo articolo
Riepilogo
Questo manoscritto fornisce protocolli che utilizzano in utero elettroporazione (IUE) per descrivere la connettività strutturale dei neuroni a livello di singola cellula e l'eccitabilità dei neuroni fluorescente. Istologia è utilizzato per caratterizzare dendritiche e le proiezioni assonali. registrazione a cellula intera a fette acuta viene utilizzato per studiare l'eccitabilità.
Abstract
Il sistema nervoso è composto da una vasta gamma di tipi neuronali distinti. Queste sottopopolazioni neuronali sono caratterizzati da, tra le altre caratteristiche, le loro morfologie dendritiche distinti, i loro modelli specifici di connettività assonale, e le loro risposte di cottura selettive. I meccanismi molecolari e cellulari responsabili di questi aspetti di differenziazione durante lo sviluppo sono ancora poco conosciuti.
Qui, descriviamo protocolli combinati per l'etichettatura e caratterizzare la connettività strutturale e l'eccitabilità dei neuroni corticali. Modifica del protocollo di elettroporazione in utero (IUE) consente l'etichettatura di una popolazione sparsa di neuroni. Questo, a sua volta, consente l'identificazione e la manutenzione dei dendriti e assoni dei singoli neuroni, la precisa caratterizzazione della posizione laminare di proiezioni assonale e analisi morfometrica. IUE può anche essere usato per studiare variazioni l'eccitabilitàwild-type (WT) o neuroni geneticamente modificati attraverso la combinazione con la registrazione a cellula intera da fettine acute di cervelli elettroporate. Queste due tecniche contribuiscono ad una migliore comprensione dell'accoppiamento di connettività strutturale e funzionale dei meccanismi molecolari che controllano diversità neuronale durante lo sviluppo. Questi processi di sviluppo hanno importanti implicazioni sul cablaggio assonale, la diversità funzionale dei neuroni, e la biologia dei disturbi cognitivi.
Introduzione
Lo sviluppo di strutture dendritiche e assonale è un aspetto importante della regolazione circuito nel sistema nervoso, compreso nella corteccia cerebrale. Essa svolge un ruolo critico durante il cablaggio selettivo delle diverse sottopopolazioni neuronali. Un certo numero di rapporti recenti hanno dimostrato che, oltre alla connettività, la diversità molecolare dei neuroni è riflessa dalla acquisizione di modalità altamente specifiche di cottura. Tuttavia, i meccanismi che determinano l'eccitabilità e la connettività dei sottotipi neuronali distinti durante lo sviluppo, così come il loro grado di coordinamento, sono ancora poco conosciuti 1, 2.
In vivo in perdita e guadagno di funzione analizza consentire lo studio del rapporto tra il livello di espressione di geni specifici e la loro influenza nello sviluppo del circuito. In utero elettroporazione (IUE) è una tecnica ampiamente utilizzata per lo studiola funzione di un gene di interesse in specifiche popolazioni neuronali e studiare gli schemi generali della loro connettività. Tuttavia, per determinare le caratteristiche morfologiche degli assoni e dendriti in strati corticali in topi vivi, è essenziale per etichettare i neuroni scarsamente. Un sistema di ricombinazione Cre combinato con IUE può essere usato per marcare una scarsa popolazione di neuroni in una sufficientemente bassa densità per risolvere le proiezioni emessi dalle singole celle delle lamine corticali identificati. Questo metodo etichetta un numero sufficiente di neuroni per corteccia di ottenere dati quantitativi dopo l'analisi dei numeri ragionevoli di cervelli elettroporate (Figura 1). Questo manoscritto presenta un metodo per tale analisi multa di connettività. Presenta inoltre una strategia simile per l'analisi, in esperimenti separati, le proprietà elettriche dei neuroni eseguendo registrazioni current-clamp su verde proteina fluorescente (GFP) -electroporated cellule da fette corticali acute. questi protocoli sono versatili e possono essere applicati allo studio dell'eccitabilità e la connettività dei neuroni di animali WT e transgenici, e anche di neuroni in cui perdite e guadagni di funzione vengono introdotti da plasmidi addizionali durante IUE.
Sebbene questo protocollo descrive l'elettroporazione di topi a giorno embrionale (E) 15.5, questa tecnica può essere eseguita a qualsiasi età tra E9.5 3 al giorno postnatale (P) 2 4. Mentre elettroporazione nelle fasi iniziali si rivolge neuroni e precursori del talamo e strati profondi della corteccia, i marchi di elettroporazione in seguito allo stadio strati più superficiali (ad esempio, neuroni E15.5 IUE obiettivi strato II-III). In sintesi, la combinazione di IUE con l'analisi morfologica singola cellula ed elettrofisiologia è uno strumento utile per chiarire i meccanismi molecolari alla base della enorme diversità strutturale e funzionale dei neuroni nel sistema nervoso.
Protocollo
Tutte le procedure di animali sono stati approvati dalla Comunità di Madrid cura degli animali e del Comitato uso, nel rispetto della normativa nazionale ed europea (PROEX 118/14; PROEX 331/15). Mantenere condizioni di sterilità durante la procedura.
1. elettroporazione in utero
NOTA: Questo protocollo per IUE è adattato da altri che sono stati precedentemente pubblicati 5, 6, 7. Questo manoscritto descrive un protocollo per l'IUE di E15.5 embrioni, con modificazioni nella strategia giornalista che permettono lo studio della morfologia dei singoli neuroni 8 e le loro proprietà elettrofisiologiche in un esperimento separato utilizzando plasmidi reporter GFP standard.
- Preparazione del DNA
- Preparare plasmidi DNA utilizzando un kit di isolamento privo di endotossine secondo le istruzioni del produttore e diluirli in 1x psalina hosphate-tamponata (PBS).
- Per l'etichettatura unicellulare, preparare 10 ml di miscela di DNA per la chirurgia (1 ml per embrione) utilizzando i seguenti costrutti e concentrazioni finali: plasmide codificante una giornalista proteina fluorescente (per esempio, CAG-DsRed2 9), 1 mg / mL come controllo per l'efficienza elettroporazione; plasmide sperimentale da testare, tipicamente a 1 mg / mL; LoxP-stop-loxP-fluorescente proteina plasmide (GFP CALNL-10), 1 mg / mL; e costruire-codifica Cre 10, 1 - 4 ng / mL. Aggiungere 1 ml di 0,1% veloce verde in acqua (peso / volume) per visualizzare il DNA iniettato.
NOTA: Cre ricombinazione del costrutto GFP verifica solo in pochi neuroni, che consente la visualizzazione e la ricostruzione delle singole proiezioni assonale (Figura 1A). - Per gli studi di patch-clamp standard preparare 10 ml di miscela DNA per la chirurgia (1 ml per embryo) dei seguenti plasmide codificante una proteina fluorescente (per esempio, CAG-GFP 11), 1 mg / mL come controllo giornalista; plasmide sperimentale, generalmente 1 mg / mL; e 1 ml di 0,1% veloce verde in acqua (peso / volume).
NOTA: Queste sono le condizioni di elettroporazione standard che analizzano fette acuta che contengono un gran numero di neuroni eccitatori marcati all'interno della lamina desiderato. Per eseguire studi di patch-clamp in singole cellule, preparare il DNA come descritto al punto 1.1.1.1.
- Per l'etichettatura unicellulare, preparare 10 ml di miscela di DNA per la chirurgia (1 ml per embrione) utilizzando i seguenti costrutti e concentrazioni finali: plasmide codificante una giornalista proteina fluorescente (per esempio, CAG-DsRed2 9), 1 mg / mL come controllo per l'efficienza elettroporazione; plasmide sperimentale da testare, tipicamente a 1 mg / mL; LoxP-stop-loxP-fluorescente proteina plasmide (GFP CALNL-10), 1 mg / mL; e costruire-codifica Cre 10, 1 - 4 ng / mL. Aggiungere 1 ml di 0,1% veloce verde in acqua (peso / volume) per visualizzare il DNA iniettato.
- Preparare plasmidi DNA utilizzando un kit di isolamento privo di endotossine secondo le istruzioni del produttore e diluirli in 1x psalina hosphate-tamponata (PBS).
2. Preparazione per la chirurgia
- Eseguire un intervento chirurgico di sopravvivenza utilizzando procedure asettiche. Garantire condizioni di sterilità, tra cui maschere, guanti, strumenti e campo chirurgico. Sterilizzare gli strumenti chirurgici (bisturi, pinze Adson, forbici sottili induriti, forbici curve, pinze Dumont, e porta aghi).
- Selezionare capillari di vetro borosilicato di diametro esterno / interno 1 / 0.58 mm. protezione di tiroillaries 3. Obiettivo per una lunghezza punta ottimale di 1 cm dopo aver tirato. Tagliare la punta dell'ago a circa un angolo di 30 ° con una pinza sottile (Figura 1B).
- Preparare 500 ml di soluzione isotonica sterile (PBS 1x o Hank's soluzione salina bilanciata (HBSS)). Aggiungere penicillina-streptomicina 1: 100 e riscaldare questa soluzione a 37 ° C. Esso può essere conservato a 4 ° C dopo l'intervento chirurgico.
- Sottocutanea iniettare una dose preoperatoria di analgesici (ad esempio, carprofen, 5 mg / kg di peso corporeo).
- Mantenere gli animali caldo per la chirurgia mettendoli su una piastra elettrica. Scaldare una gabbia pulita a 37 ° C per il recupero post-operatorio.
3. Chirurgia
- Anestetizzare un C57BL / 6 E15.5 il mouse incinta con isoflurano. Innanzitutto, infondere una camera chiusa con 3% isoflurano a 0,8 L / min ossigeno e lasciare il mouse all'interno finché è addormentato. Trasferire il mouse per una piastra elettrica e posizionare il naso e la bocca all'interno di una maschera per fornirey di isoflurano. Gradualmente diminuire l'anestesia nel corso dell'intervento al 1,5% isoflurano tramite maschera. Verificare il corretto anesthetization osservando una perdita del riflesso pedale (tep pinch). La procedura ottimale richiede circa 20 minuti e non più di 45 min.
- Applicare unguento oculare per evitare gli occhi si secchi durante la procedura.
- Rimuovere i capelli da una regione ~ 3 cm dell'addome (utilizzando un rasoio elettrico o crema depilatoria). Lavare l'area chirurgica con tamponi di cotone intriso di etanolo al 70%, seguita da un tampone di cotone di iodio-infuso. Ripetete tre volte.
- Coprire l'area chirurgica con garza sterile per prevenire le infezioni.
- Utilizzare il bisturi per effettuare una apertura verticale attraverso la pelle 2 cm di lunghezza e parallelamente alla linea mediana. Separare la pelle ei muscoli dell'addome con le forbici curve smussate. Tenere il muscolo con la pinza e tagliare attraverso la linea alba per esporre la cavità addominale.
- Individuare gli embrioni, con l'aiuto of le pinze. Inumidire due tamponi di cotone bagnato con la soluzione salina sterile preparata al punto 2.3 e li usa per manipolare un embrione accessibili dall'apertura. Posizionare i tamponi di cotone in tutto l'embrione ed estrarre delicatamente entrambe le corna uterine dalla cavità addominale. Mantenere gli embrioni e la cavità addominale aperta idratata con soluzione salina calda durante tutta la procedura per evitare che si secchi.
4. L'iniezione di DNA e elettroporazione
- Manipolare gli embrioni delicatamente con le dita per individuare il telencefalo (può essere chiaramente visualizzato dall'occhio come i due più vescicole anteriore del cervello). Posizionare un capillare borosilicato preparato in una pipetta bocca. Passare la punta dell'ago attraverso l'utero, evitando vasi sanguigni, fino al raggiungimento del ventricolo laterale. Iniettare lentamente circa 1 ml di soluzione di DNA verde color veloce fino a quando si osserva una grande macchia blu.
- Posizionare gli elettrodi di platino 7 mm lateralmente °e la testa di un embrione (Figura 1C).
NOTA: Il DNA è carica negativa; Pertanto, si muove verso l'elettrodo positivo quando viene applicata tensione fra gli elettrodi di platino. Variando la posizione degli elettrodi, diverse aree del cervello possono essere mirati. - Applicare tensione tramite gli elettrodi di platino (per E15.5 embrioni:. 5 impulsi, 38 V, 50-ms intervallo di lunghezza del ciclo, 950-ms intervallo di pausa Queste condizioni variano a seconda della fase di sviluppo) 12.
NOTA: Vedi Tabella 1 per le condizioni di tensione ed elettrodi per le diverse fasi di embrione. - Ripetere i passaggi 4,1-4,3 per ogni embrione.
5. Fine della Chirurgia e Postoperation
- Usare tamponi di cotone per manipolare l'utero torna nella madre. Riempire la cavità addominale con la soluzione salina riscaldata (aggiungere circa 2 ml).
- Suturare il muscolo con semplici punti interrotti o un punto continuo. Usa # 6-0 suturaS.
- Utilizzare punti per chiudere la ferita esterna. Fare attenzione a separare la pelle dal muscolo prima di pinzatura. Rimuovere la maschera naso.
- Lasciare che il mouse per recuperare per 30 minuti nella riscaldata, gabbia pulita prima di metterlo nella stanza stabulario. Non lasciare un animale incustodito fino a quando non ha ripreso conoscenza sufficiente a mantenere decubito sternale. Non posizionare un animale che ha subito un intervento chirurgico, in compagnia di altri animali fino alla completa guarigione.
- Sorvegliare l'animale durante i giorni dopo l'intervento. Applicare analgesici per via sottocutanea (carprofen, 5 mg / kg di peso corporeo) ogni 12 h per 2 giorni o secondo la legislazione degli animali. Nessun cure post-operatorie aggiuntivo è necessario per i cuccioli.
6. La preparazione e l'analisi dei campioni
- Optional: Su P2, controllare l'espressione della fluorescenza nei cuccioli elettroporate utilizzando un microscopio a fluorescenza; quando l'IUE ha successo, la fluorescenza può chiaramente vedere in per la testa 13. Mark o separare i topi che sono elettroporate positivamente per l'impiego nei seguenti passaggi. Mantenere la diga e cuccioli in condizioni stabulario standard.
- Nella fase desiderata di studio, i topi profumato transcardially. Tipicamente, la fase più attiva della crescita dendritica e assonale corrisponde alle prime tre settimane postnatali 2, 14, 15.
- Preparare 30 mL di 4% paraformaldeide (PFA) in PBS 1x per mouse e raffreddare in ghiaccio.
ATTENZIONE: PFA è un allergene conosciuto e cancerogena. È tossico. Indossare dispositivi di protezione adeguati.
NOTA: La quantità di PFA necessaria dipende dall'età del mouse (ad esempio, per P16, sono necessari 20 mL per la perfusione e 10 mL per la postfixation). - Preparare una miscela ketamina-xylazina per anestetizzare l'animale con un rapporto 1: 8 volumetrico di 100 ug / mL ketamina: 1 100 ug / mL xylazine: PBS (preparare circa 0,2 ml per il mouse).
- Anestetizzare il mouse iniettando per via intraperitoneale 0,2 ml di miscela preparata al punto 6.2.2.
- Posizionare il mouse anestetizzato sulla sua schiena. Effettuare una incisione orizzontale sopra il torace con un bisturi. Tagliare il muscolo e il diaframma con le forbici sottili fino a quando il cuore può essere osservato.
- Fare un'incisione nell'atrio destro con le belle forbici. Iniettare lentamente 20 ml di PBS nel ventricolo sinistro con un ago calibro 25 per rimuovere il sangue. Iniettare 20 ml di PFA (fase 6.2.1) fino a quando il mouse è rigida e gli organi diventano bianchi.
- Rimuovere immediatamente la testa e fare una incisione mediana nella pelle dal collo al cranio. Delicatamente staccarsi cranio con pinze curve ed estrarre il cervello. Prestare particolare attenzione a non forare o danneggiare il cervello durante la rimozione del cranio. Mettere il cervello in 10 mL di 4% PFA a 4 ° C durante la notte a Postfix esso.
- Preparare 30 mL di 4% paraformaldeide (PFA) in PBS 1x per mouse e raffreddare in ghiaccio.
- Cryoprotect cervelli fissato in 10 ml di 30% di saccarosio in PBS a 4 ° C per 1 - 2 giorni, fino affondano. Preparare 1 cm 3 in alluminio cubetti di stagnola. Riempire i cubetti di 2/3 del modo con ottobre Mettere i cervelli all'interno e congelarli mettendo i cubetti in ghiaccio secco. Conservare il cervello congelato a -80 ° C.
- Luogo goccia dell'OCT sulla superficie del disco di preparato, sbucciare il foglio di alluminio dal cubo istologia, e posizionare il cubo con l'orientamento desiderato per il disco campione sopra il liquido PTOM. Applicare una pressione decisa finché non viene risolto. Inserire il disco di preparato nella testa del campione del criostato. Orientare il campione (spostarlo in una posizione favorevole rispetto al coltello / lama).
- Sezione il cervello sul criostato. Selezionare 50 - 100 criosezioni Floating micron di spessore 16 con un pennello sottile e metterli in PBS.
- Macchiare se lo si desidera.
NOTA: Per lo studio della morfologia assonale, colorazione con un anticorpo GFP è fortemente raccomandato 2.- Bloccare le sezioni per 1 ora a temperatura ambiente con 5% di siero fetale bovino in PBS contenente 0,5% (soluzione bloccante) Triton-X 100. Incubare per una notte a 4 ° C con 1: 500 anticorpo primario (ad esempio, coniglio anti-GFP) diluito in soluzione bloccante.
- Lavare le sezioni tre volte in PBS. Aggiungere 1: 500 anticorpo secondario (per esempio, di capra anti-coniglio Alexa Fluor 488) diluito in soluzione di blocco e incubare per 1 ora a temperatura ambiente. Lavare le sezioni tre volte in PBS.
- Controcolorare con DAPI (1: 10.000) in PBS contenente 0,5% Triton-X 100 per 10 min. Sciacquare le sezioni con PBS. Montare le sezioni in un mezzo 16 di montaggio acquoso.
7. Imaging e analisi
- Fluorescenza o microscopia confocale
- Per ricostruire i neuroni completi, acquisire le immagini con un forte ingrandimento (almeno 40X) e alta risoluzione (minimo 1.024 x 1.024). Seleziona il "scansione tile "o l'opzione equivalente nel software di acquisizione per coprire l'area di interesse, che coprono tutti i dendriti e processi assonale. acquisire un numero sufficiente di stack su l'asse Z per evitare una perdita di informazioni.
NOTA: Generalmente, il software del microscopio ha un'opzione "stack ottimizzato", ma se questo non è il caso, di test manualmente per determinare quanti passi sono necessari per le immagini si sovrappongono per definire correttamente singoli proiezioni. Due parametri fondamentali sono il foro stenopeico e l'obiettivo; tener conto "più alto ingrandimento, più risoluzione, più necessarie z-passi".
- Per ricostruire i neuroni completi, acquisire le immagini con un forte ingrandimento (almeno 40X) e alta risoluzione (minimo 1.024 x 1.024). Seleziona il "scansione tile "o l'opzione equivalente nel software di acquisizione per coprire l'area di interesse, che coprono tutti i dendriti e processi assonale. acquisire un numero sufficiente di stack su l'asse Z per evitare una perdita di informazioni.
- Analisi
NOTA: Anche se diversi parametri possono essere analizzati, passo 7.2.1 si concentra su due: la morfologia dendriti e degli assoni ramificazione. Scarica Fiji ( http://fiji.sc/ ).- Aprire l'immagine, selezionare l'opzione "linea segmentata" dal menu. Tracciare una linea (si muove su e giù lungo the asse z scorrendo il mouse) seguendo la struttura del neurone. Vai su "Analizza, Strumenti, ROI Manager, Add" (in alternativa, premere "t") per salvare la linea. Ripetere questo processo per ogni assone o dendrite del neurone analizzato 2.
- Nel premere Menu ROI manager il pulsante "Measure" per ottenere la lunghezza (o parametri aggiuntivi). Esportare le misurazioni in un file di testo o fogli di calcolo per analizzarli.
8. Elettrofisiologia
NOTA: L'obiettivo di questo protocollo è quello di ottenere cellule intere registrazioni corrente-clamp da strati II / III neuroni piramidali cellule identificate visivamente l'espressione della GFP nel cervello di topo GFP-elettroporate (o qualsiasi altra proteina fluorescente in precedenza elettroporate). È un adattamento dei metodi precedentemente pubblicati 17, 18. Usando questo protocollo è possibile studiare l'effetto di un modif geneticaicazione introdotto dalla IUE sulle proprietà elettriche del neurone. L'acquisizione di specifiche modalità di fuoco è un processo graduale di differenziazione che coinvolge l'espressione dinamica di un vasto repertorio di canali ionici e che si traduce nell'espressione di modalità di fuoco transitori prima fasi tardo post-natale. Ad esempio, le risposte elettriche maturi non sono osservati in strati II / III della corteccia somatosensoriale mouse prima P16 2, 19.
- Prerequisiti per le fettine acute
- Preparare strumenti di chirurgia sterili per rimuovere i cervelli dei topi: una ghigliottina, per rimuovere la testa; piccole forbici, per tagliare attraverso il cranio; forcipe, per separare il cranio dal tessuto; una spatola, per rimuovere delicatamente il tessuto cerebrale di suo involucro; un'affettatrice metallico, per sezionare la corteccia in due parti uguali; e una pipetta Pasteur, per spostare le fette dalla vibratome (metterli in una soluzione contenente liquido cerebrospinale artificiale (ACSF) per l'ispezione, e poi trasferire le fette da ACSF ad una zona tenuta di incubazione).
- Preparare 1 L di ACSF utilizzando acqua di elevata purezza (acqua bidistillata) contenente 119 mM NaCl, 26 mM NaHCO 3, 11 glucosio mM, 2,5 mM KCl, 1,2 mm MgCl 2, 2,5 mM CaCl 2, e 1 mm NaH 2 PO 4. Titolare il pH a 7,3-7,4 con HCl o NaOH. Regolare l'osmolarità di 290 mOsm.
- Bubble ACSF con CarboGen (95% O 2/5% di CO 2) per 15 - 20 minuti utilizzando tubi in Teflon (~ 1 mm), per stabilizzare il pH a 7,3-7,4.
- Congelare 200 ml di soluzione satura di ACSF CarboGen a -80 ° C per 10 - 15 min per generare una soluzione dissezione fangosa. Posizionare un 100- x 20 mm piatto di coltura di tessuti su ghiaccio affettare il cervello per.
- Preparare 100 mL di soluzione di agarosio punto bassofondente 1% poco prima dell'inizio dell'esperimento. Raffreddare la soluzione, tagliare un pezzo quadrato di agarosio (dimensioni: 1 x 1 x 0,5 mm), e colla alretro della piattaforma, proprio dietro cui il cervello viene affettato (gel fornisce il supporto per il cervello durante affettare). Rendere il fronte più piatta possibile.
- Ottenere fette acuta
- Immobilizzare il mouse e anestetizzare con isoflurano 2%. Mettere la testa nell'apertura ghigliottina e decapitarlo esso rapidamente. Rimuovere il cranio più velocemente possibile con l'uso di ranger ossee o una pinza sottile. Mettere il cervello in ACSF refrigerata.
NOTA: E 'importante eseguire questo passaggio in fretta. - Posizionare il cervello nella cultura piatto freddo. Tagliare il cervelletto con piccole forbici.
- Sollevare il cervello con una spatola e asciugare asciugare su un tovagliolo di carta.
- Incollare il piano ventrocaudal del cervello su un supporto vibratome. Posizionare il supporto su una vibratome riempito con ACSF ghiacciata.
- Ottenere fette acuta tagliando 300-micron sezioni coronali (garantire la continuità della carbogenation durante tutta la procedura, ad esempio, inserire un gorgogliatore (1-mmtubo politetrafluoroetilene) nella camera vibratome) utilizzando le seguenti impostazioni vibratome: 0,06 mm in ampiezza e 0,08 - s di velocità / 0,10 mm. Impostare l'anticipo per la velocità più bassa possibile (~ 22 s per ogni passaggio). Modificare queste impostazioni ottimali e ottenere le condizioni ottimali per ogni macchina empiricamente se necessario.
- Incubare le fette acuta per almeno 60 minuti in ACSF integrato con 3 mM Myo-inositolo, acido ascorbico 0,4 mm e 2 mM di sodio piruvato mentre ribolle con il 95% O 2/5% di CO 2 gas. Mantenere la temperatura a 25 ° C.
- Eseguire la procedura di taglio in meno di 15 min. Se desiderato, le fette possono essere conservati per 1 - 7 h prima di essere trasferito alla camera di registrazione per l'utilizzo.
- Immobilizzare il mouse e anestetizzare con isoflurano 2%. Mettere la testa nell'apertura ghigliottina e decapitarlo esso rapidamente. Rimuovere il cranio più velocemente possibile con l'uso di ranger ossee o una pinza sottile. Mettere il cervello in ACSF refrigerata.
- Prerequisiti per la registrazione a cellula intera
- Assicurarsi che la stazione elettrofisiologia è dotato di una camera di registrazione, un sistema di perfusione, un microscopio, elettrodi (registrazione, stimolanti, e terra), macro e micromanipulators, rigida resistente alle vibrazioni tavolo e gabbia di Faraday, uno stimolatore, un amplificatore e analogico-digitale (A / D), un computer con software di acquisizione, e un GFP (o qualsiasi altro fluorocromo) filtrare per analizzare geneticamente modificato neuroni 18 (Figura 2A).
- Preparare la soluzione intracellulare, contenente 115 gluconato di potassio mM, 2 mM MgCl 2, 10 mM HEPES, 20 mM KCl, 4 mM Na 2 ATP e 0,3 mM Na 3 GTP, portata a pH 7,2 per KOH e 290 mOsm da KCl.
- Fare pipette di patch tirando capillari di vetro borosilicato. Preparare elettrodi di patch con un estrattore micropipetta. capillari Usa borosilicato (diametro esterno di 1,5 mm, diametro interno 0.86 mm, lunghezza 10 cm). Fai elettrodi di patch che mostra le resistenze di 3-10 MW quando è riempita di soluzione intracellulare.
- Profumato camera di registrazione con ACSF a una velocità di 2 ml / min. Mantenere la temperatura della camera a approximdiatamente 33 ° C.
- registrazione a cellula intera
- Trasferire le fettine nella camera di registrazione con una pipetta Pasteur (tagliare la lunga punta) o uno spazzolino. Tenere premuto il fetta con l'arpa. Profumato le fette costantemente con ACSF a una velocità di 2 ml / min.
- Patch un neurone GFP-positive.
- Mettere la fetta nella camera di registrazione e trovare l'area di interesse attraverso il microscopio a basso ingrandimento (10X). Quindi, trovare una cellula GFP-positive di patch utilizzando l'obiettivo 60x.
- Riempire l'elettrodo di registrazione con la soluzione intracellulare. Utilizzare la siringa collegata al filtro (filtro da 4 mm) e mancia micro-loader per riempire l'elettrodo di registrazione con la soluzione intracellulare.
- Posizionare la pipetta di vetro nel supporto pipetta. Posizionare la punta della pipetta nella vasca da bagno e concentrarsi sulla punta. Una volta che la pipetta è nel bagno, applicare pressione positiva attraverso il sistema di controllo contropressione.
- Patch un neurone che è fluorescente (figure 2B).
- Approccio alla cella di interesse sotto la guida visiva, pur mantenendo la contropressione nella pipetta. Alla comparsa di una piccola fossetta sulla superficie cellulare, rilasciare la pressione. A questo punto, può essere formata una tenuta (resistenza maggiore di 1 G). Altrimenti, applicare una leggera pressione negativa (aspirazione) per facilitare esso.
- Mentre si forma la guarnizione, portare il morsetto tensione di mantenimento di -60 mV. Una volta che il sigillo GΩ è formato, applica un impulso di aspirazione per rompere la membrana cellulare sotto la pipetta ed entra nel modo whole-cell. Vedi riferimento 20 per maggiori dettagli.
- Registrare l'attività utilizzando condizioni di corrente-clamp 21. Una volta in modalità cellula intera, passare dalla tensione-clamp in modalità corrente-clamp e avviare la registrazione. Ad esempio, per registrare eccitabilità cellulare, applicare 500 ms-lungo depolarizzante iniezioni di corrente (100 - 400 Pa).
- Calcolare i tassi di cottura By tracciare il numero di potenziali d'azione lungo il treno per aumentare correnti di ingresso.
NOTA: Riposo potenziale di membrana, resistenza di ingresso, e la capacità di membrana possono essere calcolati dalle registrazioni 21.
- Calcolare i tassi di cottura By tracciare il numero di potenziali d'azione lungo il treno per aumentare correnti di ingresso.
Risultati
Per caratterizzare i cambiamenti morfologici dei neuroni nel dettaglio e in tutto lo sviluppo, è essenziale per etichettare i neuroni scarsamente. Un sistema Cre-ricombinasi diluita permette l'espressione di un gene di interesse in una popolazione sparsa di neuroni, in modo che solo i neuroni che incorporano questo enzima esprimono GFP (Figura 1A). Usando questa strategia, strato di II-III è mirato ed etichettato da IUE a E15.5. CAG-DsRed2 a 1 mg / mL, è co-elettroporate come controllo e di individuare i cervelli elettroporate positivi negli animali viventi. È importante sottolineare che, dopo colorazione con anticorpo anti-GFP, il segnale è abbastanza forte per consentire la visualizzazione chiara delle loro morfologie dendritiche e assoni (Figura 1D ed E).
Dopo IUE e elettrofisiologia, l'analisi dei parametri ottenuti da registrazioni cellule intere sono utilizzati per coMpare le risposte di cottura e eccitabilità delle cellule elettroporate in condizioni diverse. Diversi parametri possono essere ottenuti. I parametri devono essere adattati al particolare studio utilizzando specifici software di analisi patch-clamp. Figura 2C mostra un esempio di trama dei potenziali d'azione contro la corrente di ingresso ottenuti da registrazioni di un II-III neurone strato WT è stato elettroporate a E15.5.

Figura 1. Un Cre-ricombinasi diluito strategia consente Etichettatura Sparse di neuroni corticali. A. sintesi schematica della strategia. Nei neuroni che trasportano sia CALNL-GFP e CRE, la cassetta loxP-STOP-loxP è asportato da CALNL-GFP e la GFP è espressa dal promotore forte CAG. B. Disegno schematico di un capillare borosilicato tirato con un estrattore micropipetta. La punta è tagliato da FOrceps, creando un angolo di 30 °. Misura 1 cm dalla punta all'inizio della parte più stretta del capillare. C. Posizione degli elettrodi per indirizzare la corteccia somatosensoriale. Gli elettrodi di platino sono posizionati circa sopra le orecchie dell'embrione. Grazie alla sua carica negativa, DNA va verso l'elettrodo positivo quando viene applicata la tensione. Variazione della posizione degli elettrodi consente di targeting differenti aree del cervello. D. Le immagini ottenute dopo vettori sono stati consegnati ai neuroni di livello II-III di elettroporazione in utero al giorno embrionale 15,5; Sezioni coronali sono state effettuate a giorno postnatale 16. Il vettore CAG-DsRed2 è stato co-trasfettato come controllo (a sinistra). GFP (al centro) è espressa solo in quei neuroni che anche incorporati Cre, che permette la ricombinazione dei siti loxP nel vettore CALNL-GFP. L'etichettatura sparse consente ai singoli neuroni di distinguere (punte di freccia). E. ad alto ingrandimento immagine confocale di tegli dendritiche pergole di un altro neurone GFP scarsamente etichettati. Barre di scala = 100 micron. Clicca qui per vedere una versione più grande di questa figura.
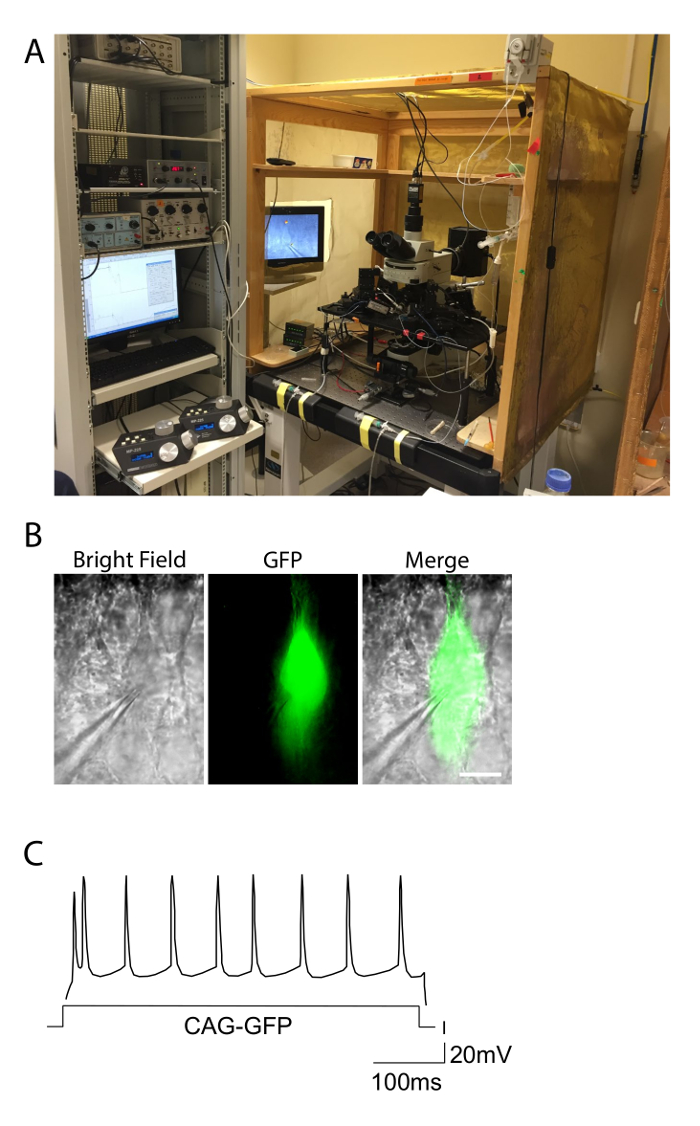
Figura 2. Impostazioni Elettrofisiologia ed esempio di una risposta di cottura. A. La foto illustra la configurazione di elettrofisiologia utilizzato per esperimenti di patch clamp in fettine acute. Il setup è incluso in una gabbia di Faraday per eliminare il rumore, e l'apparecchiatura è in cima ad un tavolo anti-vibrazioni. Controllori dei micromanipolatori motorizzati per gli elettrodi si osservano a sinistra. B. piramidale neurone di un topo elettroporate con GFP, osservata in campo luminoso e condizioni di fluorescenza verde. La pipetta di registrazione collegata a una cella GFP + è evidente. Barra di scala = 10 & #181; m. C. modelli di cottura di un CAG-GFP elettroporate livello di controllo II-III neurone che mostra la tipica risposta regular-chiodare. La distribuzione dei potenziali d'azione approssima ad una distribuzione regolare lungo la durata della corrente di ingresso (asse X). Clicca qui per vedere una versione più grande di questa figura.
| Palcoscenico | Voltaggio | elettrodi | Riferimenti |
| E9.5 | 7 V, 100 ms, 3 impulsi | Stick elettrodi di platino | Matsui et al. 2011 3 |
| E12.5 | 30 V, 50 ms, 3 - 5 impulsi | Pinze di tipo elettrodi 3 mm | Saito, T. 2006 12 |
| E15.5 | 35-48 V, 50 ms, 5 impulsi | Pinze di tipo elettrodi 5-7 mm | Rodriguez-Tornos et al. 2016 2, Saito, T. 2006 12 |
| P2 | 100 V, 50 ms, 5 impulsi | Pinze di tipo elettrodi 5-7 mm | Sonego et al. 2013 4 |
Tabella 1: condizioni di tensione e Elettrodi per l'elettroporazione di embrioni.
Discussione
Questo protocollo descrive in dettaglio come etichettare i neuroni della corteccia somatosensoriale di C75BL / 6 topi al fine di analizzare la loro connettività e la loro eccitabilità. Rispetto ai metodi esistenti, visualizza aspetti discriminanti connettività, come il numero di rami assonali per neurone, la loro precisa topografia, e la loro posizione anatomica. Modificando la posizione degli elettrodi, è possibile indirizzare altre popolazioni neuronali, come la corteccia del cingolo (mantenere lo stesso angolo tra gli elettrodi e il cervello, ma modificare l'orientamento dei poli) o dell'ippocampo 5, ed eseguire simili esperimenti etichettatura singoli neuroni o popolazioni più ampie, a seconda della strategia desiderata. Tuttavia, ci sono limitazioni per questo, in quanto non tutte le popolazioni sono ugualmente accessibili o altrettanto selettivamente etichettati. Ad esempio, nell'ippocampo, è possibile mirare selettivamente i neuroni tardo-nato della regione CA1, ma EAelettroporazione rly segna popolazioni eterogenee di cellule piramidali interne ed esterne. Nella corteccia cerebrale, neuroni nascono in maniera sequenziale, così il giorno di gestazione durante il IUE determina quale strato corticale è interessato. Esecuzione di precedenti obiettivi IUE neuroni più profonde (ad esempio, IUE a E14 etichette neuroni strato IV) 22.
Per un IUE di successo, si raccomanda di tener conto di alcune considerazioni. In primo luogo, è importante fare l'intervento in meno di 30 minuti al fine di ridurre lo sforzo sulla madre e per aumentare le possibilità di sopravvivenza dei cuccioli. In secondo luogo, la parte più difficile della procedura è l'iniezione del DNA-effettuare l'iniezione attraverso il capillare borosilicato più delicatamente possibile. Se gli embrioni vengono premuti troppo duro, possono essere danneggiati. In termini di risoluzione dei problemi la morte degli embrioni durante iniezioni di DNA, smussatura la punta con un angolo di 30 ° in grado di aumentare l'efficacia di questo processo. Se un beveller non è disponibile e capillari sono tagliati esclusivamente con le pinze, la corretta angolazione può essere confermata nel microscopio da dissezione. Eliminare capillari inadeguate. Infine, adattando le condizioni elettroporazione alla fase dell'embrione è importante al fine di aumentare il tasso di sopravvivenza (vedi Tabella 1).
Alcune considerazioni sono necessarie per quanto riguarda la ricostruzione di assoni e dendriti. Per etichettare singoli neuroni, la corretta concentrazione del plasmide Cre sono essenziali per ottenere una buona espressione sparse e per evitare la sovrapposizione confusione di proiezioni neuronali appartenenti a diversi neuroni. Sebbene questo protocollo propone l'uso di 4 ng / ml, può essere necessario regolare la concentrazione plasmide per ciascun esperimento, secondo il promotore utilizzato, la qualità della preparazione del DNA, e il metodo di quantificazione del DNA (ad esempio, riducono a 2 ng / ml se l'etichettatura troppi neuroni). in addition, per il monitoraggio assonale, è importante per tagliare un angolo appropriato per avere l'intero neurone nello stesso piano.
Passaggi critici per le registrazioni patch-clamp di successo sono la salute del tessuto delle fette acuta e la posizione e l'abbondanza di neuroni GFP-positive elettroporate. Se passi patch falliscono o risposte aberranti sono trovati durante le registrazioni, ridurre i tempi per l'elaborazione delle fette acuta. Se neuroni GFP sono difficili da identificare e localizzare grazie al loro numero ridotto nella fetta acuta, assicura che un sufficiente plasmide CAG-GFP è incluso nel mix elettroporazione. Per quanto riguarda i principali limiti degli approcci descritti, la tecnica patch-clamp consente di registrare diversi parametri che descrivono l'eccitabilità del neurone, ma non valuta aspetti che dipendono l'intero circuito. Inoltre, e di cui sopra, non tutte le sottopopolazioni neuronali sono accessibili attraverso IUE. In sintesi, in the futuro, queste tecniche possono contribuire all'ulteriore analisi della connettività strutturale e funzionale dei differenti sottopopolazioni neuronali nel cervello.
Divulgazioni
Gli autori dichiarano conflitti di interesse.
Riconoscimenti
Siamo grati a R. Gutiérrez e A. Morales per la loro eccellente assistenza tecnica e di LA Weiss per la modifica. CGB è finanziato dagli spagnoli Ministerio de Ciencia e Innovación (MICINN), FPI-BES-2012-056011. Questo lavoro è stato finanziato da una sovvenzione da BBVA Foundation e SAF2014-58598-jin (MINECO) a M. Navarrete e da una sovvenzione della Fondazione Areces e concede SAF2014-52119-R e BFU2014-55738-REDT (da MINECO) a Ramon M. Nieto.
Materiali
| Name | Company | Catalog Number | Comments |
| pCAG-Cre | Addgene | 13775 | |
| pCALNL-GFP | Addgene | 13770 | |
| pCAG-DsRed2 | Addgene | 15777 | |
| pCAG-GFP | Addgene | 11150 | |
| Fast Green | Carl Roth | 301.1 | |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| Carprofen (Rimadyl) | Pfizer GmbH | 1615 ESP | |
| Isoflurane (IsoFlo) | Abbott (Esteve) | 1385 ESP | |
| Ketamine (Imalgene) | Merial | 2528-ESP | |
| Xylazine (Xilagesic) | Calier | 0682-ESP | |
| Povidone Iodine | Meda | 694109.6 | |
| Eye Ointment (Lipolac) | Angelini | 65.277 | |
| Hanks' Balanced Salt Solution (HBSS) | Gibco by Life Technologies | 24020-091 | |
| Penicillin-Streptomycin | Sigma -Aldrich | P4333 | |
| Scalpel Handle # 3 - 12 cm | Fine Science Tools | 10003-12 | |
| Scalpel Blades # 10 | Fine Science Tools | 10010-00 | |
| Adson Forceps-Serrated - Straight 12 cm | Fine Science Tools | 1106-12 | |
| Hardened Fine Scissors - Straight 11 cm | Fine Science Tools | 14090-11 | |
| Scissors Mezenbaum-Nelson Curved L=14.5 cm | Teleflex | PO143281 | |
| Thin curved tips - Style 7 Dumoxel | Dumont | 0303-7-PO | |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11251-20 | |
| Mathieu Needle Holder - Serrated | Fine Science Tools | 12010-14 | |
| AutoClip Applier | Braintree scientific, Inc | ACS APL | |
| 9 mm AutoClips | MikRon Precision, Inc. | 205016 | |
| Sutures - Polysorb 6-0 | Covidien | UL-101 | |
| Electric Razor | Panasonic | ER 240 | |
| Borosilicate glass capillaries (100 mm, 1.0/0.58 Outer/Inner diameter) | World Precision Instrument Inc. | 1B100F-4 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma -Aldrich | A5177-5EA | |
| Gauze (Aposan) | Laboratorios Indas, S.A.U. | C.N. 482232.8 | |
| Cotton Swabs (Star Cott) | Albasa | - | |
| Needle 25 G (BD Microlance 3) | Becton, Dickinson and Company | 300600 | |
| Sucrose | Sigma -Aldrich | S0389 | |
| Paraformaldehyde | Sigma -Aldrich | 158127 | |
| OCT Compound | Sakura | 4583 | |
| Tissue Culture Dish 100 x 20 mm | Falcon | 353003 | |
| GFP Tag Polyclonal Antibody | Thermo Fisher Scientific | A-11122 | |
| Secondary Antibody, Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11008 | |
| DAPI | Sigma-Aldrich | D9542 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10270106 | |
| Triton X-100 | Sigma-Aldrich | X100-500ML | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0002 | |
| Platinum electrodes 650P 7 mm | Nepagene | CUY650P7 | |
| Microscope for Fluorescent Imaging - MZ10F | Leica | - | |
| VIP 3000 Isofluorane Vaporizer | Matrx | - | |
| TCS-SP5 Laser Scanning System | Leica | - | |
| Axiovert 200 Microscope | Zeiss | - | |
| Cryostat - CM 1950 | Leica | - | |
| P-97 Micropette Puller | Sutter Instrument Company | P-97 | |
| Patch clamp analysis softwarw (p-Clamp Clampfit 10.3) | Molecular Devices | - | |
| Acquisition software (MultiClamp 700B Amplifier) | Molecular Devices | DD1440A | |
| Motorized Micromanipulator + Rotating Base | Sutter Instrument | MP-225 | |
| Air Table | Newport | - | |
| Miniature Peristaltic Pumps | WPI | - |
Riferimenti
- Dehorter, N., et al. Tuning of fast-spiking interneuron properties by an activity-dependent transcriptional switch. Science. 349 (6253), 1216-1220 (2015).
- Rodriguez-Tornos, F. M., et al. Cux1 Enables Interhemispheric Connections of Layer II/III Neurons by Regulating Kv1-Dependent Firing. Neuron. 89 (3), 494-506 (2016).
- Matsui, A., Yoshida, A. C., Kubota, M., Ogawa, M., Shimogori, T. Mouse in utero electroporation: controlled spatiotemporal gene transfection. J Vis Exp. (54), (2011).
- Sonego, M., Zhou, Y., Oudin, M. J., Doherty, P., Lalli, G. In vivo postnatal electroporation and time-lapse imaging of neuroblast migration in mouse acute brain slices. J Vis Exp. (81), (2013).
- Baumgart, J., Baumgart, N. Cortex-, Hippocampus-, Thalamus-, Hypothalamus-,Lateral Septal Nucleus- and Striatum-specific In Utero Electroporation in the C57BL/6 Mouse. J Vis Exp. (107), (2016).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. J Vis Exp. (31), (2009).
- Rice, H., Suth, S., Cavanaugh, W., Bai, J., Young-Pearse, T. L. In utero electroporation followed by primary neuronal culture for studying gene function in subset of cortical neurons. J Vis Exp. (44), (2010).
- Woodworth, M. B., et al. Ctip1 Regulates the Balance between Specification of Distinct Projection Neuron Subtypes in Deep Cortical Layers. Cell Rep. 15 (5), 999-1012 (2016).
- Wickersham, I. R., et al. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53 (5), 639-647 (2007).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104 (3), 1027-1032 (2007).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101 (1), 16-22 (2004).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat Protoc. 1 (3), 1552-1558 (2006).
- Bullmann, T., Arendt, T., Frey, U., Hanashima, C. A transportable, inexpensive electroporator for in utero electroporation. Dev Growth Differ. , (2015).
- Miller, M. Maturation of rat visual cortex. I. A quantitative study of Golgi-impregnated pyramidal neurons. J Neurocytol. 10 (5), 859-878 (1981).
- Miller, M., Peters, A. Maturation of rat visual cortex. II. A combined Golgi-electron microscope study of pyramidal neurons. J Comp Neurol. 203 (4), 555-573 (1981).
- Cubelos, B., et al. Cux-2 controls the proliferation of neuronal intermediate precursors of the cortical subventricular zone. Cereb Cortex. 18 (8), 1758-1770 (2008).
- Kang, J. Y., Kawaguchi, D., Wang, L. Optical Control of a Neuronal Protein Using a Genetically Encoded Unnatural Amino Acid in Neurons. J Vis Exp. (109), (2016).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. J Vis Exp. (49), (2011).
- Maravall, M., Stern, E. A., Svoboda, K. Development of intrinsic properties and excitability of layer 2/3 pyramidal neurons during a critical period for sensory maps in rat barrel cortex. J Neurophysiol. 92 (1), 144-156 (2004).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nat Protoc. 1 (4), 1977-1986 (2006).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev Biol. 240 (1), 237-246 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon