Method Article
子宮内エレクトロポレーションは、神経部分集団の興奮とシングルセルの接続を研究するためのアプローチ
要約
この原稿は、単一細胞レベルおよび蛍光標識された神経細胞の興奮で、ニューロンの構造的接続性を記述するために子宮内エレクトロポレーション(IUE) で使用するプロトコルを提供します。組織学は、樹状突起および軸索突起を特徴付けるために使用されます。急性スライスにおける全細胞記録は、興奮性を調査するために使用されます。
要約
神経系は、異なる神経細胞の種類の巨大な範囲で構成されています。これらのニューロンの亜集団は、軸索の接続の他の特徴、それらの異なる樹枝状の形態、それらの特定のパターン、およびそれらの選択的な焼成反応の間、ことを特徴とします。開発中の分化のこれらの側面を担当する分子・細胞メカニズムはまだよく理解されていません。
ここでは、標識に結合されたプロトコルを記述し、皮質ニューロンの構造的な接続性と興奮性を特徴づけます。 子宮内エレクトロポレーション(IUE)プロトコルの変更は、ニューロンのまばらな人口の標識化を可能にします。これは、順番に、個々のニューロンの樹状突起と軸索の識別と追跡、正確な軸索突起の層状場所の特性評価、および形態計測分析を可能にします。 IUEはまた、興奮性の変化を調べるために使用することができ野生型(WT)またはエレクトロポレーションの脳の急性スライスからホールセル記録とそれを組み合わせることにより、遺伝的に改変された神経細胞。これら2つの技術が構造的および機能的接続性の及び開発中に神経細胞の多様性を制御する分子機構のカップリングのより良い理解に貢献しています。これらの発生プロセスは、軸索の配線、ニューロンの機能的多様性、および認知障害の生物学上重要な意味を持ちます。
概要
樹状突起と軸索構造の開発が大脳皮質を含め、神経系における回路調節の重要な側面です。これは、多様な神経細胞亜集団の選択的な配線の間に重要な役割を果たしています。最近の報告数は、接続に加えて、神経細胞の分子多様性は、焼成の非常に特異的な様式の買収により反射され、ことが示されています。しかし、開発中に明確なニューロンのサブタイプの興奮性と接続性を決定するメカニズムだけでなく、コーディネートの程度は、まだよく、2は 1を理解されています。
生体内 loss-がと機能獲得型に特異的な遺伝子および回路の開発における彼らの影響力の発現レベルとの間の関係の研究を可能に分析します。 子宮内エレクトロポレーションでは (IUE)が広く研究するために使用される技術であり、それらの接続の全体的なパターンを研究するための特定のニューロン集団における目的の遺伝子の機能と。しかし、生きたマウスでは皮質層における軸索と樹状突起の形態学的特性を決定するために、まばらニューロンを標識することが不可欠です。 IUEと組み合わせたCre組換えシステムは、識別された皮質の薄層の個々の細胞によって放出された突起を解決するために、十分に低い密度でニューロンのまばらな集団をマークするために使用することができます。この方法は、電気穿孔脳( 図1)の合理的な数の分析の後に定量的データを得るために、皮質ニューロン当たりの十分な数のラベル。この原稿は、接続のような微細な分析のための方法を提示しています。また別の実験において、分析するために同様の戦略を提示し、緑色蛍光タンパク質(GFP)の電流 - クランプ記録を行うことにより、ニューロンの電気的特性は、急性皮質切片から細胞を-electroporated。これらのプロトコールは汎用性がありますし、WTおよびトランスジェニック動物のニューロンの、また機能の損失と利益がIUE中に追加のプラスミドによって導入された神経細胞の興奮性と接続性の研究にも適用することができます。
このプロトコルは、胎生日(E)15.5におけるマウスのエレクトロポレーションについて説明したが、この技術は、E9.5 3及び生後(P)2~4の間の任意の年齢で行うことができます。初期段階でのエレクトロポレーションは、ニューロンおよび視床の前駆体および皮質の深層、後段のエレクトロポレーションマークより表面層( 例えば、E15.5 IUEターゲット層II-IIIニューロン)を標的ながら。要約すると、単一細胞形態学的分析と電気生理学とIUEの組み合わせは、神経系のニューロンの巨大な構造的および機能的多様性の根底にある分子メカニズムを解明するための有用なツールです。
プロトコル
全ての動物手順は、(PROEX 14分の118; PROEX 15分の331)国内および欧州の法律を遵守して、マドリード動物実験委員会のコミュニティに承認されました。手順中に無菌状態を維持します。
1. 子宮内エレクトロポレーション
注:IUEためのこのプロトコルは、以前5、6、7を公表されている他のものから適合されています。本稿では、単一ニューロン8と標準GFPレポータープラスミドを使用して、別の実験での電気生理学的特性の形態の研究を可能にするレポーター戦略の修正を加えて、E15.5胚のIUEためのプロトコルについて説明します。
- DNAの調製
- 製造元の指示に従ってエンドトキシンを含まない単離キットを使用して、DNAプラスミドを準備し、1×Pでそれらを希釈hosphate緩衝生理食塩水(PBS)。
- 単一セルの標識のために、以下の構築物および最終濃度を使用して手術当たりのDNA混合物の10μL(胚あたり1μL)を調製:プラスミド対照として、蛍光タンパク質レポーター( 例えば、CAG-DsRed2の9)、を1μg/μLをコードしますエレクトロポレーションの効率化のため、実験的なプラスミドは、一般的に、試験すべきを1μg/μL; LoxP-ストップのLoxP-蛍光タンパク質プラスミド(CALNL-GFP 10)、を1μg/μL;そして、構築をコードするCreを10、1から4 ngの/μL。注入されたDNAを可視化するために、水中の0.1%ファストグリーン(重量/容積)の1μLを追加します。
注:GFP構築物のCre組換えは、わずか数ニューロンで発生し、個々の軸索投射( 図1A)の可視化と再構成を可能にします。 - 標準のパッチクランプ研究のために、手術当たりのDNA混合物の10μL(EMBRあたり1μLを準備ヨーヨー)蛍光タンパク質( 例えば、CAG-GFP 11)、レポーター制御などを1μg/μLをコードする以下のプラスミド;実験プラスミド、一般に1μg/μL;そして水中の0.1%ファストグリーンの1μL(重量/体積)。
注:これらは、所望のラミナ内のラベルされた興奮性ニューロンを多く含む急性スライスを分析し、標準的なエレクトロポレーション条件です。ステップ1.1.1.1で説明したように、単一の細胞にパッチクランプ研究を実行するには、DNAを準備します。
- 単一セルの標識のために、以下の構築物および最終濃度を使用して手術当たりのDNA混合物の10μL(胚あたり1μL)を調製:プラスミド対照として、蛍光タンパク質レポーター( 例えば、CAG-DsRed2の9)、を1μg/μLをコードしますエレクトロポレーションの効率化のため、実験的なプラスミドは、一般的に、試験すべきを1μg/μL; LoxP-ストップのLoxP-蛍光タンパク質プラスミド(CALNL-GFP 10)、を1μg/μL;そして、構築をコードするCreを10、1から4 ngの/μL。注入されたDNAを可視化するために、水中の0.1%ファストグリーン(重量/容積)の1μLを追加します。
- 製造元の指示に従ってエンドトキシンを含まない単離キットを使用して、DNAプラスミドを準備し、1×Pでそれらを希釈hosphate緩衝生理食塩水(PBS)。
外科2.準備
- 無菌の手順を使用して生存手術を行います。マスク、手袋、楽器、および手術野を含む無菌状態を、確認してください。手術器具(メス、Adson鉗子、硬化罰金はさみ、曲がったはさみ、デュモン鉗子、針ホルダー)を滅菌します。
- 1 / 0.58 mmの内側/外径のホウケイ酸ガラスキャピラリーを選択します。キャップを取り外しillaries 3。引っ張った後、1センチメートルの最適な先端の長さのためにターゲットにしています。細かい鉗子( 図1B)を用いて約30度の角度で針の先端をカットします。
- 無菌の等張液(1×PBSまたはHank's平衡塩溶液(HBSS))の500ミリリットルを準備します。 100と37°Cにこのソリューションを温める:ペニシリン - ストレプトマイシン1を追加します。これは、手術後4℃で保存することができます。
- 皮下鎮痛薬の術前投与量( 例えば、カルプロフェン、5ミリグラム/ kg体重)を注入します。
- 加熱パッド上に置くことにより手術のために暖かい動物を保管してください。術後の回復のために37°Cまできれいケージを温めます。
3.手術
- イソフルランとC57BL / 6 E15.5妊娠マウスを麻酔。まず、0.8リットル/分の酸素で3%イソフルランで密室を注入し、それが眠っているまで、内側にマウスを残します。加熱パッドにマウスを転送し、配信するためのマスクの中に鼻と口を配置イソフルランのy座標。徐々にマスクを介して1.5%イソフルランに手術の過程で麻酔を減少させます。ペダル反射(つま先ピンチ)の損失を観察することによって、適切な麻酔を確認してください。最適な手順は、約20分以上かつ45分かかります。
- 手順中の乾燥から目を防ぐために、眼軟膏を適用します。
- (電気かみそりや脱毛クリームのいずれかを使用して)腹部の〜3 cmの領域から髪を削除します。ヨウ素を注入した綿棒に続いて70%エタノールを注入した綿棒で手術領域を、洗います。 3回繰り返します。
- 感染を防ぐために、滅菌ガーゼで手術領域をカバーしています。
- 正中線に垂直な長さ2cmの皮膚を貫通する開口部と平行にするためにメスを使用してください。鈍い湾曲したハサミを使用して腹部の皮膚や筋肉を分離します。鉗子で筋肉を持ち、腹腔を露出するように白線を介してそれをカット。
- ヘルプOで胚を探します鉗子F。ステップ2.3で調製した滅菌生理食塩液で2湿った綿棒を湿らし、開口部からアクセス可能な胚を操作するためにそれらを使用しています。胚の周りに綿棒を置き、静かに腹腔から両方の子宮角を抽出します。乾燥からそれらを防ぐために、胚および手順を通じて暖かく食塩水で水和開かれた腹腔にしてください。
DNAとエレクトロポレーションの4インジェクション
- (明らかに脳の2以上の前方小胞として目によって視覚化することができる)終脳を見つけるために、指で軽く胚を操作します。口のピペットで準備ホウケイ酸キャピラリーを置きます。それは1側脳室に到達するまで、血管を避け、子宮を通って針の先端を渡します。大きな青いスポットが観察されるまで、ゆっくりとファストグリーン色のDNA溶液の約1μLを注入。
- 目に横方向に7 mmの白金電極を配置胚( 図1C)の電子ヘッド。
注:DNAは負に帯電しています。電圧を白金電極間に印加されたとき、したがって、それは、正電極に向かって移動します。電極の位置を変化させることにより、脳の異なる領域を標的とすることができます。 - 白金電極を介して電圧を印加(E15.5胚のため:5パルス、38 V、50ミリ秒間隔の周期長、950ミリ秒間隔ポーズこれらの条件は、発達段階に応じて異なります)12。
注:別の胚の段階のための電圧条件と電極については、 表1を参照してください。 - 各胚のために4.3 - を繰り返して、4.1を繰り返します。
外科手術後の5終了
- バック母に子宮を操作するために綿棒を使用してください。温めた生理食塩水で腹腔を記入(約2 mLを加え)。
- 単純に中断ステッチまたは連続ステッチと筋肉を縫合。 #6-0縫合糸を使用して、秒。
- 外部傷を閉じるためにステープルを使用してください。ステープルの前に筋肉から皮膚を分離するように注意してください。鼻マスクを削除します。
- マウスを動物施設の部屋でそれを置く前に加熱された、きれいなケージで30分間回復させます。それは胸骨横臥位を維持するのに十分な意識を取り戻したまで無人の動物を放置しないでください。完全に回復するまで、他の動物の会社で手術を受けた動物を置かないでください。
- 手術の次の日の間、動物を監督。 2日間皮下(カルプロフェン、5ミリグラム/ kg体重)12時間毎に鎮痛剤を適用したり、動物の法律に従って。追加の術後ケアは子犬のために必要とされません。
6.試料の調製および分析
- オプション:P2では、蛍光顕微鏡を用いてエレクトロポ仔における蛍光の発現を確認します。 IUEが成功した場合、蛍光は明らかに私が見ることができますヘッド13を n個。マークまたは積極次の手順で使用するためにエレクトロポレーションされたマウスを分けます。標準的な動物施設条件のダムと子犬を保管してください。
- 研究の所望の段階では、経マウスを灌流。一般的に、樹状突起と軸索の成長の最も活性相は、最初の3生後週2、14、15に対応しています。
- マウス当たり1×PBS中の4%パラホルムアルデヒド(PFA)を30mLを調製し、氷上で冷やします。
注意:PFAは、既知のアレルゲンと発がん性物質です。それは有毒です。適切な個人保護具を着用します。
注:PFAの量は、必要に応じて(かん流後のために例えば 、P16のために、灌流のため20 mLおよび10 mLのが必要とされている)は、マウスの年齢によって異なります。 - 1:100μg/ mLのケタミンの8体積比:100μg/ mLの×1を用いて動物を麻酔するためにケタミン - キシラジンミックスを調製ylazine:PBS(マウス当たり約0.2ミリリットルを用意)。
- 腹腔内にステップ6.2.2で製造したミックスを0.2mLを注入することにより、マウスを麻酔。
- その背中に麻酔をかけたマウスを置きます。メスを用いて胸部上記水平切開を行います。心臓が観察できるようになるまで細かいハサミで筋肉や横隔膜をカットします。
- 細かいハサミで右心房を切開してください。ゆっくりと血液を除去するために、25ゲージの針を用いて左心室にPBSの20mLのを注入します。マウスは、剛性であり、臓器が白くなるまで20 mLのPFA(ステップ6.2.1)を注入します。
- すぐに頭を削除し、頭蓋骨に首から皮膚に正中切開を行います。緩やかに湾曲鉗子を使用して頭蓋骨を剥がすと脳を抽出します。穴をあけたり、頭蓋骨の除去中に脳を損傷しないよう注意してください。それを後置する4℃で一晩4%PFAの10 mLの脳を置きます。
- マウス当たり1×PBS中の4%パラホルムアルデヒド(PFA)を30mLを調製し、氷上で冷やします。
- Cryoprotec彼らが沈むまで、2日 - tは1、4℃で、PBS中の30%ショ糖の10 mLの脳を固定します。 1-cm 3のアルミ箔キューブを準備します。 10月にキューブの道の2/3を埋めます。内部の脳を入れて、ドライアイスでキューブを置くことによって、それらを凍結。 -80℃で凍結した脳を保管してください。
- 試料ディスクの表面上の10月の代わりの低下は、組織学キューブからアルミ箔を剥離し、液体10月の上に試料ディスクに所望の向きでキューブを配置します。それが修正されるまで、しっかりと圧力を適用します。クライオスタットの試料ヘッドに試料ディスクを挿入します。オリエント標本(ナイフ/ブレードに有利な相対位置に移動)。
- クライオスタットのセクションの脳を。細かいブラシを使用して、厚さ100μmの浮遊凍結切片16とPBSでそれらを置く- 50を選択します。
- 必要であれば染色します。
注:軸索形態の研究のために、GFP抗体で染色することを強くお勧めします 2アップ。- (ブロッキング溶液)、0.5%トリトンX-100を含むPBS中の5%ウシ胎児血清を用いて室温で1時間、切片をブロックします。ブロッキング溶液中で希釈した500一次抗体( 例えば、ウサギ抗GFP):1で4℃で一晩インキュベートします。
- PBSでセクションを3回洗浄します。 500二次抗体( 例えば、ヤギ抗ウサギアレクサフルオロ488)をブロッキング溶液中に希釈し、室温で1時間インキュベートする:1を加えます。 PBSでセクションを3回洗浄します。
- 10分間、0.5%トリトンX-100を含むPBS中:DAPI(10,000 1)との対比。 PBSでセクションをすすぎます。媒体16を装着する水性のセクションをマウントします。
7.イメージングおよび分析
- 蛍光または共焦点顕微鏡
- 完全なニューロンを再構成するために、高倍率(少なくとも40X)と高解像度(最小1,024×1024)を使用して画像を取得します。選択して "タイルスキャン」またはすべての樹状突起と軸索のプロセスにまたがる、関心領域をカバーする取得ソフトウェアの同等のオプションは、情報の損失を回避するために、Z軸上のスタックの十分な数を取得します。
注:一般的に、顕微鏡のソフトウェアは、「最適化されたスタック」オプションがありますが、そうでない場合、テスト手動で画像が正しく個々の投影を定義するためにオーバーラップするために必要なステップ数を決定します。二つの重要なパラメータは、ピンホールと客観です。考慮して「より高い倍率、より解像度、より必要なのz-手順。」
- 完全なニューロンを再構成するために、高倍率(少なくとも40X)と高解像度(最小1,024×1024)を使用して画像を取得します。選択して "タイルスキャン」またはすべての樹状突起と軸索のプロセスにまたがる、関心領域をカバーする取得ソフトウェアの同等のオプションは、情報の損失を回避するために、Z軸上のスタックの十分な数を取得します。
- 分析
注:樹状突起の形態および軸索分岐:いくつかのパラメータを分析することができますが、ステップ7.2.1は2に焦点を当てています。フィジーのダウンロード( http://fiji.sc/ )。- イメージを開き、メニューから「セグメント化された行」オプションを選択します。目に沿って上下に移動すると(線を引きますニューロンの構造以下)は、マウスをスクロールすることにより、電子のz軸。行を保存するために(あるいは、プレス「t」を) "を追加し、分析、ツール、ROIマネージャー」に移動します。分析ニューロン2のすべての軸索や樹状突起のためにこのプロセスを繰り返します。
- ROI Managerのメニュープレスの長さ(または追加のパラメータ)を取得するための「測定」ボタンを押します。それらを分析するには、テキストファイルやスプレッドシートに測定結果をエクスポートします。
8.電気生理学
注:このプロトコルの目的は、層II / III錐体細胞のニューロンからホールセル電流クランプ記録を得るために、GFP-エレクトロポマウスの脳(または以前にエレクトロポレーションし、他の蛍光タンパク質)におけるGFP発現により、視覚的に識別されます。これは、以前に発表された方法17、18の適応です。このプロトコルを使用して、遺伝子MODIFの効果を研究することが可能ですニューロンの電気的特性にIUEによって導入ication。特定の発射モードの取得は、イオンチャネルの広いレパートリーの動的な表現を含み、それは後半出生後の段階の前に過渡発射モードの発現をもたらす分化の段階的なプロセスです。例えば、成熟した電気的応答は、P16 2、19の前に体性感覚のマウス皮質のII / III層では観察されません。
- 急性スライスするための前提条件
- マウスから脳を除去するための無菌手術ツール準備:ギロチンを、頭部を削除するには、頭蓋骨を切断するための小さなはさみ、。鉗子は、組織から頭蓋骨を分離します。へらは、微妙にそのケーシングから脳組織を除去します。 2つの等しい半分に皮質を解剖するための金属製スライサー、;そしてビブラトームからスライスを移動するためのパスツールピペットは、(人工脳脊髄液(ACを含む溶液に入れます検査用SF)、その後インキュベーション保持領域にACSFからスライスを転送します)。
- 119のNaCl、26 mMの炭酸水素ナトリウムを含有する高純度(二回蒸留水)の水を使用してACSFの1 Lを用意し、11 mMグルコース、2.5のKCl、1.2mMのMgCl 2を、2.5 mMのCaCl 2を、および1mMのNaH 2 PO 4。 HClまたはNaOHで7.4から7.3のpHを滴定します。 290ミリオスモルに浸透圧を調整します。
- カルボゲンで気泡ACSF(95%O 2/5%CO 2)15 - 12 - 7.3のpHを安定化するために、テフロンチューブ(約1 mm)を用いて20分。
- 雪解けの解剖ソリューションを生成するために15分 - 10のために-80℃でカルボゲンで飽和ACSF溶液200mlをフリーズします。脳をスライスするために氷上で100-×20 mmの組織培養皿を置きます。
- ただ、実験の開始前に、1%の低融点アガロース溶液100mLを準備します。この溶液を冷却し、アガロース(寸法:1×1×0.5ミリメートル)の正方形の部分を切り出し、それを瞬間接着剤背中プラットフォームの、右の脳をスライスする場所の背後にある(アガロースゲルスライス中に脳のサポートを提供します)。できるだけフロントは限り平坦にします。
- 急性スライスを取得
- マウスを固定化し、イソフルラン2%でそれを麻酔。ギロチン開口部にヘッドを配置し、迅速にそれを刎ねます。骨レンジャーや細かい鉗子を使用してできるだけ速くその頭蓋骨を削除します。チルドACSFに脳を入れてください。
注:それはすぐにこのステップを実行することが重要です。 - チルド培養皿に脳を置きます。小さなハサミで小脳を切り取ります。
- へらで脳をピックアップし、ペーパータオル上でそれが乾燥汚点。
- ビブラホルダーの脳のventrocaudal面を接着。氷のように冷たいACSFで満たさビブラトームにホルダーを置きます。
- バブラー(1-ミリメートルを置き、例えば 、処置を通して継続carbogenationを確保(300-μmの冠状切片を切断することにより、急性スライスを取得次のビブラトームの設定を使用して、ビブラ室でポリテトラフルオロエチレンチューブ)):0.06 mmの振幅と0.08から0.10ミリメートル/ sの速度。最も遅い可能な速度(パス当たり〜22秒)に、事前に設定します。これらの最適な設定を変更し、必要に応じて経験的に各マシンのための最適な条件を得ます。
- 95%O 2/5%CO 2ガスをバブリングしながら急性3mmのミオ -イノシトールとを補充したACSF中で少なくとも60分間スライス、0.4mMのアスコルビン酸、および2mMのピルビン酸ナトリウムをインキュベートします。 25℃の温度を維持します。
- 15分未満でスライス手順を実行します。使用する記録チャンバーに移される前に7時間 - 所望の場合、スライス1のために保存することができます。
- マウスを固定化し、イソフルラン2%でそれを麻酔。ギロチン開口部にヘッドを配置し、迅速にそれを刎ねます。骨レンジャーや細かい鉗子を使用してできるだけ速くその頭蓋骨を削除します。チルドACSFに脳を入れてください。
- 全細胞記録のための前提条件
- 潅流システム、顕微鏡、電極(記録、刺激、及びグランド)、マクロおよびMICR、電気生理学ステーションは記録室が装備されていることを確認してくださいomanipulators、剛体振動耐性テーブルトップとファラデーケージ、刺激器、増幅器及びアナログ・デジタル(A / D)変換器、収集ソフトウェアを備えたコンピュータ、及びGFP(または任意の他の蛍光色素)を分析するためのフィルタ遺伝的にニューロン18( 図2A)を修正しました。
- 115ミリモルのグルコン酸カリウム、2のMgCl 2、10mMのHEPES、20mMのKClを、4 mMののNa 2 ATP、および0.3 mMののNa 3 GTPは、KOHによってとKClにより290ミリオスモルにpHを7.2に調整を含む、細胞内液を準備します。
- ホウケイ酸ガラスキャピラリーを引いて、パッチピペットを行います。マイクロピペットプラーを使用して、パッチ電極を準備します。ホウケイ酸毛細血管(1.5mmの外径、0.86 mmの内径、10 cmの長さ)を使用します。細胞内液で満たされたときに3-10MΩの抵抗を示すパッチ電極を作ります。
- 2ミリリットル/分の速度でACSFで録音室を灌流。 approximでチャンバの温度を維持ately 33°C。
- ホールセル記録
- パスツールピペット(長い先端をカットオフ)や小さなブラシを使って録音室にスライスを転送します。ハープとのスライスを押したままにします。 2ミリリットル/分の速度で常にACSFでスライスを灌流。
- GFP陽性ニューロンにパッチを適用します。
- 記録室にスライスを入れて、低倍率(10倍)で、顕微鏡を通して関心のある領域を見つけます。その後、60倍対物レンズを使用してパッチを適用するGFP陽性細胞を見つけます。
- 細胞内液と記録電極を埋めます。細胞内液と記録電極を埋めるために、フィルタ(4 mmのフィルター)にリンクされているシリンジとマイクロローダーチップを使用してください。
- ピペットホルダーにガラスピペットを置きます。浴中にピペットチップを置き、先端に焦点を当てます。ピペットバスになると、背圧制御システムを介して正の圧力を加えます。
- 蛍光( 図であるニューロンにパッチを適用UREの2B)。
- ピペット内の背圧を維持しながら、視覚的な指導の下で、目的の細胞に近づきます。細胞表面上の小さなディンプルが現れた場合には、圧力を解放します。この時点で、密封(1GΩよりも大きい抵抗)が形成されてもよいです。それ以外の場合は、それを容易にするために、光負圧(吸引)を適用します。
- シールが形成されている間、-60 mVの保持に電圧クランプをもたらします。 GΩシールが形成されると、ピペットの下の細胞膜を破壊し、全細胞モードに入るために吸引のパルスを印加します。詳細については、20を参照して参照してください。
- 電流クランプ条件21を使用して、活動を記録。いったん全細胞モードでは、電流クランプモードに電圧クランプから切り替えて録音を開始します。例えば、細胞の興奮を記録し500ミリ秒、長い脱分極電流の注射を適用する(100から400 PA)を。
- 発射速度bを計算しますyは入力電流を増加させるための列車に沿った活動電位の数をプロットします。
注:静止膜電位、入力抵抗、及び膜キャパシタンスも記録21から計算することができます。
- 発射速度bを計算しますyは入力電流を増加させるための列車に沿った活動電位の数をプロットします。
結果
詳細にと開発を通じて神経細胞の形態学的変化を特徴づけるために、まばらニューロンを標識することが不可欠です。この酵素を取り入れるだけのニューロンがGFP( 図1A)を発現するようのCreリコンビナーゼ希釈システムは、神経細胞のまばらな集団において、目的の遺伝子の発現を可能にします。この戦略を使用して、層II-IIIが標的とE15.5でIUEによって標識されています。 1μg/μLでCAG-DsRed2のは、コントロールとして同時エレクトロポレーションであり、生きている動物に正のエレクトロポレーションの脳を識別します。重要なことには、抗GFP抗体で染色した後、信号は、それらの樹状突起の形態及び軸索( 図1D及びE)の明確な可視化を可能にするのに十分に強いです。
IUEと電気後、細胞全体の記録から得られたパラメータの分析は、同時ために使用されさまざまな条件の下で焼成反応およびエレクトロポレーションした細胞の興奮性をmpare。いくつかのパラメータを得ることができます。パラメータは、特定のパッチクランプ分析ソフトウェアを使用して、特定の研究に適合させるべきです。 図2Cは、E15.5でエレクトロポレーションしたWT層II-IIIニューロンの記録から得られた入力電流に対する活動電位のプロットの例を提供します。

図1. AのCreリコンビナーゼ希薄化戦略は、皮質ニューロンのスパース標識化を可能にします。戦略のA.概略要約。 CALNL-GFPとCREの両方を運ぶ神経細胞では、のLoxP-STOP-のLoxPカセットはCALNL-GFPから切除され、GFPは、強力なCAGプロモーターによって発現されます。ホウケイ酸キャピラリーのB.模式図は、マイクロピペットプラーを使用して引っ張りました。先端はFOによって切断されますrceps、30°の角度を作成します。毛細血管の狭い部分の先頭に先端から1cmに測定します。体性感覚野を対象とする電極のC.位置 。白金電極は、約胚の耳の上に配置されています。電圧が印加されると、その負電荷のために、DNAは、正電極に向かいます。電極の位置の変化は、異なる脳領域を標的とすることができます。ベクトル後に得られたD.画像は、胚日15.5で子宮内エレクトロポレーションにして、レイヤーII-IIIニューロンに配信されました。冠状断面は、CAG-DsRed2のベクトルは、コントロール(左)として同時トランスフェクションした生後16日目に行われました。 GFP(中央)はCALNL-GFPベクターでLoxP部位の組換えを可能にする、唯一のものCreを組み入れたものニューロンにおいて発現されます。まばらな標識は、個々の神経細胞が(矢頭)を区別することができます。トンのE.高倍率の共焦点画像彼は別のまばらに標識したGFPニューロンのアーバーを樹状。スケールバー=100μmです。 この図の拡大版をご覧になるにはこちらをクリックしてください。
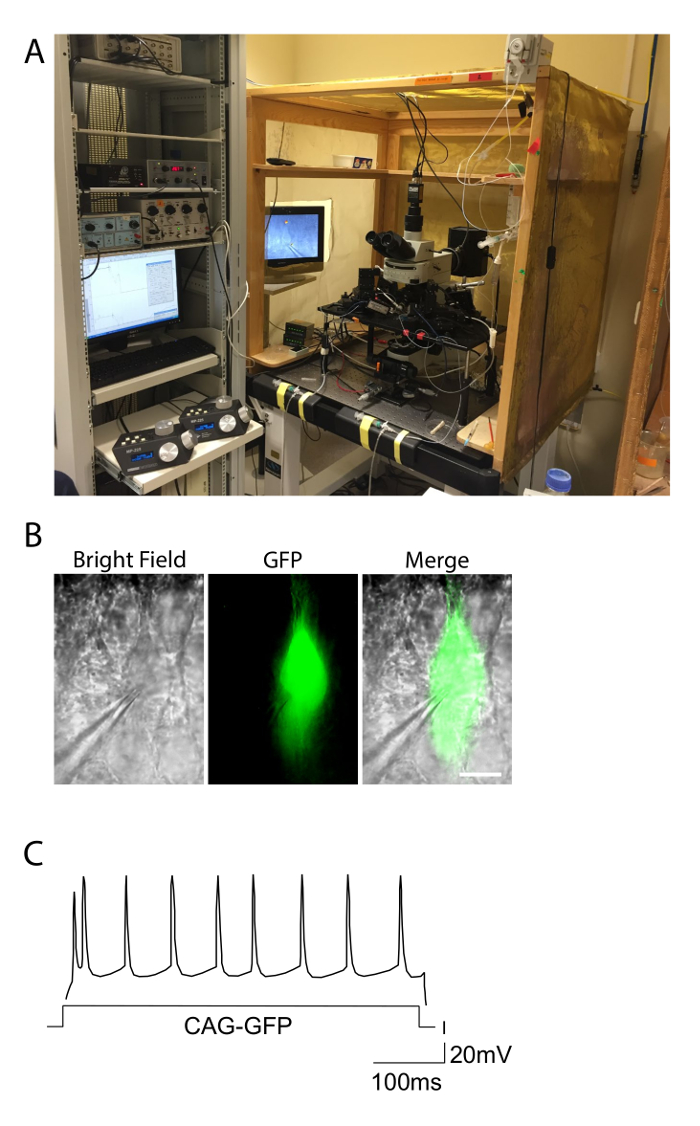
焼成応答の図2.電気生理学の設定と例。 A.写真は、急性スライスにおけるパッチクランプ実験に使用される電気のセットアップを示します。セットアップは、ノイズを除去するために、ファラデーケージ内に含まれ、装置は、除振台の上にあります。電極用の電動式マイクロマニピュレータのコントローラは、左側に観察されます。明視野と緑色の蛍光条件下で観察GFPでエレクトロマウスのB.錐体ニューロン、。 GFP +細胞に装着された記録ピペットは顕著です。スケールバー= 10µメートル。 CAG-GFPのC.発火パターンは、典型的な規則的なスパイク応答を示す制御層II-IIIニューロンを電気穿孔しました。活動電位の分布は、入力電流(X軸)の期間に沿って正規分布に近似します。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| ステージ | 電圧 | 電極 | リファレンス |
| E9.5 | 7 V、100ミリ秒、3パルス | 白金電極をスティック | マツイら。 、2011年3 |
| E12.5 | 30 V、50ミリ秒、3から5パルス | 鉗子型電極3 mmの | 斎藤、T.、2006年12 |
| E15.5 | 35-48 V、50ミリ秒、5パルス | 鉗子型電極5-7 mmの | ロドリゲス-Tornos ら。 、2016年2、斎藤、T.、2006年12 |
| P2 | 100 V、50ミリ秒、5パルス | 鉗子型電極5-7 mmの | Sonego ら。 2013年4 |
表1:胚のエレクトロポレーションのための電圧条件および電極。
ディスカッション
このプロトコルは、それらの接続とその興奮性を分析するために、C75BL / 6マウスの体性感覚皮質の神経細胞を標識する方法を詳細に説明しています。既存の方法に関しては、そのようなニューロンあたり軸索分岐の数、それらの正確な地形、およびそれらの解剖学的部位として、接続の識別側面を可視化します。電極の位置を変化させることにより、このような帯状皮質(電極と脳との間の同じ角度を維持したが、磁極の向きを変更する)または海馬5のような他の神経細胞集団を、標的、および同様に行うことができます希望の戦略に応じて、個々のニューロンまたはより広範な集団を標識実験、。すべてではない集団が等しくアクセスまたは同等に選択的に標識されているようしかし、これには限界があります。例えば、海馬では、選択的に遅く生まれCA1領域のニューロンが、EAを標的とすることが可能ですRLYエレクトロポレーションは、内側と外側の錐体細胞の不均一な集団をマーク。大脳皮質では、ニューロンは、IUE中に妊娠日連続的に生まれ、そのようにしている皮質層が影響を受けているかを決定します。以前IUEを実行すると、より深い神経細胞を標的とする( 例えば、E14でIUEはIV層ニューロンを標識する)22。
成功IUEのために、それを考慮に一定の配慮を取ることをお勧めします。まず、母親のストレスを低減し、仔の生存の可能性を増大させるために、30分未満で手術を行うことが重要です。第二に、手順の中で最も難しい部分は、DNA-実行できるだけ穏やかホウケイ酸毛細血管を経由して注射の注射です。胚があまりにもハード押された場合は、それらが損なわれることができます。 DNA注射の際に胚の死のトラブルシューティングを行うという点では、30°の角度で先端を面取りすると、このプロの有効性を高めることができますセス。 bevellerが利用できないと毛細管が鉗子でのみ切断された場合は、正しい角度を解剖顕微鏡で確認することができます。不適切な毛細血管を捨てます。最後に、胚の段階にエレクトロポレーション条件を適合すること、生存率を増加させるために重要である( 表1参照)。
いくつかの考慮事項は、軸索と樹状突起の再建に関して必要です。個々のニューロンを標識するために、Creをプラスミドの適切な濃度は良い、まばらな発現を得るために、別のニューロンに属する神経突起の交絡重複を避けるために不可欠です。このプロトコルは4 NG /μLの使用を提案するが、それが使用されるプロモーターに依存して、各実験のためのプラスミドの濃度を調整することが必要であり得る、DNA調製物の品質、及びDNA定量の方法は、( 例えば、それを減少させます2 ngの/μLの標識あまりにも多くのニューロンの場合)。 additiで軸索の追跡のために、同一平面内に全体ニューロンを得るために適切な角度で切断することが重要です。
成功したパッチクランプ記録のための重要なステップは、急性スライスの組織の健康と場所とエレクトロポGFP陽性ニューロンの豊富です。パッチ適用の手順が失敗した場合や異常な応答が録音中に検出された場合は、急性スライスを処理するための時間を短縮します。 GFPニューロンが急性スライスでその数の減少に識別して見つけることが困難な場合は、十分なCAG-GFPプラスミドをエレクトロポレーションミックスに含まれていることを確認します。本明細書中に記載のアプローチの主な制限に関しては、パッチクランプ法は、多くの異なるパラメータの記録は、ニューロンの興奮性を説明することができますが、それは回路全体に依存する側面を評価しません。先に言及し、また、全てのニューロンの亜集団は、IUE介してアクセス可能です。要約すると、目でE将来、これらの技術は、脳内の異なるニューロンの亜集団の構造的および機能的接続性のさらなる分析に寄与することができます。
開示事項
著者らは、利害の衝突を宣言しません。
謝辞
私たちは、その優れた技術支援のためと編集のためのLAヴァイスにR.・グティエレスとA.モラレスに感謝しています。 CGBはスペインMINISTERIOデCiencia電子Innovación(MICINN)、FPI-BES-2012から056011によって資金を供給されています。この作品はM.ナバレテにBBVA財団とSAF2014-58598-JIN(MINECO)からの助成金によっておよびラモンAreces財団と助成金SAF2014-52119-Rおよび(MINECOから)BFU2014-55738-REDTへの助成金によって賄われていましたM.ニエト。
資料
| Name | Company | Catalog Number | Comments |
| pCAG-Cre | Addgene | 13775 | |
| pCALNL-GFP | Addgene | 13770 | |
| pCAG-DsRed2 | Addgene | 15777 | |
| pCAG-GFP | Addgene | 11150 | |
| Fast Green | Carl Roth | 301.1 | |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| Carprofen (Rimadyl) | Pfizer GmbH | 1615 ESP | |
| Isoflurane (IsoFlo) | Abbott (Esteve) | 1385 ESP | |
| Ketamine (Imalgene) | Merial | 2528-ESP | |
| Xylazine (Xilagesic) | Calier | 0682-ESP | |
| Povidone Iodine | Meda | 694109.6 | |
| Eye Ointment (Lipolac) | Angelini | 65.277 | |
| Hanks' Balanced Salt Solution (HBSS) | Gibco by Life Technologies | 24020-091 | |
| Penicillin-Streptomycin | Sigma -Aldrich | P4333 | |
| Scalpel Handle # 3 - 12 cm | Fine Science Tools | 10003-12 | |
| Scalpel Blades # 10 | Fine Science Tools | 10010-00 | |
| Adson Forceps-Serrated - Straight 12 cm | Fine Science Tools | 1106-12 | |
| Hardened Fine Scissors - Straight 11 cm | Fine Science Tools | 14090-11 | |
| Scissors Mezenbaum-Nelson Curved L=14.5 cm | Teleflex | PO143281 | |
| Thin curved tips - Style 7 Dumoxel | Dumont | 0303-7-PO | |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11251-20 | |
| Mathieu Needle Holder - Serrated | Fine Science Tools | 12010-14 | |
| AutoClip Applier | Braintree scientific, Inc | ACS APL | |
| 9 mm AutoClips | MikRon Precision, Inc. | 205016 | |
| Sutures - Polysorb 6-0 | Covidien | UL-101 | |
| Electric Razor | Panasonic | ER 240 | |
| Borosilicate glass capillaries (100 mm, 1.0/0.58 Outer/Inner diameter) | World Precision Instrument Inc. | 1B100F-4 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma -Aldrich | A5177-5EA | |
| Gauze (Aposan) | Laboratorios Indas, S.A.U. | C.N. 482232.8 | |
| Cotton Swabs (Star Cott) | Albasa | - | |
| Needle 25 G (BD Microlance 3) | Becton, Dickinson and Company | 300600 | |
| Sucrose | Sigma -Aldrich | S0389 | |
| Paraformaldehyde | Sigma -Aldrich | 158127 | |
| OCT Compound | Sakura | 4583 | |
| Tissue Culture Dish 100 x 20 mm | Falcon | 353003 | |
| GFP Tag Polyclonal Antibody | Thermo Fisher Scientific | A-11122 | |
| Secondary Antibody, Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11008 | |
| DAPI | Sigma-Aldrich | D9542 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10270106 | |
| Triton X-100 | Sigma-Aldrich | X100-500ML | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0002 | |
| Platinum electrodes 650P 7 mm | Nepagene | CUY650P7 | |
| Microscope for Fluorescent Imaging - MZ10F | Leica | - | |
| VIP 3000 Isofluorane Vaporizer | Matrx | - | |
| TCS-SP5 Laser Scanning System | Leica | - | |
| Axiovert 200 Microscope | Zeiss | - | |
| Cryostat - CM 1950 | Leica | - | |
| P-97 Micropette Puller | Sutter Instrument Company | P-97 | |
| Patch clamp analysis softwarw (p-Clamp Clampfit 10.3) | Molecular Devices | - | |
| Acquisition software (MultiClamp 700B Amplifier) | Molecular Devices | DD1440A | |
| Motorized Micromanipulator + Rotating Base | Sutter Instrument | MP-225 | |
| Air Table | Newport | - | |
| Miniature Peristaltic Pumps | WPI | - |
参考文献
- Dehorter, N., et al. Tuning of fast-spiking interneuron properties by an activity-dependent transcriptional switch. Science. 349 (6253), 1216-1220 (2015).
- Rodriguez-Tornos, F. M., et al. Cux1 Enables Interhemispheric Connections of Layer II/III Neurons by Regulating Kv1-Dependent Firing. Neuron. 89 (3), 494-506 (2016).
- Matsui, A., Yoshida, A. C., Kubota, M., Ogawa, M., Shimogori, T. Mouse in utero electroporation: controlled spatiotemporal gene transfection. J Vis Exp. (54), (2011).
- Sonego, M., Zhou, Y., Oudin, M. J., Doherty, P., Lalli, G. In vivo postnatal electroporation and time-lapse imaging of neuroblast migration in mouse acute brain slices. J Vis Exp. (81), (2013).
- Baumgart, J., Baumgart, N. Cortex-, Hippocampus-, Thalamus-, Hypothalamus-,Lateral Septal Nucleus- and Striatum-specific In Utero Electroporation in the C57BL/6 Mouse. J Vis Exp. (107), (2016).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. J Vis Exp. (31), (2009).
- Rice, H., Suth, S., Cavanaugh, W., Bai, J., Young-Pearse, T. L. In utero electroporation followed by primary neuronal culture for studying gene function in subset of cortical neurons. J Vis Exp. (44), (2010).
- Woodworth, M. B., et al. Ctip1 Regulates the Balance between Specification of Distinct Projection Neuron Subtypes in Deep Cortical Layers. Cell Rep. 15 (5), 999-1012 (2016).
- Wickersham, I. R., et al. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53 (5), 639-647 (2007).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104 (3), 1027-1032 (2007).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101 (1), 16-22 (2004).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat Protoc. 1 (3), 1552-1558 (2006).
- Bullmann, T., Arendt, T., Frey, U., Hanashima, C. A transportable, inexpensive electroporator for in utero electroporation. Dev Growth Differ. , (2015).
- Miller, M. Maturation of rat visual cortex. I. A quantitative study of Golgi-impregnated pyramidal neurons. J Neurocytol. 10 (5), 859-878 (1981).
- Miller, M., Peters, A. Maturation of rat visual cortex. II. A combined Golgi-electron microscope study of pyramidal neurons. J Comp Neurol. 203 (4), 555-573 (1981).
- Cubelos, B., et al. Cux-2 controls the proliferation of neuronal intermediate precursors of the cortical subventricular zone. Cereb Cortex. 18 (8), 1758-1770 (2008).
- Kang, J. Y., Kawaguchi, D., Wang, L. Optical Control of a Neuronal Protein Using a Genetically Encoded Unnatural Amino Acid in Neurons. J Vis Exp. (109), (2016).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. J Vis Exp. (49), (2011).
- Maravall, M., Stern, E. A., Svoboda, K. Development of intrinsic properties and excitability of layer 2/3 pyramidal neurons during a critical period for sensory maps in rat barrel cortex. J Neurophysiol. 92 (1), 144-156 (2004).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nat Protoc. 1 (4), 1977-1986 (2006).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev Biol. 240 (1), 237-246 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved