Method Article
자궁 내 일렉트로는 신경 세포의 부분 집단의 흥분 및 단일 세포의 연결을 연구에 접근
요약
이 논문은 단일 세포 수준과 형광 표지 된 뉴런의 흥분성 뉴런의 연결 구조를 설명하는 자궁 전기 (IUE)에서 사용하는 프로토콜을 제공한다. 조직학은 수지상 및 축삭 돌기를 특성화하는 데 사용됩니다. 급성 슬라이스 전체 셀 기록 흥분성을 조사하기 위해 사용된다.
초록
신경계의 연결은 별개 형태의 엄청난 범위로 구성된다. 이러한 신경 세포의 소집단 다른 기능, 자신의 고유 한 수지상 형태학, 축삭 연결의 특정 패턴과 선택적 발사 응답 중 특징으로한다. 개발하는 동안 차별화의 이러한 측면을 담당하는 분자 및 세포 메커니즘은 여전히 저조한 이해된다.
여기, 우리는 라벨에 대한 결합 된 프로토콜을 설명하고 대뇌 피질의 신경 세포의 구조적 연결과 흥분을 특성화. 에서 자궁 전기 (IUE) 프로토콜의 수정은 뉴런의 스파 스 인구의 표시를 할 수 있습니다. 이것은, 차례로, 개별 돌기 신경 축색 돌기 층류 위치의 정확한 특성 및 형태 계측 학적 분석 축삭의 식별 및 추적 할 수있다. IUE 또한 흥분성의 변화를 조사하기 위하여 사용될 수있다야생형 (WT) 또는 전기 천공 두뇌의 급성 조각에서 전체 셀 녹음과 결합하여 유전자 변형 뉴런. 이 두 기술은 구조적 및 기능적 연결성의 결합에 대한 이해 및 개발 중에 신경 다이버 시티를 제어하는 분자 메커니즘에 기여한다. 이러한 발달 과정은 축삭 배선, 신경 세포의 기능 다양성,인지 장애의 생물학에 중요한 의미를 가지고있다.
서문
수지상 및 축삭 구조의 개발은 대뇌 피질에서 비롯한 신경계의 조절 회로의 중요한면이다. 또한 다양한 신경 세포 개체군의 선택 배선 동안 중요한 역할을한다. 최근 보고서 다수 연결 이외에 뉴런의 분자 다양성 소성 높은 특정 모드의 획득에 의해 반사되고, 그 보였다. 그러나, 개발 중에 별개 아형 신경의 흥분성 연결성 결정 메커니즘뿐만 아니라 배위 학위 여전히 잘못 2 1 이해된다.
생체 loss- 및 기능 획득하는 발현 유전자의 특정 레벨과 상기 회로의 개발에 대한 영향 사이의 관계에 대한 연구를 허용 분석한다. 자궁의 전기에서 (IUE)는 광범위하게 연구하는 데 사용하는 기술입니다특정 신경 인구에 대한 관심의 유전자의 기능과는 연결의 전체 패턴을 연구합니다. 그러나, 살아있는 생쥐의 대뇌 피질 층의 축삭과 수상 돌기의 형태 학적 특성을 결정하기 위해서는 띄엄 띄엄 뉴런 레이블을하는 것이 필수적이다. IUE와 결합 Cre 호텔 재조합 시스템은 식별 된 피질 박편의 개별 셀에 의해 방사 돌기를 해결하기 위해 충분히 낮은 밀도 뉴런 저밀도 인구를 표시하는데 사용될 수있다. 이 방법은 전기 천공 뇌 (도 1)의 적절한 수의 정량적 분석 후 데이터를 획득 피질 뉴런 당 충분한 수의 라벨. 이 원고는 연결의 미세 분석을위한 방법을 제시한다. 또한 별도의 실험에서, 분석과 유사한 전략을 제공, 녹색 형광 단백질 (GFP)에 전류 클램프 기록을 수행함으로써 신경 세포의 전기적 특성은 급성 대뇌 피질의 조각에서 세포 -electroporated. 이 프로tocols는 손실 함수의 게인이 IUE 동안 추가 플라스미드 도입 된 뉴런과 같은 다목적 및 WT 형질 전환 동물의 신경 세포의 흥분성 연결성 연구에 적용 할 수 있으며.
이 프로토콜은 배아 일 (E) 15.5에서 마우스의 전기를 설명하지만,이 기술은 E9.5 3 및 출생 후의 일 (P)이 4 사이의 나이에 수행 할 수 있습니다. 초기 단계에서 전기는 신경 세포와 시상의 전구체와 피질의 깊은 층, 이후 단계 전기 마크보다 표면 층 (예를 들어, E15.5 IUE 목표 층 II-III 뉴런)를 대상으로하지만. 요약하면, 단일 셀 형태 학적 분석과 함께 전기 생리학 IUE의 조합 신경계 뉴런의 엄청난 구조적 및 기능적 다양성의 기초가되는 분자 메카니즘을 해명하는 유용한 도구이다.
프로토콜
모든 동물의 절차는 국가 및 유럽 법률을 준수 마드리드 동물 관리 및 사용위원회의 지역 사회에 의해 승인되었다 (PROEX의 14분의 118; PROEX 15분의 331 참조). 절차 동안 멸균 상태를 유지한다.
1.에서 자궁 Electroporation에
참고 : IUE에 대한이 프로토콜은 이전에 5, 6, 7 게시 된 다른 사람들로부터 구성된다. 이 원고는 표준 GFP 기자 플라스미드를 사용하여 하나의 뉴런 (8)과 별도의 실험에서의 전기 생리 특성의 형태의 연구를 허용 기자 전략 수정과 함께 IUE E15.5의 배아에 대한 프로토콜을 설명합니다.
- DNA를 준비
- 제조업체의 지침에 따라 독소가없는 분리 키트를 사용하여 DNA 플라스미드를 준비하고 1 배의 페이지에서 그들을 희석포스페이트 완충 식염수 (PBS).
- 플라스미드가 대조군으로 형광성 단백질 리포터 (예 CAG-DsRed2 9), 1 μg의 / μL를 코딩하는 단일 셀 라벨링 수술 당 DNA 혼합물 10 μL을 (배아 당 1 μL) 다음의 구조와 최종 농도를 사용하여 제조 전기 효율; 실험 플라스미드는 일반적으로 테스트 될 1 μg의 / μL; 에 loxP 스톱에 loxP-형광 단백질 플라스미드 (CALNL-GFP 10), 1 μg의 / μL; 및 구성 인코딩 Cre 호텔 10, 1-4 NG / μL를. 주입 된 DNA를 시각화하는 물 (중량 / 부피)를 0.1 % 빠른 그린의 1 μL를 추가합니다.
참고 : GFP 구조의 Cre 호텔의 재조합 만 시각화 및 개별 축삭 돌기 (그림 1A)의 재건을 할 수있는 몇 가지 신경에 발생합니다. - 표준 패치 클램프 연구의 경우, 수술 당 DNA 혼합물의 10 μL (EMBR 당 1 μL를 준비요) 형광 단백질 (예 : GFP-CAG 11) 리포터 대조군으로서 1 μg의 / μL를 인코딩 다음 플라스미드; 실험 플라스미드, 일반적으로 1 μg의 / μL; 물에 0.1 % 빠른 그린의 1 μL (중량 / 부피).
주의 : 이러한 원하는 라미 내 표지 흥분성 뉴런의 다수를 포함하는 급성 슬라이스 표준 분석 일렉트로 포 레이션 조건은 다음과 같다. 단계 1.1.1.1에 기재된 바와 같이 단일 셀에서의 패치 클램프 조사를 수행하기 위해, DNA를 준비한다.
- 플라스미드가 대조군으로 형광성 단백질 리포터 (예 CAG-DsRed2 9), 1 μg의 / μL를 코딩하는 단일 셀 라벨링 수술 당 DNA 혼합물 10 μL을 (배아 당 1 μL) 다음의 구조와 최종 농도를 사용하여 제조 전기 효율; 실험 플라스미드는 일반적으로 테스트 될 1 μg의 / μL; 에 loxP 스톱에 loxP-형광 단백질 플라스미드 (CALNL-GFP 10), 1 μg의 / μL; 및 구성 인코딩 Cre 호텔 10, 1-4 NG / μL를. 주입 된 DNA를 시각화하는 물 (중량 / 부피)를 0.1 % 빠른 그린의 1 μL를 추가합니다.
- 제조업체의 지침에 따라 독소가없는 분리 키트를 사용하여 DNA 플라스미드를 준비하고 1 배의 페이지에서 그들을 희석포스페이트 완충 식염수 (PBS).
수술 2. 준비
- 무균 절차를 이용하여 생존 수술을 수행한다. 마스크, 장갑, 악기, 외과 필드를 포함 멸균 조건을 확인하십시오. 수술기구 (메스, Adson 집게, 강화 된 미세 가위, 곡선 가위, 뒤몽 집게, 바늘 홀더를) 소독.
- 1 / 0.58-mm 내부 / 외부 직경의 선택 붕규산 유리 모세관. 풀 캡illaries 3. 당기 후 1cm의 최적의 팁 길이 타겟팅합니다. 미세 집게 (그림 1B)를 사용하여 약 30 ° 각도로 바늘 끝을 잘라.
- 500 멸균 등장 성 용액의 ㎖ (1X PBS 또는 Hank's 균형 소금 솔루션 (HBSS))를 준비합니다. (100) 및 37 ° C에이 솔루션을 따뜻하게 : 페니실린 - 스트렙토 마이신 1을 추가합니다. 그것은 수술 후 4 ° C에 저장할 수 있습니다.
- 피하는 진통제의 수술 전 투여 (예를 들어, 카프로 펜, 5 ㎎ / ㎏ 체중)을 주입.
- 가열 패드를 배치하여 수술 따뜻한 동물을 유지합니다. 수술 후 회복을위한 37 ° C에 깨끗한 케이지를 따뜻하게.
3. 수술
- 이소 플루 란과 C57BL / 6 E15.5 임신 마우스를 마취. 우선, 0.8 L / 분 산소에서 3 % 이소 플루 란과 폐쇄 챔버를 주입하고 잠이 될 때까지 내부에 마우스를 둡니다. 가열 패드에 마우스를 전송하고 제공하기위한 마스크 내 코와 입을 배치이소 플루 란의 Y. 점차적으로 마스크를 통해 1.5 %의 이소 플루 란에 수술의 과정을 통해 마취를 줄입니다. 페달 반사 (발가락 핀치)의 손실을 관찰하여 적절한 마취를 확인합니다. 최적의 절차는 약 20 분 이상, 45 분 소요됩니다.
- 절차를 수행하는 동안 건조에서 눈을 방지하기 위해 눈 연고를 적용합니다.
- (전기 면도기 나 제모 크림을 사용하여) 복부의 ~ 3 cm 영역에서 머리를 제거합니다. 요오드 - 주입 면봉 다음 70 % 에탄올 주입 면봉과 수술 부위를 씻어 내십시오. 세 번 반복합니다.
- 감염을 방지하기 위해 멸균 거즈로 수술 영역을 커버.
- 중간 선에 세로 2cm 길이 피부를 통해 개방과 평행하게 만들기 위해 메스를 사용합니다. 무딘 곡선 가위를 사용하여 복부의 피부와 근육을 분리합니다. 포셉과 근육을 잡고 복강을 노출하는 원격 교육 알바를 통해 절단.
- 도움말 오와 배아를 찾습니다포셉 바. 단계 2.3에서 제조 된 멸균 식염수로 두 젖은 면봉을 적셔 오프닝에서 접근 배아를 조작하는 데 사용할. 배아 주위에 면봉을 넣고 부드럽게 복강에서 모두 자궁 뿔의 압축을 풉니 다. 건조되는 것을 방지하기 위해 절차를 통해 따뜻한 식염수로 수화 배아와 열린 복강을 유지합니다.
DNA와 Electroporation에 4. 주입
- telencephalon를 찾으려면 손가락으로 부드럽게 배아를 조작 (명확하게 뇌의 두 개 더 전방 소포로 눈으로 시각화 할 수 있습니다.) 입 피펫의 준비 붕규산 모세관을 놓습니다. 그것은 하나의 뇌실에 도달 할 때까지, 혈관을 회피 자궁 통해 바늘 끝을 통과한다. 큰 파란색 반점이 관찰 될 때까지 천천히 빠른 그린 색의 DNA 용액을 약 1 μL를 주입.
- 일 측방에 7 mm의 백금 전극을 배치배아 (그림 1C)의 전자 머리.
주 : DNA는 음전하; 전압이 백금 전극 사이에인가되는 경우, 따라서, 상기 양극을 향해 이동한다. 전극의 위치를 변화시킴으로써, 뇌의 다른 영역은 대상이 될 수있다. - (E15.5 배아에 대한. : 38 V, 50 밀리 초 간격주기 길이, 950 밀리 초 간격으로 일시 정지 5 펄스, 이러한 조건은 발달 단계에 따라 달라집니다) 백금 전극을 통해 전압을인가 12.
참고 : 다른 배아 단계에 대한 전압 조건과 전극은 표 1을 참조하십시오. - 각각의 배아에 대해 4.3 - 반복 4.1 단계를 반복합니다.
수술 및 수술후 5. 끝
- 어머니에 자궁을 다시 조작하기 위해 면봉을 사용합니다. 가온 된 생리 식염수로 복강 채우기 (약 2 mL를 넣어).
- 간단한 인터럽트 바늘 또는 연속 스티치 근육 봉합사. 사용 # 6-0 봉합사에스.
- 외부 상처를 닫 스테이플을 사용합니다. 스테이플 링하기 전에 근육으로부터 피부를 분리주의하십시오. 코 마스크를 제거합니다.
- 마우스가 동물 시설 룸에 배치하기 전에 가열, 깨끗한 케이지에서 30 분 동안 복구 할 수 있습니다. 이 흉골 드러 누움을 유지하기 위해 충분한 의식을 회복 할 때까지 무인 동물을 두지 마십시오. 완전히 회복 될 때까지 다른 동물의 회사에서 수술을 한 동물을 올려 놓지 마십시오.
- 수술 다음 날 동안 동물을 감독. 피하 진통제를 적용 (카프로 펜, 5 ㎎ / ㎏ 체중) 매 12 시간 2 일간 또는 동물의 법률에 따라. 추가 수술 후주의 새끼 필요하지 않습니다.
샘플 6. 준비 및 분석
- 옵션 : P2에서 형광 현미경을 사용 일렉트릭 강아지의 형광의 발현을 확인; IUE 성공하면, 형광 분명히 내가 볼 수 있습니다헤드 (13)를 n 개의. 마크 또는 긍정적 다음 단계에 사용하기 위해 전기 천공 된 쥐를 구분합니다. 표준 동물 시설 조건의 댐 및 새끼를 유지합니다.
- 연구의 목적하는 단계에서,로 transcardially 마우스를 관류. 일반적으로, 수지상 및 축삭 성장의 가장 활동적인 단계는 처음 세 출생 후 주 2, 14, 15에 해당합니다.
- 마우스 당 1X PBS로 4 % 파라 포름 알데히드 (PFA) 30 ㎖를 준비하고 얼음으로 차게.
주의 : PFA 알려진 알러지 유발 물질 및 발암 물질이다. 그것은 독성. 적절한 개인 보호 장비를 착용하십시오.
주 : PFA의 양은 필요한 마우스 (예를 들면, P16에 대해, 관류 대 20 ㎖ 및 10 ㎖의 postfixation이 필요)의 나이에 따라 달라진다. - 1 : 100 μg의 / ML의 케타민 8 체적 비율 : 1로 동물을 마취하는 케타민 - 자일 라진 믹스를 준비 100 μg의 / mL의 Xylazine : PBS (마우스 당 약 0.2 mL로 준비).
- 복강 단계 6.2.2에서 제조 한 혼합물 0.2 mL를 주사하여 마우스를 마취.
- 그 뒷면에있는 마취 마우스를 놓습니다. 메스를 사용하여 가슴 위에 수평 절개를합니다. 심장이 관찰 될 때까지 미세 가위로 근육과 횡경막을 잘라.
- 미세 가위로 우심방의 절개를합니다. 천천히 혈액을 제거하기 위해 25 게이지 바늘을 좌심실에 20㎖의 PBS를 주입. 마우스가 견고하고 장기 흰색이 될 때까지 20 mL의 PFA (단계 6.2.1)를 주입한다.
- 즉시 머리를 제거하고 두개골에 목 피부에 중간 선 절개를합니다. 부드럽게 곡선 집게를 사용하여 두개골을 벗겨 뇌의 압축을 풉니 다. 구멍을 내거나, 또는 두개골의 제거시 뇌 손상되지 않도록 특별한주의하십시오. 그것을 접미사에 밤새 4 ° C에서 4 % PFA 10 mL에 뇌를 넣습니다.
- 마우스 당 1X PBS로 4 % 파라 포름 알데히드 (PFA) 30 ㎖를 준비하고 얼음으로 차게.
- Cryoprotec그들은 침몰 할 때까지 2 일 - t 1 4 ℃에서 PBS의 30 % 자당의 10 mL에 머리를 고정. 1 cm 3 알루미늄 호일 큐브를 준비합니다. 큐브를 10월와 방법의 2/3를 채 웁니다. 내부에 머리를 넣고 드라이 아이스에 큐브를 넣어를 동결. -80 ° C에서 냉동 뇌를 저장합니다.
- 시험편 디스크 표면에의 OCT 찾는 강하, 조직학 큐브에서 알루미늄 박을 박리하고, 액체의 OCT 위에 시험편 디스크로 원하는 방향에서 큐브 위치. 이 해결 될 때까지 회사의 압력을 적용합니다. 그라 이오 스탯의 표본 머리에 표본 디스크를 삽입합니다. (나이프 / 블레이드 바람직한 상대적인 위치로 이동) 시험편의 방향.
- 제 그라 이오 스탯의 두뇌. 좋은 브러시를 사용하여 100 μm의 두께 부동 저온부 (16)와 PBS에 배치 - 50를 선택합니다.
- 원하는 경우 얼룩.
참고 : 축삭 형태의 연구를 들면, GFP 항체 염색 좋습니다 2입니다.- 0.5 % 트리톤 X-100 (블로킹 용액)을 함유하는 PBS 중 5 % 소 태아 혈청과 실온에서 1 시간 동안 부분 블록. 1 4 ° C에서 밤새 품어 : 500 차 항체 (예, 토끼-GFP 방지) 솔루션을 차단에 희석.
- PBS에 절을 세 번 씻으십시오. 추가 1 : 500 차 항체 (예, 염소 항 - 토끼 알렉사 형석 488) 용액을 차단하고 실온에서 1 시간 동안 배양 희석. PBS에 절을 세 번 씻으십시오.
- PBS는 트리톤 X-100을 10 분 동안 0.5 %를 함유하는 : DAPI (1 만)으로 Counterstain과. PBS로 섹션을 씻어. 매체 (16)를 장착 수성에 섹션을 탑재합니다.
7. 이미징 및 분석
- 형광 또는 공 초점 현미경
- 완전한 재구성 뉴런 고배율 (적어도 40X) 및 (X 1024 1024 최소값) 고해상도 화상을 취득. 선택 "타일 주사 "또는 수집 소프트웨어 동등한 옵션. 모든 돌기 및 축색 과정에 걸친 관심 영역을 커버 정보의 손실을 방지하기 위해 Z 축에 스택 충분한 수를 취득.
주 : 일반적으로, 현미경의 소프트웨어는 "최적 스택"옵션이 있지만,이없는 경우라면 테스트는 수동으로 이미지가 정확하게 개별 돌기를 정의하기 위해 중첩에 필요한 걸음 판정한다. 두 가지 중요한 변수는 핀홀과 대물이고; 고려 "높은 배율, 더 해상도, 더 필요한 Z-단계."
- 완전한 재구성 뉴런 고배율 (적어도 40X) 및 (X 1024 1024 최소값) 고해상도 화상을 취득. 선택 "타일 주사 "또는 수집 소프트웨어 동등한 옵션. 모든 돌기 및 축색 과정에 걸친 관심 영역을 커버 정보의 손실을 방지하기 위해 Z 축에 스택 충분한 수를 취득.
- 분석
참고 : 여러 매개 변수를 분석 할 수 있지만, 단계 7.2.1 두 가지에 초점을 맞추고 : 수상 돌기 형태와 축삭이 분기. 피지 다운로드 ( http://fiji.sc/ ).- 이미지를 열고 메뉴에서 "분단 라인"옵션을 선택합니다. 일을 따라 아래로 이동 (선 그리기신경 세포의 구조 다음) 마우스를 스크롤하여 전자의 z 축. 라인을 저장 "추가, 도구, 투자 수익 (ROI) 관리자를 분석"을 (또는를 눌러 "t")을 이동합니다. 분석 된 신경 세포 2의 모든 축삭 또는 수상 돌기에 대해이 과정을 반복합니다.
- 투자 수익 (ROI) 관리자 메뉴 키를 누릅니다에서 "측정"버튼 길이 (또는 추가 매개 변수)를 얻을 수 있습니다. 이를 분석하는 텍스트 파일 또는 스프레드 시트로 측정 내보내기.
8. 전기 생리학
참고 :이 프로토콜의 목표는 계층에서 GFP - 일렉트로 마우스의 뇌 (또는 이전에 전기 천공 다른 형광 단백질)에 GFP 발현에 의해 시각적으로 확인 II / III 피라미드 세포 뉴런 전체 셀 전류 클램프 녹음을 얻는 것입니다. 그것은 이전에 게시 된 방법 (17), (18)의 적응이다. 이 프로토콜을 이용하여 그 유전자 modif의 효과를 연구 할 수있다신경 세포의 전기적 특성에 IUE에 의해 도입 ication. 특정 발사 모드의 인수는 이온 채널의 다양한 레퍼토리의 동적 표현을 포함하고 늦게 출생 후의 단계 전에 과도 발사 모드의 발현 결과 분화의 점진적 과정이다. 예를 들어, 성숙 전기 응답은 P16 2, 19 전에 체성 감각 마우스 피질의 II / III 층에서 관찰되지 않습니다.
- 급성 조각을위한 전제 조건
- 쥐에서 뇌를 제거하는 무균 수술 도구 준비 : 머리를 제거하기 위해 단두대를; 두개골을 잘라 작은 가위,; 집게는 조직에서 두개골을 분리하는 단계; 주걱은, 섬세 케이스가에서 뇌 조직을 제거하는 단계; 금속 슬라이서는 두 개의 동일한 반으로 피질을 해부하는 단계; 하고 파스퇴르 피펫 (vibratome (인공 뇌척수액을 함유하는 용액에 넣지에서 AC를 슬라이스 이동검사 SF), 다음)은 배양 유지 영역에 ACSF에서 조각을 전송합니다.
- 119 mM의 염화나트륨, 26 mM의 수 NaHCO3를 포함하는 고순도 (더블 증류수)의 물을 사용 ACSF의 1 L를 준비, 11 mM의 포도당, 2.5 밀리미터의 KCl, 1.2 mM의의 MgCl 2, 2.5 mM의 염화칼슘 2, 1 ㎜의 NaH 2 PO 4. 7.3 pH를 적정 - 염산 또는 NaOH로 7.4. 이 290mOsm에 삼투압을 조절합니다.
- carbogen와 버블 ACSF (95 % O 2 / 5 % CO 2) 15 - 7.4-7.3의 pH를 안정화 테프론 튜브 (~ 1mm)를 사용하여 20 분.
- 녹은 해부 솔루션을 생성하는 데 15 분 - 10 -80 ° C에서 carbogen 포화 ACSF 용액 200 mL로 고정. 뇌를 공격 태도를 보여준 얼음에 100- × 20-mm 조직 배양 접시를 놓습니다.
- 다만, 실험을 시작하기 전에 1 % 저 융점 아가로 오스 용액 100 ㎖를 준비한다. 솔루션 쿨 아가로 오스 (크기 : 1 × 1 × 0.5 mm)의 사각형 조각을 잘라하고,에 순간 접착제다시 플랫폼의 뇌가 분리되는 경우 바로 뒤에 (아가 로스 젤 슬라이스 동안 뇌에 대한 지원을 제공합니다). 가능한 한 전면 플랫합니다.
- 급성 조각을 얻기
- 마우스를 고정하고 2 % 이소 플루 란으로 마취. 단두대 구멍에 머리를 놓고 신속하게 그것을 목을 벨. 뼈 레인저 또는 미세 집게를 사용하여 가능한 한 빨리 그 두개골을 제거합니다. 냉장 ACSF에 머리를 넣습니다.
참고 : 그것은 빨리이 단계를 수행하는 것이 중요합니다. - 냉장 배양 접시에 두뇌를 놓습니다. 작은 가위로 소뇌를 잘라.
- 주걱으로 두뇌를 들고 종이 타월에이 건조시킨다.
- vibratome 홀더에 뇌의 ventrocaudal면 접착제. 얼음처럼 차가운 ACSF 가득 vibratome에 홀더를 배치합니다.
- (1-mm 300 μm의 코로나 섹션 (버블을 배치, 예를 들어, 절차 전반에 걸쳐 계속 carbogenation을 보장 절단하여 급성 조각을 얻기다음 vibratome 설정을 사용하여 vibratome 실에 폴리 테트라 플루오로 에틸렌 관)) : 0.06-mm의 크기와 0.08-0.10-mm / s의 속도. 가장 느린 가능한 속도 (~ 패스 당 22의)에 사전 설정합니다. 이러한 최적의 설정을 수정하고 경험적으로 필요에 따라 각 시스템에 대한 최적의 조건을 구하십시오.
- 95 % O 2 / 5 % CO 2 가스로 버블 링하면서 3 밀리미터 미오의 -inositol 보충 ACSF 적어도 60 분, 0.4 mM의 아스코르브 산 및 2 mM의 피루브산 나트륨 대한 급성 슬라이스 부화. 25 ° C의 온도를 유지한다.
- 미만 15 분에 슬라이스 절차를 수행합니다. 사용 기록 챔버로 이송되기 전에 7 시간 - 필요하다면, 슬라이스 일 동안 저장 될 수있다.
- 마우스를 고정하고 2 % 이소 플루 란으로 마취. 단두대 구멍에 머리를 놓고 신속하게 그것을 목을 벨. 뼈 레인저 또는 미세 집게를 사용하여 가능한 한 빨리 그 두개골을 제거합니다. 냉장 ACSF에 머리를 넣습니다.
- 전체 셀 녹음을위한 전제 조건
- 전기 생리학 스테이션이 기록 챔버, 관류 시스템, 현미경, 전극 (녹음, 자극 및 접지), 거시 및 MICR 장착되어 있는지 확인합니다omanipulators, 견고한 내진 탁상과 패러데이하는 자극, 증폭기 및 아날로그 - 디지털 분석 필터 (A / D) 컨버터, 수집 소프트웨어가 장착 된 컴퓨터, 및 GFP (또는 다른 형광 색소) 유전자 뉴런 (18) (그림 2A)를 수정했습니다.
- 115 MM의 칼륨 글루코 네이트, 2 밀리미터의 MgCl 2, 10 mM의 HEPES, 20 mM의 KCl을, 4 mM의 나 2 ATP, 0.3 밀리미터 나 3 GTP는, KOH에 의해 KCl을하여이 290mOsm로 pH를 7.2로 조정을 포함하는, 세포 내 솔루션을 준비합니다.
- 붕규산 유리 모세관을 당겨 패치 피펫을 확인합니다. 마이크로 피펫 풀러를 사용하여 패치 전극을 준비합니다. 사용 붕규산 모세 혈관 (1.5 mm 외경, 0.86-mm 내경, 10 cm 길이). 세포 내 솔루션으로 가득 할 때 패치 전극 3-10 MΩ의 저항을 표시합니다.
- 2 mL / min의 속도로 ACSF 기록 챔버를 관류. approxim으로 챔버의 온도를 유지ately 33 ° C.
- 전체 - 세포의 기록
- 파스퇴르 피펫 (긴 팁을 잘라) 또는 작은 붓을 사용하여 상기 기록 챔버로 분할 전송. 하프와 슬라이스를 누르십시오. 2 mL / 분의 속도로 지속적으로 ACSF 슬라이스를 관류.
- GFP 양성 신경 세포 패치.
- 상기 기록 챔버로 슬라이스를 넣고 저배율 (10X)에서 현미경을 통해 관심 영역을 찾기. 그 후, 60 배 목표를 사용하여 패치 할 GFP 양성 세포를 찾을 수 있습니다.
- 세포 내 용액으로 기록 전극을 입력합니다. 세포 내 기록 용액으로 전극을 채우기 위해 상기 필터 (4 mm 필터)에 연결된 주사기 및 마이크로 - 로더 팁을 사용한다.
- 피펫 홀더에 유리 피펫을 놓습니다. 욕실에서 피펫 팁을 놓고 팁에 초점을 맞 춥니 다. 피펫 목욕되면 배압 제어 시스템을 통해 양압 (positive pressure)을 적용한다.
- (그림 형광 뉴런 패치우레의 2B).
- 피펫에 배압을 유지하면서 시각적 인지도하에 관심있는 셀을 접근. 세포 표면에 작은 딤플의 출현시의 압력을 해제. 이 시점에서 단단히 밀봉 (1 GΩ보다 큰 저항)이 형성 될 수있다. 그렇지 않으면 촉진하는 빛의 부압 (흡인)에 적용된다.
- 시일이 형성되는 동안 -60 MV 유지 전압 클램프를 가져온다. GΩ 시일이 형성되면, 피펫 아래 세포막을 파열 전체 셀 모드로 전환하는 흡입 펄스를 적용한다. 자세한 내용은 20를 참조하십시오.
- 전류 클램프 조건 (21)를 사용하여 활동을 기록합니다. 일단 전체 셀 모드에서, 전류 클램프 모드로 전압 클램프 전환 및 녹화를 시작합니다. 예를 들어, 세포의 흥분을 기록 500 밀리가 긴 현재 주사 탈분극 적용 (100-400 연평균).
- 소성 등급 B를 계산Y는 입력 전류를 증가시키는 기차 따라서 활동 전위의 수를 플롯.
주 : 휴식 막전위 입력 저항 막과 정전 용량은 또한 레코딩 (21)로부터 계산 될 수있다.
- 소성 등급 B를 계산Y는 입력 전류를 증가시키는 기차 따라서 활동 전위의 수를 플롯.
결과
상세 및 개발을 통해 신경 세포의 형태 학적 변화를 특성화하기 위해, 띄엄 띄엄 뉴런 레이블을하는 것이 필수적이다. 이 효소를 통합 만 신경 GFP (그림 1A)를 표현할 수 있도록 Cre 호텔 - 재조합 효소 희석 시스템은 뉴런의 스파 스 인구에 대한 관심의 유전자의 발현을 허용한다. 이 전략을 사용하여 레이어 II-III는 대상과 E15.5에서 IUE에 의해 표시된다. CAG-DsRed2는 / μL 1 μg의에서 공동 일렉트로 대조군으로 살아있는 동물에서 긍정적 인 일렉트로 머리를 식별하는 것입니다. 중요한 것은, 항 GFP 항체로 염색 한 후, 상기 신호는 수지상 모폴로지 및 축색 돌기 (도 1D 및 E)의 명확한 시각화를 허용하기에 충분히 강하다.
IUE 및 전기 생리학 후에 전체 셀 녹음으로부터 얻어지는 파라미터들의 분석은 공동 사용다른 조건에서 소성 반응과 전기 천공 세포의 흥분성을 mpare. 여러 매개 변수를 얻을 수있다. 파라미터는 특정 패치 클램프 분석 소프트웨어를 이용하여 특정 연구에 적용되어야한다. 도 2c는 E15.5에서 전기 천공 된 WT 층 II-III 뉴런의 녹음으로부터 얻어지는 입력 전류에 대한 활동 전위의 플롯의 일례를 제공한다.

전략 희석 그림 1. Cre 호텔 - 재조합 효소는 두피 뉴런의 스파 스 라벨을 사용합니다. 전략의 A. 도식 요약. CALNL-GFP와 CRE 모두를 운반하는 신경 세포에서에 loxP-STOP-에 loxP 카세트 CALNL-GFP에서 절제하고, GFP는 강한 CAG 프로모터에 의해 표현된다. 보로 실리케이트 모세관의 B. 도식 그리기 마이크로 피펫 풀러를 사용하여 뽑아. 선단 FO 의해 절단rceps, 30 ° 각도를 만드는. 모세관의 좁은 부분의 시작에서 끝 1cm를 측정한다. 전극의 C. 위치는 체성 감각 피질을 대상으로합니다. 백금 전극은 약 배아의 귀 위에 배치됩니다. 전압이인가 될 때 그것의 마이너스 전하에, DNA는 양극을 향해 진행한다. 전극 위치의 변동이 다른 뇌 영역을 대상으로 할 수 있습니다. 벡터 후의 D. 이미지는 배아 일 15.5에서 자궁 내 전기에 의해 층 II-III 뉴런에 전달했다; 관상 부분은 CAG-DsRed2 벡터 제어 (왼쪽)으로 공동 형질 전환 된 출생 후 하루 (16)에서 이루어졌다. GFP (중간)은 CALNL-GFP 벡터에에 loxP 부위의 재조합을 허용하는, 단지도 Cre 호텔 혼입 이들 뉴런 표현된다. 스파 스 라벨 개별 뉴런 (화살촉) 구별 할 수 있습니다. t의 E. 높은 배율 공 촛점 이미지그는 다른 띄엄 띄엄 표시 GFP 신경 세포의 아버을 수상. 스케일 바는 100 μm의 =. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
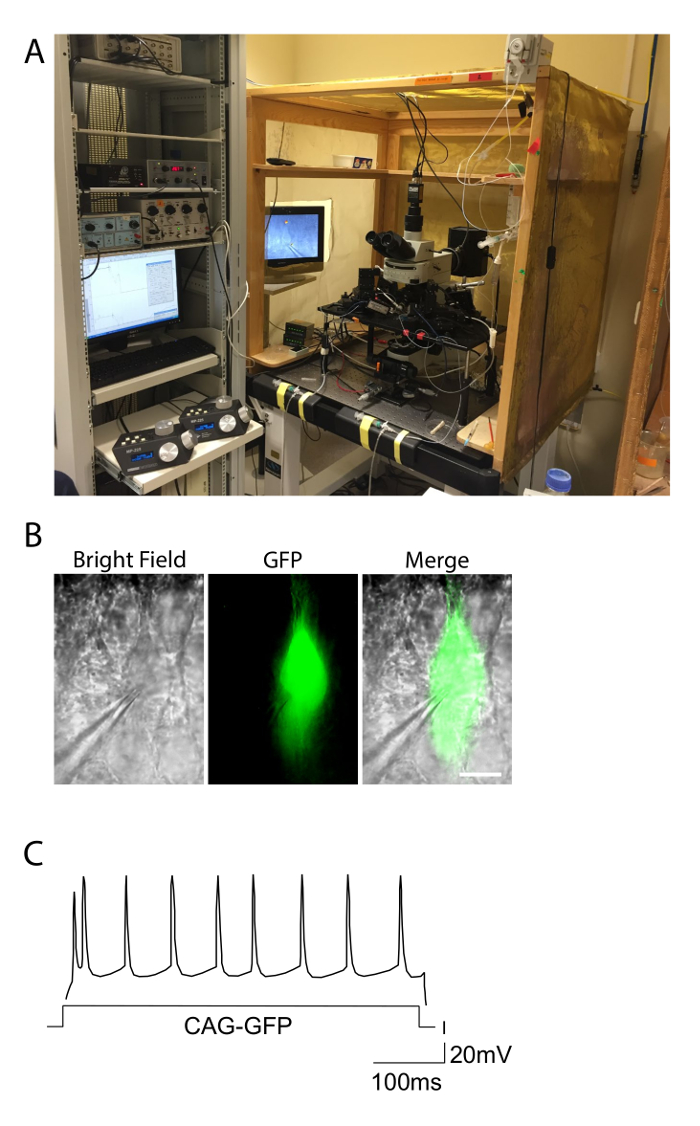
소성 응답 그림 2. 전기 생리학 설정 및 예. A. 사진은 급성 조각에서 패치 클램프 실험에 사용되는 전기 생리학의 설정을 보여줍니다. 설치 프로그램이 잡음을 제거하기 위해 패러데이 케이지에 포함되고, 상기 장치는 방진 테이블 위에있다. 전극의 동력 미세 조작기의 컨트롤러가 왼쪽에 관찰된다. 밝은 필드와 녹색 형광 조건에서 관찰 GFP와 전기 천공 마우스 B. 피라미드 신경 세포. GFP + 세포의 부착, 기록 피펫은 주목할 만하다. 스케일 바 = 10 & #181; m. CAG-GFP의 C. 발사 패턴은 전형적인 정규 급상승 응답을 나타내는 제어 계층 II-III 신경 세포를 전기 천공. 활동 전위의 분포는 입력 전류 (X 축)의 시간에 따른 정규 분포에 가깝다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 단계 | 전압 | 전극 | 참조 |
| E9.5 | 7 V, 100 밀리, 3 펄스 | 백금 전극을 스틱 | 마쓰이 등. 2011 년 3 |
| E12.5 | 30 V, 50 밀리, 3-5 펄스 | 집게 형 전극 3mm | 사이토, T. 2006 년 (12) |
| E15.5 | 35-48 V, 50 밀리, 5 펄스 | 집게 형 전극 5~7mm | 로드 리 게스 - TORNOS 등. 2, 사이토, T. 2006 12 2016 |
| P2 | 100 V, 50 밀리, 5 펄스 | 집게 형 전극 5~7mm | Sonego 등. 2013 년 4 |
표 1 : 태아의 Electroporation에 대한 전압 조건 및 전극.
토론
이 프로토콜은 연결과 흥분을 분석하기 위해 C75BL / 6 마우스의 체성 감각 피질의 뉴런 레이블을하는 방법에 대해 자세히 설명합니다. 기존의 방법과 관련하여, 이러한 신경 세포 축삭 당 분기의 수, 정확한 지형 및 해부학 적 위치로 연결성 판별 측면을 가시화. 전극의 위치를 변경함으로써, 예에 cingulate 피질과 같은 다른 신경 세포 집단을 대상 (전극 뇌와 같은 각도를 유지하지만, 자극의 방향 변화) 또는 해마 5와 유사한 수행 할 수있다 원하는 전략에 따라 개별 뉴런 또는 광범위한 인구, 라벨 실험. 모든 집단이 동등 또는 동등 접근을 선택적으로 표시되어 그러나, 이것에 제한이있다. 예를 들면, 해마에서는, 선택적 CA1 영역의 후반 태생 뉴런을 타겟팅 할 수 있지만 EARLY 전기는 내부 및 외부 피라미드 세포의 이종 인구를 표시합니다. 대뇌 피질에서 신경 세포는 순차적으로 태어난, 그래서 IUE 동안 임신의 날은 영향을받는 대뇌 피질의 층을 결정한다. 이전 IUE 대상에게 깊은 신경을 수행 (22) (예를 들면, E14에서 IUE는 계층 IV 뉴런 레이블).
성공적인 IUE를 들어, 계정 특정 고려 사항을 고려하는 것이 좋습니다. 우선, 마더의 스트레스를 감소시키고 새끼의 생존 가능성을 증가시키기 위해 30 분 이내에서 수술을 수행하는 것이 중요하다. 둘째, 절차의 가장 어려운 부분은 주입 된 바와 같이 부드럽게 가능한 붕규산 모세관을 통해 주입-DNA가 수행한다. 배아가 너무 세게 누를 경우, 그들은 피해 수있다. 이 프로의 효능을 증가시킬 수있다 30 ° 각도로 끝을, DNA 주사시 배아의 죽음의 문제를 해결 베벨의 관점에서운. beveller가없는 상기 모세관 집게 전적으로 절단, 정확한 각도는 해부 현미경으로 확인할 수있다. 부적절한 모세 혈관을 폐기하십시오. 마지막으로, 배아의 전기 천공 단계로 조건에 적응하여 생존율을 증가시키기 위해 중요하다 (표 1 참조).
일부 고려 사항은 축삭과 수상 돌기의 재건과 관련하여 필요합니다. 개별 뉴런 레이블을하려면 Cre 호텔 플라스미드의 적절한 농도는 좋은, 스파 스 표현을 얻기 위해 다른 뉴런에 속하는 신경 돌기의 혼란 중복을 피하기 위해 필수적이다. 이 프로토콜은 4 NG / μL의 사용을 제안하지만, 사용 된 프로모터에 따라 각 실험 플라스미드 농도를 조정하는 것이 필요할 수있다의 DNA 제제의 품질 및 DNA 정량 방법은 (예를 들면,이를 줄이기 2 NG / μL) 라벨에 너무 많은 신경을 경우. additi에서에서 축삭 추적, 동일한 평면에서 전체 신경을하기 위해 적절한 각도에서 절단하는 것이 중요하다.
성공적인 패치 클램프 녹음을위한 중요한 단계는 급성 조각의 조직의 건강과 위치 및 전기 천공 GFP 양성 신경 세포의 풍부하다. 패치 단계는 실패하거나 비정상적인 응답이 녹화 중에있는 경우, 급성 슬라이스 처리 시간을 감소시킨다. GFP 신경 인해 급성 조각에서의 감소 번호를 확인하고 위치하기 어려운 경우, 충분한 CAG-GFP 플라스미드는 전기 믹스에 포함되어 있는지 확인합니다. 본원에 기재된 방법의 주 제한에 관하여, 패치 클램프 기술은 신경 세포의 흥분성을 설명하는 여러 파라미터들의 기록을 허용하지만, 회로 전체에 좌우 측면을 평가할 수 없다. 상기 언급 된 바와 같은, 모든 신경 세포 개체군은 IUE 통해 접근된다. 요약하면, 일에즉 미래는, 이들 기술은 뇌의 다양한 신경 세포 개체군의 구조적 및 기능적 연결성 추가 분석에 기여할 수있다.
공개
저자는 관심의 충돌을 선언합니다.
감사의 말
우리는 그들의 우수한 기술 지원 및 편집을위한 LA 바이스에 R. 구티에레스와 A. 모랄레스에 감사하고 있습니다. CGB는 스페인 Ministerio 드 Ciencia 전자 Innovación (MICINN), FPI-BES-2012-056011에 의해 투자된다. 이 작품은 M. Navarrete은에 BBVA 재단과 SAF2014-58598-JIN (MINECO)에서 연구비와 라몬 Areces 재단과 보조금 SAF2014-52119-R과 (MINECO에서) BFU2014-55738 - REDT에에서 보조금에 의해 투자되었다 M. 니에 토.
자료
| Name | Company | Catalog Number | Comments |
| pCAG-Cre | Addgene | 13775 | |
| pCALNL-GFP | Addgene | 13770 | |
| pCAG-DsRed2 | Addgene | 15777 | |
| pCAG-GFP | Addgene | 11150 | |
| Fast Green | Carl Roth | 301.1 | |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| Carprofen (Rimadyl) | Pfizer GmbH | 1615 ESP | |
| Isoflurane (IsoFlo) | Abbott (Esteve) | 1385 ESP | |
| Ketamine (Imalgene) | Merial | 2528-ESP | |
| Xylazine (Xilagesic) | Calier | 0682-ESP | |
| Povidone Iodine | Meda | 694109.6 | |
| Eye Ointment (Lipolac) | Angelini | 65.277 | |
| Hanks' Balanced Salt Solution (HBSS) | Gibco by Life Technologies | 24020-091 | |
| Penicillin-Streptomycin | Sigma -Aldrich | P4333 | |
| Scalpel Handle # 3 - 12 cm | Fine Science Tools | 10003-12 | |
| Scalpel Blades # 10 | Fine Science Tools | 10010-00 | |
| Adson Forceps-Serrated - Straight 12 cm | Fine Science Tools | 1106-12 | |
| Hardened Fine Scissors - Straight 11 cm | Fine Science Tools | 14090-11 | |
| Scissors Mezenbaum-Nelson Curved L=14.5 cm | Teleflex | PO143281 | |
| Thin curved tips - Style 7 Dumoxel | Dumont | 0303-7-PO | |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11251-20 | |
| Mathieu Needle Holder - Serrated | Fine Science Tools | 12010-14 | |
| AutoClip Applier | Braintree scientific, Inc | ACS APL | |
| 9 mm AutoClips | MikRon Precision, Inc. | 205016 | |
| Sutures - Polysorb 6-0 | Covidien | UL-101 | |
| Electric Razor | Panasonic | ER 240 | |
| Borosilicate glass capillaries (100 mm, 1.0/0.58 Outer/Inner diameter) | World Precision Instrument Inc. | 1B100F-4 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma -Aldrich | A5177-5EA | |
| Gauze (Aposan) | Laboratorios Indas, S.A.U. | C.N. 482232.8 | |
| Cotton Swabs (Star Cott) | Albasa | - | |
| Needle 25 G (BD Microlance 3) | Becton, Dickinson and Company | 300600 | |
| Sucrose | Sigma -Aldrich | S0389 | |
| Paraformaldehyde | Sigma -Aldrich | 158127 | |
| OCT Compound | Sakura | 4583 | |
| Tissue Culture Dish 100 x 20 mm | Falcon | 353003 | |
| GFP Tag Polyclonal Antibody | Thermo Fisher Scientific | A-11122 | |
| Secondary Antibody, Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11008 | |
| DAPI | Sigma-Aldrich | D9542 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10270106 | |
| Triton X-100 | Sigma-Aldrich | X100-500ML | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0002 | |
| Platinum electrodes 650P 7 mm | Nepagene | CUY650P7 | |
| Microscope for Fluorescent Imaging - MZ10F | Leica | - | |
| VIP 3000 Isofluorane Vaporizer | Matrx | - | |
| TCS-SP5 Laser Scanning System | Leica | - | |
| Axiovert 200 Microscope | Zeiss | - | |
| Cryostat - CM 1950 | Leica | - | |
| P-97 Micropette Puller | Sutter Instrument Company | P-97 | |
| Patch clamp analysis softwarw (p-Clamp Clampfit 10.3) | Molecular Devices | - | |
| Acquisition software (MultiClamp 700B Amplifier) | Molecular Devices | DD1440A | |
| Motorized Micromanipulator + Rotating Base | Sutter Instrument | MP-225 | |
| Air Table | Newport | - | |
| Miniature Peristaltic Pumps | WPI | - |
참고문헌
- Dehorter, N., et al. Tuning of fast-spiking interneuron properties by an activity-dependent transcriptional switch. Science. 349 (6253), 1216-1220 (2015).
- Rodriguez-Tornos, F. M., et al. Cux1 Enables Interhemispheric Connections of Layer II/III Neurons by Regulating Kv1-Dependent Firing. Neuron. 89 (3), 494-506 (2016).
- Matsui, A., Yoshida, A. C., Kubota, M., Ogawa, M., Shimogori, T. Mouse in utero electroporation: controlled spatiotemporal gene transfection. J Vis Exp. (54), (2011).
- Sonego, M., Zhou, Y., Oudin, M. J., Doherty, P., Lalli, G. In vivo postnatal electroporation and time-lapse imaging of neuroblast migration in mouse acute brain slices. J Vis Exp. (81), (2013).
- Baumgart, J., Baumgart, N. Cortex-, Hippocampus-, Thalamus-, Hypothalamus-,Lateral Septal Nucleus- and Striatum-specific In Utero Electroporation in the C57BL/6 Mouse. J Vis Exp. (107), (2016).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. J Vis Exp. (31), (2009).
- Rice, H., Suth, S., Cavanaugh, W., Bai, J., Young-Pearse, T. L. In utero electroporation followed by primary neuronal culture for studying gene function in subset of cortical neurons. J Vis Exp. (44), (2010).
- Woodworth, M. B., et al. Ctip1 Regulates the Balance between Specification of Distinct Projection Neuron Subtypes in Deep Cortical Layers. Cell Rep. 15 (5), 999-1012 (2016).
- Wickersham, I. R., et al. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53 (5), 639-647 (2007).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104 (3), 1027-1032 (2007).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101 (1), 16-22 (2004).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat Protoc. 1 (3), 1552-1558 (2006).
- Bullmann, T., Arendt, T., Frey, U., Hanashima, C. A transportable, inexpensive electroporator for in utero electroporation. Dev Growth Differ. , (2015).
- Miller, M. Maturation of rat visual cortex. I. A quantitative study of Golgi-impregnated pyramidal neurons. J Neurocytol. 10 (5), 859-878 (1981).
- Miller, M., Peters, A. Maturation of rat visual cortex. II. A combined Golgi-electron microscope study of pyramidal neurons. J Comp Neurol. 203 (4), 555-573 (1981).
- Cubelos, B., et al. Cux-2 controls the proliferation of neuronal intermediate precursors of the cortical subventricular zone. Cereb Cortex. 18 (8), 1758-1770 (2008).
- Kang, J. Y., Kawaguchi, D., Wang, L. Optical Control of a Neuronal Protein Using a Genetically Encoded Unnatural Amino Acid in Neurons. J Vis Exp. (109), (2016).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. J Vis Exp. (49), (2011).
- Maravall, M., Stern, E. A., Svoboda, K. Development of intrinsic properties and excitability of layer 2/3 pyramidal neurons during a critical period for sensory maps in rat barrel cortex. J Neurophysiol. 92 (1), 144-156 (2004).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nat Protoc. 1 (4), 1977-1986 (2006).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev Biol. 240 (1), 237-246 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유