Method Article
In Utero électroporation approches pour étudier l'excitabilité des neurones sous - populations et connectivité unicellulaire
Dans cet article
Résumé
Ce manuscrit fournit des protocoles qui utilisent électroporation in utero (IUE) pour décrire la connectivité structurelle des neurones au niveau d'une seule cellule et l'excitabilité des neurones marqués par fluorescence. L'histologie est utilisé pour caractériser dendritique et projections axonales. enregistrement cellules entières en tranches aiguës est utilisée pour étudier l'excitabilité.
Résumé
Le système nerveux est composé d'une vaste gamme de types de neurones distincts. Ces sous-populations neuronales se caractérisent, entre autres caractéristiques, leurs morphologies dendritiques distinctes, leurs modèles spécifiques de connectivité axonale, et leurs réponses de tir sélectif. Les mécanismes moléculaires et cellulaires responsables de ces aspects de la différenciation au cours du développement sont encore mal compris.
Ici, nous décrivons les protocoles combinés pour l'étiquetage et la caractérisation de la connectivité structurelle et l'excitabilité des neurones corticaux. Modification du protocole électroporation in utero (IUE) permet l'étiquetage d'une faible densité de population de neurones. Ceci, à son tour, permet l'identification et le suivi des dendrites et des axones des neurones individuels, la caractérisation précise de l'emplacement laminaire des projections axonales et analyse morphométrique. IUE peut également être utilisé pour étudier les changements dans l'excitabilitéDe type sauvage (WT) ou neurones génétiquement modifiés en le combinant avec l'enregistrement de cellules entières à partir de tranches aiguës de cerveaux électroporation. Ces deux techniques contribuent à une meilleure compréhension de l'accouplement de la connectivité structurelle et fonctionnelle, ainsi que des mécanismes moléculaires qui contrôlent la diversité des neurones au cours du développement. Ces processus de développement ont des implications importantes sur le câblage axonal, la diversité fonctionnelle des neurones, et la biologie des troubles cognitifs.
Introduction
Le développement de structures dendritiques et axonales est une facette importante de la régulation du circuit dans le système nerveux, y compris dans le cortex cérébral. Elle joue un rôle crucial au cours du câblage sélectif des diverses sous-populations neuronales. Un certain nombre de rapports récents ont montré que, en plus de la connectivité, la diversité moléculaire des neurones se traduit par l'acquisition de modes très spécifiques de tir. Cependant, les mécanismes de détermination de l'excitabilité et de la connectivité des sous - types neuronaux distincts au cours du développement, ainsi que leur degré de coordination, sont encore mal compris 1, 2.
In vivo et déficitaires gain de fonction analyse permettent l'étude de la relation entre le niveau d'expression de gènes spécifiques et de leur influence sur le développement du circuit. In utero électroporation (IUE) est une technique largement utilisée pour étudierla fonction d'un gène d'intérêt dans les populations neuronales spécifiques et d'étudier les tendances générales de leur connectivité. Toutefois, afin de déterminer les caractéristiques morphologiques des axones et des dendrites dans les couches corticales chez les souris vivantes, il est nécessaire d'étiqueter les neurones à faible densité. Un système de recombinaison Cre combinée avec IUE peut être utilisée pour marquer une faible densité de population de neurones à une densité suffisamment faible pour résoudre les projections émises par des cellules individuelles des lamelles corticales identifiés. Cette méthode étiquettes un nombre suffisant de neurones par cortex pour obtenir des données quantitatives , après l'analyse des nombres raisonnables de cerveaux électroporation (Figure 1). Ce manuscrit présente une méthode pour une telle analyse fine de la connectivité. Il présente également une stratégie similaire pour analyser, dans des expériences séparées, les propriétés électriques des neurones en effectuant des enregistrements en cours-clamp sur protéine de fluorescence verte (GFP) -electroporated cellules à partir de tranches corticales aiguës. Ces protocols sont souples et peuvent être appliqués à l'étude de l'excitabilité des neurones et de la connectivité des animaux transgéniques WT et, ainsi que des neurones dans lesquels les pertes et gains de fonction sont introduits par des plasmides supplémentaires au cours de l'IUE.
Bien que ce protocole décrit l'électroporation de souris au jour embryonnaire (E) 15.5, cette technique peut être effectuée à tout âge entre 3 et E9.5 jour postnatal (P) 2 4. Alors que l' électroporation à des stades précoces ciblant les neurones et les précurseurs du thalamus et des couches profondes du cortex, électroporation marques plus tard, au stade des couches les plus superficielles (par exemple, les neurones E15.5 IUE cibles couche II-III). En résumé, la combinaison de IUE avec l'analyse morphologique seule cellule et électrophysiologie est un outil utile pour élucider les mécanismes moléculaires sous-jacents de la grande diversité structurale et fonctionnelle des neurones dans le système nerveux.
Protocole
Toutes les procédures animales ont été approuvées par la Communauté de Madrid Animal Care et utilisation Comité, conformément à la législation nationale et européenne (PROEX 118/14; 331/15 PROEX). Maintenir des conditions stériles pendant la procédure.
1. In Utero électroporation
NOTE: Ce protocole d'IUE est adapté d'autres qui ont été publiées antérieurement 5, 6, 7. Ce manuscrit décrit un protocole pour l'IUE embryons de E15.5, avec des modifications dans la stratégie de journaliste qui permettent l'étude de la morphologie des neurones isolés 8 et leurs propriétés électrophysiologiques dans une expérience séparée en utilisant des plasmides standards GFP rapporteurs.
- La préparation de l'ADN
- Préparer des plasmides ADN en utilisant un kit d'isolement sans endotoxine selon les instructions du fabricant et les diluer dans 1x pdu sérum physiologique tamponné avec hosphate (PBS).
- Pour l' étiquetage à cellule unique, préparer 10 pi de mélange d'ADN par la chirurgie (1 pi par embryon) en utilisant les constructions et les concentrations finales suivantes: plasmide codant pour un reporter de la protéine fluorescente (par exemple, CAG-DsRed2 9), 1 pg / pl en tant que témoin pour l'efficacité de l'électroporation; plasmide expérimental à tester, typiquement à 1 pg / pl; LoxP-stop-LoxP-protéine fluorescente plasmide (CALNL-GFP 10), 1 pg / pl; et construire codant pour Cre 10, 1-4 ng / ul. Ajouter 1 pi de 0,1% de vert rapide dans l'eau (poids / volume) pour visualiser l'ADN injecté.
REMARQUE: Cre recombinaison de la construction de la GFP ne se produit que dans quelques neurones, ce qui permet la visualisation et la reconstruction des projections axonales individuels (figure 1A). - Pour les études de patch-clamp standard, préparer 10 pi de mélange d'ADN par la chirurgie (1 pi par embryo) du plasmide après codant pour une protéine fluorescente (par exemple, CAG-GFP 11), 1 pg / pl en tant que rapporteur témoin; plasmide expérimental, généralement 1 ng / ul; et 1 ul de 0,1% Fast Green dans l'eau (poids / volume).
NOTE: Ce sont les conditions d'électroporation standards qui analysent les tranches aiguës contenant un grand nombre de neurones excitateurs marqués au sein de la lamina souhaitée. Pour effectuer des études de patch-clamp dans des cellules individuelles, préparer l'ADN tel que décrit à l'étape 1.1.1.1.
- Pour l' étiquetage à cellule unique, préparer 10 pi de mélange d'ADN par la chirurgie (1 pi par embryon) en utilisant les constructions et les concentrations finales suivantes: plasmide codant pour un reporter de la protéine fluorescente (par exemple, CAG-DsRed2 9), 1 pg / pl en tant que témoin pour l'efficacité de l'électroporation; plasmide expérimental à tester, typiquement à 1 pg / pl; LoxP-stop-LoxP-protéine fluorescente plasmide (CALNL-GFP 10), 1 pg / pl; et construire codant pour Cre 10, 1-4 ng / ul. Ajouter 1 pi de 0,1% de vert rapide dans l'eau (poids / volume) pour visualiser l'ADN injecté.
- Préparer des plasmides ADN en utilisant un kit d'isolement sans endotoxine selon les instructions du fabricant et les diluer dans 1x pdu sérum physiologique tamponné avec hosphate (PBS).
2. Préparation pour la chirurgie
- Effectuer une opération de survie en utilisant des procédures aseptiques. Assurer des conditions stériles, y compris des masques, des gants, des instruments et champ chirurgical. Stériliser les instruments chirurgicaux (scalpels, forceps Adson, ciseaux fins trempé, ciseaux courbes, pince Dumont, et porte-aiguille).
- capillaires Choisir de verre borosilicate de 1 / 0,58 mm de diamètre extérieur / intérieur. capuchon amovibleillaries 3. Cible pour une longueur de pointe optimale de 1 cm après avoir tiré. Couper la pointe de l' aiguille à un angle d' environ 30 ° en utilisant une pince fine (figure 1B).
- Préparer 500 ml de solution isotonique stérile (1x PBS ou Hank's solution saline équilibrée (HBSS)). Ajouter la pénicilline-streptomycine 1: 100 et réchauffer cette solution à 37 ° C. Il peut être stocké à 4 ° C après la chirurgie.
- Injecter une dose sous - cutanée préopératoire d'analgésiques (par exemple, le carprofène, 5 mg / kg de poids corporel).
- Gardez les animaux chauds pour la chirurgie en les plaçant sur un coussin chauffant. Chauffer une cage propre à 37 ° C pour la récupération post-opératoire.
3. Surgery
- Anesthetize un C57BL / 6 E15.5 souris enceinte de l'isoflurane. Tout d'abord, insuffler une chambre fermée avec 3% d'isoflurane à 0,8 L / min d'oxygène et de laisser la souris à l'intérieur jusqu'à ce qu'il soit endormi. Transférer la souris sur un coussin chauffant et placez le nez et la bouche dans un masque pour offriry de l'isoflurane. Diminuer graduellement l'anesthésie au cours de l'intervention chirurgicale à 1,5% d'isoflurane par l'intermédiaire d'un masque. Confirmer anesthetization correcte en observant une perte du réflexe de la pédale (tep de pincement). Le mode opératoire optimal prend environ 20 minutes et pas plus de 45 min.
- Appliquer une pommade oculaire pour éviter les yeux de sécher pendant la procédure.
- Retirez les cheveux d'une région ~ 3 cm de l'abdomen (en utilisant un rasoir électrique ou crème dépilatoire). Laver la zone chirurgicale avec des cotons-tiges infusé avec 70% d'éthanol, suivi d'un coton-tige d'iode infusé. Répétez trois fois.
- Couvrir la zone chirurgicale avec une gaze stérile pour prévenir les infections.
- Utiliser le scalpel pour effectuer une ouverture verticale à travers la peau 2 cm de long et parallèlement à la ligne médiane. Séparer la peau et les muscles de l'abdomen avec des ciseaux courbes émoussées. Tenir le muscle avec la pince et le couper à travers la ligne blanche pour exposer la cavité abdominale.
- Repérez les embryons avec l'aide of la pince. Humidifiez deux tampons de coton humide avec la solution saline stérile préparée à l'étape 2.3 et de les utiliser pour manipuler un embryon accessible par l'ouverture. Placez les tampons de coton autour de l'embryon et extraire délicatement les deux cornes utérines de la cavité abdominale. Garder les embryons et la cavité abdominale ouverte hydratées avec une solution saline chaude tout au long de la procédure pour les empêcher de se dessécher.
4. L'injection d'ADN et d'électroporation
- Manipuler les embryons délicatement avec les doigts pour localiser le télencéphale (peut être clairement visualisée par l'œil que les deux vésicules antérieures du cerveau). Placez un capillaire de borosilicate préparé dans une pipette à la bouche. Passez la pointe de l'aiguille dans l'utérus, ce qui évite les vaisseaux sanguins, jusqu'à ce qu'il atteigne un ventricule latéral. Injecter lentement environ 1 pi de solution d'ADN rapide de couleur verte jusqu'à ce qu'une grande tache bleue est observée.
- Placer les électrodes de platine 7 mm latéralement sur thtête de e de l'embryon (figure 1C).
NOTE: l'ADN est chargé négativement; Par conséquent, il se déplace vers l'électrode positive lorsque la tension est appliquée entre les électrodes de platine. En faisant varier l'emplacement des électrodes, les différentes zones du cerveau peuvent être ciblées. - Appliquer la tension via les électrodes de platine (pour E15.5 embryons:. 5 impulsions, 38 V, 50 ms d' intervalle longueur de cycle, pause 950 ms d' intervalle Ces conditions varient en fonction du stade de développement) 12.
NOTE: Voir le tableau 1 pour les conditions de tension et des électrodes pour différents stades de l' embryon. - Répétez les étapes 04/01 à 04/03 pour chaque embryon.
5. Fin de la chirurgie et post-op
- Utilisez des tampons de coton pour manipuler l'utérus de retour dans la mère. Remplir la cavité abdominale avec la solution saline chauffée (ajouter environ 2 ml).
- Suturer le muscle avec des points interrompus simples ou un point en continu. Utiliser # 6-0 sutures.
- Utiliser des agrafes pour fermer la plaie externe. Veillez à séparer la peau du muscle avant l'agrafage. Retirer le masque de nez.
- Laissez la souris pour récupérer pendant 30 min dans la cage propre chauffée avant de le placer dans la salle de l'animalerie. Ne pas laisser un animal sans surveillance jusqu'à ce qu'il ait repris connaissance suffisante pour maintenir décubitus sternale. Ne placez pas un animal qui a subi une intervention chirurgicale dans la compagnie d'autres animaux jusqu'à guérison complète.
- Superviser l'animal pendant les jours suivant la chirurgie. Appliquer des analgésiques sous-cutanée (carprofène, 5 mg / kg de poids corporel) toutes les 12 h pour 2 jours ou selon la législation des animaux. Pas de soins postopératoires supplémentaire est nécessaire pour les chiots.
6. Préparation et analyse des échantillons,
- Facultatif: Sur P2, vérifier l'expression de la fluorescence dans les petits électroporation en utilisant un microscope à fluorescence; lorsque l'IUE est couronnée de succès, la fluorescence peut être clairement vu in la tête 13. La marque ou de séparer les souris qui sont positivement par électroporation pour une utilisation dans les étapes suivantes. Gardez le barrage et les petits dans des conditions de l'animalerie standard.
- Au stade d'études souhaité, perfuser les souris transcardiaque. Typiquement, la phase la plus active de la croissance axonale et dendritique correspond aux trois premières semaines après la naissance 2, 14, 15.
- Préparer 30 ml de paraformaldéhyde 4% (PFA) dans PBS 1x par souris et refroidir sur de la glace.
ATTENTION: PFA est un allergène et cancérigène connu. Il est toxique. Porter un équipement de protection individuelle approprié.
NOTE: La quantité de PFA nécessaire dépend de l'âge de la souris (par exemple, pour P16, 20 ml pour la perfusion et 10 ml pour le postfixation sont nécessaires). - Préparer un mélange de kétamine-xylazine pour anesthésier l'animal avec un rapport de 1: 100 pg / ml de kétamine 8 volumétrique: 1 100 pg / ml xylazine: PBS (préparer environ 0,2 ml par souris).
- Anesthésier la souris par injection intraperitoneale de 0,2 ml du mélange préparé à l'étape 6.2.2.
- Placez la souris anesthésiée sur son dos. Faire une incision horizontale au-dessus du thorax à l'aide d'un scalpel. Coupez le muscle et le diaphragme avec des ciseaux fins jusqu'à ce que le coeur peut être observé.
- Faire une incision dans l'oreillette droite avec les ciseaux fins. Injecter lentement 20 ml de PBS dans le ventricule gauche avec une aiguille de calibre 25 afin d'éliminer le sang. Injecter 20 ml PFA (étape 6.2.1) jusqu'à ce que la souris est rigide et les organes deviennent blancs.
- Retirer immédiatement la tête et faire une incision médiane dans la peau du cou au crâne. Retire délicatement le crâne à l'aide des pinces incurvées et extraire le cerveau. Faites attention à ne pas percer ou endommager le cerveau lors de l'enlèvement du crâne. Mettre le cerveau dans 10 ml de PFA à 4% à 4 ° C pendant une nuit pour postfixer elle.
- Préparer 30 ml de paraformaldéhyde 4% (PFA) dans PBS 1x par souris et refroidir sur de la glace.
- Cryoprotect fixé cerveaux dans 10 ml de saccharose à 30% dans du PBS à 4 ° C pendant 1 - 2 jours, jusqu'à ce qu'ils coulent. Préparer 1 cm 3 aluminium foil cubes. Remplir les cubes 2/3 de la voie avec octobre Mettez les cerveaux à l'intérieur et les congeler en mettant les cubes sur glace sèche. Stocker les cerveaux congelés à -80 ° C.
- Lieu goutte d'octobre sur la surface du disque de spécimen, peler la feuille d'aluminium à partir du cube d'histologie, et positionner le cube à l'orientation désirée sur le disque de l'échantillon sur le dessus de l'OPO liquide. Appliquer une pression ferme jusqu'à ce qu'elle soit fixée. Insérez le disque d'échantillon dans la tête de l'objet du cryostat. Orientez l'échantillon (le déplacer dans une position favorable par rapport au couteau / lame).
- Section les cerveaux du cryostat. Sélectionnez 50 - 100 cryosections flottantes um d'épaisseur 16 à l' aide d' un pinceau fin et placez - les dans du PBS.
- Colorer si désiré.
NOTE: Pour l'étude de la morphologie axonale, la coloration avec un anticorps GFP est fortement recommandé 2.- Bloquer les sections pour 1 h à température ambiante avec 5% de sérum fœtal bovin dans du PBS contenant 0,5% (solution de blocage) Triton-X 100. Incuber une nuit à 4 ° C avec 1: 500 d' anticorps primaire (par exemple, de lapin anti-GFP) dilué dans une solution de blocage.
- Laver les sections à trois reprises dans du PBS. Ajouter 1: 500 d' anticorps secondaire (par exemple, une chèvre anti-lapin Alexa Fluor 488) dilué dans une solution de blocage et incuber pendant 1 h à température ambiante. Laver les sections à trois reprises dans du PBS.
- Counterstain avec du DAPI (1: 10000) dans du PBS contenant 0,5% de Triton X-100 pendant 10 min. Rincer les sections avec du PBS. Monter les sections dans un milieu aqueux 16 montage.
7. Imagerie et analyse
- Fluorescence ou microscopie confocale
- Pour reconstruire les neurones complets, acquérir les images avec un fort grossissement (au moins 40X) et haute résolution (minimum 1,024 x 1,024). Sélectionnez le "scan Tile "ou option équivalente dans le logiciel d'acquisition pour couvrir la zone d'intérêt, couvrant tous les dendrites et les processus axonales. Acquérir un nombre suffisant de piles sur l'axe z pour éviter une perte d'information.
NOTE: En règle générale, le logiciel du microscope a une option "pile optimisée", mais si ce n'est pas le cas, le test manuellement pour déterminer combien d'étapes sont nécessaires pour que les images se chevauchent afin de définir correctement les projections individuelles. Deux paramètres cruciaux sont le sténopé et l'objectif; prendre en compte "plus fort grossissement, plus de résolution, et plus z mesures nécessaires."
- Pour reconstruire les neurones complets, acquérir les images avec un fort grossissement (au moins 40X) et haute résolution (minimum 1,024 x 1,024). Sélectionnez le "scan Tile "ou option équivalente dans le logiciel d'acquisition pour couvrir la zone d'intérêt, couvrant tous les dendrites et les processus axonales. Acquérir un nombre suffisant de piles sur l'axe z pour éviter une perte d'information.
- Une analyse
NOTE: Bien que plusieurs paramètres peuvent être analysés, l'étape 7.2.1 se concentre sur deux: la morphologie des dendrites et axone ramification. Télécharger Fidji ( http://fiji.sc/ ).- Ouvrez l'image, sélectionnez l'option "ligne segmentée" dans le menu. Tracez une ligne (qui monte et descend le long de the axe z en faisant défiler la souris) suivant la structure du neurone. Allez sur "Analyser, Outils, Gestionnaire de ROI, Ajouter" (alternativement, appuyez sur "t") pour sauver la ligne. Répétez ce processus pour chaque axone ou dendrites du neurone analysé 2.
- Dans le gestionnaire de ROI Menu appuyez sur la touche "Mesure" pour obtenir la longueur (ou des paramètres supplémentaires). Exporter les mesures à un fichier texte ou d'un tableur pour les analyser.
8. électrophysiologie
NOTE: L'objectif de ce protocole est d'obtenir des cellules entières enregistrements de courant-clamp de la couche II / III neurones de cellules pyramidales identifiés visuellement par l'expression de la GFP dans les cerveaux de souris GFP-électroporation (ou tout autre protéine fluorescente précédemment électroporation). Il est une adaptation des méthodes précédemment publiées 17, 18. En utilisant ce protocole, il est possible d'étudier l'effet d'une modif génétiqueication introduit par IUE sur les propriétés électriques du neurone. L'acquisition des modes spécifiques de mise à feu est un processus progressif de différenciation qui implique l'expression dynamique d'un large répertoire de canaux ioniques et qui se traduit par l'expression de modes de tir transitoires avant les stades post-natale tardive. Par exemple, les réponses électriques matures ne sont pas observées dans la couche II / III du cortex somatosensoriel de souris avant P16 2, 19.
- Pré-requis pour les tranches aiguës
- Préparer des outils de chirurgie stériles pour éliminer les cerveaux des souris: une guillotine, pour enlever la tête; petits ciseaux, pour couper à travers le crâne; forceps, pour séparer le crâne du tissu; une spatule pour enlever délicatement le tissu cérébral de son enveloppe; un trancheur métallique, pour disséquer le cortex en deux moitiés égales; et une pipette de Pasteur pour déplacer les tranches de la vibratome (les placer dans une solution contenant du liquide céphalorachidien artificiel (ACSF) pour l'inspection, puis transférer les tranches de ACSF à une zone de rétention d'incubation).
- Préparer 1 L de ACSF utilisant de l' eau de haute pureté (eau distillée deux fois) contenant NaCl 119, 26 mM NaHCO 3, du glucose 11 mM, 2,5 mM de KCl, 1,2 mM de MgCl2, 2,5 mM de CaCl2 et 1 mM NaH 2 PO 4. Titrer le pH à 7,3 à 7,4 avec HCl ou NaOH. Ajuster l'osmolarité de 290 mOsm.
- ACSF bulle avec du carbogène (95% O 2/5% de CO2) pendant 15 - 20 min en utilisant des tubes en Teflon (~ 1 mm), afin de stabiliser le pH à 7,3 à 7,4.
- Congeler 200 ml d'une solution saturée ACSF carbogène à -80 ° C pendant 10 - 15 minutes pour produire une solution de dissection fondante. Placer un 100- x 20 mm boîte de culture de tissu sur la glace pour trancher le cerveau.
- Préparer 100 ml de solution à 1% agarose à bas point de fusion juste avant le début de l'expérience. Refroidir la solution, découper un morceau carré de agarose (dimensions: 1 x 1 x 0,5 mm), et superglue à laarrière de la plate-forme, juste derrière où le cerveau est découpé en tranches (gel d'agarose fournit un support pour le cerveau pendant le tranchage). Faire l'avant le plus plat possible.
- L'obtention de tranches aiguës
- Immobiliser la souris et anesthésier avec isoflurane 2%. Placez la tête dans l'ouverture de guillotine et décapiter rapidement. Retirer le crâne aussi vite que possible avec l'utilisation de gardes d'os ou de pinces fines. Mettre le cerveau en ACSF réfrigérés.
NOTE: Il est important d'effectuer cette étape rapidement. - Placez le cerveau dans la boîte de culture frais. Coupez le cervelet avec de petits ciseaux.
- Décrochez le cerveau avec une spatule et séchez sur une serviette en papier.
- Collez le plan ventrocaudal du cerveau sur un porte-vibratome. Placez le support sur un vibratome rempli de glace-froid ACSF.
- Obtenir des tranches aiguës en coupant 300 um coupes coronales (assurer carbogenation continue tout au long de la procédure, par exemple, placer un barboteur (1 mmtube de polytétrafluoroéthylène) dans la chambre de vibratome) en utilisant les paramètres vibratome suivants: 0,06 mm amplitude et de 0,08 à 0,10 mm / s vitesse. Réglez l'avance à la vitesse la plus lente possible (~ 22 s par passage). Modifier ces réglages optimaux et d'obtenir des conditions optimales pour chaque machine empiriquement si nécessaire.
- Incuber les tranches aiguës pendant au moins 60 min en ACSF supplémenté avec 3 mM myo - inositol, mM d' acide ascorbique 0,4, et le pyruvate de sodium à 2 mM tout en faisant barboter avec 95% O 2/5% de CO 2 gazeux. Maintenir la température à 25 ° C.
- Effectuez la procédure de tranchage en moins de 15 min. Si cela est souhaité, les tranches peuvent être stockées pendant 1 - 7 h avant d'être transféré à la chambre d'enregistrement destiné à être utilisé.
- Immobiliser la souris et anesthésier avec isoflurane 2%. Placez la tête dans l'ouverture de guillotine et décapiter rapidement. Retirer le crâne aussi vite que possible avec l'utilisation de gardes d'os ou de pinces fines. Mettre le cerveau en ACSF réfrigérés.
- Pré-requis pour l'enregistrement de cellules entières
- Assurez-vous que la station d'électrophysiologie est équipée d'une chambre d'enregistrement, un système de perfusion, un microscope, des électrodes (enregistrement, stimulant et sol), macro- et micromanipulators, une résistance aux vibrations de table rigide et la cage de Faraday, un stimulateur, un amplificateur et un convertisseur analogique-numérique (A / D), un ordinateur avec un logiciel d'acquisition et une GFP (ou tout autre fluorochrome) filtrer pour analyser 18 (figure 2A) , les neurones génétiquement modifiés.
- Préparer la solution intracellulaire contenant 115 mM de gluconate de potassium, 2 mM de MgCl2, 10 mM de HEPES, 20 mM de KCl, 4 mM de Na 2 ATP et 0,3 mM de Na 3 GTP, ajusté à pH 7,2 par KOH et 290 mOsm par KCI.
- Faire pipettes de patch en tirant des capillaires en verre de borosilicate. Préparer des électrodes plaquées à l'aide d'un extracteur micropipette. capillaires Utilisation de borosilicate (diamètre externe de 1,5 mm, 0,86 mm de diamètre intérieur, 10 cm de longueur). Faire des électrodes plaquées montrant des résistances de 3-10 MQ lorsqu'il est rempli avec une solution intracellulaire.
- Perfuser la chambre d'enregistrement avec ACSF à un débit de 2 mL / min. Maintenir la température de la chambre à envirdiatement 33 ° C.
- enregistrement cellules entières
- Transférer les tranches dans la chambre d'enregistrement à l'aide d'une pipette Pasteur (couper la longue pointe) ou une petite brosse. Maintenez la tranche avec une harpe. Perfuser les tranches en permanence avec l'ACSF à un débit de 2 mL / min.
- Patch un neurone GFP-positive.
- Mettez la tranche dans la chambre d'enregistrement et de trouver la zone d'intérêt à travers le microscope à faible grossissement (10X). Ensuite, trouver une cellule de GFP-positives patcher en utilisant l'objectif 60x.
- Remplir l'électrode d'enregistrement avec la solution intracellulaire. Utilisez la seringue reliée au filtre (filtre à 4 mm) et pointe micro-chargeur pour remplir l'électrode d'enregistrement avec une solution intracellulaire.
- Placer la pipette en verre dans le porte-pipette. Placez la pointe de la pipette dans le bain et se concentrer sur la pointe. Une fois que la pipette est dans le bain, appliquer une pression positive à travers le système de contrôle de pression.
- Patch un neurone qui est fluorescent (Figure 2B).
- L'approche de la cellule d'intérêt sous guidage visuel, tout en maintenant la contre-pression dans la pipette. A l'apparition d'une petite bosse sur la surface cellulaire, relâcher la pression. À ce stade, un joint étanche (résistance supérieure à 1 GQ) peut être formé. Sinon, appliquer une pression négative légère (aspiration) pour le faciliter.
- Tandis que le joint d'étanchéité est formé, amener la pince de tension de maintien de -60 mV. Une fois le joint de GQ est formé, appliquer une impulsion d'aspiration à la rupture de la membrane cellulaire sous la pipette et passer en mode cellule entière. Voir la référence 20 pour plus de détails.
- Notez l'activité en utilisant des conditions de courant-clamp 21. Une fois en mode cellule entière, passer du voltage-clamp en mode courant-clamp et commencer l'enregistrement. Par exemple, pour enregistrer l'excitabilité cellulaire, appliquer 500 ms-temps dépolarisants injections de courant (100-400 pA).
- Calculer les taux de tir by traçant le nombre de potentiels d'action le long du train pour augmenter les courants d'entrée.
REMARQUE: le potentiel de membrane au repos, de la résistance d' entrée, et la capacité de la membrane peuvent également être calculées à partir des enregistrements 21.
- Calculer les taux de tir by traçant le nombre de potentiels d'action le long du train pour augmenter les courants d'entrée.
Résultats
Pour caractériser les changements morphologiques des neurones dans le détail et dans le développement, il est essentiel d'étiqueter les neurones à faible densité. Un système Cre-recombinase dilué permet l'expression d'un gène d'intérêt dans une faible densité de population de neurones, de sorte que seuls les neurones qui incorporent cette enzyme expriment la GFP (figure 1A). En utilisant cette stratégie, la couche II-III est ciblé et étiqueté par IUE à E15.5. ACG-DsRed2 à 1 pg / pl, est co-électroporés en tant que témoin et pour identifier les cerveaux électroporation positifs chez les animaux vivants. Il est important, après coloration avec l' anticorps anti-GFP, le signal est suffisamment fort pour permettre la visualisation claire de leurs morphologies et des axones (figure 1D et E) dendritiques.
Et après IUE électrophysiologie, l'analyse des paramètres obtenus à partir des enregistrements de cellules entières sont utilisées pour coMpare les réponses de mise à feu et de l'excitabilité des cellules électroporées dans des conditions différentes. Plusieurs paramètres peuvent être obtenus. Les paramètres doivent être adaptés à l'étude notamment en utilisant un logiciel d'analyse spécifique patch-clamp. La figure 2C fournit un exemple de la parcelle des potentiels d'action contre le courant d'entrée obtenues à partir d' enregistrements d'une couche de WT II-III neurone qui a été électroporation à E15.5.

Figure 1. A Cre-recombinase Dilué Stratégie Active Labeling Sparse des neurones corticaux. A. Résumé schématique de la stratégie. Dans les neurones portant à la fois CALNL-GFP et la CRE, la cassette LoxP-STOP-loxP est excisé hors de CALNL-GFP et GFP est exprimée par le promoteur CAG fort. B. dessin schématique d'un capillaire de borosilicate tirée à l' aide d' un extracteur de micropipette. La pointe est coupée par forceps, créant un angle de 30 °. Mesure 1 cm de la pointe au début de la partie plus étroite du capillaire. C. Position des électrodes pour cibler le cortex somatosensoriel. Les électrodes de platine sont placés à peu près sur les oreilles de l'embryon. En raison de sa charge négative, l'ADN se dirige vers l'électrode positive lorsque la tension est appliquée. La variation de la position des électrodes permet de cibler différentes régions du cerveau. D. Les images obtenues après des vecteurs ont été livrés à la couche de neurones II-III par électroporation in utero au jour embryonnaire 15,5; coupes coronales ont été faites au jour postnatal 16. Le vecteur CAG-DsRed2 a été co-transfecté comme témoin (à gauche). GFP (milieu) est exprimé uniquement dans les neurones qui sont aussi incorporés Cre, permettant la recombinaison des sites LoxP dans le vecteur CALNL-GFP. L'étiquetage clairsemée permet neurones individuels à distinguer (pointes de flèches). E. fort grossissement image confocale de til dendritiques tonnelles d'un autre neurone GFP peu marqué. Les barres d'échelle = 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
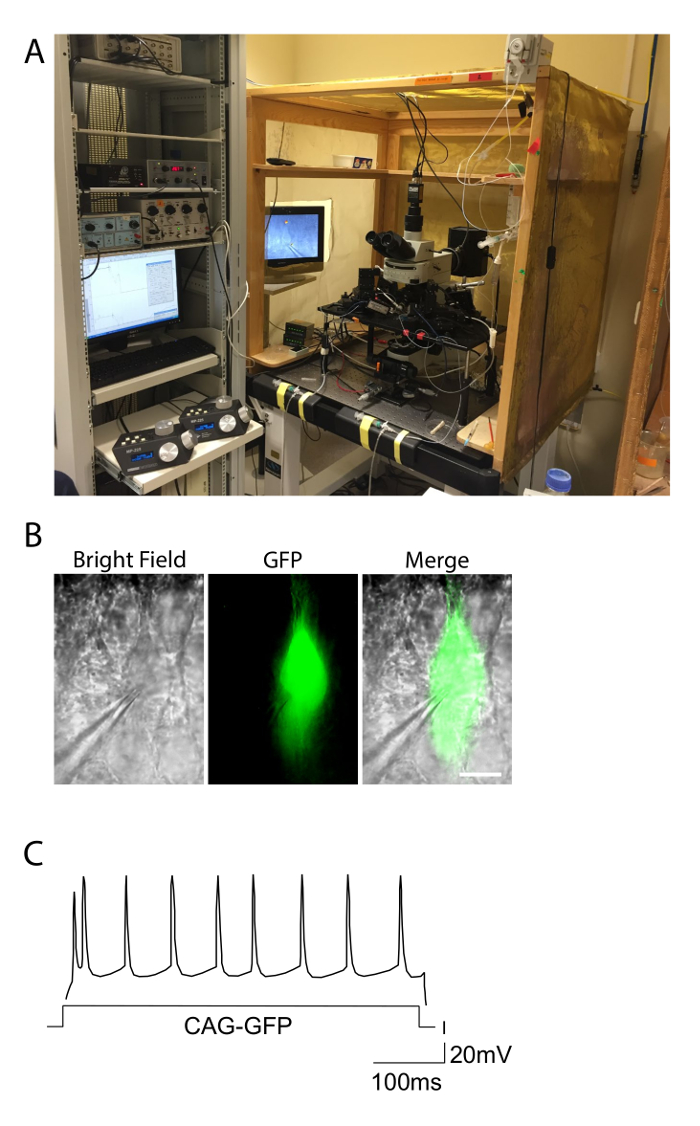
Figure 2. Paramètres électrophysiologie et l' exemple d'une réponse de tir. A. La photographie montre la configuration d'électrophysiologie utilisé pour des expériences de patch-clamp en tranches aiguës. La configuration est inclus dans une cage de Faraday pour éliminer le bruit, et l'équipement est sur le dessus d'une table anti-vibration. Les contrôleurs des micromanipulateurs motorisés pour les électrodes sont observées sur la gauche. B. Pyramidal neurone d'une souris électroporation avec GFP, observé sous champ lumineux et conditions de fluorescence verte. La pipette d'enregistrement fixé à une cellule GFP + est perceptible. Barre d'échelle = 10 & #181; m. C. motifs de mise à feu d'un CAG-GFP électroporation neurone couche de contrôle II-III montrant la réponse régulière de dopage typique. La distribution des potentiels d'action se rapproche d'une distribution régulière le long de la durée du courant d'entrée (axe X). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Étape | Tension | Electrodes | Les références |
| E9.5 | 7 V, 100 ms, 3 impulsions | Collez électrodes de platine | Matsui et al. 2011 3 |
| E12.5 | 30 V, 50 ms, 3 - 5 impulsions | Forceps de type électrodes 3 mm | Saito, T. 2006 12 |
| E15.5 | 35-48 V, 50 ms, 5 impulsions | Forceps de type électrodes 5-7 mm | Rodriguez-Tornos et al. 2016 2, Saito, T., 2006 12 |
| P2 | 100 V, 50 ms, 5 impulsions | Forceps de type électrodes 5-7 mm | Sonego et al. 2013 4 |
Tableau 1: Conditions de tension et des électrodes pour l'électroporation d'embryons.
Discussion
Ce protocole décrit en détail la façon d'étiqueter les neurones du cortex somatosensoriel de C75BL / 6 souris afin d'analyser leur connectivité et leur excitabilité. En ce qui concerne les méthodes existantes, il permet de visualiser les aspects discriminatoires de la connectivité, tels que le nombre de branches axonales par neurone, leur topographie précise, et leur localisation anatomique. En modifiant la position des électrodes, il est possible de cibler d' autres populations de neurones, telles que le cortex cingulaire (conserver le même angle entre les électrodes et le cerveau, mais de modifier l'orientation des pôles) ou de l'hippocampe 5 et exécuter similaire expériences en matière d'étiquetage des neurones individuels ou des populations plus larges, en fonction de la stratégie souhaitée. Cependant, il y a des limites à cela, comme toutes les populations ne sont pas également accessibles ou également marqué sélectivement. Par exemple, dans l'hippocampe, il est possible de cibler sélectivement les neurones tardifs d'origine de la région CA1, mais early électroporation marque des populations hétérogènes de cellules pyramidales intérieures et extérieures. Dans le cortex cérébral, les neurones sont nés d'une manière séquentielle, de sorte que le jour de gestation au cours de l'IUE détermine qui corticale couche est affectée. Exécution des cibles IUE antérieures neurones profonds (par exemple, IUE à E14 étiquettes neurones couche IV) 22.
Pour une IUE réussie, il est recommandé de tenir compte de certaines considérations. Tout d'abord, il est important de faire de la chirurgie en moins de 30 minutes afin de réduire le stress sur la mère et d'augmenter les chances de survie des petits. Deuxièmement, la partie la plus difficile de la procédure est l'injection de l'ADN-effectuer l'injection via les capillaires de borosilicate aussi doucement que possible. Si les embryons sont pressés trop dur, ils peuvent être lésés. En termes de dépannage de la mort des embryons au cours des injections d'ADN, biseauter la pointe avec un angle de 30 ° peut augmenter l'efficacité de ce process. Si un biseauteur ne sont pas disponibles et les capillaires sont découpées uniquement avec une pince, l'angle correct peut être confirmée au microscope à dissection. Jeter capillaires inadéquats. Enfin, en adaptant les conditions d'électroporation au stade de l'embryon est important afin d'augmenter le taux de survie (voir tableau 1).
Certaines considérations sont nécessaires en ce qui concerne la reconstruction des axones et des dendrites. Pour étiqueter les neurones individuels, la bonne concentration du plasmide Cre sont essentiels pour obtenir une bonne, clairsemée expression et d'éviter le chevauchement confusion des projections neuronales appartenant à différents neurones. Bien que ce protocole , on propose l'utilisation de 4 ng / ul, il peut être nécessaire d'ajuster la concentration de plasmide pour chaque essai, selon le promoteur utilisé, la qualité de la préparation de l' ADN et le procédé de quantification de l' ADN (par exemple, de réduire à 2 ng / ul si l'étiquetage trop de neurones). En additisur, pour le suivi des axones, il est important de réduire à un angle approprié afin d'avoir l'ensemble des neurones dans le même plan.
Les étapes critiques pour les enregistrements de patch-clamp réussies sont la santé du tissu des tranches aiguës et l'emplacement et l'abondance des neurones GFP-positives électroporation. Si les étapes d'application de correctifs échouent ou des réponses aberrantes sont trouvés pendant les enregistrements, réduire le temps de traitement des tranches aiguës. Si les neurones GFP sont difficiles à identifier et à localiser en raison de leur nombre réduit dans la tranche aiguë, veiller à ce que suffisamment de plasmide CAG-GFP est inclus dans le mélange d'électroporation. En ce qui concerne les principales limitations des approches décrites ici, la technique de patch-clamp permet l'enregistrement de plusieurs paramètres différents qui décrivent l'excitabilité du neurone, mais il ne semble pas évaluer les aspects qui dépendent de l'ensemble du circuit. En outre, et comme mentionné ci-dessus, toutes les sous-populations neuronales ne sont pas accessibles par le biais IUE. En résumé, ee avenir, ces techniques peuvent contribuer à la poursuite de l'analyse de la connectivité structurelle et fonctionnelle des différentes sous-populations de neurones dans le cerveau.
Déclarations de divulgation
Les auteurs déclarent aucun conflit d'intérêt.
Remerciements
Nous sommes reconnaissants à R. Gutiérrez et A. Morales pour leur excellente assistance technique et à Los Angeles Weiss pour l'édition. CGB est financé par le e Espagnol Ministerio de Ciencia Innovación (MICINN), FPI-BES-2012-056011. Ce travail a été financé par une subvention de la Fondation BBVA et SAF2014-58598-JIN (MINECO) à M. Navarrete et par une subvention de la Fondation Ramón Areces et subventions SAF2014-52119-R et BFU2014-55738-REDT (de MINECO) à M. Nieto.
matériels
| Name | Company | Catalog Number | Comments |
| pCAG-Cre | Addgene | 13775 | |
| pCALNL-GFP | Addgene | 13770 | |
| pCAG-DsRed2 | Addgene | 15777 | |
| pCAG-GFP | Addgene | 11150 | |
| Fast Green | Carl Roth | 301.1 | |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| Carprofen (Rimadyl) | Pfizer GmbH | 1615 ESP | |
| Isoflurane (IsoFlo) | Abbott (Esteve) | 1385 ESP | |
| Ketamine (Imalgene) | Merial | 2528-ESP | |
| Xylazine (Xilagesic) | Calier | 0682-ESP | |
| Povidone Iodine | Meda | 694109.6 | |
| Eye Ointment (Lipolac) | Angelini | 65.277 | |
| Hanks' Balanced Salt Solution (HBSS) | Gibco by Life Technologies | 24020-091 | |
| Penicillin-Streptomycin | Sigma -Aldrich | P4333 | |
| Scalpel Handle # 3 - 12 cm | Fine Science Tools | 10003-12 | |
| Scalpel Blades # 10 | Fine Science Tools | 10010-00 | |
| Adson Forceps-Serrated - Straight 12 cm | Fine Science Tools | 1106-12 | |
| Hardened Fine Scissors - Straight 11 cm | Fine Science Tools | 14090-11 | |
| Scissors Mezenbaum-Nelson Curved L=14.5 cm | Teleflex | PO143281 | |
| Thin curved tips - Style 7 Dumoxel | Dumont | 0303-7-PO | |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11251-20 | |
| Mathieu Needle Holder - Serrated | Fine Science Tools | 12010-14 | |
| AutoClip Applier | Braintree scientific, Inc | ACS APL | |
| 9 mm AutoClips | MikRon Precision, Inc. | 205016 | |
| Sutures - Polysorb 6-0 | Covidien | UL-101 | |
| Electric Razor | Panasonic | ER 240 | |
| Borosilicate glass capillaries (100 mm, 1.0/0.58 Outer/Inner diameter) | World Precision Instrument Inc. | 1B100F-4 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma -Aldrich | A5177-5EA | |
| Gauze (Aposan) | Laboratorios Indas, S.A.U. | C.N. 482232.8 | |
| Cotton Swabs (Star Cott) | Albasa | - | |
| Needle 25 G (BD Microlance 3) | Becton, Dickinson and Company | 300600 | |
| Sucrose | Sigma -Aldrich | S0389 | |
| Paraformaldehyde | Sigma -Aldrich | 158127 | |
| OCT Compound | Sakura | 4583 | |
| Tissue Culture Dish 100 x 20 mm | Falcon | 353003 | |
| GFP Tag Polyclonal Antibody | Thermo Fisher Scientific | A-11122 | |
| Secondary Antibody, Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11008 | |
| DAPI | Sigma-Aldrich | D9542 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10270106 | |
| Triton X-100 | Sigma-Aldrich | X100-500ML | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0002 | |
| Platinum electrodes 650P 7 mm | Nepagene | CUY650P7 | |
| Microscope for Fluorescent Imaging - MZ10F | Leica | - | |
| VIP 3000 Isofluorane Vaporizer | Matrx | - | |
| TCS-SP5 Laser Scanning System | Leica | - | |
| Axiovert 200 Microscope | Zeiss | - | |
| Cryostat - CM 1950 | Leica | - | |
| P-97 Micropette Puller | Sutter Instrument Company | P-97 | |
| Patch clamp analysis softwarw (p-Clamp Clampfit 10.3) | Molecular Devices | - | |
| Acquisition software (MultiClamp 700B Amplifier) | Molecular Devices | DD1440A | |
| Motorized Micromanipulator + Rotating Base | Sutter Instrument | MP-225 | |
| Air Table | Newport | - | |
| Miniature Peristaltic Pumps | WPI | - |
Références
- Dehorter, N., et al. Tuning of fast-spiking interneuron properties by an activity-dependent transcriptional switch. Science. 349 (6253), 1216-1220 (2015).
- Rodriguez-Tornos, F. M., et al. Cux1 Enables Interhemispheric Connections of Layer II/III Neurons by Regulating Kv1-Dependent Firing. Neuron. 89 (3), 494-506 (2016).
- Matsui, A., Yoshida, A. C., Kubota, M., Ogawa, M., Shimogori, T. Mouse in utero electroporation: controlled spatiotemporal gene transfection. J Vis Exp. (54), (2011).
- Sonego, M., Zhou, Y., Oudin, M. J., Doherty, P., Lalli, G. In vivo postnatal electroporation and time-lapse imaging of neuroblast migration in mouse acute brain slices. J Vis Exp. (81), (2013).
- Baumgart, J., Baumgart, N. Cortex-, Hippocampus-, Thalamus-, Hypothalamus-,Lateral Septal Nucleus- and Striatum-specific In Utero Electroporation in the C57BL/6 Mouse. J Vis Exp. (107), (2016).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. J Vis Exp. (31), (2009).
- Rice, H., Suth, S., Cavanaugh, W., Bai, J., Young-Pearse, T. L. In utero electroporation followed by primary neuronal culture for studying gene function in subset of cortical neurons. J Vis Exp. (44), (2010).
- Woodworth, M. B., et al. Ctip1 Regulates the Balance between Specification of Distinct Projection Neuron Subtypes in Deep Cortical Layers. Cell Rep. 15 (5), 999-1012 (2016).
- Wickersham, I. R., et al. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53 (5), 639-647 (2007).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104 (3), 1027-1032 (2007).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101 (1), 16-22 (2004).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat Protoc. 1 (3), 1552-1558 (2006).
- Bullmann, T., Arendt, T., Frey, U., Hanashima, C. A transportable, inexpensive electroporator for in utero electroporation. Dev Growth Differ. , (2015).
- Miller, M. Maturation of rat visual cortex. I. A quantitative study of Golgi-impregnated pyramidal neurons. J Neurocytol. 10 (5), 859-878 (1981).
- Miller, M., Peters, A. Maturation of rat visual cortex. II. A combined Golgi-electron microscope study of pyramidal neurons. J Comp Neurol. 203 (4), 555-573 (1981).
- Cubelos, B., et al. Cux-2 controls the proliferation of neuronal intermediate precursors of the cortical subventricular zone. Cereb Cortex. 18 (8), 1758-1770 (2008).
- Kang, J. Y., Kawaguchi, D., Wang, L. Optical Control of a Neuronal Protein Using a Genetically Encoded Unnatural Amino Acid in Neurons. J Vis Exp. (109), (2016).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. J Vis Exp. (49), (2011).
- Maravall, M., Stern, E. A., Svoboda, K. Development of intrinsic properties and excitability of layer 2/3 pyramidal neurons during a critical period for sensory maps in rat barrel cortex. J Neurophysiol. 92 (1), 144-156 (2004).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nat Protoc. 1 (4), 1977-1986 (2006).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev Biol. 240 (1), 237-246 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon