Method Article
In Utero Ansätze Elektroporation die Erregbarkeit neuronaler Subpopulationen und Einzelzell - Konnektivität zu studieren
In diesem Artikel
Zusammenfassung
Dieses Manuskript enthält Protokolle , die in utero Elektroporation (IUE) verwenden , um die strukturelle Konnektivität von Neuronen in der Ebene einzelner Zellen und die Erregbarkeit von fluoreszenzmarkierten Neuronen zu beschreiben. Histologie verwendet dendritische und axonale Projektionen zu charakterisieren. Whole-cell recording in akuten Scheiben verwendet Erregbarkeit zu untersuchen.
Zusammenfassung
Das Nervensystem besteht aus einer enormen Bandbreite von verschiedenen neuronalen Typen zusammen. Diese neuronalen Subpopulationen sind gekennzeichnet durch, unter anderen Merkmalen, ihre unterschiedlichen dendritischen Morphologien, ihre spezifische Muster von axonalen Konnektivität und deren selektive Brennen Antworten. Die molekularen und zellulären Mechanismen, die für diese Aspekte der Differenzierung während der Entwicklung sind immer noch schlecht verstanden.
Hier beschreiben wir kombinierte Protokolle für die Kennzeichnung und die Charakterisierung der strukturellen Verbindungen und Erregbarkeit der Neurone. Die Modifikation der in utero Elektroporation (IUE) Protokoll ermöglicht die Kennzeichnung einer spärlichen Population von Neuronen. Dies wiederum ermöglicht die Identifizierung und Verfolgung der Dendriten und Axone der einzelnen Neuronen, die genaue Charakterisierung der laminaren Lage von axonalen Projektionen und morphometrische Analyse. IUE kann auch in der Erregbarkeit zu untersuchen Veränderungen verwendet werden vonWildtyp (WT) oder gentechnisch veränderten Neuronen indem sie sie mit Ganzzell-Aufnahme von einer akuten Scheiben durch Elektroporation Gehirne zu kombinieren. Diese beiden Techniken tragen zu einem besseren Verständnis der Kopplung von strukturellen und funktionalen Verbindungen und der molekularen Mechanismen der neuronalen Steuerung Vielfalt während der Entwicklung. Diese Entwicklungsprozesse haben wichtige Auswirkungen auf axonalen Verkabelung, die funktionelle Diversität von Neuronen und die Biologie von kognitiven Störungen.
Einleitung
Die Entwicklung von dendritischen und axonalen Strukturen ist ein wichtiger Aspekt der Schaltungsregelung im Nervensystem, in der Großhirnrinde einschließlich. Es spielt eine entscheidende Rolle bei der selektiven Verdrahtung der verschiedenen neuronalen Subpopulationen. Eine Anzahl von jüngsten Berichte haben gezeigt, dass, zusätzlich zu Verbindungen, die molekulare Vielfalt von Neuronen wird durch die Übernahme von hochspezifischen Modi des Brennens reflektiert. Die Mechanismen , die Erregbarkeit und Konnektivität der verschiedenen neuronalen Subtypen während der Entwicklung, sowie ihre Koordinationsgrad zu bestimmen, sind jedoch immer noch schlecht verstanden , 1, 2.
In vivo Verlust- und gain-of-function Analysen zur Untersuchung der Beziehung zwischen der Expression von spezifischen Genen und deren Einfluss auf die Entwicklung der Schaltung ermöglichen. In utero Elektroporation (IUE) ist eine Technik weit verbreitet zu studierendie Funktion eines Gens von Interesse in spezifischen neuronalen Populationen und die Gesamtmuster ihrer Verbindungen zu studieren. Um jedoch die morphologischen Eigenschaften von Axonen und Dendriten in kortikalen Schichten in lebenden Mäusen zu bestimmen, ist es wichtig, Neuronen dünn zu beschriften. Eine Cre-Rekombinationssystem mit IUE kombiniert verwendet werden, um ein Sparse-Population von Neuronen bei einer ausreichend niedrigen Dichte zu markieren die Vorsprünge durch einzelne Zellen der identifizierten kortikalen laminas emittiert zu lösen. Diese Methode Etiketten eine ausreichende Anzahl von Neuronen pro Kortex quantitative Daten nach der Analyse der angemessenen Anzahl von elektroporiert Gehirne (Abbildung 1) zu erhalten. Dieses Manuskript stellt eine Methode für eine solche Feinanalyse der Konnektivität. Es stellt auch eine ähnliche Strategie zu analysieren, in getrennten Experimenten, die elektrischen Eigenschaften von Neuronen, die durch Strom-Clamp-Aufnahmen auf grün fluoreszierendes Protein Durchführung (GFP) -electroporated Zellen aus akuten kortikalen Scheiben schneiden. Diese proTocole sind vielseitig und können zur Untersuchung der Erregbarkeit und Konnektivität von Neuronen durch zusätzliche Plasmide während IUE WT und transgenen Tieren und auch von Neuronen in denen Verluste und Gewinne von Funktions eingeführt angewendet werden.
Obwohl dieses Protokoll kann die Elektroporation von Mäusen an embryonalen Tag (E) 15.5, diese Technik durchgeführt zwischen E9.5 3 und postnatalen Tag (P) 2 4 in jedem Alter werden beschrieben. Während der Elektroporation in frühen Stadien zielt Neuronen und Vorstufen des Thalamus und tiefen Schichten der Hirnrinde, späteren Stufe der Elektroporation Markierungen oberflächlicher Schichten (zB E15.5 IUE Ziele Schicht II-III Neuronen). Zusammenfassend ist die Kombination von IUE mit Einzelzell morphologische Analyse und die Elektro ein nützliches Werkzeug, um die molekularen Mechanismen, die die enorme strukturelle und funktionelle Vielfalt von Neuronen im Nervensystem zu erläutern.
Protokoll
(; PROEX 331/15 PROEX 118/14) Alle Tier Verfahren wurden von der Gemeinschaft von Madrid Animal Care und Use Committee, in Übereinstimmung mit den nationalen und europäischen Gesetzgebung zugelassen. Aufrechterhaltung steriler Bedingungen während des Verfahrens.
1. In Utero Elektroporation
Hinweis: Dieses Protokoll für IUE wird von den anderen angepaßt , die zuvor veröffentlicht wurden 5, 6, 7. Diese Handschrift beschreibt ein Protokoll für die IUE von E15.5 Embryonen, mit Modifikationen in der Reporter - Strategie , die für die Untersuchung der Morphologie der einzelnen Neuronen 8 und ihre elektrophysiologischen Eigenschaften in einem separaten Experiment unter Verwendung von Standard - GFP - Reporter - Plasmide ermöglichen.
- Vorbereitung der DNA
- Bereiten DNA-Plasmide eine Endotoxin-freie Isolierung Kit gemäß den Anweisungen des Herstellers und verdünnen sie in 1x p mithosphate-gepufferter Kochsalzlösung (PBS).
- Für die Kennzeichnung Einzelzelle, Herstellung von 10 & mgr; l DNA - Gemisch pro Operation (1 & mgr; l pro Embryo) unter Verwendung der folgenden Konstrukte und Endkonzentrationen: Plasmid , das ein fluoreszierendes Protein Reporter (zB CAG-DsRed2 9), 1 ug / ul als Kontrolle für die Elektroporation Effizienz; Versuchs Plasmid getestet werden, typischerweise bei 1 & mgr; g / & mgr; l; LoxP-stop-LoxP-fluoreszierendes Protein - Plasmid (CALNL-GFP 10), 1 & mgr; g / & mgr; l; und konstruieren kodierenden 10 Cre, 1 - 4 ng / ul. 1 ul 0,1% Fast Green in Wasser (Gewicht / Volumen), um die injizierten DNA sichtbar zu machen.
HINWEIS: Cre Rekombination des GFP - Konstrukt tritt nur in wenigen Neuronen, die die Sichtbarmachung und die Rekonstruktion der einzelnen axonale Projektionen (1A) ermöglicht. - Für Standard-Patch-Clamp-Studien, Herstellung von 10 & mgr; l DNA-Gemisch pro Operation (1 & mgr; l pro embryo) der folgenden Plasmid , das ein fluoreszierendes Protein kodiert (zB CAG-GFP 11), 1 & mgr; g / & mgr; l als Reporter - Steuerung; Versuchs Plasmid, im Allgemeinen 1 & mgr; g / & mgr; l; und 1 & mgr; l von 0,1% Fast Green in Wasser (Gewicht / Volumen).
ANMERKUNG: Dies sind die Standard Elektroporationsbedingungen die akute slices analysieren, um eine große Anzahl von markierten exzitatorischen Neuronen innerhalb des gewünschten lamina enthält. Zum Patch-Clamp-Studien in einzelnen Zellen durchführen, bereiten Sie die DNA wie in Schritt 1.1.1.1 beschrieben.
- Für die Kennzeichnung Einzelzelle, Herstellung von 10 & mgr; l DNA - Gemisch pro Operation (1 & mgr; l pro Embryo) unter Verwendung der folgenden Konstrukte und Endkonzentrationen: Plasmid , das ein fluoreszierendes Protein Reporter (zB CAG-DsRed2 9), 1 ug / ul als Kontrolle für die Elektroporation Effizienz; Versuchs Plasmid getestet werden, typischerweise bei 1 & mgr; g / & mgr; l; LoxP-stop-LoxP-fluoreszierendes Protein - Plasmid (CALNL-GFP 10), 1 & mgr; g / & mgr; l; und konstruieren kodierenden 10 Cre, 1 - 4 ng / ul. 1 ul 0,1% Fast Green in Wasser (Gewicht / Volumen), um die injizierten DNA sichtbar zu machen.
- Bereiten DNA-Plasmide eine Endotoxin-freie Isolierung Kit gemäß den Anweisungen des Herstellers und verdünnen sie in 1x p mithosphate-gepufferter Kochsalzlösung (PBS).
2. Vorbereitung für Chirurgie
- Führen Sie eine Operation Überleben von aseptischen Verfahren. Stellen Sie sicher, sterilen Bedingungen, einschließlich Masken, Handschuhe, Instrumente und OP-Feld. Sterilisieren chirurgische Instrumente (Skalpell, Adson Pinzette, gehärtet einer feinen Schere, gebogene Schere, Zange Dumont und Nadelhalter).
- Wählen Sie aus Borosilicatglas Kapillaren von 1 / 0,58-mm Außen- / Innendurchmesser. Abziehkappeillaries 3. Ziel für eine optimale Spitzenlänge von 1 cm nach dem Ziehen. Schneiden Sie die Nadelspitze bei etwa einem Winkel von 30 ° mit einer feinen Pinzette (Abbildung 1B).
- Bereiten 500 ml steriler isotonischer Lösung (1x PBS oder Hank's Balanced Salt Solution (HBSS)). Hinzufügen Penicillin-Streptomycin 1: 100 und erwärmen diese Lösung auf 37 ° C. Es kann bei 4 ° C nach der Operation gelagert werden.
- Subkutan injizieren eine präoperative Dosis von Analgetika (zB Carprofen, 5 mg / kg Körpergewicht).
- Halten Sie die Tiere warm für Chirurgie, indem sie auf einem Heizkissen platzieren. Warm einen sauberen Käfig auf 37 ° C für die postoperative Genesung.
3. Chirurgie
- Anesthetize eine C57BL / 6 E15.5 schwangere Maus mit Isofluran. Zuerst eine geschlossene Kammer mit 3% Isofluran bei 0,8 l / min Sauerstoff ziehen lassen und die Maus nach innen lassen, bis es schläft. Übertragen Sie die Maus auf einem Heizkissen und legen Sie die Nase und den Mund innerhalb einer Maske für lieferny von Isofluran. Allmählich verringern die Anästhesie im Laufe der Operation zu 1,5% Isofluran über Maske. Bestätigen Sie die richtige anesthetization durch einen Verlust des Pedals Reflex beobachtet (toe Prise). Das optimale Verfahren dauert etwa 20 min und nicht mehr als 45 min.
- Tragen Sie Augensalbe, die Augen vor dem Austrocknen während des Verfahrens zu verhindern.
- Entfernen Sie die Haare von einem ~ 3 cm Bereich des Bauches (entweder einen elektrischen Rasierapparat oder Enthaarungscreme verwenden). Waschen den OP-Bereich mit Wattestäbchen mit 70% Ethanol infundiert, um einen lod-infundiert Wattestäbchen gefolgt. Dreimal wiederholen.
- Decken Sie den OP-Bereich mit steriler Gaze zu verhindern Infektionen.
- Verwenden Sie das Skalpell eine vertikale Öffnung durch die Haut auf 2 cm lang und parallel zur Mittellinie. Trennen Sie die Haut und Muskeln des Bauches stumpf gebogenen Schere. Halten Sie den Muskel mit der Pinzette und schneiden Sie es durch die linea alba die Bauchhöhle zu belichten.
- Suchen Sie die Embryonen mit Hilfe of der Zange. Befeuchten Sie zwei nassen Wattestäbchen mit steriler Kochsalzlösung, hergestellt in Schritt 2.3 und nutzen sie einen zugänglichen Embryo aus der Öffnung zu manipulieren. Legen Sie die Wattestäbchen um den Embryo und extrahieren sanft beide Uterushörner aus der Bauchhöhle. Halten die Embryonen und die geöffnete Bauchhöhle hydratisiert mit warmer Kochsalzlösung während des Verfahrens zu verhindern, dass vor dem Austrocknen.
4. Injektion von DNA und Elektroporation
- Manipulieren die Embryonen vorsichtig mit Fingern Telencephalon zu lokalisieren (eindeutig durch das Auge als die zwei vorderen Vesikel des Gehirns sichtbar gemacht werden). Legen Sie eine vorbereitete Borosilikat-Kapillare in einem Mund Pipette. Führen Sie die Spitze der Nadel durch den Uterus, Blutgefäße zu vermeiden, bis sie einen seitlichen Ventrikel erreicht. injizieren Sie langsam ca. 1 ul Fast Green-gefärbten DNA-Lösung, bis ein großer blauer Fleck beobachtet wird.
- Legen Sie die 7-mm-Platinelektroden seitlich auf the Kopf des Embryos (1C).
HINWEIS: DNA negativ geladen ist; deshalb bewegt er sich in Richtung der positiven Elektrode, wenn die Spannung zwischen den Platinelektroden angelegt wird. Durch Variieren der Lage der Elektroden können verschiedene Bereiche des Gehirns, ausgerichtet sein. - Bewerben Spannung über die Platinelektroden (für E15.5 Embryonen. 5 Impulse, 38 V, 50-ms - Intervall - Zykluslänge, 950-ms - Intervall Pause Diese Bedingungen auf der Entwicklungsstufe variieren) 12.
HINWEIS: Siehe Tabelle 1 für Spannungsbedingungen und Elektroden für unterschiedliche Embryostadien. - Wiederholen Sie die Schritte 4,1-4,3 für jeden Embryo.
5. Ende der Chirurgie und Postoperation
- Verwenden Sie Wattestäbchen, um die Gebärmutter zu manipulieren in die Mutter zurück. Füllen Sie die Bauchhöhle mit der erwärmten Salzlösung (add etwa 2 ml).
- Nähen Sie den Muskel mit einfachen unterbrochenen Stichen oder einem kontinuierlichen Stich. Verwenden # 6-0 Nahts.
- Verwenden Sie Klammern die äußere Wunde zu schließen. Seien Sie vorsichtig, um die Haut vor den Muskel zu trennen, bevor Heften. Entfernen Sie die Nasenmaske.
- Lassen Sie die Maus für 30 Minuten in den beheizten, sauberen Käfig zu erholen, bevor es in der Tieranlage Raum platzieren. Verwenden Sie kein Tier unbeaufsichtigt lassen, bis es genügend Bewusstsein zu halten Brustlage wiedergewonnen hat. Verwenden Sie kein Tier platzieren, die Chirurgie in der Gesellschaft von anderen Tieren unterzogen wurde, bis sie vollständig erholt.
- Beaufsichtigen Sie das Tier in den Tagen nach der Operation. Bewerben Analgetika subkutan (Carprofen, 5 mg / kg Körpergewicht) alle 12 h für 2 Tage oder nach Tiergesetzgebung. Keine zusätzliche postoperative Betreuung ist für die Welpen erforderlich.
6. Vorbereitung und Analyse der Proben
- Optional: Auf P2, überprüfen Sie für die Expression von Fluoreszenz in den durch Elektroporation Welpen ein Fluoreszenzmikroskop verwendet wird; wenn der IUE erfolgreich ist, Fluoreszenz deutlich i gesehen werdenn den Kopf 13. Mark oder trennen die Mäuse, die für die Verwendung in den folgenden Schritten positiv elektroporiert werden. Halten Sie den Damm und Welpen in Standard-Tieranlage Bedingungen.
- Bei der gewünschten Phase der Studie, perfuse die transcardial Mäuse. Typischerweise entspricht die aktivsten Phase der dendritischen und axonalen Wachstums zu den ersten drei Wochen nach der Geburt 2, 14, 15.
- Bereiten Sie 30 ml 4% Paraformaldehyd (PFA) in 1x PBS pro Maus und Chill es auf Eis.
ACHTUNG: PFA ist ein bekanntes Allergen und karzinogen. Es ist giftig. Tragen Sie geeignete Schutzausrüstung.
HINWEIS: Die Menge an PFA benötigt wird, hängt von dem Alter der Maus (zB für P16, 20 ml für die Perfusion und 10 ml für die Nachfixierung sind erforderlich). - Bereiten Sie eine Ketamin-Xylazin-Mix, das Tier mit einem 1 zu betäuben: 1: 8 Volumenverhältnis von 100 ug / ml Ketamin: 100 ug / ml xylazine: PBS (bereiten etwa 0,2 ml pro Maus).
- Anästhesieren der Maus durch intraperitoneal 0,2 ml der Mischung in Schritt 6.2.2 hergestellt einzuspritzen.
- Setzen Sie den narkotisierten Maus auf dem Rücken. Machen Sie einen horizontalen Schnitt oberhalb des Thorax mit einem Skalpell. Schneiden Sie den Muskel und die Membran mit einer feinen Schere, bis das Herz zu beobachten.
- Einen Einschnitt im rechten Vorhof mit den feinen Schere. injizieren langsam 20 ml PBS in den linken Ventrikel mit einem 25-Gauge-Nadel, um das Blut zu entfernen. Spritzen 20 ml PFA (Schritt 6.2.1), bis die Maus starr ist und die Organe werden weiß.
- Ziehen Sie sofort den Kopf und einen Mittelschnitt vom Hals bis zu den Schädel in der Haut. schälen Sie vorsichtig den Schädel mit einer gebogenen Pinzette entfernt und das Gehirn zu extrahieren. Besondere Vorsicht nicht zu durchstechen oder das Gehirn während der Entfernung des Schädels beschädigen. Setzen Sie das Gehirn in 10 ml 4% PFA bei 4 ° C über Nacht es zu postfix.
- Bereiten Sie 30 ml 4% Paraformaldehyd (PFA) in 1x PBS pro Maus und Chill es auf Eis.
- Cryoprotect Gehirne für 1 bei 4 ° C in 10 ml 30% Saccharose in PBS fixiert - vor 2 Tagen, bis sie sinken. Bereiten Sie 1-cm 3 Alufolie Würfel. Füllen Sie die Würfel 2/3 des Weges mit Oktober Setzen Sie die Gehirne innen und frieren sie durch die Würfel auf Trockeneis setzen. Lagern Sie die gefrorenen Gehirne bei -80 ° C.
- Platz Tropfen Oktober auf der Oberfläche der Objektplatte, ziehen Sie die Aluminiumfolie von der Histologie Würfel, und positionieren Sie den Würfel in der gewünschten Ausrichtung auf die Probenplatte auf der Oberseite der Flüssigkeit Oktober Wenden Sie festen Druck, bis er fest ist. Legen Sie die Objektplatte in den Probenkopf des Kryostaten. Richten Sie die Probe (bewegen sie in eine günstige Position relativ zum Messer / Klinge).
- Abschnitt die Gehirne auf den Kryostaten. Wählen Sie von 50 bis 100 & mgr; m dicken floating Kryoabschnitte 16 mit einem feinen Pinsel mit und legen Sie sie in PBS.
- Fleck, falls gewünscht.
HINWEIS: Für die Studie der axonalen Morphologie, Färbung mit einem GFP-Antikörper wird dringend empfohlen 2.- Blockieren die Abschnitte für 1 h bei Raumtemperatur mit 5% fötalem Rinderserum in PBS, enthaltend 0,5% Triton-X 100 (Blockierungslösung). Inkubieren über Nacht bei 4 ° C mit 1: 500 primäre Antikörper (beispielsweise Kaninchen - Anti-GFP) in Blocking - Lösung verdünnt.
- Waschen Sie die Abschnitte dreimal in PBS. 1: 500 sekundärer Antikörper (beispielsweise Ziegen - anti-Kaninchen - Alexa Fluor 488) , verdünnt in Blocking - Lösung und Inkubation für 1 h bei Raumtemperatur. Waschen Sie die Abschnitte dreimal in PBS.
- Gegenfärbung mit DAPI (1: 10.000) in PBS für 10 min 0,5% Triton-X 100 enthält. Spülen Sie die Abschnitte mit PBS. Montieren Sie die Abschnitte in einer wässrigen Eindeckmedium 16.
7. Imaging and Analysis
- Fluoreszenz oder konfokale Mikroskopie
- Zur Rekonstruktion komplette Neuronen, erwerben die Bilder mit hoher Vergrößerung (mindestens 40-fach) und hoher Auflösung (mindestens 1.024 x 1.024). Wähle aus "Tile-Scan "oder entsprechende Option im Erfassungssoftware den Bereich von Interesse abzudecken, quer durch alle Dendriten und Axonen Prozesse. Erwerben Sie eine ausreichende Anzahl von Stapeln auf der z-Achse einen Verlust von Informationen zu vermeiden.
Hinweis: Im allgemeinen ist die Software des Mikroskop hat einen "Optimized stack" Option, aber wenn dies nicht der Fall ist, Prüfung manuell zu bestimmen, wie viele Schritte erforderlich sind, um die Bilder, um zu überlappen, um korrekt einzelnen Vorsprünge definieren. Zwei wichtige Parameter sind die Pinhole und das Ziel; berücksichtigen "höhere Vergrößerung, eine höhere Auflösung und mehr notwendig, z-Schritten."
- Zur Rekonstruktion komplette Neuronen, erwerben die Bilder mit hoher Vergrößerung (mindestens 40-fach) und hoher Auflösung (mindestens 1.024 x 1.024). Wähle aus "Tile-Scan "oder entsprechende Option im Erfassungssoftware den Bereich von Interesse abzudecken, quer durch alle Dendriten und Axonen Prozesse. Erwerben Sie eine ausreichende Anzahl von Stapeln auf der z-Achse einen Verlust von Informationen zu vermeiden.
- Analyse
HINWEIS: Auch wenn mehrere Parameter analysiert werden kann, Schritt 7.2.1 konzentriert sich auf zwei: Dendriten Morphologie und Axon verzweigen. Download von Fidschi ( http://fiji.sc/ ).- Öffnen Sie das Bild, wählen Sie die "Segmented line" Option aus dem Menü. Zeichnen Sie eine Linie (oben und unten bewegt entlang thNachfolgend wird der Aufbau des Neurons e z-Achse durch die Maus) scrollen. Gehen Sie auf "Analysieren, Werkzeuge, ROI-Manager hinzufügen" (alternativ, drücken Sie "t"), um die Zeile zu speichern. Wiederholen Sie diesen Vorgang für jedes Axon oder Dendriten des analysierten Neuron 2.
- Im ROI-Manager-Menü drücken Sie die "Messen", um die Länge (oder zusätzliche Parameter) zu erhalten. Exportieren Sie die Messungen in eine Textdatei oder eine Tabelle zu analysieren.
8. Electrophysiology
HINWEIS: Das Ziel dieses Protokolls ist Ganzzellenstrom-clamp-Aufnahmen von Schicht II / III pyramidalen Zellneuronen visuell durch die GFP-Expression in GFP-elektroporiert Mäusehirnen (oder einem anderen fluoreszierenden Protein zuvor elektroporiert) identifiziert zu erhalten. Es ist eine Anpassung der zuvor 17 veröffentlichten Methoden, 18. Unter Verwendung dieses Protokolls ist es möglich, die Wirkung eines genetischen modif zu studierenication durch IUE auf die elektrischen Eigenschaften des Neurons eingeführt. Der Erwerb von spezifischen Feuermodi ist ein allmählicher Prozess der Differenzierung, die den dynamischen Ausdruck eines breiten Repertoire von Ionenkanälen und führt zur Expression von transienten Feuermodi vor späten postnatalen Stadien beinhaltet. Zum Beispiel sind reife elektrischen Antworten in Schicht II / III des somatosensorischen Kortex der Maus nicht beobachtet vor P16 2, 19.
- Voraussetzungen für den akuten Scheiben
- Bereiten Sie sterile Chirurgie Werkzeuge, um die Gehirne der Mäuse zu entfernen: eine Guillotine, den Kopf zu entfernen; eine kleine Schere, durch den Schädel zu schneiden; Zangen, den Schädel von Gewebe zu trennen; ein Spachtel, zu zart Hirngewebe aus dem Gehäuse entfernen; ein Metallschneidemaschine, die Rinde in zwei gleiche Hälften zu zerlegen; und eine Pasteurpipette zu bewegen Scheiben aus dem Vibratom (legen sie in eine Lösung, die künstliche Zerebrospinalflüssigkeit (ACSF) für die Inspektion, und übertragen dann die Scheiben von ACSF zu einem Bereich Inkubation Halte).
- Vorbereitung 1 l ACSF mit Wasser von hoher Reinheit (Aqua bidest) , enthaltend 119 mM NaCl, 26 mM NaHCO 3, 11 mM Glucose, 2,5 mM KCl, 1,2 mM MgCl 2, 2,5 mM CaCl 2 und 1 mM NaH 2 PO 4. Daraufhin wird die pH-Wert auf 7,3 bis 7,4 mit HCl oder NaOH. Stellen Sie die Osmolarität auf 290 mOsm.
- Bubble ACSF mit Carbogen (95% O 2/5% CO 2) für 15 bis 20 min unter Verwendung von Teflonrohre (~ 1 mm), um den pH zu stabilisieren 7,3-7,4.
- Gefriert 200 ml ACSF-Lösung, gesättigt mit Carbogen bei -80 ° C für 10 bis 15 min eine Lösung matschigen Dissektion zu erzeugen. Legen Sie eine 100- x 20-mm-Gewebekulturschale auf Eis für das Gehirn schneiden.
- Herstellung von 100 ml einer 1% niedrigschmelzende Agarose-Lösung unmittelbar vor dem Beginn des Experiments. Die Lösung wird, schneiden Sie ein quadratisches Stück Agarose (Abmessung: 1 x 1 x 0,5 mm), und Sekundenkleber es dieRückseite der Plattform direkt hinter wo das Gehirn in Scheiben geschnitten wird (Agarose-Gel bietet Unterstützung für das Gehirn während des Schneidens). Stellen Sie die Front so flach wie möglich.
- Erhalten akuten Scheiben
- Unbeweglichkeitseffekt die Maus und betäuben sie mit Isofluran 2%. Legen Sie den Kopf in die Guillotine Öffnung und enthaupten es schnell. Entfernen Sie seinen Schädel so schnell wie möglich mit der Verwendung von Knochen Ranger oder feinen Pinzette. Setzen Sie das Gehirn in ein gekühltes ACSF.
HINWEIS: Es ist wichtig, diesen Schritt schnell auszuführen. - Legen Sie das Gehirn in der gekühlten Kulturschale. Schneiden Sie das Cerebellum mit einer kleinen Schere ab.
- Nehmen Sie das Gehirn mit einem Spatel und tupfen sie trocken auf einem Papiertuch.
- Kleben Sie die ventrokaudalen Ebene des Gehirns auf einem Vibratom Halter. Setzen Sie den Halter auf einem Vibratom mit eiskaltem ACSF gefüllt.
- Erhalten akuten Scheiben durch Schneiden 300 & mgr; m Koronalschnitte (Fortsetzung carbogenation während des gesamten Verfahrens zu gewährleisten, zum Beispiel, setzen Sie ein Sprudler (1-mmPolytetrafluorethylen-Rohr) in der Vibratom Kammer) unter Verwendung der folgenden Vibratom Einstellungen: 0,06-mm Amplitude und 0,08 bis 0,10 mm / s Geschwindigkeit. Stellen Sie den Fortschritt auf die langsamste mögliche Geschwindigkeit (~ 22 s pro Durchgang). Ändern Sie diese optimalen Einstellungen und erhalten optimale Bedingungen für jede Maschine empirisch, wenn nötig.
- Inkubieren der akuten Scheiben für ACSF mindestens 60 min in supplementiert mit 3 mM myo - Inositol, 0,4 mM Ascorbinsäure und 2 mM Natriumpyruvat , während mit 95% O 2/5% CO & sub2 ; -Gas hindurchleitete. Man hält die Temperatur bei 25 ° C.
- Führen Sie die Slicing-Verfahren in weniger als 15 min. Falls gewünscht, können die Scheiben 1 gespeichert werden - 7 h, bevor zur Verwendung auf die Aufzeichnungskammer übertragen wird.
- Unbeweglichkeitseffekt die Maus und betäuben sie mit Isofluran 2%. Legen Sie den Kopf in die Guillotine Öffnung und enthaupten es schnell. Entfernen Sie seinen Schädel so schnell wie möglich mit der Verwendung von Knochen Ranger oder feinen Pinzette. Setzen Sie das Gehirn in ein gekühltes ACSF.
- Voraussetzungen für die Ganzzell-Aufnahme
- Stellen Sie sicher, dass der Elektrostation mit einer Aufnahmekammer ausgestattet ist, ein Perfusions-System, ein Mikroskop, Elektroden (Aufnahme, anregend und Boden), Makro- und MICRomanipulators eine starre vibrationsfeste Tischplatte und Faradayschen Käfig, einem Stimulator, einen Verstärker und Analog-zu-digital (A / D-Wandler), einen Computer mit Erfassungssoftware und ein GFP (oder jede andere Fluorochrom) -Filter zum Analysieren genetisch Neuronen 18 (2A) modifiziert.
- Bereiten Sie die intrazelluläre Lösung, enthaltend 115 mM Kaliumgluconat, 2 mM MgCl 2, 10 mM HEPES, 20 mM KCl, 4 mM Na & sub2 ; ATP und 0,3 mM Na 3 GTP, eingestellt auf pH 7,2 durch KOH und auf 290 mOsm durch KCl.
- Machen Sie Patch-Pipetten von Borosilicatglas Kapillaren ziehen. Bereiten Sie Patch-Elektroden mit einer Mikropipette Abzieher. Verwenden Borosilikat Kapillaren (1,5 mm Außendurchmesser, 0,86 mm Innendurchmesser, 10 cm Länge). Machen Sie Patch-Elektroden Widerstände von 3-10 MOhm zeigt, wenn mit intrazellulären Lösung gefüllt.
- Perfundieren die Aufnahmekammer mit ACSF mit einer Rate von 2 ml / min. Aufrechterhaltung der Temperatur der Kammer bei approximzüglich 33 ° C.
- Whole-cell recording
- Übertragen Sie die Scheiben in die Aufnahmekammer mit einer Pasteurpipette (schneiden Sie die lange Spitze aus) oder einer kleinen Bürste. Halten Sie die Scheibe mit einer Harfe nach unten. Perfundieren die Scheiben ständig mit ACSF mit einer Rate von 2 ml / min.
- Patch Ein GFP-positiven Neuronen.
- Legen Sie die Scheibe in die Aufnahmekammer und finden Sie den Bereich von Interesse durch das Mikroskop bei geringer Vergrößerung (10X). Dann finden Sie eine GFP-positive Zelle mit dem 60x Ziel zu patchen.
- Füllen Sie die Aufzeichnungselektrode mit intrazellulären Lösung. Verwenden Sie die verknüpfte Spritze mit dem Filter (4-mm-Filter) und Mikro-loader Spitze der Aufzeichnungselektrode mit intrazellulären Lösung zu füllen.
- Legen Sie die Glaspipette in den Pipettenhalter. Setzen Sie die Pipettenspitze in das Bad und den Schwerpunkt auf die Spitze. Nachdem die Pipette in dem Bad, so gelten positive Druck durch den Gegendruck-Steuersystem.
- Patch Ein Neuron , das fluoreszierend ist (Abbure 2B).
- Nähern Sie sich die Zelle von Interesse, unter visueller Kontrolle, während der Druck in der Pipette Aufrechterhaltung zurück. Bei Auftreten eines kleinen Grübchen auf der Zelloberfläche, den Druck. An diesem Punkt wird eine dichte Abdichtung (Widerstand größer als 1 G & Omega;) gebildet werden. Ansonsten einen leichten Unterdruck (Sog) gelten sie zu erleichtern.
- Während die Dichtung gebildet wird, bringen die Halte voltage clamp bis -60 mV. Sobald die GOhm Dichtung gebildet wird, wenden Sie einen Impuls des Saugens die Zellmembran unter der Pipette zu Bruch und Ganzzell-Modus zu gehen. Siehe 20 für weitere Einzelheiten verweisen.
- Notieren Sie sich die Aktivität Current-Clamp - Bedingungen unter Verwendung von 21. Einmal in Ganzzellmodus umschalten von Spannungsklemme Strom Clamp-Modus und die Aufnahme zu starten. Zum Beispiel Zellerregbarkeit aufzeichnen, gelten 500 ms langen Strominjektionen depolarisierenden (100-400 pA).
- Berechnen Sie die Feuerraten by Plotten die Anzahl der Aktionspotentiale entlang der Bahn für Eingangsströme zu erhöhen.
HINWEIS: Ruhemembranpotential, Eingangswiderstand und die Membrankapazität können auch aus den Aufnahmen 21 berechnet werden.
- Berechnen Sie die Feuerraten by Plotten die Anzahl der Aktionspotentiale entlang der Bahn für Eingangsströme zu erhöhen.
Ergebnisse
Um die morphologischen Veränderungen von Neuronen im Detail zu charakterisieren und während der Entwicklung ist es wesentlich Neuronen dünn zu etikettieren. Ein Cre-Rekombinase verdünnt System ermöglicht die Expression eines Gens von Interesse in einer spärlichen Population von Neuronen, so dass nur solche Neuronen , die dieses Enzym exprimieren GFP (1A) integrieren. Mit dieser Strategie Schicht II-III wird gezielt und von IUE bei E15.5 gekennzeichnet. CAG-DsRed2 bei 1 ug / ul, ist Co-elektroporiert als Kontrolle und positive elektroporiert Gehirne in lebenden Tieren zu identifizieren. Wichtig ist , dass, nachdem sie mit anti-GFP - Antikörper - Färbung ist das Signal stark genug für die klare Darstellung ihrer dendritischen Morphologien und Axone (1D und E) zu ermöglichen.
Nach IUE und Elektro erhaltene Analyse der Parameter von Ganzzellaufzeichnungen zusammen werden verwendet, ummpare die Brennreaktionen und Erregbarkeit der elektroporierten Zellen unter verschiedenen Bedingungen. Mehrere Parameter erhalten werden. Die Parameter sollten auf die jeweilige Studie mit spezifischen Patch-Clamp-Analyse-Software angepasst werden. 2C stellt ein Beispiel für die Handlung der Aktionspotentiale gegen den Eingangsstrom von Aufnahmen einer WT Schicht II-III Neuron erhalten , die bei E15.5 elektroporiert.

Abbildung 1. Ein Cre-Rekombinase Verwässertes Strategie ermöglicht Sparse Labeling von kortikalen Neuronen. A. Schematische Zusammenfassung der Strategie. In Neuronen sowohl CALNL-GFP und CRE, den loxP-Stop-LoxP Kassette trägt exzidiert aus CALNL-GFP und GFP wird durch die starke CAG-Promotor exprimiert. B. Schematische Darstellung eines Borosilikat - Kapillare gezogen einer Mikropipette Abzieher. Die Spitze wird durch fo geschnittenrceps, die Schaffung eines Winkel von 30 °. Maßnahme 1 cm von der Spitze bis zum Beginn des schmaleren Teil der Kapillare. C. Position der Elektroden die somatosensorischen Kortex zu zielen. Die Platinelektroden sind annähernd über die Ohren des Embryos gelegt. Aufgrund seiner negativen Ladung geht DNA in Richtung der positiven Elektrode, wenn die Spannung angelegt wird. Variation in der Position der Elektroden ermöglicht es, verschiedene Gehirnbereiche abzielen. D. Bilder nach Vektoren erhalten wurden bei embryonalen Tag 15.5 in utero Elektroporation Schicht II-III Neuronen geliefert; koronale Schnitte wurden am postnatalen Tag 16. Der CAG-DsRed2 Vektor wurde als Kontrolle (links) cotransfiziert hergestellt. GFP (Mitte) ist nur in den Neuronen exprimiert, die auch Cre eingebaut, so dass die Rekombination der loxP-Sites in der CALNL-GFP-Vektor. Die spärliche Beschriftung ermöglicht eine individuelle Neuronen unterschieden (Pfeilspitzen) werden. E. Hoch Vergrößerung konfokales Bild von ter dendritischen Dorne eines anderen dünn GFP Neuron bezeichnet. Maßstabsbalken = 100 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
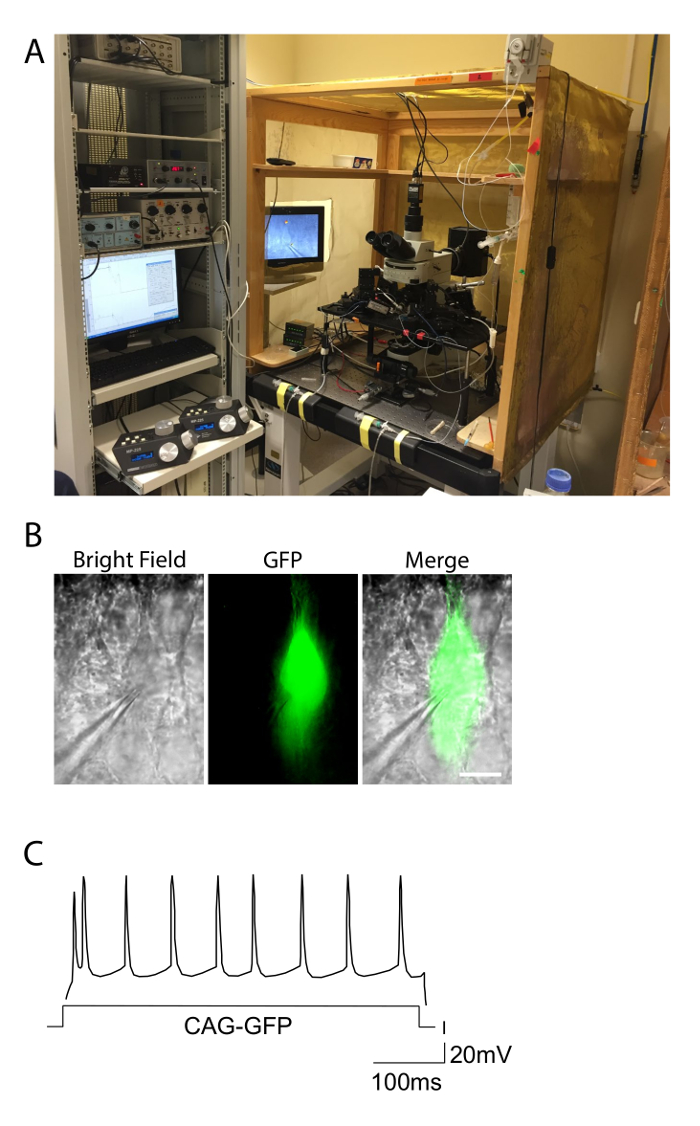
Abbildung 2. Electrophysiology Einstellungen und Beispiel einer Firing Antwort. A. Fotografie zeigt die Elektro Setup für Patch - Clamp - Experimente in akuten Scheiben verwendet. Die Einrichtung ist in einem Faradayschen Käfig enthalten Rauschen zu eliminieren, und die Ausrüstung ist auf der Oberseite eines Antischwingungstisches. Steuerungen der motorisierten Mikromanipulatoren für die Elektroden sind auf der linken Seite beobachtet. B. pyramidale Neuron einer Maus durch Elektroporation mit GFP, beobachtet unter Hellfeld und grüne Fluoreszenz Bedingungen. Die Aufnahme Pipette auf eine GFP + Zelle angebracht ist spürbar. Maßstabsbalken = 10 & #181; m. C. Feuermuster eines CAG-GFP elektroporiert Steuerschicht II-III Neuron die typische reguläre Spick Reaktion zeigt. Die Verteilung von Aktionspotentialen annähert einer regelmäßigen Verteilung entlang der Dauer der Eingangsstrom (X-Achse). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
| Stufe | Stromspannung | Elektroden | Referenzen |
| E9.5 | 7 V, 100 ms, 3 Impulsen | Halten Sie Platinelektroden | Matsui et al. 2011 3 |
| E12,5 | 30 V, 50 ms, 3 bis 5 Impulse | Zangenartigen Elektroden 3 mm | Saito, T., 2006 , 12 |
| E15.5 | 35-48 V, 50 ms, 5 Impulse | Zangenartigen Elektroden 5-7 mm | Rodriguez-Tornos et al. 2016 2, Saito, T., 2006 , 12 |
| P2 | 100 V, 50 ms, 5 Impulse | Zangenartigen Elektroden 5-7 mm | Sonego et al. 2013 4 |
Tabelle 1: Spannungsbedingungen und Elektroden für die Elektroporation von Embryonen.
Diskussion
Dieses Protokoll beschreibt im Detail, wie Neuronen des somatosensorischen Kortex von C75BL / 6-Mäuse zu beschriften, um ihre Verbindungen und ihre Erregbarkeit zu analysieren. In Bezug auf die bestehenden Methoden, visualisiert sie diskriminierende Aspekte der Konnektivität, wie die Anzahl der axonalen Verzweigungen pro Neuron, ihre genaue Topographie und ihrer anatomischen Lage. Durch Veränderung der Position der Elektroden, ist es möglich , andere Neuronenpopulationen, wie beispielsweise die cingulären Cortex zu zielen (halten den gleichen Winkel zwischen den Elektroden und dem Gehirn, aber die Ausrichtung der Pole aus ) oder den Hippocampus 5 und führen ähnliche Experimente Kennzeichnung einzelner Neuronen oder breitere Bevölkerung, auf die gewünschte Strategie abhängig. Es gibt jedoch Einschränkungen dieses, da nicht alle Populationen gleichermaßen zugänglich sind oder in gleicher Weise selektiv markiert. Zum Beispiel in dem Hippocampus, ist es möglich, selektiv spätgeborenen Neuronen des CA1 Region abzielen, sondern eaRLY Elektroporation markiert heterogene Populationen von inneren und äußeren Pyramidenzellen. In der Großhirnrinde, Neuronen werden in sequentieller Weise getragen, so während der IUE der Trächtigkeit Tag bestimmt, welche Rindenschicht beeinflußt wird. Durchführen von früher IUE Ziele tiefer Neuronen (zB IUE bei E14 - Etiketten Schicht IV Neuronen) 22.
Für eine erfolgreiche IUE wird empfohlen Berücksichtigung bestimmter Überlegungen zu nehmen. Erstens ist es wichtig, dass die Operation in weniger als 30 Minuten zu tun, um die Belastung der Mutter zu verringern und die Überlebenschancen der Jungen zu erhöhen. Zweitens ist der schwierigste Teil des Verfahrens die Injektion der DNA ist-führen die Injektion über die Borosilikat Kapillaren so schonend wie möglich. Wenn die Embryonen zu hart gedrückt werden, können sie beschädigt werden. In Bezug auf die Fehlerbehebung für den Tod der Embryonen während der DNA-Injektionen, Anfasen die Spitze mit einem Winkel von 30 ° um die Wirksamkeit dieser Pro erhöhengang. Wenn ein Beveller nicht verfügbar ist und die Kapillaren sind nur mit einer Pinzette geschnitten, der richtige Winkel kann im Binokular bestätigt werden. Entsorgen unzureichend Kapillaren. Schließlich auf die Bühne des Embryos die Elektroporation Bedingungen anzupassen ist wichtig, um die Überlebensrate zu erhöhen (siehe Tabelle 1).
Einige Überlegungen notwendig sind, um im Hinblick auf den Wiederaufbau von Axonen und Dendriten. Zur Kennzeichnung der einzelnen Neuronen, sind die richtige Konzentration des Cre-Plasmid wichtig, eine gute, spärliche Ausdruck zu erhalten und die verwirrende Überschneidungen von neuronalen Projektionen zu vermeiden verschiedenen Neuronen gehören. Obwohl dieses Protokoll die Verwendung von 4 ng / & mgr; l schlägt, kann es notwendig sein , die Plasmid - Konzentration für jeden Versuch einzustellen, von dem verwendeten Promotor abhängig, die Qualität der DNA - Präparation und die Methode der DNA - Quantifizierung (zB reduzieren sie auf 2 ng / & mgr; l, wenn die Kennzeichnung zu viele Neuronen). in additiauf, für axonale tracking, ist es wichtig, in einem geeigneten Winkel zu schneiden, um die gesamte Neuron in der gleichen Ebene zu haben.
Kritische Schritte für eine erfolgreiche Patch-Clamp-Aufnahmen sind die Gesundheit des Gewebes der akuten Scheiben und die Lage und die Größe der durch Elektroporation GFP-positiven Neuronen. Wenn das Patchen Schritte fehlschlagen oder abweichende Antworten werden während der Aufnahmen, reduzieren die Zeit für die Verarbeitung der akuten Scheiben gefunden. Wenn GFP Neuronen schwierig zu identifizieren und aufgrund ihrer reduzierten Anzahl in der akuten slice können, ist sicherzustellen, dass eine ausreichende CAG-GFP-Plasmid in der Elektroporation Mischung enthalten ist. Hinsichtlich der Haupteinschränkungen der Ansätze hierin beschrieben, erlaubt die Patch-Clamp-Technik, um die Aufzeichnung vieler verschiedener Parameter, um die Erregbarkeit des Neurons beschreibt, aber nicht Aspekte auswerten, die auf der gesamten Schaltung abhängen. Außerdem und wie oben erwähnt, nicht alle neuronalen Subpopulationen sind durch IUE. Zusammengefasst in the Zukunft können diese Techniken zur weiteren Analyse der strukturellen und funktionellen Konnektivität von verschiedenen neuronalen Subpopulationen im Gehirn beitragen.
Offenlegungen
Die Autoren erklären, keine Interessenkonflikte.
Danksagungen
Wir danken R. Gutiérrez und A. Morales für ihre hervorragende technische Unterstützung und LA Weiss für die Bearbeitung. CGB wird von der spanischen Ministerio de Ciencia e Innovación (MICINN), FPI-BES-2012-056011 finanziert. Diese Arbeit wurde durch einen Zuschuss von BBVA-Stiftung und SAF2014-58598-jin (Mineco) M. Navarrete und durch einen Zuschuss aus dem Ramón Areces Stiftung und Zuschüsse SAF2014-52119-R und BFU2014-55738-REDT finanziert (von Mineco) zu M. Nieto.
Materialien
| Name | Company | Catalog Number | Comments |
| pCAG-Cre | Addgene | 13775 | |
| pCALNL-GFP | Addgene | 13770 | |
| pCAG-DsRed2 | Addgene | 15777 | |
| pCAG-GFP | Addgene | 11150 | |
| Fast Green | Carl Roth | 301.1 | |
| EndoFree Plasmid Maxi Kit | QIAGEN | 12362 | |
| Carprofen (Rimadyl) | Pfizer GmbH | 1615 ESP | |
| Isoflurane (IsoFlo) | Abbott (Esteve) | 1385 ESP | |
| Ketamine (Imalgene) | Merial | 2528-ESP | |
| Xylazine (Xilagesic) | Calier | 0682-ESP | |
| Povidone Iodine | Meda | 694109.6 | |
| Eye Ointment (Lipolac) | Angelini | 65.277 | |
| Hanks' Balanced Salt Solution (HBSS) | Gibco by Life Technologies | 24020-091 | |
| Penicillin-Streptomycin | Sigma -Aldrich | P4333 | |
| Scalpel Handle # 3 - 12 cm | Fine Science Tools | 10003-12 | |
| Scalpel Blades # 10 | Fine Science Tools | 10010-00 | |
| Adson Forceps-Serrated - Straight 12 cm | Fine Science Tools | 1106-12 | |
| Hardened Fine Scissors - Straight 11 cm | Fine Science Tools | 14090-11 | |
| Scissors Mezenbaum-Nelson Curved L=14.5 cm | Teleflex | PO143281 | |
| Thin curved tips - Style 7 Dumoxel | Dumont | 0303-7-PO | |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11251-20 | |
| Mathieu Needle Holder - Serrated | Fine Science Tools | 12010-14 | |
| AutoClip Applier | Braintree scientific, Inc | ACS APL | |
| 9 mm AutoClips | MikRon Precision, Inc. | 205016 | |
| Sutures - Polysorb 6-0 | Covidien | UL-101 | |
| Electric Razor | Panasonic | ER 240 | |
| Borosilicate glass capillaries (100 mm, 1.0/0.58 Outer/Inner diameter) | World Precision Instrument Inc. | 1B100F-4 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma -Aldrich | A5177-5EA | |
| Gauze (Aposan) | Laboratorios Indas, S.A.U. | C.N. 482232.8 | |
| Cotton Swabs (Star Cott) | Albasa | - | |
| Needle 25 G (BD Microlance 3) | Becton, Dickinson and Company | 300600 | |
| Sucrose | Sigma -Aldrich | S0389 | |
| Paraformaldehyde | Sigma -Aldrich | 158127 | |
| OCT Compound | Sakura | 4583 | |
| Tissue Culture Dish 100 x 20 mm | Falcon | 353003 | |
| GFP Tag Polyclonal Antibody | Thermo Fisher Scientific | A-11122 | |
| Secondary Antibody, Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11008 | |
| DAPI | Sigma-Aldrich | D9542 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10270106 | |
| Triton X-100 | Sigma-Aldrich | X100-500ML | |
| Electroporator ECM 830 | BTX Harvard Apparatus | 45-0002 | |
| Platinum electrodes 650P 7 mm | Nepagene | CUY650P7 | |
| Microscope for Fluorescent Imaging - MZ10F | Leica | - | |
| VIP 3000 Isofluorane Vaporizer | Matrx | - | |
| TCS-SP5 Laser Scanning System | Leica | - | |
| Axiovert 200 Microscope | Zeiss | - | |
| Cryostat - CM 1950 | Leica | - | |
| P-97 Micropette Puller | Sutter Instrument Company | P-97 | |
| Patch clamp analysis softwarw (p-Clamp Clampfit 10.3) | Molecular Devices | - | |
| Acquisition software (MultiClamp 700B Amplifier) | Molecular Devices | DD1440A | |
| Motorized Micromanipulator + Rotating Base | Sutter Instrument | MP-225 | |
| Air Table | Newport | - | |
| Miniature Peristaltic Pumps | WPI | - |
Referenzen
- Dehorter, N., et al. Tuning of fast-spiking interneuron properties by an activity-dependent transcriptional switch. Science. 349 (6253), 1216-1220 (2015).
- Rodriguez-Tornos, F. M., et al. Cux1 Enables Interhemispheric Connections of Layer II/III Neurons by Regulating Kv1-Dependent Firing. Neuron. 89 (3), 494-506 (2016).
- Matsui, A., Yoshida, A. C., Kubota, M., Ogawa, M., Shimogori, T. Mouse in utero electroporation: controlled spatiotemporal gene transfection. J Vis Exp. (54), (2011).
- Sonego, M., Zhou, Y., Oudin, M. J., Doherty, P., Lalli, G. In vivo postnatal electroporation and time-lapse imaging of neuroblast migration in mouse acute brain slices. J Vis Exp. (81), (2013).
- Baumgart, J., Baumgart, N. Cortex-, Hippocampus-, Thalamus-, Hypothalamus-,Lateral Septal Nucleus- and Striatum-specific In Utero Electroporation in the C57BL/6 Mouse. J Vis Exp. (107), (2016).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. J Vis Exp. (31), (2009).
- Rice, H., Suth, S., Cavanaugh, W., Bai, J., Young-Pearse, T. L. In utero electroporation followed by primary neuronal culture for studying gene function in subset of cortical neurons. J Vis Exp. (44), (2010).
- Woodworth, M. B., et al. Ctip1 Regulates the Balance between Specification of Distinct Projection Neuron Subtypes in Deep Cortical Layers. Cell Rep. 15 (5), 999-1012 (2016).
- Wickersham, I. R., et al. Monosynaptic restriction of transsynaptic tracing from single, genetically targeted neurons. Neuron. 53 (5), 639-647 (2007).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104 (3), 1027-1032 (2007).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101 (1), 16-22 (2004).
- Saito, T. In vivo electroporation in the embryonic mouse central nervous system. Nat Protoc. 1 (3), 1552-1558 (2006).
- Bullmann, T., Arendt, T., Frey, U., Hanashima, C. A transportable, inexpensive electroporator for in utero electroporation. Dev Growth Differ. , (2015).
- Miller, M. Maturation of rat visual cortex. I. A quantitative study of Golgi-impregnated pyramidal neurons. J Neurocytol. 10 (5), 859-878 (1981).
- Miller, M., Peters, A. Maturation of rat visual cortex. II. A combined Golgi-electron microscope study of pyramidal neurons. J Comp Neurol. 203 (4), 555-573 (1981).
- Cubelos, B., et al. Cux-2 controls the proliferation of neuronal intermediate precursors of the cortical subventricular zone. Cereb Cortex. 18 (8), 1758-1770 (2008).
- Kang, J. Y., Kawaguchi, D., Wang, L. Optical Control of a Neuronal Protein Using a Genetically Encoded Unnatural Amino Acid in Neurons. J Vis Exp. (109), (2016).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. J Vis Exp. (49), (2011).
- Maravall, M., Stern, E. A., Svoboda, K. Development of intrinsic properties and excitability of layer 2/3 pyramidal neurons during a critical period for sensory maps in rat barrel cortex. J Neurophysiol. 92 (1), 144-156 (2004).
- Karadottir, R., Attwell, D. Combining patch-clamping of cells in brain slices with immunocytochemical labeling to define cell type and developmental stage. Nat Protoc. 1 (4), 1977-1986 (2006).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annu Rev Physiol. 46, 455-472 (1984).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev Biol. 240 (1), 237-246 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten