Method Article
Pré-clínica Ortotópico Modelo murino de cancro da próstata humano
Neste Artigo
Resumo
Prostate cancer is the second most common cause of cancer-related deaths in the United States. An orthotopic cancer model provides a useful approach to understand the biology of prostate cancer and to evaluate the efficacy of therapeutic regimens. This protocol describes detailed steps necessary to establish an orthotopic prostate cancer mouse model.
Resumo
To study the multifaceted biology of prostate cancer, pre-clinical in vivo models offer a range of options to uncover critical biological information about this disease. The human orthotopic prostate cancer xenograft mouse model provides a useful alternative approach for understanding the specific interactions between genetically and molecularly altered tumor cells, their organ microenvironment, and for evaluation of efficacy of therapeutic regimens. This is a well characterized model designed to study the molecular events of primary tumor development and it recapitulates the early events in the metastatic cascade prior to embolism and entry of tumor cells into the circulation. Thus it allows elucidation of molecular mechanisms underlying the initial phase of metastatic disease. In addition, this model can annotate drug targets of clinical relevance and is a valuable tool to study prostate cancer progression. In this manuscript we describe a detailed procedure to establish a human orthotopic prostate cancer xenograft mouse model.
Introdução
O câncer de próstata é a segunda causa mais comum de morte por câncer (9%) entre os homens nos Estados Unidos, ao lado de câncer de pulmão e brônquios (28%) 1. De acordo com dados recentes, estima-se que 220 de 800 casos de cancro da próstata diagnosticados recentemente e 27 540 mortes ocorrerá em 2015 um. A taxa de sobrevivência relativa de cinco anos de cancro da próstata fase inicial é> 99%, enquanto que de doença metastática avançada é apenas 28% 1. Um grande desafio para o tratamento de doença metastática avançada é a falta de compreensão dos mecanismos moleculares subjacentes a propensão da doença de metástase para outros órgãos, particularmente para o osso, que é um local frequente de cancro da próstata. Assim, há uma clara necessidade para o estudo da composição molecular destes tumores da próstata, a fim de desenvolver regimes terapêuticos eficazes contra a progressão para doença metastática avançada 2,3.
Próstata tumores exibem high heterogeneidade biológica sem um caminho bem definido para progressão. Metástases ocorrem frequentemente sem indicação prévia da capacidade de invasão do tumor 4. Esta heterogeneidade clínica é atribuída à diversidade molecular de cancro da próstata. Compreender a composição molecular destes tumores letais é a chave para criar estratégias de melhor diagnóstico e terapêuticas para esta doença. Consequentemente, cancro da próstata investigação está focada na compreensão e prevenção de metástases.
Pré-clínicos in vivo mouse modelos oferecem uma variedade de opções para compreender os mecanismos moleculares da progressão do câncer de próstata para doença metastática avançada. Além disso, estes modelos são importantes para a avaliação pré-clínica de novas estratégias terapêuticas contra esta doença. Os modelos animais mais comumente usados incluem modelos de camundongos transgênicos, injeção na veia da cauda, implantação intra-cardíaca e mouse modelos ortotópicos humanos. estudos transgênicos são consumi tempong e correlação de desenvolvimento de câncer de próstata em ratos com a dos seres humanos têm demonstrado variabilidade 11. Em modelos de ratinhos metastáticos espontâneas, as células são injectadas directamente na circulação e no entanto, eles têm tempo de resposta rápido, que não pode ser utilizado para estudar o tumor primário ou os passos iniciais da cascata metastática 5. modelos de xenotransplante ortotópicos têm a limitação de desenvolver lesões metastáticas ósseas, o local comum de metástase de câncer de próstata. No entanto, o modelo de ratinho humano ortotópico de cancro de próstata de xenoenxerto é bem caracterizado, e amplamente utilizado para estudar os acontecimentos moleculares do desenvolvimento do tumor primário, a diafonia entre o tumor e microambiente órgão, a fase inicial da doença metastática e uso de drogas experimentais para a intervenção terapêutica 6 , 7,8-11.
Protocolo
Protocolos para todos os procedimentos envolvendo animais devem ser revistos e aprovados por um Comitê Institucional de Animal Care and Use (IACUC). Siga os procedimentos oficialmente aprovados para o cuidado e uso de animais de laboratório. injecção intra-prostática requer cirurgia open-abdominal e os animais devem ser mantidos em um ambiente livre de patógenos com uma sala de cirurgia designado onde as técnicas assépticas cirúrgicos apropriados são usados durante todo o procedimento.
1. Preparação de células para implantação
NOTA: Com base na necessidade de investigação, qualquer linha celular de cancro da próstata pode ser usado. As linhas celulares são cultivadas de acordo com as instruções do fornecedor.
- Para a linha de células PC3M-Luc-C6 que expressa estavelmente o gene de luciferase de pirilampo, células de cultura em Meio Essencial Mínimo (MEM) suplementado com 10% de Soro Fetal Bovino (FBS), aminoácidos 1x não essenciais, 1 x fleomicina D1 e 1 mM de piruvato de sódio . Manter as células numa incubadora Wom uma atmosfera humidificada de 95% de ar e 5% de CO2 a 37 ° C. células PC3M-Luc-C6 foram adquiridos a partir de instalação de núcleo de UCSF.
- Células colheita por tripsinização. Lavar as placas de cultura de uma vez com solução salina tamponada com fosfato (PBS). Adicionar 2 ml de tripsina a 0,05% a um prato de 10 cm e incuba-se durante 3-5 minutos numa incubadora com uma atmosfera humidificada de 95% de ar e 5% de CO2 a 37 ° C até as células são separadas.
- Para evitar aglomeração, não agitar as células batendo ou sacudindo o prato enquanto espera para que as células desanexar. Recolher as células em 5 ml de meio completo e girar durante 5 minutos a 200 x g. Lava-se a pelete de células com PBS para remover a tripsina.
- Enumerar células vivas por ensaio de exclusão de azul de tripano. Misturar 10 ul da suspensão de células em PBS com 10 ul de 0,4% (p / v) de solução de azul de tripano. Coloque a mistura em um hemocitômetro ou câmara de contagem slide e contagem de células imediatamente sob um microscópio ou ler o slide câmara em um cou celularnter.
- Prepara-se uma suspensão de células contendo 2,5 x 10 5 células em 10 ul meios. Misture a suspensão de células com extrato de matriz extracelular 10 ul membrana basal-like e colocar as células em gelo. Adicionar luciferina à suspensão de células (1: 200 ul; estoque de 30 mg / ml de concentração) antes da injecção em ratinhos.
NOTA: Isto permite imediato bio-imagem dos animais para verificar a consistência das injeções de células entre os diferentes grupos experimentais. Injectar células tão rapidamente quanto possível, de preferência dentro de 30 min após tripsinização uma vez que a viabilidade celular diminui rapidamente depois da separação.
- Prepara-se uma suspensão de células contendo 2,5 x 10 5 células em 10 ul meios. Misture a suspensão de células com extrato de matriz extracelular 10 ul membrana basal-like e colocar as células em gelo. Adicionar luciferina à suspensão de células (1: 200 ul; estoque de 30 mg / ml de concentração) antes da injecção em ratinhos.
2. Preparação da área cirúrgica
- Realizar a cirurgia em uma área organizada, desinfectados que promove a assepsia.
- Higienizar do banco contador / laboratório com uma solução de água sanitária antes da cirurgia.
NOTA: O uso de álcool é desencorajado devido ao tempo de contacto prolongado necessário para entrar em vigor (15 min). - Use campos estéreis,limpar almofadas absorvíveis ou toalhas, e substituir esses materiais após cada sessão cirúrgica. Esterilizar todos os instrumentos antes de usar. Os métodos preferidos são um autoclave a vapor, esterilizador esferas de vidro, o gás de óxido de etileno, ou esterilização de vapor de peróxido de hidrogénio.
- Use um microscópio de dissecação assepticamente limpa para realizar o procedimento cirúrgico ou investigadores experientes pode executar sem um microscópio.
3. O implante de células tumorais
- Use masculina 6-8 semanas de idade imunocomprometidos Balb / c ou NOD / SCID.
NOTA: É mais difícil de operar em pequenos animais e animais maiores tendem a ter uma cinética mais lenta do crescimento tumoral e metástases. - Injectar pré-cirurgia medicação para a dor de acordo com instruções da instalação animal. Por exemplo, pode ser utilizado Buprenorfina intra-peritoneal, numa dose de 0,1 mg / kg de peso corporal.
- Anestesiar os animais, colocando-os em uma câmara de isoflurano com 1-3% de isoflurano em oxigênio e wa-lo até os animais são anestesiados completamente. Certifique-se de que não há reflexo do dedo do pé de tónus muscular nesse ponto. Use veterinário adequado lubrificante pomada oftálmica para prevenir a cegueira devido à xeroftalmia durante a anestesia geral.
NOTA: Anestesiar os animais pelo método do investigador por exemplo preferido, por pentobarbital de sódio, 0,05 mg por grama de peso corporal é administrado intra-peritoneal ou uma solução de ketamina / xilazina (concentração: 17,16 mg / ml) numa dose de 65 mg / kg de peso corporal é usado por via subcutânea. inalação de isoflurano é um método preferido de anestesia. A pomada deve ser cuidadosamente aplicado sem esfregar contra a córnea. - Remover o animal a partir da câmara de isoflurano e colocar em um aparelho de cone de nariz com o fluxo contínuo de 1-2% de isoflurano em oxigénio para assegurar que o animal está sob anestesia completa antes de prosseguir.
- Remover pêlos de ratos pelo barbear ou usar um creme de cabelo remoção antes de iniciar o procedimento.
NOTA: Seria preferível colocar o mouse sobre uma almofada de aquecimento estéril durante a cirurgia.
- Remover pêlos de ratos pelo barbear ou usar um creme de cabelo remoção antes de iniciar o procedimento.
- Coloque o mouse na posição supina. Limpar o abdómen inferior com 10% w / w solução de povidona-iodo seguido por 70% de etanol esfregaços.
- Com um par de fórceps finos, levantar uma área de pele de 2 mm acima da glândula prepucial, cerca de 1-2 cm acima da bainha do pénis, e cerca de 2-3 cm abaixo da parte inferior da caixa torácica.
- Adicione uma incisão mediana um centímetro de comprimento, em primeiro lugar através da pele com um bisturi e depois através da camada de músculo com uma tesoura (Figura 1).
- Localizar a bexiga na cavidade do corpo. É um órgão esférico castanho amarelo-claro, localizado directamente sob a incisão (Figura 1).
- Com um par de aperto de pinça fina da bexiga e, em seguida, para baixo para cima levantar para fora da cavidade do corpo para a bainha do pénis. Isto exporá os dois vesículas seminais que são um par de órgãos saclike branco e claramente distinta.
- Com umcotonete em cada mão, externalizar as vesículas seminais, um por um, e trazê-los para fora da cavidade do corpo e colocá-los face para baixo sobre a superfície exterior do abdómen com a bexiga no meio (Figura 2).
- Usando os cotonetes, inclina suavemente para trás as vesículas seminais no ponto de inserção perto do colo da bexiga, para o invólucro do pénis, de modo que os dois lóbulos da próstata dorsal são claramente visíveis. Use cotonetes de algodão molhado, para evitar danos nos tecidos (Figura 3).
- Agita-se a suspensão de células com uma micropipeta antes do carregamento na seringa.
- Ao colocar as vesículas seminais em posição com um cotonete de algodão, inserir a agulha da seringa no lóbulo dorsal da próstata sob o microscópio (Figura 4). Lentamente injectar 20 jil de suspensão de células até uma formação de bolhas é identificado. A bula abaulamento indica que a injeção está correto.
- Enquanto retraindo a agulha, pressione levemente o local da injecção comum cotonete e espera por alguns segundos para evitar fugas.
- Retire cuidadosamente as vesículas seminais com cotonetes e inseri-los de volta para a cavidade do corpo, um por um, seguido pela bexiga. Evite 'girando' os órgãos internos durante a realização deste procedimento.
- Depois de colocar os órgãos de volta para dentro da cavidade do corpo, suturar a primeira camada muscular em um padrão interrompido com 4-0 suturas absorvíveis catgut crómico, seguido pelo fechamento da pele com 4-0 não absorvíveis de nylon de sutura cirúrgica. A pele também pode ser puxado em conjunto e fechada com grampos cirúrgicos para fechar a incisão completamente.
NOTA: Os ratos têm um hábito de arranhar e morder a sua ferida, o que pode conduzir à reabertura da ferida, por conseguinte, utilizar cola de tecido, também é recomendado juntamente com suturas. animais imediatamente a imagem para assegurar que não é igual intensidade bioluminescente entre todos os grupos experimentais. - Devolver os animais para limpar gaiolas e mantê-los sob uma lâmpada de aquecimento ou caloring pad. Monitorar os animais constantemente até que eles se recuperar completamente da anestesia e manter decúbito esternal.
4. Acompanhamento dos Animais
- Monitorizar os animais regularmente até ao final da experiência, de acordo com protocolos institucionais. Se estiver usando clipes metálicos cirúrgicos, retirar após uma a duas semanas. Duração do experimento depende da necessidade de investigações específicas.
NOTA: Este experimento foi realizado durante 21 dias para examinar o estabelecimento bem sucedido das células cancerosas implantadas na próstata do rato. - Administrar medicação para a dor com base nas instruções da instalação animal. Por exemplo, buprenorfina intra-peritoneal, numa dose de 0,1 mg / kg de peso corporal pode ser utilizado no momento do procedimento com uma segunda dose após doses de 6 horas adicionais e a cada 8-12 horas, conforme necessário.
- Monitorar o peso animal, consumo de alimentos, a cor da pele e textura, atividade e frequência de micção e defecação. Euthanize animais immediately se há uma perda significativa de peso corporal superior a 15%.
- Para a eutanásia, entregar CO 2 a partir de um tanque pressurizado em uma gaiola un-lotada, com um caudal de deslocar 10-30% da câmara ou gaiola de volume / minuto, permitindo CO 2 para entrar na câmara lentamente para que narcotização inconsciência e completa ocorrer antes da morte.
- Manter o fluxo de CO 2 durante pelo menos um minuto após paragem respiratória e deixar os animais na câmara durante um tempo suficiente para que a morte ocorra imediatamente antes da realização de um método físico.
- Execute decapitação, deslocamento cervical ou qualquer outro IACUC aprovado método físico após a eutanásia de animais quimicamente.
NOTA: Redução significativa de peso corporal, muitas vezes indica uma condição letárgico. animais portadores de tumor deve estar de boa saúde, excepto quanto à presença de tumores, até ao final da experiência. A eutanásia deve ser coerente com as Orientações AVMA sobre eutanásia e deve ser listed no protocolo IACUC aprovado.
5. Non-invasive Bio-imaging dos Animais
- Monitorar os animais semanalmente usando uma técnica de imagem não-invasivo para monitorar a colonização das células cancerosas, o crescimento do tumor e qualquer metástases à distância.
NOTA: modalidades de imagem, como GFP-imagem, a imagem latente de luciferase, raios-X ou tomografia computadorizada de micro 3D (UCT) etc, podem ser usadas com base na investigação específica precisa 12-15.
Resultados
Após a implantação ortotópica de células PC3M-Luc-C6 no lóbulo posterior da próstata, os ratinhos foram semanal fotografada utilizando um sistema de imagem de bioluminescência animal vivo para monitorizar a colonização das células e o crescimento do tumor ao longo do decurso da experiência (Figura 5A - B). A quantificação do sinal bioluminescente indicaram que as células PC3M-Luc-C6 colonizado com sucesso os lóbulos da próstata. O aumento da bioluminescência é indicativo de um aumento do crescimento do tumor primário durante o curso da experiência (Figura 5B). Com base no objectivo de investigação, os ratos podem ser monitorizados semanalmente não invasiva por meio de radiografia, a fluorescência ou luminescência de imagem para controlar o crescimento do tumor e quaisquer lesões metastáticas distantes. Outros parâmetros que podem ser obtidos com este modelo são: As alterações no peso corporal e consumo de alimentos ao longo do curso da experiência; efeito do tratamento com fármaco na dimensão e o peso do tumor; quantificaçãodo tamanho do tumor e peso ao término da experiência; extracção de ADN / ARN / proteína para determinar alterações moleculares que ocorrem no interior do tumor primário após o fim da experiência.
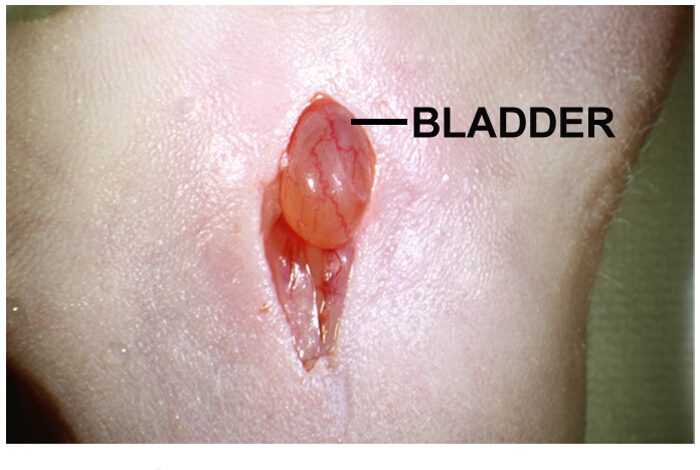
Figura 1:. Incisão mediana abdominal para implantação intra-prostática de células tumorais Abdominal incisão na linha média é de cerca de 1-2 cm de comprimento. bexiga urinária está diretamente sob a incisão. Gentil pressionando em ambos os lados da incisão ajuda a projetar a bexiga urinária. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: Disposição dos vesículas seminais novesículas tra-prostática implante de células tumorais. Seminal são órgãos branco saco-como e estão localizados diretamente adjacente à bexiga. Vesículas seminais se exteriorizam com cotonetes e dispostos a esquerda e direita com a bexiga no centro. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3:. Dorso da próstata No ponto de inserção, inclina suavemente para trás as vesículas seminais para a bainha de pénis de modo que os dois lóbulos da próstata dorsal são claramente visíveis. Use cotonetes molhados para evitar danos aos tecidos. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4:.. O implante intra-prostática de células tumorais As células tumorais são injetadas no lobo dorsal da próstata Por favor clique aqui para ver uma versão maior desta figura.

Figura 5:. In vivo de imagens de modelo bioluminescência intra-implante prostática (A) in vivo imagens bioluminescência de ratinhos ao longo do tempo experimental, após as células PC3M-Luc-C6 luciferase marcadas foram implantadas no lóbulo dorsal da próstata de ratos pelados. (B) Quantificação do sinal de bioluminescência mostra que as células PC3M-Luc-C6 colonizado com sucesso a glândula da próstata com increased crescimento do tumor ortotópico no decorrer do experimento. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Este manuscrito descreve um procedimento detalhado para o estabelecimento de um modelo ortotópico humana rato xenoenxerto de cancro da próstata. Este modelo foi estabelecido por implantação directa da linha de células de cancro da próstata humano PC3M-Luc-C6 nos lóbulos da próstata dorsal de ratinhos imunocomprometidos. Os tumores foram deixados a desenvolver ao longo do curso do experimento. O crescimento do tumor foi monitorizado semanalmente por um sistema de imagem de bioluminescência não invasiva durante o experimento.
O factor mais importante no estabelecimento de modelos de tumor de xenoenxerto é conseguir a consistência ao longo da implantação de células tumorais. Para obter resultados estatisticamente significativos, cada grupo experimental devem conter 5-10 ratos e variação do tamanho do tumor não deve exceder mais de 10% do tamanho médio do tumor. Para atingir este objetivo, alguns passos críticos no âmbito do protocolo são importantes, tais como: i) a realização de uma cirurgia na área que promove a assepsia durante a cirurgia; ii) as células devem ser Transplanted o mais rapidamente possível depois da separação a partir da cultura; iii) o volume de injecção deve ser consistente; iv) elevação cuidadosa dos órgãos internos dentro e para fora da cavidade do corpo durante a implantação de células; v) todos os animais devem ser injetados usando a mesma técnica e por um investigador; vi) os animais devem ser distribuídos aleatoriamente em grupos experimentais após o implante de células tumorais.
Alguns problemas que podem ocorrer são: i) de tumor não se desenvolver de todo ou nódulos tumorais desenvolvem na cavidade mesentério ou corpo; ii) o tamanho do tumor desigual é observada entre o mesmo grupo experimental; iii) não pode ser elevado a mortalidade relacionada com a cirurgia. Estes problemas podem ser superados por adopção de medidas simples tais como: i) ensaios de cultura de células para qualquer contaminação com micoplasma etc; ii) prevenção de fugas da suspensão de células do tumor para dentro do mesentério e cavidade abdominal durante a injecção; iii) a agitação da suspensão de células antes de cada carregamento da seringa; iv) dose de anestesia adequada deve ser followed e almofadas de aquecimento deve ser usada para manter a temperatura do corpo durante o procedimento.
Uma grande variedade de dados podem ser recolhidas utilizando este modelo de acordo com um objectivo particular de pesquisa incluindo o peso do rato, consumo alimentar, o tamanho e o peso do tumor, alterações genéticas e moleculares para as células tumorais que contribuem para o crescimento do tumor, bem como linfáticos regionais metástase 10 , 16. Hoffman e seu grupo desenvolveram a técnica de implante ortotópico cirúrgica (SOI) e extensivamente usado esta técnica para transplantar fragmentos histologicamente intacta dos principais tipos de cânceres humanos, incluindo próstata, bexiga e câncer de rim nos roedores 17. Estes modelos ortotópicos têm vantagem sobre os modelos transgênicos ou subcutâneos do rato uma vez que representam com precisão o câncer clínica 18,19. Estes modelos também foram utilizados para o transplante de tumores tiradas diretamente dos pacientes para o órgão correspondente do rode imunodeficientesNTS. Modelos ortotópicos também são bem adequados para examinar os efeitos do tratamento de drogas no crescimento de tumores e metástase ganglionar 10. Eles são também úteis para examinar os efeitos da expressão genética alterada, ex vivo, e determinando o seu efeito sobre a incidência de tumores, bem como do crescimento intra-prostática e metástase 20. No entanto, uma limitação do modelo ortotópico de cancro da próstata é que nenhum desses modelos têm sido relatados para levar a metástase espontânea ao osso que é o local mais comum para metástases de cancro da próstata 12.
A falha em conseguir metástases ósseas pode ser devido a murganhos morrem de obstrução urinária antes de qualquer osso lesões metastáticas podem desenvolver, ou porque o microambiente do rato falhar para recapitular o microambiente humano, deixando assim de desenvolver metástases ósseas 12. No entanto, este modelo faz recapitular os eventos iniciais da cascata metastática antes da embolia e a entrada de células tumoraispara a circulação e, portanto, é uma ferramenta valiosa para estudar o tumor primário, o processo de início de transformação metastática e para a avaliação pré-clínica de novas estratégias terapêuticas 10,12.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
We thank Dr. Roger Erickson for his support and assistance with the preparation of the manuscript. This work was supported by the National Cancer Institute at the National Institutes of Health through grant numbers RO1CA160079, RO1CA138642, UO1CA184966 and VA funded program project number 1P1 BX001604.
Materiais
| Name | Company | Catalog Number | Comments |
| PC3 prostate cancer cell line | ATCC | CRL-1435 | |
| Minimum Essential Medium (MEM) | GIBCO,Life Technology | 11095-080 | |
| PBS | GIBCO,Life Technology | 10010-023 | |
| FBS | GIBCO,Life Technology | 10437-028 | |
| Zeocin | Invitrogen,Life Technology | R250-01 | |
| Trypsin | GIBCO,Life Technology | 25300-54 | |
| IVIS | Xenogen-Caliper | ||
| Insulin Syringes (300 µl, 28.5 g) | Becton Dickinson | 309300 | |
| Mice | Charles River Laboratories, Inc | ||
| Alcohol Swabs | MEDEquip Depot | 326895 BD | |
| PVP Iodine Prep Pad | MEDEquip Depot | C12400PDI | |
| Surgical CatGut Chromic Suture | Demetech | CC224017F0P | |
| Matrigel | Corning | 354248 |
Referências
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- Andrieu, C., et al. Heat shock protein 27 confers resistance to androgen ablation and chemotherapy in prostate cancer cells through eIF4E. Oncogene. 29 (13), 1883-1896 (2010).
- Fusi, A., et al. Treatment options in hormone-refractory metastatic prostate carcinoma. Tumori. 90 (6), 535-546 (2004).
- Hughes, C., Murphy, A., Martin, C., Sheils, O., O'Leary, J. Molecular pathology of prostate cancer. J Clin Pathol. 58 (7), 673-684 (2005).
- Pavese, J., Ogden, I. M., Bergan, R. C. An orthotopic murine model of human prostate cancer metastasis. J Vis Exp. (79), e50873 (2013).
- Pettaway, C. A., et al. Selection of highly metastatic variants of different human prostatic carcinomas using orthotopic implantation in nude mice. Clin Cancer Res. 2 (9), 1627-1636 (1996).
- Rembrink, K., Romijn, J. C., van der Kwast, T. H., Rubben, H., Schroder, F. H. Orthotopic implantation of human prostate cancer cell lines: a clinically relevant animal model for metastatic prostate cancer. Prostate. 31 (3), 168-174 (1997).
- Kim, S. J., et al. Blockade of epidermal growth factor receptor signaling in tumor cells and tumor-associated endothelial cells for therapy of androgen-independent human prostate cancer growing in the bone of nude mice. Clin Cancer Res. 9 (3), 1200-1210 (2003).
- Kim, S. J., et al. Targeting platelet-derived growth factor receptor on endothelial cells of multidrug-resistant prostate cancer. J Natl Cancer Inst. 98 (11), 783-793 (2006).
- Park, S. I., et al. Targeting SRC family kinases inhibits growth and lymph node metastases of prostate cancer in an orthotopic nude mouse model. Cancer Res. 68 (9), 3323-3333 (2008).
- Zhang, J., et al. AFAP-110 is overexpressed in prostate cancer and contributes to tumorigenic growth by regulating focal contacts. J Clin Invest. 117 (10), 2962-2973 (2007).
- Park, S. I., Kim, S. J., McCauley, L. K., Gallick, G. E. Pre-clinical mouse models of human prostate cancer and their utility in drug discovery. Curr Protoc Pharmacol. Chapter 14, Unit 14.15 (2010).
- Johnson, L. C., et al. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48 (1), 141-151 (2011).
- Steinbauer, M., et al. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin Exp Metastasis. 20 (2), 135-141 (2003).
- Yang, M., et al. A fluorescent orthotopic bone metastasis model of human prostate cancer. Cancer Res. 59 (4), 781-786 (1999).
- Stephenson, R. A., et al. Metastatic model for human prostate cancer using orthotopic implantation in nude mice. J Natl Cancer Inst. 84 (12), 951-957 (1992).
- Hoffman, R. M. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic. Invest New Drugs. 17 (4), 343-359 (1999).
- Wang, X., An, Z., Geller, J., Hoffman, R. M. High-malignancy orthotopic nude mouse model of human prostate cancer LNCaP. Prostate. 39 (3), 182-186 (1999).
- An, Z., Wang, X., Geller, J., Moossa, A. R., Hoffman, R. M. Surgical orthotopic implantation allows high lung and lymph node metastatic expression of human prostate carcinoma cell line PC-3 in nude mice. Prostate. 34 (3), 169-174 (1998).
- Kim, S. J., et al. Reduced c-Met expression by an adenovirus expressing a c-Met ribozyme inhibits tumorigenic growth and lymph node metastases of PC3-LN4 prostate tumor cells in an orthotopic nude mouse model. Clin Cancer Res. 9 (14), 5161-5170 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados