Method Article
ما قبل السريرية مثلي فأري موديل سرطان البروستاتا البشرية
In This Article
Summary
Prostate cancer is the second most common cause of cancer-related deaths in the United States. An orthotopic cancer model provides a useful approach to understand the biology of prostate cancer and to evaluate the efficacy of therapeutic regimens. This protocol describes detailed steps necessary to establish an orthotopic prostate cancer mouse model.
Abstract
To study the multifaceted biology of prostate cancer, pre-clinical in vivo models offer a range of options to uncover critical biological information about this disease. The human orthotopic prostate cancer xenograft mouse model provides a useful alternative approach for understanding the specific interactions between genetically and molecularly altered tumor cells, their organ microenvironment, and for evaluation of efficacy of therapeutic regimens. This is a well characterized model designed to study the molecular events of primary tumor development and it recapitulates the early events in the metastatic cascade prior to embolism and entry of tumor cells into the circulation. Thus it allows elucidation of molecular mechanisms underlying the initial phase of metastatic disease. In addition, this model can annotate drug targets of clinical relevance and is a valuable tool to study prostate cancer progression. In this manuscript we describe a detailed procedure to establish a human orthotopic prostate cancer xenograft mouse model.
Introduction
سرطان البروستاتا هو ثاني أكثر الأسباب شيوعا لوفيات السرطان (9٪) بين الذكور في الولايات المتحدة، إلى جانب سرطان الرئة والقصبات الهوائية (28٪) 1. ووفقا لبيانات حديثة، تشير التقديرات إلى أن 220، 800 حالات سرطان البروستاتا تشخيصها حديثا و 27، 540 حالة وفاة تحدث في عام 2015 1. ويبلغ معدل البقاء النسبي لمدة خمس سنوات من مرحلة مبكرة من سرطان البروستاتا> 99٪ في حين أن المرض المنتشر المتقدمة هو فقط 28٪ 1. ويتمثل التحدي الرئيسي لعلاج المرض المنتشر المتقدمة هو عدم فهم الآليات الجزيئية الكامنة وراء ميل هذا المرض إلى metastasize إلى الأجهزة الأخرى، وخاصة في العظام، وهو موقع المتكرر لسرطان البروستاتا. وبالتالي، هناك حاجة واضحة لدراسة التركيب الجزيئي لهذه الأورام البروستاتا من أجل تطوير نظم علاجية فعالة ضد التقدم إلى متقدمة 2،3 المرض المنتشر.
البروستاتا الأورام المعرض المهزومةح التجانس البيولوجي دون طريقا واضحة المعالم إلى التقدم. وغالبا ما تحدث الانبثاث مع عدم وجود إشارة مسبقة من ورم الغازية 4. ويعزى هذا التباين السريرية إلى التنوع الجزيئي للسرطان البروستاتا. فهم التركيبة الجزيئية لهذه الأورام المميتة هو المفتاح لوضع استراتيجيات أفضل التشخيصية والعلاجية لهذا المرض. وبناء على ذلك، تركز بحوث سرطان البروستات حاليا على التفاهم ومنع ورم خبيث.
ما قبل السريرية المجراة نماذج الماوس توفر مجموعة متنوعة من الخيارات لفهم الآليات الجزيئية للتطور سرطان البروستاتا المرض المنتشر المتقدمة. وبالإضافة إلى ذلك، وهذه النماذج هي مهمة لتقييم ما قبل السريرية استراتيجيات علاجية جديدة ضد هذا المرض. وتشمل النماذج الحيوانية الأكثر شيوعا النماذج المعدلة وراثيا الماوس، حقن الوريد الذيل، وغرس داخل القلب ونماذج الماوس مثلي الإنسان. دراسات المعدلة وراثيا هي المرة consumiوقد أظهرت نانوغرام وارتباط التنمية سرطان البروستاتا في الفئران مع أن البشر تقلب 11. في نماذج الماوس المتنقل عفوية، يتم حقن الخلايا مباشرة في الدورة الدموية ورغم ذلك، كان لديهم الوقت التحول السريع، فإنها لا يمكن أن تستخدم لدراسة الورم الرئيسي أو الخطوات الأولية في تتالي النقيلي 5. نماذج طعم أجنبي مثلي لديها الحد من تطوير العظام الآفات المتنقل، وموقع مشترك للالانبثاث سرطان البروستاتا. ومع ذلك، فإن مثلي سرطان البروستاتا طعم أجنبي نموذج الفأر البشري يتميز جيدا وتستخدم على نطاق واسع لدراسة الأحداث الجزيئية للتنمية الورم الرئيسي، عبر الحديث بين الورم والمكروية الجهاز، المرحلة الأولى من المرض المنتشر واستخدام الأدوية التجريبية للتدخل العلاجي 6 ، 7،8-11.
Protocol
يجب مراجعة بروتوكولات لجميع الإجراءات التي تنطوي على الحيوانات التي وافقت عليها لجنة رعاية واستخدام الحيوان المؤسسي (IACUC). اتبع الإجراءات المعتمدة رسميا لرعاية واستخدام الحيوانات المختبرية. الحقن داخل البروستاتا يتطلب عملية جراحية مفتوحة البطن ويجب أن تبقى الحيوانات في بيئة خالية من مسببات الأمراض مع غرفة الجراحة المعينة التي يتم فيها استخدام تقنيات مناسبة العقيم جراحية خلال الإجراء بأكمله.
1. إعداد الخلايا لزرع
ملاحظة: بناء على الحاجة البحوث، ويمكن استخدام أي خط الخلايا السرطانية في البروستاتا. وتربيتها خطوط الخلايا وفقا لتعليمات المورد.
- للخط الخلوي PC3M لوك-C6 التي تعبر عن مستقر الجين يراعة luciferase، وخلايا الثقافة في الحد الأدنى الضروري المتوسطة (MEM) تستكمل مع 10٪ مصل بقري جنيني (FBS)، الأحماض الأمينية 1X غير الضرورية، 1X Phleomycin D1 و1MM البيروفات الصوديوم . الحفاظ على الخلايا في حاضنة ثإيث جو مرطب من 95٪ الجوية و 5٪ CO 2 عند 37 درجة مئوية. وتم شراء خلايا PC3M لوك-C6 من مرفق الأساسية UCSF.
- حصاد الخلايا بواسطة trypsinization. غسل الأطباق الثقافة مرة واحدة مع الفوسفات مخزنة المالحة (PBS). إضافة 2 مل 0.05٪ التربسين إلى صحن 10 سم واحتضان لمدة 3-5 دقائق في حاضنة مع جو مرطب من 95٪ الجوية و 5٪ CO 2 عند 37 درجة مئوية حتى يتم فصل الخلايا.
- لتجنب تراكمها، لا تستنهض الهمم الخلايا عن طريق ضرب أو هز طبق أثناء انتظار الخلايا لفصل. جمع الخلايا في 5 مل من وسائل الاعلام كاملة وتدور باستمرار لمدة 5 دقائق في 200 × ز. غسل بيليه الخلية مع برنامج تلفزيوني لإزالة التربسين.
- تعداد الخلايا الحية التي التريبان الأزرق الاستبعاد مقايسة. مزيج 10 ميكرولتر من تعليق خلية في برنامج تلفزيوني مع 10 ميكرولتر من 0.4٪ (وزن / حجم) التريبان حل الأزرق. تحميل الخليط في عدادة الكريات أو غرفة العد الشرائح وعدد الخلايا مباشرة تحت المجهر أو قراءة الشريحة غرفة في فصول التوجيه الجامعي خليةnter.
- إعداد تعليق خلية تحتوي على 2.5 × 10 5 خلايا في 10 ميكرولتر وسائل الإعلام. مزيج تعليق الخلية مع مثل غشاء 10 ميكرولتر الطابق السفلي استخراج المصفوفة خارج الخلية ووضع الخلايا على الجليد. إضافة وسيفيرين إلى تعليق الخلية (1: 200 ميكرولتر، الأسهم 30 ملغ / مل تركيز) قبل الحقن في الفئران.
ملاحظة: هذا يسمح فوري الحيوي التصوير من الحيوانات للتحقق من اتساق حقن الخلايا بين المجموعات التجريبية المختلفة. حقن الخلايا في أسرع وقت ممكن، ويفضل أن يكون في غضون 30 دقيقة بعد trypsinization منذ بقاء الخلية يتناقص بسرعة بعد انفصال.
- إعداد تعليق خلية تحتوي على 2.5 × 10 5 خلايا في 10 ميكرولتر وسائل الإعلام. مزيج تعليق الخلية مع مثل غشاء 10 ميكرولتر الطابق السفلي استخراج المصفوفة خارج الخلية ووضع الخلايا على الجليد. إضافة وسيفيرين إلى تعليق الخلية (1: 200 ميكرولتر، الأسهم 30 ملغ / مل تركيز) قبل الحقن في الفئران.
2. إعداد المنطقة الجراحية
- إجراء عمليات جراحية في منطقة غير مزدحمة، تطهيرها تعزز عقامة.
- تطهير العداد / مختبر مقاعد البدلاء مع محلول التبييض قبل الجراحة.
ملاحظة: استخدام الكحول المحبطين بسبب مدة الاتصال اللازمة لتصبح نافذة المفعول (15 دقيقة). - استخدام الستائر العقيمة،تنظيف منصات للامتصاص أو المناشف، واستبدال هذه المواد بعد كل دورة الجراحية. تعقيم جميع الأدوات قبل استخدامها. الأساليب المفضلة هي الأوتوكلاف بخار والزجاج حبة تعقيم، غاز أكسيد الإثيلين، أو بيروكسيد الهيدروجين بخار التعقيم.
- استخدام مجهر تشريح تنظيف جو معقم و مطهر لإجراء العملية الجراحية أو يمكن الباحثين من ذوي الخبرة أداؤه دون المجهر.
3. زرع الخلايا السرطانية
- استخدام الذكور 6-8 الاسبوع القديمة المناعة BALB / ج أو موافقة / الفئران SCID.
ملاحظة: إنه من الصعب أن تعمل على الحيوانات الصغيرة والحيوانات الكبيرة تميل إلى أن تكون حركية أبطأ من نمو الورم والانبثاث. - ضخ ما قبل الجراحة ألم الدواء وفقا لتعليمات منشأة الحيوان. على سبيل المثال، البوبرينورفين داخل البريتوني بجرعة 0.1 ملجم / كجم من وزن الجسم يمكن استخدامها.
- تخدير الحيوانات عن طريق وضعها في دائرة الأيزوفلورين مع 1-3٪ الأيزوفلورين في الأكسجين وواحتى يتم تخدير كامل الحيوانات. ضمان عدم وجود أي رد فعل اصبع القدم من العضلات في هذه المرحلة. استخدام السليم البيطري زيوت التشحيم مرهم للعين للوقاية من العمى نتيجة لجفاف الملتحمة أثناء التخدير العام.
ملاحظة: تخدير الحيوانات التي كتبها المحقق الطريقة على سبيل المثال المفضل، لبنتوباربيتال الصوديوم، يدار 0.05 ملغ لكل غرام من وزن الجسم داخل الصفاق أو الكيتامين / حل زيلازين (تركيز: 17.16 ملغ / مل) بجرعة 65 ملغم / كغم من وزن الجسم يستخدم تحت الجلد. استنشاق الأيزوفلورين هو الأسلوب المفضل للتخدير. ينبغي تطبيق مرهم العين بلطف دون فرك ضد القرنية. - إزالة الحيوان من غرفة الأيزوفلورين والمكان الى جهاز مخروط الأنف مع تدفق مستمر من 1-2٪ الأيزوفلورين في الأكسجين للتأكد من أن هذا الحيوان هو تحت التخدير الكامل قبل المتابعة.
- إزالة الشعر من الفئران عن طريق الحلاقة أو استخدام كريم إزالة الشعر قبل البدء في إجراء.
ملاحظة: قد يكون من الأفضل وضع الماوس على وسادة التدفئة معقمة أثناء الجراحة.
- إزالة الشعر من الفئران عن طريق الحلاقة أو استخدام كريم إزالة الشعر قبل البدء في إجراء.
- ضع الماوس في موقف ضعيف. تنظيف أسفل البطن مع 10٪ ث / ث حل بوفيدون اليود تليها 70٪ مسحات الايثانول.
- مع زوج من ملقط غرامة، ورفع مساحة الجلد 2 مم فوق الغدة القلفة، حوالي 1-2 سم فوق غمد القضيب، وحوالي 2-3 سم تحت الجزء السفلي من القفص الصدري.
- جعل 1CM شق خط الوسط في الطول، أولا من خلال الجلد مع مشرط ومن ثم عن طريق طبقة العضلات مع مقص (الشكل 1).
- تحديد موقع المثانة في تجويف الجسم. وإنما هي جهاز كروية البني الأصفر الخفيف، وتقع مباشرة تحت شق (الشكل 1).
- مع زوج من ملقط غرامة قبضة المثانة ورفع إلى الأعلى ثم إلى الأسفل من تجويف الجسم نحو غمد القضيب. هذا وسوف تعرض اثنين من الحويصلات المنوية التي هي زوج من أجهزة saclike بيضاء ومميزة بشكل واضح.
- معمسحة القطن في كل يد، تخريج الحويصلات المنوية، واحدا تلو الآخر، وسحب لهم للخروج من تجويف الجسم ووضع لهم وجهه لأسفل على السطح الخارجي للبطن مع المثانة في الوسط (الشكل 2).
- باستخدام قطعة قطن، والميل بلطف ذهابا والحويصلات المنوية عند نقطة الإدراج بالقرب من عنق المثانة، نحو غمد القضيب، حتى أن اثنين من فصوص البروستاتا الظهرية واضحة للعيان. استخدام قطعة قطن مبللة لتجنب تلف الأنسجة (الشكل 3).
- تستنهض الهمم تعليق الخلية مع micropipette قبل تحميل في المحقنة.
- في حين وضع الحويصلات المنوية في موقف مع مسحة القطن، تضاف إبرة الحقنة في الفص الظهرية البروستاتا تحت المجهر (الشكل 4). ببطء ضخ 20 ميكرولتر من تعليق الخلية حتى يتم التعرف على تشكيل الفقاعة. والفقاعة المنتفخة تشير إلى أن الحقن هو الصحيح.
- في حين يتراجع الإبرة، ثم اضغط برفق على موقع الحقن معمسحة القطن والانتظار لبضع ثوان لمنع التسرب.
- بعناية رفع الحويصلات المنوية مع مسحات القطن وإدراجها مرة أخرى إلى تجويف الجسم واحدا تلو الآخر تليها المثانة. تجنب 'التدوير' الأعضاء الداخلية أثناء أداء هذا الإجراء.
- بعد وضع أجهزة مرة أخرى إلى تجويف الجسم، خياطة طبقة العضلات أولا في نمط توقف مع امتصاص 4-0 الغرز الخيوط الكروم تليها إغلاق الجلد مع غير قابل للامتصاص خياطة الجراحية 4-0 النايلون. ويمكن أيضا أن الجلد يتم سحبها معا وأغلق مع المشابك جراحية لإغلاق الجرح تماما.
ملاحظة: الفئران لديهم عادة من الخدش والعض على الجرح، والتي قد تؤدي إلى إعادة فتح الجرح، وبالتالي استخدام الغراء الأنسجة ويوصى أيضا جنبا إلى جنب مع الغرز. الحيوانات صورة على الفور لضمان عدم وجود تكافؤ شدة إضاءة الحيوية بين جميع المجموعات التجريبية. - عودة الحيوانات لتنظيف الأقفاص والاحتفاظ بها تحت مصباح الاحترار أو الحرارةجي وحة. مراقبة الحيوانات باستمرار حتى يشفى تماما من التخدير والحفاظ على الاستلقاء القصية.
4. مراقبة الحيوانات
- مراقبة الحيوانات بانتظام حتى نهاية التجربة، وفقا لبروتوكولات المؤسسية. في حالة استخدام مقاطع معدنية جراحية، إزالة بعد 1-2 أسابيع. مدة التجربة تعتمد على ضرورة بحثية محددة.
ملاحظة: تم إجراء هذه التجربة لمدة 21 يوما لدراسة إنشاء الناجح الخلايا السرطانية المزروعة في البروستاتا الماوس. - إدارة الدواء الألم بناء على تعليمات منشأة الحيوان. على سبيل المثال، البوبرينورفين داخل البريتوني بجرعة 0.1 ملجم / كجم من وزن الجسم يمكن أن تستخدم في ذلك الوقت من الإجراء مع جرعة ثانية بعد 6 ساعات وإضافية جرعات كل 8-12 ساعة حسب الحاجة.
- مراقبة الوزن الحيوان، واستهلاك الغذاء، ولون البشرة والملمس، والنشاط وتواتر التبول والتغوط. الموت ببطء الحيوانات IMMEDiately إذا كان هناك خسارة كبيرة في وزن الجسم أكبر من 15٪.
- للقتل الرحيم، وتقديم CO 2 من خزان الضغط إلى قفص إلغاء مزدحم في معدل تدفق لتهجير 10-30٪ من غرفة أو قفص حجم / دقيقة، والسماح CO 2 للدخول إلى الغرفة ببطء بحيث تحدث التخدر فقدان الوعي والكامل قبل وفاته.
- الحفاظ CO 2 تدفق لمدة دقيقة واحدة على الأقل بعد توقف التنفس وترك الحيوانات في غرفة لوقت كاف حتى الموت يحدث قبل أداء طريقة المادية.
- وافق أداء قطع الرأس، خلع عنق الرحم أو أي طريقة أخرى IACUC البدني بعد القتل الرحيم للحيوانات كيميائيا.
ملاحظة: انخفاض كبير وزن الجسم كثيرا ما يشير إلى وجود حالة السبات العميق. وينبغي أن يكون الورم الحيوانات تحمل في صحة جيدة باستثناء وجود أورام حتى نهاية التجربة. وينبغي أن يكون القتل الرحيم يتفق مع المبادئ التوجيهية اخر احصاء على القتل الرحيم، ويجب أن يكون LISTEد في بروتوكول IACUC المعتمدة.
5. عدم الغازية بيو تصوير الحيوانات
- مراقبة الحيوانات أسبوعيا باستخدام تقنية التصوير غير الغازية لتعقب الاستعمار من الخلايا السرطانية، نمو الورم وأي ورم خبيث بعيد.
ملاحظة: طرائق التصوير مثل GFP التصوير، والتصوير luciferase المراسل، الأشعة السينية أو التصوير المقطعي 3D-احتساب الدقيقة (UCT) وما يمكن أن تستخدم استنادا إلى بحوث محددة تحتاج 12-15.
النتائج
بعد زرع مثلي الخلايا PC3M لوك-C6 في الفص الخلفي البروستاتا، تم تصوير الفئران أسبوعيا باستخدام حيوان نظام تلألؤ بيولوجي التصوير الحي لمراقبة استعمار الخلايا ونمو الورم على مدى التجربة (الشكل 5A - B). وأشار الكمي للإشارة إضاءة الحيوية أن خلايا PC3M لوك-C6 استعمرت بنجاح فصوص البروستاتا. زيادة تلألؤ بيولوجي يدل على زيادة نمو الورم الرئيسي على مسار التجربة (الشكل 5B). على أساس هدف البحث، والفئران يمكن رصدها أسبوعيا غير جراحية عن طريق التصوير الشعاعي، مضان أو التصوير التلألؤ لمراقبة نمو الورم وأي الآفات النقيلي بعيدة. غيرها من المعالم التي يمكن تحقيقها مع هذا النموذج هي: التغيرات في وزن الجسم واستهلاك الأغذية خلال التجربة. تأثير العلاج من تعاطي المخدرات على حجم الورم والوزن. تحديد الكميةمن حجم الورم والوزن عند انتهاء التجربة. استخراج DNA / RNA / البروتين لتحديد التغيرات الجزيئية التي تحدث داخل الورم الرئيسي بعد انتهاء التجربة.
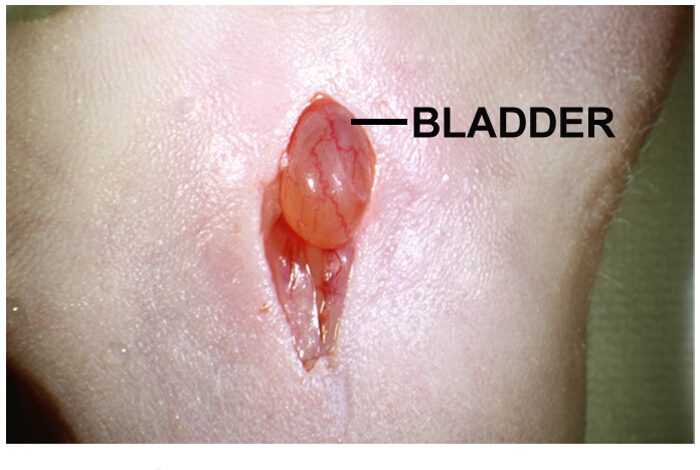
الشكل 1: البطن شق خط الوسط لزرع داخل البروستاتا من خلايا ورم في البطن شق خط الوسط ما يقرب من 1-2 سم. المثانة البولية مباشرة تحت شق. لطيف الضغط على كلا الجانبين من شق يساعد على نتأ المثانة البولية. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: ترتيب الحويصلات المنوية لفيالحويصلات هيئة تنظيم الاتصالات البروستاتا زرع الخلايا السرطانية. المنوي هي بيضاء تشبه كيس الأجهزة وتقع المتاخمة مباشرة إلى المثانة. وexteriorized الحويصلات المنوية مع مسحات القطن ومرتبة اليسار واليمين مع المثانة في المركز. الرجاء النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الشكل (3): ظهر البروستاتا عند نقطة الإدراج، إمالة بلطف ذهابا والحويصلات المنوية نحو غمد القضيب حتى أن اثنين من فصوص البروستاتا الظهرية واضحة للعيان. استخدام قطعة قطن مبللة لتجنب تلف الأنسجة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
الرقم 4: زرع البينية البروستاتا الخلايا السرطانية يتم حقن الخلايا السرطانية في الفص الظهرية البروستاتا الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الرقم 5: في الجسم الحي تلألؤ بيولوجي التصوير من نموذج زرع داخل البروستاتا (أ) في الجسم الحي زرعت الصور تلألؤ بيولوجي من الفئران على مدار الساعة التجريبية بعد وسيفيراز المسمى خلايا PC3M لوك-C6 في الفص الظهرية البروستاتا لدى الفئران عارية. (ب) الكمي للإشارة تلألؤ بيولوجي يظهر أن الخلايا PC3M لوك-C6 استعمرت بنجاح غدة البروستاتا مع الزيادهإد نمو الورم مثلي على مدار التجربة. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
توضح هذه المخطوطة إجراءات تفصيلية لإنشاء مثلي سرطان البروستاتا نموذج طعم أجنبي الماوس البشري. أنشئ هذا النموذج من قبل الزرع مباشرة من خط الخلايا السرطانية في البروستاتا البشرية PC3M لوك-C6 في فصوص البروستاتا الظهرية من الفئران المناعة. سمح أورام لتطوير أكثر من مسار التجربة. تم رصد نمو الورم الأسبوعية عن طريق نظام التصوير تلألؤ بيولوجي غير الغازية أثناء التجربة.
العامل الأكثر أهمية في إنشاء نماذج طعم أجنبي الورم لتحقيق الاتساق في جميع أنحاء زرع الخلايا السرطانية. للحصول على نتائج ذات دلالة إحصائية، يجب أن تحتوي كل مجموعة التجريبية 5-10 الفئران، وينبغي أن حجم الورم الاختلاف لا تتجاوز أكثر من 10٪ من متوسط حجم الورم. ولتحقيق هذا الهدف، بعض الخطوات الحاسمة ضمن بروتوكول مهمة، مثل: أ) إجراء عملية جراحية في المنطقة التي تعزز عقامة أثناء الجراحة. ب) يجب أن تكون خلايا transplanteد في أقرب وقت ممكن بعد مفرزة من الثقافة؛ ج) يجب أن يكون حجم الحقن ثابت. د) رفع حذرا من الأعضاء الداخلية داخل وخارج تجويف الجسم خلال زرع خلايا. ت) يجب أن يتم حقن جميع الحيوانات باستخدام نفس التقنية ومحقق واحد؛ سادسا) ينبغي العشوائية الحيوانات في المجموعات التجريبية بعد زرع الخلايا السرطانية.
بعض المشاكل التي قد تحدث هي: ط) لا ورم تطوير على الإطلاق، أو عقيدات الورم تتطور في مساريق أو تجويف الجسم. لوحظ ب) متفاوتا حجم الورم بين نفس المجموعة التجريبية. ج) قد يكون هناك ارتفاع الوفيات الناجمة عن الجراحة. ويمكن التغلب على هذه المشاكل عن طريق اتخاذ تدابير بسيطة مثل: أ) اختبار ثقافة خلية لأي تلوث مع الميكوبلازما وما إلى ذلك؛ ب) منع تسرب تعليق الخلية السرطانية في مساريق وتجويف البطن أثناء الحقن. ج) التحريض تعليق الخلية قبل تحميل كل حقنة. د) يجب أن تكون مناسبة جرعة التخدير فلوينبغي أن تستخدم lowed ومنصات التدفئة للحفاظ على درجة حرارة الجسم أثناء العملية.
مجموعة واسعة من البيانات التي يمكن جمعها باستخدام هذا النموذج اعتمادا على هدف البحث معين بما في ذلك وزن الماوس، واستهلاك الغذاء، وحجم الورم والوزن، والتغيرات الوراثية والجزيئية في الخلايا السرطانية التي تساهم في نمو الورم وكذلك الليمفاوية الإقليمي عقدة الانبثاث 10 16. وضعت هوفمان ومجموعته تقنية زرع مثلي الجراحية (أبناء العراق) واستخدمت على نطاق واسع هذه التقنية لزرع شظايا-تشريحيا سليمة من أنواع رئيسية من السرطانات البشرية بما في ذلك البروستاتا والمثانة وسرطان الكلية في القوارض 17. هذه النماذج مثلي لها ميزة على نماذج الماوس المعدلة وراثيا أو تحت الجلد لأنها تمثل بدقة السرطان السريرية 18،19. واستخدمت هذه النماذج أيضا إلى زرع الأورام مأخوذة مباشرة من المرضى إلى الجهاز المقابلة من ركب العوز المناعياليلة. نماذج مثلي هي أيضا مناسبة تماما لدراسة الآثار المترتبة على العلاج من تعاطي المخدرات على نمو الورم والعقد الليمفاوية الانبثاث 10. كما أنها مفيدة لدراسة الآثار المترتبة على التعبير الجيني تغير خارج الحي، وتحديد تأثيرها على حدوث الأورام وكذلك النمو داخل البروستاتا والانبثاث 20. ومع ذلك، وجود قيود على مثلي نموذج سرطان البروستاتا هو أن لم يتم الابلاغ عن مثل هذه النماذج أن يؤدي إلى ورم خبيث عفوية حتى العظم الذي هو الموقع الأكثر شيوعا لسرطان البروستاتا ورم خبيث 12.
الفشل في تحقيق الانبثاث العظام قد يكون ناجما عن الفئران الذين يموتون بسبب انسداد المسالك البولية قبل أي العظام يمكن الآفات النقيلي تطوير، أو بسبب فشل المكروية من الماوس لألخص المكروية الإنسان، وبالتالي فشلها في تطوير العظام الانبثاث 12. ومع ذلك، وهذا النموذج لا تلخص الأحداث في وقت مبكر في تتالي النقيلي قبل الانسداد ودخول الخلايا السرطانيةإلى الدورة الدموية، وبالتالي هو أداة قيمة لدراسة الورم الرئيسي، عملية الأولى من التحول النقيلي والتقييمات قبل السريرية استراتيجيات علاجية جديدة 10،12.
Disclosures
الكتاب تعلن أنه ليس لديهم مصالح مالية المتنافسة.
Acknowledgements
We thank Dr. Roger Erickson for his support and assistance with the preparation of the manuscript. This work was supported by the National Cancer Institute at the National Institutes of Health through grant numbers RO1CA160079, RO1CA138642, UO1CA184966 and VA funded program project number 1P1 BX001604.
Materials
| Name | Company | Catalog Number | Comments |
| PC3 prostate cancer cell line | ATCC | CRL-1435 | |
| Minimum Essential Medium (MEM) | GIBCO,Life Technology | 11095-080 | |
| PBS | GIBCO,Life Technology | 10010-023 | |
| FBS | GIBCO,Life Technology | 10437-028 | |
| Zeocin | Invitrogen,Life Technology | R250-01 | |
| Trypsin | GIBCO,Life Technology | 25300-54 | |
| IVIS | Xenogen-Caliper | ||
| Insulin Syringes (300 µl, 28.5 g) | Becton Dickinson | 309300 | |
| Mice | Charles River Laboratories, Inc | ||
| Alcohol Swabs | MEDEquip Depot | 326895 BD | |
| PVP Iodine Prep Pad | MEDEquip Depot | C12400PDI | |
| Surgical CatGut Chromic Suture | Demetech | CC224017F0P | |
| Matrigel | Corning | 354248 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- Andrieu, C., et al. Heat shock protein 27 confers resistance to androgen ablation and chemotherapy in prostate cancer cells through eIF4E. Oncogene. 29 (13), 1883-1896 (2010).
- Fusi, A., et al. Treatment options in hormone-refractory metastatic prostate carcinoma. Tumori. 90 (6), 535-546 (2004).
- Hughes, C., Murphy, A., Martin, C., Sheils, O., O'Leary, J. Molecular pathology of prostate cancer. J Clin Pathol. 58 (7), 673-684 (2005).
- Pavese, J., Ogden, I. M., Bergan, R. C. An orthotopic murine model of human prostate cancer metastasis. J Vis Exp. (79), e50873 (2013).
- Pettaway, C. A., et al. Selection of highly metastatic variants of different human prostatic carcinomas using orthotopic implantation in nude mice. Clin Cancer Res. 2 (9), 1627-1636 (1996).
- Rembrink, K., Romijn, J. C., van der Kwast, T. H., Rubben, H., Schroder, F. H. Orthotopic implantation of human prostate cancer cell lines: a clinically relevant animal model for metastatic prostate cancer. Prostate. 31 (3), 168-174 (1997).
- Kim, S. J., et al. Blockade of epidermal growth factor receptor signaling in tumor cells and tumor-associated endothelial cells for therapy of androgen-independent human prostate cancer growing in the bone of nude mice. Clin Cancer Res. 9 (3), 1200-1210 (2003).
- Kim, S. J., et al. Targeting platelet-derived growth factor receptor on endothelial cells of multidrug-resistant prostate cancer. J Natl Cancer Inst. 98 (11), 783-793 (2006).
- Park, S. I., et al. Targeting SRC family kinases inhibits growth and lymph node metastases of prostate cancer in an orthotopic nude mouse model. Cancer Res. 68 (9), 3323-3333 (2008).
- Zhang, J., et al. AFAP-110 is overexpressed in prostate cancer and contributes to tumorigenic growth by regulating focal contacts. J Clin Invest. 117 (10), 2962-2973 (2007).
- Park, S. I., Kim, S. J., McCauley, L. K., Gallick, G. E. Pre-clinical mouse models of human prostate cancer and their utility in drug discovery. Curr Protoc Pharmacol. Chapter 14, Unit 14.15 (2010).
- Johnson, L. C., et al. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48 (1), 141-151 (2011).
- Steinbauer, M., et al. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin Exp Metastasis. 20 (2), 135-141 (2003).
- Yang, M., et al. A fluorescent orthotopic bone metastasis model of human prostate cancer. Cancer Res. 59 (4), 781-786 (1999).
- Stephenson, R. A., et al. Metastatic model for human prostate cancer using orthotopic implantation in nude mice. J Natl Cancer Inst. 84 (12), 951-957 (1992).
- Hoffman, R. M. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic. Invest New Drugs. 17 (4), 343-359 (1999).
- Wang, X., An, Z., Geller, J., Hoffman, R. M. High-malignancy orthotopic nude mouse model of human prostate cancer LNCaP. Prostate. 39 (3), 182-186 (1999).
- An, Z., Wang, X., Geller, J., Moossa, A. R., Hoffman, R. M. Surgical orthotopic implantation allows high lung and lymph node metastatic expression of human prostate carcinoma cell line PC-3 in nude mice. Prostate. 34 (3), 169-174 (1998).
- Kim, S. J., et al. Reduced c-Met expression by an adenovirus expressing a c-Met ribozyme inhibits tumorigenic growth and lymph node metastases of PC3-LN4 prostate tumor cells in an orthotopic nude mouse model. Clin Cancer Res. 9 (14), 5161-5170 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved