Method Article
Pré-clinique Orthotopique modèle murin de cancer de la prostate humaine
Dans cet article
Résumé
Prostate cancer is the second most common cause of cancer-related deaths in the United States. An orthotopic cancer model provides a useful approach to understand the biology of prostate cancer and to evaluate the efficacy of therapeutic regimens. This protocol describes detailed steps necessary to establish an orthotopic prostate cancer mouse model.
Résumé
To study the multifaceted biology of prostate cancer, pre-clinical in vivo models offer a range of options to uncover critical biological information about this disease. The human orthotopic prostate cancer xenograft mouse model provides a useful alternative approach for understanding the specific interactions between genetically and molecularly altered tumor cells, their organ microenvironment, and for evaluation of efficacy of therapeutic regimens. This is a well characterized model designed to study the molecular events of primary tumor development and it recapitulates the early events in the metastatic cascade prior to embolism and entry of tumor cells into the circulation. Thus it allows elucidation of molecular mechanisms underlying the initial phase of metastatic disease. In addition, this model can annotate drug targets of clinical relevance and is a valuable tool to study prostate cancer progression. In this manuscript we describe a detailed procedure to establish a human orthotopic prostate cancer xenograft mouse model.
Introduction
Le cancer de la prostate est la deuxième cause la plus fréquente de décès par cancer (9%) chez les hommes aux États-Unis, à côté d' un cancer du poumon et des bronches (28%) 1. Selon des données récentes, on estime que 220 800 cas de cancer de la prostate nouvellement diagnostiqués et 27 540 décès auront lieu en 2015 1. Le taux de survie relative à cinq ans du début de cancer de la prostate stade est> 99% tandis que celle de la maladie métastatique avancé est seulement 28% 1. Un défi majeur pour le traitement de la maladie métastatique avancé est le manque de compréhension des mécanismes moléculaires qui sous-tendent la propension de cette maladie à métastaser à d'autres organes, en particulier à l'os, qui est un site fréquent pour le cancer de la prostate. Par conséquent, il existe un besoin évident d'étudier la composition moléculaire de ces tumeurs de la prostate afin de développer des schémas thérapeutiques efficaces contre la progression à avancé 2,3 de la maladie métastatique.
Prostate tumeurs présentent high hétérogénéité biologique sans une voie bien définie à la progression. Métastases se produisent souvent sans indication préalable de l' invasivité tumorale 4. Cette hétérogénéité clinique est attribuée à la diversité moléculaire du cancer de la prostate. Comprendre la composition moléculaire de ces tumeurs mortelles est la clé pour concevoir de meilleures stratégies diagnostiques et thérapeutiques pour cette maladie. Par conséquent, la recherche sur le cancer de la prostate est actuellement axé sur la compréhension et la prévention des métastases.
Modèles de souris pré-cliniques in vivo offrent une variété d'options pour comprendre les mécanismes moléculaires de la progression du cancer de la prostate à la maladie métastatique avancé. En outre, ces modèles sont importants pour les évaluations précliniques de nouvelles stratégies thérapeutiques contre cette maladie. Les modèles animaux les plus couramment utilisés comprennent des modèles transgéniques de souris, l'injection de queue veineuse, l'implantation intra-cardiaque et des modèles de souris orthotopique humains. Les études transgéniques sont consumi de tempsng et la corrélation du développement du cancer de la prostate chez les souris avec celle de l' homme ont montré une variabilité 11. Dans les modèles spontanés de souris métastatiques, les cellules sont injectées directement dans la circulation et bien, ils ont le temps de réponse rapide, ils ne peuvent pas être utilisés pour étudier la tumeur primaire ou les premières étapes de la cascade métastatique 5. des modèles de xénogreffes orthotopiques ont la limitation du développement de lésions métastatiques osseuses, le site commun de métastases du cancer de la prostate. Néanmoins, le modèle orthotopique humain du cancer de la prostate de xénogreffe de souris est bien caractérisé et largement utilisé pour étudier les événements moléculaires du développement de la tumeur primaire, diaphonie entre tumeur et microenvironnement d'organes, de la phase initiale de la maladie métastatique et l' utilisation de médicaments expérimentaux pour une intervention thérapeutique 6 , 7,8-11.
Protocole
Protocoles pour toutes les procédures impliquant des animaux doivent être examinés et approuvés par un comité de protection et d'utilisation institutionnelle des animaux (IACUC). Suivre les procédures approuvées officiellement pour le soin et l'utilisation des animaux de laboratoire. L'injection intra-prostatique nécessite une intervention chirurgicale ouverte abdominale et les animaux doivent être conservés dans un environnement exempt d'agents pathogènes avec une pièce désignée de chirurgie où les techniques aseptiques chirurgicales appropriées sont utilisées pendant toute la procédure.
1. Préparation des cellules pour implantation
REMARQUE: Selon les besoins de recherche, toute lignée cellulaire de cancer de la prostate peut être utilisé. Les lignées cellulaires sont cultivées selon les instructions du fournisseur.
- Pour la lignée cellulaire PC3M-Luc-C6 qui exprime de façon stable le gène de la luciférase de luciole, des cellules de culture en milieu essentiel minimum (MEM) supplémenté avec 10% de sérum bovin fœtal (FBS), des acides aminés 1x non essentiels, 1x phléomycine D1 et 1 mM de pyruvate de sodium . Maintenir les cellules dans un incubateur wvec une atmosphère humidifiée de 95% d' air et 5% de CO 2 à 37 ° C. cellules PC3M-Luc-C6 ont été achetés auprès de l'installation de base UCSF.
- Récolte des cellules par trypsinisation. Laver les plaques de culture une fois avec du tampon phosphate salin (PBS). Ajouter 2 ml de trypsine à 0,05% dans une boîte de 10 cm et laisser incuber pendant 3-5 min dans un incubateur avec une atmosphère humidifiée de 95% d' air et 5% de CO2 à 37 ° C jusqu'à ce que les cellules se détachent.
- Pour éviter l'agglutination, ne pas agiter les cellules en frappant ou en secouant le plat en attendant les cellules pour détacher. Recueillir les cellules dans 5 ml de milieu complet et centrifuger pendant 5 minutes à 200 x g. Laver le culot cellulaire avec du PBS pour éliminer la trypsine.
- Énumérer les cellules vivantes par essai d'exclusion au bleu trypan. Mélanger 10 ul de la suspension cellulaire dans du PBS avec 10 ul de 0,4% (poids / volume) de solution de bleu trypan. Chargez le mélange dans une diapositive hémocytomètre ou chambre de comptage et de compter les cellules immédiatement sous un microscope ou lire la diapositive de chambre dans un cou cellulairenter.
- Préparer une suspension de cellules contenant 2,5 x 10 5 cellules dans 10 ul de milieux. Mélanger la suspension cellulaire avec 10 ul de la membrane basale, comme l'extrait de matrice extracellulaire et de placer les cellules sur de la glace. Ajouter luciférine à la suspension cellulaire (1: 200 pi; stocks 30 mg / ml concentration) avant d'injecter à des souris.
NOTE: Cela permet immédiatement bio-imagerie des animaux pour vérifier la cohérence des injections de cellules entre les différents groupes expérimentaux. Injecter cellules aussi rapidement que possible, de préférence dans les 30 minutes après trypsinisation depuis la viabilité cellulaire diminue rapidement après le détachement.
- Préparer une suspension de cellules contenant 2,5 x 10 5 cellules dans 10 ul de milieux. Mélanger la suspension cellulaire avec 10 ul de la membrane basale, comme l'extrait de matrice extracellulaire et de placer les cellules sur de la glace. Ajouter luciférine à la suspension cellulaire (1: 200 pi; stocks 30 mg / ml concentration) avant d'injecter à des souris.
2. Préparation de la zone chirurgicale
- Effectuer la chirurgie dans, une zone épurée désinfectée qui favorise l'asepsie.
- Désinfectez le compteur / banc de laboratoire avec une solution d'eau de Javel avant la chirurgie.
NOTE: La consommation d'alcool est déconseillée en raison de temps de contact nécessaire pour prendre effet (15 min). - Utilisez des champs stériles,nettoyer des tampons ou des serviettes résorbables, et remplacer ces matériaux après chaque session chirurgicale. Stériliser tous les instruments avant de les utiliser. Les procédés préférés sont un autoclave à vapeur, perle de verre stérilisateur, gaz d'oxyde d'éthylène, ou le peroxyde d'hydrogène stérilisation à la vapeur.
- Utiliser un microscope à dissection aseptique nettoyé pour effectuer la procédure chirurgicale ou des chercheurs expérimentés peuvent effectuer sans un microscope.
3. L'implantation des cellules tumorales
- Utilisez homme de 6-8 semaines immunodéprimés Balb / c ou des souris NOD / SCID.
NOTE: Il est plus difficile d'opérer sur des animaux plus petits et plus grands animaux ont tendance à avoir une cinétique plus lente de la croissance tumorale et les métastases. - Injecter des médicaments contre la douleur pré-opératoire selon les instructions de l'installation animale. Par exemple, la buprénorphine intrapéritonéale à une dose de 0,1 mg / kg de poids corporel peut être utilisé.
- Anesthésier les animaux en les plaçant dans une chambre d'isoflurane avec 1-3% d'isoflurane dans de l'oxygène et wajusqu'à ce que les animaux sont complètement anesthésiés. Assurez-vous qu'il n'y a pas toe réflexe du tonus musculaire à ce stade. Utilisez vétérinaires appropriés pommade ophtalmique lubrifiante pour prévenir la cécité due à la xérophtalmie pendant l'anesthésie générale.
NOTE: Anesthetize les animaux par la méthode préférée , par exemple de l'enquêteur, pour pentobarbital de sodium, 0,05 mg par poids corporel de gramme est administré intra-péritonéale ou kétamine / solution de Xylazine (concentration: 17,16 mg / ml) à une dose de 65 mg / kg de poids corporel est utilisé sous-cutanée. par inhalation d'isoflurane est un procédé préféré de l'anesthésie. La pommade oculaire doit être appliquée doucement sans frotter contre la cornée. - Retirer l'animal de la chambre isoflurane et le placer dans un appareil de cône de nez avec un flux continu de 1-2% d'isoflurane dans de l'oxygène pour assurer que l'animal est sous anesthésie générale avant de poursuivre.
- Enlever les poils de souris par le rasage ou utiliser une crème épilatoire avant de commencer la procédure.
NOTE: Il serait préférable de placer la souris sur un coussin chauffant stérile pendant la chirurgie.
- Enlever les poils de souris par le rasage ou utiliser une crème épilatoire avant de commencer la procédure.
- Placez la souris dans une position couchée. Nettoyer l'abdomen inférieur à 10% en poids / poids solution de povidone-iode suivi par 70% des prélèvements d'éthanol.
- Avec une paire de pinces fines, soulever une zone de peau 2 mm au-dessus de la glande préputiale, environ 1-2 cm au-dessus de la gaine du pénis, et environ 2-3 cm en dessous du bas de la cage thoracique.
- Faire une incision de 1 cm de la ligne médiane de la longueur, tout d' abord à travers la peau avec un scalpel, puis à travers la couche musculaire avec une paire de ciseaux (figure 1).
- Localiser la vessie dans la cavité du corps. Il est un organe sphérique jaune brun-clair, situé directement sous l'incision (Figure 1).
- Avec une paire de pinces fines saisir la vessie et soulever vers le haut puis vers le bas de la cavité du corps vers la gaine du pénis. Cela permettra d'exposer les deux vésicules séminales qui sont une paire de blancs organes en forme de sac et clairement distincts.
- Avec uncoton - tige dans chaque main, extériorisent les vésicules séminales, un par un, et les sortir de la cavité du corps et se trouvait face cachée sur la surface extérieure de l'abdomen avec la vessie au milieu (Figure 2).
- En utilisant les tampons de coton, inclinez doucement les vésicules séminales au point d'insertion à proximité du col de la vessie, vers la gaine du pénis, de sorte que les deux lobes de la prostate dorsale sont clairement visibles. Utilisez des cotons - tiges humides pour éviter des dommages aux tissus (figure 3).
- Agiter la suspension cellulaire avec une micropipette avant le chargement dans la seringue.
- En plaçant les vésicules séminales en position avec un coton - tige, insérer l'aiguille de la seringue dans le lobe dorsal de la prostate sous le microscope (figure 4). Injecter lentement 20 ul de suspension cellulaire jusqu'à une formation de bulle est identifiée. Une bulle bombée indique que l'injection est correcte.
- Alors que la rétraction de l'aiguille, appuyez légèrement sur le site d'injection avecun coton-tige et maintenez pendant quelques secondes pour éviter les fuites.
- Soulevez délicatement les vésicules séminales avec des cotons-tiges et insérez-les dans la cavité du corps, un par un suivi de la vessie. Évitez 'virevoltant' les organes internes pendant cette procédure.
- Après avoir placé les organes dans la cavité du corps, le fil de suture de la couche musculaire d'abord dans un motif interrompu par 4-0 absorbable catgut chromique suivie par la fermeture de la peau non absorbable suture chirurgicale de nylon 4-0. La peau peut également être tiré ensemble et fermé avec des pinces chirurgicales pour fermer l'incision complètement.
NOTE: Les souris ont l'habitude de se gratter et mordre à leur blessure, ce qui peut conduire à la réouverture de la plaie, d'où l'utilisation de colle tissulaire est également recommandée avec sutures. animaux de l'image immédiatement pour assurer qu'il y ait une intensité bioluminescente égale entre tous les groupes expérimentaux. - Remettre les animaux pour nettoyer les cages et les garder sous une lampe chauffante ou à la chaleuring pad. Surveiller les animaux en permanence jusqu'à ce qu'ils récupèrent complètement de l'anesthésie et de maintenir décubitus sternale.
4. Surveillance des animaux
- Surveiller les animaux régulièrement jusqu'à la fin de l'essai, selon des protocoles institutionnels. Si vous utilisez des clips métalliques chirurgicales, retirer après une à deux semaines. Durée de l'expérience dépend de la nécessité de recherche spécifique.
REMARQUE: Cette expérience a été menée pendant 21 jours pour examiner la mise en place réussie des cellules cancéreuses de la prostate implantées dans la souris. - Administrer des médicaments de la douleur sur la base des instructions de l'installation des animaux. Par exemple, la buprénorphine intrapéritonéale à une dose de 0,1 mg / kg de poids corporel peut être utilisé au moment de l'opération avec une seconde dose après 6 h et toutes les doses supplémentaires de 8 à 12 h selon les besoins.
- Surveiller le poids des animaux, la consommation alimentaire, la couleur de la peau et la texture, l'activité et la fréquence de la miction et la défécation. Euthanasier animaux immediately s'il y a une perte significative de poids corporel supérieur à 15%.
- Pour l' euthanasie, livrer CO 2 à partir d' un réservoir sous pression dans une cage non encombrée à un débit pour déplacer 10-30% de la chambre ou de la cage de volume / minute, ce qui permet de CO 2 pour entrer dans la chambre lentement pour que narcotisation inconscience et complète se produit avant la mort.
- Maintenir CO 2 flux pendant au moins une minute après l' arrêt respiratoire et de laisser les animaux dans la chambre pendant un temps suffisant pour que la mort se produit avant d'effectuer une méthode physique.
- Effectuer la décapitation, la dislocation cervicale ou tout autre IACUC approuvé la méthode physique après euthanasier les animaux chimiquement.
REMARQUE: le poids corporel significativement réduite indique souvent une condition léthargique. Tumoraux animaux porteurs doivent être en bonne santé, sauf pour la présence de tumeurs jusqu'à la fin de l'expérience. Euthanasie devrait être conforme aux lignes directrices de l'AVMA sur l'euthanasie et doit être listed dans le protocole IACUC approuvé.
Bio-imagerie 5. Non-invasive des animaux
- Surveiller les animaux chaque semaine à l'aide d'une technique d'imagerie non invasive pour suivre la colonisation des cellules cancéreuses, la croissance tumorale et des métastases à distance.
NOTE: modalités d'imagerie telles que la GFP-imagerie, l' imagerie de la luciférase, les rayons X ou 3D micro-tomographie par ordinateur (UCT) , etc. , peuvent être utilisés en fonction de la recherche spécifique ont besoin 12-15.
Résultats
Après l' implantation orthotopique de cellules PC3M-Luc-C6 dans le lobe de la prostate postérieure, les souris ont été hebdomadaire imagés en utilisant un système d'imagerie par bioluminescence d'animaux vivants pour contrôler la colonisation des cellules et la croissance des tumeurs au cours de l' expérience (Figure 5A - B). Quantification du signal bioluminescent a indiqué que les cellules PC3M-Luc-C6 colonisé avec succès les lobes de la prostate. Bioluminescence accrue indique une augmentation de la croissance de la tumeur primaire au cours de l'expérience (figure 5B). Sur la base de l'objectif de recherche, les souris peuvent être surveillées par semaine de manière non invasive par radiographie, fluorescence, imagerie par luminescence pour surveiller la croissance des tumeurs et des lésions métastatiques distantes. D'autres paramètres qui peuvent être obtenus avec ce modèle sont les suivants: les changements dans le poids corporel et la consommation alimentaire au cours de l'expérience; l'effet du traitement médicamenteux sur la taille de la tumeur et du poids; quantificationla taille de la tumeur et du poids à la fin de l'expérience; extraction de l'ADN / ARN / protéine pour déterminer des modifications moléculaires qui se produisent à l'intérieur de la tumeur primaire, après la fin de l'expérience.
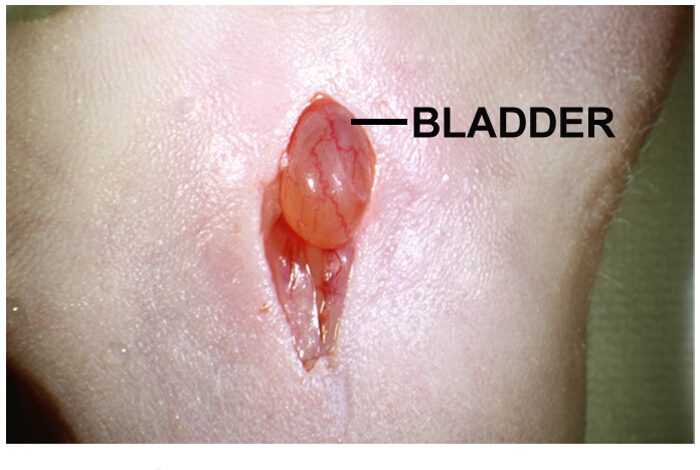
Schéma 1:. Abdominale incision médiane pour l' implantation intra-prostatique de cellules tumorales incision abdominale médiane d' environ 1-2 cm de long. la vessie urinaire est directement sous l'incision. Pressurage doux des deux côtés de l'incision aide à dépasser la vessie. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2: Disposition des vésicules séminales dansvésicules tra-prostatique d'implantation des cellules tumorales. séminal sont blancs organes sac-comme et sont situés juste à côté de la vessie. Vésicules séminales sont extériorisées avec des cotons - tiges et arrangées de gauche et à droite avec la vessie dans le centre. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3:. Dorsum de la prostate Au point d'insertion, inclinez doucement les vésicules séminales vers la gaine de pénis de sorte que les deux lobes de la prostate dorsale sont clairement visibles. Utilisez des cotons - tiges humides pour éviter des dommages aux tissus. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4:.. L' implantation intra-prostatique de cellules tumorales Les cellules tumorales sont injectées dans le lobe dorsal de la prostate S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5:. In vivo bioluminescence imagerie modèle intra-prostatiques d'implantation (A) In vivo , les images de bioluminescence des souris au cours du temps expérimental après la luciférase a marqué des cellules PC3M-Luc-C6 ont été implantées dans le lobe dorsal de la prostate chez des souris nues. (B) Quantification du signal de bioluminescence montre que les cellules PC3M-Luc-C6 colonisées avec succès la glande de la prostate avec de plus ened croissance de la tumeur orthotopique au cours de l'expérience. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Ce manuscrit décrit une procédure détaillée pour établir un modèle de xénogreffe de souris humaine orthotopique de cancer de la prostate. Ce modèle a été mis en place par implantation directe de la lignée cellulaire du cancer de la prostate humain PC3M-Luc-C6 dans les lobes prostatiques dorsale de souris immunodéprimées. Les tumeurs ont été autorisés à se développer au cours de l'expérience. La croissance tumorale a été surveillée toutes les semaines par un système d'imagerie par bioluminescence non invasive au cours de l'expérience.
Le facteur le plus important dans l'établissement de modèles de xénogreffe de tumeur est d'assurer la cohérence à travers l'implantation de cellules tumorales. Pour obtenir des résultats statistiquement significatifs, chaque groupe expérimental doit contenir de 5 à 10 souris, et la variation de la taille de la tumeur ne doit pas dépasser plus de 10% de la taille moyenne de la tumeur. Pour atteindre cet objectif, certaines étapes critiques dans le protocole sont importants, tels que: i) la réalisation d'une intervention chirurgicale dans la zone qui favorise l'asepsie pendant l'intervention chirurgicale; ii) les cellules doivent être transplanteD le plus tôt possible après le détachement de la culture; iii) le volume d'injection doit être cohérente; iv) le levage soigneux des organes internes dans et hors de la cavité du corps pendant l'implantation de cellules; v) tous les animaux doivent être injectés en utilisant la même technique et par un enquêteur; vi) les animaux doivent être répartis de façon aléatoire dans des groupes expérimentaux après l'implantation des cellules tumorales.
Certains problèmes qui peuvent se produire sont les suivantes: i) la tumeur ne se développe pas ou nodules de tumeur se développer dans la cavité du corps ou méso; ii) la taille de la tumeur inégale est observée dans le même groupe expérimental; iii) il peut y avoir une forte mortalité liée à la chirurgie. Ces problèmes peuvent être surmontés grâce à des mesures simples telles que: i) le test de la culture cellulaire à une contamination par des mycoplasmes , etc; ii) empêcher la fuite de la suspension de cellules tumorales dans la cavité abdominale et le mésentère lors de l'injection; iii) agiter la suspension cellulaire avant chaque chargement de la seringue; iv) la dose d'anesthésie appropriée devrait être folcoussinets de mugissaient et de chauffage doivent être utilisés pour maintenir la température du corps pendant la procédure.
Une grande variété de données peuvent être collectées en utilisant ce modèle en fonction d'un objectif de recherche particulier , y compris le poids de la souris, la consommation alimentaire, la taille de la tumeur et le poids, les changements génétiques et moléculaires dans les cellules tumorales qui contribuent à la croissance de la tumeur ainsi que la lymphe régionale métastases ganglionnaires 10 , 16. Hoffman et son groupe ont développé la technique d'implantation chirurgicale orthotopique (SOI) et ont largement utilisé cette technique pour transplanter des fragments histologiquement intact des principaux types de cancers humains , y compris la prostate, de la vessie et les cancers du rein chez les rongeurs 17. Ces modèles orthotopique ont un avantage par rapport aux modèles de souris transgéniques les ou sous - cutanée , car ils représentent avec précision le cancer clinique 18,19. Ces modèles ont également été utilisés pour transplanter les tumeurs prélevées directement auprès des patients à l'organe correspondant de la rode immunodéficientnts. Modèles orthotopiques sont également bien adaptés pour examiner les effets du traitement médicamenteux sur la croissance de la tumeur et des métastases ganglionnaires 10. Ils sont également utiles pour étudier les effets de l' expression du gène modifié ex vivo, et la détermination de son effet sur l' incidence des tumeurs ainsi que la croissance intra-prostatiques et les métastases 20. Cependant, une limitation du modèle de cancer de la prostate orthotopique est qu'aucun de ces modèles ont été rapportés conduire à des métastases spontanées à l'os qui est le site le plus fréquent pour les métastases du cancer de la prostate 12.
L' incapacité d'atteindre des métastases osseuses peut être due à des souris qui meurent de l' obstruction urinaire avant tout os lésions métastatiques peuvent se développer, ou parce que le microenvironnement de la souris ne parvient pas à récapituler le microenvironnement humain, manquant ainsi de développer des métastases osseuses 12. Néanmoins, ce modèle fait récapituler les événements précoces dans la cascade métastatique avant l'embolie et l'entrée des cellules tumoralesdans la circulation et est donc un outil précieux pour étudier la tumeur primaire, processus précoce de transformation métastatique et pour les évaluations précliniques de nouvelles stratégies thérapeutiques 10,12.
Déclarations de divulgation
Les auteurs déclarent qu'ils ont aucun intérêt financier concurrents.
Remerciements
We thank Dr. Roger Erickson for his support and assistance with the preparation of the manuscript. This work was supported by the National Cancer Institute at the National Institutes of Health through grant numbers RO1CA160079, RO1CA138642, UO1CA184966 and VA funded program project number 1P1 BX001604.
matériels
| Name | Company | Catalog Number | Comments |
| PC3 prostate cancer cell line | ATCC | CRL-1435 | |
| Minimum Essential Medium (MEM) | GIBCO,Life Technology | 11095-080 | |
| PBS | GIBCO,Life Technology | 10010-023 | |
| FBS | GIBCO,Life Technology | 10437-028 | |
| Zeocin | Invitrogen,Life Technology | R250-01 | |
| Trypsin | GIBCO,Life Technology | 25300-54 | |
| IVIS | Xenogen-Caliper | ||
| Insulin Syringes (300 µl, 28.5 g) | Becton Dickinson | 309300 | |
| Mice | Charles River Laboratories, Inc | ||
| Alcohol Swabs | MEDEquip Depot | 326895 BD | |
| PVP Iodine Prep Pad | MEDEquip Depot | C12400PDI | |
| Surgical CatGut Chromic Suture | Demetech | CC224017F0P | |
| Matrigel | Corning | 354248 |
Références
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- Andrieu, C., et al. Heat shock protein 27 confers resistance to androgen ablation and chemotherapy in prostate cancer cells through eIF4E. Oncogene. 29 (13), 1883-1896 (2010).
- Fusi, A., et al. Treatment options in hormone-refractory metastatic prostate carcinoma. Tumori. 90 (6), 535-546 (2004).
- Hughes, C., Murphy, A., Martin, C., Sheils, O., O'Leary, J. Molecular pathology of prostate cancer. J Clin Pathol. 58 (7), 673-684 (2005).
- Pavese, J., Ogden, I. M., Bergan, R. C. An orthotopic murine model of human prostate cancer metastasis. J Vis Exp. (79), e50873 (2013).
- Pettaway, C. A., et al. Selection of highly metastatic variants of different human prostatic carcinomas using orthotopic implantation in nude mice. Clin Cancer Res. 2 (9), 1627-1636 (1996).
- Rembrink, K., Romijn, J. C., van der Kwast, T. H., Rubben, H., Schroder, F. H. Orthotopic implantation of human prostate cancer cell lines: a clinically relevant animal model for metastatic prostate cancer. Prostate. 31 (3), 168-174 (1997).
- Kim, S. J., et al. Blockade of epidermal growth factor receptor signaling in tumor cells and tumor-associated endothelial cells for therapy of androgen-independent human prostate cancer growing in the bone of nude mice. Clin Cancer Res. 9 (3), 1200-1210 (2003).
- Kim, S. J., et al. Targeting platelet-derived growth factor receptor on endothelial cells of multidrug-resistant prostate cancer. J Natl Cancer Inst. 98 (11), 783-793 (2006).
- Park, S. I., et al. Targeting SRC family kinases inhibits growth and lymph node metastases of prostate cancer in an orthotopic nude mouse model. Cancer Res. 68 (9), 3323-3333 (2008).
- Zhang, J., et al. AFAP-110 is overexpressed in prostate cancer and contributes to tumorigenic growth by regulating focal contacts. J Clin Invest. 117 (10), 2962-2973 (2007).
- Park, S. I., Kim, S. J., McCauley, L. K., Gallick, G. E. Pre-clinical mouse models of human prostate cancer and their utility in drug discovery. Curr Protoc Pharmacol. Chapter 14, Unit 14.15 (2010).
- Johnson, L. C., et al. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48 (1), 141-151 (2011).
- Steinbauer, M., et al. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin Exp Metastasis. 20 (2), 135-141 (2003).
- Yang, M., et al. A fluorescent orthotopic bone metastasis model of human prostate cancer. Cancer Res. 59 (4), 781-786 (1999).
- Stephenson, R. A., et al. Metastatic model for human prostate cancer using orthotopic implantation in nude mice. J Natl Cancer Inst. 84 (12), 951-957 (1992).
- Hoffman, R. M. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic. Invest New Drugs. 17 (4), 343-359 (1999).
- Wang, X., An, Z., Geller, J., Hoffman, R. M. High-malignancy orthotopic nude mouse model of human prostate cancer LNCaP. Prostate. 39 (3), 182-186 (1999).
- An, Z., Wang, X., Geller, J., Moossa, A. R., Hoffman, R. M. Surgical orthotopic implantation allows high lung and lymph node metastatic expression of human prostate carcinoma cell line PC-3 in nude mice. Prostate. 34 (3), 169-174 (1998).
- Kim, S. J., et al. Reduced c-Met expression by an adenovirus expressing a c-Met ribozyme inhibits tumorigenic growth and lymph node metastases of PC3-LN4 prostate tumor cells in an orthotopic nude mouse model. Clin Cancer Res. 9 (14), 5161-5170 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon