Method Article
人前列腺癌的临床前原位小鼠模型
摘要
Prostate cancer is the second most common cause of cancer-related deaths in the United States. An orthotopic cancer model provides a useful approach to understand the biology of prostate cancer and to evaluate the efficacy of therapeutic regimens. This protocol describes detailed steps necessary to establish an orthotopic prostate cancer mouse model.
摘要
To study the multifaceted biology of prostate cancer, pre-clinical in vivo models offer a range of options to uncover critical biological information about this disease. The human orthotopic prostate cancer xenograft mouse model provides a useful alternative approach for understanding the specific interactions between genetically and molecularly altered tumor cells, their organ microenvironment, and for evaluation of efficacy of therapeutic regimens. This is a well characterized model designed to study the molecular events of primary tumor development and it recapitulates the early events in the metastatic cascade prior to embolism and entry of tumor cells into the circulation. Thus it allows elucidation of molecular mechanisms underlying the initial phase of metastatic disease. In addition, this model can annotate drug targets of clinical relevance and is a valuable tool to study prostate cancer progression. In this manuscript we describe a detailed procedure to establish a human orthotopic prostate cancer xenograft mouse model.
引言
前列腺癌是美国男性中癌症死亡(9%)的第二最常见的原因,旁边的肺和支气管(28%)1的癌症。根据最近的数据,估计是220,800初诊前列腺癌病例和27,540死亡将发生在2015年1。早期前列腺癌的五个年相对存活率为> 99%,而晚期转移性疾病是只有28%1。治疗晚期转移性疾病的一个主要挑战是缺乏对本病的基本倾向的转移到其它器官,尤其是对骨骼,这是前列腺癌的一个频繁的部位分子机制的认识。因此,有一个明确的需要研究这些前列腺肿瘤的分子组成,以发展对发展有效的治疗方案,以先进的转移性疾病2,3。
前列腺肿瘤展览HIGħ生物异质没有明确定义的途径发展。转移往往与肿瘤的侵袭性4事先没有迹象发生。此临床异质性是由于前列腺癌的分子多样性。了解这些致命肿瘤的分子组成是设计出更好的诊断和治疗策略对本病的关键。因此,前列腺癌的研究目前主要集中在了解和预防转移。
临床前活体小鼠模型提供了多种选择,以了解前列腺癌的进展,以先进的转移性疾病的分子机制。此外,这些模型是对这种疾病的新的治疗策略的临床前评估重要。最常用的动物模型包括转基因小鼠模型,尾静脉注射,心内注入和人类原位小鼠模型。转基因研究是时间consumi纳克以及与人类的小鼠的前列腺癌的发展的相关性表明变性11。在自发转移小鼠模型,将细胞直接注射到循环和虽然,他们具有快速的周转时间,它们不能被用来研究在原发肿瘤或转移级联5的初始步骤。原位异种移植模型有显影骨转移灶,前列腺癌转移的常见部位的限制。然而,人类的原位前列腺癌异种移植的小鼠模型是充分表征的,并广泛用于研究原发性肿瘤发展,肿瘤和器官的微环境中,转移性疾病和使用的实验性药物用于治疗性干预6的初始相位之间的串扰的分子事件,7,8-11。
研究方案
涉及动物的所有程序协议必须经过审核并通过机构动物护理和使用委员会(IACUC)的批准。按照照顾和使用实验动物的正式批准程序。帧内前列腺注射需要开腹部手术和动物应与在适当的手术无菌技术在整个过程期间使用的指定手术室保持在无病原体的环境中。
1.细胞植入的制备
注意:基于研究的需要,可使用任何前列腺癌细胞系。细胞系是根据供应商的说明进行培养。
- 对于稳定表达萤火虫萤光素酶基因的PC3M吕克-C 6细胞系,在最低必需培养基(MEM)中培养的细胞在补充有10%胎牛血清(FBS),1×非必需氨基酸,1×腐草霉素D1和1mM的丙酮酸钠。维持细胞在培养箱瓦特第i个95%空气和5% 的 CO 2在37℃的湿润气氛中。 PC3M - 吕克·-C6细胞从加州大学旧金山分校的核心设备采购。
- 收获细胞胰蛋白酶消化。用磷酸盐缓冲盐水(PBS)洗涤培养板一次。用95%空气和5%CO 2的潮湿气氛中在37℃下加2ml的0.05%胰蛋白酶至10cm皿并孵育3-5分钟的培养箱直到细胞分离。
- 为了避免结块,不通过敲击或振动的菜,而等待的细胞分离搅动细胞。收集细胞在5ml完全培养基,并降速在200×g下5分钟。用PBS洗涤细胞沉淀,除去胰蛋白酶。
- 通过台盼蓝排除法一一列举活细胞。混合10微升在PBS中的细胞悬浮液与0.4%的10微升(重量/体积)台盼蓝溶液。加载混合物成血球或计数室滑动件和在显微镜下立即计数细胞或阅读在细胞凑腔室滑动NTER。
- 制备含有2.5×10 5个细胞于10微升培养基的细胞悬浮液。混合10微升基底膜样胞外基质提取物中的细胞悬浮液,然后将细胞在冰上。注射到小鼠中之前;(库存30毫克/毫升浓度200μl的1)添加荧光素的细胞悬浮液。
注意:这允许动物的即时生物成像检查不同的实验组之间的细胞注射的一致性。注入细胞尽快,优选在30分钟胰蛋白酶消化后自细胞活力脱离后迅速下降。
- 制备含有2.5×10 5个细胞于10微升培养基的细胞悬浮液。混合10微升基底膜样胞外基质提取物中的细胞悬浮液,然后将细胞在冰上。注射到小鼠中之前;(库存30毫克/毫升浓度200μl的1)添加荧光素的细胞悬浮液。
2.手术区的制备
- 在促进无菌整洁,消毒面积进行手术。
- 消毒术前漂白粉溶液计数器/实验室工作台。
注意:使用酒精是泄气因生效(15分钟)所需的接触时间长。 - 使用无菌单,清洁吸收垫或毛巾,每个手术后会更换这些材料。消毒,使用前所有仪器。优选的方法是蒸汽高压釜中,玻璃珠灭菌,环氧乙烷气体,或过氧化氢蒸汽消毒。
- 使用清洁无菌解剖显微镜进行外科手术或有经验的研究人员可以不用显微镜执行它。
3.肿瘤细胞移植
- 男性使用6-8周龄免疫缺陷的Balb / c或NOD / SCID小鼠。
注:它是对较小的动物,以及较大的动物操作更加困难往往具有肿瘤生长和转移的较慢动力学。 - 根据动物设施的指令注入手术前的止痛药。例如,可使用的剂量为0.1毫克/公斤体重腹膜内丁丙诺啡。
- 通过在氧和WA将它们放置在一个异氟烷室用1-3%异氟烷麻醉动物直到动物完全麻醉。确保有在这一点上的肌肉张力的无趾反射。使用适当的兽医眼药膏,防止润滑油全身麻醉期间,由于干眼症失明。
注意:由研究者的优选方法例如麻醉动物,对于戊巴比妥钠,0.05毫克每克体重施用腹膜内或氯胺酮/甲苯噻嗪溶液(浓度:17.16毫克/毫升),剂量为65毫克/千克体重经皮下使用。异氟醚麻醉是一个首选方法。该眼药膏应无摩擦角膜被轻轻涂抹。 - 从异氟烷室取出动物并放入在氧气1-2%异氟醚的连续流动的鼻锥装置,以确保动物是全身麻醉下实施,然后再继续。
- 通过剃须删除小鼠毛发或开始操作之前,使用脱毛膏。
注:这将是最好放置在无菌加热垫鼠标手术过程中。
- 通过剃须删除小鼠毛发或开始操作之前,使用脱毛膏。
- 放置鼠标在仰卧位置。清洗,用10%的下腹部W W,随后用70%乙醇拭子/聚维酮碘溶液。
- 有一对细镊子,抬起的皮肤区域的包皮接头2毫米的位置,约1-2厘米的阴茎鞘的上方,并且肋笼的底部低于约2-3厘米。
- 使一个中线切口1cm的长度,首先通过用解剖刀的皮肤,然后通过肌肉层用剪刀( 图1)。
- 定位在体腔内的膀胱。它是一种黄色的,浅棕色球形器官,直接位于切口( 图1)下。
- 有一对细钳子把持的膀胱和向下抬起向上再出朝向阴茎鞘体腔。这将会使两个精囊这是一双白色囊状器官和明显不同。
- 随着棉签每手,外部化精囊,一个接一个,拉出来的体腔,躺在它们面朝下在中间膀胱( 图2)腹部的外表面。
- 使用棉签轻轻在膀胱颈附近插入点向后倾斜的精囊,朝向阴茎鞘,使两背侧前列腺叶都清晰可见。用湿棉签,以避免组织损伤( 图3)。
- 在装入注射器搅拌前用微量细胞悬液。
- 而用棉签将精囊中的位置,将注射器针头插入显微镜下背侧前列腺叶( 图4)。缓缓注入20微升细胞悬浮液,直到泡的形成被识别。一个鼓鼓的大泡表明,注射是正确的。
- 同时轻轻缩回针头,按注射部位上棉签并保持几秒钟,以防止泄漏。
- 小心地提起用棉签精囊和由一个后跟膀胱插回到体腔之一。避免"捻转'内脏,而执行此过程。
- 放置器官回进入体腔后,在用可吸收4-0铬肠线缝合接着皮肤缝合以非吸收性4-0尼龙手术缝线断续图案的第一缝合肌肉层。皮肤也能够一起拉出并与手术夹子闭合以完全关闭切口。
注:小鼠有划伤和在它们的伤口,这可能会导致重新开口的伤口,因此,使用组织胶的咬的习惯,还建议连同缝线。图像动物立即以确保有各实验组之间的平等生物发光的强度。 - 返回动物清洁笼子,并保持他们变暖灯或下热ING垫。监视动物不断,直到它们完全从麻醉中恢复并保持胸骨斜卧。
4.动物监测
- 定期监测这些动物直到试验结束时,根据机构的协议。如果使用的手术金属夹,一到两周后拆下。实验的持续时间取决于具体的研究需要。
注:此实验21天进行,探讨在小鼠前列腺成功建立植入癌细胞。 - 管理基于所述动物设施的指示的止痛药。例如,在剂量为0.1毫克/公斤体重腹膜内丁丙诺啡可以在与第二剂量的步骤的时间后6小时和附加剂量根据需要使用的每8-12小时。
- 监测动物体重,食品消费,皮肤颜色和质地,活动及排尿和排便次数。动物实施安乐死IMMEDiately如果有体重大于15%的显著损失。
- 安乐死,在流速从加压罐递送的 CO 2进入的未挤笼来置换腔室或笼体积/分钟的10-30%,从而使无意识和完整narcotization发生的 CO 2慢慢进入腔室之前死亡。
- 维持二氧化碳流为呼吸停止后至少一分钟,离开动物在腔室足够长的时间,使得前执行物理方法时发生的死亡。
- 执行斩首,颈椎脱位或任何其他IACUC化学安乐死动物批准后的物理方法。
注:显着降低体重常提示病情昏昏欲睡。荷瘤动物应该在良好卫生除了肿瘤的存在,直到实验结束。安乐死应该是关于安乐死的AVMA指引一致,且不能清单当然d。在批准IACUC协议。
动物5.非侵入性生物成像
- 监测动物每周使用非侵入性成像技术来跟踪癌细胞,肿瘤的生长和任何远处转移的定植。
注:可以基于特定的研究中使用成像方式如GFP成像,萤光素酶的成像,X射线或3D显微计算机断层摄影术(UCT) 等需要12-15。
结果
以下PC3M吕克-C6细胞原位植入后前列腺叶,将小鼠每周用活的动物生物发光成像系统,以监测细胞的定居和肿瘤生长超过实验的过程中( - B 图5A)成像。生物发光信号的定量分析表明,PC3M - 吕克 - C6细胞成功殖民前列腺叶。增加生物发光是指示增加原发性肿瘤生长在实验中( 图5B)的过程中的。根据研究目的,小鼠可以每周非侵入性通过射线照相,荧光或发光成像监测,以监测肿瘤生长和任何远处转移病灶。可以与此模型可以实现其它参数是:在体重并用实验过程中食物消耗的改变;对肿瘤的大小和重量的药物治疗的效果;量化在实验结束时肿瘤的大小和重量的; DNA / RNA /蛋白质的提取,以确定在实验结束后的原发肿瘤内部发生的分子变化。
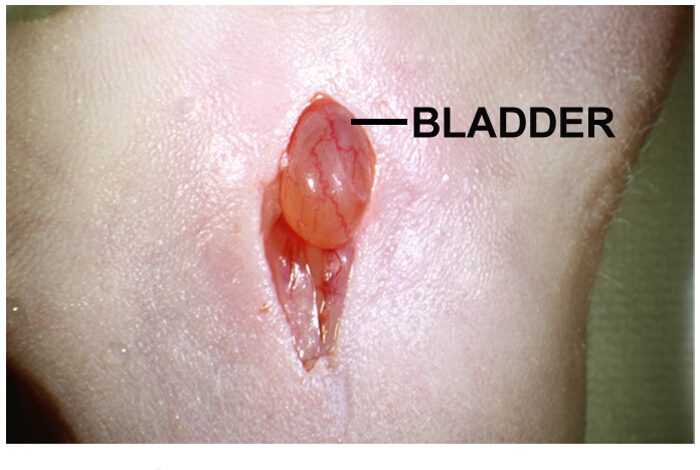
图 1: 对肿瘤细胞的帧内前列腺植入腹部中线切口腹部中线切口是约1-2厘米长。膀胱是直接下切口。轻柔按压切口两侧有助于突出膀胱。 请点击此处查看该图的放大版本。

图2: 精囊安排在TRA-前列腺肿瘤细胞的植入。精囊是白色囊样器官并位于直接邻近于膀胱。精囊的外置用棉签和左右设置在中心膀胱。 请点击此处查看该图的放大版本。

图3:前列腺的鼻背在插入点,轻轻朝向阴茎鞘向后倾斜精囊使两背侧前列腺叶都清晰可见。用湿棉签,以避免组织损伤。 请点击此处查看该图的放大版本。
图4:。 肿瘤细胞内部,前列腺植入肿瘤细胞注射到前列腺背叶请点击此处查看该图的放大版本。

图5: 在 内部植入前列腺模型 体内 生物发光成像 (A)体内荧光素酶标记PC3M -吕克- C6细胞后,小鼠在实验时间,当然生物发光图像被植入到裸鼠前列腺背侧叶。生物发光信号(B)定量显示,PC3M -吕克- C6细胞成功殖民统治前列腺与人口增加编原位肿瘤生长在实验的过程中。 请点击此处查看该图的放大版本。
讨论
这份手稿描述了建立人体原位前列腺癌异种移植小鼠模型的详细过程。该模型是由人前列腺癌细胞系PC3M吕克-C 6的直接植入建立到免疫缺陷小鼠的背侧前列腺叶。肿瘤被允许开发在实验的过程中。在实验过程中的肿瘤生长每周监测由非侵入性生物发光成像系统。
在建立异种移植肿瘤模型中最重要的因素是整个肿瘤细胞的植入实现的一致性。以获得统计学显著的结果,各试验组应包含5-10小鼠和肿瘤大小的变化不应超过平均肿瘤大小的10%以上。为了实现这一目标,该协议中的某些关键步骤是重要的,如:i)进行面积的手术,在手术过程中促进无菌; II)细胞应该是transplanteð尽快从文化脱离后; ⅲ)注射体积应该是一致的;四)进出体腔细胞的植入过程中的内部器官的小心吊装;五)所有的动物应该使用相同的技术和一名调查员注射;六)动物应该被随机分为肿瘤细胞植入后的实验组。
可能出现的一些问题是:i)肿瘤完全不发展或肿瘤结节中的肠系膜或体腔开发; II)不均匀肿瘤大小相同的实验组中观察到的; III)可能有高手术相关的死亡率。这些问题可以通过采取简单的措施,例如被克服:ⅰ)测试细胞培养物与支原体等的任何污染; ⅱ)防止肿瘤细胞悬浮液进入喷射期间肠系膜和腹腔的泄漏; ⅲ)搅拌各注射器装载前的细胞悬浮液;四)适当的麻醉用量应FOLlowed和加热垫应该用于在手术过程中,以保持体温。
各种各样的数据可以被收集利用该模型根据特定的研究目标,包括小鼠体重,食物消耗,肿瘤大小和重量,在有助于肿瘤的生长以及局部淋巴结转移10肿瘤细胞的遗传和分子变化16。霍夫曼和他的团队开发了外科原位移植(SOI)的技术,并已广泛使用这种技术移植的主要类型的人类癌症包括前列腺癌,膀胱癌和肾癌的啮齿类动物17的组织学,完整片段。这些原位车型有优势的转基因或皮下小鼠模型,因为它们准确地反映临床癌症18,19。这些模型也被用来直接从患者采取的瘤移植到免疫缺陷骑着车的相应器官NTS。原位模型也很适合研究药物治疗对肿瘤生长及淋巴结转移10的影响。它们也可用于检查改变的基因表达的离体的影响,并确定其对肿瘤发生率的影响以及帧内前列腺生长和转移20是有用的。然而,原位前列腺癌模型的一个限制是,没有这样的模型已经报道导致自发转移到骨是用于前列腺癌转移12的最频繁的部位。
未能实现骨转移,可能是由于任何骨转移灶可以开发前死亡的尿路梗阻的小鼠中,或因为鼠标的微环境未能概括人微环境,从而不能开发骨转移12。然而,这种模式的确在概括转移级联的早期事件栓塞和肿瘤细胞进入之前进入循环,因此是一个有价值的工具来研究原发灶,转移转化和新的治疗策略10,12的临床前评估的早期过程。
披露声明
作者宣称,他们没有竞争的经济利益。
致谢
We thank Dr. Roger Erickson for his support and assistance with the preparation of the manuscript. This work was supported by the National Cancer Institute at the National Institutes of Health through grant numbers RO1CA160079, RO1CA138642, UO1CA184966 and VA funded program project number 1P1 BX001604.
材料
| Name | Company | Catalog Number | Comments |
| PC3 prostate cancer cell line | ATCC | CRL-1435 | |
| Minimum Essential Medium (MEM) | GIBCO,Life Technology | 11095-080 | |
| PBS | GIBCO,Life Technology | 10010-023 | |
| FBS | GIBCO,Life Technology | 10437-028 | |
| Zeocin | Invitrogen,Life Technology | R250-01 | |
| Trypsin | GIBCO,Life Technology | 25300-54 | |
| IVIS | Xenogen-Caliper | ||
| Insulin Syringes (300 µl, 28.5 g) | Becton Dickinson | 309300 | |
| Mice | Charles River Laboratories, Inc | ||
| Alcohol Swabs | MEDEquip Depot | 326895 BD | |
| PVP Iodine Prep Pad | MEDEquip Depot | C12400PDI | |
| Surgical CatGut Chromic Suture | Demetech | CC224017F0P | |
| Matrigel | Corning | 354248 |
参考文献
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- Andrieu, C., et al. Heat shock protein 27 confers resistance to androgen ablation and chemotherapy in prostate cancer cells through eIF4E. Oncogene. 29 (13), 1883-1896 (2010).
- Fusi, A., et al. Treatment options in hormone-refractory metastatic prostate carcinoma. Tumori. 90 (6), 535-546 (2004).
- Hughes, C., Murphy, A., Martin, C., Sheils, O., O'Leary, J. Molecular pathology of prostate cancer. J Clin Pathol. 58 (7), 673-684 (2005).
- Pavese, J., Ogden, I. M., Bergan, R. C. An orthotopic murine model of human prostate cancer metastasis. J Vis Exp. (79), e50873 (2013).
- Pettaway, C. A., et al. Selection of highly metastatic variants of different human prostatic carcinomas using orthotopic implantation in nude mice. Clin Cancer Res. 2 (9), 1627-1636 (1996).
- Rembrink, K., Romijn, J. C., van der Kwast, T. H., Rubben, H., Schroder, F. H. Orthotopic implantation of human prostate cancer cell lines: a clinically relevant animal model for metastatic prostate cancer. Prostate. 31 (3), 168-174 (1997).
- Kim, S. J., et al. Blockade of epidermal growth factor receptor signaling in tumor cells and tumor-associated endothelial cells for therapy of androgen-independent human prostate cancer growing in the bone of nude mice. Clin Cancer Res. 9 (3), 1200-1210 (2003).
- Kim, S. J., et al. Targeting platelet-derived growth factor receptor on endothelial cells of multidrug-resistant prostate cancer. J Natl Cancer Inst. 98 (11), 783-793 (2006).
- Park, S. I., et al. Targeting SRC family kinases inhibits growth and lymph node metastases of prostate cancer in an orthotopic nude mouse model. Cancer Res. 68 (9), 3323-3333 (2008).
- Zhang, J., et al. AFAP-110 is overexpressed in prostate cancer and contributes to tumorigenic growth by regulating focal contacts. J Clin Invest. 117 (10), 2962-2973 (2007).
- Park, S. I., Kim, S. J., McCauley, L. K., Gallick, G. E. Pre-clinical mouse models of human prostate cancer and their utility in drug discovery. Curr Protoc Pharmacol. Chapter 14, Unit 14.15 (2010).
- Johnson, L. C., et al. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48 (1), 141-151 (2011).
- Steinbauer, M., et al. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin Exp Metastasis. 20 (2), 135-141 (2003).
- Yang, M., et al. A fluorescent orthotopic bone metastasis model of human prostate cancer. Cancer Res. 59 (4), 781-786 (1999).
- Stephenson, R. A., et al. Metastatic model for human prostate cancer using orthotopic implantation in nude mice. J Natl Cancer Inst. 84 (12), 951-957 (1992).
- Hoffman, R. M. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic. Invest New Drugs. 17 (4), 343-359 (1999).
- Wang, X., An, Z., Geller, J., Hoffman, R. M. High-malignancy orthotopic nude mouse model of human prostate cancer LNCaP. Prostate. 39 (3), 182-186 (1999).
- An, Z., Wang, X., Geller, J., Moossa, A. R., Hoffman, R. M. Surgical orthotopic implantation allows high lung and lymph node metastatic expression of human prostate carcinoma cell line PC-3 in nude mice. Prostate. 34 (3), 169-174 (1998).
- Kim, S. J., et al. Reduced c-Met expression by an adenovirus expressing a c-Met ribozyme inhibits tumorigenic growth and lymph node metastases of PC3-LN4 prostate tumor cells in an orthotopic nude mouse model. Clin Cancer Res. 9 (14), 5161-5170 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。