Method Article
인간의 전립선 암의 전 임상 동소 이식 쥐 모델
요약
Prostate cancer is the second most common cause of cancer-related deaths in the United States. An orthotopic cancer model provides a useful approach to understand the biology of prostate cancer and to evaluate the efficacy of therapeutic regimens. This protocol describes detailed steps necessary to establish an orthotopic prostate cancer mouse model.
초록
To study the multifaceted biology of prostate cancer, pre-clinical in vivo models offer a range of options to uncover critical biological information about this disease. The human orthotopic prostate cancer xenograft mouse model provides a useful alternative approach for understanding the specific interactions between genetically and molecularly altered tumor cells, their organ microenvironment, and for evaluation of efficacy of therapeutic regimens. This is a well characterized model designed to study the molecular events of primary tumor development and it recapitulates the early events in the metastatic cascade prior to embolism and entry of tumor cells into the circulation. Thus it allows elucidation of molecular mechanisms underlying the initial phase of metastatic disease. In addition, this model can annotate drug targets of clinical relevance and is a valuable tool to study prostate cancer progression. In this manuscript we describe a detailed procedure to establish a human orthotopic prostate cancer xenograft mouse model.
서문
전립선 암은 옆에있는 폐와 기관지 (28 %) 1 암, 미국 남성 중 암 사망 (9 %)의 두 번째 가장 일반적인 원인이다. 최근의 데이터에 따르면, 220, 800 새로 진단 전립선 암의 경우 27, 540 사망 2015 1에서 발생할 것으로 예상된다. 고급 전이성 질환 즉 동안 초기 전립선 암 오년 상대 생존율은> 99 %이고 28 % 1. 고급 전이성 질환의 치료에 대한 주요 과제는, 특히 전립선 암 빈번한 사이트 뼈에 다른 장기로 전이이 질병의 경향을 기초 분자 메커니즘에 대한 이해의 부족이다. 따라서, 진보 된 전이성 질환 2,3-으로 진행에 대한 효과적인 치료법을 개발하기 위하여 이러한 전립선 종양의 분자 화장 공부 분명한 필요성이 존재한다.
전립선은 전시 HIG를 종양이진행에 잘 정의 된 경로가없는 시간 생물 학적 이질성. 전이는 종종 종양의 침윤 4없이 이전의 표시와 함께 발생합니다. 이 이질성은 임상 적 전립선 암의 분자 다양성에 기인한다. 이러한 치명적인 종양의 분자 메이크업을 이해하는 것은이 질병에 대한 더 나은 진단 및 치료 전략을 설계하는 열쇠입니다. 따라서, 전립선 암 연구 현재 이해 및 전이를 방지하는데 초점을 맞추고있다.
전임상 생체 내 마우스 모델 고급 전이성 전립선 암의 진행의 분자 메커니즘을 이해하기 위해 다양한 옵션을 제공한다. 또한, 이러한 모델은 본 질병에 대한 새로운 치료 전략의 임상 평가에 중요하다. 가장 흔히 사용되는 동물 모델은 트랜스 제닉 마우스 모델의 꼬리 정맥 주사, 인트라 심장 이식 인간 소성을 마우스 모델을 포함한다. 형질 전환 연구는 시간 consumi 있습니다NG 인간의 그것과 생쥐의 전립선 암 발생의 상관 관계 변화 (11)을 보여 주었다. 자발적 전이 마우스 모델에서, 세포 순환에 직접 주입되고, 이들이 신속한 처리 시간을 가질지라도, 이들은 차 종양 또는 전이성 캐스케이드 (5)의 초기 단계를 연구하기 위해 사용될 수 없다. 동소 이종 이식 모델은 뼈 전이성 병변 전립선 암 전이 공통 사이트 개발의 한계를 가지고있다. 그럼에도 불구하고, 인간의 동소 전립선 암 이종 이식 마우스 모델 잘 특성화 널리 일차 종양 발생, 종양 및 장기 미세 치료 개입 6 전이성 질환 실험 약물 사용의 초기 위상 사이의 크로스 토크 (cross-talk)의 분자 사건을 연구하는 데 사용되는 , 7,8-11.
프로토콜
동물과 관련된 모든 절차에 대한 프로토콜 검토 및 기관 동물 관리 및 사용위원회 (IACUC)의 승인을 받아야한다. 관리 및 실험 동물의 사용을 위해 공식적으로 승인 된 절차를 따르십시오. 인트라 전립선 주입 오픈 복부 수술을 필요로하며, 동물은 수술 적절한 무균 기술은 전체 과정 동안 사용되는 수술 지정된 방 무균 환경에서 유지되어야한다.
주입을위한 세포의 1. 준비
주 : 연구 필요에 따라 임의의 전립선 암 세포주가 사용될 수있다. 세포주 공급자의 지침에 따라 배양한다.
- 안정적 반딧불 루시퍼 라제 유전자를 표현하는 PC3M 룩-C6 세포주 최소 필수 매체 (MEM)에서 배양 된 세포를 10 % 태아 소 혈청 (FBS), 1X 비 필수 아미노산이 보충 된, 1X Phleomycin D1 및 1mM의 피루브산 나트륨 . 인큐베이터 w에서 셀을 유지i 번째 37 ° C에서 95 % 공기 및 5 % CO 2의 가습 된 분위기. PC3M 룩-C6 세포는 UCSF의 핵심 시설에서 조달했다.
- 트립신 처리하여 수확 세포. 인산염 완충 식염수 (PBS)로 한번 배양 접시를 씻으십시오. 세포가 분리되는 때까지 37 ° C에서 95 % 공기 및 5 % CO 2의 가습 된 분위기 인큐베이터에서 10cm 접시에 2 ml의 0.05 % 트립신을 첨가하고 3-5 분 동안 배양한다.
- 응집을 방지하기 위해, 타격 또는 세포 분리를 기다리는 동안 접시를 흔들어 세포를 선동하지 않습니다. 완전한 미디어 5ml에 세포를 수집하고 200 x g에서 5 분 동안 스핀 다운. 트립신을 제거하기 위해 PBS로 세포 펠렛을 씻으십시오.
- 은 트리 판 블루 배제 분석법에 의해 생균 열거. 0.4 %의 10 μL (중량 / V) 트리 판 블루 용액을 PBS에서 세포 현탁액 10 μL를 혼합한다. 혈구 계산 또는 챔버 슬라이드에 혼합물을 넣고 현미경으로 즉시 세포 계산 또는 셀 COU에서 챔버 슬라이드를 읽어nter.
- 10 μl의 배지에서 2.5 × 105 세포를 함유하는 세포 현탁액을 준비한다. 10 μl의 기저막과 같은 세포 외 기질 추출물과 세포 현탁액을 혼합하고 얼음에 세포를 배치합니다. 세포 현탁액에 루시페린 추가 (1 : 200 μL, 재고 30 ㎎ / ㎖ 농도) 마우스에 주입하기 전에.
참고 :이 다른 실험군 중 세포 주입의 일관성을 확인하기 위해 동물의 즉각적인 바이오 이미징을 할 수 있습니다. 세포 생존율은 박리 후에 급격히 감소 이후 트립신 처리 후, 바람직하게는 30 분 이내에 가능한 빨리 세포를 주입한다.
- 10 μl의 배지에서 2.5 × 105 세포를 함유하는 세포 현탁액을 준비한다. 10 μl의 기저막과 같은 세포 외 기질 추출물과 세포 현탁액을 혼합하고 얼음에 세포를 배치합니다. 세포 현탁액에 루시페린 추가 (1 : 200 μL, 재고 30 ㎎ / ㎖ 농도) 마우스에 주입하기 전에.
외과 영역 2. 준비
- 무균을 촉진 정돈, 소독 지역에서 수술을 수행합니다.
- 수술 전 표백제 용액으로 카운터 / 실험실 벤치를 소독.
참고 : 알코올의 사용으로 인해 효과 (15 분)을 취할 필요가 긴 접촉 시간에 실망입니다. - 멸균 커튼을 사용하여흡수 패드 나 수건을 청소하고, 각각의 수술 세션 후 이러한 자료를 대체합니다. 사용하기 전에 모든 악기를 소독. 바람직한 방법은 증기 오토 클레이브 유리 비드 살균제, 산화 에틸렌 가스, 과산화수소 증기 멸균한다.
- 수술 절차를 수행하기 위해 무균 청소 해부 현미경을 사용하거나 경험이 풍부한 연구자들은 현미경없이 수행 할 수 있습니다.
종양 세포의 주입 3
- 남성 6~8주 된 면역을 Balb / C 또는 NOD / SCID 마우스를 사용합니다.
참고 : 종양의 성장과 전이의 느린 반응 속도를 갖는 경향이 작은 동물과 큰 동물에서 작동하는 것이 더 어렵다. - 동물 시설의 지시에 따라 미리 수술 통증 약물을 주입. 예를 들어, 0.1 ㎎ / ㎏ 체중의 투여 량으로 복강 내 부 프레 놀핀 사용할 수있다.
- 산소와 웨스턴 오스트 레일 리아 1-3 %의 이소 플루 란과 함께 이소 플루 란 챔버로 배치하여 동물을 마취그것은 동물은 완전히 마취 될 때까지. 이 시점에서의 근육의 어떠한 토우 반사가 없다는 것을 보장한다. 전신 마취 중에 안구 건조증으로 인한 실명을 방지하기 위해 적절한 수의 안과 연고 윤활제를 사용합니다.
주 : 펜토 바르 비탈 나트륨을 위해, 연구자의 바람직한 방법의 예에 의해 동물을 마취는 g 체중 당 0.05 ㎎을 복강 내 또는 케타민 / 크 실라 진 용액을 투여 (농도 : 17.16 ㎎ / ㎖) 65 밀리그램의 용량 / kg 체중 피하 사용됩니다. 이소 플루 란 흡입은 마취의 바람직한 방법이다. 눈 연고 부드럽게 각막에 마찰없이 적용되어야한다. - 이소 플루 란 챔버에서 동물을 제거하고 동물을 진행하기 전에 전체 마취 있는지 확인하기 위해 산소의 1 ~ 2 %의 이소 플루 란의 연속적인 흐름과 코 콘 장치에 배치합니다.
- 면도에 의해 쥐에서 머리를 제거하거나 절차를 시작하기 전에 헤어 크림을 사용합니다.
주 : 수술 중 멸균 가열 패드에서 마우스를 배치하는 것이 바람직 할 것이다.
- 면도에 의해 쥐에서 머리를 제거하거나 절차를 시작하기 전에 헤어 크림을 사용합니다.
- 부정사 위치에 마우스를 놓습니다. 포비돈 - 요오드 용액을 70 % 에탄올 면봉 다음에 W / W 10 %와 하복부를 청소합니다.
- 미세 집게 한 쌍, 2mm 포피 선 위의 음경의 외피 위 약 1-2cm, 그리고 흉곽의 바닥 아래에 2 ~ 3 cm의 피부의 영역을 올립니다.
- 제 메스로 피부를 통해 다음 시저 (도 1)와 근육층 통해 길이 정중선 절개 1cm합니다.
- 체강에서 방광을 찾습니다. 그것은 절개 (그림 1) 바로 아래에있는 노란색 밝은 갈색 구형 기관이다.
- 미세 겸자 파지하는 한 쌍의 블래 더와 음경 시스 향해 체강에서 하방 후 상방으로 들어 올려. 이 흰색 주머니 모양의 기관의 쌍과 명확하게 구별되는 두 개의 정낭에 노출됩니다.
- 와면봉은 각 손에서 정낭 하나씩 구체화 한 체강 그들을 끌어들이 중간에 블래 더 (도 2)와 복부의 외면에 아래로 향하게 배치.
- 두 지느러미 전립선 엽 명확하게 표시되도록 면봉을 사용하여 부드럽게, 음경 피복으로, 방광의 목 근처에 삽입 지점에 정낭을 뒤로 기울이십시오. 조직 손상 (그림 3)을 방지하기 위해 젖은 면봉을 사용합니다.
- 주사기에 넣기 전에 마이크로 피펫을 가진 세포 현탁액을 교반한다.
- 면봉 위치에 정낭을 배치하는 동안, 현미경 지느러미 전립선 엽 (그림 4)에 주사기 바늘을 삽입합니다. 수포 형성이 확인 될 때까지 천천히 세포 현탁액 20 μL를 주입. X 창 수포는 주사가 올바른지을 나타냅니다.
- 와 주사 부위에 가볍게 침을 누릅니다 후퇴하는 동안몇 초 동안 면봉 길게는 누설을 방지합니다.
- 조심스럽게 면봉과 정낭을 들어 올려 방광 다음에 의해 다시 체강 하나에 삽입. 이 절차를 수행하는 동안 '달리기'내부 장기를 피하십시오.
- 체강 내로 다시 장기를 배치 한 후, 비 흡수성 4-0 나일론 봉합사와 외과 피부 폐색 하였다 흡수성 장선 4-0 크롬 봉합사와 중단 패턴 제 근육층 봉합사. 피부는 완전히 절개를 닫 함께 뽑아 외과 클램프로 닫을 수 있습니다.
참고 : 마우스는 봉합과 함께 추천 긁힘 때문에, 상처의 개방을 다시 조직 접착제의 사용 될 수 있습니다 자신의 상처에 무는 습관이있다. 이미지 동물은 즉시 모든 실험군 중 동일한 생물 발광 강도가 있음을 확신합니다. - 새장을 청소하고, 온난화 램프 또는 열에서 그들을 유지하기 위해 동물을 반환패드를 보내고. 그들이 완전히 마취에서 회복하고 흉골 드러 누움을 유지 지속적 때까지 동물을 모니터링합니다.
동물의 4. 모니터링
- 기관 프로토콜에 따라, 실험이 종료 될 때까지 주기적으로 동물을 모니터한다. 수술 금속 클립을 사용하는 경우, 1 ~ 2 주 후 제거합니다. 실험 기간은 특정 연구의 필요성에 따라 달라집니다.
주 :이 실험은 마우스에서 전립선 암세포 이식의 성공 확립을 확인 21 일간 실시 하였다. - 동물 시설의 지침에 따라 진통제를 관리 할 수 있습니다. 필요에 따라 예를 들어 0.1 ㎎ / ㎏ 체중의 투여 량으로 복강 내 부 프레 놀핀 6 시간 추가 투여 후 제 복용량 절차시 매 8-12 시간을 사용할 수있다.
- 동물 체중, 음식 소비, 피부 색깔과 질감 활성 및 소변 및 배변 빈도를 모니터한다. 동물에게 IMMED를 안락사iately 15 %보다 더 큰 체중의 상당한 손실이있는 경우.
- 안락사 무의식 완전한 마취제가 발생되도록 CO 2 천천히 챔버를 입력 할 수 있도록, 상기 챔버 또는 케이지 볼륨 / 분 10-30 %의 변위 유량 미 혼잡 케이지에 가압 된 탱크로부터 CO 2 전달 사망하기 전에.
- 호흡 정지 후 1 분 이상이 CO 흐름을 유지하고 죽음 물리적 방법을 수행하기 전에 발생되도록 충분한 시간 동안 상기 챔버에 동물을 떠난다.
- 수행 잘린, 자궁 경부 전위 또는 다른 IACUC는 화학적으로 동물을 안락사 후 물리적 방법을 승인했다.
주 : 상당히 감소 체중 종종 혼수 상태를 나타낸다. 종양 함유 동물 실험이 끝날 때까지 종양의 존재를 제외하고 건강하게해야한다. 안락사는 안락사에 AVMA 지침과 일치해야하고 liste해야합니다승인 된 IACUC 프로토콜 라.
동물의 5. 비 침습적 바이오 이미징
- 주간 암세포, 종양 성장 및 원격 전이의 정착을 추적하기 위해 비 침습성 영상화 기술을 사용하여 동물을 모니터한다.
참고 : 등 GFP 이미징, 루시 페라 이미징, X 선 또는 3D 마이크로 컴퓨터 단층 촬영 (UCT)와 같은 이미징 양식이 특정 연구에 따라 사용할 수는 12-15이 필요합니다.
결과
후방 전립선 로브로 PC3M 룩-C6 세포의 동소 이식 이후, 생쥐는 주간의 실험 과정 (- B도 5a)를 통해 세포의 정착 종양의 성장을 모니터링하는 살아있는 동물의 생물 발광 이미징 시스템을 사용하여 영상화 하였다. 생물 발광 신호의 정량화는 PC3M 룩-C6 세포가 성공적으로 전립선 로브를 식민지 것으로 나타났다. 증가 생물 발광 실험 (도 5b)에 걸쳐 증가 차 종양의 성장을 나타낸다. 연구 목표에 기초하여, 마우스는 종양 성장 및 먼 전이성 병변을 모니터링하는 방사선 형광 또는 발광 이미징에 의해 주간 비 침습적 모니터링 할 수있다. 이 모델에 의해 달성 될 수있는 다른 매개 변수는 : 체중 실험에 걸쳐 음식 섭취의 변화; 종양의 크기 및 중량에 약물 치료의 효과; 부량실험 종결시 종양 크기와 중량; DNA / RNA / 단백질의 추출 실험 종료 후 차 종양 내부에 발생하는 분자 적 변화를 결정한다.
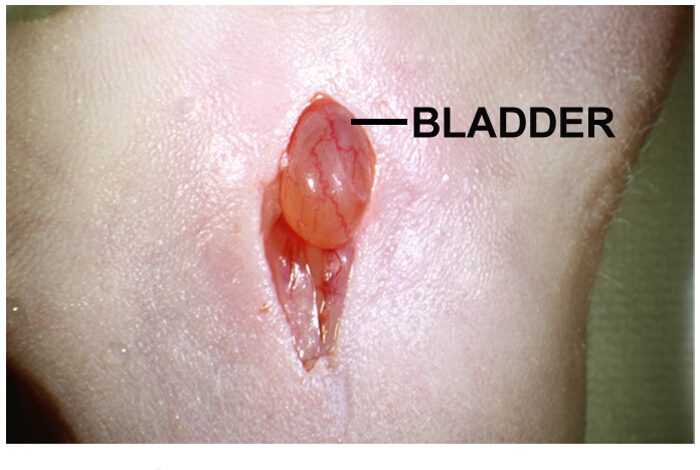
그림 1 :. 종양 세포의 내 전립선 주입 복부 정중선 절개 복부 정중선 절개는 약 1-2cm 길이입니다. 방광은 절개 바로 아래에 있습니다. 부드러운 절개의 양쪽에서 누르면 방광을 돌출하는 데 도움이됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 :에 대한 정낭의 배열TRA-전립선 종양 세포의 주입. 정낭 흰색 SAC 형상 장기이며 방광 바로 인접하여 위치된다. 정낭은 면봉으로 표면화되고 왼쪽으로 정렬과 오른쪽 중앙에있는 방광과. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 :. 두 지느러미 전립선 엽 명확하게 보이도록 전립선의 배부 삽입 시점에서 조심스럽게 음경의 외피를 향해 정낭을 뒤로 기울이십시오. 조직의 손상을 방지하기 위해 젖은 면봉을 사용합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 :.. 종양 세포의 내부 - 전립선 주입 종양 세포가 전립선의 등 로브에 주입 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5 :. 내 전립선 주입 모델의 생체 내 생물 발광 영상에서 (A)는 생체 루시 페라 표시 PC3M 룩-C6 세포 후 실험 시간의 과정을 통해 마우스의 생물 발광 이미지를 누드 마우스의 지느러미 전립선 엽에 이식했다. 생물 발광 신호의 (B) 정량은 PC3M 룩-C6 세포가 성공적으로 increas로 전립선을 식민지 보여줍니다실험의 과정을 통해 동 소성 종양의 성장을 에드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 원고는 인간의 소성을 전립선 암 이종 이식 마우스 모델을 설정하기위한 상세한 절차를 설명합니다. 이 모델은 면역 쥐의 등 전립선 로브에 인간 전립선 암 세포주 PC3M 룩-C6의 직접 주입에 의해 수립되었다. 종양은 실험의 과정을 통해 발전 할 수 있었다. 종양 성장 실험 동안에 비 침습적 생물 발광 이미징 시스템에 의해 매주 모니터링 하였다.
이종 이식 종양 모델을 확립하는데 가장 중요한 요소는 종양 세포의 주입에 걸쳐 일관성을 달성한다. 통계적으로 유의 한 결과를 얻기 위해, 각 실험 그룹은 5-10 마우스를 포함해야하고, 종양 크기의 변화는 평균 종양 크기의 10 % 이상을 초과하지 않아야한다. 이를 위해, 프로토콜 내의 몇몇 중요한 단계 같은 중요하다 : I) 수술 동안 무균 촉진 영역에서 수술을 수행; ⅱ) 세포를해야 transplante가능한 한 빨리 d를 문화로부터 분리 한 후, ⅲ) 사출 볼륨이 일치해야합니다; 세포의 주입시와 체강 중 내부 장기의 ⅳ)주의 리프팅; ⅴ) 모든 동물은 동일한 기술 한 조사원을 이용하여 주입한다; ⅵ) 동물은 종양 세포 주입 후 실험군 무작위로한다.
발생할 수있는 몇 가지 문제는 다음과 같습니다 ⅰ) 종양이 전혀 개발하지 않거나 종양 결절은 장간막이나 신체 공동으로 개발; ⅱ) 요철 종양의 크기는 동일한 실험 집단 중 관찰된다; ⅲ) 높은 수술 관련 사망률이있을 수 있습니다. 이러한 문제는 다음과 같은 간단한 조치를 취함으로써 극복 될 수있다 : 미코 플라스마 등 어떠한 오염 세포 배양 테스트) I; ⅱ) 사출 동안 장간막 및 복강에 종양 세포 현탁액의 유출을 방지; ⅲ) 각 주사기를로드하기 전에 세포 현탁액을 교반; ⅳ) 적절한 마취 용량은 FOL해야한다lowed 가열 패드 절차를 수행하는 동안 체온을 유지하는 데 사용되어야한다.
데이터의 다양한 마우스 체중, 음식 소비, 종양의 크기 및 중량, 림프절 전이 (10)뿐만 아니라, 종양 성장에 기여하는 종양 세포의 유전 및 분자의 변화를 포함하는 특정 연구 목표에 따라이 모델을 이용하여 수집 될 수있다 16. 호프만과 그의 그룹은 수술 소성을 주입 (SOI)의 기술을 개발하고 광범위하게 설치류 (17)의 전립선, 방광 및 신장 암을 포함한 인간의 암의 주요 유형의 조직 학적-그대로 조각을 이식하기 위해이 기술을 사용하고 있습니다. 그들은 정확하게 임상 암 (18, 19)를 대표로이 동 소성 모델은 형질 전환 또는 피하 마우스 모델을 통해 장점이있다. 이 모델은 또한 면역 결핍 탔다의 해당 기관에 환자에서 직접 촬영 한 종양을 이식하는 데 사용 된국세청. 동소 이식 모델은 또한 종양 성장 및 림프절 전이 10 약물 치료의 효과를 조사하기 위해 적합하다. 그들은 또한 생체 변화된 유전자 발현의 효과를 검토하고, 그 종양 발생률에 영향뿐만 아니라 인트라 전립선 성장 및 전이 (20)을 결정하는데 유용하다. 그러나, 소성을 전립선 암 모델의 제한은 이러한 모델은 전립선 암 전이 12 가장 빈번한 사이트 뼈 자발적 전이 발생할 것으로보고되어 있지 않은 점이다.
마우스의 미세 환경은 인간 미세 요점을 되풀이하지 못하기 때문에 골 전이를 달성하지 못하면 인한 전이성 병변을 개발할 수있는 뼈 전에 요로 폐색 사망 생쥐 수 있거나, 또는 이와 뼈를 개발하지 못한 12 전이. 그럼에도 불구하고,이 모델은 전 색전증 및 종양 세포의 항목에 전이성 캐스케이드의 초기 이벤트를 요점을 되풀이하지순환에 따라서하는 것은 기본 종양, 전이성 변환의 새로운 치료 전략 (10, 12)의 전임상 평가를위한 초기 과정을 공부하는 유용한 도구입니다.
공개
저자는 더 경쟁 재정적 이해 관계가 없음을 선언합니다.
감사의 말
We thank Dr. Roger Erickson for his support and assistance with the preparation of the manuscript. This work was supported by the National Cancer Institute at the National Institutes of Health through grant numbers RO1CA160079, RO1CA138642, UO1CA184966 and VA funded program project number 1P1 BX001604.
자료
| Name | Company | Catalog Number | Comments |
| PC3 prostate cancer cell line | ATCC | CRL-1435 | |
| Minimum Essential Medium (MEM) | GIBCO,Life Technology | 11095-080 | |
| PBS | GIBCO,Life Technology | 10010-023 | |
| FBS | GIBCO,Life Technology | 10437-028 | |
| Zeocin | Invitrogen,Life Technology | R250-01 | |
| Trypsin | GIBCO,Life Technology | 25300-54 | |
| IVIS | Xenogen-Caliper | ||
| Insulin Syringes (300 µl, 28.5 g) | Becton Dickinson | 309300 | |
| Mice | Charles River Laboratories, Inc | ||
| Alcohol Swabs | MEDEquip Depot | 326895 BD | |
| PVP Iodine Prep Pad | MEDEquip Depot | C12400PDI | |
| Surgical CatGut Chromic Suture | Demetech | CC224017F0P | |
| Matrigel | Corning | 354248 |
참고문헌
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- Andrieu, C., et al. Heat shock protein 27 confers resistance to androgen ablation and chemotherapy in prostate cancer cells through eIF4E. Oncogene. 29 (13), 1883-1896 (2010).
- Fusi, A., et al. Treatment options in hormone-refractory metastatic prostate carcinoma. Tumori. 90 (6), 535-546 (2004).
- Hughes, C., Murphy, A., Martin, C., Sheils, O., O'Leary, J. Molecular pathology of prostate cancer. J Clin Pathol. 58 (7), 673-684 (2005).
- Pavese, J., Ogden, I. M., Bergan, R. C. An orthotopic murine model of human prostate cancer metastasis. J Vis Exp. (79), e50873(2013).
- Pettaway, C. A., et al. Selection of highly metastatic variants of different human prostatic carcinomas using orthotopic implantation in nude mice. Clin Cancer Res. 2 (9), 1627-1636 (1996).
- Rembrink, K., Romijn, J. C., van der Kwast, T. H., Rubben, H., Schroder, F. H. Orthotopic implantation of human prostate cancer cell lines: a clinically relevant animal model for metastatic prostate cancer. Prostate. 31 (3), 168-174 (1997).
- Kim, S. J., et al. Blockade of epidermal growth factor receptor signaling in tumor cells and tumor-associated endothelial cells for therapy of androgen-independent human prostate cancer growing in the bone of nude mice. Clin Cancer Res. 9 (3), 1200-1210 (2003).
- Kim, S. J., et al. Targeting platelet-derived growth factor receptor on endothelial cells of multidrug-resistant prostate cancer. J Natl Cancer Inst. 98 (11), 783-793 (2006).
- Park, S. I., et al. Targeting SRC family kinases inhibits growth and lymph node metastases of prostate cancer in an orthotopic nude mouse model. Cancer Res. 68 (9), 3323-3333 (2008).
- Zhang, J., et al. AFAP-110 is overexpressed in prostate cancer and contributes to tumorigenic growth by regulating focal contacts. J Clin Invest. 117 (10), 2962-2973 (2007).
- Park, S. I., Kim, S. J., McCauley, L. K., Gallick, G. E. Pre-clinical mouse models of human prostate cancer and their utility in drug discovery. Curr Protoc Pharmacol. Chapter 14, Unit 14.15(2010).
- Johnson, L. C., et al. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48 (1), 141-151 (2011).
- Steinbauer, M., et al. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin Exp Metastasis. 20 (2), 135-141 (2003).
- Yang, M., et al. A fluorescent orthotopic bone metastasis model of human prostate cancer. Cancer Res. 59 (4), 781-786 (1999).
- Stephenson, R. A., et al. Metastatic model for human prostate cancer using orthotopic implantation in nude mice. J Natl Cancer Inst. 84 (12), 951-957 (1992).
- Hoffman, R. M. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic. Invest New Drugs. 17 (4), 343-359 (1999).
- Wang, X., An, Z., Geller, J., Hoffman, R. M. High-malignancy orthotopic nude mouse model of human prostate cancer LNCaP. Prostate. 39 (3), 182-186 (1999).
- An, Z., Wang, X., Geller, J., Moossa, A. R., Hoffman, R. M. Surgical orthotopic implantation allows high lung and lymph node metastatic expression of human prostate carcinoma cell line PC-3 in nude mice. Prostate. 34 (3), 169-174 (1998).
- Kim, S. J., et al. Reduced c-Met expression by an adenovirus expressing a c-Met ribozyme inhibits tumorigenic growth and lymph node metastases of PC3-LN4 prostate tumor cells in an orthotopic nude mouse model. Clin Cancer Res. 9 (14), 5161-5170 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유