Method Article
ヒト前立腺癌の前臨床同所性マウスモデル
要約
Prostate cancer is the second most common cause of cancer-related deaths in the United States. An orthotopic cancer model provides a useful approach to understand the biology of prostate cancer and to evaluate the efficacy of therapeutic regimens. This protocol describes detailed steps necessary to establish an orthotopic prostate cancer mouse model.
要約
To study the multifaceted biology of prostate cancer, pre-clinical in vivo models offer a range of options to uncover critical biological information about this disease. The human orthotopic prostate cancer xenograft mouse model provides a useful alternative approach for understanding the specific interactions between genetically and molecularly altered tumor cells, their organ microenvironment, and for evaluation of efficacy of therapeutic regimens. This is a well characterized model designed to study the molecular events of primary tumor development and it recapitulates the early events in the metastatic cascade prior to embolism and entry of tumor cells into the circulation. Thus it allows elucidation of molecular mechanisms underlying the initial phase of metastatic disease. In addition, this model can annotate drug targets of clinical relevance and is a valuable tool to study prostate cancer progression. In this manuscript we describe a detailed procedure to establish a human orthotopic prostate cancer xenograft mouse model.
概要
前立腺癌は次の肺と気管支(28%)1の癌に、米国では男性のがん死亡(9%)の第二の最も一般的な原因です。最近のデータによれば、220、800、新たに診断された前立腺癌症例27、540 deaths 2015年1で発生すると推定されている。高度な転移性疾患のことがあるが、早期前立腺癌の5年相対生存率は> 99%ですわずか28%1。高度な転移性疾患の治療のための主要な課題は、特に前立腺癌のための頻繁な部位である骨に、他の臓器に転移するために、この疾患の傾向の根底にある分子機構の理解の欠如です。したがって、高度な転移性疾患の2,3への進行に対する効果的な治療法を開発するために、これらの前立腺腫瘍の分子メイクを研究する明確な必要性があります。
前立腺腫瘍は、HIGを示します進行に明確に定義された経路のない時間生物学的異質。転移は、多くの場合、腫瘍侵襲性4の無事前の指示で発生します。この臨床的不均一性は、前立腺癌の分子多様性に起因します。これらの致死的な腫瘍の分子構成を理解することは、この疾患のためのより良い診断および治療戦略を設計するためのキーです。したがって、前立腺癌の研究は、現在、理解および転移を予防に焦点を当てています。
前臨床in vivoでのマウスモデルは、高度な転移性疾患に前立腺癌の進行の分子機構を理解するためのさまざまなオプションを提供しています。さらに、これらのモデルは、この疾患に対する新たな治療戦略の前臨床評価のために重要です。最も一般的に使用される動物モデルは、トランスジェニックマウスモデル、尾静脈注射、心臓内移植およびヒト同所性マウスモデルを含みます。トランスジェニックの研究では、時間consumiありますNGとヒトのそれとマウスにおける前立腺癌発生の相関が変動11を示しています。自発的転移のマウスモデルにおいて、細胞は、循環中に直接注入されると、それらは迅速なターンアラウンド時間を有するが、それらは原発腫瘍または転移カスケード5の初期段階を研究するために使用することができません。同所異種移植モデルは、骨転移病変、前立腺癌の転移の一般的なサイトの開発の制限があります。それにもかかわらず、人間の同所前立腺癌異種移植マウスモデルは、十分に特徴付けられており、広く原発腫瘍の発達、腫瘍や臓器微小環境、治療的介入の6のための転移性疾患および実験薬物の使用の初期段階の間のクロストークの分子事象を研究するために使用され、7,8-11。
プロトコル
動物に関わるすべての手続きのためのプロトコルを見直し、制度的動物実験委員会(IACUC)によって承認されなければなりません。実験動物の管理と使用のために公式に承認された手順に従ってください。前立腺内注射はオープン腹部手術を必要とし、動物は、適切な外科的無菌技術は、全体の手順の間に使用されている指定された手術室で病原体のない環境で保たれるべきです。
移植用の細胞の調製
注:研究ニーズに基づいて、いずれかの前立腺癌細胞株を使用することができます。細胞株は、供給者の指示に従って培養されます。
- 安定的にホタルルシフェラーゼ遺伝子を発現するPC3Mリュック-C6細胞株のために、最小必須培地(MEM)中の培養細胞を、10%ウシ胎児血清(FBS)、1×非必須アミノ酸、1×フレオマイシンD1及び1mMのピルビン酸ナトリウムを補充し。インキュベーターワットで細胞を維持i番目の37℃で95%空気および5%CO 2の加湿雰囲気。 PC3M-リュック-C6細胞を、UCSFの中核施設から調達されました。
- トリプシン処理により細胞を回収。リン酸緩衝生理食塩水(PBS)で1回洗浄培養プレート。細胞が剥離するまで、37℃で95%空気および5%CO 2の加湿雰囲気でインキュベーター中で10cmディッシュ2mLの0.05%トリプシンを加え、3~5分間インキュベートします。
- 凝集を回避するために、細胞を分離するために待っている間に皿を押すか、振とうすることにより細胞を攪拌しないでください。完全培地5mlに細胞を収集し、200×gで5分間スピンダウン。トリプシンを除去するためにPBSで細胞ペレットを洗浄します。
- トリパンブルー排除アッセイにより生細胞を列挙します。 0.4%の10μlのPBS中の細胞懸濁液(重量/ v)のトリパンブルー溶液10μlを混ぜます。血球計数器または計数チャンバースライドに混合物をロードし、顕微鏡下ですぐに細胞数をカウントしたり、細胞COUでチャンバースライドを読みますNTER。
- 10μlの培地に2.5×10 5個の細胞を含む細胞懸濁液を準備します。 10μlの基底膜のような細胞外マトリックス抽出物と細胞懸濁液を混合し、細胞を氷上に置きます。細胞懸濁液にルシフェリンを追加し(1:200μlの、株式を30mg / mlの濃度)をマウスに注入する前に。
注:これは異なる実験群間の細胞注射の整合性をチェックするために、動物の即時バイオイメージングを可能にします。細胞生存率は、剥離後に急激に減少するため、トリプシン処理した後、好ましくは30分以内に、できるだけ迅速に細胞を注入します。
- 10μlの培地に2.5×10 5個の細胞を含む細胞懸濁液を準備します。 10μlの基底膜のような細胞外マトリックス抽出物と細胞懸濁液を混合し、細胞を氷上に置きます。細胞懸濁液にルシフェリンを追加し(1:200μlの、株式を30mg / mlの濃度)をマウスに注入する前に。
手術領域の調製
- 無菌状態を促進整頓、消毒領域に手術を行います。
- 手術前に漂白剤溶液でカウンタ/実験台を消毒します。
注:アルコールの使用は、効果(15分)を取るために必要な長い接触時間に推奨されていません。 - 滅菌ドレープを使用して、吸収性パッドやタオルをきれいにし、それぞれの外科手術セッションの後、これらの材料を交換してください。使用前にすべての機器を滅菌します。好ましい方法は、蒸気オートクレーブ、ガラスビーズ滅菌、エチレンオキサイドガス、または過酸化水素蒸気滅菌です。
- 外科手術を行うために無菌的に洗浄解剖顕微鏡を使用するか、経験豊富な研究者が顕微鏡なしでそれを行うことができます。
腫瘍細胞の3移植
- 男性の6〜8週齢の免疫不全のBalb / CまたはNOD / SCIDマウスを使用してください。
注:これは、小さな動物を操作することはより困難である、より大きな動物は、腫瘍の増殖および転移のより遅い反応速度を有する傾向があります。 - 動物施設の指示に従って、手術前の痛みの薬を注入します。例えば、0.1 mg / kg体重の用量で腹腔内ブプレノルフィンを用いることができます。
- 酸素とWA 1-3%イソフルランでイソフルラン室にそれらを配置することによって動物を麻酔それは、動物が完全に麻酔されるまで。この時点での筋緊張のないつま先の反射がないことを確認してください。全身麻酔中に眼球乾燥症による失明を防ぐために、適切な獣医学の眼軟膏の潤滑剤を使用してください。
注:65 mg / kg体重の用量で:研究者の好ましい方法などにより動物を麻酔、ペントバルビタールナトリウムのために、グラム体重あたり0.05 mgを腹腔内またはケタミン/キシラジン溶液(17.16ミリグラム/ mlの濃度)を投与します皮下投与に使用されます。イソフルラン吸入は麻酔の好ましい方法です。眼軟膏は優しく角膜擦れることなく適用されるべきです。 - イソフルランチャンバーから動物を削除し、動物が先に進む前に、全身麻酔下にあることを確実にするために酸素中で1〜2%イソフルランの連続流とノーズコーン装置内に配置します。
- シェービングによってマウスから髪を削除するか、または手順を開始する前に、脱毛クリームを使用しています。
注:これは、手術中に滅菌加熱パッド上にマウスを配置することが好ましいであろう。
- シェービングによってマウスから髪を削除するか、または手順を開始する前に、脱毛クリームを使用しています。
- 仰臥位でマウスを置きます。ポビドンヨード溶液を70%エタノール綿棒続いw / wの10%と下腹部をきれいにしてください。
- 細かい鉗子のペアで、2ミリメートル包皮腺の上に陰茎鞘上記の約1~2センチ、および胸郭の下、以下の約2~3センチ皮膚の領域を持ち上げます。
- 最初のメスで皮膚を介して、その後、シザー( 図1)との筋肉層を介して、長さに正中切開1cmのを確認します。
- 体腔内の膀胱の位置を確認します。これは、直接切開( 図1)の下に位置する黄淡褐色球形の器官、です。
- 細かい鉗子グリップのペア膀胱と陰茎鞘に向かって体腔外に下方その後、上方に持ち上げます。これは、白い袋状の器官のペアと明確に区別されている2精嚢を公開します。
- とともに綿棒は、それぞれの手で、精嚢、一つ一つを外部化し、体腔からそれらを引き出し、それらを途中で膀胱( 図2)と腹部の外側表面上に伏せて横たわっていました。
- 綿棒を使用して、2つの背側の前立腺ローブがはっきりと見えるように優しく、陰茎鞘に向けて、膀胱頸部付近の挿入の時点で精嚢を倒します。組織損傷( 図3)を回避するために、湿った綿棒を使用してください。
- 注射器に充填する前にマイクロピペットで細胞懸濁液を攪拌します。
- 綿棒で位置に精嚢を配置しながら、顕微鏡下で背側前立腺ローブ( 図4)に注射針を挿入します。水疱形成が識別されるまで、ゆっくりと細胞懸濁液の20μLを注入します。膨らみ水疱は、注射が正しいことを示しています。
- と注射部位に軽く針、を押して後退しながら、数秒間綿棒ホールド漏れを防止します。
- 慎重に綿棒と精嚢を持ち上げ、膀胱に続く1により体腔1にそれらをバックに挿入します。この手順を実行中に内臓 'を駆け巡って」は避けてください。
- 体腔内に戻って臓器を配置した後、非吸収性4-0ナイロン縫合糸で皮膚の閉鎖に続いて吸収4-0クロム腸線縫合糸で中断したパターンの最初の筋層を縫合。皮膚はまた、完全に切開部を閉鎖するために一緒に引っ張られ、手術用クランプを閉じることができます。
注:マウスはまた、縫合糸と一緒に推奨され引っ掻き、したがって、傷の開口を再組織接着剤の使用につながる可能性があり、その傷、で噛む習慣があります。画像動物はすぐにすべての実験群間で同等の生物発光強度があることを保証します。 - ケージをきれいにし、加温ランプや熱の下でそれらを保つために動物を返します。パッドる。彼らは完全に麻酔から回復し、胸骨横臥位を維持するまで、常に動物を監視します。
動物の4モニタリング
- 制度的なプロトコルに従って、実験終了まで定期的に動物を監視します。外科的な金属製のクリップを使用している場合、1〜2週間後に削除します。実験期間は、特定の研究の必要性に依存します。
注記:この実験は、マウスの前立腺に移植癌細胞の正常な確立を検査するために21日間行いました。 - 動物施設の指示に基づいて、鎮痛薬を管理します。必要に応じて、例えば、0.1 mg / kg体重の用量で腹腔内ブプレノルフィンは、各8~12時間、6時間および追加用量後の第2の用量で手順の際に使用することができます。
- 動物体重、摂餌量、肌の色や質感、活動と排尿や排便の頻度を監視します。動物にIMMEDを安楽死させますiately 15%を超える体重の有意な損失がある場合。
- 安楽死のために、無意識と完全narcotizationが発生するようにCO 2がゆっくりとチャンバーを入力することができ、チャンバまたはケージ容積/分10〜30%を置換する流量で非混雑ケージに加圧タンクからのCO 2をお届け死の前に。
- 呼吸停止後少なくとも1分間のCO 2流れを維持し、死が前に物理的な方法を実行するに起こるように十分な時間、室内で動物を残します。
- 実行断頭、頸椎脱臼または任意の他のIACUCは、化学的に動物を安楽死させた後、物理的な方法を承認しました。
注:大幅に体重減少は、多くの場合、無気力状態を示しています。腫瘍を有する動物は、実験の終了時まで腫瘍の存在を除いて良好な健康状態であるべきです。安楽死は安楽死にAVMAガイドラインと整合的であるべきであるとLISTEでなければなりません承認されたIACUCプロトコル中のd。
5.動物の非侵襲的バイオイメージング
- 毎週の癌細胞、腫瘍増殖および任意の遠隔転移のコロニー形成を追跡するために非侵襲的イメージング技術を用いて動物を監視します。
注:このようなGFPイメージング、ルシフェラーゼイメージング、X線または3Dマイクロコンピュータ断層撮影(UCT)などのイメージングモダリティなどは特定の研究に基づいて使用することができます12月15日を必要としています。
結果
後方前立腺葉にPC3Mリュック-C6細胞の同所移植後、マウスを毎週( - B 図5A)、実験の過程で細胞のコロニー形成および腫瘍増殖をモニターするために生きている動物の生物発光イメージングシステムを用いて画像化しました。生物発光シグナルの定量化は、PC3M-リュック-C6細胞は正常前立腺ローブをコロニー形成することを示しました。増加した生物発光実験( 図5B)の経過とともに増加した原発腫瘍増殖の指標です。研究目標に基づいて、マウスは、腫瘍成長および任意の遠隔転移性の病変を監視するためにX線撮影、蛍光または発光イメージングによって毎週非侵襲的に監視することができます。このモデルを用いて達成することができる他のパラメータは次のとおりです。実験の過程にわたって体重および摂餌量の変化、腫瘍サイズおよび体重の薬物治療の効果。定量化実験終了時、腫瘍のサイズおよび重量の、実験終了後、原発腫瘍の内部に発生する分子の変化を決定するために、DNA / RNA /タンパク質の抽出。
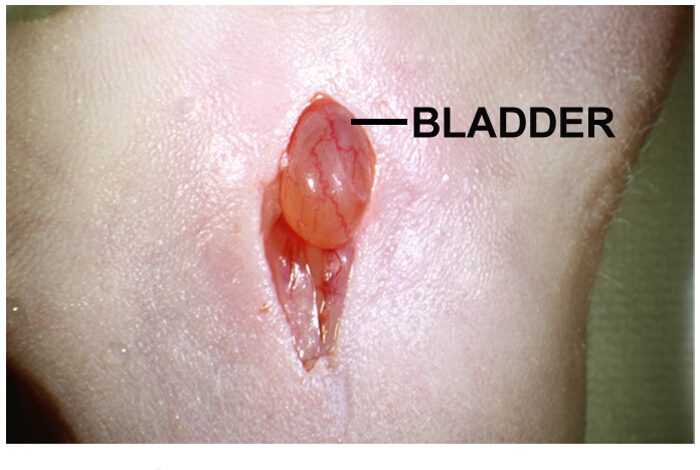
図1: 腫瘍細胞の前立腺内注入のための腹部正中切開腹部正中切開は約1〜2センチです。膀胱は、切開部の直下にあります。穏やかな切開部の両側に押すと、膀胱を突出するのに役立ちます。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2:in の精嚢の配置TRA-前立腺腫瘍細胞の移植。精嚢は白嚢のような器官であり、膀胱に直接隣接して配置されています。精嚢は、綿棒で体外に出していると左に配置され、右の中央に膀胱と。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図3:2背の前立腺ローブがはっきりと見えるように、前立腺の背挿入の時点で、優しくペニスシースに向かって精嚢を倒します。組織の損傷を避けるために、湿った綿棒を使用してください。 この図の拡大版をご覧になるにはこちらをクリックしてください。
図4: 腫瘍細胞の前立腺内注入腫瘍細胞が前立腺の背側葉に注入されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図5:実験時間の経過とともにマウスの前立腺内注入モデルの インビボ 生物発光イメージング (A) インビボ生物発光画像ルシフェラーゼ標識したPC3Mリュック-C6細胞をヌードマウスの背側前立腺葉に移植した後。 (B)生物発光シグナルの定量化は、PC3M-リュック-C6細胞が正常にincreasで前立腺を植民地化していることを示しています実験の過程にわたって同所性腫瘍の成長を編。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
この原稿は、人間の同所前立腺癌異種移植マウスモデルを確立するための詳細な手順を説明します。このモデルは、免疫不全マウスの背部前立腺ローブにヒト前立腺癌細胞株PC3Mリュック-C6の直接注入によって設立されました。腫瘍は、実験の過程で発達させました。腫瘍増殖は、実験中に非侵襲的生物発光イメージングシステムによって毎週モニターしました。
異種移植片腫瘍モデルを確立する上で最も重要な要因は、腫瘍細胞の移植を通して一貫性を達成することです。統計学的に有意な結果を得るために、各実験群は5~10匹のマウスが含まれているべきであり、腫瘍の大きさの変化は、平均腫瘍サイズの10%以上を超えてはなりません。この目標を達成するために、プロトコル内のいくつかの重要なステップは、次のような、重要です:ⅰ)手術中に無菌状態を促進する領域で手術を行います。 ⅱ)細胞はtransplanteでなければなりませんできるだけ早くdを培養物から剥離した後、 ⅲ)注入量は一貫している必要があります。細胞の注入中及び体腔のうち内臓の静脈)慎重に持ち上げ。 v)のすべての動物は、同じ技術を用いて注入し、1研究者によるべきです。 VI)動物は、腫瘍細胞移植後の実験群に無作為化されるべきです。
発生する可能性があるいくつかの問題がある:ⅰ)腫瘍が全く発生しないか、腫瘍結節は、腸間膜または体腔内で開発すること。 ⅱ)不均一な腫瘍の大きさは、同じ実験群の間で観察されました。 III)高い手術関連の死亡があってもよいです。これらの問題は、次のような単純な措置を講ずることにより克服することができます:マイコプラズマなどとの任意の汚染のための細胞培養をテストする)は、i; II)注入中腸間膜および腹腔内の腫瘍細胞懸濁液の漏れを防止します。 ⅲ)各シリンジローディング前に細胞懸濁液を攪拌します。 ⅳ)適切な麻酔の投与量は、FOLでなければなりませんlowed加熱パッドは、手順の間、体温を維持するために使用されるべきです。
データの多種多様なマウスの体重、食物消費量、腫瘍の大きさと重さ、リンパ節転移10と同様に、腫瘍の成長に貢献する腫瘍細胞における遺伝的および分子的変化を含む、特定の研究目的に応じて、このモデルを利用して収集することができます、16。ホフマンと彼のグループは、外科的同所移植(SOI)技術を開発し、広くげっ歯類で17を前立腺癌、膀胱癌および腎臓癌を含むヒトの癌の主要なタイプの組織学的に無傷の断片を移植するために、この技術を使用しています。彼らは正確に臨床癌18,19を表すように、これらの同所性モデルは、トランスジェニックまたは皮下マウスモデルを上回る利点を持っています。これらのモデルはまた、免疫不全RODEの対応する器官に患者から直接採取した腫瘍を移植するために使用されましたNTS。同所性モデルは、腫瘍の増殖およびリンパ節転移10に対する薬物治療の効果を調べるのに適しています。彼らはまた、ex vivoで遺伝子発現の変化の影響を調査し、その腫瘍発生率に対する効果ならびにイントラ前立腺増殖および転移20を決定するのに有用です。しかし、同所性前立腺癌モデルの制限は、そのようなモデルは、前立腺癌転移12のための最も頻繁な部位である骨に自然転移をもたらすことが報告されていないことです。
任意の骨転移病変が開発することができます前に、骨転移を達成するための失敗は、尿路閉塞で死亡したマウスにあってもよいし、マウスの微小環境は、人間の微小環境を再現できないため、このように骨転移12を開発することができません。それにもかかわらず、このモデルは前塞栓症および腫瘍細胞のエントリに転移カスケードにおける初期の事象を再現ません循環へと、したがって、転移性転換の初期過程を、原発腫瘍を研究し、新しい治療戦略10,12の前臨床評価のための貴重なツールです。
開示事項
著者は、彼らが競合する金融利害関係を持たないことを宣言します。
謝辞
We thank Dr. Roger Erickson for his support and assistance with the preparation of the manuscript. This work was supported by the National Cancer Institute at the National Institutes of Health through grant numbers RO1CA160079, RO1CA138642, UO1CA184966 and VA funded program project number 1P1 BX001604.
資料
| Name | Company | Catalog Number | Comments |
| PC3 prostate cancer cell line | ATCC | CRL-1435 | |
| Minimum Essential Medium (MEM) | GIBCO,Life Technology | 11095-080 | |
| PBS | GIBCO,Life Technology | 10010-023 | |
| FBS | GIBCO,Life Technology | 10437-028 | |
| Zeocin | Invitrogen,Life Technology | R250-01 | |
| Trypsin | GIBCO,Life Technology | 25300-54 | |
| IVIS | Xenogen-Caliper | ||
| Insulin Syringes (300 µl, 28.5 g) | Becton Dickinson | 309300 | |
| Mice | Charles River Laboratories, Inc | ||
| Alcohol Swabs | MEDEquip Depot | 326895 BD | |
| PVP Iodine Prep Pad | MEDEquip Depot | C12400PDI | |
| Surgical CatGut Chromic Suture | Demetech | CC224017F0P | |
| Matrigel | Corning | 354248 |
参考文献
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- Andrieu, C., et al. Heat shock protein 27 confers resistance to androgen ablation and chemotherapy in prostate cancer cells through eIF4E. Oncogene. 29 (13), 1883-1896 (2010).
- Fusi, A., et al. Treatment options in hormone-refractory metastatic prostate carcinoma. Tumori. 90 (6), 535-546 (2004).
- Hughes, C., Murphy, A., Martin, C., Sheils, O., O'Leary, J. Molecular pathology of prostate cancer. J Clin Pathol. 58 (7), 673-684 (2005).
- Pavese, J., Ogden, I. M., Bergan, R. C. An orthotopic murine model of human prostate cancer metastasis. J Vis Exp. (79), e50873 (2013).
- Pettaway, C. A., et al. Selection of highly metastatic variants of different human prostatic carcinomas using orthotopic implantation in nude mice. Clin Cancer Res. 2 (9), 1627-1636 (1996).
- Rembrink, K., Romijn, J. C., van der Kwast, T. H., Rubben, H., Schroder, F. H. Orthotopic implantation of human prostate cancer cell lines: a clinically relevant animal model for metastatic prostate cancer. Prostate. 31 (3), 168-174 (1997).
- Kim, S. J., et al. Blockade of epidermal growth factor receptor signaling in tumor cells and tumor-associated endothelial cells for therapy of androgen-independent human prostate cancer growing in the bone of nude mice. Clin Cancer Res. 9 (3), 1200-1210 (2003).
- Kim, S. J., et al. Targeting platelet-derived growth factor receptor on endothelial cells of multidrug-resistant prostate cancer. J Natl Cancer Inst. 98 (11), 783-793 (2006).
- Park, S. I., et al. Targeting SRC family kinases inhibits growth and lymph node metastases of prostate cancer in an orthotopic nude mouse model. Cancer Res. 68 (9), 3323-3333 (2008).
- Zhang, J., et al. AFAP-110 is overexpressed in prostate cancer and contributes to tumorigenic growth by regulating focal contacts. J Clin Invest. 117 (10), 2962-2973 (2007).
- Park, S. I., Kim, S. J., McCauley, L. K., Gallick, G. E. Pre-clinical mouse models of human prostate cancer and their utility in drug discovery. Curr Protoc Pharmacol. Chapter 14, Unit 14.15 (2010).
- Johnson, L. C., et al. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48 (1), 141-151 (2011).
- Steinbauer, M., et al. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin Exp Metastasis. 20 (2), 135-141 (2003).
- Yang, M., et al. A fluorescent orthotopic bone metastasis model of human prostate cancer. Cancer Res. 59 (4), 781-786 (1999).
- Stephenson, R. A., et al. Metastatic model for human prostate cancer using orthotopic implantation in nude mice. J Natl Cancer Inst. 84 (12), 951-957 (1992).
- Hoffman, R. M. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic. Invest New Drugs. 17 (4), 343-359 (1999).
- Wang, X., An, Z., Geller, J., Hoffman, R. M. High-malignancy orthotopic nude mouse model of human prostate cancer LNCaP. Prostate. 39 (3), 182-186 (1999).
- An, Z., Wang, X., Geller, J., Moossa, A. R., Hoffman, R. M. Surgical orthotopic implantation allows high lung and lymph node metastatic expression of human prostate carcinoma cell line PC-3 in nude mice. Prostate. 34 (3), 169-174 (1998).
- Kim, S. J., et al. Reduced c-Met expression by an adenovirus expressing a c-Met ribozyme inhibits tumorigenic growth and lymph node metastases of PC3-LN4 prostate tumor cells in an orthotopic nude mouse model. Clin Cancer Res. 9 (14), 5161-5170 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved