Method Article
Präklinische Orthotopische Mausmodell der menschlichen Prostata-Krebs
In diesem Artikel
Zusammenfassung
Prostate cancer is the second most common cause of cancer-related deaths in the United States. An orthotopic cancer model provides a useful approach to understand the biology of prostate cancer and to evaluate the efficacy of therapeutic regimens. This protocol describes detailed steps necessary to establish an orthotopic prostate cancer mouse model.
Zusammenfassung
To study the multifaceted biology of prostate cancer, pre-clinical in vivo models offer a range of options to uncover critical biological information about this disease. The human orthotopic prostate cancer xenograft mouse model provides a useful alternative approach for understanding the specific interactions between genetically and molecularly altered tumor cells, their organ microenvironment, and for evaluation of efficacy of therapeutic regimens. This is a well characterized model designed to study the molecular events of primary tumor development and it recapitulates the early events in the metastatic cascade prior to embolism and entry of tumor cells into the circulation. Thus it allows elucidation of molecular mechanisms underlying the initial phase of metastatic disease. In addition, this model can annotate drug targets of clinical relevance and is a valuable tool to study prostate cancer progression. In this manuscript we describe a detailed procedure to establish a human orthotopic prostate cancer xenograft mouse model.
Einleitung
Prostatakrebs ist die zweithäufigste Todesursache bei Krebserkrankungen (9%) bei den Männern in den Vereinigten Staaten, neben Krebs der Lunge und Bronchien (28%) 1. Nach jüngsten Daten, es wird geschätzt , dass 220, 800 neu Prostatakrebs diagnostizierten Fälle und 27 540 Todesfälle im Jahr 2015 1. Das fünfjährige Überlebensrate von Prostatakrebs im Frühstadium auftreten wird , ist> 99% , während die von fortgeschrittenen metastasierten Erkrankung ist nur 28% 1. Eine große Herausforderung für die Behandlung von fortgeschrittenen metastasierten Erkrankung ist der Mangel an Verständnis der molekularen Mechanismen, die die Neigung dieser Krankheit zugrunde liegen auf andere Organe metastasieren, vor allem auf den Knochen, die eine häufige Website für Prostatakrebs ist. Daher gibt es eine klare Notwendigkeit , die molekulare Make - up dieser Prostatatumoren zu untersuchen , um wirksame therapeutische Behandlungen gegen Progression zu fortgeschrittenen metastasierten Erkrankung 2,3 zu entwickeln.
Prostata-Tumoren zeigen high biologische Heterogenität ohne einen gut definierten Weg zur Progression. Metastasen treten häufig ohne vorherige Angabe des Tumorinvasivität 4. Diese klinische Heterogenität wird auf die molekulare Vielfalt von Prostatakrebs zurückzuführen. die molekulare Make-up dieser tödlichen Tumoren zu verstehen ist der Schlüssel zu entwerfen bessere diagnostische und therapeutische Strategien für diese Krankheit. Folglich wird der Prostatakrebsforschung derzeit auf dem Verstehen und zur Verhinderung der Metastasierung.
Präklinische in vivo Mausmodellen bieten eine Vielzahl von Optionen , um die molekularen Mechanismen der Progression von Prostatakrebs zu fortgeschrittenen metastasierten Erkrankung zu verstehen. Darüber hinaus sind diese Modelle wichtig für die präklinische Auswertungen neuer therapeutischer Strategien gegen diese Krankheit. Die am häufigsten verwendeten Tiermodelle umfassen transgene Mausmodelle, Schwanzvenen-Injektion, intra-Herz-Implantation und die menschliche orthotoper Mausmodellen. Transgene Studien Zeit consuming und Korrelation der Entwicklung von Prostatakrebs bei Mäusen mit dem des Menschen haben 11 Variabilität gezeigt. Bei spontanen metastatischen Maus - Modellen werden die Zellen direkt in den Kreislauf injiziert und obwohl sie eine schnelle Durchlaufzeit haben, können sie nicht den Primärtumor oder die ersten Schritte in der metastatischen Kaskade 5 zu studieren verwendet werden. Orthotopische Xenotransplantatmodellen haben die Einschränkung Knochen Metastasen zu entwickeln, die gemeinsame Website von Prostatakrebs Metastasen. Nichtsdestoweniger ist der menschliche orthotope Prostatakrebs - Xenotransplantat - Mausmodell gut charakterisiert und häufig die molekularen Ereignisse des Primärtumorentwicklung, Übersprechen zwischen Tumor und Organ - Mikroumgebung, initiale Phase der Metastasierung und die Verwendung von experimentellen Arzneimitteln für die therapeutische Intervention 6 bis Studie verwendet , 7,8-11.
Protokoll
Protokolle für alle Verfahren mit Tieren müssen überprüft und von einem Institutional Animal Care und Use Committee (IACUC) genehmigt werden. Folgen Sie offiziell genehmigten Verfahren für die Pflege und Verwendung von Labortieren. Intra-Prostata-Injektion erfordert offene Bauchchirurgie und Tiere sollten in einer keimfreien Umgebung mit einem bestimmten Operationssaal, wo die richtige chirurgische aseptischer Techniken während des gesamten Verfahrens verwendet werden, gehalten werden.
1. Herstellung von Zellen für die Implantierung
Hinweis: Basierend auf der Forschung Notwendigkeit, jede Prostatakrebs-Zelllinie verwendet werden kann. Zellinien kultiviert werden gemäß den Anweisungen des Lieferanten.
- Für die PC3M-Luc-C6-Zelllinie, die das Glühwürmchen-Luciferase-Gen stabil exprimiert, Kulturzellen in Minimum Essential Medium (MEM), ergänzt mit 10% fötalem Rinderserum (FBS), 1x Nicht-essentielle Aminosäuren, 1x Phleomycin D1 und 1 mM Natriumpyruvat . Pflegen Sie Zellen in einem Inkubator with einer befeuchteten Atmosphäre von 95% Luft und 5% CO 2 bei 37 ° C. PC3M-Luc-C6-Zellen wurden von UCSF Core Facility beschafft.
- Ernten Sie die Zellen durch Trypsinierung. Waschen Kulturplatten einmal mit phosphatgepufferter Salzlösung (PBS). 2 ml 0,05% Trypsin zu einer 10 cm Schüssel und Inkubation für 3-5 min in einem Inkubator mit einer angefeuchteten Atmosphäre von 95% Luft und 5% CO 2 bei 37 ° C bis Zellen abgelöst werden.
- Um zu vermeiden, Verklumpung, nicht agitieren Zellen nicht durch Schlagen oder das Gericht Schütteln während des Wartens auf Zellen zu lösen. Sammeln Sie die Zellen in 5 ml komplettem Medium und Spin-Down für 5 Minuten bei 200 x g. Waschen des Zellpellets mit PBS Trypsin zu entfernen.
- Auflisten von lebenden Zellen durch Trypanblau-Ausschluss-Assay. Mischen 10 ul der Zellsuspension in PBS mit 10 & mgr; l von 0,4% (wt / v) Trypanblau-Lösung. Legen Sie die Mischung in einem Hämozytometer oder Zählkammer Dia- und zählen Zellen unmittelbar unter dem Mikroskop oder lesen Sie die Kammer Folie in einer Zelle counter.
- Vorbereitung einer Zellsuspension , die 2,5 x 10 5 Zellen in 10 ul Medium. Mischen Sie die Zellsuspension mit 10 ul Basalmembran-ähnlichen extrazellulären Matrix-Extrakt und legen Sie die Zellen auf Eis. Hinzufügen, Luciferin zu der Zellsuspension (1: 200 & mgr; l; stock 30 mg / ml Konzentration), bevor sie in Mäuse injiziert wird.
HINWEIS: Diese ermöglicht die sofortige Bio-Imaging von Tieren, die Konsistenz von Zellinjektionen unter verschiedenen Versuchsgruppen zu überprüfen. Injizieren Zellen so schnell wie möglich, vorzugsweise innerhalb von 30 min nach der Trypsinierung da die Lebensfähigkeit der Zellen schnell nach der Ablösung abnimmt.
- Vorbereitung einer Zellsuspension , die 2,5 x 10 5 Zellen in 10 ul Medium. Mischen Sie die Zellsuspension mit 10 ul Basalmembran-ähnlichen extrazellulären Matrix-Extrakt und legen Sie die Zellen auf Eis. Hinzufügen, Luciferin zu der Zellsuspension (1: 200 & mgr; l; stock 30 mg / ml Konzentration), bevor sie in Mäuse injiziert wird.
2. Vorbereitung des OP-Bereich
- Führen Operation in einem aufgeräumten, desinfiziert Bereich, der Asepsis fördert.
- Desinfizieren Sie den Zähler / Labortisch mit Bleichlösung vor der Operation.
HINWEIS: Die Verwendung von Alkohol ist entmutigt durch lange Kontaktzeit wirksam wird (15 min). - Verwenden sterilen Tüchern,reinigen resorbierbaren Pads oder Handtücher, und ersetzen Sie diese Materialien nach jeder chirurgischen Sitzung. Sterilisieren alle Instrumente vor dem Gebrauch. Bevorzugte Verfahren sind ein Dampfautoklav, Glasperlen Sterilisator, Ethylenoxidgas oder Wasserstoffperoxid Dampfsterilisation.
- Verwenden Sie ein aseptisch gereinigt Binokular das chirurgische Verfahren oder erfahrenen Forschern durchführen kann es ohne Mikroskop durchführen.
3. Die Implantation von Tumorzellen
- Verwenden Sie männlich 6-8 Wochen alt immunsupprimierten Balb / c oder NOD / SCID-Mäusen.
HINWEIS: haben langsamere Kinetik des Tumorwachstums und der Metastasierung Schwieriger ist es bei kleineren Tieren und größere Tiere dazu neigen, zu betreiben. - Injizieren Vorchirurgischer Schmerzmittel gemäß den Anweisungen des Tieranlage. Beispielsweise intra-peritoneal Buprenorphin in einer Dosis von 0,1 mg / kg Körpergewicht eingesetzt werden.
- Anesthetize Tiere, indem sie in einer Isofluran Kammer mit 1-3% Isofluran in Sauerstoff und wa platzierenes bis die Tiere vollständig betäubt. Stellen Sie sicher, dass es an dieser Stelle keine Zehe Reflex des Muskeltonus ist. Verwenden Sie geeignete veterinärAugenSalbe Schmiermittel Blindheit aufgrund xerophthalmia während der Narkose zu verhindern.
HINWEIS: Anesthetize die Tiere durch das bevorzugte Verfahren zum Beispiel für den Prüfer, für Pentobarbital - Natrium, 0,05 mg pro Gramm Körpergewicht verabreicht intraperitoneale oder Ketamin / Xylazin - Lösung (Konzentration: 17,16 mg / ml) in einer Dosis von 65 mg / kg Körpergewicht subkutan verwendet wird. Isofluran Inhalation ist ein bevorzugtes Verfahren zur Anästhesierung. Die Augensalbe sanft ohne Reiben an der Hornhaut angewendet werden soll. - Zu entfernen, das Tier aus der Kammer Isofluran und in einen Nasenkonus Vorrichtung mit kontinuierlichen Fluss von 1-2% Isofluran in Sauerstoff, um sicherzustellen, dass das Tier unter Vollnarkose ist, bevor fortgefahren wird.
- Entfernen Sie Haare von Mäusen durch Rasieren oder verwenden Sie eine Haarentfernungscreme vor Beginn des Verfahrens.
HINWEIS: Es wäre vorzuziehen, die Maus auf einem sterilen Heizkissen während der Operation zu setzen.
- Entfernen Sie Haare von Mäusen durch Rasieren oder verwenden Sie eine Haarentfernungscreme vor Beginn des Verfahrens.
- Bewegen Sie die Maus in Rückenlage. Reinigen der Unterleib mit 10% w / w Povidon-Jod-Lösung durch 70% Ethanol gefolgt Tupfern.
- Mit einem Paar feinen Pinzette, heben einen Bereich der Haut, 2 mm über der Präputialdrüse, ca. 1-2 cm über der Penishülle, und etwa 2-3 cm unter dem Boden des Brustkorbs.
- Machen Sie einen Mittelschnitt 1 cm in der Länge, zuerst durch die Haut mit einem Skalpell und dann durch die Muskelschicht mit einer Schere (Abbildung 1).
- Suchen Sie die Blase in der Körperhöhle. Es ist ein gelb-hellbraun kugelförmige Organ, befindet sich direkt unter dem Einschnitt (Abbildung 1).
- Mit einem Paar feinen Pinzette greifen die Blase und nach oben heben dann nach unten aus der Körperhöhle in Richtung der Penishülle. Dadurch werden die beiden Samenbläschen freizulegen, die ein Paar weiße sackartige Organe und deutlich verschieden sind.
- Mit einemWattestäbchen in jeder Hand, externalisieren die Samenbläschen, eins nach dem anderen, und ziehen Sie sie aus der Körperhöhle und legen sie auf der äußeren Oberfläche des Bauches mit der Blase in der Mitte (Abbildung 2) nach unten zeigen .
- Mit den Wattestäbchen, kippen sanft die Samenbläschen an dem Punkt der Einfügung in der Nähe des Blasenhalses zurück, in Richtung der Penishülle, so dass die beiden dorsalen Prostatalappen deutlich sichtbar sind. Verwenden Sie nassen Wattestäbchen zu Gewebeschäden (Abbildung 3) zu vermeiden.
- Agitieren die Zellsuspension mit einer Mikropipette, bevor sie in die Spritze geladen wird.
- Während die Samenbläschen in Position mit einem Wattestäbchen platzieren, legen Sie die Spritzennadel in die dorsale Prostatalappen unter dem Mikroskop (Abbildung 4). Langsam 20 ul Zellsuspension injizieren, bis eine Blasenbildung identifiziert. Ein prall Bulla zeigt an, dass die Injektion korrekt ist.
- Während das Zurückziehen der Nadel, drücken Sie leicht auf die Injektionsstelle mitein Wattestäbchen und Halt für einige Sekunden ein Auslaufen zu verhindern.
- Heben Sie vorsichtig die Samenbläschen mit Wattestäbchen und legen Sie sie zurück in die Körperhöhle eines nach dem anderen durch die Blase folgte. Vermeiden Sie 'wirbeln' die inneren Organe während der Durchführung dieses Verfahrens.
- die Organe wieder in die Körperhöhle, vernähen der Muskelschicht zunächst in einem unterbrochenen Muster mit absorbierbaren 4-0 Chrom Catgutnähte gefolgt von der Hautverschluss mit nicht absorbierbaren 4-0 Nylon chirurgisches Naht nach der Platzierung. Die Haut kann auch zusammen und schloss mit chirurgischen Klammern gezogen werden, um den Einschnitt vollständig zu schließen.
HINWEIS: Die Mäuse haben eine Gewohnheit von Kratzen und Beißen an ihre Wunde, die Wiedereröffnung der Wunde führen kann, also von Gewebekleber verwenden, ist auch mit Nähten empfohlen zusammen. Bild Tiere sofort, um sicherzustellen, dass es gleich Biolumineszenz-Intensität unter allen Versuchsgruppen. - Bringen Sie die Tiere Käfige zu reinigen und halten sie unter einer Wärmelampe oder Wärmeing-Pad. Überwachen Sie die Tiere ständig, bis sie vollständig aus der Narkose erholen und Brustlage halten.
4. Überwachung von Tieren
- Überwachen Sie die Tiere regelmäßig bis zum Ende des Experiments, nach institutionellen Protokolle. Wenn chirurgische Metallklammern verwenden, nach ein bis zwei Wochen zu entfernen. Dauer des Experiments hängt von der spezifischen Forschungsbedarf.
Hinweis: Dieses Experiment 21 Tage lang durchgeführt wurde, die erfolgreiche Etablierung der implantierten Krebszellen in der Prostata Maus zu untersuchen. - Verwalten Schmerzmittel auf Basis der Anweisungen des Tieranlage. Beispielsweise intra-peritoneal Buprenorphin in einer Dosis von 0,1 mg / kg Körpergewicht kann mit einer zweiten Dosis nach 6 h und zusätzliche Dosen alle 8-12 Stunden nach Bedarf zum Zeitpunkt des Verfahrens verwendet werden.
- Überwachen Tiergewicht, Nahrungsaufnahme, Hautfarbe und Textur, Aktivität und die Häufigkeit des Wasserlassens und Defäkation. Euthanize Tiere immediately wenn es einen signifikanten Verlust an Körpergewicht von mehr als 15%.
- Für Euthanasie, liefern CO 2 aus einem unter Druck stehenden Behälter in einem nicht überfüllten Käfig mit einer Fließgeschwindigkeit von 10 bis 30% der Kammer oder des Käfigs Volumen / Minute zu verschieben, so dass CO 2 in die Kammer langsam zu betreten , so dass Bewusstlosigkeit und vollständige narcotization auftreten vor dem Tod.
- Pflegen CO 2 Fluss für mindestens eine Minute nach dem Atemstillstand wird und die Tiere in der Kammer für eine ausreichende Zeit , so dass der Tod eine physikalische Methode zur Durchführung vor auftritt.
- Führen Sie Enthauptung, Genickbruch oder eine andere IACUC genehmigt physikalische Verfahren nach den Tieren chemisch euthanizing.
HINWEIS: Deutlich reduzierte Körpergewicht zeigt oft eine lethargisch Zustand. Tumor tragende Tiere sollten mit Ausnahme der Anwesenheit von Tumoren, bis zum Ende des Experiments in guter Gesundheit zu sein. Euthanasie sollte mit den AVMA Leitlinien für Euthanasie konsistent sein und müssen listed im IACUC Protokoll genehmigt.
5. Nicht-invasive Bio-Imaging von Tieren
- Überwachen Sie die Tiere wöchentlich eine nicht-invasive Bildgebungstechnik Besiedlung von Krebszellen zu verfolgen, Tumorwachstum und jede Fernmetastasen.
HINWEIS: Imaging Modalitäten wie GFP-imaging, Luciferase Bildgebung, Röntgenstrahlen oder 3D - Mikrocomputertomographie (uCT) usw. auf der Basis der spezifischen Forschungsbedarf 12-15 verwendet werden.
Ergebnisse
Folgende orthotope Implantation PC3M-Luc-C6 - Zellen in die posterior prostatic Lappens wurden die Mäuse wöchentlich abgebildet durch ein lebendes Tier Biolumineszenz - Bildgebungssystem mit der Kolonisierung von Zellen und Tumorwachstum im Verlauf des Experiments (5A - B) zu überwachen. Die Quantifizierung des Biolumineszenz-Signal angezeigt, dass PC3M-Luc-C6-Zellen erfolgreich die Prostatalappen besiedelt. Erhöhte Biolumineszenz ist indikativ für erhöhte Primärtumorwachstum über den Verlauf des Experiments (5B). Basierend auf dem Forschungsziel können Mäuse wöchentlich nicht-invasiv durch Röntgen, Fluoreszenz oder Lumineszenz-Bildgebung überwacht werden, um das Tumorwachstum und jedem entfernten metastatischen Läsionen überwachen. Andere Parameter, die mit diesem Modell erreicht werden können, sind: Veränderungen des Körpergewichts und der Nahrungsaufnahme über den Verlauf des Experiments; Wirkung der medikamentösen Behandlung auf die Tumorgröße und Gewicht; Quantifizierungder Tumorgröße und das Gewicht bei der Beendigung des Experiments; Extraktion von DNA / RNA / Protein-molekularen Veränderungen zu bestimmen, innerhalb des primären Tumors nach der Beendigung des Experiments auftreten.
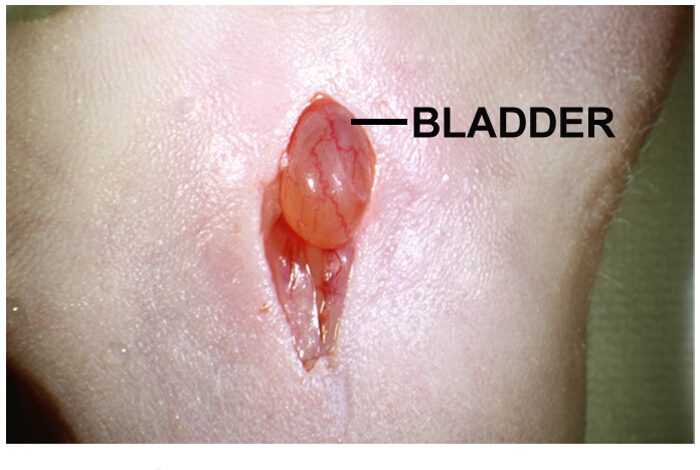
Abb . 1: Bauchmittelschnitt für die intra Prostatahyperplasie Implantation von Tumorzellen Bauchmittelschnitt beträgt ca. 1-2 cm lang. Harnblase ist direkt unter dem Schnitt. Sanft auf beiden Seiten des Einschnitts drücken hilft , die Harnblase vorzustehen. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 2: Anordnung der Samenbläschen intra-prostatische Implantation von Tumorzellen. Seminal - Vesikel sind weiße sackartige Organe und direkt angrenzend an der Blase liegt. Seminal Vesikel werden mit Wattestäbchen exteriorisiert und angeordnet links und rechts mit der Blase in der Mitte. Bitte hier klicken um eine größere Version dieser Figur zu sehen.

Abbildung 3:. Dorsum Prostata An der Stelle der Insertion, kippen sanft die Samenbläschen in Richtung der Penishülle zurück , so dass die beiden dorsalen Prostatalappen deutlich sichtbar sind. Verwenden Sie nassen Wattestäbchen zu Gewebeschäden zu vermeiden. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abb . 4:. Intra-Prostata - Implantation von Tumorzellen Tumorzellen in den dorsalen Lappen der Prostata injiziert werden Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abb . 5: In - vivo - Biolumineszenz - Bildgebung von intra-prostatischen Implantation Modell (A) In - vivo - Biolumineszenz Bilder von Mäusen über die experimentelle Zeitverlauf nach Luciferase markierten PC3M-Luc-C6 - Zellen wurden in den dorsalen Prostatalappen von Nacktmäusen implantiert. (B) Quantifizierung des Biolumineszenz - Signal zeigt , dass PC3M-Luc-C6 - Zellen erfolgreich die Prostata mit zuneh kolonisiertorthotope Tumorwachstum im Laufe des Experiments ed. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
Dieses Manuskript beschreibt ein detailliertes Verfahren für eine menschliche orthotoper Prostatakrebs-Xenotransplantat-Mausmodell zu etablieren. Dieses Modell wurde durch direkte Implantation der humanen Prostatakrebs-Zelllinie in den dorsalen Prostatalappen immunsupprimierten Mäusen PC3M-Luc-C6 gegründet. Tumoren durften über den Verlauf des Experiments zu entwickeln. Das Tumorwachstum wurde während des Versuchs wöchentlich durch eine nicht-invasive Biolumineszenz-Bildgebungssystem überwacht.
Der wichtigste Faktor bei der Festlegung Modellen Xenograft Tumor ist Konsistenz der Implantation von Tumorzellen zu erreichen. Zu erhalten, um statistisch signifikante Ergebnisse sollte jede Versuchsgruppe enthalten 5-10 Mäusen und Tumorgrößenvariation sollte nicht mehr als 10% des durchschnittlichen Tumorgröße überschreiten. Um dieses Ziel zu erreichen, einige wichtige Schritte innerhalb des Protokolls wichtig sind, wie zum Beispiel: i) die Durchführung der Operation in Bereich, der Asepsis während der Operation fördert; ii) Zellen sollte umtopfstd so bald wie möglich nach der Ablösung von Kultur; iii) Injektionsvolumen sollte konsistent sein; iv) vorsichtig Anheben der inneren Organe in die und aus der Körperhöhle während der Implantation von Zellen; v) alle Tiere sollten mit der gleichen Technik und von einem Prüfer injiziert werden; vi) sollten die Tiere in Versuchsgruppen nach der Tumorzellimplantation randomisiert werden.
Einige Probleme, die auftreten können, sind: i) Tumor entwickelt sich nicht oder Tumorknoten entwickeln im Gekröse oder Körperhöhle; ii) uneben Tumorgröße wird unter den gleichen Versuchsgruppe beobachtet; iii) es kann eine hohe Chirurgie-Mortalität sein. Diese Probleme können durch einfache Maßnahmen überwunden werden wie zum Beispiel: i) die Prüfung der Zellkultur für jede Kontamination mit Mykoplasmen usw.; ii) Verhindern einer Leckage der Tumorzellsuspension in das Mesenterium und die Bauchhöhle während des Einspritzens; iii) Rühren der Zellsuspension vor jeder Spritze Belastung; iv) geeignete Anästhesie Dosierung sollte fol seinlaubt und Heizkissen sollte verwendet werden, die Körpertemperatur während des Verfahrens aufrecht zu erhalten.
Eine Vielzahl von Daten kann unter Verwendung dieses Modells auf einem bestimmten Forschungsziel einschließlich Mausgewicht, Nahrungsaufnahme, Tumorgröße und Gewicht, genetischen und molekularen Veränderungen in den Tumorzellen abhängig gesammelt werden, sowie regionale Lymphknotenmetastasen 10 zum Tumorwachstum beitragen , 16. Hoffman und seine Gruppe entwickelte die Technik der chirurgischen orthotope Implantation (SOI) und haben ausgiebig verwendet diese Technik 17 histologisch intakten Fragmente von wichtigen Arten von menschlichen Krebserkrankungen einschließlich Prostata-, Blasen- und Nierenkrebs in den Nagern zu verpflanzen. Diese orthotoper Modelle haben Vorteile gegenüber den transgenen oder subkutane Mausmodellen , wie sie genau den klinischen Krebs 18,19 darstellen. Diese Modelle wurden auch die Tumoren direkt von den Patienten in das entsprechende Organ des immundefizienten rode genommen zu verpflanzennts. Orthotopische Modelle sind auch gut geeignet , 10 , um die Auswirkungen der medikamentösen Behandlung auf das Tumorwachstum und Lymphknotenmetastasen zu untersuchen. Sie sind auch nützlich für die Untersuchung der Wirkungen der veränderten Genexpression ex vivo, und zum Bestimmen ihrer Wirkung auf Tumorinzidenz sowie intra-prostatischen Wachstum und Metastasierung 20. Allerdings ist eine Beschränkung von orthotoper Prostatakrebs Modell , dass keine derartigen Modelle berichtet wurden spontane Metastasen in den Knochen zu führen , die die häufigste Stelle für Prostatakrebs Metastasierung 12 ist.
Failure Knochenmetastasen zu erreichen , kann aufgrund Mäuse sein Sterben von Harnwegsobstruktionen vor jeder Knochen kann Metastasen entwickeln, oder weil die Mikroumgebung der Maus , um den menschlichen Mikroumgebung zu rekapitulieren versagt, so dass in Ermangelung Knochen zu entwickeln Metastasen 12. Dennoch hat dieses Modell die frühen Ereignisse in der metastatischen Kaskade vor Embolie und Eindringen von Tumorzellen rekapitulierendie Zirkulation in und daher ist ein wertvolles Werkzeug , um den Primärtumor, frühe Prozess des metastasierten Transformation und für die präklinische Auswertungen neuer therapeutischer Strategien 10,12 zu studieren.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
We thank Dr. Roger Erickson for his support and assistance with the preparation of the manuscript. This work was supported by the National Cancer Institute at the National Institutes of Health through grant numbers RO1CA160079, RO1CA138642, UO1CA184966 and VA funded program project number 1P1 BX001604.
Materialien
| Name | Company | Catalog Number | Comments |
| PC3 prostate cancer cell line | ATCC | CRL-1435 | |
| Minimum Essential Medium (MEM) | GIBCO,Life Technology | 11095-080 | |
| PBS | GIBCO,Life Technology | 10010-023 | |
| FBS | GIBCO,Life Technology | 10437-028 | |
| Zeocin | Invitrogen,Life Technology | R250-01 | |
| Trypsin | GIBCO,Life Technology | 25300-54 | |
| IVIS | Xenogen-Caliper | ||
| Insulin Syringes (300 µl, 28.5 g) | Becton Dickinson | 309300 | |
| Mice | Charles River Laboratories, Inc | ||
| Alcohol Swabs | MEDEquip Depot | 326895 BD | |
| PVP Iodine Prep Pad | MEDEquip Depot | C12400PDI | |
| Surgical CatGut Chromic Suture | Demetech | CC224017F0P | |
| Matrigel | Corning | 354248 |
Referenzen
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- Andrieu, C., et al. Heat shock protein 27 confers resistance to androgen ablation and chemotherapy in prostate cancer cells through eIF4E. Oncogene. 29 (13), 1883-1896 (2010).
- Fusi, A., et al. Treatment options in hormone-refractory metastatic prostate carcinoma. Tumori. 90 (6), 535-546 (2004).
- Hughes, C., Murphy, A., Martin, C., Sheils, O., O'Leary, J. Molecular pathology of prostate cancer. J Clin Pathol. 58 (7), 673-684 (2005).
- Pavese, J., Ogden, I. M., Bergan, R. C. An orthotopic murine model of human prostate cancer metastasis. J Vis Exp. (79), e50873 (2013).
- Pettaway, C. A., et al. Selection of highly metastatic variants of different human prostatic carcinomas using orthotopic implantation in nude mice. Clin Cancer Res. 2 (9), 1627-1636 (1996).
- Rembrink, K., Romijn, J. C., van der Kwast, T. H., Rubben, H., Schroder, F. H. Orthotopic implantation of human prostate cancer cell lines: a clinically relevant animal model for metastatic prostate cancer. Prostate. 31 (3), 168-174 (1997).
- Kim, S. J., et al. Blockade of epidermal growth factor receptor signaling in tumor cells and tumor-associated endothelial cells for therapy of androgen-independent human prostate cancer growing in the bone of nude mice. Clin Cancer Res. 9 (3), 1200-1210 (2003).
- Kim, S. J., et al. Targeting platelet-derived growth factor receptor on endothelial cells of multidrug-resistant prostate cancer. J Natl Cancer Inst. 98 (11), 783-793 (2006).
- Park, S. I., et al. Targeting SRC family kinases inhibits growth and lymph node metastases of prostate cancer in an orthotopic nude mouse model. Cancer Res. 68 (9), 3323-3333 (2008).
- Zhang, J., et al. AFAP-110 is overexpressed in prostate cancer and contributes to tumorigenic growth by regulating focal contacts. J Clin Invest. 117 (10), 2962-2973 (2007).
- Park, S. I., Kim, S. J., McCauley, L. K., Gallick, G. E. Pre-clinical mouse models of human prostate cancer and their utility in drug discovery. Curr Protoc Pharmacol. Chapter 14, Unit 14.15 (2010).
- Johnson, L. C., et al. Longitudinal live animal micro-CT allows for quantitative analysis of tumor-induced bone destruction. Bone. 48 (1), 141-151 (2011).
- Steinbauer, M., et al. GFP-transfected tumor cells are useful in examining early metastasis in vivo, but immune reaction precludes long-term tumor development studies in immunocompetent mice. Clin Exp Metastasis. 20 (2), 135-141 (2003).
- Yang, M., et al. A fluorescent orthotopic bone metastasis model of human prostate cancer. Cancer Res. 59 (4), 781-786 (1999).
- Stephenson, R. A., et al. Metastatic model for human prostate cancer using orthotopic implantation in nude mice. J Natl Cancer Inst. 84 (12), 951-957 (1992).
- Hoffman, R. M. Orthotopic metastatic mouse models for anticancer drug discovery and evaluation: a bridge to the clinic. Invest New Drugs. 17 (4), 343-359 (1999).
- Wang, X., An, Z., Geller, J., Hoffman, R. M. High-malignancy orthotopic nude mouse model of human prostate cancer LNCaP. Prostate. 39 (3), 182-186 (1999).
- An, Z., Wang, X., Geller, J., Moossa, A. R., Hoffman, R. M. Surgical orthotopic implantation allows high lung and lymph node metastatic expression of human prostate carcinoma cell line PC-3 in nude mice. Prostate. 34 (3), 169-174 (1998).
- Kim, S. J., et al. Reduced c-Met expression by an adenovirus expressing a c-Met ribozyme inhibits tumorigenic growth and lymph node metastases of PC3-LN4 prostate tumor cells in an orthotopic nude mouse model. Clin Cancer Res. 9 (14), 5161-5170 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten