루이스 산-베이스 상호 작용 Ph3P-BH3
Overview
출처: 타마라 M. 파워스, 텍사스 A&M 대학교 화학학과
화학의 목표 중 하나는 추세를 설명하고 반응성에 기여하는 반응제의 특성에 대한 통찰력을 제공하는 모델을 사용하는 것입니다. 물질은 고대 그리스 시절부터 산과 기지로 분류되었지만 산과 기지의 정의는 수년에 걸쳐 수정되고 확장되었습니다. 1
고대 그리스인들은 맛에 의한 물질을 특성화하고, 레몬 주스와 식초와 같은 신맛으로 산을 정의했습니다. 용어 "산"은 라틴어 용어에서 파생되어 "신 맛"을 위해 파생됩니다. 염기는 산을 중화하거나 중화시키는 능력을 특징으로했다. 특징의 첫 번째 기지는 비누를 만들기 위해 지방과 혼합 된 화재에서 재의 그였다. 사실,용어 "알칼리성"은 아랍어 단어에서 파생되어 "로스팅"을 위해 파생됩니다. 실제로, 산과 기지를 결합하여 소금과 물을 줄 수 있다는 것이 고대부터 알려져 왔습니다.
산의 첫 번째 널리 사용되는 설명은 스웨덴 화학자, Svante Arrhenius의 것입니다, 누가 1894 년에 하이드로늄 이온을 제공하기 위해 물에 해리 물질로 산을 정의하고, 수산화 이온을 제공하기 위해 물에 해리 물질로 염기. 따라서 이러한 정의는 수성산으로 제한되며 산이 양성자에게 기여하는 것이 필요하다. 2 예를 들어, 물에서 HCl은 하이드로늄 이온(H3O)+ 및 염화물 이온을 제공하기 위해 해리화되기 때문에 산이다. 보론 트리클로라이드는 물에서와 같이 산으로 간주되지 않을 것이며, 물에서와 같이 B (OH)3 및 3 HCl을 제공하기 위해 가수 분해합니다. 제품 HCl 하지만 아레니우스 산.
1923년 요하네스 니콜라우스 브뢰스테드와 마틴 로리(Martin Lowry)는 수소 이온 또는 양성자를 기증하고 받아들이는 능력에 대해 산과 기지를 독립적으로 정의했습니다. 따라서 산염-염기 공수 쌍의 개념이 나왔고, 물 이외의 용매에서 산및 염기의 정의의 확장이 이루어졌다. 예를 들어, 암모늄은 양성자를 기증하고 암모니아를 생성할 수 있기 때문에 산입니다. 암모니아는 암모늄을 제공하기 위해 양성자를 받아 들일 수 있습니다. 따라서 암모니아는 암모늄의 컨쥬게이트 기저입니다. 이 산염 염기 반응은 물, 암모니아 또는 그밖 용매에서 생길 수 있습니다.
이 비디오는 1923년에 산과 기지를 정의한 미국 화학자 길버트 N. 루이스의 산염 기본 정의를 다룹니다. 사실, 이것은 일반 화학에서 루이스 도트 구조에서 같은 루이스입니다. 그의 접근 방식은 양성자를 기증하고 받아들이는 산과 기지의 능력이 아니라 전자 쌍을 각각 받아들이고 기증하는 능력에 초점을 맞추고 있습니다. 이것은 H+가 프로토 네이션 동안 Brønsted 기지에서 전자 쌍을 받아 들이기 때문에 Brønsted-Lowry 정의를 포함합니다. 그러나, 그것은 크게 산의 정의를 확장, 지금 금속 이온 및 주요 그룹 화합물을 포괄. 여기에서, 우리는 루이스 산염 제합 부관 Ph3P-BH3의 3PNMR을 무료 트리페닐포스핀과 비교합니다.
Principles
트리페닐포스핀과 보란 사이의 결합을 고려하십시오. 우리는 먼저 루이스 교관을형성하기 전에 두 분자가 어떻게 생겼는지 고려할 것입니다.
일반적인 화학에서 루이스 점 구조 및 발덴 쉘 전자 쌍 반발 (VSEPR) 이론을 기억하십시오. 트리페닐포스핀의 루이스 도트 구조는 도 1에도시되어 있다. 3페닐 고리의 각각에 인 원자와 탄소 원자 중 하나 사이에 는 3개의 공유 결합이 있습니다. 두 개의 전자 (외로운 쌍)는 옥텟을 완료하기 위해 인 원자에 상주합니다. 인 중심은 Sp3 혼성화되어 있으며 스테트헤드랄 전자 기하학을 가지며, 고독한 쌍의 전자가 Sp3 궤도에 상주한다. 트리페닐포스핀은 다른 분자에 기증될 수 있는 외로운 쌍을 가지고 있으며, 따라서 루이스 기지로분류된다.
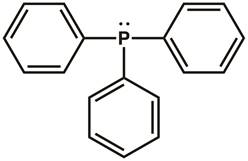
그림 1. 트리페닐포스핀의 루이스 도트 구조.
보란의 루이스 도트 구조는 도 2에도시되어 있다. 붕소 원자와 수소 원자 사이에는 세 가지 공유 결합이 있습니다. 이 경우 붕소 센터에는 6 개의 valence 전자만 있으므로 8 e- 규칙을 따르지 않습니다. 따라서 보란은 평면과 sp2 혼성화되어, SP2 궤도는 수소 원자에 결합을 형성하고 외로운 p 궤도가 비어 있다. 따라서 보란은 루이스 산이다.

그림 2. 루이스 도트 구조의 보란.
트리페닐포스핀의 인은 궤도가 가득 차 있고 붕소의 붕소가 비어 있기 때문에 루이스 산염 기반 부덕이 형성될 수 있으며, 트리페닐포스핀은 두 개의 전자를 붕소에 기증합니다. 유도가 형성되면 붕소 중심은 sp3 혼성화(수학식1)가됩니다.
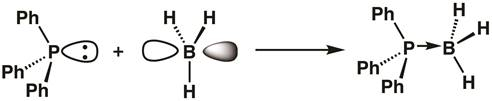 (1)
(1)
방정식 1은 루이스 산이 외로운 전자 쌍을 받아들이고 루이스 기지가 전자 쌍을 기증하는 루이스 산성의 아이디어를 보여줍니다. 때때로, 루이스 산은 전기 필로 불리고, 루이스는 뉴클레오필로 기지를 두는다. 루이스 산과 기지 사이의 결합은 종종 좌표 공유 또는 다정성 결합이라고하며 때로는 선이 아닌 화살표로 지정됩니다.
Procedure
1. 보란 트리페닐포스핀 복합체 합성을 위한 슐렌크 라인 설치
참고: 보다 자세한 절차는 유기 화학 시리즈의 "솔벤트의 슐렌크 라인 전송" 비디오를 검토하십시오. 이 실험을 수행하기 전에 Schlenk 라인 안전을 검토해야 합니다. 유리 웨어는 사용하기 전에 별 균열을 검사해야합니다. 액체N2를 사용하는 경우 O2가 슐렌크 라인 트랩에 응축되지 않도록주의해야 한다. 액체 N2 온도에서 O2는 응축되며 유기 용매가 있는 경우 폭발성입니다. O2가 응축되었거나 차가운 트랩에서 파란색 액체가 관찰된 것으로 의심되는 경우, 트랩을 동적 진공 상태에서 차갑게 둡니다. 액체 N2 트랩을 제거하거나 진공 펌프를 끄지 마십시오. 시간이 지남에 따라 액체 O2가 펌프로 증발합니다. 모든 O2가 증발한 후에만 액체 N 2 트랩을 제거하는 것이 안전합니다.
- 압력 방출 밸브를 닫습니다.
- N2 가스와 진공 펌프를 켭니다.
- 슐렌크 라인 진공이 최소 압력에 도달하면 액체 N2 또는 드라이 아이스/아세톤으로 콜드 트랩을 준비합니다.
- 차가운 함정을 조립합니다.
2. 보란 트리페닐포스핀 컴플렉스3합성
- 트리페닐포스핀 5.3g(20.3mmol)을 250mL 슐렌크 플라스크 A에 넣고 용매의 캐뉼라 전달을 위해 슐렌크 플라스크를 준비한다.
- 20mL의 건조/탈가스 THF를 슐렌크 플라스크 A에 캐뉼라 전송을 통해 추가합니다. 액액을 저어 트리페닐포스핀을 녹입니다.
- 캐뉼라 전송을 위해 1.15g(30.5mmol) NaBH4를 함유한 두 번째 슐렌크 플라스크(B)를 준비한다.
- 얼음 욕조에서 슐렌크 플라스크 A와 B를 모두 식힙니다.
- 캐뉼라슐렌크 플라스크 A의 내용을 슐렌크 플라스크 B로 옮킨다.
- 양수 N2 압력으로 슐렌크 플라스크 B의 고무 중격을 고무 중격이 장착 한 깔때기로 교체하십시오.
- 추가 깔때기에, 캐뉼라 전송에 의해 건조 / 탈가스 THF의 8 mL을 추가합니다.
- 양수 N2 압력으로, 떨어지는 깔때기의 상단에서 중격을 제거하고 추가 깔때기에 빙하 아세트산 2 mL을 추가합니다.
- 슐렌크 플라스크 B를 얼음 욕조에 넣고 THF/빙하 아세트산을 30분 이상 떨어뜨립니다. 추가 하는 동안, 거품이 발생할 수 있습니다. 이를 최소화하기 위해 반응이 활발하게 저반되고 있는지 확인하십시오.
- 추가 후, 반응을 실내 온도에 따뜻하게 하고 한 시간 동안 저어줍니다.
- 떨어지는 깔때기를 제거하고 천천히 20mL의 물을 추가합니다.
- 25mL의 물에 2mL 빙하 아세트산의 용액을 준비한다. 천천히 반응에이 혼합물을 추가합니다.
- 결정이 자발적으로 형성되지 않으면 얼음 욕조에서 반응을 식히면 결정화를 촉진하십시오.
- 프리스테드 깔때기를 통해 흡입하여 제품을 필터링합니다. 20mL의 물로 3회 세척합니다.
- NMR 분석을 위해 샘플을 준비하기 전에 제품이 후드에서 건조하도록 허용하십시오.
3. 31P NMR 분석 보란 트리페닐포스핀 복합체
- CDCl3에서트리페닐포스핀 과 보란 트리헤닐포스핀 복합체의 NMR 샘플을 준비한다.
- 각 샘플의 31P NMR을 수집하고 (인산에 참조) 삼중 포스핀의 인 신호가 보란에 조정시 이동하는 방법을 관찰한다.
Results
보란 트리헤닐포스핀 복합체:
31 P NMR (클로로폼d,500 MHz, δ, ppm): 20.7 (광역 더블트)
트리페닐포스핀:
31 P NMR (클로로폼d,500 MHz, δ, ppm): -5.43
보란 트리페닐포스핀 컴플렉스의 31P NMR 신호는 무료 트리페닐포스핀에 비해 다운필드입니다. 이것은 인 중심에서 전자 밀도의 제거와 일치, 이는 유도체 형성에 차폐된다.
Application and Summary
보란 트리헤닐포스핀 복합체는 루이스 어덕트의 한 예로, 루이스 기지가 루이스 산에 전자를 기증합니다. BH3 및 PPh3반드시 산 및 염기로 간주 되지 않을 것 이다, 각각, 다른 산 염기 이론을 사용 하 여, 루이스 산-베이스 이론 분자 안정 된 부덕을 형성 하는 정확 하 게 예측.
작은 분자 활성화:
전이 금속 이온은 역사적으로 루이스 산으로 간주되었지만 루이스 기지로 사용할 수 있다는 개념은 진보되고 있습니다. 예를 들어, 조나스 피터스와 칼텍의 동료들은 루이스 산 붕산(Z형 리간드)에 전자를 기증할 수 있는 금속 보란 복합체가 새로운 반응성을 야기할 수 있음을 보여주었습니다. 니켈 보란 종은 H-H 결합을 이질적으로 분주하게 H2를가역적으로 추가하는 것으로 나타났다. 4 H2-첨가종은 올레핀의 수소화를 위한 촉매제입니다. 이 그룹은 또한 철 보란 복합체가 암모니아에 질소를 촉매적으로 감소시킬 수 있다고 보고했다. 5 이것은 이 도전적이면서도 비판적인 반응을 위한 철계 균질성 촉매의 첫 번째 예였다.
좌절 루이스 쌍 :
연구의 또 다른 현재 영역은 "좌절 루이스 쌍", 또는 FLP의. 이들은 루이스 산 염기 "adducts" 그 때문에 stative 결합을 형성할 수 없습니다. 6 더글러스 스테판과 토론토 대학의 동료들은 특히 작은 분자 활성화 및 촉매에 사용할 것이라는 생각으로 이러한 교덕이 어떤 반응성을 가질 지 고민했습니다. 기판에서 전자 밀도를 받아들이고 기증할 수 있는 전환 금속 복합체에 대해 생각하면 반응성과 관련하여 "좌절한 루이스 페어"라고 불리는 기증자/수용자 특성이 가설되었습니다.
2006년, 스테판과 동료들은 사이언스에서 zwitterionic (C6H2Me3)2PH (C6F4)BH (C 6F5) )2 가역적으로H2를 잃어 준다고 과학에서 보고했습니다 (C6H2Me3)2P (C6F4)B (C6F5)2. 7 이는 주요 그룹 요소와 함께 뒤집을 수 있는H2 활성화의 첫 번째 예였으며, 그 밖의 예가 뒤따랐다(그림3). 이 연구는 FLP 연구의 개발을위한 길을 열었습니다. 그 이후, FLP는 유능한 수소화 촉매로 개발되었으며 CO2를포함한 다양한 소분자를 활성화할 수 있다. 이것은 연구의 적극적이고 흥미로운 새로운 분야입니다.
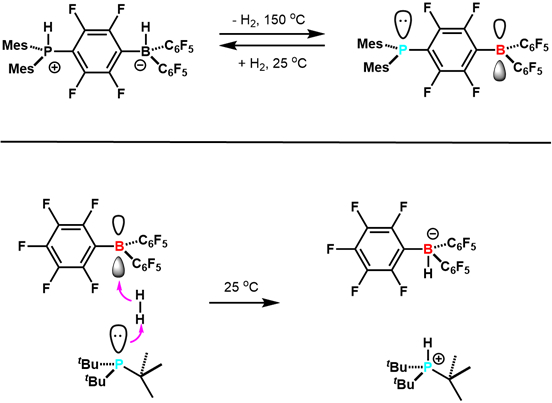
그림 3. H 2를 가진 FlP의 반응성의 초기 예. 참조 5에서 적응합니다.
References
- Lesney, Today's Chemist at Work, 2003, 47-48.
- Miessler, P. J. Fischer and D. A. Tarr, Inorganic Chemistry, Pearson, 2014.
- McNulty, J.; Zhou, Y. Tetrahedron Letters, 2004, 45, 407-409.
- Harman and J. C. Peters, J. Am. Chem. Soc., 2012, 134, 5080-5082.
- Anderson, J. Rittle and J. C. Peters, Nature, 2013, 501, 84-87.
- Stephan, J. Am. Chem. Soc., 2015, 137, 10018-10032.
- Welch, R. R. S. Juan, J. D. Masuda and D. W. Stephan, Science, 2006, 314, 1124-1126.
Tags
건너뛰기...
이 컬렉션의 비디오:

Now Playing
루이스 산-베이스 상호 작용 Ph3P-BH3
Inorganic Chemistry
38.8K Views

슐렌크 라인 기술을 이용한 티(III) 메탈로센의 합성
Inorganic Chemistry
31.5K Views

글러브박스 및 불순물 센서
Inorganic Chemistry
18.6K Views

승화에 의한 페로센정화
Inorganic Chemistry
54.3K Views

에반스 방법
Inorganic Chemistry
68.1K Views

단일 결정 및 분말 X선 회절
Inorganic Chemistry
104.0K Views

전자 파라마그네틱 공명 (EPR) 분광법
Inorganic Chemistry
25.4K Views

뫼스바우어 분광법
Inorganic Chemistry
21.9K Views

페로센의 구조
Inorganic Chemistry
79.2K Views

IR 분광기에 그룹 이론의 적용
Inorganic Chemistry
45.0K Views

분자 궤도 (MO) 이론
Inorganic Chemistry
35.2K Views

네 배 금속 - 금속 본딩 패들 휠
Inorganic Chemistry
15.3K Views

염료 감질 태양 전지
Inorganic Chemistry
15.7K Views

산소 운반 코발트 (II) 복합체의 합성
Inorganic Chemistry
51.5K Views

급진적 중합 반응의 광화학 개시
Inorganic Chemistry
16.7K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유