Ph3P BH3ルイス酸-塩基相互作用
概要
ソース: タマラ ・ m ・力、化学科テキサス A & M 大学
化学の目標の 1 つは、モデルの動向を考慮して反応に寄与する反応の性質への洞察を提供するを使用します。物質は、古代ギリシャ人の時以来酸および塩基として分類されているが、酸と塩基の定義を変更して、長年にわたって拡大します。1
古代ギリシア人は、味によって物質を特徴づける、すっぱい味、レモン汁や酢などをしたものとして酸を定義します。「酸」という用語は「サワー味」のラテン語から派生しました。拠点は、対抗する酸を中和する能力により特徴づけられた.特徴と最初の拠点は石鹸を作るための脂肪と混合された火から灰のものであった。実際には、「アルカリ」の言葉は、「焙煎」のアラビア語の単語から派生されます確かに、それはので古代時、酸と塩と水を与えるベースを組み合わせることにより、知られています。
酸の最初の広く使われている説明は、スウェーデンの化学者、Svante アレニウス物質として 1894 定義された酸の水酸化物イオンを与えるために水に解離する物質としてヒドロニウム イオンと塩基を与えるために水に解離する人のことです。この定義は、水溶液に限定したがって、酸はプロトンを貢献することが必要になります。2たとえば、水、HCl は酸、それが解離してヒドロニウム イオン (H3O) を与えると+と塩化物イオン。三塩化ホウ素とみなされないそれを B(OH)3と 3 の HCl; を与える加水分解する水と同様に、酸製品 HCl アレニウス酸のです。
1923 年に、ヨハネス ・ ニコラウス ブレンステッドとマーティン ・ ロウリー独立して定義される酸と寄付して水素イオンまたはプロトンを受け入れるする能力に基づいて。共役酸塩基対、コンセプトと酸と水以外の溶媒に塩基の定義の拡大がやってきた。たとえば、アンモニア、酸、プロトンを寄付する、アンモニアを生成できます。アンモニアはアンモニウムを与えるため、プロトンを受け入れることができます。したがって、アンモニアはアンモニウムの共役塩基であります。この酸塩基反応は、水、アンモニア、またはその他の溶剤で発生します。
このビデオは、アメリカの化学者、また 1923 年に酸と塩基を定義したギルバート ・ ルイス、酸・塩基の定義を扱います。確かに、これは一般的な化学のルイス ・ ドット構造の同じ・ ルイスです。彼のアプローチは、酸と塩基を寄付し、陽子を受け入れる能力ではなく、受け入れ、それぞれ電子組を寄付する能力ではなく焦点を当てています。H+がプロトン化時にブレンステッド ベースから電子対を受け取ると、ブレンステッド-ローリーの定義が含まれます。ただし、それは大きく今包括的な金属イオンと化合物の主要なグループ、酸の定義を展開します。ここでは、我々 は31P NMR を比較、ルイスの酸・塩基付加物 Ph3P BH3無料トリフェニルホスフィンを。
原則
トリフェニルホスフィンとボランの間結合を検討してください。最初、彼らはルイスの付加体を形成する前に両方の分子を見て検討します。
原子価殻電子対反発 (VSEPR) 理論、一般的な化学からルイス ・ ドット構造を思い出してください。トリフェニルホスフィンのルイス ・ ドット構造を図 1に示します。リン原子とそれぞれ 3 つのフェニル環の炭素原子の 1 つの間の 3 つの共有結合があります。2 つの電子 (単独 1 組) オクテットを完了するリン原子上に存在します。リンのセンターは、sp3交配させられるそして sp3軌道に存在する電子の孤立電子対との四面体の電子ジオメトリです。トリフェニルホスフィンは孤立電子対を別の分子に寄付することができます、したがってルイス基本として分類されます。
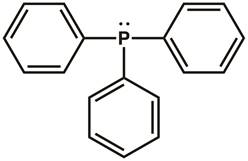
図 1.トリフェニルホスフィンのルイス ・ ドット構造。
ボランのルイス ・ ドット構造を図 2に示します。ホウ素原子と水素原子の間の 3 つの共有結合があります。この場合、ホウ素センターは六つの原子価の電子だけありしたがって 8 e-ルールに従わない。ボランはこうして平面と sp2交配、sp2軌道関数水素原子と孤独なp軌道は空に結合を形成します。ボランはルイス酸ではこうです。

図 2 。ボランのルイス ・ ドット構造。
トリフェニルホスフィン リンが塗りつぶされた軌道、ボランのボロンは空軌道が形成できますルイス酸-塩基が付加物ホウ素にその 2 つの電子を寄付トリフェニルホスフィンと。付加体形成を時に、ホウ素センターなる sp3交配させられる (式 1)。
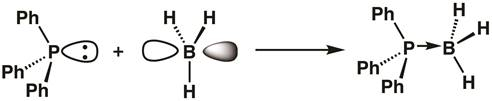 (1)
(1)
方程式 1は電子の孤立電子対を受け入れるルイス酸とルイス酸性の考えを示します、ルイス塩基の電子の寄付のペア。時々、ルイス酸、ケミカルバイオロジーと呼ばれますおよび求核試薬としてルイス基地します。ルイス酸と基盤間の結束座標の共有結合または与格結束が呼ばれ、時々 行ではなく矢印で示されます。
手順
1. シュレンク管ボラン トリフェニルホスフィン錯体の合成のためのセットアップ
注: より詳細な手順を参照してください有機化学の必需品シリーズの「Schlenk ライン転送の溶媒」ビデオ).Schlenk ラインの安全は、この実験を行う前に確認必要があります。ガラス製品は、使用する前に星のき裂検査必要があります。リキッド N2を使用している場合に、Schlenk ライン トラップに O2がない凝縮されて確保するため注意が必要があります。温液体 N2 O2凝縮し、有機溶媒存在下で爆発。O2が凝縮されているまたは青色の液体はコールド トラップで観察されることが疑われる場合は動的真空下ではコールド トラップを残します。リキッド N2トラップを取除くか、または真空ポンプ.をオフにします。ポンプに蒸発すれば液体 O2時間をかけて、それは、O2のすべてが蒸発した後、液体 N2トラップを削除しても安全になります。
- 圧力解放バルブを閉じます。
- N2ガス、真空ポンプをオンにします。
- Schlenk としてラインの真空に達するその最低気圧、液体 N2またはドライアイス/アセトンでコールド トラップを準備します。
- コールド トラップを組み立てます。
ボランの合成トリフェニルホスフィン コンプレックス3
- 250 mL Schlenk フラスコ A にトリフェニルホスフィンの 5.3 g (20.3 モル) を追加し、溶剤のカニューレ転送 Schlenk フラスコを準備します。
- 20 mL の thf のドライ/脱気をカニューレ振込 Schlenk フラスコ A に追加します。トリフェニルホスフィンを解消するソリューションをかき混ぜます。
- カニューレ転送 1.15 g (30.5 ミリ モル) NaBH4を含む 2 番目 Schlenk フラスコ (B) を準備します。
- Schlenk フラスコ A と B の両方を氷浴中で冷却します。
- カニューレは、Schlenk フラスコ B. Schlenk フラスコ A の内容を転送します。
- N2加圧とゴムキャップが装備添加漏斗で Schlenk フラスコ B にゴムキャップを置き換えます。
- 添加漏斗カニューレ譲渡によるドライ/脱 THF の 8 mL を追加します。
- 正 N2圧、添加漏斗に氷酢酸 2 mL を追加して滴下漏斗の上部から中隔を削除します。
- シュレンク管操作を維持する、氷浴中でフラスコ B 追加 THF/氷酢酸滴 30 分以上。また、中には泡が発生します。反応がこれを最小限に抑えるため積極的に広がっていることを確認します。
- また後、常温にし、さらに 1 時間撹拌反応ができます。
- 滴下漏斗を削除し、ゆっくりと 20 mL の水を追加します。
- 25 mL の水に 2 mL の氷酢酸の溶液を準備します。ゆっくりと反応にこの混合物を追加します。
- 結晶が自発的になっていない場合は、結晶化を促進するための氷浴で反応をクールします。
- ガラスフリット漏斗を介して吸引で製品をフィルターします。結果固体 20 mL の水で 3 回洗浄します。
- ボンネットの NMR 解析のサンプルを準備する前に乾燥する製品を許可します。
3 ボラン トリフェニルホスフィン複合体の31P NMR 解析。
- トリフェニルホスフィンとボラン トリフェニルホスフィン CDCl3複合体の NMR サンプルを準備します。
- 31P (リン酸を参照) 各サンプルの NMR を収集、トリフェニルホスフィン リン信号がボランにシフト調整時に方法を観察します。
結果
ボラン トリフェニルホスフィン複雑です。
31(クロロホルムは δ をd、500 MHz、ppm) P NMR: 20.7 (ブロードダブレット)
トリフェニルホスフィン
31(クロロホルムは δ をd、500 MHz、ppm) P NMR:-5.43
複雑なボラン トリフェニルホスフィンの31P NMR 信号は無料トリフェニルホスフィンを基準にして相手の攻撃です。これは電子の除去時に deshielded はリンのセンターから密度付加体形成。
申請書と概要
複雑なボラン トリフェニルホスフィンは、ルイス-付加物、ルイス塩基がルイス酸に電子を寄付するという事例です。BH3と PPh3必ずしも考慮されない酸とベース、それぞれ、他の酸塩基理論を使用して、ルイス酸塩基理論を予測正常分子が安定した付加を形成します。
小分子の活性化:
中の遷移金属イオンはルイス酸と歴史的にみなされている、ルイス塩基としても概念が進められています。たとえば、ジョナス ・ ピーターズとカリフォルニア工科大学の同僚を示しているルイス酸ボラン (Z 型配位子) に電子を寄付することが、金属ボラン錯体が新規反応性に上昇を与えることができます。可逆 H 追加2、heterolytically H 結合を切断するニッケル ボラン種を示した。4 H2-種はオレフィンの hydrogenations のための触媒を追加。グループはまた鉄ボラン錯体は触媒アンモニア窒素を低減できることを報告しました。5これはこの挑戦はまだ重要な反作用のために鉄系の均一系触媒の最初の例だった。
イライラしたルイスのペア:
研究のもう一つの現在の領域は、「イライラ ・ ルイス組」または Flp のことです。これらはルイス酸-塩基「付加体」を立体上の理由により格の債券を形成できません。6ダグラス ステファンとトロント大学から同僚を付加体のようなどのような反応があるので、特に小分子の活性化と触媒作用のそれらを使用してのアイデアを考えました。彼らはドナー/アクセプターを仮説することができます両方を受諾し、基板から電子密度を寄付、遷移金属錯体について考えて反応性に関して彼らは「イライラしたルイス ・ ペア」と呼ばれるものの特性があります。
2006 年、ステファンと同僚たちは科学の報告を両性イオン (C6H2私3)2PH (C6F4) BH (C6F5)2可逆失う H2を与えるため (C6H2私3)2P (C6F4) B (C6F5)2。7今回は主要なグループ要素を持つリバーシブル H2活性化の最初の例とその後の他の例 (図 3)。本研究では、FLP 研究の開発のための道を開いた。それ以来、Flp 開発されている有能な水素化触媒は、CO2を含む小さな分子のさまざまなをアクティブにすることができます。これは研究のアクティブでエキサイティングな新しい領域です。
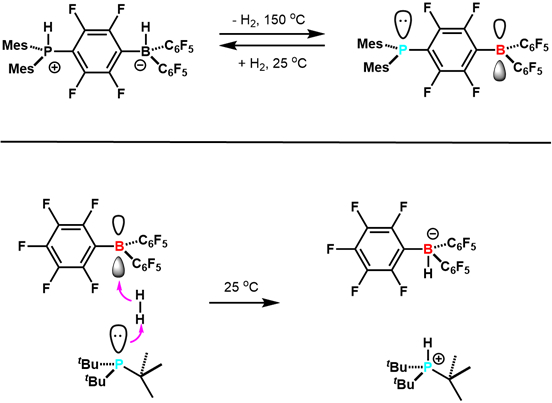
図 3。H と Flp の反応の早い例2.参照 5 から適応。
参考文献
- Lesney, Today's Chemist at Work, 2003, 47-48.
- Miessler, P. J. Fischer and D. A. Tarr, Inorganic Chemistry, Pearson, 2014.
- McNulty, J.; Zhou, Y. Tetrahedron Letters, 2004, 45, 407-409.
- Harman and J. C. Peters, J. Am. Chem. Soc., 2012, 134, 5080-5082.
- Anderson, J. Rittle and J. C. Peters, Nature, 2013, 501, 84-87.
- Stephan, J. Am. Chem. Soc., 2015, 137, 10018-10032.
- Welch, R. R. S. Juan, J. D. Masuda and D. W. Stephan, Science, 2006, 314, 1124-1126.
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
Ph3P BH3ルイス酸-塩基相互作用
Inorganic Chemistry
38.7K 閲覧数

シュレンク管を用いた Ti(III) メタロセンの合成
Inorganic Chemistry
31.5K 閲覧数

グローブ ボックスと不純物センサー
Inorganic Chemistry
18.6K 閲覧数

昇華によってフェロセンの精製
Inorganic Chemistry
54.3K 閲覧数

エバンス メソッド
Inorganic Chemistry
68.0K 閲覧数

単結晶および粉末 x 線回折
Inorganic Chemistry
103.9K 閲覧数

電子常磁性共鳴 (EPR) 分光法
Inorganic Chemistry
25.3K 閲覧数

メスバウアー分光法
Inorganic Chemistry
21.9K 閲覧数

フェロセンの構造
Inorganic Chemistry
79.1K 閲覧数

群論の赤外分光法への応用
Inorganic Chemistry
44.9K 閲覧数

分子軌道 (MO) 理論
Inorganic Chemistry
35.1K 閲覧数

Quadruply 金属-金属接合外輪
Inorganic Chemistry
15.3K 閲覧数

色素増感太陽電池
Inorganic Chemistry
15.7K 閲覧数

酸素運ぶのコバルト (ii) 錯体の合成
Inorganic Chemistry
51.5K 閲覧数

根本的な重合反応の光化学開始
Inorganic Chemistry
16.7K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved