Interaction des acides et bases de Lewis au sein du complexe Ph3P-BH3
Vue d'ensemble
Source : Tamara M. Powers, département de chimie, Texas A & M University
Un des objectifs de la chimie est d’utiliser des modèles qui représentent les tendances et donnent des indications sur les propriétés des réactifs qui contribuent à la réactivité. Des substances ont été classées comme les acides et les bases depuis l’époque de la Grèce antique, mais la définition des acides et des bases a été modifiée et élargie au cours des années. 1
Les Grecs de l’antiquité définirait les substances par goût et défini des acides que ceux qui ont le goût aigre, comme le jus de citron et le vinaigre. Le terme « acide » est dérivé du terme Latin pour « goût aigre ». Bases sont caractérisés par leur capacité à neutraliser ou à neutraliser les acides. Les premières bases caractérisés étaient ceux des cendres d’un feu, qui ont été mélangés avec les graisses pour fabriquer du savon. En fait, le terme « alcalin » est dérivé du mot arabe pour « griller ». En effet, on sait depuis les temps anciens que les acides et les bases peuvent être combinés pour donner un sel et eau.
La première description répandu d’un acide est celui de la chimiste suédois Svante Arrhenius, qui, en 1894 acides définis comme des substances qui se dissocient dans l’eau pour donner des ions hydronium et bases comme des substances qui se dissocient dans l’eau pour donner des ions hydroxyde. Cette définition est donc limitée aux acides aqueuses et nécessite qu’un acide contribuer un proton. 2 par exemple, dans l’eau, HCl est un acide, tel qu’il se dissocie pour donner l’ion hydronium (H3O)+ et l’ion chlorure. Le trichlorure de bore n’est pas considéré comme un acide, comme dans l’eau qu'il s’hydrolyse pour donner B(OH)3 et 3 HCl ; le produit HCl est un acide d’Arrhenius.
En 1923, Johannes Nicolaus Brønsted et Martin Lowry défini indépendamment des acides et des bases sur leur capacité à donner ou accepter des ions d’hydrogène, ou protons. Ainsi, est venu le concept d’acide-base paires conjuguées et l’élargissement de la définition des acides et des bases dans des solvants autres que l’eau. Par exemple, l’ammonium est un acide, car il peut donner un proton et générer l’ammoniac. L’ammoniac peut accepter un proton, pour donner d’ammonium. Ainsi, l’ammoniac est la base conjuguée de l’ammonium. Cette réaction acido-basique peut se produire dans l’eau, ammoniaque ou autres solvants.
Cette vidéo traite de la définition de l’acide-base du chimiste américain, Lewis, qui a également défini des acides et des bases en 1923. C’est d’ailleurs le même Lewis de structures de Lewis-dot en chimie générale. Son approche met l’accent non pas sur la capacité des acides et des bases à donner ou accepter des protons, mais plutôt sur leur capacité à accepter et à faire un don de paires d’électrons, respectivement. Cela englobe la définition de Brønsted-Lowry, comme H+ accepte une paire d’électron d’une base de Brønsted lors de protonation. Cependant, il élargit considérablement la définition d’un acide, qui englobe désormais des ions métalliques et composés du groupe principal. Ici, nous comparons les 31P RMN d’un Lewis acido-basique adduit Ph3P-BH3 de triphénylphosphine gratuit.
Principles
Étudier la liaison entre la triphénylphosphine et borane. Nous examinerons tout d’abord ce que les deux molécules ressemblent avant ils forment un adduit de Lewis.
Rappeler les structures de Lewis dot et la théorie de répulsion (VSEPR) de paires d’électrons couche de valence, de chimie générale. La structure de Lewis dot de triphénylphosphine est illustrée à la Figure 1. Il existe trois liaisons covalentes entre l’atome de phosphore et de l’un des atomes de carbone dans chacun des trois noyaux phényles. Deux électrons (un doublet) se trouvent sur l’atome de phosphore pour compléter l’Octuor. Le centre de phosphore est sp3 hybridé et possède une géométrie tétraédrique d’électronique, avec le doublet d’électrons résidant dans une orbitale sp3 . Triphénylphosphine a une paire d’électrons qui peut être donnée à une autre molécule et est donc considérée comme une base de Lewis.
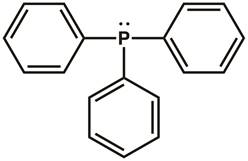
Figure 1. Structure de Lewis dot de triphénylphosphine.
La structure de Lewis dot du borane est illustrée à la Figure 2. Il existe trois liaisons covalentes entre les atomes d’hydrogène et de l’atome de bore. Dans ce cas, le centre de bore seulement a six électrons de valence et par conséquent, ne suit pas la règle 8 e– . Borane est donc plan et sp2 hybride, avec les orbitales de2 sp formant des liaisons avec les atomes d’hydrogène et le lone p orbitale étant vide. Borane est donc un acide de Lewis.

Figure 2. Structure de Lewis dot du borane.
Étant donné que le phosphore dans la triphénylphosphine a une orbitale remplie et le bore du borane possède une orbitale vide, un adduit de Lewis acido-basique peut former, avec la triphénylphosphine donnant ses deux électrons au bore. À la formation d’un adduit, le centre de bore devient sp3 hybridé (équation 1).
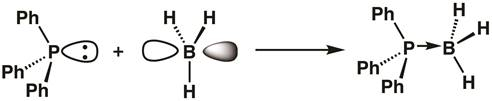 (1)
(1)
Équation 1 illustre l’idée de l’acidité de Lewis, avec des acides de Lewis acceptant des doublets d’électrons, et bases de Lewis faisant don de paires d’électrons. Parfois, les acides de Lewis sont appelés électrophiles et bases de Lewis comme nucléophiles. Les liens entre les bases et les acides de Lewis sont souvent appelés des liaisons covalentes ou datif coordonnées et sont parfois désignées avec des flèches par opposition aux lignes.
Procédure
1. installation de la ligne de Schlenk pour la synthèse du complexe triphénylphosphine Borane
Remarque : Pour une procédure plus détaillée, veuillez consulter la vidéo de « Schlenk lignes transfert de solvant » dans la série Essentials of Organic Chemistry ). Sécurité de canalisation de Schlenk devrait être révisée avant la tenue de cette expérience. Verrerie doit être inspecté pour fissures star avant d’utiliser. Il faut pour s’assurer que O2 n’est pas condensée dans le piège de ligne Schlenk si vous utilisez le liquide N2. À température2 N, O2 se condense et est explosif en présence de solvants organiques. Si l'on soupçonne que O2 a été condensée ou un liquide bleu est observé dans le piège froid, laissez le piège froid sous vide dynamique. Ne pas enlever le liquide N2 collecteur ou éteignez la pompe à vide. Au fil du temps, le liquide O2 va s’évaporer dans la pompe ; il sera sécuritaire d’enlever le piège de2 N liquid une fois tous les O2 s’est évaporée.
- Fermez le robinet de purge.
- Allumez le gaz2 N et la pompe à vide.
- Comme le Schlenk ligne vide atteint sa pression minimale, préparer le piège froid avec liquide N2 ou neige carbonique et d’acétone.
- Assembler le piège froid.
2. synthèse du Borane complexe triphénylphosphine3
- Ajouter 5,3 g (20,3 mmol) de triphénylphosphine dans un ballon de Schlenk 250 mL A et préparer le ballon de Schlenk le transfert de la canule de solvant.
- Ajouter 20 mL de THF sec/dégazé le ballon de Schlenk A par virement de la canule. Agiter la solution pour dissoudre la triphénylphosphine.
- Préparer un deuxième ballon de Schlenk (B) contenant de NaBH 1,15 g (30,5 mmol)4 pour le transfert de la canule.
- Refroidir les Schlenk fiole A et B dans un bain de glace.
- Canule de transvaser le contenu du ballon de Schlenk A dans ballon de Schlenk B.
- Avec une pression positive N2 , remplacer le bouchon en caoutchouc sur ballon de Schlenk B avec un addition entonnoir muni d’un septum en caoutchouc.
- Pour l’entonnoir de l’addition, ajoutez 8 mL de THF sec/dégazé par transfert de la canule.
- Avec une pression positive N2 , enlever la cloison du haut de l’entonnoir et ajouter 2 mL d’acide acétique glacial à l’entonnoir de l’addition.
- Maintien de Schlenk ballon B dans un bain de glace, ajouter le THF/acide acétique glacial goutte à goutte pendant 30 min. Lors de l’ajout, moussage peut se produire. Veillez à ce que la réaction est en remuant vigoureusement pour minimiser cela.
- Après l’addition, permettre la réaction à la température ambiante et mélanger pendant une heure supplémentaire.
- Retirez l’entonnoir à robinet et lentement ajouter 20 mL d’eau.
- Préparer une solution de 2 mL d’acide acétique glacial dans 25 mL d’eau. Lentement, ajouter ce mélange à la réaction.
- Si les cristaux ne se forme pas spontanément, refroidir la réaction dans un bain de glace pour favoriser la cristallisation.
- Filtrer le produit par aspiration à travers un entonnoir fritté. Laver le résultant solide avec 20 mL d’eau 3 fois.
- Laissez le produit sécher dans le capot avant la préparation de l’échantillon pour analyse par RMN.
3. analyse de NMR 31P du complexe triphénylphosphine Borane
- Préparer un échantillon de NMR de triphénylphosphine et de borane triphénylphosphine complexe dans CDCl3.
- Recueillir un 31P RMN de chaque échantillon (référencé à l’acide phosphorique) et d’observer comment le signal de phosphore de triphénylphosphine décale à la coordination de borane.
Résultats
Borane triphénylphosphine complexe :
31 RMN du (chloroforme -d, 500 MHz, δ, ppm) : 20,7 (large doublet)
Triphénylphosphine :
31 RMN du (chloroforme -d, 500 MHz, δ, ppm) :-5.43
Le signal de RMN du 31de la triphénylphosphine borane complexe est champ faible par rapport à la triphénylphosphine gratuit. Ceci est cohérent avec l’enlèvement d’électron densité depuis le centre de phosphore, qui est déblindé sur la formation d’adduits.
Applications et Résumé
La triphénylphosphine borane complexe est un exemple d’un Lewis-adduit, auquel cas une base de Lewis donne des électrons à un acide de Lewis. Bien que BH3 et PPh3 ne seraient pas nécessairement considérées un acide et la base, respectivement, à l’aide d’autres théories d’acide-base, théorie acido-basique de Lewis prédit correctement que les molécules forment un adduit stable.
Activation de petites molécules :
Tandis que les ions de métaux de transition ont historiquement été considérées comme des acides de Lewis, l’idée qu’ils peuvent servir de bases de Lewis est érigée. Par exemple, Jonas Peters et ses collaborateurs à Caltech ont montré que métal-borane complexes, qui peuvent donner des électrons pour le borane acide de Lewis (un ligand de Z-type), peuvent donner lieu à la nouvelle réactivité. Une espèce de borane nickel s’est avérée réversible ajouter H2, heterolytically clivant la liaison H-H. 4 H de la2-ajouté espèces sont un catalyseur d’hydrogénation des oléfines. Le groupe a également signalé que les complexes fer-borane peuvent réduire catalytiquement azote d’ammonium. 5 c’est le premier exemple d’un catalyseur homogène à base de fer pour cette réaction difficile, mais critique.
Paires de Lewis frustré :
Un autre domaine actuel de recherche est celui de « Paires de Lewis frustrés », ou FLPs. Voici les Lewis acide-base « adduits » qui, pour des raisons stériques, ne peut former une liaison dative. 6 Douglas Stephan et ses collègues de l’Université de Toronto réfléchi quel réactivité telle adduits aurait, en particulier avec l’idée de les utiliser pour la catalyse et l’activation de petites molécules. Penser à des complexes de métaux de transition, qui peuvent accepter et faire un don de densité électronique vers et à partir de substrats, ils l’hypothèse donneur/accepteur propriétés de ce qu’on appelle « Paires de Lewis frustrés » pourraient avoir en ce qui concerne la réactivité.
En 2006, Stephan et ses collaborateurs ont signalé en sciences qui le zwitterion (C6H2Me3)2PH (C6F4) BH (C6F5)2 perd réversiblement H2 de donner (C6H2Me3)2P (C6F4) B (C6F5)2. 7 c’est le premier exemple d’activation de2 H réversible avec des éléments du groupe principal, et d’autres exemples suivi (Figure 3). Cette étude a ouvert la voie pour le développement de la recherche FLP. Depuis lors, les FLPs ont été développés qui sont les catalyseurs d’hydrogénation compétente et peut activer une variété de petites molécules dont le CO2. Il s’agit d’un domaine de recherche nouveau actif et passionnant.
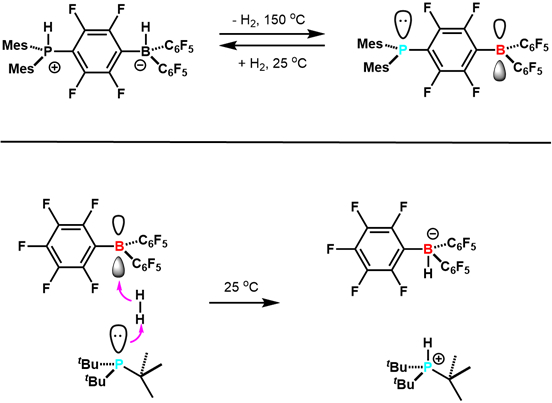
Figure 3. Les premiers exemples de réactivité de FLPs avec H2. Adapté de référence 5.
References
- Lesney, Today's Chemist at Work, 2003, 47-48.
- Miessler, P. J. Fischer and D. A. Tarr, Inorganic Chemistry, Pearson, 2014.
- McNulty, J.; Zhou, Y. Tetrahedron Letters, 2004, 45, 407-409.
- Harman and J. C. Peters, J. Am. Chem. Soc., 2012, 134, 5080-5082.
- Anderson, J. Rittle and J. C. Peters, Nature, 2013, 501, 84-87.
- Stephan, J. Am. Chem. Soc., 2015, 137, 10018-10032.
- Welch, R. R. S. Juan, J. D. Masuda and D. W. Stephan, Science, 2006, 314, 1124-1126.
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Interaction des acides et bases de Lewis au sein du complexe Ph3P-BH3
Inorganic Chemistry
38.7K Vues

Synthèse d'un métallocène de Ti(III) avec une ligne Schlenk
Inorganic Chemistry
31.5K Vues

Boîte à gants et capteurs d'impuretés
Inorganic Chemistry
18.6K Vues

Purification du Ferrocène par sublimation
Inorganic Chemistry
54.3K Vues

La méthode Evans
Inorganic Chemistry
68.0K Vues

Diffraction par rayons X : cristal vs poudre
Inorganic Chemistry
104.0K Vues

Spectroscopie par résonance paramagnétique électronique (RPE)
Inorganic Chemistry
25.4K Vues

Spectroscopie Mössbauer
Inorganic Chemistry
21.9K Vues

Structure du ferrocène
Inorganic Chemistry
79.1K Vues

Application de la théorie des groupes à la spectroscopie IR
Inorganic Chemistry
45.0K Vues

Théorie de l’orbital moléculaire (OM)
Inorganic Chemistry
35.1K Vues

Quadruples clusters métalliques
Inorganic Chemistry
15.3K Vues

Capteurs solaires teintés
Inorganic Chemistry
15.7K Vues

Synthèse d'un complexe de cobalt(II) porteur d'oxygène
Inorganic Chemistry
51.5K Vues

Initiation photochimique des réactions de polymérisation radicalaire
Inorganic Chemistry
16.7K Vues