Lewis-Säure-Base-Wechselwirkungen in Ph3P-BH3
Überblick
Quelle: Tamara M. Powers, Department of Chemistry, Texas A & M Universität
Eines der Ziele der Chemie soll Modelle verwenden, die für Trends und geben Einblicke in die Eigenschaften der Reaktionspartner, die Reaktivität beitragen. Seit der Zeit der alten Griechen wurden als Säuren und Basen Stoffe eingestuft, aber die Definition von Säuren und Basen geändert wurde und im Laufe der Jahre erweitert. 1
Die alten Griechen würden charakterisieren Substanzen durch Geschmack und Säuren als jene, die sauer schmeckende, wie Zitronensaft und Essig waren definiert. Der Begriff "Acid" leitet sich vom lateinischen Begriff für "sauer schmeckende." Basen zeichneten sich durch ihre Fähigkeit, entgegenzuwirken oder Säuren zu neutralisieren. Die ersten Grundlagen geprägt waren die Asche von einem Feuer, die mit fetten Seife machen gemischt wurden. Der Begriff "Alkali" leitet sich übrigens aus dem arabischen Wort für "braten". In der Tat ist es bekannt seit alten, dass Säuren Zeiten und Basen kombiniert werden, können um ein Salz und Wasser zu geben.
Die weit verbreitete Erstbeschreibung einer Säure ist der schwedische Chemiker Svante Arrhenius, der in 1894 definierten Säuren als Stoffe die in Wasser zu Protolyse Ionen und Basen als Stoffe geben, die in Wasser zu Hydroxid-Ionen geben, distanzieren distanzieren. Diese Definition beschränkt sich somit auf wässrige Säuren und erfordert, dass eine Säure ein Proton beitragen. 2 z. B. in Wasser, HCl ist eine Säure, wie es distanziert geben die Protolyse-Ionen (H3O)+ und Chlorid-Ionen. Bor Bortrichlorid würde keine Säure in Wasser betrachtet werden, die es hydrolysiert, um B(OH)3 und 3 HCl geben; das Produkt HCl ist aber eine Arrhenius-Säure.
Im Jahr 1923, Johannes Nicolaus Brønsted und Martin Lowry unabhängig definiert Säuren und Basen auf ihre Fähigkeit zu Spenden und Wasserstoff-Ionen oder Protonen zu akzeptieren. So entstand das Konzept der konjugierte Säure-Base-Paare und die Erweiterung der Definition von Säuren und Basen in Lösungsmitteln als Wasser. Ammonium ist beispielsweise eine Säure wie kann ein Proton Spenden und Ammoniak zu generieren. Ammoniak kann akzeptieren, dass ein Proton, Ammonium zu geben. Ammoniak ist somit die konjugierte Base von Ammonium. Dieser Säure-Base-Reaktion kann in Wasser, Ammoniak oder andere Lösungsmittel auftreten.
Dieses Video beschäftigt sich mit der Säure-Base-Definition von der amerikanische Chemiker, Gilbert N. Lewis, der auch Säuren und Basen im Jahr 1923 definiert. In der Tat ist dies die gleiche Lewis von Lewis-Dot-Strukturen in der allgemeinen Chemie. Sein Ansatz konzentriert sich nicht auf die Fähigkeit der Säuren und Basen zu Spenden und Protonen zu akzeptieren, sondern auf deren Fähigkeit zu akzeptieren und Elektronenpaaren, bzw. zu spenden. Dies umfasst die Brønsted-Lowry Definition H+ ein Elektronenpaar aus einer Brønsted-Base während Protonierung akzeptiert. Allerdings wird die Definition einer Säure, umfasst nun Metall-Ionen und Hauptgruppe Verbindungen stark erweitert. Hier vergleichen wir die 31P NMR der Lewis Säureunterseite Addukt Ph3P-BH3 , kostenlose Triphenylphosphine.
Grundsätze
Betrachten Sie die Bindung zwischen Triphenylphosphine und Boran. Wir betrachten zuerst, wie beide Moleküle aussehen, bevor sie eine Lewis Adduktbilden.
Erinnern an Lewis Dot Strukturen und Valence Shell Elektronenpaar Abstoßung (VSEPR) Theorie, von der allgemeinen Chemie. Die Lewis-Dot-Struktur der Triphenylphosphine ist in Abbildung 1dargestellt. Es gibt drei kovalente Bindungen zwischen das Phosphor-Atom und einem der Kohlenstoffatome in jedem der drei Phenyl-Ringe. Zwei Elektronen (ein Elektronenpaar) befinden sich auf das Phosphor-Atom, das Oktett abzuschließen. Das Phosphor Zentrum ist sp3 hybridisiert und hat eine Tetraeder elektronische Geometrie mit Elektronenpaar mit Wohnsitz in einer sp-3 orbital Elektronen. Triphenylphosphine hat ein Elektronenpaar, das kann zu einem anderen Molekül gespendet werden und gilt daher als eine Lewis-base.
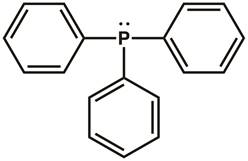
Abbildung 1. Lewis-Dot-Struktur der Triphenylphosphine.
Die Lewis-Dot-Struktur der Boran ist in Abbildung 2dargestellt. Es gibt drei kovalente Bindungen zwischen dem Bor-Atom und Wasserstoff-Atome. In diesem Fall das Bor-Center nur sechs Valenzelektronen und folgt daher nicht die Regel 8 e– . Boran ist planar und sp2 hybridisiert mit der sp-2 -orbitale bilden Anleihen, die Wasserstoffatome und die einsame p orbital leer. Boran ist somit eine Lewis-Säure.

Abbildung 2. Lewis-Dot-Struktur der Boran.
Da Phosphor in Triphenylphosphine eine gefüllte Orbital hat und das Bor Boran eine leere Orbital hat, können eine Lewis-Säure-Base-Addukt , mit den Spenden seiner zwei Elektronen zu Bor Triphenylphosphine bilden. Auf Bildung Addukt, das Bor-Center wird sp3 hybridisiert (Gleichung 1).
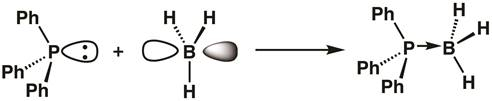 (1)
(1)
Gleichung 1 zeigt die Idee der Lewis-Säure, mit Lewis-Säuren, die freien Elektronenpaare der Elektronen zu akzeptieren, und Lewis Basen spendenden Paare von Elektronen. Manchmal, Lewis-Säuren werden als Electrophiles bezeichnet, und Lewis Basen als nukleophile. Bindungen zwischen Lewis-Säuren und Basen werden oft als beigeordnete kovalente oder Dativ Anleihen bezeichnet und sind manchmal mit Pfeilen im Gegensatz zu Linien gekennzeichnet.
Verfahren
1. Setup der Schlenk-Linie für die Synthese von Boran Triphenylphosphine Komplex
Hinweis: Für eine detailliertere Verfahren, lesen Sie bitte die "Schlenk Linien übertragen von Lösungsmittel" Video der Serie Essentials of Organic Chemistry ). Schlenk Linie Sicherheit sollte überprüft werden, vor der Durchführung dieses Experiments. Gläser sollten für Sterne Risse vor der Verwendung überprüft werden. Darauf sollte geachtet werden, um sicherzustellen, dass O2 ist nicht in der Schlenk Linie Falle kondensiert, wenn Flüssigkeit N2verwenden. Bei N2 Flüssigkeitstemperatur O2 kondensiert und explosiv in Anwesenheit von organischen Lösungsmitteln. Wenn der Verdacht besteht, dass O2 verdichtet worden oder eine blaue Flüssigkeit in die Kühlfalle eingehalten wird, lassen Sie die Falle unter dynamischen Vakuum kalt. Entfernen Sie die Flüssigkeit N2 Falle nicht oder schalten Sie die Vakuumpumpe. Im Laufe der Zeit verdunstet die Flüssigkeit O2 in die Pumpe; Es wird nur sicher sein, die Flüssigkeit N2 Falle zu entfernen, sobald alle O2 verdampft.
- Schließen Sie das Überdruckventil.
- Aktivieren Sie das N2 Gas und die Vakuumpumpe.
- Als die Schlenk Linie Vakuum erreicht seine Mindestdruck, bereiten die Kühlfalle mit Flüssigkeit N2 oder Trockeneis/Aceton.
- Montieren Sie die Kühlfalle.
2. Synthese von Boran Triphenylphosphine Komplex3
- Eine 250 mL-Schlenk-Kolben A 5,3 g (20,3 Mmol) der Triphenylphosphine hinzu und die Kanüle Übertragung des Lösungsmittels bereiten Sie Schlenk-Kolben vor.
- Schlenk-Kolben A per Kanüle 20 mL THF trocken/entgast hinzufügen. Rühren Sie die Lösung um die Triphenylphosphine aufzulösen.
- Bereiten Sie einen zweite Schlenk-Kolben (B) mit 1,15 g (30,5 Mmol) NaBH4 für die Kanüle Übertragung.
- Beide Schlenk-Kolben A und B im Eisbad abkühlen.
- Kanüle übertragen Sie den Inhalt von Schlenk-Kolben A in Schlenk-Kolben B.
- Ersetzen Sie mit N2 Überdruck die Gummiseptum auf Schlenk-Kolben B durch eine Zusatz-Trichter mit einem Gummiseptum ausgestattet.
- Hinzugeben Sie zu den Zusatz-Trichter 8 mL trocken/entgast THF per Kanüle.
- Entfernen Sie mit N2 Überdruck das Septum vom oberen Rand der Tropftrichter und 2 mL Eisessig in den Zusatz-Trichter.
- Halten Schlenk Kolben B im Eisbad, fügen Sie die THF/Glazial-Essigsäure tropfenweise über 30 min. Während der Zugabe auftreten aufschäumen. Stellen Sie sicher, dass die Reaktion kräftig rühren ist, um dies zu minimieren.
- Ermöglichen Sie nach der Zugabe die Reaktion auf Raumtemperatur erwärmt und eine weitere Stunde köcheln.
- Entfernen Sie den Tropftrichter und geben Sie 20 mL Wasser langsam zu.
- Bereiten Sie eine Lösung von 2 mL Eisessig in 25 mL Wasser. Diese Mischung langsam in die Reaktion einfügen
- Wenn Kristalle nicht spontan bilden, kühlen Sie die Reaktion im Eisbad Kristallisation zu fördern.
- Filtern Sie das Produkt durch Absaugen durch einen fritted Trichter. Waschen Sie die resultierende solide mit 20 mL Wasser 3 Mal.
- Lassen Sie das Produkt in der Haube zu trocknen, bevor die Probenvorbereitung für NMR-Analyse.
3. 31P-NMR-Analyse von Boran Triphenylphosphine Komplex
- Eine NMR-Probe Triphenylphosphine und Boran Triphenylphosphine Komplex in CDCl3vorbereiten.
- Sammeln Sie eine 31P NMR jeder Probe (bezogen auf Phosphorsäure) zu und beobachten Sie, wie das Phosphor Signal des Triphenylphosphine auf Koordination, Boran verschiebt.
Ergebnisse
Boran Triphenylphosphine Komplex:
31 P-NMR (Chloroform -d, 500 MHz, δ, ppm): 20,7 (Breite Wams)
Triphenylphosphine:
31 P-NMR (Chloroform -d, 500 MHz, δ, ppm):-5.43
31P NMR Signals von der Boran Triphenylphosphine Komplex ist relativ frei Triphenylphosphine downfield. Dies steht im Einklang mit der Entfernung des Elektron Dichte vom Phosphor entfernt, die auf deshielded Addukt Bildung.
Anwendung und Zusammenfassung
Die Boran Triphenylphosphine Komplex ist ein Beispiel für ein Lewis-Addukt, wobei eine Lewis-Base spendet Elektronen eine Lewis-Säure. Obwohl BH3 und PPh3 nicht unbedingt eine Säure und Base, bzw. gelten würde mit anderen Säure-Base-Theorien, prognostiziert Lewis-Säure-Basen-Theorie richtig, dass die Moleküle eine stabile Addukt bilden.
Kleines Molekül Aktivierung:
Während historisch Übergangsmetall-Ionen als Lewis-Säuren gegolten haben, ist die Vorstellung, die sie als Lewis-Basen dienen können vorangetrieben. Zum Beispiel haben Jonas Peters und Mitarbeiter am Caltech gezeigt, dass Metall-Boran-komplexe, die Elektronen, die Lewis Säure Boran (ein Z-Art-Liganden) Spenden können, zu einer neuartigen Reaktivität führen können. Eine Nickel-Boran-Arten zeigte sich reversibel H2, heterolytically der H-H-Bindung Spalten hinzufügen. 4 der H2-Arten ist ein Katalysator für Hydrogenations von Olefinen hinzugefügt. Die Gruppe berichtet auch, dass Eisen-Boran komplexe katalytisch Stickstoff zu Ammoniak reduzieren können. 5 dies war das erste Beispiel für ein Eisen basierten homogener Katalysator für diese anspruchsvolle und dennoch kritische Reaktion.
Frustriert Lewis-Paare:
Eine weitere aktuelle Forschungsgebiet ist die "Frustriert Lewis Paare" oder FLPs. Dies sind Lewis "Addukte Säure-Base", die aus sterischen Gründen ein Dativ Band bilden können. 6 Douglas Stephan und Kollegen von der University of Toronto überlegt, welchen solche Addukte Reaktivität haben würde, vor allem mit der Idee für kleines Molekül Aktivierung und Katalyse zu verwenden. Übergang Metall komplexe, die sich zu akzeptieren und Elektronendichte von Substraten und Spenden können denken, sie die Hypothese auf Spender/Akzeptor Eigenschaften der so genannten sie "Frustriert Lewis Paare" möglicherweise in Bezug auf Reaktivität.
Im Jahr 2006, berichtet Stephan und Mitarbeiter in der Wissenschaft , der auch (C6H2Me3) reversibel verliert2PH (C6F4) BH (C6F5)2 H2 geben (C6H2Me3)2P (C6F4) B (C6F5)2. 7 dies war das erste Beispiel für reversible H2 Aktivierung mit Elementen der Hauptgruppe, und andere Beispiele gefolgt (Abbildung 3). Diese Studie ebnete den Weg für die Entwicklung der FLP-Forschung. Seitdem wurden FLPs entwickelt, die zuständigen Hydrierung Katalysatoren und können eine Vielzahl von kleinen Molekülen, darunter CO2aktivieren. Dies ist eine aktive und spannende neue Forschungsgebiet.
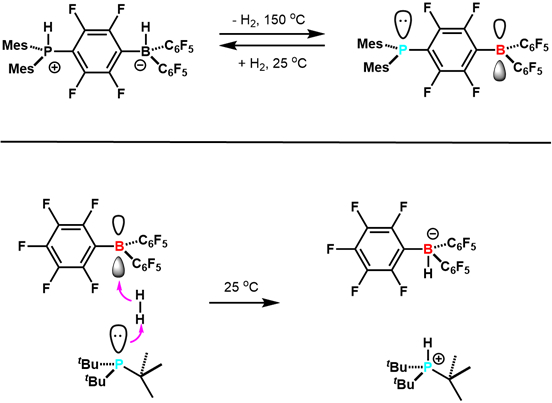
Abbildung 3. Frühe Beispiele der Reaktivität der FLPs mit H2. Adaptiert von Referenz 5.
Referenzen
- Lesney, Today's Chemist at Work, 2003, 47-48.
- Miessler, P. J. Fischer and D. A. Tarr, Inorganic Chemistry, Pearson, 2014.
- McNulty, J.; Zhou, Y. Tetrahedron Letters, 2004, 45, 407-409.
- Harman and J. C. Peters, J. Am. Chem. Soc., 2012, 134, 5080-5082.
- Anderson, J. Rittle and J. C. Peters, Nature, 2013, 501, 84-87.
- Stephan, J. Am. Chem. Soc., 2015, 137, 10018-10032.
- Welch, R. R. S. Juan, J. D. Masuda and D. W. Stephan, Science, 2006, 314, 1124-1126.
Tags
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Lewis-Säure-Base-Wechselwirkungen in Ph3P-BH3
Inorganic Chemistry
38.7K Ansichten

Synthese eines Ti(III)-Metallocen-Katalysators mittels Schlenk-Technik
Inorganic Chemistry
31.5K Ansichten

Handschuhbox und Verunreinigungssensoren
Inorganic Chemistry
18.6K Ansichten

Reinigung von Ferrocen durch Sublimation
Inorganic Chemistry
54.3K Ansichten

Die Evans-Methode
Inorganic Chemistry
68.0K Ansichten

Einkristall- und Pulverröntgendiffraktometrie
Inorganic Chemistry
103.9K Ansichten

Elektronenparamagnetische Rezonanzspektroskopie (EPR-Spektroskopie)
Inorganic Chemistry
25.3K Ansichten

Mößbauerspektroskopie
Inorganic Chemistry
21.9K Ansichten

Struktur von Ferrocen
Inorganic Chemistry
79.1K Ansichten

Anwendung der Gruppentheorie auf die IR-Spektroskopie
Inorganic Chemistry
44.9K Ansichten

Molekülorbital (MO)-Theorie
Inorganic Chemistry
35.1K Ansichten

Vierfach-metallgeklebte Schaufelräder
Inorganic Chemistry
15.3K Ansichten

Farbstoffsensibilisierte Solarzellen
Inorganic Chemistry
15.7K Ansichten

Synthese eines Sauerstoff-transportierenden Cobalt(II) - Komplex
Inorganic Chemistry
51.5K Ansichten

Photochemische Initiierung von radikalischen Polymerisationsreaktionen
Inorganic Chemistry
16.7K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten