Method Article
Generating Spheroids from Various Chondrocytes using Low-Adhesive Conditions under Gravity and Homemade Mini-Bioreactors
요약
본 연구는 중력을 이용하여 저접착 조건에서 세포를 스페로이드로 응집한 후 생성된 스페로이드를 미니 생물반응기에서 배양하여 연골세포 스페로이드를 생산하는 방법을 설명합니다.
초록
만성 관절 질환에서 연골 복구는 손상된 조직을 효과적으로 재생하기 위해 고급 세포 기반 요법을 필요로 합니다. 이 프로토콜은 유도만능줄기세포(iPSC)를 연골세포 기반 스페로이드로 분화하기 위한 단계별 방법을 제공하여 조직 공학 및 세포 치료 응용 분야를 지원합니다. 분화 과정은 연골형성 계통 헌신을 촉진하기 위해 세심하게 구조화되어 있으며, 이는 특정 배지에서 배양된 iPSC로 시작하여 세포를 분화의 중요한 단계로 순차적으로 안내합니다. 초기에 iPSC는 일련의 정의된 배지 변화를 사용하여 연골형성 계통으로 유도되기 전에 최적의 포화도에 도달하도록 확장됩니다. 10일째가 되면 세포는 성숙한 연골세포의 주요 마커를 발현하는 연골세포와 유사한 세포의 형성을 향상시키는 연골형성을 촉진하는 배지로 전환됩니다. 96웰 아가로스 코팅 플레이트에서 추가 응집은 3차원 스페로이드의 형성으로 이어지며, 이 스페로이드는 세포외 기질(ECM) 증착을 촉진하는 미세환경을 시뮬레이션하도록 설계된 맞춤형 미니 생물반응기에서 배양됩니다. 이 접근법은 천연 연골 특성을 모방하는 연골 세포 타원체의 확장 가능한 생산을 가능하게 함으로써 연골 결손에 대한 세포 기반 치료법을 개발하기 위한 유망하고 재현 가능한 솔루션을 제공하여 근골격계 재생 의학의 임상 및 연구 응용 분야에 광범위한 유용성을 제공합니다.
서문
관절 질환의 유병률은 장애인 환자의 증가와 그들의 치료와 관련된 비용으로 인해 상당한 경제적 부담으로 이어집니다. 유리질 연골은 재생 잠재력이 제한된 결합 무혈관 조직입니다1. 특정 비스테로이드성 항염증제(NSAIDs), 글루코코르티코이드, 화학요법 또는 방사선 요법을 장기간 사용하면 연골의 재생 능력이 더욱 저하되어 연골의 치유 능력이 거의 사라질 수 있다2. 이로 인해 세포 치료를 위한 자가 연골 세포를 얻는 것이 어렵습니다.
연골세포를 포함한 3차원(3D) 세포 배양 기술은 오랫동안 상당한 잠재력을 가진 새로운 연구 분야로 인식되어 왔습니다. 이러한 3D 구조는 기초 생물학 연구와 재생 의학 모두에 응용하기 위해 연구되고 있습니다. 자가 연골 세포에서 유래한 스페로이드는 현재 전 세계적으로 상당한 관심을 받고 있는 상태인 연골 조직 퇴행을 해결할 수 있는 치료 가능성을 가지고 있습니다3.
iPSC와 분화된 연골세포에서 유래한 스페로이드는 원발성 연골세포에 대한 유망한 대안으로 연골 복구에 상당한 이점을 제공합니다. iPSC는 거의 무한한 자가 재생 능력을 제공하고 광범위한 분화 잠재력을 가지고 있어 세포 채취를 위한 침습적 절차 없이 임상 적용에 충분한 양의 연골세포를 생산할 수 있습니다4. 또한, 기존의 2차원(2D) 연골세포 배양에서 연골구와 같은 3D 배양 시스템으로 전환하면 생리학적으로 보다 관련성이 높은 환경을 조성하여 이러한 세포의 생존력과 기능을 더욱 향상시킬 수 있습니다. 연구에 따르면 3D 스페로이드에서 배양된 연골세포는 표현형을 더 잘 유지하여 역분화율이 낮고 콜라겐 유형 II 및 아그레칸5와 같은 주요 유리질 연골 마커의 발현 수준이 더 높은 것으로 나타났습니다.
iPSC 유래 연골구의 잠재력에도 불구하고 고품질 연골구체를 생성하기 위한 표준화된 프로토콜은 여전히 제한적입니다. 연구에 따른 프로토콜의 다양성은 종종 연골세포의 질과 세포외 기질 구성의 불일치로 이어져 치료 효과에 영향을 미친다6. 여기에서는 저렴하고 맞춤형으로 제작된 미니 바이오리액터를 사용하여 iPSC 유래 연골세포에서 스페로이드 생성을 표준화하는 정교한 프로토콜이 제시됩니다. 미니 바이오리액터 배양 단계는 영양분 분포, ECM 성숙 및 스페로이드 압축7을 최적화하는 제어된 저접착 설정을 제공하기 때문에 필수적입니다. 이 단계는 천연 연골과 매우 유사한 ECM 구성과 함께 콜라겐 유형 II, 아그레칸 및 SOX9를 포함한 필수 연골세포 마커의 강력한 발현을 촉진합니다. 정기적인 배지 변화와 온도, CO2 및 회전 속도와 같은 환경 조건의 신중한 제어는 연골 세포 스페로이드의 생존력과 성숙을 더욱 보장합니다. 이 프로토콜은 비용 효율적이고 확장 가능한 방식으로 유리질 연골 마커를 강력하게 발현하는 고품질 연골구를 생성하도록 최적화되어 연골 복구의 연구 및 임상 응용 분야에 적합합니다.
프로토콜
이 연구는 LOPUKHIN FRCC PCM(2019년 4월 9일 프로토콜 번호 2019/02)의 윤리 위원회에서 검토 및 승인되었습니다. 모든 기증자 샘플은 헬싱키 선언의 원칙에 따라 획득되었습니다. 모든 참가자 및/또는 법적 보호자로부터 사전 동의를 받았습니다.
참고: 프로토콜 전반에 걸쳐 멸균 기술을 유지합니다. 모든 배양 배지와 용액을 세포 또는 스페로이드에 적용하기 전에 37°C로 가열합니다. 37°C의 CO2 인큐베이터에서 80% 습도에서 5% CO2 로 세포를 배양합니다. 프로토콜 체계는 그림 1에 나와 있습니다.

그림 1: iPSC 라인 IPSRG4S에서 연골구를 생성하기 위한 프로토콜. (A) 초기에 iPSC는 80% 포화도에 도달할 때까지 만능 줄기 세포 배지에서 배양됩니다. (B) 연골세포 계통으로의 분화를 유도하기 위해 iPSC를 배지 A에서 2일 동안 배양합니다. 그 후 배지를 Chir 99021 및 Rho kinase 억제제가 결핍된 제형으로 대체하고, 세포를 2일마다 배지 변화로 추가로 6일 동안 배양합니다. (C) 그런 다음 세포를 배지 B로 옮겨 다음 10일 동안 연골 형성을 촉진합니다. (D) 충분한 세포 수가 달성되면 공정은 스페로이드 생산 단계로 진행됩니다. (E) 세포는 중력 하에서 접착력이 낮은 조건에서 스페로이드로 응집됩니다. (F) 생성된 스페로이드는 배지 B를 갖는 미니 생물반응기에서 배양됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 페트리 접시를 미니 생물 반응기로 변환
참고 : 이전 기사의 세부 정보5.
- 멸균 오토클레이브 가위를 사용하여 원심분리기 튜브를 7-8mm 높이의 고리로 자릅니다(오토클레이브 설정: 15psi에서 121°C(250°F), 30분 및 20분 동안 오토클레이브 후 건조).
- 접착력이 낮거나 처리되지 않았거나 미생물 학적 페트리 접시를 작은 조각으로 부수십시오. 약 1g의 플라스틱 입자를 클로로포름 10mL에 하룻밤 동안 녹여 액체 플라스틱 용액을 만듭니다. 흄 후드에서 이 절차를 수행하십시오.
- 액체 플라스틱이 피펫팅에 충분히 점성이 있는지 확인합니다. 액적이 표면에 퍼지지 않고 구형을 유지하는지 확인하십시오. 용액이 너무 묽으면 일반적으로 1-3g이 필요한 플라스틱 입자를 더 추가하십시오. 너무 두꺼우면 일반적으로 최대 5mL가 필요한 클로로포름을 추가로 첨가하십시오.
- 아래에 설명된 두 가지 효과적인 방법 중 하나를 사용하여 멸균, 초저접착 60mm 페트리 접시 중앙에 플라스틱 손잡이를 형성합니다.
- 옵션 1 : 오토 클레이브 플라스틱 링을 페트리 접시 중앙에 놓고 링 내부에 액체 플라스틱을 바르십시오. 한 방울에는 약 100-200μL의 액체 플라스틱 방울이 필요합니다.
- 옵션 2: 플라스틱 링을 사용하지 않고 동일한 수의 액체 플라스틱 방울을 페트리 접시 중앙에 직접 바릅니다.
- 층류 후드에서 뚜껑을 덮지 않은 상태로 접시를 2-3시간 동안 건조시킵니다. 건조 후 접시를 20-30분 동안 자외선에 노출시킵니다.
2. 젤라틴을 사용한 문화 접시 처리
- 분말 젤라틴을 95°C의 증류수에 녹여 0.1% 젤라틴 용액을 준비합니다. 용액을 0.45μm 및 0.25μm 멤브레인 필터에 순차적으로 통과시킨 다음 여과액을 4°C에서 보관합니다.
- 연골세포 재파종 직전에 3mL의 젤라틴 용액을 25cm2 플라스크에 도포합니다(T25 플라스크당 최대 15g의 연골 조직 권장). 실온(RT)에서 30분 동안 배양하고 젤라틴을 제거하고 PBS로 두 번 헹구고 세포 파종을 진행합니다.
3. 연골 세포의 분리 및 재배
참고: 연골세포는 무릎 전치환술을 받는 환자의 체중을 지탱하지 않는 연골 부위에서 분리됩니다. 멸균 상태에서 모든 검체를 채취하고 200U/mL 페니실린/스트렙토마이신 용액이 들어 있는 DMEM으로 채워진 멸균 튜브에 보관합니다. 연골 조직은 2-8 °C의 냉장고에 보관하십시오.
- 연골 채취 후 2일 이내에 효소 치료를 시작하십시오. 60mm 페트리 접시를 사용하여 행크스 용액으로 연골 조각을 씻은 다음 오토클레이브 가위를 사용하여 연골을 직경 약 1-2mm의 조각으로 자릅니다.
- 연골 조각을 15mL 튜브로 옮기고 DMEM의 0.01% 콜라겐분해효소 II형 용액(연골 1g당 약 1mL)으로 150-200rpm의 오비탈 쉐이커에서 연속 교반하면서 37°C, 5% CO2, 100% 습도로 설정된 CO2 인큐베이터에서 8-12시간 이내에 분해합니다.
- 분해 후 15mL 튜브에 DMEM을 첨가하여 연골 조각을 세척한 다음 300×g에서 10 분 동안 원 심분리합니다. 연골세포 배양 배지(보충 표 1)에 단편을 재현탁하고 0.1% 젤라틴 용액으로 사전 코팅된 접착 T25 플라스크에 파종합니다.
- 계대 연골 세포는 80%의 합류 밀도가 달성될 때 발생합니다.
- 계대 형성을 위해 Hanks' solution으로 연골 세포를 세척한 다음 37°C에서 5분 동안 0.25% 트립신 용액으로 세포를 배양합니다.
- 트립신을 비활성화하려면 동일한 부피의 DMEM + 10% FBS를 추가합니다. 신선한 배양 배지에 연골 세포를 재현 탁 한 다음 1 : 3 비율로 배포하여 1cm 당 20,000-30,000 개의 세포를 파종합니다2.
- 배양 플라스크를 37°C, 5% CO2 및 100% 습도의 인큐베이터에 넣습니다.
4. 만능줄기세포의 배양
참고:이전 연구에서 iPSC 계열 IPSRG4S 인공 지능 Virtanen 연구소, A.I. Virtanen Institute, 신경생물학과 분자 뇌 연구 그룹의 줄기 세포 실험실과 협력하여 iPSC 라인 이 성공적으로 생성되었습니다.
- 세포외 단백질을 포함하는 매트릭스로 사전 코팅된 6웰 플레이트에서 iPSC를 배양합니다( 그림 1A). 만능 줄기세포에 배지를 사용한다(보충 표 1).
- 80% 밀도에서 계대 세포, 1:4 비율(1cm당 50,000-75,000개 세포2)을 유지합니다. 박리 약 2-3시간 전에 1일 동안 최종 농도 1μM에서 Rho kinase inhibitor Y27632를 함유한 만능 줄기세포용 배지로 iPSC를 전달합니다.
- Hanks의 용액으로 iPSC를 세척하고 0.05% 트립신 용액으로 37°C에서 배양합니다. 트립신을 비활성화하려면 동일한 부피의 DMEM + 10% FBS를 추가합니다. 15mL 튜브에서 200 x g 의 세포 현탁액을 5분 동안 원심분리합니다.
- 상등액을 버리고 만능 줄기세포를 위한 새로운 배지에 세포를 재현탁합니다. 세포 생존율을 높이기 위해 Rho kinase inhibitor Y27632를 1일 동안 최종 농도 1μM로 배지에 첨가합니다. 배양 플레이트를 37°C, 5% CO2 및 100% 습도로 설정된 CO2 인큐베이터에 놓습니다.
5. iPSC의 연골형성 분화
- 처음 2일 동안 Medium A(보충 표 1)에서 세포를 배양하여 연골세포 계통으로 분화를 시작합니다. 3일차에 Medium A를 Chir 99021 및 Rho kinase 억제제를 제외한 용액으로 교체하고 다른 모든 성분은 변경하지 않습니다. 3일차부터 9일차까지 2일마다 매체를 변경합니다(그림 1B).
- 10일째에 연골세포와 유사한 세포를 연골형성을 촉진하도록 제조된 Medium B(보충 표 1)로 이동합니다. 10일 동안 2일마다 매체를 교체합니다(그림 1C).
- 증류수에 1.5% 아가로스로 각 웰을 코팅하여 96웰 세포 현탁 배양 플레이트를 미리 준비합니다. 아가로스를 끓을 때까지 전자레인지에 녹입니다(700W에서 약 60-90초). 아가로스가 액화되면 각 웰에 75μL의 아가로스를 첨가하고 RT(약 15분)에서 경화시킵니다.
- 각 웰에 150μL의 DMEM 배지를 추가하고 최소 12시간 동안 CO2 인큐베이터에서 플레이트를 배양합니다.
알림: 준비된 플레이트는 증발을 보상하기 위해 각 웰의 배지가 보충되는 경우 37°C의 CO2 인큐베이터에서 최대 1개월 동안 보관할 수 있습니다. - 12일째에 연골 형성과 관련된 표현형 변화를 관찰한 후 생성된 연골 세포 유사 세포를 사용하여 스페로이드 형성을 시작합니다.
참고: 이 단계에서는 iPSC의 성공적인 연골형성 분화를 확인하기 위해 2-ΔΔCT 방법9 를 사용하여 면역세포화학(ICC) 및 정량적 중합효소 연쇄 반응(qPCR)으로 주요 연골세포 마커의 발현을 분석하는 것이 좋습니다. 6-well plate에서 75cm2 cell culture flask로 passage하는 동안 분석할 marker의 수와 일치하는 48-well plate에 세포의 일부를 파스딩할 수 있습니다. 이러한 샘플에 대해 ICC 분석을 수행하여 유전자 발현을 확인합니다.
6. 연골세포와 같은 iPSC 유래 세포에서 스페로이드 형성
- 연골 세포 유사 유도체를 얻은 후, 80% confluency에서 세포를 계대시킵니다. 0.05% 트립신 용액을 사용하여 6-well 플레이트에서 세포를 분리합니다. 트립신을 비활성화하려면 동일한 부피의 DMEM + 10% FBS를 첨가한 다음 세포를 15mL 튜브로 옮기고 200 x g 에서 5분 동안 원심분리합니다.
- 상층액을 제거하고 1mL의 배지 B에 세포를 재현탁시킨 다음 0.1% 젤라틴 용액으로 사전 코팅된 75cm2 세포 배양 플라스크로 옮깁니다(그림 1D). 세포가 단층으로서 80% 포화도에 도달하면 트립신으로 세포를 다시 분리하고 설명된 대로 배지 B에서 재현탁합니다.
- 웰당 100,000개 세포의 밀도로 1.5% 아가로스로 코팅된 96웰 플레이트로 세포를 전달합니다. 웰당 150μL의 완전한 배지를 추가하여 배지 B에서 배양합니다(그림 1D, 3A).
- 스페로이드가 형성될 때까지 최소 1일에서 최대 3일 동안 1.5% 아가로스로 코팅된 96웰 플레이트의 세포를 유지합니다(그림 2B). 끝부분이 잘린 1mL 피펫 팁을 사용하여 웰에서 스페로이드를 옮긴 다음 15mL 튜브로 옮깁니다. 스페로이드가 2-3분 동안 가라앉을 때까지 기다렸다가 상층액을 제거합니다.
- 4°C로 유지되는 갓 해동된 희석되지 않은 기저막 매트릭스 용액에 스페로이드를 담그십시오. 30분 후 15mL 튜브에서 수동 침강 또는 100 x g 에서 1분 동안 부드러운 원심분리로 스페로이드를 수집합니다.
알림: 매트릭스는 2-8°C 냉장고에서 얼음으로 밤새 해동해야 합니다. 첫 번째 해동 후, 반복되는 동결-해동 주기를 피하기 위해 매트릭스의 일회용 부분 표본이 만들어집니다. 폴리프로필렌 또는 기타 냉동고 호환 튜브를 사용하여 -70°C 또는 -20°C에서 보관합니다. 제조일로부터 2년인 배치/로트의 만료 날짜에 주의하십시오. - 스페로이드를 미니 생물반응기로 옮기고 6mL의 Medium B를 추가합니다. 5% CO2 및 100% 습도와 70-75rpm의 교반 속도를 37°C로 설정한 CO2 인큐베이터 내부의 궤도 셰이커에 미니 생물반응기를 놓습니다(그림 1F).
- 매체를 매주 변경하거나 산-염기 지표의 중간 고갈 또는 색상 변경에 따라 필요에 따라 변경합니다. 이렇게 하려면 스페로이드가 15mL 튜브에 중력에 의해 침전되도록 한 다음 상층액을 조심스럽게 제거합니다. 튜브에 새로운 배지 B를 추가하고 스페로이드를 미니 생물반응기로 다시 옮깁니다.
결과
요약된 프로토콜은 그림 1에 설명되어 있습니다. 이 방법론은 두 가지 별개의 배양 배지를 사용하여 최소 1개월 동안 iPSC를 연골세포 스페로이드로 분화시킵니다(그림 2). 분화 과정은 iPSC가 75%-90% 포화도를 달성할 때 시작됩니다(그림 1B). 연골형성 분화의 초기 지표는 배지 A에서 배양 9-10일째 되는 날쯤에 나타나며, 세포가 연골세포의 특징적인 형태를 채택하는 것으로 표시됩니다. 10일째에 세포를 배지 B(그림 1C)로 옮기고 19일까지 분화가 완료될 때까지 배양합니다(그림 3). 이 단계에서 세포의 99%가 연골형성 마커인 아그레칸(ACAN), 콜라겐 I형(COL1A2), 콜라겐 II형(COL2A1), SOX9에 대해 양성이었으며 만능 세포 마커 TRA-1-81 및 OCT4의 발현은 보이지 않았습니다. 주요 연골 세포 마커의 높은 수준의 발현이 모든 사례에서 항상 관찰되는 것은 아니라는 점에 주목할 가치가 있습니다. 최소 90%-95%의 유전자 마커 발현을 가진 연골구는 고품질로 간주됩니다. 따라서 예를 들어 iPSC 분화 30일째와 같은 스페로이드 샘플에서 추가적인 유전자 발현 분석이 권장됩니다(그림 4 및 그림 5).
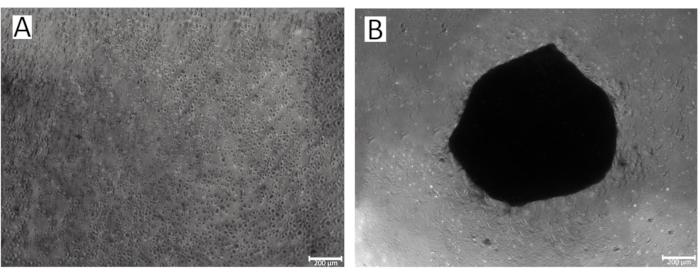
그림 2: 96웰 플레이트의 웰에서 스페로이드 형성 과정. (A) 연골세포 스페로이드 형성의 초기 단계IPSRG4S (B) 저접착IPSRG4S 중력 조건에서 배양 2일차에 연골세포 타원체로 형성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 다양한 출처에서 얻은 연골 세포의 면역조직화학적 분석. (A-L) 분화 시작 시점부터 19일째까지 얻은 iPSC의 연골세포 유도체는 주요 연골세포 마커 유전자의 발현 수준이 유사하며(ACAN, E; COL2A1, G; SOX9, H)를 통로 2에서 천연 연골세포 배양과 비교했을 때(ACAN, A; COL2A1, C; SOX9, D)입니다. iPSC 배양은 음성 대조군(ACAN, I; COL1A1, J; COL2A1, 케이; SOX9, L)입니다. I형 콜라겐의 발현은 천연 연골세포(COL1A1, B)와 iPSC 유래 연골세포 샘플(COL1A1, F) 간에도 비슷합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
다음으로 이 프로세스는 스페로이드 생성에 필요한 연골세포 유사 iPSC 유도체의 최적 수를 결정하는 데 중점을 두었습니다(96웰 플레이트의 각 웰이 단일 스페로이드를 생성하는 데 100,000개의 세포가 필요하다는 계산에 기반함). 이 준비 단계를 완료하는 데 약 1주일이 걸렸습니다(그림 1D). 대조적으로, 천연 연골세포에서 스페로이드를 생성하는 것은 스페로이드 생산 단계로 직접 진행하기 전에 최적의 연골 세포 수를 얻는 것만 포함합니다.
후속 단계에서는 에틸렌디아민테트라아세트산(EDTA) 함유 용액을 사용하여 세포를 수집하고, 1.5% 아가로스로 사전 코팅된 96웰, U-바닥 배양 플레이트의 각 웰에 100,000개의 세포를 파종했습니다(그림 1E). 그런 다음 세포를 스페로이드 형성을 촉진하기 위해 12시간 내지 48시간 동안 배지 B에서 배양했습니다. 각 웰은 세포가 단일 스페로이드로 응집되는 것을 지지했습니다. 일단 스페로이드가 형성되면, 갓 해동된 세포외 기질로 코팅하고 배지 B를 포함하는 수제 미니 생물반응기로 옮겼습니다(그림 1F). 이 생물 반응기는 70-75 rpm으로 회전하는 궤도 셰이커에 배치되었습니다. 스페로이드는 모든 샘플에서 균일한 성장과 일관된 형태 형성을 가진 연골구체로 성숙했습니다.
연골권은 증식 잠재력이 제한되어 있으며, 주로 초기 한 달 동안 크기가 확장되며, 이러한 성장을 주도하는 세포 외 기질 단백질의 생산이 있습니다. 2개월의 배양 후 도달한 최대 직경은 3-4mm였으며 연골구는 일반적으로 1-2mm의 직경을 나타냅니다(그림 4E, J).
더 큰 오가노이드는 느슨한 중앙 영역을 나타냈으며, 종종 구멍이나 괴사 부위를 동반했습니다. 생후 1개월된 오가노이드는 아그레칸(aggrecan), 콜라겐 유형 II, SOX9를 포함한 연골세포 마커를 발현했습니다(그림 4 및 그림 5). 고품질 연골구의 최적 재배 기간은 약 1개월이었습니다.

그림 4: 다양한 출처의 연골세포에서 생성된 스페로이드의 면역조직화학적 분석. (A-J) ICC 분석은 미니 생물반응기에서 스페로이드를 배양한 분화 시작부터 30일째에 수행되었습니다. 천연 연골세포의 스페로이드에서 아그레칸 및 제2형 콜라겐의 발현(ACAN, A; COL2A1, C) 및 iPSC 유래 연골세포 스페로이드(ACAN, F; COL2A1, H)도 비슷한 수준입니다. 그러나 스페로이드는 iPSC에서 유래한 연골세포 스페로이드(COL1A1, G, SOX9, I)와 천연 연골세포(COL1A1, B; SOX9, D)는 콜라겐 유형 1 및 SOX9의 발현 수준이 더 높은 것이 특징입니다. 미니 생물반응기 배양 중 천연 연골세포(E)에서 유래한 스페로이드와 iPSC(J)에서 유래한 연골세포 스페로이드의 형태도 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 스페로이드에서 주요 연골형성 마커의 발현 수준에 대한 qPCR 분석. 천연 연골세포와 iPSC의 연골세포 유도체에서 생성된 연골구에서 연골세포 유전자의 발현 수준에 대한 본 분석은 위에 제시된 결과를 확인합니다. 그래프는 Tukey의 검정에 의한 차이의 통계적 유의성을 나타냅니다(**p ≤ 0.01, ***p ≤ 0.001, ****p ≤ 0.0001). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
iPSC가 연골세포 계통으로 분화되는 동안 연골구의 최종 배양은 유리질 연골에 비해 더 큰 탄력성을 특징으로 하는 어린 연골과 더 유사하다는 점에 유의하는 것이 중요합니다. 이것은 천연 연골 세포에서 얻은 스페로이드와 대조됩니다. 스페로이드 내에 hyaline과 fibrous 조직을 결합한 혼합된 연골세포 표현형의 존재가 이러한 차이에 기여합니다.
보충 표 1: 매체의 조성. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
iPSC는 재생 의학의 혁신적인 도구로, 연골 복구를 위한 환자 맞춤형 연골 세포를 생성할 수 있는 잠재력을 제공합니다. 현재 프로토콜은 TGF-β 및 BMP-2와 같은 주요 신호 분자와 함께 중배엽 경로를 통한 지시된 분화를 활용하여 연골세포 계통 헌신을 촉진합니다. 이러한 방법은 배아 연골 발달을 복제하여 기능성 연골 조직에 필수적인 콜라겐 II형 및 아그레칸과 같은 세포외 기질 구성 요소의 생산을 가능하게 하는 것을 목표로 합니다. 펠릿 및 현탁액 배양을 포함한 3D 배양 기술의 발전으로 안정적인 연골세포 표현형을 유지하면서 역분화를 줄이는 능력이 향상되었습니다10,11.
생물반응기는 다른 시스템에 비해 연골세포 스페로이드를 배양하는 데 몇 가지 주요 이점을 제공합니다12. 생물반응기는 생체 내 조건을 모방하여 3D 스페로이드의 성장을 효과적으로 촉진합니다. 이를 통해 연골 조직의 기능적 특성에 필수적인 공간적으로 분산된 세포-기질 및 세포-세포 상호 작용의 발달을 가능하게 합니다. 또한, 생물반응기는 연골세포 분화 및 세포외 기질 생산을 유지하는 데 중요한 산소 전달 속도, 영양분 흐름 및 전단 응력과 같은 매개변수를 포함하여 제어된 미세환경을 제공하도록 맞춤화할 수 있습니다13.
미니 바이오리액터는 상업적으로 이용 가능한 바이오리액터보다 훨씬 저렴합니다. 그들은 쉽게 구할 수 있는 재료와 더 간단한 조립 공정을 활용하여 고전적인 생물 반응기와 같이 자금이 제한된 실험실에서 사용할 수 있습니다. 미니 바이오리액터는 소규모, 고처리량 연구에 매우 적합하며, 이를 통해 연구자들은 다양한 배양 배지, 성장 인자 또는 차별화 프로토콜과 같은 여러 변수를 동시에 테스트할 수 있습니다.
집에서 만든 미니 바이오리액터를 사용하면 각 오가노이드가 일관된 환경에 노출되어 밀집 또는 원치 않는 접착 위험을 줄일 수 있습니다. 세포의 품질 및 성숙 단계는 프로토콜 성공에 필수적이며, 연골형성 분화는 iPSC에 대해 75%-90%의 합류를 필요로 합니다14. 시딩 밀도가 너무 낮으면 iPSC가 비연골형성 세포 유형으로의 분화가 발생할 수 있습니다. 분화 과정에서 세포와 스페로이드에 새로운 배지를 정기적으로 공급하는 것이 필수적인데, 영양분 고갈은 오가노이드의 품질을 크게 저하시킬 수 있기 때문입니다.
프로토콜에 대한 특정 수정은 절차의 기본 원칙을 변경하지 않는 한 허용될 수 있습니다. 불소수지, 폴리에틸렌 또는 폴리프로필렌과 같은 불활성 재료를 사용하여 미니 생물반응기 중앙에 손잡이를 만들 수 있습니다. 미생물 페트리 접시를 사용하여 액체 플라스틱을 준비하는 경우, 생성된 미니 생물반응기에 세포 독성 테스트를 실시하여 연골 세포 배양에 대한 적합성을 검증합니다. 다양한 직경의 페트리 접시는 또한 미니 생물 반응기 기지로 사용될 수 있습니다. 그러나 최적의 속도는 중간 볼륨에 따라 달라지므로 그에 따라 회전 속도를 조정해야 합니다. 예를 들어, 6cm 페트리 접시에 담긴 8mL의 매체의 경우 이상적인 회전 속도는 70-75rpm입니다.
COL1A2 유전자의 발현 증가는 천연 연골세포에서 형성된 스페로이드와 비교하여 iPSC 유래 연골세포 스페로이드에서 관찰되었으며, 이는 혼합된 표현형을 가진 세포의 존재를 나타냅니다(그림 5). 이 혼합된 유전자 발현은 유리질 연골과 섬유성 연골의 특징을 모두 포함하는 하이브리드 조직 구조를 암시합니다. 이러한 구조는 조직 회복력을 증가시킬 수 있기 때문에 유리할 수 있지만, 다른 연구에서는 혈청 성분이 I형 콜라겐 합성을 촉진하여 섬유화 효과에 기여할 수 있다고 제안한다15.
이 프로토콜은 미니 생물반응기에서 스페로이드가 한 달 동안 숙성하는 동안 5-7일마다 배지를 교체하도록 지정하며, 엄격한 멸균 관행의 중요성을 강조합니다. 마이코플라스마 오염의 위험을 완화하기 위해 예방적 용량의 항균제를 통합할 수 있습니다. 집에서 만든 미니 바이오리액터는 특히 경제성, 접근 용이성 및 컴팩트한 디자인 측면에서 상업용 대안에 비해 뚜렷한 이점을 제공합니다. 컴팩트한 특성으로 인해 여러 장치를 인큐베이터 내의 단일 오비탈 셰이커에서 편리하게 유지 관리할 수 있습니다. 대조적으로, 인큐베이터에 비슷한 수의 교반 미니 생물반응기를 수용하는 것은 종종 물류적으로 어려운 것으로 판명되었습니다.
공개
저자는 이 연구가 잠재적인 이해 상충으로 해석될 수 있는 상업적 또는 재정적 관계가 없는 상태에서 수행되었다고 선언합니다.
감사의 말
이 연구는 러시아 과학 재단(Russian Science Foundation)의 할당 #22-15-00250으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin solution | Thermo Fisher Scientific | 25300-062 | |
| 0.25% Trypsin solution | Thermo Fisher Scientific | 25200-072 | |
| Advanced DMEM/F12 Eagle's medium | Thermo Fisher Scientific | 12634028 | |
| Aggrecan Monoclonal Antibody | Invitrogen | AHP0022 | Host: Mouse; Dilution: 1/500 |
| Ascorbic acid | Sigma | A4544 | 50 μg/mL |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | 1x or 2% |
| Beta-mercaptoethanol | Serva | 28625 | 90 mM |
| BMP2 | Miltenyi biotec | 130-110-922 | 10 ng/mL |
| Chir 99021 | Miltenyi biotec | 130-103-926 | 10 μM |
| COL1A1 (E6A8E) Monoclonal antibody | CellSignalling | 39952 | Host: Rabbit; Dilution: 1/800 |
| COL2A1 (M2139) Monoclonal antibody | Santa Cruz | sc-52658 | Host: Mouse; Dilution: 1/50 |
| Collagenase type II solution | PanEco | P011-2 | 0.01% |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma-Aldrich | D9542-5MG | 1 μg/mL |
| DMEM medium w/o glutamine | PanEco | ?420? | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | 10% |
| Hanks' solution | PanEco | ?020? | |
| Hybris 8 medium | PanEco | ?780?/?780 | |
| Insulin-Transferrin-Selenium solution | PanEco | ?065 | 1x solution has the following concentrations: Insulin: 10 µg/mL; Transferrin: 5.5 µg/mL; Selenium 5 ng/mL |
| L-alanyl-L-glutamine | Thermo Fisher Scientific | 35050038 | 2 mM |
| Matrigel Matrix | BD | 354277 | 300 μg/mL |
| Penicillin-Streptomycin solution | PanEco | ?063? | 100 U/mL |
| Retinoic acid | Miltenyi biotec | 130-117-339 | 10 nM |
| Rho kinase inhibitor Y27632 | Miltenyi biotec | 130-103-922 | 10 mM |
| Secondary Antibody Goat anti-Mouse IgG (H+L) Cross-Adsorbed, Alexa Fluor 555 | Thermo Fisher Scientific | A21422 | Host: Goat; Dilution: 1/500 |
| Secondary Antibody Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed, Alexa Fluor Plus 555 | Thermo Fisher Scientific | ?32732 | Host: Goat; Dilution: 1/500 |
| Sox9 (D8G8H) Monoclonal antibody | CellSignalling | 82630 | Host: Rb; Dilution: 1/400 |
| TeSR-1 medium | STEMCELL technologies | 85850 | |
| TGF-β1 | Miltenyi biotec | 130-095-067 | 10 ng/mL |
참고문헌
- Cieza, A., Causey, K., Kamenov, K., Hanson, S. W., Chatterji, S., Vos, T. Global estimates of the need for rehabilitation based on the Global Burden of Disease study 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 396, e10267(2021).
- Hua, C., Buttgereit, F., Combe, B. Glucocorticoids in rheumatoid arthritis: Current status and future studies. RMD Open. 6 (1), e000536(2020).
- Wang, M., et al. Articular cartilage repair biomaterials: Strategies and applications. Materials Today Bio. 24, e100948(2024).
- Lee, N., Bayaraa, O., Zechu, Z., Kim, H. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Rep. 54 (7), 356-367 (2021).
- Eremeev, A., Pikina, A., Ruchko, E., Sidorov, V., Ragozin, A. Fabrication of cartilage tissue substitutes from cells with induced pluripotency. Med Extrem Situat. 4, 30-41 (2022).
- Rodríguez Ruiz, A., et al. Cartilage from human-induced pluripotent stem cells: comparison with neo-cartilage from chondrocytes and bone marrow mesenchymal stromal cells. Cell Tissue Res. 386, 309-320 (2021).
- Eremeev, A., et al. Brain organoid generation from induced pluripotent stem cells in homemade mini bioreactors. J Vis Exp. 178, e62987(2021).
- Holmqvist, S., et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2, e16009(2016).
- Livak, K., Schmittgen, T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25 (40), 402-408 (2001).
- De Kinderen, P., et al. Differentiation of induced pluripotent stem cells into chondrocytes: Methods and applications for disease modeling and drug discovery. J Bone Miner Res. 37 (3), 397-410 (2022).
- Ali, E., et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 15 (1), 185(2024).
- Reina-Mahecha, A., Beers, M., van der Veen, H., Zuhorn, I., van Kooten, T., Sharma, P. A Review of the role of bioreactors for iPSCs-based tissue-engineered articular cartilage. Tissue Eng Regen Med. 20 (7), 1041-1052 (2023).
- Fu, L., et al. The application of bioreactors for cartilage tissue engineering: Advances, limitations, and future perspectives. Stem Cells Int. 2021, 6621806(2021).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Mol Ther Methods Clin Dev. 23, 569-581 (2021).
- Endo, K., Fujita, N., Nakagawa, T., Nishimura, R. Effect of fibroblast growth factor-2 and serum on canine mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 25 (11-12), 901-910 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유