Method Article
Erzeugung von Sphäroiden aus verschiedenen Chondrozyten unter Verwendung von niedrigadhäsiven Bedingungen unter Schwerkraft und selbstgemachten Mini-Bioreaktoren
In diesem Artikel
Zusammenfassung
Diese Studie beschreibt ein Verfahren zur Herstellung von chondrozytären Sphäroiden, indem Zellen unter Verwendung der Schwerkraft unter Bedingungen mit geringer Adhäsion zu Sphäroiden aggregiert werden, gefolgt von der Kultivierung der resultierenden Sphäroide in Mini-Bioreaktoren.
Zusammenfassung
Die Knorpelreparatur bei chronischen Gelenkerkrankungen erfordert fortschrittliche zellbasierte Therapien, um geschädigtes Gewebe effektiv zu regenerieren. Dieses Protokoll bietet eine Schritt-für-Schritt-Methode zur Differenzierung von induzierten pluripotenten Stammzellen (iPSCs) in Chondrozyten-basierte Sphäroide und unterstützt so Tissue Engineering und Zelltherapieanwendungen. Der Differenzierungsprozess ist sorgfältig strukturiert, um die Bindung an die chondrogene Abstammungslinie zu fördern, beginnend mit iPSCs, die in spezifischen Medien kultiviert werden und die Zellen nacheinander durch kritische Stadien der Differenzierung führen. Zunächst werden iPS-Zellen expandiert, um eine optimale Konfluenz zu erreichen, bevor sie unter Verwendung einer Reihe definierter Medienänderungen in Richtung chondrogener Linie induziert werden. Bis zum 10. Tag werden die Zellen auf ein Chondrogenese-förderndes Medium umgestellt, das die Bildung von Chondrozyten-ähnlichen Zellen fördert, die Schlüsselmarker reifer Chondrozyten exprimieren. Eine weitere Aggregation in 96-Well-Agarose-beschichteten Platten führt zur Bildung dreidimensionaler Sphäroide, die dann in speziellen Mini-Bioreaktoren kultiviert werden, die eine Mikroumgebung simulieren sollen, die die Ablagerung extrazellulärer Matrix (ECM) fördert. Durch die skalierbare Produktion von Chondrozyten-Sphäroiden, die native Knorpeleigenschaften nachahmen, bietet dieser Ansatz eine vielversprechende, reproduzierbare Lösung für die Entwicklung zellbasierter Behandlungen für Knorpeldefekte und bietet einen breiten Nutzen für klinische und Forschungsanwendungen in der muskuloskelettalen regenerativen Medizin.
Einleitung
Die Prävalenz von Gelenkerkrankungen führt aufgrund der steigenden Zahl behinderter Patienten und der damit verbundenen Kosten zu erheblichen wirtschaftlichen Belastungen. Hyaliner Knorpel ist ein bindegliedriges avaskuläres Gewebe mit begrenztem regenerativem Potenzial1. Die längere Einnahme bestimmter nichtsteroidaler Antirheumatika (NSAIDs), Glukokortikoide und Chemotherapie oder Strahlentherapie kann die Regenerationsfähigkeit des Knorpels weiter verringern und seine Heilungsfähigkeit fast eliminieren2. Dies macht es schwierig, autologe Knorpelzellen für die Zelltherapie zu gewinnen.
Die Technologie der dreidimensionalen (3D) Zellkultivierung, einschließlich Chondrozyten, gilt seit langem als aufstrebendes Forschungsgebiet mit erheblichem Potenzial. Diese 3D-Strukturen werden sowohl für Anwendungen in der biologischen Grundlagenforschung als auch in der regenerativen Medizin untersucht. Sphäroide, die aus autologen Chondrozyten gewonnen werden, sind vielversprechend für die Behandlung der Degeneration des Knorpelgewebes, eine Erkrankung, die derzeit weltweit große Aufmerksamkeit erfährt3.
Sphäroide, die aus Chondrozyten gewonnen werden, die von iPSCs differenziert sind, stellen eine vielversprechende Alternative zu primären Chondrozyten dar und bieten erhebliche Vorteile für die Knorpelreparatur. iPSCs bieten eine nahezu unbegrenzte Fähigkeit zur Selbsterneuerung und besitzen ein breites Differenzierungspotenzial, das die Produktion von Chondrozyten in für klinische Anwendungen ausreichenden Mengen ohne invasive Verfahren zur Zellentnahme ermöglicht4. Darüber hinaus verbessert der Übergang von traditionellen zweidimensionalen (2D) Chondrozytenkulturen zu 3D-Kultursystemen, wie z. B. Chondrosphären, die Lebensfähigkeit und Funktionalität dieser Zellen weiter, indem eine physiologisch relevantere Umgebung geschaffen wird. Studien zeigen, dass Chondrozyten, die in 3D-Sphäroiden kultiviert werden, ihren Phänotyp besser beibehalten und geringere Dedifferenzierungsraten und höhere Expressionsniveaus von wichtigen hyalinen Knorpelmarkern wie Kollagen Typ II und Aggrecan5 aufweisen.
Trotz des Potenzials von iPSC-abgeleiteten Chondrosphären sind standardisierte Protokolle zur Erzeugung hochwertiger Chondrosphären nach wie vor begrenzt. Die Variabilität der Protokolle in den verschiedenen Studien führt häufig zu Inkonsistenzen in der Chondrozytenqualität und der Zusammensetzung der extrazellulären Matrix, was sich auf ihre Wirksamkeit für den therapeutischen Einsatz auswirkt6. Hier wird ein verfeinertes Protokoll vorgestellt, das die Erzeugung von Sphäroiden aus iPSC-abgeleiteten Chondrozyten unter Verwendung erschwinglicher, maßgeschneiderter Mini-Bioreaktoren standardisiert. Die Kulturphase des Mini-Bioreaktors ist von entscheidender Bedeutung, da sie eine kontrollierte, adhäsionsarme Einstellung bietet, die die Nährstoffverteilung, die ECM-Reifung und die Sphäroidverdichtung optimiert7. Diese Phase fördert eine robuste Expression essentieller Chondrozytenmarker, einschließlich Kollagen Typ II, Aggrecan und SOX9, zusammen mit einer EZM-Zusammensetzung, die dem nativen Knorpel sehr ähnlich ist. Regelmäßige Medienwechsel und eine sorgfältige Kontrolle der Umgebungsbedingungen - Temperatur, CO2 und Rotationsgeschwindigkeit - gewährleisten die Lebensfähigkeit und Reifung der Chondrozyten-Sphäroide zusätzlich. Dieses Protokoll wurde optimiert, um qualitativ hochwertige Chondrosphären mit starker Expression von hyalinen Knorpelmarkern auf kostengünstige und skalierbare Weise zu erzeugen, die für Forschung und klinische Anwendungen in der Knorpelreparatur geeignet sind.
Protokoll
Die Studie wurde von der Ethikkommission des LOPUKHIN FRCC PCM geprüft und genehmigt (Protokoll Nr. 2019/02 vom 9. April 2019). Alle Spenderproben wurden in Übereinstimmung mit den Grundsätzen der Deklaration von Helsinki entnommen. Die Einverständniserklärung wurde von allen Teilnehmern und/oder ihren Erziehungsberechtigten eingeholt.
HINWEIS: Behalten Sie während des gesamten Protokolls die sterile Technik bei. Erwärmen Sie alle Nährmedien und -lösungen auf 37 °C, bevor Sie sie auf Zellen oder Sphäroide auftragen. Kultivieren Sie die Zellen in einem CO2 -Inkubator bei 37 °C mit 5 % CO2 bei 80 % Luftfeuchtigkeit. Das Protokollschema ist in Abbildung 1 dargestellt.

Abbildung 1: Protokoll zur Herstellung von Chondrosphären aus iPS-Linie IPSRG4S. (A) Zunächst werden iPSCs in pluripotenten Stammzellmedien kultiviert, bis eine Konfluenz von 80 % erreicht ist. (B) Um eine Differenzierung in Richtung der chondrozytären Linie zu induzieren, werden die iPSCs dann 2 Tage lang in Medium A kultiviert. Das Medium wird anschließend durch eine Formulierung ersetzt, in der Chir 99021 und Rho-Kinase-Inhibitor fehlen, und die Zellen werden für weitere 6 Tage kultiviert, wobei das Medium alle 2 Tage gewechselt wird. (C) Die Zellen werden dann in Medium B übertragen, um die Chondrogenese für die nächsten 10 Tage zu fördern. (D) Sobald eine ausreichende Zellzahl erreicht ist, geht der Prozess in die Phase der Sphäroidproduktion über. (E) Die Zellen werden unter wenig adhäsiven Bedingungen unter der Schwerkraft zu Sphäroiden aggregiert. (F) Die resultierenden Sphäroide werden in Mini-Bioreaktoren mit Medium B kultiviert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Umwandlung von Petrischalen in Mini-Bioreaktoren
HINWEIS: Details in einem früheren Artikel5.
- Schneiden Sie die Zentrifugenröhrchen mit einer sterilen Autoklavenschere in 7-8 mm hohe Ringe (Autoklaveneinstellungen: 121 °C (250 °F) bei 15 psi, 30 min und Trocknung nach dem Autoklaven für 20 min).
- Zerkleinern Sie unbehandelte oder mikrobiologische Petrischalen mit geringer Adhäsion in kleine Stücke. Lösen Sie über Nacht etwa 1 g Kunststoffpartikel in 10 ml Chloroform auf, um eine flüssige Kunststofflösung zu erhalten. Führen Sie diesen Vorgang in einem Abzug durch.
- Stellen Sie sicher, dass der flüssige Kunststoff für das Pipettieren viskos genug ist. Stellen Sie sicher, dass die Tröpfchen eine kugelförmige Form behalten und sich nicht auf der Oberfläche ausbreiten. Wenn die Lösung zu dünnflüssig ist, fügen Sie weitere Kunststoffpartikel hinzu, die normalerweise 1-3 g benötigen. Wenn es zu dickflüssig ist, fügen Sie zusätzliches Chloroform hinzu, das normalerweise bis zu 5 ml benötigt.
- Formen Sie einen Kunststoffknauf in der Mitte einer sterilen, 60 mm Petrischale mit extrem geringer Adhäsion mit einer der beiden unten beschriebenen effektiven Methoden.
- Option 1: Platzieren Sie den autoklavierten Kunststoffring in der Mitte der Petrischale und tragen Sie dann flüssigen Kunststoff in den Ring auf. Für einen Tropfen werden etwa 100-200 μl Tropfen flüssiger Kunststoff benötigt.
- Option 2: Tragen Sie die gleiche Anzahl von Tropfen flüssigem Kunststoff direkt in die Mitte der Petrischale auf, ohne den Kunststoffring zu verwenden.
- Lassen Sie das Geschirr 2-3 h unbedeckt in einer Laminar-Flow-Haube trocknen. Nach dem Trocknen das Geschirr 20-30 Minuten lang ultravioletter Strahlung aussetzen.
2. Behandlung von Kulturschalen mit Gelatine
- Bereiten Sie eine 0,1%ige Gelatinelösung vor, indem Sie Gelatinepulver in destilliertem Wasser bei 95 °C auflösen. Die Lösung wird nacheinander durch 0,45 μm und 0,25 μm Membranfilter geleitet und das Filtrat dann bei 4 °C gelagert.
- Unmittelbar vor der Nachsaat der Chondrozyten tragen Sie die 3 ml Gelatinelösung auf den 25 cm2 Kolben auf (bis zu 15 g Knorpelgewebe pro T25-Kolben werden empfohlen). 30 Minuten bei Raumtemperatur (RT) inkubieren, die Gelatine entfernen, zweimal mit PBS spülen und mit der Zellaussaat fortfahren.
3. Isolierung und Kultivierung von Chondrozyten
HINWEIS: Chondrozyten werden aus nicht tragenden Knorpelregionen von Patienten isoliert, die sich einem Kniegelenkersatz unterziehen. Alle Proben werden unter sterilen Bedingungen entnommen und in sterilen Röhrchen gelagert, die mit DMEM gefüllt sind, die 200 U/ml Penicillin/Streptomycin-Lösung enthalten. Knorpelgewebe im Kühlschrank bei 2-8 °C lagern.
- Beginnen Sie innerhalb von 2 Tagen nach der Knorpelentnahme mit der enzymatischen Behandlung. Waschen Sie Knorpelstücke in Hanks-Lösung mit 60-mm-Petrischalen und schneiden Sie den Knorpel dann mit einer autoklavierten Schere in Fragmente von etwa 1-2 mm Durchmesser.
- Übertragen Sie Knorpelstücke in 15-ml-Röhrchen und verdauen Sie sie in 0,01%iger Kollagenase-Typ-II-Lösung in DMEM, ca. 1 ml pro 1 g Knorpel, innerhalb von 8-12 h in einem CO2 -Inkubator, der auf 37 °C mit 5 % CO2 und 100 % Luftfeuchtigkeit eingestellt ist, unter kontinuierlichem Rühren auf einem Orbitalschüttler bei 150-200 U/min.
- Nach dem Aufschluss waschen Sie die Knorpelfragmente, indem Sie DMEM in ein 15-ml-Röhrchen geben, und zentrifugieren Sie dann 10 Minuten lang bei 300 × g . Die Fragmente werden in einem Chondrozyten-Nährmedium resuspendiert (Ergänzende Tabelle 1) und auf einen selbstklebenden T25-Kolben gesät, der mit 0,1%iger Gelatinelösung vorbeschichtet ist.
- Passage Chondrozyten, wenn eine konfluente Dichte von 80% erreicht wird.
- Für die Passage werden die Chondrozyten mit Hanks-Lösung gewaschen und die Zellen dann 5 Minuten lang mit 0,25%iger Trypsinlösung bei 37 °C inkubiert.
- Um Trypsin zu inaktivieren, fügen Sie ein gleiches Volumen DMEM + 10 % FBS hinzu. Resuspendieren Sie Chondrozyten in frischem Kulturmedium und verteilen Sie sie dann im Verhältnis 1:3, wobei Sie 20.000-30.000 Zellen pro 1 cmaussäen 2.
- Der Kulturkolben wird bei 37 °C mit 5 % CO2 und 100 % Luftfeuchtigkeit in einen Inkubator gestellt.
4. Kultivierung von pluripotenten Stammzellen
HINWEIS: In Zusammenarbeit mit dem Stammzelllabor der Molecular Brain Research Group, Abteilung für Neurobiologie, A.I. Virtanen Institute, Universität von Ostfinnland, Kuopio, Finnland, wurde in einer früheren Studie erfolgreich eine iPSCs-Linie IPSRG4S erzeugt8.
- Kultivieren Sie iPSCs in 6-Well-Platten, die mit einer Matrix vorbeschichtet sind, die extrazelluläre Proteine enthält ( Abbildung 1A). Verwenden Sie ein Medium für pluripotente Stammzellen (Ergänzende Tabelle 1).
- Passagezellen bei 80 % Konfluenz unter Beibehaltung eines Verhältnisses von 1:4 (50.000-75.000 Zellen pro 1 cm2). Etwa 2-3 h vor der Ablösung iPS-Zellen in das Medium für pluripotente Stammzellen, die den Rho-Kinase-Inhibitor Y27632 enthalten, in einer Endkonzentration von 1 μM für 1 Tag übertragen.
- iPS-Zellen werden mit Hanks-Lösung gewaschen und bei 37 °C mit 0,05 %iger Trypsinlösung inkubiert. Um Trypsin zu inaktivieren, fügen Sie ein gleiches Volumen DMEM + 10 % FBS hinzu. Zentrifugieren Sie die Zellsuspension bei 200 x g für 5 min in 15 mL Röhrchen.
- Entsorgen Sie den Überstand und resuspendieren Sie die Zellen in einem frischen Medium für pluripotente Stammzellen. Um die Lebensfähigkeit der Zellen zu verbessern, geben Sie den Rho-Kinase-Inhibitor Y27632 in einer Endkonzentration von 1 μM für 1 Tag in das Medium. Stellen Sie die Kulturplatte in einen CO2 -Inkubator, der auf 37 °C mit 5 % CO2 und 100 % Luftfeuchtigkeit eingestellt ist.
5. Chondrogene Differenzierung von iPSCs
- Initiieren Sie die Differenzierung in Richtung der chondrozytären Linie, indem Sie in den ersten 2 Tagen Zellen in Medium A (Ergänzende Tabelle 1) kultivieren. Ersetzen Sie Medium A an Tag 3 durch eine Lösung, die Chir 99021 und Rho-Kinase-Inhibitor ausschließt, während alle anderen Komponenten unverändert bleiben. Wechseln Sie das Medium alle 2 Tage von Tag 3 bis 9 (Abbildung 1B).
- Übertragen Sie am Tag 10 Chondrozyten-ähnliche Zellen auf Medium B (Ergänzende Tabelle 1), das zur Erleichterung der Chondrogenese formuliert ist. Wechseln Sie das Medium 10 Tage lang alle 2 Tage (Abbildung 1C).
- Bereiten Sie im Voraus eine 96-Well-Zellsuspensionskulturplatte vor, indem Sie jede Well mit 1,5 % Agarose in destilliertem Wasser beschichten. Die Agarose in der Mikrowelle schmelzen, bis sie kocht (ca. 60-90 s bei 700 W). Sobald Agarose verflüssigt ist, geben Sie 75 μl Agarose in jede Vertiefung und lassen Sie sie bei RT (ca. 15 min) aushärten.
- Geben Sie 150 μl DMEM-Medium in jede Vertiefung und inkubieren Sie die Platte mindestens 12 Stunden lang in einem CO2 - Inkubator.
HINWEIS: Vorbereitete Platten können bis zu 1 Monat in einem CO2 -Inkubator bei 37 °C gelagert werden, wenn das Medium in jeder Vertiefung aufgefüllt wird, um die Verdunstung auszugleichen. - Am Tag 12, nachdem phänotypische Veränderungen im Zusammenhang mit der Chondrogenese beobachtet wurden, initiieren Sie die Bildung von Sphäroiden mit den erzeugten Chondrozyten-ähnlichen Zellen.
HINWEIS: In diesem Stadium ist es ratsam, die Expression wichtiger chondrozytärer Marker mit Immunzytochemie (ICC) und quantitativer Polymerase-Kettenreaktion (qPCR) unter Verwendung der 2-ΔΔCT-Methode 9 zu analysieren, um eine erfolgreiche chondrogene Differenzierung von iPSCs zu bestätigen. Während der Übergabe von einer 6-Well-Platte an einen 75 cm 2-Zellkulturkolben kann ein kleiner Teil der Zellen in eine 48-Well-Platte ausgesät werden, die der Anzahl der zu analysierenden Marker entspricht. Führen Sie eine ICC-Analyse an diesen Proben durch, um die Genexpression zu überprüfen.
6. Bildung von Sphäroiden aus Chondrozyten-ähnlichen iPSC-abgeleiteten Zellen
- Nach der Gewinnung von Chondrozyten-ähnlichen Derivaten bilden sich die Passagezellen mit einer Konfluenz von 80 %. Trennen Sie die Zellen mit einer 0,05%igen Trypsinlösung von den 6-Well-Platten. Um Trypsin zu inaktivieren, fügen Sie ein gleiches Volumen DMEM + 10 % FBS hinzu und geben Sie die Zellen dann in ein 15-ml-Röhrchen und zentrifugieren Sie sie 5 Minuten lang bei 200 x g .
- Entfernen Sie den Überstand, resuspendieren Sie die Zellen in 1 ml Medium B und geben Sie sie in einen 75 cmgroßen 2-Zell-Kulturkolben, der mit 0,1%iger Gelatinelösung vorbeschichtet ist (Abbildung 1D). Sobald die Zellen eine Konfluenz von 80 % als Monoschicht erreicht haben, lösen Sie die Zellen wieder mit Trypsin ab und resuspendieren Sie wie beschrieben in Medium B.
- Übertragen Sie die Zellen in eine 96-Well-Platte, die mit 1,5 % Agarose bei einer Dichte von 100.000 Zellen pro Well beschichtet ist. Kultivieren Sie in Medium B und fügen Sie 150 μl vollständiges Medium pro Vertiefung hinzu (Abbildung 1D, 3A).
- Halten Sie die Zellen in der 96-Well-Platte, die mit 1,5 % Agarose beschichtet ist, für mindestens 1 Tag und maximal 3 Tage, bis Sphäroide gebildet werden (Abbildung 2B). Übertragen Sie die Sphäroide aus den Vertiefungen mit einer 1-ml-Pipettenspitze mit abgeschnittenem Ende und geben Sie sie dann in ein 15-ml-Röhrchen. Lassen Sie die Sphäroide 2-3 Minuten einwirken und entfernen Sie den Überstand.
- Tauchen Sie die Sphäroide in frisch aufgetaute, unverdünnte Basalmembranmatrixlösung, die bei 4 °C gehalten wird. Nach 30 min werden die Sphäroide durch passive Sedimentation in einem 15 mL Röhrchen oder durch schonende Zentrifugation bei 100 x g für 1 min gesammelt.
HINWEIS: Die Matrix sollte über Nacht auf Eis im Kühlschrank bei 2-8 °C aufgetaut werden. Nach dem ersten Auftauen werden Einmal-Aliquots der Matrix hergestellt, um wiederholte Gefrier-Auftau-Zyklen zu vermeiden. Es werden Polypropylen oder andere gefrierkompatible Tuben verwendet und bei -70 °C oder -20 °C gelagert. Achten Sie auf das Verfallsdatum der Charge/Charge, das 2 Jahre ab dem Herstellungsdatum liegt. - Übertragen Sie die Sphäroide in Mini-Bioreaktoren und fügen Sie 6 ml Medium B hinzu. Stellen Sie den Mini-Bioreaktor auf einen Orbitalschüttler in einem CO2 -Inkubator, der auf 37 °C mit 5 % CO2 und 100 % Luftfeuchtigkeit und einer Rührgeschwindigkeit von 70-75 U/min eingestellt ist (Abbildung 1F).
- Wechseln Sie das Medium wöchentlich oder je nach Bedarf bei Mediummangel oder Farbwechsel des Säure-Base-Indikators. Lassen Sie dazu die Sphäroide durch die Schwerkraft in einem 15-ml-Röhrchen absetzen und entfernen Sie dann vorsichtig den Überstand. Geben Sie frisches Medium B in das Röhrchen und übertragen Sie die Sphäroide zurück in die Mini-Bioreaktoren.
Ergebnisse
Das skizzierte Protokoll ist in Abbildung 1 dargestellt. Bei dieser Methodik werden zwei unterschiedliche Nährmedien verwendet, um die Differenzierung von iPSCs in Chondrozyten-Sphäroide über einen Zeitraum von mindestens 1 Monat voranzutreiben (Abbildung 2). Der Differenzierungsprozess wird eingeleitet, wenn iPSCs eine Konfluenz von 75 % bis 90 % erreichen (Abbildung 1B). Frühindikatoren für eine chondrogene Differenzierung treten um den 9. bis 10. Tag der Kultivierung in Medium A auf, wobei die Zellen eine für Chondrozyten charakteristische Morphologie annehmen. An Tag 10 werden die Zellen in Medium B überführt (Abbildung 1C) und kultiviert, bis die Differenzierung an Tag 19 abgeschlossen ist (Abbildung 3). Zu diesem Zeitpunkt waren 99% der Zellen positiv für chondrogene Marker - Aggrecan (ACAN), Kollagen Typ I (COL1A2), Kollagen Typ II (COL2A1), SOX9 - und zeigten keine Expression der pluripotenten Zellmarker TRA-1-81 und OCT4. Es ist erwähnenswert, dass nicht immer in allen Fällen ein hohes Maß an Expression wichtiger chondrozytärer Marker beobachtet wird. Chondrosphären mit einer Genmarkerexpression von mindestens 90 % bis 95 % gelten als qualitativ hochwertig; Daher wird eine zusätzliche Genexpressionsanalyse in Sphäroidproben, z. B. am 30. Tag der iPS-Differenzierung, empfohlen (Abbildung 4 und Abbildung 5).
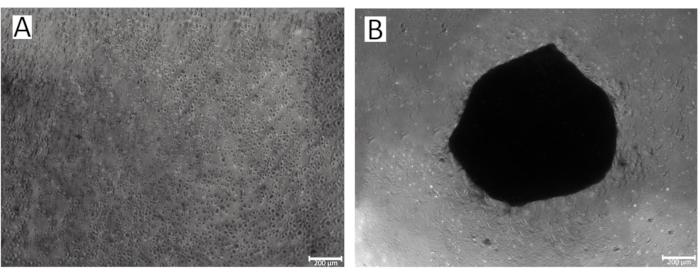
Abbildung 2: Prozess der Sphäroidbildung in den Vertiefungen einer 96-Well-Platte. (A)Das Anfangsstadium IPSRG4S chondrozytären Sphäroidbildung; (B) Gebildet IPSRG4S chondrozytären Sphäroid am Tag 2 der Kultivierung unter wenig adhäsiven Schwerkraftbedingungen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Immunhistochemische Analyse von Chondrozyten aus verschiedenen Quellen. (A-L) Chondrozytenderivate aus iPSCs, die bis zum 19. Tag nach Beginn der Differenzierung erhalten wurden, weisen ähnliche Expressionsniveaus wichtiger Chondrozyten-Markergene auf (ACAN, E; COL2A1, G; SOX9, H) im Vergleich zu nativen Chondrozytenkulturen an Passage 2 (ACAN, A; COL2A1, C; SOX9, D). Die Kultur der iPSCs diente als Negativkontrolle (ACAN, I; COL1A1, J; COL2A1, K; SOX9, L). Die Expression von Typ-I-Kollagen ist auch zwischen nativen Chondrozyten (COL1A1, B) und iPSCs-abgeleiteten Chondrozytenproben (COL1A1, F) vergleichbar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Der Prozess konzentrierte sich als nächstes auf die Bestimmung der optimalen Anzahl von Chondrozyten-ähnlichen iPSC-Derivaten, die für die Sphäroiderzeugung erforderlich sind (basierend auf der Berechnung, dass jede Vertiefung in einer 96-Well-Platte 100.000 Zellen benötigt, um ein einzelnes Sphäroid zu produzieren). Diese Vorbereitungsphase dauerte ca. 1 Woche (Abbildung 1D). Im Gegensatz dazu geht es bei der Erzeugung von Sphäroiden aus nativen Chondrozyten nur darum, die optimale Anzahl von Chondrozyten zu erhalten, bevor direkt mit dem Schritt der Sphäroidproduktion begonnen wird.
In der nachfolgenden Phase wurden die Zellen mit einer Ethylendiamintetraessigsäure (EDTA)-haltigen Lösung entnommen und 100.000 Zellen in jede Vertiefung einer 96-Well-Kulturplatte mit U-Boden ausgesät, die mit 1,5 % Agarose vorbeschichtet war (Abbildung 1E). Die Zellen wurden dann für 12 bis 48 Stunden in Medium B inkubiert, um die Sphäroidbildung zu fördern. Jede Vertiefung unterstützte die Aggregation von Zellen zu einem einzigen Sphäroide. Nachdem sich die Sphäroide gebildet hatten, wurden sie mit frisch aufgetauter extrazellulärer Matrix beschichtet und in selbstgebaute Mini-Bioreaktoren mit Medium B überführt (Abbildung 1F). Diese Bioreaktoren wurden auf einem orbitalen Schüttler platziert, der sich mit 70-75 U/min drehte. Die Sphäroide reiften zu Chondrosphären mit gleichmäßigem Wachstum und konsistenter Morphogenese über alle Proben hinweg.
Chondrosphären haben ein begrenztes proliferatives Potenzial und nehmen vor allem im ersten Monat an Größe zu, wobei die Produktion von extrazellulären Matrixproteinen dieses Wachstum vorantreibt. Nach 2-monatiger Kultivierung betrug der maximale Durchmesser 3-4 mm, wobei die Chondrosphären typischerweise einen Durchmesser von 1-2 mm aufwiesen (Abbildung 4E,J).
Größere Organoide wiesen eine lockere zentrale Zone auf, die oft von Hohlräumen oder nekrotischen Bereichen begleitet wurde. Organoide, die 1 Monat alt sind, exprimierten Chondrozytenmarker, einschließlich Aggrecan, Kollagen Typ II und SOX9 (Abbildung 4 und Abbildung 5). Die optimale Kultivierungsdauer von hochwertigen Chondrosphären betrug ca. 1 Monat.

Abbildung 4: Immunhistochemische Analyse von Sphäroiden, die aus Chondrozyten verschiedener Quellen erzeugt wurden. (A-J) Die ICC-Analyse wurde an Tag 30 nach Beginn der Differenzierung durchgeführt, als die Sphäroide in Mini-Bioreaktoren kultiviert wurden. Die Expression von Aggrecan- und Typ-2-Kollagen in Sphäroiden aus nativen Chondrozyten (ACAN, A; COL2A1, C) und von iPSCs-abgeleiteten chondrozytären Sphäroiden (ACAN, F; COL2A1, H) liegt auf ähnlichen Werten. Sphäroide chondrozytäre Sphäroide, die von iPSCs (COL1A1, G, SOX9, I) abgeleitet sind, verglichen mit nativen Chondrozyten (COL1A1, B; SOX9, D) zeichnen sich durch eine höhere Expression von Kollagen Typ 1 und SOX9 aus. Die Morphologie von Sphäroiden, die aus nativen Chondrozyten (E) gewonnen wurden, und chondrozytären Sphäroiden, die von iPSCs (J) während der Kultivierung in Mini-Bioreaktoren abgeleitet wurden, wird ebenfalls gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: qPCR-Analyse der Expressionsniveaus wichtiger chondrogener Marker in Sphäroiden. Diese Analyse des Expressionsniveaus von chondrozytären Genen in Chondrosphären, die aus nativen Chondrozyten und chondrozytären Derivaten von iPSCs erzeugt wurden, bestätigt die oben vorgestellten Ergebnisse. Die Diagramme zeigen die statistische Signifikanz der Unterschiede durch den Tukey-Test - **p ≤ 0,01, ***p ≤ 0,001, ****p ≤ 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Es ist wichtig zu beachten, dass bei der Differenzierung von iPSCs in die chondrozytäre Linie die endgültige Kultur der Chondrosphären eher dem juvenilen Knorpel ähnelt und sich durch eine größere Elastizität im Vergleich zum hyalinen Knorpel auszeichnet. Dies steht im Gegensatz zu Sphäroiden, die aus nativen Chondrozyten gewonnen werden. Das Vorhandensein eines gemischten Chondrozyten-Phänotyps innerhalb des Sphäroids, der hyalines und fibröses Gewebe kombiniert, trägt zu diesem Unterschied bei.
Ergänzende Tabelle 1: Zusammensetzung der Medien. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
iPSCs stellen ein transformatives Werkzeug in der regenerativen Medizin dar und bieten das Potenzial, patientenspezifische Chondrozyten für die Knorpelreparatur zu generieren. Aktuelle Protokolle nutzen die gerichtete Differenzierung über mesodermale Signalwege, wobei Schlüsselsignalmoleküle wie TGF-β und BMP-2 die Bindung an die chondrozytäre Linie fördern. Diese Methoden zielen darauf ab, die embryonale Knorpelentwicklung zu replizieren und die Produktion von extrazellulären Matrixkomponenten wie Kollagen Typ II und Aggrecan zu ermöglichen, die für funktionelles Knorpelgewebe unerlässlich sind. Fortschritte bei 3D-Kultivierungstechniken, einschließlich Pellet- und Suspensionskulturen, haben die Fähigkeit verbessert, einen stabilen chondrozytären Phänotyp aufrechtzuerhalten und gleichzeitig die Dedifferenzierung zu reduzieren10,11.
Bioreaktoren bieten im Vergleich zu anderen Systemen mehrere entscheidende Vorteile für die Kultivierung von Chondrozyten-Sphäroiden12. Bioreaktoren erleichtern effektiv das Wachstum von 3D-Sphäroiden, indem sie In-vivo-Bedingungen nachahmen. Sie ermöglichen die Entwicklung von räumlich verteilten Zell-Matrix- und Zell-Zell-Interaktionen, die für die funktionellen Eigenschaften von Knorpelgewebe essentiell sind. Darüber hinaus können Bioreaktoren so angepasst werden, dass sie eine kontrollierte Mikroumgebung bieten, einschließlich Parametern wie Sauerstofftransferraten, Nährstofffluss und Scherspannung, die für die Aufrechterhaltung der Chondrozytendifferenzierung und der Produktion extrazellulärer Matrix entscheidend sind13.
Mini-Bioreaktoren sind deutlich günstiger als kommerziell erhältliche Bioreaktoren. Sie verwenden leicht verfügbare Materialien und einfachere Montageprozesse, so dass sie für Labore mit begrenzten Mitteln zugänglich sind, wie z. B. klassische Bioreaktoren. Mini-Bioreaktoren eignen sich gut für kleine Hochdurchsatzstudien, die es Forschern ermöglichen, mehrere Variablen wie verschiedene Kulturmedien, Wachstumsfaktoren oder Differenzierungsprotokolle gleichzeitig zu testen.
Die Verwendung von selbstgemachten Mini-Bioreaktoren stellt sicher, dass jedes Organoid einer einheitlichen Umgebung ausgesetzt ist, wodurch das Risiko von Überfüllung oder unerwünschter Adhäsion verringert wird. Die Qualität und das Reifestadium der Zellen sind entscheidend für den Erfolg des Protokolls, wobei die chondrogene Differenzierung für iPSCs eine Konfluenz von 75 % bis 90 % erfordert14. Ist die Aussaatdichte zu gering, kann es zu einer iPSC-Differenzierung in nicht-chondrogene Zelltypen kommen. Während der Differenzierung ist eine regelmäßige Zufuhr von frischem Medium zu Zellen und Sphäroiden unerlässlich, da ein Nährstoffmangel die Qualität der Organoide erheblich beeinträchtigen kann.
Bestimmte Änderungen des Protokolls können zugelassen werden, solange sie die Grundprinzipien des Verfahrens nicht verändern. Inerte Materialien wie Fluorkunststoff, Polyethylen oder Polypropylen können verwendet werden, um einen Knopf in der Mitte des Mini-Bioreaktors zu erzeugen. Wenn Sie eine mikrobiologische Petrischale zur Herstellung des flüssigen Kunststoffs verwenden, unterziehen Sie die resultierenden Mini-Bioreaktoren einem Zytotoxizitätstest, um ihre Eignung für Chondrozytenkulturen zu überprüfen. Petrischalen mit verschiedenen Durchmessern können auch als Basis für Mini-Bioreaktoren dienen; Die Drehzahl muss jedoch entsprechend angepasst werden, da die optimalen Drehzahlen vom mittleren Volumen abhängen. Für 8 ml Medium in einer 6-cm-Petrischale beträgt die ideale Drehzahl beispielsweise 70-75 U/min.
Eine erhöhte Expression des COL1A2-Gens wurde in iPSC-abgeleiteten Chondrozyten-Sphäroiden im Vergleich zu Sphäroiden, die aus nativen Chondrozyten gebildet wurden, beobachtet, was auf das Vorhandensein von Zellen mit einem gemischten Phänotyp hinweist (Abbildung 5). Diese gemischte Genexpression deutet auf eine hybride Gewebestruktur hin, die sowohl Merkmale des hyalinen als auch des fibrösen Knorpels umfasst. Eine solche Struktur kann von Vorteil sein, da sie die Widerstandsfähigkeit des Gewebes erhöhen könnte, obwohl andere Studien darauf hindeuten, dass Serumbestandteile die Kollagensynthese vom Typ I fördern können, was zu fibrotischen Effekten beiträgt15.
Das Protokoll legt fest, dass das Medium während der einmonatigen Reifung der Sphäroide in Mini-Bioreaktoren alle 5-7 Tage ausgetauscht wird, und unterstreicht die entscheidende Bedeutung strenger steriler Praktiken. Um das Risiko einer Mykoplasmenkontamination zu verringern, kann eine prophylaktische Dosis von antimikrobiellen Mitteln eingearbeitet werden. Selbstgebaute Mini-Bioreaktoren bieten deutliche Vorteile gegenüber kommerziellen Alternativen, insbesondere in Bezug auf Erschwinglichkeit, einfachen Zugang und kompaktes Design. Ihre kompakte Beschaffenheit ermöglicht die bequeme Wartung mehrerer Einheiten auf einem einzigen Orbitalschüttler innerhalb eines Inkubators. Im Gegensatz dazu erweist sich die Unterbringung einer vergleichbaren Anzahl von gerührten Mini-Bioreaktoren in einem Inkubator oft als logistische Herausforderung.
Offenlegungen
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Die Forschung wurde mit der Zuweisung #22-15-00250 von der Russischen Wissenschaftsstiftung unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin solution | Thermo Fisher Scientific | 25300-062 | |
| 0.25% Trypsin solution | Thermo Fisher Scientific | 25200-072 | |
| Advanced DMEM/F12 Eagle's medium | Thermo Fisher Scientific | 12634028 | |
| Aggrecan Monoclonal Antibody | Invitrogen | AHP0022 | Host: Mouse; Dilution: 1/500 |
| Ascorbic acid | Sigma | A4544 | 50 μg/mL |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | 1x or 2% |
| Beta-mercaptoethanol | Serva | 28625 | 90 mM |
| BMP2 | Miltenyi biotec | 130-110-922 | 10 ng/mL |
| Chir 99021 | Miltenyi biotec | 130-103-926 | 10 μM |
| COL1A1 (E6A8E) Monoclonal antibody | CellSignalling | 39952 | Host: Rabbit; Dilution: 1/800 |
| COL2A1 (M2139) Monoclonal antibody | Santa Cruz | sc-52658 | Host: Mouse; Dilution: 1/50 |
| Collagenase type II solution | PanEco | P011-2 | 0.01% |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma-Aldrich | D9542-5MG | 1 μg/mL |
| DMEM medium w/o glutamine | PanEco | ?420? | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | 10% |
| Hanks' solution | PanEco | ?020? | |
| Hybris 8 medium | PanEco | ?780?/?780 | |
| Insulin-Transferrin-Selenium solution | PanEco | ?065 | 1x solution has the following concentrations: Insulin: 10 µg/mL; Transferrin: 5.5 µg/mL; Selenium 5 ng/mL |
| L-alanyl-L-glutamine | Thermo Fisher Scientific | 35050038 | 2 mM |
| Matrigel Matrix | BD | 354277 | 300 μg/mL |
| Penicillin-Streptomycin solution | PanEco | ?063? | 100 U/mL |
| Retinoic acid | Miltenyi biotec | 130-117-339 | 10 nM |
| Rho kinase inhibitor Y27632 | Miltenyi biotec | 130-103-922 | 10 mM |
| Secondary Antibody Goat anti-Mouse IgG (H+L) Cross-Adsorbed, Alexa Fluor 555 | Thermo Fisher Scientific | A21422 | Host: Goat; Dilution: 1/500 |
| Secondary Antibody Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed, Alexa Fluor Plus 555 | Thermo Fisher Scientific | ?32732 | Host: Goat; Dilution: 1/500 |
| Sox9 (D8G8H) Monoclonal antibody | CellSignalling | 82630 | Host: Rb; Dilution: 1/400 |
| TeSR-1 medium | STEMCELL technologies | 85850 | |
| TGF-β1 | Miltenyi biotec | 130-095-067 | 10 ng/mL |
Referenzen
- Cieza, A., Causey, K., Kamenov, K., Hanson, S. W., Chatterji, S., Vos, T. Global estimates of the need for rehabilitation based on the Global Burden of Disease study 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 396, e10267(2021).
- Hua, C., Buttgereit, F., Combe, B. Glucocorticoids in rheumatoid arthritis: Current status and future studies. RMD Open. 6 (1), e000536(2020).
- Wang, M., et al. Articular cartilage repair biomaterials: Strategies and applications. Materials Today Bio. 24, e100948(2024).
- Lee, N., Bayaraa, O., Zechu, Z., Kim, H. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Rep. 54 (7), 356-367 (2021).
- Eremeev, A., Pikina, A., Ruchko, E., Sidorov, V., Ragozin, A. Fabrication of cartilage tissue substitutes from cells with induced pluripotency. Med Extrem Situat. 4, 30-41 (2022).
- Rodríguez Ruiz, A., et al. Cartilage from human-induced pluripotent stem cells: comparison with neo-cartilage from chondrocytes and bone marrow mesenchymal stromal cells. Cell Tissue Res. 386, 309-320 (2021).
- Eremeev, A., et al. Brain organoid generation from induced pluripotent stem cells in homemade mini bioreactors. J Vis Exp. 178, e62987(2021).
- Holmqvist, S., et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2, e16009(2016).
- Livak, K., Schmittgen, T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25 (40), 402-408 (2001).
- De Kinderen, P., et al. Differentiation of induced pluripotent stem cells into chondrocytes: Methods and applications for disease modeling and drug discovery. J Bone Miner Res. 37 (3), 397-410 (2022).
- Ali, E., et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 15 (1), 185(2024).
- Reina-Mahecha, A., Beers, M., van der Veen, H., Zuhorn, I., van Kooten, T., Sharma, P. A Review of the role of bioreactors for iPSCs-based tissue-engineered articular cartilage. Tissue Eng Regen Med. 20 (7), 1041-1052 (2023).
- Fu, L., et al. The application of bioreactors for cartilage tissue engineering: Advances, limitations, and future perspectives. Stem Cells Int. 2021, 6621806(2021).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Mol Ther Methods Clin Dev. 23, 569-581 (2021).
- Endo, K., Fujita, N., Nakagawa, T., Nishimura, R. Effect of fibroblast growth factor-2 and serum on canine mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 25 (11-12), 901-910 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten