Method Article
توليد كرويات من الخلايا الغضروفية المختلفة باستخدام ظروف منخفضة الالتصاق تحت الجاذبية والمفاعلات الحيوية الصغيرة محلية الصنع
In This Article
Summary
تصف هذه الدراسة طريقة لإنتاج الكرويات الغضروفية عن طريق تجميع الخلايا إلى كرويات في ظل ظروف منخفضة الالتصاق باستخدام الجاذبية ، متبوعة بزراعة الكرويات الناتجة في المفاعلات الحيوية الصغيرة.
Abstract
يتطلب إصلاح الغضروف في أمراض المفاصل المزمنة علاجات متقدمة قائمة على الخلايا لتجديد الأنسجة التالفة بشكل فعال. يوفر هذا البروتوكول طريقة خطوة بخطوة لتمييز الخلايا الجذعية المستحثة متعددة القدرات (iPSCs) إلى خلايا كروية قائمة على الخلايا الغضروفية ، مما يدعم هندسة الأنسجة وتطبيقات العلاج الخلوي. يتم تنظيم عملية التمايز بعناية لتعزيز التزام النسب الغضروفية ، بدءا من iPSCs المستزرعة في وسائط محددة توجه الخلايا بالتتابع خلال المراحل الحرجة من التمايز. في البداية, يتم توسيع iPSCs للوصول إلى التقاء مثالي قبل الحث نحو النسب الغضروفي باستخدام سلسلة من التغييرات الإعلامية المحددة. بحلول اليوم العاشر ، يتم نقل الخلايا إلى وسط يعزز تكوين الغضروف يعزز تكوين الخلايا الشبيهة بالخلايا الغضروفية التي تعبر عن العلامات الرئيسية للخلايا الغضروفية الناضجة. يؤدي التجميع الإضافي في صفائح مغلفة ب 96 بئرا إلى تكوين كرويات ثلاثية الأبعاد ، والتي يتم زراعتها بعد ذلك في مفاعلات حيوية صغيرة مخصصة مصممة لمحاكاة بيئة مكروية تشجع على ترسب المصفوفة خارج الخلية (ECM). من خلال تمكين الإنتاج القابل للتطوير من كرويات الخلايا الغضروفية التي تحاكي خصائص الغضروف الأصلية ، يقدم هذا النهج حلا واعدا وقابلا للتكرار لتطوير علاجات قائمة على الخلايا لعيوب الغضروف ، مما يوفر فائدة واسعة للتطبيقات السريرية والبحثية في الطب التجديدي العضلي الهيكلي.
Introduction
يؤدي انتشار أمراض المفاصل إلى أعباء اقتصادية كبيرة بسبب العدد المتزايد من المرضى المعاقين والتكاليف المرتبطة برعايتهم. الغضروف الزجاجي هو نسيج لاوعائي ضام ذو إمكانات تجديديةمحدودة 1. يمكن أن يؤدي الاستخدام المطول لبعض الأدوية غير الستيرويدية المضادة للالتهابات (NSAIDs) ، والجلوكوكورتيكويد ، والعلاج الكيميائي أو العلاج الإشعاعي إلى تقليل قدرة الغضروف على التجدد ، مما يقضي تقريبا على قدرته على الشفاء2. هذا يجعل من الصعب الحصول على خلايا الغضروف الذاتية للعلاج الخلوي.
لطالما تم التعرف على تقنية زراعة الخلايا ثلاثية الأبعاد (3D) ، بما في ذلك الخلايا الغضروفية ، كمجال بحثي ناشئ ذو إمكانات كبيرة. تتم دراسة هذه الهياكل ثلاثية الأبعاد للتطبيقات في كل من البحوث البيولوجية الأساسية والطب التجديدي. تحمل الكرات المشتقة من الخلايا الغضروفية الذاتية وعدا علاجيا لمعالجة تنكس أنسجة الغضروف ، وهي حالة تحظى حاليا باهتمام عالميكبير 3.
تمثل الكرات المشتقة من الخلايا الغضروفية المتمايزة عن iPSCs بديلا واعدا للخلايا الغضروفية الأولية, تقدم مزايا كبيرة لإصلاح الغضروف. توفر iPSCs قدرة غير محدودة تقريبا للتجديد الذاتي وتمتلك إمكانات تمايز واسعة, مما يسمح لإنتاج الخلايا الغضروفية بكميات كافية للتطبيقات السريرية دون إجراءات جراحية لجمعالخلايا 4. علاوة على ذلك ، فإن الانتقال من مزارع الخلايا الغضروفية التقليدية ثنائية الأبعاد (2D) إلى أنظمة الثقافة ثلاثية الأبعاد ، مثل الغلاف الغضروفي ، يعزز من قابلية هذه الخلايا للحياة ووظائفها من خلال خلق بيئة أكثر صلة من الناحية الفسيولوجية. تشير الدراسات إلى أن الخلايا الغضروفية المستزرعة في الكرات الكروية ثلاثية الأبعاد تحافظ بشكل أفضل على نمطها الظاهري ، وتظهر معدلات أقل من عدم التمايز ومستويات تعبير أعلى لعلامات الغضروف الزجاجي الرئيسية ، مثل الكولاجين من النوع الثاني و aggrecan5.
على الرغم من إمكانات الغلاف الغضروفي المشتق من iPSC, لا تزال البروتوكولات الموحدة لتوليد الغلاف الغضروفي عالية الجودة محدودة. غالبا ما يؤدي التباين في البروتوكولات عبر الدراسات إلى تناقضات في جودة الخلايا الغضروفية وتكوين المصفوفة خارج الخلية ، مما يؤثر على فعاليتها للاستخدام العلاجي6. هنا, يتم تقديم بروتوكول مكرر يوحد توليد الكرويات من الخلايا الغضروفية المشتقة من iPSC باستخدام مفاعلات حيوية صغيرة ميسورة التكلفة حسب الطلب. تعد مرحلة زراعة المفاعل الحيوي المصغر ضرورية ، لأنها توفر إعدادا منخفض الالتصاق متحكم فيه يعمل على تحسين توزيع المغذيات ، ونضج ECM ، والضغط الكروي7. تعزز هذه المرحلة التعبير القوي عن علامات الخلايا الغضروفية الأساسية ، بما في ذلك الكولاجين من النوع الثاني ، و aggrecan ، و SOX9 ، جنبا إلى جنب مع تركيبة ECM التي تشبه إلى حد كبير الغضروف الأصلي. تضمن التغييرات المنتظمة في الوسائط والتحكم الدقيق في الظروف البيئية - درجة الحرارة ، ثاني أكسيد الكربون2 ، وسرعة الدوران - صلاحية ونضج الخلايا الكروية الغضروفية. تم تحسين هذا البروتوكول لإنشاء غلاف غضروفي عالي الجودة مع تعبير قوي عن علامات الغضروف الزجاجي بطريقة فعالة من حيث التكلفة وقابلة للتطوير ، ومناسبة للأبحاث والتطبيقات السريرية في إصلاح الغضاريف.
Protocol
تمت مراجعة الدراسة والموافقة عليها من قبل لجنة الأخلاقيات التابعة ل LOPUKHIN FRCC PCM (البروتوكول رقم 2019/02 بتاريخ 9 أبريل 2019). تم الحصول على جميع عينات المانحين وفقا لمبادئ إعلان هلسنكي. تم الحصول على الموافقة المستنيرة من جميع المشاركين و / أو الأوصياء القانونيين عليهم.
ملاحظة: حافظ على تقنية التعقيم طوال البروتوكول. قم بتسخين جميع وسائط ومحاليل الاستزراع إلى 37 درجة مئوية قبل وضعها على الخلايا أو الكرويات. زراعة الخلايا في حاضنة ثاني أكسيد الكربون2 عند 37 درجة مئوية ، مع 5٪ ثاني أكسيد الكربون2 على 80٪ رطوبة. يظهر مخطط البروتوكول في الشكل 1.

الشكل 1: بروتوكول لإنتاج الغلاف الغضروفي من خط iPSC IPSRG4S. (أ) في البداية, يتم استزراع iPSCs في وسائط الخلايا الجذعية متعددة القدرات حتى 80٪ يتم الوصول إلى التقاء. (ب) للحث على التمايز نحو النسب الغضروفية, ثم يتم استزراع iPSCs في وسط A 2 أيام. يتم استبدال الوسط لاحقا بتركيبة تفتقر إلى مثبط Chir 99021 و Rho kinase ، ويتم زراعة الخلايا لمدة 6 أيام إضافية مع تغييرات متوسطة كل يومين. (ج) ثم يتم نقل الخلايا إلى الوسط B لتعزيز تكوين الغضروف لمدة 10 أيام قادمة. (د) بمجرد تحقيق عدد كاف من الخلية، تتقدم العملية إلى مرحلة إنتاج الكرويات. (ه) يتم تجميع الخلايا في كرويات في ظروف منخفضة الالتصاق تحت الجاذبية. (و) يتم استزراع الكرويات الناتجة في مفاعلات حيوية صغيرة ذات متوسط B. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
1. تحويل أطباق بتري إلى مفاعلات حيوية صغيرة
ملاحظة: التفاصيل الواردة في مقال سابق5.
- قم بتقطيع أنابيب أجهزة الطرد المركزي إلى حلقات بارتفاع 7-8 مم باستخدام مقص الأوتوكلاف المعقم (إعدادات الأوتوكلاف: 121 درجة مئوية (250 درجة فهرنهايت) عند 15 رطل لكل بوصة مربعة ، و 30 دقيقة ، وتجفيف ما بعد الأوتوكلاف لمدة 20 دقيقة).
- سحق أطباق بتري منخفضة الالتصاق أو غير المعالجة أو الميكروبيولوجية إلى قطع صغيرة. قم بإذابة ما يقرب من 1 جم من جزيئات البلاستيك في 10 مل من الكلوروفورم طوال الليل لإنشاء محلول بلاستيكي سائل. قم بإجراء هذا الإجراء في غطاء الدخان.
- تحقق من أن البلاستيك السائل لزج بدرجة كافية لسحب العينات. تأكد من أن القطرات تحافظ على شكل كروي بدلا من انتشارها على السطح. إذا كان المحلول رقيقا جدا ، أضف المزيد من الجزيئات البلاستيكية ، وعادة ما تتطلب 1-3 جم. إذا كان سميكا جدا ، أضف كلوروفورم إضافي ، وعادة ما يتطلب ما يصل إلى 5 مل.
- قم بتشكيل مقبض بلاستيكي في وسط طبق بتري معقم منخفض الالتصاق 60 مم باستخدام إحدى الطريقتين الفعالتين الموضحة أدناه.
- الخيار 1: ضع الحلقة البلاستيكية المعقمة في وسط طبق بتري ، ثم ضع البلاستيك السائل داخل الحلقة ؛ ستتطلب قطرة واحدة حوالي 100-200 ميكرولتر قطرات من البلاستيك السائل.
- الخيار 2: ضع نفس عدد قطرات البلاستيك السائل مباشرة في وسط طبق بتري دون استخدام الحلقة البلاستيكية.
- اترك الأطباق تجف مكشوفة لمدة 2-3 ساعات في غطاء التدفق الرقائقي. بعد التجفيف ، قم بتعريض الأطباق للأشعة فوق البنفسجية لمدة 20-30 دقيقة.
2. علاج أطباق الثقافة بالجيلاتين
- تحضير محلول جيلاتين 0.1٪ عن طريق إذابة مسحوق الجيلاتين في الماء المقطر عند 95 درجة مئوية. قم بتمرير المحلول بالتتابع عبر مرشحات غشائية 0.45 ميكرومتر و 0.25 ميكرومتر ، ثم قم بتخزين المرشح عند 4 درجات مئوية.
- مباشرة قبل إعادة بذر الخلايا الغضروفية ، ضع 3 مل من محلول الجيلاتين على قارورة 25 سم2 (يوصى باستخدام ما يصل إلى 15 جم من أنسجة الغضروف لكل قارورة T25). احتضن في درجة حرارة الغرفة (RT) لمدة 30 دقيقة ، وقم بإزالة الجيلاتين ، واشطفه مرتين باستخدام PBS ، واستمر في بذر الخلايا.
3. عزل وزراعة الخلايا الغضروفية
ملاحظة: يتم عزل الخلايا الغضروفية من مناطق الغضروف غير الحاملة للوزن من المرضى الذين يخضعون لاستبدال الركبة بالكامل. حصاد جميع العينات في ظروف معقمة وتخزينها في أنابيب معقمة مملوءة ب DMEM تحتوي على 200 وحدة / مل من محلول البنسلين / الستربتومايسين. قم بتخزين مناديل الغضروف في الثلاجة عند 2-8 درجة مئوية.
- ابدأ العلاج الأنزيمي في غضون يومين من حصاد الغضروف. اغسل قطع الغضروف في محلول هانكسباستخدام أطباق بتري مقاس 60 مم ، ثم قم بتقطيع الغضروف إلى شظايا يبلغ قطرها حوالي 1-2 مم باستخدام مقص معقم.
- نقل قطع الغضروف إلى أنابيب سعة 15 مل وهضمها في محلول كولاجيناز من النوع الثاني بنسبة 0.01٪ في DMEM ، حوالي 1 مل لكل 1 غرام من الغضروف ، في غضون 8-12 ساعة في حاضنة ثاني أكسيد الكربون2 مضبوطة على 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 ، رطوبة 100٪ ، تحت التحريك المستمر على شاكر مداري عند 150-200 دورة في الدقيقة.
- بعد الهضم ، اغسل شظايا الغضروف عن طريق إضافة DMEM إلى أنبوب سعة 15 مل ، ثم جهاز طرد مركزي بوزن 300 × جم لمدة 10 دقائق. أعد تعليق الشظايا في وسط زراعة الخلايا الغضروفية (الجدول التكميلي 1) وبذرها في قارورة لاصقة T25 مطلية مسبقا بمحلول جيلاتين 0.1٪.
- مرور الخلايا الغضروفية عند تحقيق كثافة ملتقى بنسبة 80٪.
- للمرور ، اغسل الخلايا الغضروفية بمحلول هانكس ، ثم احتضن الخلايا بمحلول التربسين بنسبة 0.25٪ عند 37 درجة مئوية لمدة 5 دقائق.
- لتعطيل التربسين ، أضف حجما متساويا من DMEM + 10٪ FBS. أعد تعليق الخلايا الغضروفية في وسط استزراع طازج ، ثم وزعها بنسبة 1: 3 ، مع بذر 20,000-30,000 خلية لكل 1 سم2.
- ضع قارورة الاستزراع في حاضنة على حرارة 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 و 100٪ رطوبة.
4. زراعة الخلايا الجذعية متعددة القدرات
ملاحظة: بالتعاون مع مختبر الخلايا الجذعية لمجموعة أبحاث الدماغ الجزيئي, قسم علم الأعصاب, A.I. معهد فيرتانين, جامعة شرق فنلندا, كوبيو, فنلندا, خط iPSCs IPSRG4S, تم إنشاؤه بنجاح في دراسةسابقة 8.
- زراعة iPSCs في 6 لوحات الآبار المغلفة مسبقا مع مصفوفة تحتوي على بروتينات خارج الخلية ( الشكل 1 أ). استخدم وسيطا للخلايا الجذعية متعددة القدرات (الجدول التكميلي 1).
- مرور الخلايا عند التقاء 80٪ ، مع الحفاظ على نسبة 1: 4 (50،000-75،000 خلية لكل 1 سم2). تقريبا 2-3 ساعة قبل الانفصال, نقل iPSCs إلى وسط للخلايا الجذعية متعددة القدرات التي تحتوي على مثبط رو كيناز Y27632 بتركيز نهائي 1 ميكرومتر ل 1 يوم.
- اغسل iPSCs بمحلول هانكس واحتضنه عند 37 درجة مئوية بمحلول التربسين 0.05٪. لتعطيل التربسين ، أضف حجما متساويا من DMEM + 10٪ FBS. جهاز الطرد المركزي لتعليق الخلية عند 200 × جم لمدة 5 دقائق في أنابيب 15 مل.
- تخلص من المادة الطافية الخلايا في وسط جديد للخلايا الجذعية متعددة القدرات. لتعزيز صلاحية الخلية ، أضف مثبط Rho kinase Y27632 إلى الوسط بتركيز نهائي قدره 1 ميكرومتر لمدة يوم واحد. ضع لوحة الاستزراع في حاضنة ثاني أكسيد الكربون2 مضبوطة على 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 ورطوبة 100٪.
5. التمايز الغضروفي من iPSCs
- ابدأ التمايز نحو سلالة الغضروف عن طريق زراعة الخلايا في الوسط أ (الجدول التكميلي 1) لأول يومين. في اليوم 3 ، استبدل Medium A بمحلول يستبعد Chir 99021 ومثبط Rho kinase مع الحفاظ على جميع المكونات الأخرى دون تغيير. قم بتغيير الوسيط كل يومين من الأيام 3 إلى 9 (الشكل 1 ب).
- في اليوم 10 ، انقل الخلايا الشبيهة بالخلايا الغضروفية إلى الوسط B (الجدول التكميلي 1) ، الذي تمت صياغته لتسهيل تكوين الغضروف. قم بتغيير الوسيط كل يومين لمدة 10 أيام (الشكل 1 ج).
- قم بإعداد لوحة ثقافة معلقة من 96 بئرا مسبقا عن طريق طلاء كل بئر بنسبة 1.5٪ من الاغاروز في الماء المقطر. تذوب الاغاروز في الميكروويف حتى الغليان (حوالي 60-90 ثانية عند 700 واط). بمجرد تسييل الاغاروز ، أضف 75 ميكرولتر من الاغاروز إلى كل بئر واتركه يتماسك عند RT (حوالي 15 دقيقة).
- أضف 150 ميكرولتر من وسط DMEM إلى كل بئر واحتضن اللوحة في حاضنة ثاني أكسيد الكربون2 لمدة 12 ساعة على الأقل.
ملاحظة: يمكن تخزين الألواح المحضرة لمدة تصل إلى شهر واحد في حاضنة ثاني أكسيد الكربون2 عند 37 درجة مئوية إذا تم تجديد الوسط في كل بئر للتعويض عن التبخر. - في اليوم 12 ، بعد ملاحظة التغيرات الظاهرية المرتبطة بتكوين الغضروف ، ابدأ تكوين الكرويات باستخدام الخلايا الشبيهة بالخلايا الغضروفية المتولدة.
ملاحظة: في هذه المرحلة, من المستحسن تحليل التعبير عن علامات غضروف الخلايا الرئيسية مع الكيمياء المناعية (المحكمة الجنائية الدولية) وتفاعل البوليميراز المتسلسل الكمي (qPCR) باستخدام طريقة 2-ΔΔCT 9 لتأكيد التمايز الغضروفي الناجح من iPSCs. أثناء الانتقال من صفيحة 6 آبار إلى قارورة ثقافة خلية 75 سم2 ، يمكن زرع جزء صغير من الخلايا في صفيحة 48 بئرا ، مطابقة لعدد العلامات المراد تحليلها. قم بإجراء تحليل ICC على هذه العينات للتحقق من التعبير الجيني.
6. تكوين الكرات من الخلايا المشتقة من الخلايا المشتقة من iPSC الشبيهة بالخلايا الغضروفية
- بعد الحصول على مشتقات تشبه الخلايا الغضروفية ، تمر الخلايا عند التقاء 80٪. افصل الخلايا عن الألواح المكونة من 6 آبار باستخدام محلول التربسين بنسبة 0.05٪. لتعطيل التربسين ، أضف حجما متساويا من DMEM + 10٪ FBS ، ثم انقل الخلايا إلى أنبوب 15 مل وجهاز طرد مركزي عند 200 × جم لمدة 5 دقائق.
- قم بإزالة المادة الطافية ، وأعد تعليق الخلايا في 1 مل من Medium B ، وانقلها إلى قارورة ثقافة خلية مقاس 75 سم2 مغلفة مسبقا بمحلول جيلاتين 0.1٪ (الشكل 1 د). بمجرد أن تصل الخلايا إلى 80٪ من التقاء كطبقة أحادية ، افصل الخلايا مرة أخرى باستخدام التربسين وأعد تعليقها في الوسط B كما هو موضح.
- نقل الخلايا إلى صفيحة 96 بئرا مغلفة بنسبة 1.5٪ agarose بكثافة 100,000 خلية لكل بئر. ازرع في الوسط ب ، مع إضافة 150 ميكرولتر من الوسط الكامل لكل بئر (الشكل 1 د ، 3 أ).
- حافظ على الخلايا في صفيحة 96 بئرا مغطاة ب 1.5٪ agarose لمدة لا تقل عن يوم واحد وبحد أقصى 3 أيام حتى تتشكل الكرويات (الشكل 2 ب). انقل الكرات الكروية من الآبار باستخدام طرف ماصة سعة 1 مل بنهاية مشذبة، ثم انقلها إلى أنبوب سعة 15 مل. اترك الكرويات تستقر لمدة 2-3 دقائق وقم بإزالة المادة الطافية.
- اغمر الكرويات في محلول مصفوفة غشاء القاعدي المذاب حديثا وغير المخفف الذي يتم الحفاظ عليه عند 4 درجات مئوية. بعد 30 دقيقة ، اجمع الكرات عن طريق الترسيب السلبي في أنبوب سعة 15 مل أو عن طريق الطرد المركزي اللطيف عند 100 × جم لمدة دقيقة واحدة.
ملاحظة: يجب إذابة المصفوفة طوال الليل على الثلج في ثلاجة 2-8 درجة مئوية. بعد الذوبان الأول ، يتم إجراء حصص ذات استخدام واحد للمصفوفة لتجنب دورات التجميد والذوبان المتكررة. يتم استخدام وتخزين البولي بروبلين أو غيرها من الأنابيب المتوافقة مع المجمد عند -70 درجة مئوية أو -20 درجة مئوية. كن حذرا لتاريخ انتهاء صلاحية الدفعة / الدفعة ، وهو 2 سنوات من تاريخ التصنيع. - انقل الكرويات إلى مفاعلات حيوية صغيرة وأضف 6 مل من Medium B. ضع المفاعل الحيوي الصغير على شاكر مداري داخل حاضنة ثاني أكسيد الكربون2 مضبوطة على 37 درجة مئوية مع 5٪ ثاني أكسيد الكربون2 ورطوبة 100٪ وسرعة تحريك 70-75 دورة في الدقيقة (الشكل 1F).
- قم بتغيير الوسط أسبوعيا أو كما هو مطلوب من خلال النضوب المتوسط أو تغيير لون مؤشر القاعدة الحمضية. للقيام بذلك ، اسمح للكرويات بالاستقرار عن طريق الجاذبية في أنبوب سعة 15 مل ، ثم قم بإزالة المادة الطافية بعناية. أضف Medium B الطازج إلى الأنبوب ، وانقل الكرويات مرة أخرى إلى المفاعلات الحيوية الصغيرة.
النتائج
البروتوكول الموضح موضح موضح في الشكل 1. تستخدم هذه المنهجية اثنين من وسائل الإعلام الثقافية المتميزة لدفع تمايز iPSCs إلى الخلايا الكروية الغضروفية على مدى مدة لا تقل عن 1 شهر (الشكل 2). تبدأ عملية التمايز عندما تحقق iPSCs 75٪-90٪ التقاء (الشكل 1 ب). تظهر المؤشرات المبكرة للتمايز الغضروفي في حوالي الأيام 9-10 من الزراعة في الوسط A ، والتي تتميز بالخلايا التي تتبنى خاصية مورفولوجية للخلايا الغضروفية. في اليوم 10 ، يتم نقل الخلايا إلى الوسط B (الشكل 1C) ويتم زراعتها حتى يكتمل التمايز بحلول اليوم 19 (الشكل 3). في هذه المرحلة ، كانت 99٪ من الخلايا إيجابية للعلامات الغضروفية - Aggrecan (ACAN) ، الكولاجين من النوع الأول (COL1A2) ، الكولاجين من النوع الثاني (COL2A1) ، SOX9 ولم تظهر أي تعبير عن علامات الخلايا متعددة القدرات TRA-1-81 و OCT4. تجدر الإشارة إلى أن مستوى عال من التعبير عن علامات الغضروف الرئيسية لا يلاحظ دائما في جميع الحالات. تعتبر الغلاف الغضروفي التي تحتوي على 90٪ -95٪ على الأقل من التعبير عن العلامات الجينية عالية الجودة. لذلك, تحليل إضافي للتعبير الجيني في عينات كروية, على سبيل المثال, في اليوم 30 من تمايز iPSC, ويوصي (الشكل 4 والشكل 5).
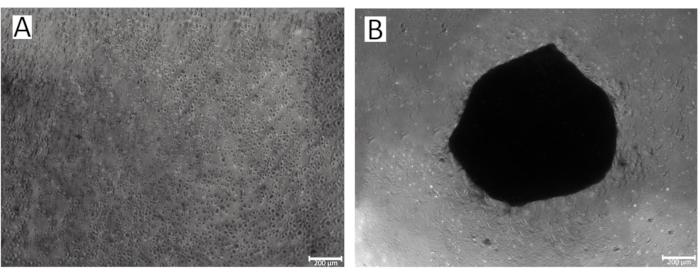
الشكل 2: عملية تكوين كروي في آبار صفيحة 96 بئرا. (أ) المرحلة الأولى من IPSRG4S تكوين كروي غضروفي الخلايا ؛ (ب) تتكون IPSRG4S كروية غضروفية في اليوم الثاني من الزراعة في ظل ظروف جاذبية منخفضة اللصق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التحليل الكيميائي المناعي للخلايا الغضروفية التي تم الحصول عليها من مصادر مختلفة. (أ-ل) تظهر مشتقات الخلايا الغضروفية من iPSCs التي تم الحصول عليها في اليوم 19 من بداية التمايز مستويات تعبير مماثلة لجينات علامات الخلايا الغضروفية الرئيسية (ACAN, E; COL2A1 ، ز ؛ SOX9 ، H) عند مقارنتها بمزارع الخلايا الغضروفية الأصلية عند الممر 2 (ACAN ، A ؛ COL2A1 ، ج ؛ SOX9 ، D). كانت ثقافة iPSCs بمثابة عنصر تحكم سلبي (ACAN, I; COL1A1 ، J ؛ COL2A1 ، ك ؛ SOX9 ، L). التعبير عن النوع الأول من الكولاجين يمكن مقارنته أيضا بين الخلايا الغضروفية الأصلية (COL1A1 ، B) وعينات الخلايا الغضروفية المشتقة من iPSCs (COL1A1 ، F). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
ركزت العملية بعد ذلك على تحديد العدد الأمثل لمشتقات iPSC الشبيهة بالخلايا الغضروفية المطلوبة لتوليد كروي (بناء على الحساب الذي يفتقر إلى أن كل بئر في صفيحة 96 بئر يحتاج إلى 100,000 خلية لإنتاج كروي واحد). استغرقت مرحلة التحضير هذه حوالي أسبوع واحد لإكمالها (الشكل 1 د). في المقابل ، فإن توليد الكرويات من الخلايا الغضروفية الأصلية لا يتضمن سوى الحصول على العدد الأمثل من الخلايا الغضروفية قبل الانتقال مباشرة إلى خطوة إنتاج الكروية.
في المرحلة اللاحقة ، تم جمع الخلايا باستخدام محلول يحتوي على حمض الإيثيلين ديامين تترا أسيتيك (EDTA) ، وتم زرع 100,000 خلية في كل بئر من 96 بئرا ، صفيحة ثقافة قاع على شكل حرف U مطلية مسبقا ب 1.5٪ من الاغاروز (الشكل 1E). ثم تم تحضين الخلايا في الوسط B لمدة 12 ساعة إلى 48 ساعة لتعزيز تكوين كروي. دعم كل بئر تجميع الخلايا في كروي واحد. بمجرد أن تتشكل الكرويات ، تم تغطيتها بمصفوفة خارج الخلية المذابة حديثا ونقلها إلى مفاعلات حيوية صغيرة محلية الصنع تحتوي على وسط B (الشكل 1F). تم وضع هذه المفاعلات الحيوية على شاكر مداري يدور بسرعة 70-75 دورة في الدقيقة. نضجت الكرات الكروية إلى الغلاف الغضروفي مع نمو موحد وتشكل ثابت عبر جميع العينات.
تتمتع الغلاف الغضروفي بإمكانات تكاثرية محدودة ، حيث تتوسع في الحجم بشكل أساسي خلال الشهر الأول ، مع إنتاج بروتينات المصفوفة خارج الخلية التي تقود هذا النمو. بعد شهرين من الزراعة ، كان الحد الأقصى للقطر الذي تم الوصول إليه هو 3-4 مم ، مع ظهور الغلاف الغضروفي عادة بقطر 1-2 مم (الشكل 4E ، J).
أظهرت العضيات الأكبر منطقة مركزية فضفاضة ، وغالبا ما تكون مصحوبة بتجاويف أو مناطق نخرية عبرت العضيات التي يبلغ عمرها شهر واحد عن علامات الخلايا الغضروفية ، بما في ذلك aggrecan و collagen type II و SOX9 (الشكل 4 والشكل 5). كانت مدة الزراعة المثلى للغلاف الغضروفي عالي الجودة حوالي شهر واحد.

الشكل 4: التحليل الكيميائي المناعي للكفيريات المتولدة من الخلايا الغضروفية من مصادر مختلفة. (أ-ج) تم إجراء تحليل ICC في اليوم 30 من بداية التمايز عندما تم استزراع الكرويات في مفاعلات حيوية صغيرة. التعبير عن الكولاجين الصغير والنوع 2 في الكرويات من الخلايا الغضروفية الأصلية (ACAN، A؛ A؛ COL2A1, C) والسكرويات الغضروفية المشتقة من iPSCs (ACAN, F; COL2A1 ، H) عند مستويات مماثلة. ومع ذلك ، فإن الكرويات الكروية الغضروفية المشتقة من iPSCs (COL1A1 ، G ، SOX9 ، I) ، مقارنة بالخلايا الغضروفية الأصلية (COL1A1 ، B ؛ SOX9 ، D) ، تتميز بمستويات أعلى من التعبير عن الكولاجين من النوع 1 و SOX9. كما يظهر مورفولوجيا الكرويات المشتقة من الخلايا الغضروفية الأصلية (E) والكرويات الغضروفية المشتقة من iPSCs (J) أثناء زراعة المفاعل الحيوي الصغير. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تحليل qPCR لمستويات التعبير عن العلامات الغضروفية الرئيسية في الكرويات. هذا التحليل لمستوى التعبير عن الجينات الغضروفية في الغلاف الغضروفي المولدة من الخلايا الغضروفية الأصلية والمشتقات الغضروفية من iPSCs يؤكد النتائج المعروضة أعلاه. تشير الرسوم البيانية إلى الدلالة الإحصائية للاختلافات حسب اختبار Tukey - ** p ≤ 0.01 ، ***p ≤ 0.001 ، ****p ≤ 0.0001. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
من المهم أن نلاحظ أنه أثناء تمايز iPSCs إلى سلالة غضروفية ، فإن الثقافة النهائية للغلاف الغضروفي تشبه إلى حد كبير الغضروف اليافع ، وتتميز بمرونة أكبر مقارنة بالغضروف الزجاجي. هذا يتناقض مع الكرات التي تم الحصول عليها من الخلايا الغضروفية الأصلية. يساهم وجود نمط ظاهري مختلط للخلايا الغضروفية داخل الغلاف الكروي ، يجمع بين الأنسجة الزجاجية والليفية ، في هذا الاختلاف.
الجدول التكميلي 1: تكوين الوسائط. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
تمثل iPSCs أداة تحويلية في الطب التجديدي, توفر القدرة على توليد الخلايا الغضروفية الخاصة بالمريض لإصلاح الغضروف. تستفيد البروتوكولات الحالية من التمايز الموجه من خلال مسارات الأديم المتوسط ، مع جزيئات الإشارات الرئيسية مثل TGF-β و BMP-2 التي تعزز التزام النسب الغضروفية. تهدف هذه الطرق إلى تكرار تطور الغضروف الجنيني ، مما يتيح إنتاج مكونات المصفوفة خارج الخلية مثل الكولاجين من النوع الثاني والأجغريكان ، وهو ضروري لأنسجة الغضروف الوظيفية. عززت التطورات في تقنيات الزراعة ثلاثية الأبعاد ، بما في ذلك مزارع الحبيبات والمعلقات ، القدرة على الحفاظ على نمط ظاهري غضروفي مستقر مع تقليل عدم التمايز10،11.
توفر المفاعلات الحيوية العديد من المزايا الرئيسية لزراعة كرويات الخلايا الغضروفية مقارنة بالأنظمة الأخرى12. تسهل المفاعلات الحيوية بشكل فعال نمو الأكرويات ثلاثية الأبعاد من خلال تقليد الظروف في الجسم الحي. إنها تمكن من تطوير تفاعلات مصفوفة الخلية الموزعة مكانيا والخلية والخلية الضرورية للخصائص الوظيفية للأنسجة الغضاريفية. أيضا ، يمكن تصميم المفاعلات الحيوية لتوفير بيئة مكروية خاضعة للرقابة ، بما في ذلك معلمات مثل معدلات نقل الأكسجين ، وتدفق المغذيات ، وإجهاد القص ، والتي تعتبر ضرورية للحفاظ على تمايز الخلايا الغضروفية وإنتاج المصفوفة خارجالخلية 13.
المفاعلات الحيوية الصغيرة ميسورة التكلفة أكثر بكثير من المفاعلات الحيوية المتاحة تجاريا. يستخدمون المواد المتاحة بسهولة وعمليات تجميع أبسط ، مما يجعلها في متناول المختبرات ذات التمويل المحدود ، مثل المفاعلات الحيوية الكلاسيكية. تعتبر المفاعلات الحيوية الصغيرة مناسبة تماما للدراسات الصغيرة وعالية الإنتاجية ، والتي تسمح للباحثين باختبار متغيرات متعددة في وقت واحد مثل وسائط الثقافة المختلفة أو عوامل النمو أو بروتوكولات التمايز.
يضمن استخدام المفاعلات الحيوية الصغيرة محلية الصنع تعرض كل عضوية لبيئة متسقة ، مما يقلل من مخاطر الازدحام أو الالتصاق غير المرغوب فيه. جودة ومرحلة نضوج الخلايا ضرورية لنجاح البروتوكول, مع التمايز الغضروفي يتطلب التقاء 75٪-90٪ ل iPSCs14. إذا كانت كثافة البذر منخفضة جدا, قد يحدث تمايز iPSC إلى أنواع الخلايا غير الغضروية. أثناء التمايز ، من الضروري الإمداد المنتظم بالوسط الطازج للخلايا والكرويات ، حيث يمكن أن يؤدي استنفاد المغذيات إلى الإضرار بجودة العضوية بشكل كبير.
قد يسمح بإدخال بعض التعديلات على البروتوكول طالما أنها لا تغير المبادئ الأساسية للإجراء. يمكن استخدام المواد الخاملة مثل البلاستيك الفلوري أو البولي إيثيلين أو البولي بروبلين لإنشاء مقبض في وسط المفاعل الحيوي الصغير. في حالة استخدام طبق بتري ميكروبيولوجي لتحضير البلاستيك السائل ، فقم بإخضاع المفاعلات الحيوية الصغيرة الناتجة لاختبار السمية الخلوية للتحقق من ملاءمتها لثقافة الخلايا الغضروفية. يمكن أن تكون أطباق بتري بأقطار مختلفة بمثابة قواعد مفاعل حيوي صغير ؛ ومع ذلك ، يجب ضبط سرعة الدوران وفقا لذلك ، حيث تعتمد السرعات المثلى على الحجم المتوسط. على سبيل المثال ، بالنسبة ل 8 مل من المتوسط في طبق بتري 6 سم ، فإن سرعة الدوران المثالية هي 70-75 دورة في الدقيقة.
لوحظ زيادة التعبير عن جين COL1A2 في الخلايا الكروية المشتقة من iPSC مقارنة بالكرات المكونة من الخلايا الغضروفية الأصلية ، مما يشير إلى وجود خلايا ذات نمط ظاهري مختلط (الشكل 5). يشير هذا التعبير الجيني المختلط إلى بنية أنسجة هجينة ، تشمل ميزات كل من الغضروف الزجاجي والليفي. قد يكون هذا الهيكل مفيدا ، لأنه يمكن أن يزيد من مرونة الأنسجة ، على الرغم من أن دراسات أخرى تشير إلى أن مكونات المصل قد تعزز تخليق الكولاجين من النوع الأول ، مما يساهم في التأثيرات الليفية15.
يحدد البروتوكول استبدال الوسط كل 5-7 أيام طوال فترة نضوج الكرات لمدة شهر في المفاعلات الحيوية الصغيرة ، مع التأكيد على الأهمية الحاسمة للممارسات المعقمة الصارمة. للتخفيف من مخاطر تلوث الميكوبلازما، يمكن دمج جرعة وقائية من مضادات الميكروبات. تقدم المفاعلات الحيوية الصغيرة محلية الصنع فوائد مميزة على البدائل التجارية ، لا سيما من حيث القدرة على تحمل التكاليف وسهولة الوصول والتصميم المضغوط. تسمح طبيعتها المدمجة بصيانة وحدات متعددة بشكل ملائم على شاكر مداري واحد داخل حاضنة. في المقابل ، غالبا ما يكون استيعاب عدد مماثل من المفاعلات الحيوية الصغيرة في حاضنة أمرا صعبا من الناحية اللوجستية.
Disclosures
ويعلن المؤلفون أن البحث أجري في غياب أي علاقات تجارية أو مالية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
Acknowledgements
تم دعم البحث بالتخصيص # 22-15-00250 من قبل مؤسسة العلوم الروسية.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin solution | Thermo Fisher Scientific | 25300-062 | |
| 0.25% Trypsin solution | Thermo Fisher Scientific | 25200-072 | |
| Advanced DMEM/F12 Eagle's medium | Thermo Fisher Scientific | 12634028 | |
| Aggrecan Monoclonal Antibody | Invitrogen | AHP0022 | Host: Mouse; Dilution: 1/500 |
| Ascorbic acid | Sigma | A4544 | 50 μg/mL |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | 1x or 2% |
| Beta-mercaptoethanol | Serva | 28625 | 90 mM |
| BMP2 | Miltenyi biotec | 130-110-922 | 10 ng/mL |
| Chir 99021 | Miltenyi biotec | 130-103-926 | 10 μM |
| COL1A1 (E6A8E) Monoclonal antibody | CellSignalling | 39952 | Host: Rabbit; Dilution: 1/800 |
| COL2A1 (M2139) Monoclonal antibody | Santa Cruz | sc-52658 | Host: Mouse; Dilution: 1/50 |
| Collagenase type II solution | PanEco | P011-2 | 0.01% |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma-Aldrich | D9542-5MG | 1 μg/mL |
| DMEM medium w/o glutamine | PanEco | ?420? | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | 10% |
| Hanks' solution | PanEco | ?020? | |
| Hybris 8 medium | PanEco | ?780?/?780 | |
| Insulin-Transferrin-Selenium solution | PanEco | ?065 | 1x solution has the following concentrations: Insulin: 10 µg/mL; Transferrin: 5.5 µg/mL; Selenium 5 ng/mL |
| L-alanyl-L-glutamine | Thermo Fisher Scientific | 35050038 | 2 mM |
| Matrigel Matrix | BD | 354277 | 300 μg/mL |
| Penicillin-Streptomycin solution | PanEco | ?063? | 100 U/mL |
| Retinoic acid | Miltenyi biotec | 130-117-339 | 10 nM |
| Rho kinase inhibitor Y27632 | Miltenyi biotec | 130-103-922 | 10 mM |
| Secondary Antibody Goat anti-Mouse IgG (H+L) Cross-Adsorbed, Alexa Fluor 555 | Thermo Fisher Scientific | A21422 | Host: Goat; Dilution: 1/500 |
| Secondary Antibody Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed, Alexa Fluor Plus 555 | Thermo Fisher Scientific | ?32732 | Host: Goat; Dilution: 1/500 |
| Sox9 (D8G8H) Monoclonal antibody | CellSignalling | 82630 | Host: Rb; Dilution: 1/400 |
| TeSR-1 medium | STEMCELL technologies | 85850 | |
| TGF-β1 | Miltenyi biotec | 130-095-067 | 10 ng/mL |
References
- Cieza, A., Causey, K., Kamenov, K., Hanson, S. W., Chatterji, S., Vos, T. Global estimates of the need for rehabilitation based on the Global Burden of Disease study 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 396, e10267(2021).
- Hua, C., Buttgereit, F., Combe, B. Glucocorticoids in rheumatoid arthritis: Current status and future studies. RMD Open. 6 (1), e000536(2020).
- Wang, M., et al. Articular cartilage repair biomaterials: Strategies and applications. Materials Today Bio. 24, e100948(2024).
- Lee, N., Bayaraa, O., Zechu, Z., Kim, H. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Rep. 54 (7), 356-367 (2021).
- Eremeev, A., Pikina, A., Ruchko, E., Sidorov, V., Ragozin, A. Fabrication of cartilage tissue substitutes from cells with induced pluripotency. Med Extrem Situat. 4, 30-41 (2022).
- Rodríguez Ruiz, A., et al. Cartilage from human-induced pluripotent stem cells: comparison with neo-cartilage from chondrocytes and bone marrow mesenchymal stromal cells. Cell Tissue Res. 386, 309-320 (2021).
- Eremeev, A., et al. Brain organoid generation from induced pluripotent stem cells in homemade mini bioreactors. J Vis Exp. 178, e62987(2021).
- Holmqvist, S., et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2, e16009(2016).
- Livak, K., Schmittgen, T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25 (40), 402-408 (2001).
- De Kinderen, P., et al. Differentiation of induced pluripotent stem cells into chondrocytes: Methods and applications for disease modeling and drug discovery. J Bone Miner Res. 37 (3), 397-410 (2022).
- Ali, E., et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 15 (1), 185(2024).
- Reina-Mahecha, A., Beers, M., van der Veen, H., Zuhorn, I., van Kooten, T., Sharma, P. A Review of the role of bioreactors for iPSCs-based tissue-engineered articular cartilage. Tissue Eng Regen Med. 20 (7), 1041-1052 (2023).
- Fu, L., et al. The application of bioreactors for cartilage tissue engineering: Advances, limitations, and future perspectives. Stem Cells Int. 2021, 6621806(2021).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Mol Ther Methods Clin Dev. 23, 569-581 (2021).
- Endo, K., Fujita, N., Nakagawa, T., Nishimura, R. Effect of fibroblast growth factor-2 and serum on canine mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 25 (11-12), 901-910 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved