Method Article
Generazione di sferoidi da vari condrociti utilizzando condizioni di bassa adesività per gravità e mini-bioreattori fatti in casa
In questo articolo
Riepilogo
Questo studio descrive un metodo per la produzione di sferoidi condrocitici aggregando le cellule in sferoidi in condizioni di bassa adesione utilizzando la gravità, seguita dalla coltura degli sferoidi risultanti in mini-bioreattori.
Abstract
La riparazione della cartilagine nelle malattie articolari croniche richiede terapie cellulari avanzate per rigenerare efficacemente i tessuti danneggiati. Questo protocollo fornisce un metodo graduale per differenziare le cellule staminali pluripotenti indotte (iPSC) in sferoidi basati su condrociti, supportando le applicazioni di ingegneria tissutale e terapia cellulare. Il processo di differenziazione è attentamente strutturato per promuovere l'impegno del lignaggio condrogenico, a partire da iPSC coltivate in terreni specifici che guidano in sequenza le cellule attraverso le fasi critiche del differenziamento. Inizialmente, le iPSC vengono espanse per raggiungere la confluenza ottimale prima dell'induzione verso il lignaggio condrogenico utilizzando una serie di cambiamenti di terreno definiti. Entro il decimo giorno, le cellule vengono trasferite in un mezzo che promuove la condrogenesi che migliora la formazione di cellule simili ai condrociti che esprimono marcatori chiave dei condrociti maturi. Un'ulteriore aggregazione in piastre rivestite di agarosio a 96 pozzetti porta alla formazione di sferoidi tridimensionali, che vengono poi coltivati in mini-bioreattori personalizzati progettati per simulare un microambiente che favorisce la deposizione di matrice extracellulare (ECM). Consentendo la produzione scalabile di sferoidi condrocitari che imitano le caratteristiche della cartilagine nativa, questo approccio offre una soluzione promettente e riproducibile per lo sviluppo di trattamenti cellulari per i difetti della cartilagine, fornendo un'ampia utilità per applicazioni cliniche e di ricerca nella medicina rigenerativa muscoloscheletrica.
Introduzione
La prevalenza della malattia articolare comporta notevoli oneri economici a causa del crescente numero di pazienti disabili e dei costi associati alla loro cura. La cartilagine ialina è un tessuto connettivo avascolare con un potenziale rigenerativo limitato1. L'uso prolungato di alcuni farmaci antinfiammatori non steroidei (FANS), glucocorticoidi e chemioterapia o radioterapia può ridurre ulteriormente la capacità rigenerativa della cartilagine, eliminando quasi completamente la sua capacità di guarire2. Ciò rende difficile ottenere cellule cartilaginee autologhe per la terapia cellulare.
La tecnologia della coltivazione di cellule tridimensionali (3D), compresi i condrociti, è stata a lungo riconosciuta come un'area di ricerca emergente con un potenziale significativo. Queste strutture 3D sono in fase di studio per applicazioni sia nella ricerca biologica di base che nella medicina rigenerativa. Gli sferoidi derivati da condrociti autologhi sono promettenti dal punto di vista terapeutico per affrontare la degenerazione del tessuto cartilagineo, una condizione che attualmente riceve una notevole attenzione a livello globale3.
Gli sferoidi derivati da condrociti differenziati dalle iPSC rappresentano un'alternativa promettente ai condrociti primari, offrendo vantaggi significativi per la riparazione della cartilagine. Le iPSC forniscono una capacità quasi illimitata di auto-rinnovamento e possiedono un ampio potenziale di differenziazione, che consente la produzione di condrociti in quantità sufficienti per applicazioni cliniche senza procedure invasive per la raccolta cellulare4. Inoltre, il passaggio dalle tradizionali colture di condrociti bidimensionali (2D) ai sistemi di coltura 3D, come le condrosfere, migliora ulteriormente la vitalità e la funzionalità di queste cellule creando un ambiente fisiologicamente più rilevante. Gli studi dimostrano che i condrociti coltivati in sferoidi 3D mantengono meglio il loro fenotipo, mostrando tassi più bassi di dedifferenziazione e livelli di espressione più elevati dei principali marcatori della cartilagine ialina, come il collagene di tipo II e l'aggrecano5.
Nonostante il potenziale delle condrosfere derivate da iPSC, i protocolli standardizzati per la generazione di condrosfere di alta qualità rimangono limitati. La variabilità dei protocolli tra gli studi porta spesso a incongruenze nella qualità dei condrociti e nella composizione della matrice extracellulare, influenzando la loro efficacia per l'uso terapeutico6. Qui, viene presentato un protocollo raffinato che standardizza la generazione di sferoidi da condrociti derivati da iPSC utilizzando mini-bioreattori economici e personalizzati. La fase di coltura del mini-bioreattore è essenziale, in quanto fornisce un'impostazione controllata e a bassa adesione che ottimizza la distribuzione dei nutrienti, la maturazione della ECM e la compattazione degli sferoidi7. Questa fase promuove una robusta espressione dei marcatori essenziali dei condrociti, tra cui il collagene di tipo II, l'aggrecan e SOX9, insieme a una composizione ECM che ricorda da vicino la cartilagine nativa. I cambi regolari dei terreni e l'attento controllo delle condizioni ambientali - temperatura, CO2 e velocità di rotazione - garantiscono ulteriormente la vitalità e la maturazione degli sferoidi dei condrociti. Questo protocollo è stato ottimizzato per creare condrosfere di alta qualità con una forte espressione di marcatori della cartilagine ialina in modo economico e scalabile, adatte per la ricerca e le applicazioni cliniche nella riparazione della cartilagine.
Protocollo
Lo studio è stato esaminato e approvato dal Comitato Etico del LOPUKHIN FRCC PCM (protocollo n. 2019/02 del 9 aprile 2019). Tutti i campioni dei donatori sono stati ottenuti in conformità con i principi della Dichiarazione di Helsinki. Il consenso informato è stato ottenuto da tutti i partecipanti e/o dai loro tutori legali.
NOTA: Mantenere la tecnica sterile per tutto il protocollo. Riscaldare tutti i terreni di coltura e le soluzioni a 37 °C prima di applicarli su cellule o sferoidi. Coltivare le cellule in un incubatore di CO2 a 37 °C, con il 5% di CO2 e l'80% di umidità. Lo schema del protocollo è illustrato nella Figura 1.

Figura 1: Protocollo per la produzione di condrosfere dalla linea iPSC IPSRG4S. (A) Inizialmente, le iPSC vengono coltivate in terreni di cellule staminali pluripotenti fino a raggiungere l'80% di confluenza. (B) Per indurre la differenziazione verso la linea condrocitica, le iPSC vengono poi coltivate nel terreno A per 2 giorni. Il terreno viene successivamente sostituito con una formulazione priva di Chir 99021 e dell'inibitore della Rho chinasi e le cellule vengono coltivate per altri 6 giorni con cambi di terreno ogni 2 giorni. (C) Le cellule vengono quindi trasferite al terreno B per promuovere la condrogenesi per i successivi 10 giorni. (D) Una volta raggiunto un numero sufficiente di cellule, il processo avanza allo stadio di produzione degli sferoidi. (E) Le cellule sono aggregate in sferoidi in condizioni di bassa aderenza per gravità. (F) Gli sferoidi risultanti vengono coltivati in mini-bioreattori con mezzo B. Clicca qui per visualizzare una versione più grande di questa figura.
1. Trasformazione di piastre di Petri in mini-bioreattori
NOTA: dettagli in un precedente articolo5.
- Tagliare le provette da centrifuga in anelli alti 7-8 mm utilizzando le forbici sterili per autoclave (impostazioni dell'autoclave: 121 °C (250 °F) a 15 psi, 30 min e asciugatura post-autoclave per 20 min).
- Frantumare le piastre di Petri a bassa adesione, non trattate o microbiologiche in piccoli pezzi. Sciogliere circa 1 g di particelle di plastica in 10 ml di cloroformio durante la notte per creare una soluzione di plastica liquida. Eseguire questa procedura in una cappa aspirante.
- Verificare che la plastica liquida sia sufficientemente viscosa per il pipettaggio. Assicurarsi che le goccioline mantengano una forma sferica piuttosto che diffondersi sulla superficie. Se la soluzione è troppo liquida, aggiungere altre particelle di plastica, richiedendo solitamente 1-3 g. Se è troppo denso, aggiungere altro cloroformio, che di solito richiede fino a 5 ml.
- Formare una manopola di plastica al centro di una piastra di Petri sterile a bassissima adesione da 60 mm utilizzando uno dei due metodi efficaci descritti di seguito.
- Opzione 1: posizionare l'anello di plastica autoclavato al centro della capsula di Petri, quindi applicare la plastica liquida all'interno dell'anello; una goccia richiederà circa 100-200 μL di gocce di plastica liquida.
- Opzione 2: Applicare lo stesso numero di gocce di plastica liquida direttamente al centro della capsula di Petri senza utilizzare l'anello di plastica.
- Lasciare asciugare le stoviglie scoperte per 2-3 ore in una cappa a flusso laminare. Dopo l'asciugatura, esporre le stoviglie ai raggi ultravioletti per 20-30 minuti.
2. Trattamento delle piastre di coltura con gelatina
- Preparare una soluzione di gelatina allo 0,1% sciogliendo la gelatina in polvere in acqua distillata a 95 °C. Far passare la soluzione in sequenza attraverso filtri a membrana da 0,45 μm e 0,25 μm, quindi conservare il filtrato a 4 °C.
- Immediatamente prima della risemina dei condrociti, applicare i 3 mL di soluzione di gelatina sul pallone da 25 cm2 (si consiglia fino a 15 g di tessuto cartilagineo per pallone T25). Incubare a temperatura ambiente (RT) per 30 min, rimuovere la gelatina, sciacquare due volte con PBS e procedere con la semina cellulare.
3. Isolamento e coltivazione dei condrociti
NOTA: I condrociti sono isolati da regioni cartilaginee non portanti di pazienti sottoposti a sostituzione totale del ginocchio. Raccogliere tutti i campioni in condizioni sterili e conservarli in provette sterili riempite con DMEM contenenti 200 U/mL di soluzione di penicillina/streptomicina. Conservare il tessuto cartilagineo in frigorifero a 2-8 °C.
- Iniziare il trattamento enzimatico entro 2 giorni dal prelievo della cartilagine. Lavare i pezzi di cartilagine nella soluzione di Hanks utilizzando piastre di Petri da 60 mm, quindi tagliare la cartilagine in frammenti di circa 1-2 mm di diametro utilizzando forbici autoclavate.
- Trasferire i pezzi di cartilagine in provette da 15 mL e digerirli in una soluzione di collagenasi 0,01% di tipo II in DMEM, circa 1 mL per 1 g di cartilagine, entro 8-12 ore in un incubatore di CO2 impostato a 37 °C con 5% di CO2, 100% di umidità, in continua agitazione su un agitatore orbitale a 150-200 giri/min.
- Dopo la digestione, lavare i frammenti di cartilagine aggiungendo DMEM in una provetta da 15 mL, quindi centrifugare a 300 × g per 10 min. Risospendere i frammenti in un terreno di coltura di condrociti (Tabella supplementare 1) e seminarli su un pallone adesivo T25 pre-rivestito con una soluzione di gelatina allo 0,1%.
- Passaggio dei condrociti quando si raggiunge una densità confluente dell'80%.
- Per il passaggio, lavare i condrociti con la soluzione di Hanks, quindi incubare le cellule con una soluzione di tripsina allo 0,25% a 37 °C per 5 minuti.
- Per inattivare la tripsina, aggiungere un volume uguale di DMEM + 10% FBS. Risospendere i condrociti in un terreno di coltura fresco, quindi distribuirli in un rapporto 1:3, seminando 20.000-30.000 cellule per 1 cm2.
- Porre il pallone di coltura in un incubatore a 37 °C con il 5% di CO2 e il 100% di umidità.
4. Coltivazione di cellule staminali pluripotenti
NOTA: In collaborazione con il Laboratorio di Cellule Staminali del Molecular Brain Research Group, Dipartimento di Neurobiologia, A.I. Virtanen Institute, Università della Finlandia Orientale, Kuopio, Finlandia, è stata generata con successo una linea di iPSCs IPSRG4S in un precedente studio8.
- Coltivare iPSC in piastre a 6 pozzetti pre-rivestite con una matrice contenente proteine extracellulari (Figura 1A). Utilizzare un terreno per le cellule staminali pluripotenti (Tabella supplementare 1).
- Celle di passaggio all'80% di confluenza, mantenendo un rapporto 1:4 (50.000-75.000 celle per 1 cm2). Circa 2-3 ore prima del distacco, trasferire le iPSC nel terreno per cellule staminali pluripotenti contenenti l'inibitore della chinasi Rho Y27632 a una concentrazione finale di 1 μM per 1 giorno.
- Lavare le iPSC con la soluzione di Hanks e incubare a 37 °C con una soluzione di tripsina allo 0,05%. Per inattivare la tripsina, aggiungere un volume uguale di DMEM + 10% FBS. Centrifugare la sospensione cellulare a 200 x g per 5 minuti in provette da 15 mL.
- Scartare il surnatante e risospendere le cellule in un terreno fresco per ottenere cellule staminali pluripotenti. Per migliorare la vitalità cellulare, aggiungere l'inibitore della chinasi Rho Y27632 al terreno a una concentrazione finale di 1 μM per 1 giorno. Posizionare la piastra di coltura in un incubatore a CO2 impostato a 37 °C con il 5% di CO2 e il 100% di umidità.
5. Differenziamento condrogenico delle iPSC
- Avviare la differenziazione verso la linea condrocitica coltivando cellule nel terreno A (Tabella supplementare 1) per i primi 2 giorni. Il giorno 3, sostituire il terreno A con una soluzione che escluda Chir 99021 e l'inibitore della Rho chinasi mantenendo invariati tutti gli altri componenti. Cambiare il mezzo ogni 2 giorni dal giorno 3 al giorno 9 (Figura 1B).
- Il giorno 10, trasferire le cellule simili ai condrociti nel terreno B (Tabella supplementare 1), formulato per facilitare la condrogenesi. Cambiare il fluido ogni 2 giorni per 10 giorni (Figura 1C).
- Preparare in anticipo una piastra di coltura in sospensione cellulare da 96 pozzetti rivestendo ogni pozzetto con agarosio all'1,5% in acqua distillata. Sciogliere l'agarosio in un forno a microonde fino a ebollizione (circa 60-90 s a 700 W). Una volta liquefatto l'agarosio, aggiungere 75 μL di agarosio a ciascun pozzetto e lasciarlo indurire a RT (circa 15 minuti).
- Aggiungere 150 μl di terreno DMEM a ciascun pozzetto e incubare la piastra in un incubatore di CO2 per almeno 12 ore.
NOTA: Le piastre preparate possono essere conservate per un massimo di 1 mese in un incubatore di CO2 a 37 °C se il terreno in ciascun pozzetto viene reintegrato per compensare l'evaporazione. - Il giorno 12, dopo aver osservato i cambiamenti fenotipici associati alla condrogenesi, avviare la formazione di sferoidi utilizzando le cellule simili ai condrociti generate.
NOTA: In questa fase, è consigliabile analizzare l'espressione di marcatori condrocitici chiave con immunocitochimica (ICC) e reazione a catena della polimerasi quantitativa (qPCR) utilizzando il metodo 2-ΔΔCT 9 per confermare il successo della differenziazione condrogenica delle iPSC. Durante il passaggio da una piastra a 6 pozzetti a un pallone per colture cellulari da 75 cm2 , una piccola porzione di cellule può essere seminata in una piastra a 48 pozzetti, in base al numero di marcatori da analizzare. Eseguire l'analisi ICC su questi campioni per verificare l'espressione genica.
6. Formazione di sferoidi da cellule derivate da iPSC simili ai condrociti
- Dopo aver ottenuto derivati simili ai condrociti, le cellule passano all'80% di confluenza. Staccare le cellule dalle piastre a 6 pozzetti utilizzando una soluzione di tripsina allo 0,05%. Per inattivare la tripsina, aggiungere un volume uguale di DMEM + 10% FBS, quindi trasferire le cellule in una provetta da 15 mL e centrifugare a 200 x g per 5 minuti.
- Rimuovere il surnatante, risospendere le cellule in 1 mL di terreno B e trasferirle in un pallone di coltura cellulare da 75 cm2 pre-rivestito con soluzione di gelatina allo 0,1% (Figura 1D). Una volta che le cellule raggiungono l'80% di confluenza come monostrato, staccare nuovamente le cellule con la tripsina e risospendere nel terreno B come descritto.
- Trasferire le cellule in una piastra da 96 pozzetti rivestita con agarosio all'1,5% a una densità di 100.000 cellule per pozzetto. Coltivare nel terreno B, aggiungendo 150 μl di terreno completo per pozzetto (Figura 1D, 3A).
- Mantenere le cellule nella piastra a 96 pozzetti rivestite con agarosio all'1,5% per un minimo di 1 giorno e un massimo di 3 giorni fino alla formazione di sferoidi (Figura 2B). Trasferire gli sferoidi dai pozzetti utilizzando un puntale per pipetta da 1 mL con un'estremità tagliata, quindi trasferirli in una provetta da 15 mL. Lasciare riposare gli sferoidi per 2-3 minuti e rimuovere il surnatante.
- Immergere gli sferoidi in una soluzione di matrice a membrana basale appena scongelata e non diluita mantenuta a 4 °C. Dopo 30 minuti, raccogliere gli sferoidi per sedimentazione passiva in una provetta da 15 mL o per centrifugazione delicata a 100 x g per 1 minuto.
NOTA: La matrice deve essere scongelata per una notte con ghiaccio in frigorifero a 2-8 °C. Dopo il primo scongelamento, vengono realizzate aliquote monouso della matrice per evitare ripetuti cicli di gelo-scongelamento. I tubi in polipropilene o altri tubi compatibili con il congelatore vengono utilizzati e conservati a -70 °C o -20 °C. Prestare attenzione alla data di scadenza del lotto/lotto, che è di 2 anni dalla data di produzione. - Trasferire gli sferoidi nei mini-bioreattori e aggiungere 6 mL di terreno B. Posizionare il mini-bioreattore su un agitatore orbitale all'interno di un incubatore di CO2 impostato a 37 °C con il 5% di CO2 e il 100% di umidità e una velocità di agitazione di 70-75 giri/min (Figura 1F).
- Cambiare il terreno settimanalmente o come richiesto dall'esaurimento del medio o dal cambiamento di colore dell'indicatore acido-base. Per fare ciò, lasciare che gli sferoidi si depositino per gravità in una provetta da 15 mL, quindi rimuovere con cura il surnatante. Aggiungere il terreno B fresco al tubo e trasferire gli sferoidi ai mini-bioreattori.
Risultati
Il protocollo delineato è illustrato nella Figura 1. Questa metodologia impiega due terreni di coltura distinti per guidare la differenziazione delle iPSC in sferoidi condrocitari per una durata minima di 1 mese (Figura 2). Il processo di differenziazione inizia quando le iPSC raggiungono una confluenza del 75%-90% (Figura 1B). I primi indicatori di differenziazione condrogenica emergono intorno al 9-10° giorno di coltivazione nel terreno A, caratterizzati dall'adozione da parte delle cellule di una morfologia caratteristica dei condrociti. Il giorno 10, le cellule vengono trasferite nel terreno B (Figura 1C) e coltivate fino al completamento della differenziazione entro il giorno 19 (Figura 3). In questa fase, il 99% delle cellule era positivo per i marcatori condrogenici - Aggrecan (ACAN), Collagene di tipo I (COL1A2), Collagene di tipo II (COL2A1), SOX9 e non mostrava alcuna espressione dei marcatori cellulari pluripotenti TRA-1-81 e OCT4. Vale la pena notare che in tutti i casi non si osserva sempre un alto livello di espressione dei marcatori condrocitici chiave. Le condrosfere con almeno il 90%-95% di espressione di marcatori genici sono considerate di alta qualità; pertanto, si raccomanda un'ulteriore analisi dell'espressione genica in campioni di sferoidi, ad esempio il giorno 30 di differenziazione delle iPSC (Figura 4 e Figura 5).
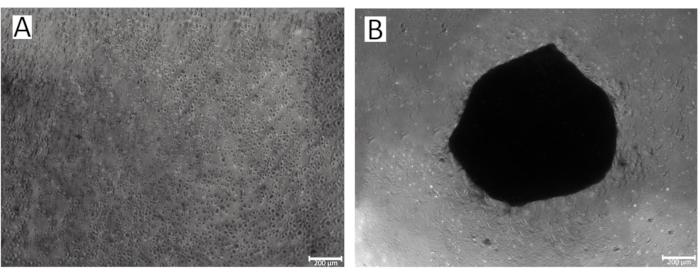
Figura 2: Processo di formazione degli sferoidi nei pozzetti di una piastra a 96 pozzetti. (A) La fase iniziale della formazione di sferoidi condrocitici IPSRG4S; (B) Formato IPSRG4S sferoide condrocitico il giorno 2 di coltivazione in condizioni di bassa adesività e gravità. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Analisi immunoistochimica di condrociti ottenuti da varie fonti. (A-L) I derivati dei condrociti dalle iPSC ottenuti entro il giorno 19 dall'inizio del differenziamento mostrano livelli di espressione simili dei geni marcatori chiave dei condrociti (ACAN, E; COL2A1, G; SOX9, H) rispetto alle colture di condrociti nativi al passaggio 2 (ACAN, A; COL2A1, C; SOX9, D). La cultura delle iPSC fungeva da controllo negativo (ACAN, I; COL1A1, J; COL2A1, K; SOX9, L). L'espressione del collagene di tipo I è anche comparabile tra i condrociti nativi (COL1A1, B) e i campioni di condrociti derivati da iPSC (COL1A1, F). Clicca qui per visualizzare una versione più grande di questa figura.
Il processo si è poi concentrato sulla determinazione del numero ottimale di derivati iPSC simili ai condrociti necessari per la generazione di sferoidi (sulla base del calcolo che ogni pozzetto in una piastra da 96 pozzetti ha bisogno di 100.000 cellule per produrre un singolo sferoide). Questa fase di preparazione ha richiesto circa 1 settimana per essere completata (Figura 1D). Al contrario, la generazione di sferoidi da condrociti nativi comporta solo l'ottenimento del numero ottimale di condrociti prima di procedere direttamente alla fase di produzione degli sferoidi.
Nella fase successiva, le cellule sono state raccolte utilizzando una soluzione contenente acido etilendiamminotetraacetico (EDTA) e 100.000 cellule sono state seminate in ciascun pozzetto di una piastra di coltura con fondo a U a 96 pozzetti pre-rivestita con agarosio all'1,5% (Figura 1E). Le cellule sono state poi incubate nel terreno B per 12-48 ore per promuovere la formazione di sferoidi. Ogni pozzetto supportava l'aggregazione di cellule in un singolo sferoide. Una volta che gli sferoidi si sono formati, sono stati rivestiti con matrice extracellulare appena scongelata e trasferiti in mini-bioreattori fatti in casa contenenti il terreno B (Figura 1F). Questi bioreattori sono stati posizionati su un agitatore orbitale rotante a 70-75 giri/min. Gli sferoidi sono maturati in condrosfere con crescita uniforme e morfogenesi coerente in tutti i campioni.
Le condrosfere hanno un potenziale proliferativo limitato, espandendosi principalmente in dimensioni durante il mese iniziale, con la produzione di proteine della matrice extracellulare che guidano questa crescita. Dopo 2 mesi di coltivazione, il diametro massimo raggiunto era di 3-4 mm, con condrosfere che mostravano tipicamente un diametro di 1-2 mm (Figura 4E,J).
Gli organoidi più grandi mostravano una zona centrale sciolta, spesso accompagnata da cavità o aree necrotiche. Gli organoidi che hanno 1 mese esprimevano marcatori condrociti, tra cui aggrecano, collagene di tipo II e SOX9 (Figura 4 e Figura 5). La durata ottimale della coltivazione di condrosfere di alta qualità è stata di circa 1 mese.

Figura 4: Analisi immunoistochimica di sferoidi generati da condrociti di varie fonti. (A-J) L'analisi ICC è stata condotta il giorno 30 dall'inizio della differenziazione, quando gli sferoidi sono stati coltivati in mini-bioreattori. L'espressione dell'aggrecano e del collagene di tipo 2 negli sferoidi dei condrociti nativi (ACAN, A; COL2A1, C) e di sferoidi condrocitici derivati da iPSC (ACAN, F; COL2A1, H) è a livelli simili. Tuttavia, gli sferoidi condrocitici derivati da iPSC (COL1A1, G, SOX9, I), rispetto ai condrociti nativi (COL1A1, B; SOX9, D), sono caratterizzati da livelli di espressione più elevati di collagene di tipo 1 e SOX9. Viene anche mostrata la morfologia degli sferoidi derivati dai condrociti nativi (E) e degli sferoidi condrocitici derivati dalle iPSC (J) durante la coltivazione di mini-bioreattori. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: analisi qPCR dei livelli di espressione di marcatori condrogenici chiave negli sferoidi. Questa analisi del livello di espressione dei geni condrocitici nelle condrosfere generate da condrociti nativi e derivati condrocitici di iPSC conferma i risultati presentati sopra. I grafici indicano la significatività statistica delle differenze secondo il test di Tukey - **p ≤ 0,01, ***p ≤ 0,001, ****p ≤ 0,0001. Clicca qui per visualizzare una versione più grande di questa figura.
È importante notare che durante la differenziazione delle iPSC in linea condrocitica, la coltura finale delle condrosfere è più simile alla cartilagine giovanile, caratterizzata da una maggiore elasticità rispetto alla cartilagine ialina. Questo contrasta con gli sferoidi ottenuti dai condrociti nativi. La presenza di un fenotipo di condrociti misti all'interno dello sferoide, che combina tessuto ialino e fibroso, contribuisce a questa differenza.
Tabella supplementare 1: Composizione dei media. Clicca qui per scaricare questa tabella.
Discussione
Le iPSC rappresentano uno strumento trasformativo nella medicina rigenerativa, offrendo il potenziale per generare condrociti specifici per il paziente per la riparazione della cartilagine. I protocolli attuali sfruttano la differenziazione diretta attraverso le vie mesodermiche, con molecole di segnalazione chiave come TGF-β e BMP-2 che promuovono l'impegno del lignaggio condrocitico. Questi metodi mirano a replicare lo sviluppo della cartilagine embrionale, consentendo la produzione di componenti della matrice extracellulare come il collagene di tipo II e l'aggrecan, essenziali per il tessuto cartilagineo funzionale. I progressi nelle tecniche di coltura 3D, comprese le colture in pellet e in sospensione, hanno migliorato la capacità di mantenere un fenotipo condrocitico stabile riducendo al contempo la dedifferenziazione10,11.
I bioreattori offrono diversi vantaggi chiave per la coltivazione di sferoidi di condrociti rispetto ad altri sistemi12. I bioreattori facilitano efficacemente la crescita di sferoidi 3D imitando le condizioni in vivo. Consentono lo sviluppo di interazioni cellula-matrice e cellula-cellula distribuite spazialmente che sono essenziali per le proprietà funzionali del tessuto cartilagineo. Inoltre, i bioreattori possono essere personalizzati per fornire un microambiente controllato, inclusi parametri come le velocità di trasferimento dell'ossigeno, il flusso di nutrienti e lo stress di taglio, che sono fondamentali per mantenere la differenziazione dei condrociti e la produzione di matrice extracellulare13.
I mini bioreattori sono significativamente più convenienti dei bioreattori disponibili in commercio. Utilizzano materiali prontamente disponibili e processi di assemblaggio più semplici, rendendoli accessibili ai laboratori con finanziamenti limitati, come i bioreattori classici. I mini-bioreattori sono adatti per studi su piccola scala e ad alto rendimento, che consentono ai ricercatori di testare contemporaneamente più variabili come diversi terreni di coltura, fattori di crescita o protocolli di differenziazione.
L'utilizzo di mini-bioreattori fatti in casa garantisce che ogni organoide sia esposto a un ambiente coerente, riducendo i rischi di affollamento o adesione indesiderata. La qualità e lo stadio di maturazione delle cellule sono essenziali per il successo del protocollo, con la differenziazione condrogenica che richiede una confluenza del 75%-90% per le iPSC14. Se la densità di semina è troppo bassa, può verificarsi la differenziazione delle iPSC in tipi di cellule non condrogeniche. Durante la differenziazione, è essenziale un apporto regolare di terreno fresco alle cellule e agli sferoidi, poiché l'esaurimento dei nutrienti può compromettere significativamente la qualità degli organoidi.
Alcune modifiche al protocollo possono essere autorizzate, purché non alterino i principi fondamentali della procedura. Materiali inerti come fluoroplastici, polietilene o polipropilene possono essere utilizzati per creare una manopola al centro del mini-bioreattore. Se si utilizza una capsula di Petri microbiologica per preparare la plastica liquida, sottoporre i mini-bioreattori risultanti a test di citotossicità per verificarne l'idoneità alla coltura di condrociti. Le piastre di Petri di vari diametri possono fungere anche da basi per mini-bioreattori; Tuttavia, la velocità di rotazione deve essere regolata di conseguenza, poiché le velocità ottimali dipendono dal volume medio. Ad esempio, per 8 ml di terreno in una piastra di Petri da 6 cm, la velocità di rotazione ideale è di 70-75 giri/min.
È stato osservato un aumento dell'espressione del gene COL1A2 negli sferoidi dei condrociti derivati da iPSC rispetto agli sferoidi formati da condrociti nativi, indicando la presenza di cellule con un fenotipo misto (Figura 5). Questa espressione genica mista suggerisce una struttura tissutale ibrida, che comprende le caratteristiche della cartilagine ialina e fibrosa. Tale struttura può essere vantaggiosa, in quanto potrebbe aumentare la resilienza dei tessuti, sebbene altri studi suggeriscano che i componenti del siero possano promuovere la sintesi del collagene di tipo I, contribuendo agli effetti fibrotici15.
Il protocollo specifica la sostituzione del terreno ogni 5-7 giorni durante la maturazione di un mese degli sferoidi in mini-bioreattori, sottolineando l'importanza critica di rigorose pratiche sterili. Per mitigare il rischio di contaminazione da micoplasma, può essere incorporata una dose profilattica di antimicrobici. I mini-bioreattori fatti in casa presentano vantaggi distinti rispetto alle alternative commerciali, in particolare in termini di convenienza, facilità di accesso e design compatto. La loro natura compatta consente di mantenere comodamente più unità su un singolo agitatore orbitale all'interno di un incubatore. Al contrario, l'alloggiamento di un numero comparabile di mini-bioreattori agitati in un incubatore si rivela spesso impegnativo dal punto di vista logistico.
Divulgazioni
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che possano essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
La ricerca è stata supportata con l'assegnazione #22-15-00250 dalla Russian Science Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin solution | Thermo Fisher Scientific | 25300-062 | |
| 0.25% Trypsin solution | Thermo Fisher Scientific | 25200-072 | |
| Advanced DMEM/F12 Eagle's medium | Thermo Fisher Scientific | 12634028 | |
| Aggrecan Monoclonal Antibody | Invitrogen | AHP0022 | Host: Mouse; Dilution: 1/500 |
| Ascorbic acid | Sigma | A4544 | 50 μg/mL |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | 1x or 2% |
| Beta-mercaptoethanol | Serva | 28625 | 90 mM |
| BMP2 | Miltenyi biotec | 130-110-922 | 10 ng/mL |
| Chir 99021 | Miltenyi biotec | 130-103-926 | 10 μM |
| COL1A1 (E6A8E) Monoclonal antibody | CellSignalling | 39952 | Host: Rabbit; Dilution: 1/800 |
| COL2A1 (M2139) Monoclonal antibody | Santa Cruz | sc-52658 | Host: Mouse; Dilution: 1/50 |
| Collagenase type II solution | PanEco | P011-2 | 0.01% |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma-Aldrich | D9542-5MG | 1 μg/mL |
| DMEM medium w/o glutamine | PanEco | ?420? | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | 10% |
| Hanks' solution | PanEco | ?020? | |
| Hybris 8 medium | PanEco | ?780?/?780 | |
| Insulin-Transferrin-Selenium solution | PanEco | ?065 | 1x solution has the following concentrations: Insulin: 10 µg/mL; Transferrin: 5.5 µg/mL; Selenium 5 ng/mL |
| L-alanyl-L-glutamine | Thermo Fisher Scientific | 35050038 | 2 mM |
| Matrigel Matrix | BD | 354277 | 300 μg/mL |
| Penicillin-Streptomycin solution | PanEco | ?063? | 100 U/mL |
| Retinoic acid | Miltenyi biotec | 130-117-339 | 10 nM |
| Rho kinase inhibitor Y27632 | Miltenyi biotec | 130-103-922 | 10 mM |
| Secondary Antibody Goat anti-Mouse IgG (H+L) Cross-Adsorbed, Alexa Fluor 555 | Thermo Fisher Scientific | A21422 | Host: Goat; Dilution: 1/500 |
| Secondary Antibody Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed, Alexa Fluor Plus 555 | Thermo Fisher Scientific | ?32732 | Host: Goat; Dilution: 1/500 |
| Sox9 (D8G8H) Monoclonal antibody | CellSignalling | 82630 | Host: Rb; Dilution: 1/400 |
| TeSR-1 medium | STEMCELL technologies | 85850 | |
| TGF-β1 | Miltenyi biotec | 130-095-067 | 10 ng/mL |
Riferimenti
- Cieza, A., Causey, K., Kamenov, K., Hanson, S. W., Chatterji, S., Vos, T. Global estimates of the need for rehabilitation based on the Global Burden of Disease study 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 396, e10267(2021).
- Hua, C., Buttgereit, F., Combe, B. Glucocorticoids in rheumatoid arthritis: Current status and future studies. RMD Open. 6 (1), e000536(2020).
- Wang, M., et al. Articular cartilage repair biomaterials: Strategies and applications. Materials Today Bio. 24, e100948(2024).
- Lee, N., Bayaraa, O., Zechu, Z., Kim, H. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Rep. 54 (7), 356-367 (2021).
- Eremeev, A., Pikina, A., Ruchko, E., Sidorov, V., Ragozin, A. Fabrication of cartilage tissue substitutes from cells with induced pluripotency. Med Extrem Situat. 4, 30-41 (2022).
- Rodríguez Ruiz, A., et al. Cartilage from human-induced pluripotent stem cells: comparison with neo-cartilage from chondrocytes and bone marrow mesenchymal stromal cells. Cell Tissue Res. 386, 309-320 (2021).
- Eremeev, A., et al. Brain organoid generation from induced pluripotent stem cells in homemade mini bioreactors. J Vis Exp. 178, e62987(2021).
- Holmqvist, S., et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2, e16009(2016).
- Livak, K., Schmittgen, T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25 (40), 402-408 (2001).
- De Kinderen, P., et al. Differentiation of induced pluripotent stem cells into chondrocytes: Methods and applications for disease modeling and drug discovery. J Bone Miner Res. 37 (3), 397-410 (2022).
- Ali, E., et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 15 (1), 185(2024).
- Reina-Mahecha, A., Beers, M., van der Veen, H., Zuhorn, I., van Kooten, T., Sharma, P. A Review of the role of bioreactors for iPSCs-based tissue-engineered articular cartilage. Tissue Eng Regen Med. 20 (7), 1041-1052 (2023).
- Fu, L., et al. The application of bioreactors for cartilage tissue engineering: Advances, limitations, and future perspectives. Stem Cells Int. 2021, 6621806(2021).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Mol Ther Methods Clin Dev. 23, 569-581 (2021).
- Endo, K., Fujita, N., Nakagawa, T., Nishimura, R. Effect of fibroblast growth factor-2 and serum on canine mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 25 (11-12), 901-910 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon