Method Article
在重力和自制微型生物反应器下使用低粘附条件从各种软骨细胞生成球状体
摘要
本研究描述了一种通过在低粘附条件下利用重力将细胞聚集成球状体,然后在微型生物反应器中培养所得球状体来生产软骨细胞球状体的方法。
摘要
慢性关节疾病中的软骨修复需要先进的基于细胞的疗法来有效地再生受损组织。该方案提供了一种将诱导多能干细胞 (iPSC) 分化为基于软骨细胞的球体的分步方法,支持组织工程和细胞治疗应用。分化过程经过精心设计,以促进软骨形成谱系定型,从在特定培养基中培养的 iPSC 开始,依次引导细胞通过分化的关键阶段。最初,iPSC 扩增以达到最佳汇合度,然后使用一系列确定的培养基变化诱导至软骨形成谱系。到第 10 天,细胞转变为促进软骨形成的培养基,该培养基可增强表达成熟软骨细胞关键标志物的软骨细胞样细胞的形成。在 96 孔琼脂糖包被板中进一步聚集导致形成三维球状体,然后在定制的微型生物反应器中培养,该反应器旨在模拟促进细胞外基质 (ECM) 沉积的微环境。通过实现模拟天然软骨特征的软骨细胞球体的可扩展生产,这种方法为开发基于细胞的软骨缺损治疗方法提供了一种有前途的、可重复的解决方案,为肌肉骨骼再生医学的临床和研究应用提供了广泛的应用。
引言
由于残疾患者数量的增加和与其护理相关的成本,关节病的流行导致了巨大的经济负担。透明软骨是一种再生潜力有限的结缔无血管组织1。长期使用某些非甾体抗炎药 (NSAID)、糖皮质激素以及化疗或放疗会进一步降低软骨的再生能力,几乎消除其愈合能力2。这使得获得用于细胞治疗的自体软骨细胞变得具有挑战性。
包括软骨细胞在内的三维 (3D) 细胞培养技术长期以来一直被认为是具有巨大潜力的新兴研究领域。这些 3D 结构正在基础生物学研究和再生医学中的应用。源自自体软骨细胞的球状体有望解决软骨组织退化问题,这种情况目前受到全球的广泛关注3。
源自从 iPSC 分化的软骨细胞的球状体代表了原代软骨细胞的有前途的替代品,为软骨修复提供了显着优势。iPSC 提供了几乎无限的自我更新能力,并具有广泛的分化潜力,这允许产生足够数量的软骨细胞用于临床应用,而无需侵入性细胞采集程序4。此外,从传统的二维 (2D) 软骨细胞培养过渡到 3D 培养系统(如软骨球),通过创造更具生理相关性的环境,进一步增强了这些细胞的活力和功能。研究表明,在 3D 球状体中培养的软骨细胞更好地维持其表型,表现出较低的去分化率和较高的关键透明软骨标志物(如 II 型胶原和聚集蛋白聚糖5)的表达水平。
尽管 iPSC 衍生的软骨球具有潜力,但用于生成高质量软骨球的标准化方案仍然有限。不同研究方案的差异通常会导致软骨细胞质量和细胞外基质组成的不一致,从而影响其治疗效果6。在这里,提出了一种改进的方案,该方案使用经济实惠的定制微型生物反应器标准化地从 iPSC 衍生的软骨细胞生成球体。微型生物反应器培养阶段是必不可少的,因为它提供了一个受控的低粘附设置,可优化营养分配、ECM 成熟和球状体压实7。该阶段促进必需软骨细胞标志物的强烈表达,包括 II 型胶原、聚集蛋白聚糖和 SOX9,以及与天然软骨非常相似的 ECM 组成。定期更换培养基和仔细控制环境条件(温度、CO2 和转速)可进一步确保软骨细胞球体的活力和成熟度。该方案已经过优化,以经济高效且可扩展的方式创建具有透明软骨标志物强烈表达的高质量软骨球,适用于软骨修复的研究和临床应用。
研究方案
该研究由 LOPUKHIN FRCC PCM 伦理委员会审查和批准(2019 年 4 月 9 日第 2019/02 号协议)。所有供体样本均根据赫尔辛基宣言的原则获得。已获得所有参与者和/或其法定监护人的知情同意。
注意:在整个方案中保持无菌技术。将所有培养基和溶液加热至 37 °C,然后再将其应用于细胞或球状体。在 37 °C 的 CO2 培养箱中培养细胞,在 5% CO2 和 80% 湿度下。协议方案如图 1 所示。

图 1:从 iPSC 系 IPSRG4S 生产软骨球的方案。 (A) 最初,iPSC 在多能干细胞培养基中培养,直至达到 80% 汇合。(B) 为了诱导向软骨细胞系分化,然后将 iPSC 在培养基 A 中培养 2 天。随后用缺乏 Chir 99021 和 Rho 激酶抑制剂的制剂替换培养基,并将细胞再培养 6 天,每 2 天更换一次培养基。(C) 然后将细胞转移到培养基 B 中,以促进接下来 10 天的软骨生成。(D) 一旦达到足够的细胞数量,该过程就会进入球状体生产阶段。(E) 在重力作用下,细胞在低粘附条件下聚集成球状体。(F) 所得球体在含有培养基 B 的微型生物反应器中培养。 请点击此处查看此图的较大版本。
1. 将培养皿转化为微型生物反应器
注意:详情见上一篇文章5.
- 使用无菌高压灭菌剪刀将离心管切成 7-8 mm 高的环(高压灭菌器设置:121 °C (250 °F),15 psi,30 分钟,高压灭菌后干燥 20 分钟)。
- 将低粘附力、未经处理或微生物培养皿粉碎成小块。将大约 1 g 塑料颗粒溶解在 10 mL 氯仿中过夜,以形成液态塑料溶液。在通风橱中执行此程序。
- 验证液态塑料是否具有足够的粘性以进行移液。确保液滴保持球形,而不是在表面上扩散。如果溶液太稀,则添加更多的塑料颗粒,通常需要 1-3 g。如果太稠,请添加额外的氯仿,通常需要 5 mL。
- 使用下面概述的两种有效方法之一,在无菌、超低粘附力的 60 mm 培养皿的中心形成一个塑料旋钮。
- 选项 1:将高压灭菌的塑料环放在培养皿的中央,然后在环内涂抹液态塑料;一滴大约需要 100-200 μL 液态塑料。
- 选项 2:将相同数量的液态塑料滴直接滴入培养皿的中心,而不使用塑料环。
- 让餐具在层流罩中不加盖晾干 2-3 小时。干燥后,将培养皿暴露在紫外线照射下 20-30 分钟。
2. 用明胶处理培养皿
- 通过将明胶粉溶解在 95 °C 的蒸馏水中来制备 0.1% 明胶溶液。 将溶液依次通过 0.45 μm 和 0.25 μm 膜过滤器,然后将滤液储存在 4 °C。
- 在软骨细胞重新接种之前,立即将 3 mL 明胶溶液涂抹在 25 cm2 培养瓶中(建议每个 T25 培养瓶最多使用 15 g 软骨组织)。在室温 (RT) 下孵育 30 分钟,去除明胶,用 PBS 冲洗两次,然后进行细胞接种。
3. 软骨细胞的分离和培养
注意:软骨细胞是从接受全膝关节置换术患者的非负重软骨区域分离出来的。在无菌条件下收获所有标本,并将其储存在装有含有 200 U/mL 青霉素/链霉素溶液的 DMEM 的无菌管中。将软骨组织储存在 2-8 °C 的冰箱中。
- 在软骨收获后 2 天内开始酶处理。使用 60 毫米培养皿在 Hanks 溶液中清洗软骨块,然后使用高压灭菌剪刀将软骨切成直径约 1-2 毫米的碎片。
- 将软骨块转移到 15 mL 试管中,并在 DMEM 中的 0.01% 胶原酶 II 型溶液中消化它们,每 1 g 软骨约 1 mL,在设置为 37 °C 的 CO2 培养箱中,5% CO 2,100% 湿度,在轨道振荡器上以 150-200 rpm 的速度连续搅拌。
- 消化后,将 DMEM 加入 15 mL 试管中洗涤软骨碎片,然后以 300 × g 离心 10 分钟。将片段重悬于软骨细胞培养基中(补充表 1),并将它们接种到预涂有 0.1% 明胶溶液的粘合剂 T25 烧瓶上。
- 当汇合密度达到 80% 时传代软骨细胞。
- 对于传代,用 Hanks 溶液洗涤软骨细胞,然后将细胞与 0.25% 胰蛋白酶溶液在 37 °C 下孵育 5 分钟。
- 要灭活胰蛋白酶,请添加等体积的 DMEM + 10% FBS。在新鲜培养基中重悬软骨细胞,然后以 1:3 的比例分布,每 1 cm2 接种 20,000-30,000 个细胞。
- 将培养瓶置于 37 °C、5% CO2 和 100% 湿度的培养箱中。
4. 多能干细胞的培养
注:与芬兰库奥皮奥东芬兰大学 AI Virtanen 研究所神经生物学系分子脑研究小组的干细胞实验室合作,在之前的一项研究中成功生成了 iPSCs 系IPSRG4S8。
- 在预涂有含有细胞外蛋白的基质的 6 孔板中培养 iPSC( 图 1A)。使用多能干细胞培养基(补充表 1)。
- 以 80% 汇合度传代细胞,保持 1:4 的比例(每 1 cm2 50,000-75,000 个细胞)。在分离前约 2-3 小时,将 iPSC 转移到含有终浓度为 1 μM 的 Rho 激酶抑制剂 Y27632 的多能干细胞培养基中,持续 1 天。
- 用Hanks溶液洗涤iPSC,并在37°C下与0.05%胰蛋白酶溶液孵育。要灭活胰蛋白酶,请添加等体积的 DMEM + 10% FBS。在 15 mL 试管中以 200 x g 离心细胞悬液 5 分钟。
- 弃去上清液,将细胞重悬于多能干细胞的新鲜培养基中。为了提高细胞活力,将 Rho 激酶抑制剂 Y27632 以终浓度 1 μM 添加到培养基中,持续 1 天。将培养板置于 CO2 培养箱中,培养箱温度设置为 37 °C,CO2 浓度为 5%,湿度为 100%。
5. iPSC 的软骨形成分化
- 通过在培养基 A 中培养细胞前 2 天(补充表 1)开始向软骨细胞系分化。第 3 天,用排除 Chir 99021 和 Rho 激酶抑制剂的溶液替换培养基 A,同时保持所有其他组分不变。从第 3 天到第 9 天每 2 天更换一次培养基(图 1B)。
- 第 10 天,将软骨细胞样细胞转移到培养基 B 中(补充表 1),培养基 B 的配方可促进软骨生成。每 2 天更换一次培养基,持续 10 天(图 1C)。
- 通过在蒸馏水中包被每个孔中,提前制备 96 孔细胞悬浮培养板 1.5%。在微波炉中熔化琼脂糖直至沸腾(在 700 W 下约 60-90 秒)。琼脂糖液化后,向每个孔中加入 75 μL 琼脂糖,并使其在 RT 下硬化(约 15 分钟)。
- 向每个孔中加入 150 μL DMEM 培养基,并将板在 CO2 培养箱中孵育至少 12 小时。
注:如果补充每个孔中的培养基以补偿蒸发,则制备的板可以在 37 °C 的 CO2 培养箱中储存长达 1 个月。 - 第 12 天,在观察到与软骨形成相关的表型变化后,使用产生的软骨细胞样细胞开始球状体形成。
注意:在此阶段,建议使用 2-ΔΔCT 方法9 通过免疫细胞化学 (ICC) 和定量聚合酶链反应 (qPCR) 分析关键软骨细胞标志物的表达,以确认 iPSC 的成功软骨形成分化。在从 6 孔板传代到 75 cm2 细胞培养瓶的过程中,可以将一小部分细胞接种到 48 孔板中,与要分析的标记物数量相匹配。对这些样品进行 ICC 分析以验证基因表达。
6. 从软骨细胞样 iPSC 衍生的细胞形成球状体
- 获得软骨细胞样衍生物后,以 80% 汇合度传代细胞。使用 0.05% 胰蛋白酶溶液从 6 孔板中分离细胞。要灭活胰蛋白酶,加入等体积的 DMEM + 10% FBS,然后将细胞转移至 15 mL 试管中,并以 200 x g 离心 5 分钟。
- 去除上清液,将细胞重悬于 1 mL 培养基 B 中,然后转移至预涂有 0.1% 明胶溶液的 75 cm2 细胞培养瓶中(图 1D)。一旦细胞达到 80% 的单层汇合度,再次用胰蛋白酶分离细胞,并如上所述重悬于培养基 B 中。
- 将细胞以每孔 100,000 个细胞的密度转移到涂有 1.5% 琼脂糖的 96 孔板中。在培养基 B 中培养,每孔添加 150 μL 完全培养基(图 1D、 3A)。
- 将细胞在涂有 1.5% 琼脂糖的 96 孔板中维持至少 1 天,最多 3 天,直到形成球体(图 2B)。使用末端修剪的 1 mL 移液器吸头从孔中转移球状体,然后转移到 15 mL 试管中。让球体沉降 2-3 分钟并去除上清液。
- 将球体浸入新鲜解冻的未稀释基底膜基质溶液中,保持在 4 °C 下。 30 分钟后,通过在 15 mL 试管中被动沉降或以 100 x g 的离心力轻轻离心 1 分钟来收集球状体。
注意:基质应在 2-8 °C 冰箱中在冰上解冻过夜。第一次解冻后,制备一次性使用的基质等分试样,以避免重复冻融循环。使用聚丙烯或其他与冰箱兼容的试管,并在 -70 °C 或 -20 °C 下储存。 请注意批次/批次的有效期,即自生产日期起 2 年。 - 将球体转移到微型生物反应器中,并加入 6 mL 培养基 B。将微型生物反应器放在 CO2 培养箱内的轨道振荡器上,培养箱设置为 37 °C,具有 5% CO2 和 100% 湿度,搅拌速度为 70-75 rpm(图 1F)。
- 每周更换培养基,或根据酸碱指示剂的培养基消耗或颜色变化的要求更换培养基。为此,让球体在 15 mL 试管中通过重力沉降,然后小心去除上清液。将新鲜的培养基 B 添加到试管中,并将球状体转移回微型生物反应器中。
结果
概述的协议如图 1 所示。该方法采用两种不同的培养基,在至少 1 个月的时间内驱动 iPSC 分化为软骨细胞球体(图 2)。当 iPSC 达到 75%-90% 汇合时,分化过程开始(图 1B)。在培养基 A 中培养的第 9-10 天左右出现软骨形成分化的早期指标,其特征是细胞采用软骨细胞的形态特征。在第 10 天,将细胞转移至培养基 B 中(图 1C)并培养直至第 19 天分化完成(图 3)。在这个阶段,99% 的细胞对软骨形成标志物 - 聚集蛋白聚糖 (ACAN)、I 型胶原蛋白 (COL1A2)、II 型胶原蛋白 (COL2A1)、SOX9 呈阳性,并且多能细胞标志物 TRA-1-81 和 OCT4 没有表达。值得注意的是,并非在所有情况下都观察到关键软骨细胞标志物的高水平表达。具有至少 90%-95% 基因标记表达的软骨球被认为是高质量的;因此,建议在球状体样品中进行额外的基因表达分析,例如,在 iPSC 分化的第 30 天(图 4 和 图 5)。
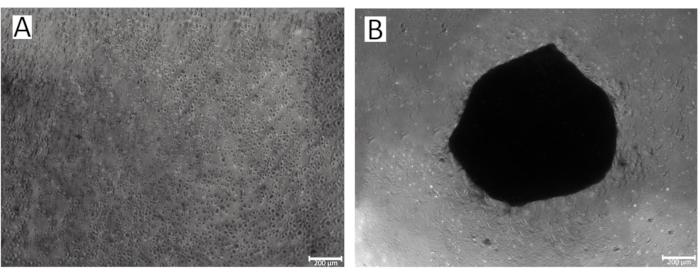
图 2: 96 孔板孔中球状体形成的过程。 (A) IPSRG4S软骨细胞球状体形成的初始阶段; (B) 在低粘附力、重力条件下IPSRG4S培养第 2 天形成软骨细胞球体。 请单击此处查看此图的较大版本。

图 3:从各种来源获得的软骨细胞的免疫组织化学分析。 (A-L)在分化开始第 19 天获得的 iPSC 的软骨细胞衍生物显示出关键软骨细胞标志基因 (ACAN, E;COL2A1,G;SOX9, H) 与第 2 代的天然软骨细胞培养物 (ACAN, A;COL2A1,C;SOX9, D) 的iPSCs 培养物作为阴性对照 (ACAN, I;COL1A1, J;COL2A1,K;SOX9, L) 的 SOX9, L)。I 型胶原的表达在天然软骨细胞 (COL1A1, B) 和 iPSC 来源的软骨细胞样品 (COL1A1, F) 之间也相当。请单击此处查看此图的较大版本。
接下来,该过程侧重于确定球状体生成所需的软骨细胞样 iPSC 衍生物的最佳数量(基于 96 孔板中每个孔需要 100,000 个细胞才能产生单个球状体的计算)。这个准备阶段大约需要 1 周才能完成(图 1D)。相比之下,从天然软骨细胞生成球体仅涉及在直接进行球体生产步骤之前获得最佳数量的软骨细胞。
在后续阶段,使用含乙二胺四乙酸 (EDTA) 的溶液收集细胞,并将 100,000 个细胞接种到预涂有 1.5% 琼脂糖的 96 孔 U 形底培养板的每个孔中(图 1E)。然后将细胞在培养基 B 中孵育 12 小时至 48 小时,以促进球状体形成。每个孔都支持细胞聚集成单个球体。一旦球体形成,它们就被涂上新鲜解冻的细胞外基质,并转移到含有培养基 B 的自制微型生物反应器中(图 1F)。将这些生物反应器放置在以 70-75 rpm 旋转的轨道振荡器上。球体成熟为软骨球,在所有样品中具有均匀的生长和一致的形态发生。
软骨球的增殖潜力有限,主要在最初一个月扩大大小,细胞外基质蛋白的产生推动了这种生长。培养 2 个月后,达到的最大直径为 3-4 毫米,软骨球的直径通常为 1-2 毫米(图 4E,J)。
较大的类器官表现出松散的中央区,通常伴有空腔或坏死区域。1 个月大的类器官表达软骨细胞标志物,包括聚集蛋白聚糖、II 型胶原和 SOX9(图 4 和图 5)。优质软骨球的最佳培养持续时间约为 1 个月。

图 4:对各种来源的软骨细胞产生的球状体进行免疫组织化学分析。 (A-J)在分化开始的第 30 天进行 ICC 分析,此时球体在微型生物反应器中培养。天然软骨细胞 (ACAN, A;COL2A1, C) 和 iPSC 衍生的软骨细胞球体 (ACAN, F;COL2A1, H) 处于相似水平。然而,与天然软骨细胞 (COL1A1, B;SOX9、D) 的特征是 1 型和 SOX9 型胶原蛋白的表达水平较高。还显示了在微型生物反应器培养过程中源自天然软骨细胞 (E) 的球体和源自 iPSC (J) 的软骨细胞球体的形态。请单击此处查看此图的较大版本。

图 5:球状体中关键软骨形成标志物表达水平的 qPCR 分析。 对天然软骨细胞和 iPSC 软骨细胞衍生物产生的软骨球中软骨细胞基因表达水平的分析证实了上述结果。这些图表显示了 Tukey 检验 - **p ≤ 0.01、***p ≤ 0.001、****p ≤ 0.0001 的差异统计显著性。 请单击此处查看此图的较大版本。
值得注意的是,在 iPSC 分化为软骨细胞谱系的过程中,软骨球的最终培养更类似于幼年软骨,其特征是与透明软骨相比具有更大的弹性。这与从天然软骨细胞获得的球状体形成鲜明对比。球状体内存在混合软骨细胞表型,结合透明组织和纤维组织,导致了这种差异。
补充表 1:介质的组成。请点击此处下载此表格。
讨论
iPSC 代表了再生医学中的一种变革性工具,具有产生患者特异性软骨细胞用于软骨修复的潜力。目前的方案利用通过中胚层途径的定向分化,TGF-β 和 BMP-2 等关键信号分子促进软骨细胞谱系定型。这些方法旨在复制胚胎软骨发育,从而能够产生细胞外基质成分,例如 II 型胶原蛋白和聚集蛋白聚糖,这对功能性软骨组织至关重要。3D 培养技术的进步,包括沉淀和悬浮培养,增强了维持稳定软骨细胞表型的能力,同时减少了去分化10,11。
与其他系统相比,生物反应器为培养软骨细胞球体提供了几个关键优势12。生物反应器通过模拟体内条件有效地促进 3D 球体的生长。它们能够发展空间分布的细胞-基质和细胞-细胞相互作用,这对软骨组织的功能特性至关重要。此外,生物反应器可以定制以提供受控的微环境,包括氧转移速率、营养物质流动和剪切应力等参数,这些参数对于维持软骨细胞分化和细胞外基质产生至关重要13。
微型生物反应器比市售生物反应器便宜得多。它们利用现成的材料和更简单的组装工艺,使资金有限的实验室(如经典生物反应器)易于使用。微型生物反应器非常适合小规模、高通量研究,使研究人员能够同时测试多个变量,例如不同的培养基、生长因子或分化方案。
使用自制的微型生物反应器可确保每个类器官都暴露在一致的环境中,从而降低拥挤或不必要的粘附风险。细胞的质量和成熟阶段对于方案的成功至关重要,iPSC 的软骨形成分化需要 75%-90% 的汇合度14。如果接种密度太低,则可能会发生 iPSC 分化为非软骨形成细胞类型。在分化过程中,定期向细胞和球状体供应新鲜培养基是必不可少的,因为营养消耗会严重损害类器官质量。
只要不改变程序的基本原则,就可以允许对协议进行某些修改。氟塑料、聚乙烯或聚丙烯等惰性材料可用于在微型生物反应器的中心创建一个旋钮。如果使用微生物培养皿制备液体塑料,则对所得微型生物反应器进行细胞毒性测试,以验证其是否适合软骨细胞培养。各种直径的培养皿也可以用作微型生物反应器底座;但是,必须相应地调整转速,因为最佳速度取决于介质体积。例如,对于 6 cm 培养皿中的 8 mL 培养基,理想的转速为 70-75 rpm。
与天然软骨细胞形成的球体相比,在 iPSC 衍生的软骨细胞球体中观察到 COL1A2 基因的表达增加,表明存在具有混合表型的细胞(图 5)。这种混合基因表达表明混合组织结构,包括透明软骨和纤维软骨的特征。这样的结构可能是有利的,因为它可以增加组织弹性,尽管其他研究表明血清成分可能会促进 I 型胶原蛋白的合成,从而导致纤维化效应15。
该方案规定在微型生物反应器中球体为期一个月的成熟过程中每 5-7 天更换一次培养基,强调了严格无菌实践的至关重要性。为了降低支原体污染的风险,可以加入预防剂量的抗菌药物。与商业替代品相比,自制微型生物反应器具有明显的优势,特别是在经济性、易于访问和紧凑的设计方面。其紧凑的特性使多个单元可以方便地保存在培养箱内的单个轨道摇床上。相比之下,在培养箱中容纳相当数量的搅拌式微型生物反应器通常被证明在物流上具有挑战性。
披露声明
作者声明,该研究是在没有任何可能被解释为潜在利益冲突的商业或财务关系的情况下进行的。
致谢
该研究得到了俄罗斯科学基金会分配 #22-15-00250 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin solution | Thermo Fisher Scientific | 25300-062 | |
| 0.25% Trypsin solution | Thermo Fisher Scientific | 25200-072 | |
| Advanced DMEM/F12 Eagle's medium | Thermo Fisher Scientific | 12634028 | |
| Aggrecan Monoclonal Antibody | Invitrogen | AHP0022 | Host: Mouse; Dilution: 1/500 |
| Ascorbic acid | Sigma | A4544 | 50 μg/mL |
| B-27 supplement | Thermo Fisher Scientific | 17504044 | 1x or 2% |
| Beta-mercaptoethanol | Serva | 28625 | 90 mM |
| BMP2 | Miltenyi biotec | 130-110-922 | 10 ng/mL |
| Chir 99021 | Miltenyi biotec | 130-103-926 | 10 μM |
| COL1A1 (E6A8E) Monoclonal antibody | CellSignalling | 39952 | Host: Rabbit; Dilution: 1/800 |
| COL2A1 (M2139) Monoclonal antibody | Santa Cruz | sc-52658 | Host: Mouse; Dilution: 1/50 |
| Collagenase type II solution | PanEco | P011-2 | 0.01% |
| DAPI (4',6-diamidino-2-phenylindole) | Sigma-Aldrich | D9542-5MG | 1 μg/mL |
| DMEM medium w/o glutamine | PanEco | ?420? | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | 10% |
| Hanks' solution | PanEco | ?020? | |
| Hybris 8 medium | PanEco | ?780?/?780 | |
| Insulin-Transferrin-Selenium solution | PanEco | ?065 | 1x solution has the following concentrations: Insulin: 10 µg/mL; Transferrin: 5.5 µg/mL; Selenium 5 ng/mL |
| L-alanyl-L-glutamine | Thermo Fisher Scientific | 35050038 | 2 mM |
| Matrigel Matrix | BD | 354277 | 300 μg/mL |
| Penicillin-Streptomycin solution | PanEco | ?063? | 100 U/mL |
| Retinoic acid | Miltenyi biotec | 130-117-339 | 10 nM |
| Rho kinase inhibitor Y27632 | Miltenyi biotec | 130-103-922 | 10 mM |
| Secondary Antibody Goat anti-Mouse IgG (H+L) Cross-Adsorbed, Alexa Fluor 555 | Thermo Fisher Scientific | A21422 | Host: Goat; Dilution: 1/500 |
| Secondary Antibody Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed, Alexa Fluor Plus 555 | Thermo Fisher Scientific | ?32732 | Host: Goat; Dilution: 1/500 |
| Sox9 (D8G8H) Monoclonal antibody | CellSignalling | 82630 | Host: Rb; Dilution: 1/400 |
| TeSR-1 medium | STEMCELL technologies | 85850 | |
| TGF-β1 | Miltenyi biotec | 130-095-067 | 10 ng/mL |
参考文献
- Cieza, A., Causey, K., Kamenov, K., Hanson, S. W., Chatterji, S., Vos, T. Global estimates of the need for rehabilitation based on the Global Burden of Disease study 2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 396, e10267(2021).
- Hua, C., Buttgereit, F., Combe, B. Glucocorticoids in rheumatoid arthritis: Current status and future studies. RMD Open. 6 (1), e000536(2020).
- Wang, M., et al. Articular cartilage repair biomaterials: Strategies and applications. Materials Today Bio. 24, e100948(2024).
- Lee, N., Bayaraa, O., Zechu, Z., Kim, H. Biomaterials-assisted spheroid engineering for regenerative therapy. BMB Rep. 54 (7), 356-367 (2021).
- Eremeev, A., Pikina, A., Ruchko, E., Sidorov, V., Ragozin, A. Fabrication of cartilage tissue substitutes from cells with induced pluripotency. Med Extrem Situat. 4, 30-41 (2022).
- Rodríguez Ruiz, A., et al. Cartilage from human-induced pluripotent stem cells: comparison with neo-cartilage from chondrocytes and bone marrow mesenchymal stromal cells. Cell Tissue Res. 386, 309-320 (2021).
- Eremeev, A., et al. Brain organoid generation from induced pluripotent stem cells in homemade mini bioreactors. J Vis Exp. 178, e62987(2021).
- Holmqvist, S., et al. Creation of a library of induced pluripotent stem cells from Parkinsonian patients. NPJ Parkinsons Dis. 2, e16009(2016).
- Livak, K., Schmittgen, T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method. Methods. 25 (40), 402-408 (2001).
- De Kinderen, P., et al. Differentiation of induced pluripotent stem cells into chondrocytes: Methods and applications for disease modeling and drug discovery. J Bone Miner Res. 37 (3), 397-410 (2022).
- Ali, E., et al. iPSCs chondrogenic differentiation for personalized regenerative medicine: a literature review. Stem Cell Res Ther. 15 (1), 185(2024).
- Reina-Mahecha, A., Beers, M., van der Veen, H., Zuhorn, I., van Kooten, T., Sharma, P. A Review of the role of bioreactors for iPSCs-based tissue-engineered articular cartilage. Tissue Eng Regen Med. 20 (7), 1041-1052 (2023).
- Fu, L., et al. The application of bioreactors for cartilage tissue engineering: Advances, limitations, and future perspectives. Stem Cells Int. 2021, 6621806(2021).
- Castro-Viñuelas, R., et al. Tips and tricks for successfully culturing and adapting human induced pluripotent stem cells. Mol Ther Methods Clin Dev. 23, 569-581 (2021).
- Endo, K., Fujita, N., Nakagawa, T., Nishimura, R. Effect of fibroblast growth factor-2 and serum on canine mesenchymal stem cell chondrogenesis. Tissue Eng Part A. 25 (11-12), 901-910 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。