Method Article
전체 마운트 면역 조직 화학 및 3D 재건을 사용하여 인두 아치 동맥의 시각화 및 분석
요약
여기서, 우리는 전체 마운트 면역 형광, 조직 정리, 공초점 현미경 및 3D 재건을 사용하여 마우스 배아의 인두 아치 동맥 3, 4 및 6을 시각화하고 분석하는 프로토콜을 설명합니다.
초록
인두 아치 동맥의 부적절한 형성 또는 리모델링 (PAA) 3, 4, 6은 선천성 심장 질환의 가장 심각한 형태의 일부에 기여합니다. PAA의 형성을 연구하기 위하여는, 우리는 벤질 알콜/벤질 벤조에이트 (BABB) 조직 정리 및 공초점 현미경 검사법과 결합된 전체 마운트 면역 형광을 사용하여 프로토콜을 개발했습니다. 이를 통해 미세한 세포 해상도에서 인두 아치 내피의 시각화뿐만 아니라 혈관 구조의 3D 연결을 가능하게합니다. 소프트웨어를 사용하여 PAA의 내피 세포(EC)의 수와 인두 아치 내의 PA를 둘러싼 혈관 신경총 내의 EC 수를 정량화하는 프로토콜을 확립했습니다 3, 4 및 6. 전체 배아에 적용하면이 방법론은 배아 혈관 구조의 포괄적 인 시각화 및 정량 분석을 제공합니다.
서문
마우스 배아 발생 동안, 인두 아치 동맥 (PAA)은 등등 aortae1과심장을 연결하는 대칭, 이중 측면 동맥 쌍으로 발생합니다. 배아가 발달함에 따라, PAA의 제1 및 제2 쌍은 회귀하고,3rd,4th,및 6PAA는 대동맥 아치 동맥을 형성하기 위해 일련의 비대칭 리모델링 이벤트를 겪는다2.
PAA 3, 4 및 6은 혈관 형성을 통해 발전하며, 이는 혈관의 드노보형성인 3. 이러한 아치 동맥의 형성 또는 리모델링의 결함은 DiGeorge 증후군4,5환자에서 볼 수있는 것과 같은 다양한 선천성 심장 결함을 야기합니다. 그러므로, PAA의 발달을 통제하는 기계장치를 이해하는 것은 선천성 심장병 (CHD) 병인학의 더 나은 이해로 이끌어 낼 수 있습니다.
PAA 발달을 시각화하고 분석하기 위한 현재 접근법은 조직 단면도의 면역형광, 혈관 캐스트, 인도 잉크 주입, 고분해능 후피 현미경 검사법 및/또는 전체 마운트 면역조직화학1,,4,,5,,6,,7을포함한다. 본 명세서에서, 우리는 체적 데이터, 혈관 연결성 및 세포 정체성을 수집, 분석 및 정량화하기 위해 전체 마운트 면역형광, 공초점 현미경 및 3D 이미지 렌더링을 결합한 프로토콜을 설명한다. 또한, 우리는 인두 아치 의 형성과 PAA로의 리모델링을 연구하는 수단으로 각 인두 아치의 EC 수를 구획화하고 정량화하는 방법을 자세히 설명합니다. 이 프로토콜은 PAA 개발을 분석하기 위해 설계되었지만 다른 개발 혈관 네트워크를 분석하는 데 사용할 수 있습니다.
프로토콜
동물 사용 및 절차는 러트거스 대학의 기관 동물 관리 및 사용 위원회에 의해 승인되었습니다.
1. 솔루션 준비
- 0.1% 트리톤-X-100(PBST)으로 인산완충 식염수 1L를 준비하고 필터멸균을 제조합니다. 이 용액은 적어도 1 년 동안 실온 (RT)에서 저장할 수 있습니다.
- PBST에서 정상 당나귀 혈청의 10%로 구성된 블로킹 버퍼 600 μL을 준비합니다. 이 솔루션을 매번 새로 만듭니다.
- 다음 의 메탄올(MeOH) 희석액을 유동 후드에 50 mL의 준비: 탈이온수(dH2O)에서 25% MeOH, dH2O에서 50% MeOH, 및 dH2O. 소용돌이에서 75% MeOH를 혼합한다. RT에 보관하십시오.
- 50 mL 원엽 튜브에서 다음 벤질 알코올 벤질 벤조에이트 (BABB) 용액의 50 mL를 준비합니다.
- 100% BABB의 경우, 벤질 알콜 16 mL에 벤질 벤조에이트 32 mL을 추가하십시오 (부피 당 2 :1 부피).
- 50% BABB의 경우, 벤질 벤조에이트 16 mL과 벤질 알코올 8 mL을 MeOH 24 mL에 추가하십시오.
- 빛으로부터 보호하기 위해 알루미늄 호일에 원엽 튜브를 덮습니다. 이러한 솔루션은 최대 1년 동안 RT에 저장할 수 있습니다.
주의 사항: BABB는 독성이 있고 부식성이 있습니다. MSDS에 따라 처리하고 폐기해야 합니다.
2. 배아 해부 및 고정
참고: 이 프로토콜은 임의의 마우스 균주로부터 분리된 E9.5 및 E10.5 마우스 배아(남성 또는 여성)에 적합합니다. 더 젊고 오래된 배아의 경우, 배양 시간은 형광 신호의 신호 대 잡음 비를 최대화하기 위해 실험적으로 결정되어야 합니다.
- 35mm 와 60mm 페트리 접시 1개를 1x PBS로 채우고 필요할 때까지 얼음 위에 놓습니다.
- CO2 흡입을 통해2 임신한 마우스를 안락사시. 안락사의 보조 측정으로 자궁 경부 탈구를 수행합니다.
- 댐의 복부 를 70 % 에탄올로 청소하십시오. 집게를 사용하여 복부 영역을 꼬집고 중간선에서 복벽의 기지에서 시작하는 수술 가위를 사용하여 V-like 절개를 합니다. 흉강 구멍을 계속 엽니다. 복부 조직을 들어 올리고 자궁 경적을 노출하기 위해 옆으로 내장을 이동합니다.
- 질 운하의 기지에서 잘라내고 집게로 자궁을 댐에서 빼냅니다. 자궁을 자유롭게하기 위해 각 난소에서 추가 컷을 만듭니다. 차가운 1x PBS를 포함하는 60 mm 페트리 접시 중 하나에 자궁을 옮김.
- 직선 가위를 사용하여 각 이식 부위 사이에 자궁 벽을 잘라냅니다. 유리 피펫으로 데시두아를 들고 1x PBS로 35mm 페트리 접시로 옮김을 넣습니다. 해부 현미경으로 데시두아와 자궁 벽 사이의 공간에 직선 가위를 삽입하십시오. 자른 자궁 벽을 제거합니다.
- 미세 한 집게로, 조심스럽게 조직을 따라 가로 절개를하고 노른자 낭에서 조직을 당겨 배아에서 데시두아와 라이허트의 막을 제거합니다. 조심스럽게 배아에서 조직을 당기고 allantois와 배꼽 정맥에서 상처를 만들어 노른자 낭과 양수 낭을 제거합니다.
참고 : 노른자 주머니는 배아에 대한 지질 형이 없는 데 사용할 수 있습니다. - 유리 파이펫으로 각 배아를 1x PBS의 1 mL로 채워진 개별 2 mL 튜브로 옮김을 옮김. 각 튜브에 고유 식별자로 레이블을 지정합니다.
- 배아를 고치려면 1x PBS를 조심스럽게 제거하고 1x PBS에 4% 파라포름알데히드(PFA) 용액을 추가합니다. 밤새 부드러운 교반으로 4 °C에서 배양하십시오.
참고: 4% PFA 고정은 이 프로토콜에서 언급된 항체에 적합하다. 그러나, 고정 절차는 추가 항체를 위해 최적화되어야 합니다.
3. 배아 염색
참고 :이 섹션에서 배아는 1 차 및 이차 항체로 투과되고 염색됩니다. PAA 발달이 급속하게 진행하기 때문에, 배아 단계의 차이는 분석 다운스트림에 크게 영향을 미칠 것이다. 그러므로, 태아는 추가 조작의 앞에 통제및 돌연변이 쌍을 일치시키기 위하여 신중하게 somites를 계수하에 의해 나이 일치되어야 합니다.
- 배아를 씻으려면 4 % PFA를 조심스럽게 제거하고 1 x PBS를 추가하십시오. 튜브를 여러 번 부드럽게 반전시다. 튜브를 오른쪽으로 위로 놓고 배아가 가라앉을 수 있도록 합니다. 3회 반복 세탁하십시오. 튜브를 배아와 얼음 위에 놓습니다.
참고: (선택적 정지점) 세차 후, 배아는 섹션 1.3에서와 같이 희석당 30분 동안 MeOH의 등급화 계열로 탈수될 수 있으며, 100% MeOH에서 -20°C에서 저장하여 최대 6개월 까지 나중에 사용할 수 있다. - E10.5 배아의 경우 유리 피펫을 사용하여 한 배아를 차가운 1x PBS로 채워진 35mm 페트리 접시로 옮니다. 조심스럽게 미세 한 집게와 뒷다리 바로 위에 배아를 꼬집고 배아의 후방 절반을 제거하기 위해 가로 절단을합니다. 이것은 태아가 단계 4.2를 위한 시상 위치에 평평하게 놓는 것을 허용합니다. 신선한 1x PBS로 배아를 다시 2 mL 튜브에 넣습니다.
참고: 대조군 및 돌연변이 배아는 3.3단계부터 3.8단계까지 하나의 튜브에서 동일한 항체 용액으로 페어링및 염색될 수 있다.- 두 개의 배아를 함께 염색하는 경우, 첫 번째 인두 아치 위의 한 배아의 머리를 미세 한 집게로 꼬집어 가로 절단합니다. 이것은 각 관 내의 2개의 다른 유전형의 태아를 구별할 것입니다.
- 배아를 투과시키기 위해 튜브에서 1 x PBS를 피펫 아웃시키고 배아를 만지지 않도록주의하십시오. PBST 의 1 mL을 추가합니다. 튜브를 밤새 부드러운 교반으로 4 °C에 놓습니다.
참고: (선택적 정지점) 배아는 며칠 동안 4°C에서 PBST 용액에 보관될 수 있다. - 항체의 비특이적 결합을 방지하기 위해 먼저 튜브에서 PBST를 제거하고 배아를 만지지 않도록주의하십시오. 600 μL의 블로킹 버퍼 용액을 배아에 추가합니다. 배아를 4°C에서 밤새 부드럽게 교반하여 차단합니다.
참고: 이물질을 제거하기 위해 사용하기 직전에 벤치탑 원심분리기에서 블로킹 솔루션을 최고 속도로 분사해야 합니다. - EC를 더럽고 정량화하려면 VEGFR2 및 ERG에 대한 항체를 사용하십시오. 항체 솔루션은 차단 버퍼에서 만들어집니다. 항-VEGFR2 항체는 1:200 및 ERG 항체가 1:1000 희석된다.
참고: 항체 용액은 미립자를 제거하기 위해 사용하기 직전에 벤치 탑 원심분리기에서 최고 속도로 분사해야 합니다.- 배아를 1 차 항체로 배양하려면 튜브에서 차단 완충액을 제거하고 배아를 만지지 않도록주의하십시오. 각 튜브에 600 μL의 원발성 항체 용액을 추가합니다. 4°C에서 배아를 4-5일 동안 부드럽게 교반하여 배아를 배양한다.
- 항체 용액의 배아를 세척하려면 먼저 튜브에서 1 차 항체 용액을 제거하십시오. 실온(RT)에서 PBST 1mL로 매시간 배아를 부드러운 교반으로 씻으시다. 배아를 하루 동안 4-5회 씻은 다음 밤새 부드러운 교반으로 4°C에서 배양합니다. 다음 날 다시 세안하십시오.
- 안티 염소 알렉사 플루어 488 및 안티 마우스 알렉사 플루어 555 1:300 차단 버퍼를 희석하여 이차 항체 용액을 확인합니다. 블로킹 버퍼에서 주식 DAPI 1:1000을 희석하십시오.
참고: 항체 용액은 미립자를 제거하기 위해 사용하기 직전에 벤치 탑 원심분리기에서 최고 속도로 분사되어야 합니다. 또한, 다른 알렉사 플루어 염료는 488 또는 555 대신에 사용될 수 있다.- 이차 항체로 배아를 배양하려면 튜브에서 PBST를 제거하십시오. 각 튜브에 600 μL의 이차 항체 용액을 추가합니다. 4°C에서 배아를 4-5일 동안 부드럽게 교반하여 배아를 배양한다.
- 항체 용액의 배아를 세척하려면 먼저 튜브에서 이차 항체 용액을 제거합니다. 부드러운 교반RT에서 PBST의 1 mL로 매 시간마다 배아를 씻으하십시오. 배아를 하루 동안 4-5회 씻은 다음 밤새 부드러운 교반으로 4°C에서 배양합니다. 다음 날 다시 세안하십시오.
4. 아가로즈에 배아 를 포함
참고: 섹션 4에서 배아는 아가로오스에 내장됩니다. 이 포함 과정은 두 가지 목적을 제공합니다 : 이미징 전에 배아를 적절하게 방향을 정하고 BABB에서 제거 된 후 배아를 찾는 데 도움을 주습니다 (단계 5.2.2 - 5.3.2).
- 모든 아가로즈가 용해될 때까지 200 mL의 아가로스를 dH2O. 마이크로웨이브에 200 mL에 첨가하여 1% 아가로즈 용액 의 200 mL를 준비합니다.
참고: 남은 아가로즈는 4°C에서 보관하고 나중에 사용하기 위해 재가열할 수 있습니다. - 플라스틱 파라핀 몰드와 유리 파이펫을 사용하여 한 배아를 곰팡이로 부드럽게 옮김을 옮김으로 부드럽게 옮김을 옮김으로 옮김을 옮김으로 옮기십시오. 배아에서 PBST를 조심스럽게 제거하십시오. 태아를 시상 위치에 놓습니다. 신속하게, 금형에 뜨거운 아가로스의 약 0.5 mL을 추가 - 배아를 덮고 금형을 채울 정도로. 배아를 둘러싸는 기포가 없는지 확인합니다.
- 얼음에 금형을 놓고 아가로즈가 굳어 때까지 알루미늄 호일로 덮습니다.
참고: PBST를 제거한 후 배아가 건조되지 않도록 하십시오. 아가로즈 용액은 배아에 첨가될 때 액체를 유지할 수 있을 만큼 충분히 따뜻해야 합니다. 배아를 덮을 만큼 충분한 아가로스를 추가하지만 너무 많이하지 않으면 이미지하기가 어려울 것입니다. 이미지 깊이는 부분적으로 목표의 작업 거리에 의해 결정됩니다.
5. 탈수 및 조직 정리
참고: 본 섹션에서, 배아(들)는 메탄올 계열을 사용하여 탈수되고, 유기 용매, BABB에서 제거되고, 고무 스페이서에 의해 분리된 두 개의 커버슬립 사이에 장착된다; 이 프로토콜에서 빠른 잘 고무 스페이서가 사용된다. 패스트 웰 범퍼는 양면 접착제 표면을 가지고 있습니다. 스페이서가 우물을 만드는 데 필요한데, 배아가 두 개의 커버립 사이에 놓여지고 유지됩니다.
-
메탄올 탈수
- 배아 당 하나씩 새로운 2 mL 튜브에 라벨을 붙입니다. 튜브 당 25 % MeOH의 1 mL을 추가하십시오.
- 깨끗한 메스를 사용하여 배아 주위의 아가로스를 부드럽게 자르고 배아 주위에 충분히 남겨 두어 집게로 집어 들 수 있습니다. 미세 한 집게를 사용 하 여 부드럽게 내장 된 배아와 아가로즈를 잡아 하 고 25% MeOH와 라벨 튜브에 배치. 집게가 배아를 만지지 않도록 하십시오.
- 어둠 속에서 1 시간 동안 부드러운 교반으로 RT에서 배아를 배양하십시오.
- 튜브에서 25 % MeOH를 제거하여 배아를 만지지 않도록주의하십시오. 튜브 당 50 % MeOH의 1 mL을 추가하십시오. 어둠 속에서 1 시간 동안 부드러운 교반으로 RT에서 배양하십시오.
- 튜브에서 50 % MeOH를 제거하여 배아를 만지지 않도록주의하십시오. 튜브 당 75 % MeOH의 1 mL을 추가하십시오. 어둠 속에서 1 시간 동안 부드러운 교반으로 RT에서 배양하십시오.
- 튜브에서 75 % MeOH를 제거하여 배아를 만지지 않도록주의하십시오. 튜브 당 1 mL 100 % MeOH를 추가하십시오. 어둠 속에서 1 시간 동안 부드러운 교반으로 RT에서 배양하십시오. 100% MeOH 세척을 두 번 반복합니다.
-
BABB로 클리어링
- 튜브에서 100 % MeOH를 제거하여 배아를 만지지 않도록주의하십시오. 튜브 당 50 % BABB의 1 mL을 추가합니다. 어둠 속에서 1 시간 동안 부드러운 교반으로 RT에서 배양하십시오.
- 튜브에서 50 % BABB를 제거하여 배아를 만지지 않도록주의하십시오. 튜브 당 1 mL의 100 % BABB를 추가하십시오. 어둠 속에서 1 시간 동안 부드러운 교반으로 RT에서 배양하십시오. 100% BABB 세척을 두 번 반복합니다.
참고 : (선택적 정지 점) 배아는 약 1 주일 동안 튜브에서 100 % BABB에 남아있을 수 있습니다. 저장이 길면 BABB가 튜브의 플라스틱을 용해시킬 수 있습니다.
-
이미징을 위한 배아 장착
- 한쪽에서 플라스틱 접착제를 벗겨 내어 24mm x 60mm #1.5 글래스 커버 슬립에 패스트 웰 범퍼를 놓습니다. 고무 범퍼 위에 플라스틱 접착제에 부드러운 압력을 가하여 커버슬립과 범퍼 사이에 기포가 없는지 확인합니다. 염색에 사용되는 배아 수, 유전자형 및 항체에 따라 커버슬립을 라벨링합니다.
참고 : 모든 스페이서가 배아를 분쇄하거나 분쇄하는 것을 방지하기에 충분히 두꺼운 한 커버 립 사이에 배치 할 수 있습니다. 우리는 그것의 두께와 편리함으로 인해 빠른 우물 스페이서를 사용, 이는 커버 립을 고정하기위한 스페이서의 양쪽에 접착 면을 포함. - 조심스럽게 배펫아웃하고 튜브에서 100% BABB를 버립니다. 관에 아가로즈 가삽입 된 배아를 시각화 한 후 미세 한 집게를 사용하여 아가로스를 집어 들고 조심스럽게 배아를 Fast Well 내부의 커버 슬립으로 옮김을 옮기십시오 - 집게가 배아를 만지지 못하게하십시오.
- 범퍼에서 두 번째 플라스틱 접착제를 제거하고 두 번째 커버슬립을 위에 놓습니다. 커버슬립을 가볍게 눌러 기포를 제거합니다. 유리가 부러지지 않도록 주의하십시오.
참고 : 샘플은 씰이 꽉 경우 최대 1 년 동안 RT의 어두운 슬라이드 홀더에 평평하게 보관 할 수 있습니다.
- 한쪽에서 플라스틱 접착제를 벗겨 내어 24mm x 60mm #1.5 글래스 커버 슬립에 패스트 웰 범퍼를 놓습니다. 고무 범퍼 위에 플라스틱 접착제에 부드러운 압력을 가하여 커버슬립과 범퍼 사이에 기포가 없는지 확인합니다. 염색에 사용되는 배아 수, 유전자형 및 항체에 따라 커버슬립을 라벨링합니다.
6. 데이터 수집
참고 : 다음 단계에서 인두 아치 3, 4 및 6의 내피는 공초점 현미경을 사용하여 이미지화됩니다.
-
현미경 단계에 슬라이드의 위치 지정
- 배아를 이미지화하려면 20배 의 침수 목표, 수치 조리개 0.95, 작동 거리 0.95mm, NIS-Elements AR 5.11.01 64비트 소프트웨어가 장착된 공초점 현미경을 사용하십시오.
- 넓은 필드 형광을 사용하여, 시각적으로 인두 아치를 찾습니다. 4번째 PAA 주변의 필드 뷰를 가운데로 합니다.
- 목표의 시야가 전체 인두 아치 영역을 캡처하지 않는 경우 1% 겹치는 큰 이미지 패널을 가져 와서 스티치합니다. 큰 이미지를 획득하는 동안 시료의 이동을 방지하기 위해 성형 점토를 사용하여 커버 슬립 어셈블리를 스테이지에 부드럽게 고정시다.
-
수집 매개변수 설정
- 핀홀 크기를 1.0으로 설정합니다.
- ND 수집 탭에서 거친 조정을 사용하여 이미징의 상단 및 하단 한계를 설정합니다. 소프트웨어 사양에 따라 Z 단계 크기를 설정합니다. 목표물의 작업 거리와 샘플의 선명도로 이미지화할 수 있는 두께를 결정합니다.
- 배아의 두께로 인해 Z 스택 전체의 게인을 조정합니다. 각 채널(405, 488 및 555)에 대해 Z 스택의 중간에 레이저 강도와 게인을 설정하고 Z 강도 보정 탭 아래에 값을 할당합니다.
- 형광 신호가 희미하게 나타나기 시작할 때까지 배아를 스크롤합니다. 신호 강도가 이전 세그먼트와 비슷하게 나타날 때까지 각 채널의 게인을 늘립니다. Z 강도 보정 탭 아래에 새 값을 할당합니다. z 스택이 완료될 때까지 반복합니다. 설정을 ND 획득로다시 가져옵니다.
- Z 수정 실행 옵션을 사용하여 검사를 실행합니다.
7. Imaris 소프트웨어를 사용한 분석
참고: 이 단계에서는 공초점 이미지가 현미경 이미지 분석 소프트웨어인 Imaris 버전 9.2.0을 사용하여 분석됩니다. 이 분석 중에 먼저 표면을 작성하여 분석할 관심 영역을 선택합니다. 다음으로 Mask 함수를 사용하여 이러한 영역을 시각적으로 구분합니다. 마지막으로 스팟 함수를 사용하여 관심 있는 각 영역 내의 EC 수를 정량화합니다.
- 6단계에서 사용되는 이미징 소프트웨어에 따라 Imaris 파일 변환기를사용하여 이미지를 .ims로 변환합니다.
- .ims 파일을 엽니다. 카메라/레이블 아래 의 직교로 이미지 설정 | 카메라 유형 패널.
- PA를 찾아 서페이싱을 위해 이미지 방향을 지정합니다.
참고: 파일이 처음 열리면 이미지가 있는 모든 조각의 3D 컴파일로 표시됩니다. 이 단계에서는 3D 이미지를 2D 이미지로 만들어 PAA를 배치합니다. 그런 다음 2D 이미지를 사용하면 PAA가 분석을 위해 제대로 방향을 조정할 수 있습니다.- 속성 패널에서 볼륨을 끕니다. 속성 패널에서 새 새 교신대 슬라이서 추가를클릭합니다. 슬라이스 방향을 XY 평면으로설정합니다. 슬라이스 위치를 사용하여 PA를 찾을 때까지 이미지를 스크롤합니다.
- PAA가 이미지의 위쪽과 아래쪽과 평행하지 않은 경우 마우스 커서를 사용하여 이미지를 자유롭게 회전하여 PA가 화면에서 왼쪽에서 오른쪽으로 실행되도록 합니다. 이미지 처리 드롭다운 메뉴에서 자유 회전을 선택하고 확인을클릭합니다.
- 3rd 인두 아치 표면(그림 2A, B - B")
참고: 이 단계에서는 인두 아치와 PA를 Surface 도구를 사용하여 관심 영역을 '표면화'하여 추적합니다. 이것은 관심의 각 지역이 주변 조직으로부터 시각적으로 분리될 수 있게 합니다. 여기서 우리는3rd 인두 아치의 내피 성분을 표면화하고 분석하는 단계를 설명한다. 인두 아치 4 및 6도 유사하게 분석된다.- 전체3rd 인두 아치의 내피를 표면화하려면 속성 패널 아래에 있는 새 표면 추가 단추를 클릭합니다. 표면 1을 두 번 클릭하고 새 서피스의 이름을 "3rd 인두 아치"로 바꿉니다.rd
- 자동 생성 건너뛰기, 수동으로 편집을 선택합니다. 곡면 방향을 YZ 평면(관상 방향)으로 설정합니다. 슬라이스 위치를 사용하여3rd 인두 아치 표면 평면을3RD PAA 및 등쪽 아오르타가 연결되는 위치에 배치합니다.
- 3rd 인두 아치rd 표면 평면이 뷰에 있도록 이미지를 회전합니다. 교교 슬라이서 1을 끕니다.
- 무승부 아래 | 윤곽 | 모드 탭을 선택하고 거리 그리기 모드 기능을 선택합니다. 필요한 경우 매개 변수 설정을 조정합니다. 샘플 간에 일관된 표면 매개 변수를 유지합니다. 이 예제에서 정점 간격은 10 μm입니다.
- 표면을 시작하려면 Esc 키를 누릅니다. Draw 마우스 커서를 사용하면3rd 인두 아치의 둘레를 추적합니다. 슬라이스 위치를 사용하여 10-25개의 슬라이스를 이동합니다. 인두 아치의 둘레를 추적합니다. 인두 아치가 완전히 추적될 때까지 반복합니다.
- 추적된 영역의 표면을 생성하려면 속성 패널에서 지표면 만들기 단추를 선택합니다.
- 3RD PAA 표면화(그림 2C -C")
- 3rd PAA의 내피를 표면화하기 위해, 먼저3rd 인두 아치 표면 상자를 선택 해제하여 7.4 단계에서 표면 영역을 해제합니다. 그런 다음 새 표면 추가 단추를 다시 클릭합니다. Surface 1을 두 번 클릭하고 새 서피스의 이름을 "3rd PAA"로 바꿉니다.rd
- 자동 생성 건너뛰기, 수동으로 편집을 선택합니다. 곡면 방향을 YZ 평면(관상 방향)으로 설정합니다. 슬라이스 위치를 사용하여3rd PAA 및 등쪽 대반이 연결되는 위치에3RD PAA 표면 평면을 배치한 다음 7.4단계를 반복합니다.
- 표면 구조 마스킹
참고: 다음 단계에서는 각 표면영역이 마스로 표시됩니다. 마스킹은 관심 영역이 이미지 된 조직의 나머지 부분과 시각적으로 구별 될 수 있게하고 관심있는 이러한 별개의 구조의 정량화를 허용합니다. 아래, 우리는 PAA 내피뿐만 아니라 신경총 - 인두 아치 내에서 PAA를 둘러싼 작은 혈관 구조의 시각화 및 분석이 Imaris의 단계를 설명합니다. 이러한 단계에서는 섹션 7.7에 설명된 스팟 함수를 사용하여 PAA에서만 분석을 시각화하고 수행하기 위해3rd PAA 표면이 마스백됩니다.- 마스크된 모든 채널을 시각화하려면 볼륨을 선택합니다. 이미지를 회전하고 이미지를 XY 위치로 배치하려면 Esc 키를 누릅니다.
- 편집 탭에서3rd PAA에 대한 마스크 선택을 선택합니다. DAPI 채널을 선택하고 확인을클릭합니다. 나머지 채널에 대해 반복합니다.
- 키보드에서 Ctrl + D를 눌러 디스플레이 조정 패널을 봅니다. 각 새 채널을 선택하고 이름을 변경하여 각 채널에 표시되는 내용을 명확하게 알 수 있습니다. 예를 들어, 이것은 세 가지 새로운 채널로 이어질 것입니다 : "3RD PAA DAPI", "3rd PAA ERG", "3rd PAA VEGFR2".
참고: 단계 7.6.4-7.6.7에서는 인두 아치 신경총에 대한 채널만 만듭니다. - PAA와 별도로 내피 신경총의 시각화를 위해 먼저3rd PAA 표면에 대한 마스크 선택을 선택합니다. DAPI 채널을 선택합니다. 곡셀 선택을 선택하여 서피스 외부에서 단추로 이동을 선택하고 서피스 내부의 복셀 선택을 0으로설정합니다. Select voxels inside surface to 확인을 클릭합니다.
- 나머지 채널에 대해 반복합니다. 이 작업은 새 마스크된 채널에서 PAA를 포함하는 영역을 제외합니다. 채널 이름을 변경하여 각 채널에 표시되는 내용을 명확하게 알 수 있습니다. 예를 들어 이렇게 하면 "비 PAA DAPI", "비 PAA ERG", "비 PAA VEGFR2"의 세 가지 새로운 채널이 생생합니다.
- 3rd 인두 아치 내에서 내피 신경총신경총을 시각화하려면 편집 탭 에서 마스크 선택을 선택하고rd 3rd 인두 아치 표면에 대해 선택합니다. 비 PAA DAPI 채널을 선택합니다. 확인을 클릭합니다.
- 나머지 비 PAA 채널에 대해 반복합니다. 채널 이름을 변경하여 각 채널에 표시되는 내용을 명확하게 알 수 있습니다. 예를 들어, 이것은 세 가지 새로운 채널로 이어질 것입니다: "플렉서스 DAPI", "플렉서스 ERG", 그리고 "플렉서스 VEGFR2".
- EC 수치 정량화
참고 : ERG의 발현은 EC 숫자를 정량화하는 것이 편리합니다 내피 핵을 표시합니다. 이러한 단계에서는 스팟 함수를 사용하여 PAA 및 신경총에서 ERG 식으로 표시된 각 EC에 대한 스팟을 생성하는 EC 수를 정량화합니다. 섹션 7.7에서, 반점은 마스크된 PAA에 있는 각 ERG 양성 세포에 대해 생성되고, ERG 양성, VEGFR2 음성 세포에서 반점의 선택 해제가 뒤따른다.- 키보드에서 Ctrl + D를 눌러 디스플레이 조정 패널을 봅니다. PAA ERG를 제외한 모든 채널을 끕니다.
- 속성 탭에서 새 관광 명소 추가 단추를 클릭합니다. 스팟 1을 클릭하고 이름을 "PAA 총 EC 수"로 바꿉니다. 파란색 화살표 버튼을 클릭합니다. 소스 채널의경우 PAA ERG 채널을 선택합니다. 예상 XY 지름을 4 μm로 조정합니다. 파란색 화살표 버튼을 클릭하여 다음 패널로 이동합니다.
- 슬라이딩 스케일을 사용하여 보이는 스팟 수를 조정하여 각 EC 핵(ERG 발현으로 표시)이 한 지점으로 표현되도록 합니다. 녹색 이중 화살표 버튼을 클릭합니다.
- 디스플레이 조정에서 PAA ERG 채널을 끕니다. PAA VEGFR2 채널을 켜서 PAA 내피를 시각화합니다.
- EC 수를 정확하게 정량화하기 위해 각 스팟이 EC 마커, ERG 및 VEGFR2를 모두 표현하도록 합니다. 이렇게 하려면 편집 탭에서 오브젝트 표면을 선택합니다 | 패널 추가/삭제 Esc 키를 누르고 VEGFR2 가 양성이 아닌 스팟을 삭제합니다.
참고: 다음 단계에서는 마스크된 신경총의 각 ERG 양성 세포에 대해 반점이 생성되고 ERG 양성, VEGFR2 음성 세포에서 반점의 선택 해제가 뒤따릅니다. - 속성 탭에서 새 관광 명소 추가 단추를 클릭합니다. 스팟 1을 선택하고 이름을 "플렉스총 EC 수"로 변경합니다. 파란색 화살표 버튼을 클릭합니다. 소스 채널의 경우 플렉서스 ERG 채널을 선택합니다. 예상 XY 지름을 4 μm로 조정합니다. 플렉서스 총 EC 수에 대해 7.7.1 - 7.7.5 단계를 반복합니다.
- 각 스팟 함수의 통계 탭을 클릭하여3rd PAA 및 인두 아치 신경총의 총 EC 수를 확인합니다.
- 나머지 PAA 및 인두 아치 신경총에 대해 7.7.1 - 7.7.6 단계를 반복합니다.
결과
여기에 제시된 전체 마운트 면역형광 프로토콜은 도 1A에서볼 수 있듯이 인두 아치 내피의 3D 재건을 허용하는 명확하고 깨끗한 결과를 생성한다. 각 항체 용액에서 충분한 시간 동안 배아를 배양하여 시료를 통한 완전한 침투를 보장하고, 배아를 철저히 세척하는 것은 항체 배양 후이다. 도 1B에서,크고 밝은 점은 항체 또는 차단 완충액 중 하나에서 미립자의 결과로 나타난다. 우리는 각 항체 배양 후에 PBST의 사용 의 앞에 각 해결책을 원심분리하고 PBST의 더 긴 기간은 이 문제를 해결한다는 것을 것을을 발견했습니다.
도 2는 프로토콜의 섹션 7에 기재된 바와 같이 분석을 위해 인두 아치 및 PAA를 표면화하는 데 사용되는 공정을 도시한다. 마스크 된 기능을 사용하여 Imaris 소프트웨어는 표면 영역을 시각적으로 분리하고 독립적으로 분석 할 수 있습니다.
도 3은 인두 아치에서 상이한 혈관 구획의 개별 마스킹을 나타내며, PAA(그림3A, B, C)및 신경총(그림3A', B', C')을보여 준다. 마스킹을 사용하면 각 구조에서 EC 번호를 별도로 분석하고 정량화할 수 있습니다. 그림 3C-C'에서스팟 기능은 ERG를 발현하는 각 핵에 대해 단일 스팟을 할당하여 PAA 및 신경총 모두에서 총 EC 수를 정량화하는 데 사용됩니다. 스팟 함수에 사용되는 알고리즘은 지정된 크기의 모든 픽셀에 대해 점을 생성하도록 설계되었습니다. ERG, EC 핵의 마커로 여기에 사용되는, 또한 신경 문장 세포에서 발현8; 신경 문장 세포는 VEGFR2를 표현하지 않습니다. 도 3D는 이마리스 스팟 함수에 의해 생성된 ERG 양성(녹색), VEGFR2 음성(분홍색) 스팟의 예를 도시한다. 따라서 각 점이 단일 EC를 나타내고 ERG 및 VEGFR2로 레이블이 지정되어 있는지 확인하는 것이 필수적입니다.
| 단계 | 시간 | 온도 | |
| 1 | PBST 워시/퍼메라빌화 | 24 시간 또는 O / N | 4 °C |
| 2 | 버퍼 차단 | 25 시간 또는 O / N | 4 °C |
| 3 | 1 차 항체 | 4-5 일 | 4 °C |
| 4 | PBST 워시 | 2 일 동안 하루에 4-5 회 | RT(또는 4°C의 경우 O/N) |
| 5 | 이차 항체 | 4-5 일 | 4 °C |
| 6 | PBST 워시 | 2 일 동안 하루에 4-5 회 | RT(또는 4°C의 경우 O/N) |
| 7 | 포함 | 해당/A | Rt |
| 8 | 메탄올 탈수 및 BABB | 단계당 1시간 | Rt |
표 1: 전체 마운트 면역형광 프로토콜의 개요. O/N - 하룻밤; RT - 실온.
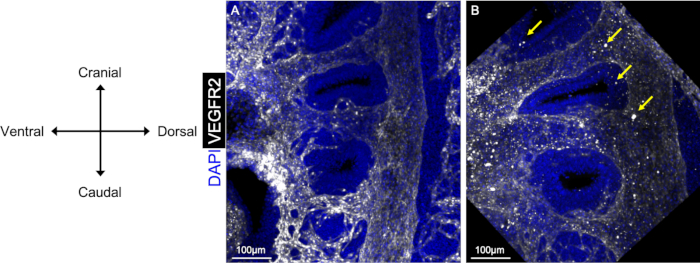
그림 1: 전체 마운트 면역 형광에 따른 깨끗하고 더러운 이미지의 비교. E10.5 배아의 시상 뷰는 PAA 내피의 를 가시화하기 위해 항 VEGFR2 항체(흰색)의 사용을 보여준다. PBST 후 항체 배양(A)으로 철저히A세척된 배아는 신호 대 잡음비가 높고, 철저하게 세척되지 않은 배아와 비교할 때 더 깨끗한 영상을 생성한다(B).B B의 화살표는 배아가 철저히 세척되지 않거나 항체 용액이 원심 분리되지 않았을 때 이미지에 나타난 노이즈/먼지 영역을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 인두 아치(PA) 및 PAA의 표면화. 2D 시상뷰(A)는 공초점 이미지에서 PAA의 위치를 식별하는 데 사용된다.A 관상 동맥 교부술(A, 노란색 선)은PAA를 통해 배치됩니다. 인두아치(B)및 PAA(C)는 이마리스에서 거리 그리기 도구를 사용하여 관상 방향으로 표면화됩니다.C 거리 그리기 도구는 10 μm로 설정되어3rd 인두아치(B)또는 PAA(C)의C둘레를 추적하는 데 사용됩니다. 윤곽선은 전체 아치(B', C')를통해 모든 10-25 슬라이스를 그려집니다. 윤곽선은 인두아치(B")또는 PAA(C")의 3D 표면을C"생성하기 위해 결합된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
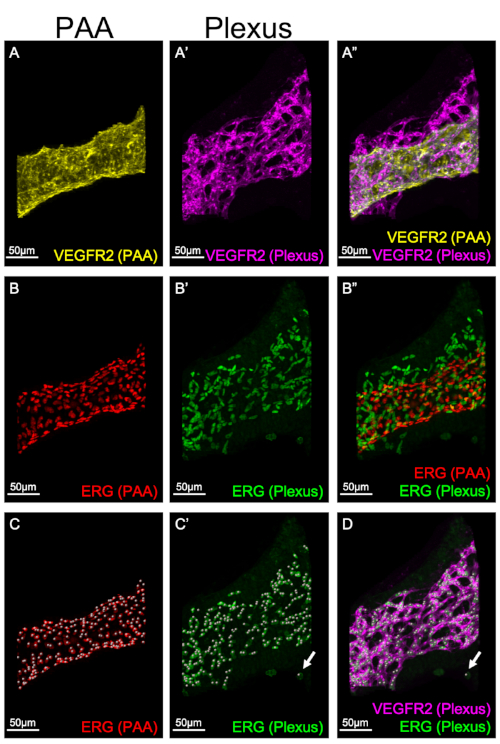
그림 3: PAA 및 신경총에서 EC 수치의 정량화. 3D 재구성은 PAA 또는 EC 신경총에서 혈관 구조 및 EC 마커의 발현을 별도로 시각화하는 데 사용됩니다. 패널 A-A'는 PAA(A, 노란색)와신경총(A', 분홍색)에서VEGFR2의 표정을 보여줍니다. 패널 A"는 PAA 및 신경총 VEGFR2 식의 병합을 나타내시다. 패널 B-B'는 PAA(B, 빨간색)와신경총(B', 녹색)에서ERG의 발현을 보여줍니다. 패널 B"는 PAA 및 신경총의 병합을 나타내시다. C-C'. Imaris의 스팟 함수는 PAA 또는 신경총의 EC 수를 정량화하는 데 사용됩니다. PAA(C, 적색)또는 신경총(C',녹색)의각 ERG 양성 세포는 단일 EC를 표시하기 위해 단일 스팟을 할당한다. C'-D의 화살표는 Imaris 스팟 함수에 의해 생성된 신경총에서 ERG 양성, VEGFR2 음성 스팟의 예를 보여줍니다. 이 지점은 정량화에서 제외됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
마우스 배아의 내피를 3D로 시각화하는 기능은 개발3에대한 새로운 통찰력을 제공했습니다. 여기에서 우리는 배아의 고해상도 3D 화상 진찰, 혈관 연결의 가시화 및 PAA 대형의 정량적인 분석을 허용하는 프로토콜을 제시합니다. 이 프로토콜은 유전 적 변경 또는 환경 모욕이 PAA 개발에 미치는 영향을 확인하기 위해 사용될 수 있습니다. 여기에서 보고된 절차는 PAA 대형을 구상하고 EC 수를 정량화하기 위하여 VEGFR2 및 ERG에 대하여 항체를 이용합니다; 그러나, 추가 항체는 신경 문장 모집 또는 평활근 세포 분화와 같은 아치 동맥 발달의 그밖 양상을 구상하고 분석하기 위하여 이용될 수 있습니다. 이 절차가 배아 발생의 초기 단계에서 사용되는 경우, 이 프로토콜에서 검출된 일부 항원(예를 들어, ERG)이 아직 발현되지 않을 수 있다는 점에 유의하는 것이 중요하다. DAPI 또는 DRAQ5와 같은 다른 핵 얼룩 또는 핵 태그 추적기로 계보 라벨링을 사용하여 EC 번호를 정량화할 수 있습니다.
프로토콜 내에서 몇 가지 중요한 단계가 있습니다 : 1) 배아가 솔루션 변경 사이에 건조되지 않도록보장; 2) 배아는 항체 배양 후 철저히 세척됩니다. 및 3) 배아는 BABB로 조직을 치우기 전에 MeOH로 완전히 탈수된다.
조직 정리 전에 메탄올은 두 가지 목적을 위해 사용: 형광 단백질의 발현으로 인한 형광을 제거하기 위해 (예를 들어, 계보 추적에 사용되는 EGFP 또는 tdTomato의 발현) 및 조직을 탈수. 형광 성 단백질에서 형광의 제거는 화상 진찰을 위한 형광의 어떤 조합든지의 사용을 허용합니다. EGFP 및 TdTomato (체리)에 대한 항체는 이러한 형광 단백질의 발현을 시각화하는 데 사용될 수 있다. 대안적으로, MeOH는 형광 단백질의 형광을 보존하기 위해 테트라하이드로푸란으로 대체될 수 있다9.
우리는 BABB 정리 이전에 제대로 탈수되지 않은 배아가 빛 산란으로 인해 이미지화하기 어렵다는 것을 발견했습니다. BABB는 불투명 조직을 지우기 위해 유기 용매에서 완전한 탈수가 필요한 소수성 용액입니다. 완전한 클리어링은 배아10,,11내에서 가능한 가장 깊은 수준에서 이미지를 얻을 수 있는 능력을 보장한다. 이 프로토콜에서는 실험 당시의 긴 작업 거리와 가용성으로 인해 20배의 수몰입 목표를 사용했습니다. BABB와 오일은 물과 BABB보다 굴절지수가 더 가깝기 때문에 오일 침지 목표가 이 프로토콜에 더 적합합니다. 그러나, 굴절률의 차이에도 불구하고, 이 프로토콜에 사용된 수몰입 대물량은 우수한 화질을 제공했다.
이 프로토콜에는 몇 가지 제한 사항이 있습니다. 여기서 활용되는 BABB 클리어링은 독성 및 부식성11,,12,,13. BABB는 접착제와 플라스틱을 용해시다. 이미징 중에 시료를 제대로 처리하지 않으면 BABB에 의해 현미경 대물 렌즈가 손상되어 커버슬립의 균열이나 Fast Well 범퍼와 커버슬립 사이의 깨진 씰을 통해 시료에서 빠져나갈 수 있습니다. CLARITY와 같은 유기 용매를 사용하지 않는 클리어링 방법은10,,11,,14대안으로 사용할 수 있다. CLARITY의 굴절률 매칭 솔루션은 물과 유사한 굴절률을 가지므로 침수 목표를 사용하는 경우 적절한 청산 방법이 됩니다. 이 프로토콜의 추가 제한은 비 살아있는 조직에서만 수행 될 수 있으므로 라이브 이미징을위한 응용 프로그램을 방지 할 수 있다는 것입니다.
공개
저자는 공개 할 것이 없다.
감사의 말
우리는 이 원고를 주의 깊게 읽고 편집해 주신 브리아나 알렉산더, 카올란 오도넬, 마이클 워칼라에게 감사드립니다. 이 작품은 NIH R01 HL103920, R01 HL134935, R21 OD025323-01SA의 국립 심장, 폐 및 혈액 연구소의 자금 지원; AJR은 NHLBI HL103920-08S1과 국립 관절염 및 근골격계 및 피부 질환 교육 교부금 T32052283-11에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 10x PBS | MP Biomedicals | PBS10X02 | |
| 20x water immersion objective | Nikon | MRD77200 | |
| Agarose | Bio-Rad Laboratories | 1613101 | |
| Alexa Fluor 488 anti-goat | Invitrogen | A-11055 | |
| Alexa Fluor 555 anti-mouse | Invitrogen | A-31570 | |
| Analysis Software | Imaris 9.2.0 | ||
| Benzyl Alcohol | Sigma-Aldrich | 305197 | |
| Benzyl Benzoate | Sigma-Aldrich | 8.18701.0100 | |
| Cover Slips | VWR | 16004-312 | |
| DAPI (5 mg/mL stock) | Fisher Scientific | D3571 | |
| Eppendorf Tubes (2.0 mL) | Fisher Scientific | 05-408-138 | |
| Ethanol | VWR | 89370-084 | |
| Falcon tubes (50 mL) | Corning | 352098 | |
| Fast wells | Grace Bio Labs | 664113 | |
| Forceps | Roboz | RS-5015 | |
| Goat anti-VEGFR2 | R&D Systems, Inc. | AF644 | |
| Methanol | VWR | BDH1135-4LP | |
| Microscope | Nikon | A1HD25 | |
| Mouse anti-ERG | Abcam | ab214341 | |
| Normal Donkey Serum | Sigma-Aldrich | D9663 | |
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| Pasteur pipets | Fisher Scientific | 13-678-20D | |
| Petri dishes (35 mm) | Genesee Scientific | 32-103 | |
| Petri dishes (60 mm) | Genesee Scientific | 32-105 | |
| Plastic Molds | VWR | 18000-128 | |
| Scapels | Exelint International Co. | 29552 | |
| Triton-X-100 | Fisher Scientific | BP 151-500 |
참고문헌
- Hiruma, T., Nakajima, Y., Nakamura, H. Development of pharyngeal arch arteries in early mouse embryo. Journal of Anatomy. 201 (1), 15-29 (2002).
- Hutson, M. R., Kirby, M. L. Model systems for the study of heart development and disease Cardiac neural crest and conotruncal malformations. Seminars in Cell & Developmental Biology. 18 (1), 101-110 (2007).
- Wang, X., et al. Endothelium in the pharyngeal arches 3, 4 and 6 is derived from the second heart field. Developmental Biology. 421 (2), 108-117 (2017).
- Jerome, L. A., Papaioannou, V. E. DiGeorge syndrome phenotype in mice mutant for the T-box gene, Tbx1. Nature Genetics. 27 (3), 286-291 (2001).
- Lindsay, E. A., et al. Tbx1 haploinsufficieny in the DiGeorge syndrome region causes aortic arch defects in mice. Nature. 410 (6824), 97-101 (2001).
- Weninger, W., et al. Visualising the Cardiovascular System of Embryos of Biomedical Model Organisms with High Resolution Episcopic Microscopy (HREM). Journal of Cardiovascular Development and Disease. 5 (4), 58(2018).
- Phillips, H. M., et al. Pax9 is required for cardiovascular development and interacts with Tbx1 in the pharyngeal endoderm to control 4th pharyngeal arch artery morphogenesis. Development. 146 (18), (2019).
- Vlaeminck-Guillem, V., et al. The Ets family member Erg gene is expressed in mesodermal tissues and neural crests at fundamental steps during mouse embryogenesis. Mechanisms of Development. 91 (1-2), 331-335 (2000).
- Ertürk, A., et al. Three-dimensional imaging of the unsectioned adult spinal cord to assess axon regeneration and glial responses after injury. Nature Medicine. 18 (1), 166-217 (2012).
- Azaripour, A., et al. A survey of clearing techniques for 3D imaging of tissues with special reference to connective tissue. Progress in Histochemistry and Cytochemistry. 51 (2), 9-23 (2016).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Becker, K., Jährling, N., Saghafi, S., Weiler, R., Dodt, H. U. Chemical Clearing and Dehydration of GFP Expressing Mouse Brains. PLoS One. 7 (3), e33916(2012).
- Ertürk, A., et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nature Protocols. 7 (11), 1983-1995 (2012).
- Kuwajima, T., et al. ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유