Method Article
Visualisation et analyse des artères pharyngées à l’aide de l’immunohistochimie à monture entière et de la reconstruction 3D
Dans cet article
Résumé
Ici, nous décrivons un protocole pour visualiser et analyser les artères pharyngées d’arc 3, 4, et 6 des embryons de souris utilisant l’immunofluorescence entière de montage, le dégagement de tissu, la microscopie confocale, et la reconstruction 3D.
Résumé
La formation ou le remodelage inadéquats des artères d’arc pharyngée (PAAs) 3, 4 et 6 contribuent à certaines des formes les plus graves de maladie cardiaque congénitale. Pour étudier la formation des APA, nous avons mis au point un protocole utilisant l’immunofluorescence à monture entière couplée à l’élimination des tissus de l’alcool et du benzyl benzylo (BABB) et à la microscopie confocale. Cela permet la visualisation de l’endothélium d’arc pharyngé à une résolution cellulaire fine ainsi que la connectivité 3D de la vascularisation. À l’aide d’un logiciel, nous avons établi un protocole pour quantifier le nombre de cellules endothéliales (CE) dans les APE, ainsi que le nombre d’EC dans le plexus vasculaire entourant les APA dans les arcs pharyngés 3, 4 et 6. Lorsqu’elle est appliquée à l’ensemble de l’embryon, cette méthodologie fournit une visualisation complète et une analyse quantitative de la vascularisation embryonnaire.
Introduction
Pendant l’embryogenèse de souris, les artères d’arc pharyngées (PAA) apparaissent comme des paires symétriques et bi-latérales d’artères qui relient le coeur avec l’aortae dorsale1. Au fur et à mesure que l’embryon se développe, les premières et deuxièmes paires de PAAs régressent, tandis que les 3rd,4eet 6e PAAs subissent une série d’événements asymétriques de remodelage pour former les artères aortiques de l’arc2.
Les PAA 3, 4 et 6 se développent via la vasculogenèse, qui est la formation de novo des vaisseaux sanguins3. Les défauts dans la formation ou le remodelage de ces artères d’arc donnent lieu à diverses malformations cardiaques congénitales, telles que celles vues dans les patients présentant le syndrome de DiGeorge4,5. Par conséquent, la compréhension des mécanismes qui réglementent le développement des APA peut mener à une meilleure compréhension de l’étiologie congénitale des maladies cardiaques (CHD).
Les approches actuelles pour visualiser et analyser le développement de l’AAP comprennent l’immunofluorescence des sections tissulaires, les moulages vasculaires, l’injection d’encre en Inde, la microscopie épiscopique à haute résolution, et/ou l’immunohistochimie à monture entière1,4,5,6,7. Ici, nous décrivons un protocole combinant l’immunofluorescence de monté entière, la microscopie confocale et le rendu d’image 3D afin de recueillir, d’analyser et de quantifier des données volumétriques, la connectivité vasculaire et l’identité cellulaire. En outre, nous détaillons une méthode pour compartimenter et quantifier le nombre de CE dans chaque arc pharyngeal comme un moyen d’étudier la formation du plexus vasculaire d’arc pharyngé et son remodelage dans les PAA. Bien que ce protocole soit conçu pour analyser le développement de l’AAP, il peut être utilisé pour analyser d’autres réseaux vasculaires en développement.
Protocole
L’utilisation et les procédures relatives aux animaux ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux de l’Université Rutgers.
1. Préparation de solutions
- Préparer 1 L de phosphate tamponné saline avec 0,1% Triton-X-100 (PBST) et filtrer stériliser. Cette solution peut être stockée à température ambiante (RT) pendant au moins un an.
- Préparer 600 L de tampon de blocage composé de 10% de sérum d’âne normal dans PBST. Rendre cette solution fraîche à chaque fois.
- Préparer 50 ml des dilutions suivantes de méthanol (MeOH) dans un capot d’écoulement : 25% MeOH dans l’eau déionisée (dH2O), 50% MeOH en dH2O, et 75% MeOH en dH2O. Vortex à mélanger. Magasinez chez RT.
- Préparer 50 ml des solutions suivantes benzyl alcool-benzyl benzoate (BABB) dans des tubes coniques de 50 ml.
- Pour 100% BABB, ajouter 32 ml de benzyloté à 16 ml d’alcool benzyle (2:1 volume par rapport volume).
- Pour 50% BABB, ajouter 16 ml de benzyloïl et 8 ml d’alcool de benzyl à 24 ml de MeOH.
- Couvrir les tubes coniques dans du papier d’aluminium pour se protéger de la lumière. Ces solutions peuvent être stockées chez RT jusqu’à un an.
CAUTION: BABB est toxique et corrosif. Il doit être manipulé et éliminé selon MSDS.
2. Dissection et fixation d’embryons
REMARQUE : Ce protocole convient aux embryons de souris E9.5 et E10.5 (mâles ou femelles) isolés de toute souche de souris. Pour les embryons plus jeunes et plus âgés, les temps d’incubations devraient être déterminés expérimentalement afin de maximiser le rapport signal/bruit du signal de fluorescence.
- Remplir un plat Petri de 35 mm et un Petri de 60 mm avec 1x PBS et les déposer sur la glace jusqu’à ce que nécessaire.
- Euthanasiez une souris enceinte par inhalation de CO2. Effectuer la dislocation cervicale comme mesure secondaire de l’euthanasie.
- Nettoyez la zone abdominale de la digue avec 70% d’éthanol. Pincer la zone abdominale à l’aide de forceps et faire une incision V-like à l’aide de ciseaux chirurgicaux à partir de la base de la paroi abdominale à la ligne médiane; continuer à ouvrir la cavité thoracique. Soulevez le tissu abdominal et déplacez les intestins sur le côté pour exposer les cornes utérines.
- Faire une coupure à la base du canal vaginal, et avec des forceps, tirer l’utérus loin du barrage. Faire une coupe supplémentaire à chaque ovaire pour libérer l’utérus. Transférer l’utérus dans l’un des plats Petri de 60 mm contenant des 1x PBS froids.
- À l’aide de ciseaux droits, couper la paroi utérine entre chaque site d’implantation. Ramassez un decidua avec une pipet en verre et transférer dans le plat Petri de 35 mm avec 1x PBS. Sous un microscope à dissection, insérer des ciseaux droits dans l’espace entre le decidua et la paroi utérine. Couper et enlever le mur utérin.
- Avec de fines forceps, retirez les membranes de la decidua et de Reichert de l’embryon en faisant soigneusement des incisions transversales le long du tissu et en tirant le tissu loin du sac jaune. Enlever le sac jaune et le sac amniotique en tirant soigneusement le tissu loin de l’embryon et en faisant des coupures à la veine allantois et ombilical.
REMARQUE : Les sacs jaunes peuvent être utilisés pour le génotypage des embryons. - Transférer chaque embryon avec un tuyau de verre dans des tubes individuels de 2 ml remplis de 1 ml de PBS 1x. Étiquetez chaque tube avec un identifiant unique.
- Pour corriger les embryons, retirez soigneusement le PBS 1x et ajoutez 4% de solution de paraformaldéhyde (PFA) dans 1x PBS. Incuber à 4 oC avec une agitation douce pendant la nuit.
REMARQUE : La fixation de PFA de 4 % convient aux anticorps mentionnés dans ce protocole. Cependant, les procédures de fixation doivent être optimisées pour les anticorps supplémentaires.
3. Coloration d’embryon
REMARQUE : Dans cette section, les embryons sont perméabilisés et tachés d’anticorps primaires et secondaires. Étant donné que le développement de l’APA se produit rapidement, les différences au stade embryonnaire auront une grande incidence sur l’analyse en aval. Par conséquent, les embryons doivent être appariés par le comptage minutieux des somites pour correspondre aux couples de contrôle et de mutants avant d’autres manipulations.
- Pour laver l’embryon, retirer soigneusement 4 % de PFA et ajouter 1x PBS. Inverser doucement le tube(s) plusieurs fois. Placer le tube (s) vers le haut et laisser couler l’embryon. Répéter le lavage 3 fois. Placer le tube (s) avec l’embryon(s) sur la glace.
REMARQUE : (point d’arrêt facultatif) Après les lavages, les embryons peuvent être déshydratés dans des séries classées de MeOH pendant 30 min par dilution, comme à la section 1.3, et stockés à -20 oC dans 100% MeOH pour une utilisation ultérieure jusqu’à 6 mois. - Pour les embryons E10.5, utilisez une pipet en verre pour transférer un embryon dans un plat Petri de 35 mm rempli de PBS 1x réfrigéré. Pincez soigneusement l’embryon juste au-dessus du membre postérieur avec de fines forceps et faites une coupe transversale pour enlever la moitié postérieure de l’embryon. Cela permet à l’embryon de se poser à plat dans une position sagittale pour l’étape 4.2. Remettre l’embryon dans le tube de 2 ml avec un PBS frais de 1x.
REMARQUE : Un embryon de contrôle et mutant peut être jumelé et taché avec la même solution d’anticorps dans un tube, pour les étapes 3.3 à 3.8.- Si la coloration de deux embryons ensemble, couper la tête d’un embryon au-dessus de la première arche pharyngée en pinçant avec de fines forceps pour faire une coupe transversale. Cela distinguera les embryons de deux génotypes différents dans chaque tube.
- Pour permébiliser l’embryon,s), pipet out 1x PBS du tube, en prenant soin de ne pas toucher l’embryon.s. Ajouter 1 ml de PBST. Placer le tube à 4 oC avec une agitation douce pendant la nuit.
REMARQUE : (point d’arrêt facultatif) Les embryons peuvent être conservés dans la solution PBST à 4 oC pendant plusieurs jours. - Pour empêcher la liaison non spécifique des anticorps, retirez d’abord PBST du tube, en prenant soin de ne pas toucher l’embryon. Ajouter 600 L de solution tampon de blocage à l’embryon.s. Bloquez l’embryon à 4 oC avec une agitation douce pendant la nuit.
REMARQUE : La solution de blocage doit être filée à grande vitesse sur une centrifugeuse de banc immédiatement avant utilisation pour enlever les débris. - Pour tacher et quantifier les CE, utilisez des anticorps contre VEGFR2 et ERG. Les solutions d’anticorps sont faites dans le tampon de blocage. L’anticorps anti-VEGFR2 est dilué 1:200 et l’anticorps ERG est dilué 1:1000.
REMARQUE : Les solutions d’anticorps doivent être filées à grande vitesse sur une centrifugeuse de banc-dessus immédiatement avant utilisation pour enlever les particules.- Pour incuber l’embryon(s) avec des anticorps primaires, supprimez la solution tampon de blocage du tube, en prenant soin de ne pas toucher l’embryon. Ajouter 600 L de solution d’anticorps primaires à chaque tube. Incuber l’embryon(s) à 4 oC avec une agitation douce pendant 4-5 jours.
- Pour laver l’embryon(s) de la solution anticorps, retirez d’abord la solution primaire d’anticorps du tube. Laver l’embryon toutes les heures avec 1 ml de PBST à température ambiante (RT) avec une agitation douce. Laver l’embryon (s) 4-5 fois pendant la journée, puis incuber à 4 oC avec une agitation douce pendant la nuit. Répéter les lavages le lendemain.
- Fabriquez des solutions d’anticorps secondaires en diluant l’anti-chèvre Alexa Fluor 488 et l’anti-souris Alexa Fluor 555 1:300 dans le tampon de blocage. Diluer le stock DAPI 1:1000 dans le tampon de blocage.
REMARQUE : Les solutions d’anticorps doivent être filées à grande vitesse sur une centrifugeuse de banc-dessus immédiatement avant utilisation pour enlever les particules. En outre, d’autres colorants Alexa Fluor peuvent être utilisés au lieu de 488 ou 555.- Pour incuber l’embryon(s) avec des anticorps secondaires, retirez PBST du tube. Ajouter 600 L de solution d’anticorps secondaires à chaque tube. Incuber l’embryon(s) à 4 oC avec une agitation douce pendant 4-5 jours.
- Pour laver l’embryon(s) de la solution anticorps, retirez d’abord la solution secondaire d’anticorps du tube. Laver l’embryon toutes les heures avec 1 ml de PBST à RT avec une agitation douce. Laver l’embryon (s) 4-5 fois pendant la journée, puis incuber à 4 oC avec une agitation douce pendant la nuit. Répéter les lavages le lendemain.
4. Embéquer des embryons dans l’agarose
REMARQUE : À la section 4, l’embryon sera incorporé dans l’agarose. Ce processus d’intégration a deux buts : orienter correctement l’embryon avant l’imagerie, et aider à localiser l’embryon une fois qu’il a été éliminé dans BABB (étapes 5.2.2 - 5.3.2).
- Préparer 200 ml de solution agarose de 1 % en ajoutant 2 g d’agarose à 200 ml de dH2O. Micro-ondes jusqu’à ce que toute l’agarose soit dissoute.
REMARQUE : Le reste de l’agarose peut être stocké à 4 oC et réchauffé pour des utilisations ultérieures. - À l’aide d’un moule à paraffine en plastique et d’une pipe en verre, transférez doucement un embryon au moule. Retirez soigneusement PBST de l’embryon. Placer l’embryon dans une position sagittale. Rapidement, ajouter environ 0,5 ml d’agarose chaude au moule - juste assez pour couvrir l’embryon et remplir le moule. Assurez-vous qu’aucune bulle d’air n’entoure l’embryon.
- Placer le moule sur la glace et couvrir de papier d’aluminium jusqu’à ce que l’agarose se solidifie.
REMARQUE : Ne laissez pas sécher l’embryon après l’ablation du PBST. La solution Agarose doit être suffisamment chaude pour rester liquide lorsqu’elle est ajoutée à l’embryon. Ajouter juste assez d’agarose pour couvrir l’embryon, mais pas trop, sinon il sera difficile à imaginer. La profondeur de l’image est déterminée en partie par la distance de travail de l’objectif.
5. Déshydratation et déblaiement des tissus
REMARQUE : Dans cette section, les embryons sont déshydratés à l’aide de la série de méthanol, puis éliminés dans le solvant organique, BABB, et montés entre deux reprises séparées par un espaceur en caoutchouc; dans ce protocole Fast Well spacers caoutchouc sont utilisés. Le pare-chocs Fast Well a une surface adhésive à double face. L’espaceur est nécessaire pour créer un puits, dans lequel l’embryon sera placé et maintenu entre deux reprises.
-
Déshydratation du méthanol
- Étiqueter de nouveaux tubes de 2 ml, un par embryon. Ajouter 1 ml de MeOH à 25 % par tube.
- À l’aide d’un scalpel propre, coupez doucement l’agarose autour de l’embryon, en laissant assez autour de l’embryon pour qu’il puisse être ramassé par des forceps. Utilisez de fines forceps pour saisir doucement l’agarose avec l’embryon incorporé et le placer dans le tube étiqueté avec 25% MeOH. Ne laissez pas les forceps toucher l’embryon.
- Incuber l’embryon(s) à RT avec une douce agitation pendant 1 heure dans l’obscurité.
- Retirez 25% MeOH du tube, en prenant soin de ne pas toucher l’embryon. Ajouter 1 ml de MeOH à 50 % par tube. Incuber à RT avec une douce agitation pendant 1 heure dans l’obscurité.
- Retirez 50% MeOH du tube, en prenant soin de ne pas toucher l’embryon. Ajouter 1 ml de MeOH à 75 % par tube. Incuber à RT avec une douce agitation pendant 1 heure dans l’obscurité.
- Retirez 75% MeOH du tube, en prenant soin de ne pas toucher l’embryon. Ajouter 1 ml de 1 mL de 100% MeOH par tube. Incuber à RT avec une douce agitation pendant 1 heure dans l’obscurité. Répétez 100% MeOH laver deux fois.
-
Dégagement avec BABB
- Retirez 100% MeOH du tube, en prenant soin de ne pas toucher l’embryon. Ajouter 1 ml de BABB à 50 % par tube. Incuber à RT avec une douce agitation pendant 1 heure dans l’obscurité.
- Retirez 50% DE BABB du tube, en prenant soin de ne pas toucher l’embryon. Ajouter 1 ml de BABB à 100 % par tube. Incuber à RT avec une douce agitation pendant 1 heure dans l’obscurité. Répétez 100% BABB laver deux fois.
REMARQUE : (point d’arrêt facultatif) Les embryons peuvent rester dans 100% BABB dans les tubes pendant environ une semaine. Un stockage plus long entraînera la dissolution du plastique des tubes PAR BABB.
-
Montage d’embryons pour l’imagerie
- Placez un pare-chocs Fast Well sur un glissement de couverture en verre de 24 mm x 60 mm #1,5, en épluchant l’adhésif en plastique d’un côté. Assurez-vous qu’il n’y a pas de bulles d’air entre le coverlip et le pare-chocs en appliquant une légère pression sur l’adhésif en plastique au sommet du pare-chocs en caoutchouc. Étiquetez le coverlip en fonction du numéro d’embryon, du génotype et des anticorps utilisés pour la coloration.
REMARQUE : Tout espaceur peut être placé entre les reprises tant qu’il est assez épais pour éviter d’écraser ou de squishing un embryon. Nous utilisons des espaceurs Fast Well en raison de leur épaisseur et de leur commodité, qui comprend des surfaces adhésives de chaque côté de l’espaceur pour le fixer aux couvertures. - Sortez soigneusement et jetez le BABB à 100 % du tube. Après avoir visualisé l’embryon intégré à l’agarose dans le tube, utilisez des forceps fins pour ramasser l’agarose et transférer soigneusement l’embryon sur le coverlip à l’intérieur du Puits rapide - ne permettent pas aux forceps de toucher l’embryon.
- Retirer le deuxième adhésif en plastique du pare-chocs et placer le deuxième coverlip sur le dessus. Retirez les bulles d’air en appuyant doucement sur le coverlip. Veillez à ne pas casser le verre.
REMARQUE : Les échantillons peuvent être stockés à plat dans un porte-glissières dans l’obscurité à RT jusqu’à un an si le joint est serré.
- Placez un pare-chocs Fast Well sur un glissement de couverture en verre de 24 mm x 60 mm #1,5, en épluchant l’adhésif en plastique d’un côté. Assurez-vous qu’il n’y a pas de bulles d’air entre le coverlip et le pare-chocs en appliquant une légère pression sur l’adhésif en plastique au sommet du pare-chocs en caoutchouc. Étiquetez le coverlip en fonction du numéro d’embryon, du génotype et des anticorps utilisés pour la coloration.
6. Acquisition de données
REMARQUE : Dans les étapes suivantes, l’endothélium des arcs pharyngés 3, 4 et 6 sera photographié à l’aide de microscopie confocale.
-
Positionnement des diapositives sur l’étape du microscope
- Pour imager les embryons, utilisez un microscope confocal équipé d’un objectif d’immersion 20x, d’une ouverture numérique 0,95, d’une distance de travail de 0,95 mm et du logiciel NIS-Elements AR 5.11.01 64 bits.
- À l’aide d’une fluorescence à champ large, localisez visuellement les arcs pharyngaires. Centrez la vue sur le terrain autour de la 4e PAA.
- Si le champ de vision de l’objectif ne capture pas toute la zone de l’arc pharyngé, prenez et placez un grand panneau d’images avec 1% de chevauchement. Pour éviter le mouvement de l’échantillon lors de l’acquisition de la grande image, fixer délicatement l’assemblage de feuille de couverture à la scène à l’aide d’argile moulante.
-
Mise en place de paramètres d’acquisition
- Réglez la taille du sténopé à 1,0.
- Sous l’onglet ND Acquisition, définissez les limites supérieures et inférieures de l’imagerie à l’aide du réglage grossier. Définissez la taille de l’étape Z selon les spécifications du logiciel. Déterminer l’épaisseur qui peut être image par la distance de travail de l’objectif et la clarté de l’échantillon.
- En raison de l’épaisseur de l’embryon, ajustez le gain tout au long de la pile Z. Réglez l’intensité et le gain laser au milieu de la pile Z pour chaque canal (405, 488 et 555) et attribuez des valeurs sous l’onglet Z Intensity Correction. Définissez les mêmes valeurs pour la tranche inférieure.
- Faites défiler l’embryon jusqu’à ce que les signaux de fluorescence commencent à apparaître plus faibles. Augmentez le gain de chaque canal jusqu’à ce que l’intensité du signal semble similaire au segment précédent. Affectez la nouvelle valeur sous l’onglet Z Intensity Correction. Répétez jusqu’à ce que z-stack soit complet. Les paramètres d’importation de retour à ND Acquisition.
- Exécuter l’analyse à l’aide de l’option Run Z Correction.
7. Analyse à l’aide du logiciel Imaris
REMARQUE : Dans ces étapes, les images confocales seront analysées à l’aide du logiciel d’analyse d’images de microscopie, version Imaris 9.2.0. Au cours de cette analyse, nous sélectionnerons d’abord les régions d’intérêt à analyser en créant des surfaces. Ensuite, nous utiliserons la fonction Masque pour séparer visuellement ces régions. Enfin, nous utiliserons la fonction Spot pour quantifier le nombre de CE dans chaque région d’intérêt.
- Selon le logiciel d’imagerie utilisé à l’étape 6, convertir les images en .ims en utilisant Imaris File Converter.
- Ouvrez les fichiers .ims. Définir l’image à Orthogonal sous La caméra/étiquettes Panneau de type caméra.
- Localiser les PAA et orienter l’image pour le revêtement.
REMARQUE : Lorsque les fichiers sont ouverts pour la première fois, ils apparaissent sous forme de compilation 3D de toutes les tranches illustrées. Dans cette étape, les APA seront localisés en faisant de l’image 3D une image 2D. L’image 2D permet alors aux APA d’être correctement orientées pour l’analyse.- Sous le panneau Propriétés, éteignez volume. Sous le panneau Propriétés, cliquez sur Ajouter de nouvelles trancheuses Ortho. Définir l’orientation des tranches sur le plan XY. Utilisez la position de tranche pour faire défiler l’image jusqu’à ce que trouver les PAA.
- Si les PAA ne sont pas parallèles au haut et au bas de l’image, faites pivoter librement l’image à l’aide du curseur de souris afin que les PAA s’exécutent de gauche à droite à travers l’écran. Dans le cadre du menu De traitement d’image, sélectionnez Free Rotate et cliquez sur OK.
- Surfant sur le 3 rd Pharyngeal Arch (Figure 2A, B - B")
REMARQUE : Dans ces étapes, les arcs pharyngés et les PAA seront tracés à l’aide de l’outil Surface pour générer une région d’intérêt « surface ». Cela permettra à chaque région d’intérêt d’être visuellement isolée du tissu environnant. Ici, nous décrivons les étapes de la surface et d’analyser les composants endothéliaux de l’arc pharyngé 3rd. Les arcs pharyngés 4 et 6 sont analysés de la même façon.- Pour faire surface l’endothélium dans l’ensemble de l’arc pharyngé de 3rd, cliquez sur le bouton Ajouter de nouvelles surfaces situé sous le panneau Propriétés. Double clic sur Surface 1 et renommez la nouvelle surface à "3rd Pharyngeal Arch".
- Sélectionnez Skip création automatique, modifier manuellement. Définissez l’orientation de surface au plan YZ (orientation coronale). Utilisez la position de tranche pour placer le plan de surface d’arc pharyngé 3rd à l’endroit où le 3rd PAA et Dorsal Aorta se connecter.
- Faites pivoter l’image de sorte que le plan de surface de l’arc pharyngé 3rd est en vue. Éteindre Ortho Slicer 1.
- Sous le tirage au sort ( Contour (en anglais) Onglet mode, sélectionnez la fonction Mode De dessin à distance. Ajuster les paramètres si nécessaire. Maintenir des paramètres de revêtement cohérents entre les échantillons. Pour cet exemple, l’espacement De Vertex est de 10 m.
- Pour commencer à faire surface, appuyez sur la touche Esc, puis cliquez sur le bouton Dessiner. Tracez le périmètre de l’arc pharyngé 3rd avec le curseur de souris. Utilisez la position de tranche pour déplacer 10-25 tranches. Tracez le périmètre de l’arc pharyngé. Répétez l’opération jusqu’à ce que l’arc pharyngé soit entièrement tracé.
- Pour générer la surface de la région tracée, sélectionnez le bouton Créer la surface dans le panneau Propriétés.
- Surfant sur le 3 rd PAA (Figure 2C - C")
- Pour faire surface l’endothélium de la 3rd PAA, d’abord éteindre la région en surface de l’étape 7.4, en désélectionnant la boîte de surface 3rd Pharyngeal Arch. Ensuite, cliquez sur le bouton Ajouter de nouvelles surfaces à nouveau. Double clic sur Surface 1 et renommez la nouvelle surface à "3rd PAA".
- Sélectionnez Skip création automatique, modifier manuellement. Définissez l’orientation de surface au plan YZ (orientation coronale). Utilisez la position de tranche pour placer le plan de surface paA 3rd à l’endroit où le 3rd PAA et Dorsal Aorta se connecter, puis répéter les étapes 7.4.
- Masquer les structures en surface
REMARQUE : Dans les étapes suivantes, chaque région d’intérêt refait surface sera masquée. Le masquage permet à la région d’intérêt d’être visuellement distincte du reste du tissu d’image et permet la quantification de ces structures d’intérêt distinctes. Ci-dessous, nous décrivons les étapes d’Imaris pour visualiser et analyser l’endothélium PAA, ainsi que le plexus - la plus petite vascularisation entourant les PAA dans les arcs pharyngés. Dans ces étapes, la surface de l’AAP 3rd sera masquée afin de visualiser et d’effectuer une analyse uniquement sur les APA à l’aide de la fonction Spot décrite à la section 7.7.- Sélectionnez Volume afin de visualiser tous les canaux masqués. Appuyez sur la clé Esc afin de faire pivoter l’image et de placer l’image en position XY.
- Sous l’onglet Modifier, sélectionnez Mask Selection pour le 3rd PAA. Sélectionnez le canal DAPI et cliquez sur OK. Répétez l’opération pour les canaux restants.
- Sur le clavier, appuyez sur Ctrl 'D pour afficher le panneau d’ajustement d’affichage. Sélectionnez chaque nouveau canal et renommez-les pour préciser ce que chaque canal affiche. Par exemple, cela conduira à trois nouvelles chaînes: "3rd PAA DAPI", "3rd PAA ERG", et "3rd PAA VEGFR2".
REMARQUE : Dans les étapes 7.6.4-7.6.7 nous créerons des canaux pour le plexus d’arc pharyngé seulement. - Pour visualiser le plexus endothélien séparément de l’AAP, nous sélectionnerons d’abord Mask Selection pour la surface de 3rd PAA. Sélectionnez le canal DAPI. Décochez sélectionnez voxels surface extérieure pour vérifier Select voxels à l’intérieur de la surface à des boutons, définissez Sélectionnez voxels à l’intérieur de la surface à zéro. Cliquez sur OK.
- Répétez l’opération pour les canaux restants. Cette opération exclura la région contenant l’AAP des nouveaux canaux masqués. Renommer les canaux pour préciser ce que chaque canal affiche. Par exemple, cela conduira à trois nouvelles chaînes: "Non-PAA DAPI", "Non-PAA ERG", et "Non-PAA VEGFR2".
- Pour visualiser le plexus endothélien dans l’arc pharyngé 3rd, sélectionnez Mask Selection sous l’onglet Edit, pour la surface 3rd Pharyngeal Arch. Sélectionnez le canal DAPI Non-PAA. Cliquez sur OK.
- Répétez l’opération pour les autres canaux non-PAA. Renommer les canaux pour préciser ce que chaque canal affiche. Par exemple, cela conduira à trois nouvelles chaînes: "Plexus DAPI", "Plexus ERG", et "Plexus VEGFR2".
- Quantification des chiffres des CE
REMARQUE : L’expression de l’ERG marque des noyaux endothéliaux, ce qui permet de quantifier les nombres d’EC. Dans ces étapes, le nombre d’EC sera quantifié à l’aide de la fonction Spot pour générer un spot pour chaque CE marqué par l’expression ERG dans l’AAP et le plexus. À la section 7.7, des taches seront générées pour chaque cellule ERG-positive dans l’AAP masquée, suivies de la désélection des taches dans les cellules ERG-positives, VEGFR2-négatives.- Sur le clavier, appuyez sur Ctrl 'D pour afficher le panneau d’ajustement d’affichage. Éteignez tous les canaux à l’exception de PAA ERG.
- Sous l’onglet propriétés, cliquez sur le bouton Ajouter de nouveaux spots. Cliquez sur les spots 1 et renommez-le à "PAA Total Number of ECs". Cliquez sur le bouton flèche bleue. Pour Source Channel, sélectionnez le canal PAA ERG. Ajuster le diamètre XY estimé à 4 m. Passez au panneau suivant en cliquant sur le bouton flèche bleue.
- Ajuster le nombre de taches vues à l’aide de l’échelle mobile, pour s’assurer que chaque noyau EC (marqué par l’expression ERG) est représenté par un seul endroit. Cliquez sur le bouton double flèche vert.
- Éteignez le canal PAA ERG dans le réglage de l’affichage. Activez le canal PAA VEGFR2 pour visualiser l’endothélium PAA.
- Pour quantifier avec précision le nombre de CE, nous veillons à ce que chaque spot exprime les deux marqueurs EC, ERG et VEGFR2. Pour ce faire, sélectionnez Surface d’objet sous l’onglet Modifier Ajouter/Supprimer le panneau. Appuyez sur la clé Esc et supprimez tous les endroits qui ne sont pas veGFR2 positif, en maintenant le décalage vers le bas et la sélection de l’endroit.
REMARQUE : Dans l’étape suivante, des taches seront générées pour chaque cellule ERG-positive dans le plexus masqué, suivie par la désélection des taches dans les cellules ERG-positives, VEGFR2-négatives. - Sous l’onglet propriétés, cliquez sur le bouton Ajouter de nouveaux spots. Sélectionnez les spots 1 et renommez-vous pour « Nombre total de CE ». Cliquez sur le bouton flèche bleue. Pour Source Channel, sélectionnez le canal Plexus ERG. Ajuster le diamètre XY estimé à 4 m. Étapes répétées 7.7.1 - 7.7.5 pour le nombre total de CE de Plexus.
- Cliquez sur l’onglet Statistiques de chaque fonction spot pour déterminer le nombre total de CE dans le 3rd PAA et le plexus d’arc pharyngé.
- Répétez les étapes 7.7.1 - 7.7.6 pour les PAA restants et le plexus d’arc pharyngé.
Résultats
Le protocole d’immunofluorescence à monture entière présenté ici produit des résultats clairs et propres, permettant la reconstruction 3D de l’endothélium pharyngé, comme on le voit dans la figure 1A. Il est important d’incuber des embryons pendant suffisamment de temps dans chaque solution d’anticorps pour assurer une pénétration complète à travers l’échantillon, ainsi que, le lavage complet des embryons après l’incubation des anticorps. Dans la figure 1B, de grands points lumineux apparaissent à la suite de particules dans les anticorps ou de blocage des solutions tampons. Nous avons constaté que centrifuger chaque solution avant utilisation et de plus longues périodes de lavages PBST après chaque incubation d’anticorps résout ce problème.
La figure 2 illustre le processus utilisé pour faire surface une arche pharyngée et un PAA pour analyse tel que décrit à l’article 7 du protocole. À l’aide de la fonction masquée, le logiciel Imaris permet aux régions de surface d’être visuellement séparées et analysées de façon indépendante.
La figure 3 démontre le masquage individuel de différents compartiments vasculaires dans les arcs pharyngés : l’APA(figure 3A, B, C) et le plexus(figure 3A', B', C'). Le masquage permet l’analyse et la quantification des nombres d’EC dans chaque structure séparément. Dans la figure 3C-C', la fonction Spot est utilisée pour quantifier le nombre total de CE dans l’AAP et le plexus, en attribuant une seule place pour chaque noyau exprimant ERG. Il est important de noter que l’algorithme utilisé pour la fonction Spot est conçu pour générer un point pour n’importe quel pixel d’une taille spécifiée. ERG, qui est utilisé ici comme marqueur des noyaux d’EC, est également exprimé dans les cellules de crête neurale8; les cellules de crête neurale n’expriment pas VEGFR2. La figure 3D illustre un exemple d’un spot ERG-positif (vert), VEGFR2-négatif (rose) qui a été généré par la fonction Imaris Spot. Par conséquent, il est essentiel de vérifier que chaque point représente un seul EC et est étiqueté avec ERG et VEGFR2.
| Étape | Temps | Température | |
| 1 | PBST Wash/Permeabilisation | 24 h ou O/N | 4 oC |
| 2 | Blocage du tampon | 25 h ou O/N | 4 oC |
| 3 | Anticorps primaires | 4-5 jours | 4 oC |
| 4 | Lavage PBST | 4-5 fois par jour pendant 2 jours | RT (ou 4 oC si O/N) |
| 5 | Anticorps secondaires | 4-5 jours | 4 oC |
| 6 | Lavage PBST | 4-5 fois par jour pendant 2 jours | RT (ou 4 oC si O/N) |
| 7 | Incorporer | N/A | Rt |
| 8 | Déshydratation du méthanol et BABB | 1 heure par étape | Rt |
Tableau 1 : Aperçu du protocole d’immunofluorescence de montage entier. O/N - du jour au lendemain; RT - température ambiante.
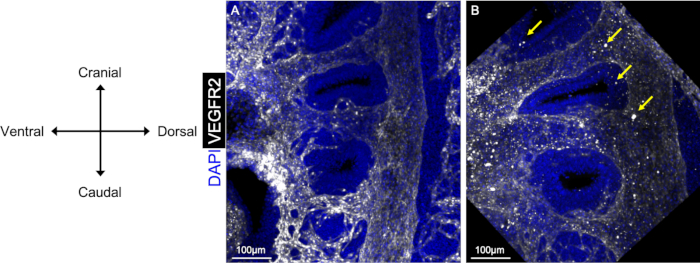
Figure 1 : Comparaison d’images propres et sales suivant l’immunofluorescence à monture entière. Les vues sagittales de l’embryon E10.5 montrent l’utilisation d’anticorps anti-VEGFR2 (blanc) pour visualiser l’endothélium PAA. Les embryons soigneusement lavés avec des incubations d’anticorps post-PBST (A) ont un rapport signal-bruit plus élevé et produisent une image plus propre, par rapport aux embryons qui ne sont pas soigneusement lavés (B). Les flèches en B montrent des zones de bruit/saleté qui sont apparues dans l’image lorsqu’un embryon n’est pas bien lavé ou que la solution d’anticorps n’a pas été centrifugée. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2 : Revêtement de l’arc pharyngé (PA) et de l’APA. Une vue sagittale 2D (A) est utilisée pour identifier l’emplacement des APA dans l’image confocale. Un trancheur d’ortho coronal (A, ligne jaune) est placé par les PAA. L’arc pharyngé (B) et PAA (C) sont ensuite fait surface dans l’orientation coronale à l’aide de l’outil de dessin à distance à Imaris. L’outil de dessin à distance, réglé à 10 m, est utilisé pour tracer le périmètre de l’arc pharyngé 3rd (B) ou de la PAA (C). Les contours sont dessinés toutes les 10-25 tranches à travers l’arc entier (B', C'). Les contours sont combinés pour générer une surface 3D de l’arc pharyngé (B") ou de la PAA (C"). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
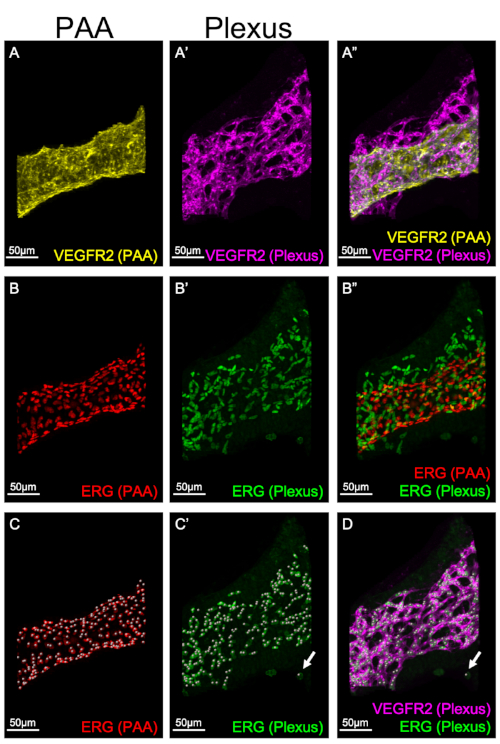
Figure 3 : Quantification des numéros de CE dans un AAP et un plexus. Les reconstructions 3D sont utilisées pour visualiser la structure et l’expression des marqueurs EC dans un PAA ou dans un plexus EC séparément. Les panneaux A-A' montrent l’expression de VEGFR2 dans le PAA (A, jaune) et dans le plexus (A', rose). Panel A" illustre une fusion de l’expression PAA et plexus VEGFR2. Les panneaux B-B' montrent l’expression de l’ERG dans l’AAP (B, rouge) et dans le plexus (B', vert). Panel B" illustre la fusion de l’APA et du plexus. C-C'. La fonction Spot dans Imaris est utilisée pour quantifier le nombre d’EP dans l’AAP ou le plexus. Chaque cellule ERG-positive dans le PAA (C, rouge) ou plexus (C', vert) se voit attribuer un seul endroit pour marquer un seul EC. La flèche dans C'-D montre un exemple ERG-positif, VEGFR2-négatif place dans le plexus qui a été généré par la fonction Imaris Spot. Cet endroit est exclu de la quantification. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
La capacité de visualiser l’endothélium dans les embryons de souris en 3D a fourni de nouvelles perspectives dans leur développement3. Nous présentons ici un protocole qui permet l’imagerie 3D haute résolution des embryons, la visualisation de la connectivité vasculaire et les analyses quantitatives de la formation de PAA. Ce protocole peut être utilisé pour voir comment les altérations génétiques ou les insultes environnementales influent sur le développement de l’AAP. La procédure signalée ici utilise des anticorps contre VEGFR2 et ERG pour visualiser la formation de PAA et quantifier le nombre d’EC; cependant, des anticorps supplémentaires peuvent être employés pour visualiser et analyser d’autres aspects du développement de l’artère archi, tels que le recrutement de crêtes neurales ou la différenciation lisse de cellules de muscle. Si cette procédure doit être utilisée à des stades précoces de l’embryogenèse, il est important de noter que certains antigènes (p. ex., ERG) détectés dans ce protocole peuvent ne pas encore être exprimés. D’autres taches nucléaires telles que DAPI ou DRAQ5 ou l’étiquetage de lignée avec des traceurs d’étiquette nucléaire peuvent être utilisées pour quantifier le nombre d’EC.
Il y a plusieurs étapes critiques dans le protocole : s’assurer que 1) les embryons ne deviennent pas desséchés entre les changements de solution ; 2) les embryons sont soigneusement lavés après des incubations d’anticorps; et 3) que les embryons sont complètement déshydratés avec MeOH avant le déblaiement des tissus avec BABB.
Les lavages de méthanol avant le déboisement des tissus servent deux buts : éliminer la fluorescence due à l’expression de protéines fluorescentes (p. ex. l’expression de l’EGFP ou du tdTomato utilisé pour le traçage de la lignée) dans l’embryon, et déshydrater le tissu. L’élimination de la fluorescence des protéines fluorescentes permet l’utilisation de toute combinaison de fluorophores pour l’imagerie. Les anticorps contre l’EGFP et le TdTomato (cerise) peuvent être utilisés pour visualiser l’expression de ces protéines fluorescentes. Alternativement, MeOH peut être remplacé par tétrahydrofuran pour préserver la fluorescence des protéines fluorescentes9.
Nous avons constaté que les embryons qui n’ont pas été correctement déshydratés avant le dégagement de BABB sont difficiles à imager en raison de la diffusion de la lumière. BABB est une solution hydrophobe qui nécessite une déshydratation complète dans un solvant organique afin d’effacer le tissu opaque. Une compensation complète assure la possibilité d’obtenir des images aux niveaux les plus profonds possibles au sein de l’embryon10,11. Dans ce protocole, nous avons utilisé un objectif d’immersion 20x, en raison de sa longue distance de travail et de sa disponibilité au moment de nos expériences. Les objectifs d’immersion pétrolière conviennent mieux à ce protocole, car le BABB et le pétrole ont des indices réfractaires plus proches que l’eau et le BABB. Cependant, malgré la différence d’index réfractiv, l’objectif d’immersion en eau utilisé dans ce protocole a fourni une excellente qualité d’image.
Il y a quelques limites de ce protocole. BabB compensation utilisée ici est toxique et corrosif11,12,13. BABB dissout la colle et les plastiques. Si les échantillons ne sont pas manipulés correctement pendant l’imagerie, la lentille objective au microscope peut être endommagée par BABB qui peut s’échapper de l’échantillon par des fissures dans le coverlip ou un joint cassé entre le pare-chocs Fast Well et le coverlip. Les méthodes de compensation qui n’utilisent pas de solvants organiques, comme CLARITY, peuvent être utilisées comme alternatives10,11,14. La solution de correspondance d’index réfractif de CLARITY a un indice réfractif semblable à celui de l’eau, ce qui en fait une méthode de compensation appropriée si elle utilise un objectif d’immersion en eau. Une limitation supplémentaire de ce protocole est qu’il ne peut être effectué sur les tissus non vivants, empêchant ainsi son application pour l’imagerie vivante.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Brianna Alexander, Caolan O’Donnell et Michael Warkala pour la lecture et l’édition minutieuses de ce manuscrit. Ce travail a été soutenu par le financement de l’Institut national du cœur, du poumon et du sang des NIH R01 HL103920, R01 HL134935, R21 OD025323-01 à SA; L’AJR est appuyée par l’AJR HL103920-08S1 et la subvention de l’Institut national de formation de l’arthrite et des maladies musculo-squelettiques et des maladies de la peau T32052283-11.
matériels
| Name | Company | Catalog Number | Comments |
| 10x PBS | MP Biomedicals | PBS10X02 | |
| 20x water immersion objective | Nikon | MRD77200 | |
| Agarose | Bio-Rad Laboratories | 1613101 | |
| Alexa Fluor 488 anti-goat | Invitrogen | A-11055 | |
| Alexa Fluor 555 anti-mouse | Invitrogen | A-31570 | |
| Analysis Software | Imaris 9.2.0 | ||
| Benzyl Alcohol | Sigma-Aldrich | 305197 | |
| Benzyl Benzoate | Sigma-Aldrich | 8.18701.0100 | |
| Cover Slips | VWR | 16004-312 | |
| DAPI (5 mg/mL stock) | Fisher Scientific | D3571 | |
| Eppendorf Tubes (2.0 mL) | Fisher Scientific | 05-408-138 | |
| Ethanol | VWR | 89370-084 | |
| Falcon tubes (50 mL) | Corning | 352098 | |
| Fast wells | Grace Bio Labs | 664113 | |
| Forceps | Roboz | RS-5015 | |
| Goat anti-VEGFR2 | R&D Systems, Inc. | AF644 | |
| Methanol | VWR | BDH1135-4LP | |
| Microscope | Nikon | A1HD25 | |
| Mouse anti-ERG | Abcam | ab214341 | |
| Normal Donkey Serum | Sigma-Aldrich | D9663 | |
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| Pasteur pipets | Fisher Scientific | 13-678-20D | |
| Petri dishes (35 mm) | Genesee Scientific | 32-103 | |
| Petri dishes (60 mm) | Genesee Scientific | 32-105 | |
| Plastic Molds | VWR | 18000-128 | |
| Scapels | Exelint International Co. | 29552 | |
| Triton-X-100 | Fisher Scientific | BP 151-500 |
Références
- Hiruma, T., Nakajima, Y., Nakamura, H. Development of pharyngeal arch arteries in early mouse embryo. Journal of Anatomy. 201 (1), 15-29 (2002).
- Hutson, M. R., Kirby, M. L. Model systems for the study of heart development and disease Cardiac neural crest and conotruncal malformations. Seminars in Cell & Developmental Biology. 18 (1), 101-110 (2007).
- Wang, X., et al. Endothelium in the pharyngeal arches 3, 4 and 6 is derived from the second heart field. Developmental Biology. 421 (2), 108-117 (2017).
- Jerome, L. A., Papaioannou, V. E. DiGeorge syndrome phenotype in mice mutant for the T-box gene, Tbx1. Nature Genetics. 27 (3), 286-291 (2001).
- Lindsay, E. A., et al. Tbx1 haploinsufficieny in the DiGeorge syndrome region causes aortic arch defects in mice. Nature. 410 (6824), 97-101 (2001).
- Weninger, W., et al. Visualising the Cardiovascular System of Embryos of Biomedical Model Organisms with High Resolution Episcopic Microscopy (HREM). Journal of Cardiovascular Development and Disease. 5 (4), 58(2018).
- Phillips, H. M., et al. Pax9 is required for cardiovascular development and interacts with Tbx1 in the pharyngeal endoderm to control 4th pharyngeal arch artery morphogenesis. Development. 146 (18), (2019).
- Vlaeminck-Guillem, V., et al. The Ets family member Erg gene is expressed in mesodermal tissues and neural crests at fundamental steps during mouse embryogenesis. Mechanisms of Development. 91 (1-2), 331-335 (2000).
- Ertürk, A., et al. Three-dimensional imaging of the unsectioned adult spinal cord to assess axon regeneration and glial responses after injury. Nature Medicine. 18 (1), 166-217 (2012).
- Azaripour, A., et al. A survey of clearing techniques for 3D imaging of tissues with special reference to connective tissue. Progress in Histochemistry and Cytochemistry. 51 (2), 9-23 (2016).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Becker, K., Jährling, N., Saghafi, S., Weiler, R., Dodt, H. U. Chemical Clearing and Dehydration of GFP Expressing Mouse Brains. PLoS One. 7 (3), e33916(2012).
- Ertürk, A., et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nature Protocols. 7 (11), 1983-1995 (2012).
- Kuwajima, T., et al. ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon