Method Article
全実装免疫学化学と3D再構成を用いた咽頭弓動脈の可視化と解析
要約
ここでは、全実装免疫蛍光、組織クリア、共焦点顕微鏡、3D再構成を用いて、咽頭弓動脈3、4、および6個のマウス胚を可視化・解析するプロトコルについて述べている。
要約
咽頭弓動脈(PAA)3、4、および6の不適切な形成または改修は、先天性心疾患の最も重篤な形態のいくつかに寄与する。PAAの形成を研究するために、ベンジルアルコール/ベンジルベンゾアート(BABB)組織クリアリングと共焦点顕微鏡を組み合わせた全実装免疫蛍光を用いたプロトコルを開発した。これにより、細かい細胞分解能で咽頭のアーチ内皮を可視化し、血管構造の3D接続性を可能にします。ソフトウェアを用いて、PAA内の内皮細胞(IC)の数、咽頭アーチ3、4、および6内のPAAを取り巻く血管叢内のICの数を定量化するプロトコルを確立しました。胚全体に適用される場合、この方法論は胚脈管構造の包括的な視覚化および定量的分析を提供する。
概要
マウスの胚発生時に、咽頭弓動脈(PAA)は、心臓と後部大動脈1を結ぶ対称的な二側側の動脈対として生じる。胚が発達するにつれて、PAAの第1および第2のペアは後退し、第3、第4、および第6のPAAは大動脈動脈を形成する一連の非対称リモデリングイベントを受ける2。
PAA 3,4,6は血管形成を介して発達し、血管形成3.これらのアーチ動脈の形成または改造における欠陥は、ディジョージ症候群4、5の患者に見られるような様々な先天性心不全を5引き起こす。したがって、PAAの発達を調節するメカニズムを理解することは、先天性心疾患(CHD)病因をよりよく理解することにつながる。
PAA開発を可視化および分析するための現在のアプローチとしては、組織切片の免疫蛍光、血管キャスト、インドのインク注入、高解像度のエピスコピック顕微鏡、および/または全実装免疫組織化学11、4、5、6、74,5,6,が挙げられる。ここでは、体積データ、血管接続性、細胞アイデンティティを収集、解析、定量化するために、全実装免疫蛍光、共焦点顕微鏡、3D画像レンダリングを組み合わせたプロトコルについて説明する。さらに、咽頭弓血管叢の形成とPAAへの改修を研究する手段として、各咽頭弓中のICの数を区分化し定量化する方法を詳述する。このプロトコルはPAAの開発を分析するために設計されていますが、他の発達中の血管ネットワークを分析するために使用することができます。
プロトコル
動物の使用と手順は、ラトガース大学の施設動物ケアと使用委員会によって承認されました.
1. ソリューションの準備
- 0.1%トリトンX-100(PBST)とフィルター滅菌でリン酸緩衝生理食塩液の1 Lを調製します。この溶液は、少なくとも1年間室温(RT)で保存することができます。
- PBSTで通常のロバ血清の10%からなるブロッキングバッファーの600 μLを調製します。このソリューションを毎回新鮮にします。
- フローフードにメタノール(MeOH)希釈液を50 mL用意します:脱イオン水(dH2O)で25%MeOH、dH2Oで50%MeOH、2および75%MeOHを混合します。22RTに保管してください。
- 50 mL円錐管に、以下のベンジルアルコールベンジルベンゾアート(BABB)溶液を50 mL用意します。
- 100%BABBの場合、ベンジルアルコール16mL(体積比あたり2:1体積)にベンジルベンゾアート32 mLを加えます。
- 50%のBABBの場合、ベンジルベンゾアート16mLと8mLのベンジルアルコールをMeOHの24mLに加えます。
- 光から保護するために、アルミニウム箔で円錐形のチューブをカバーします。これらのソリューションは、RTで最長1年間保存できます。
注意:BABBは有毒で腐食性です。MSDS に従って処理し、廃棄する必要があります。
2. 胚解剖と固定
注:このプロトコルは、マウス株から分離されたE9.5およびE10.5マウス胚(オスまたはメス)に適しています。若い胚および古い胚については、インキュベーション時間は、蛍光シグナルのノイズ比に対する信号を最大にするように実験的に決定されるべきである。
- 1つの35ミリメートルと1 60 mmペトリ皿を1x PBSで満たし、必要になるまで氷の上に置きます。
- CO2吸入を介して妊娠中2のマウスを安楽死させる。安楽死の二次的尺度として子宮頸部脱臼を行う。
- 70%エタノールでダムの腹部を清掃してください。鉗子を使用して腹部の領域をつまみ、正中線の腹壁の基部から始まる外科用ハサミを使用してV様切開を行う。胸腔を開き続けます。腹部組織を持ち上げ、腸を側に移動して子宮の角を露出させる。
- 膣管の基部で切り傷を行い、鉗子で子宮をダムから引き離します。子宮を解放するために各卵巣で追加のカットを行います.冷たい1x PBSを含む60 mmペトリ皿の1つに子宮を移します。
- ストレートハサミを使用して、各埋め込み部位の間の子宮壁を切断します。ガラスパイプでデシドゥアを拾い、1x PBSで35mmペトリ皿に移します。解剖顕微鏡の下で、デシドゥアと子宮壁の間のスペースにまっすぐなはさみを挿入します。子宮壁を切り取り、取り除きます。
- 細かい鉗子では、慎重に組織に沿って横断切開を行い、卵黄嚢から組織を引き離すことによって、胚からデシドゥアとライヒャートの膜を取り除きます。卵黄嚢と羊膜嚢を慎重に胚から引き離し、アラントワと臍帯静脈で切り傷を加えることによって除去する。
注:黄身嚢は、遺伝子型入力胚に使用することができます。 - ガラスピペットを用いた各胚を、1mLのPBSを充填した個々の2mLチューブに移します。各チューブに一意の識別子を付けます。
- 胚を固定するには、慎重に1x PBSを除去し、1x PBSに4%パラホルムアルデヒド(PFA)溶液を添加します。一晩穏やかな攪拌で4°Cでインキュベート。
注: 4% PFA 固定は、このプロトコルで言及されている抗体に適しています。しかし、固定手順は、追加の抗体に最適化する必要があります。
3. 胚染色
注: このセクションでは、胚は透過して、一次抗体と二次抗体で染色されます。PAAの発達は急速に進行するため、胚期の違いは下流の分析に大きな影響を与えます。したがって、胚は、さらなる操作の前に対照および突然変異体のペアに一致するように慎重にスマイトを数えることによって年齢一致しなければならない。
- 胚を洗浄するには、4%のPFAを慎重に取り除き、1倍のPBSを加えます。チューブを数回ゆっくり反転します。チューブを右に上に置き、胚を沈まします。洗浄を3回繰り返します。胚を持つチューブを氷の上に置きます。
注:(任意停止点)の後の、胚は、セクション1.3のように、希釈あたり30分間、MeOHの段階的な系列で脱水することができ、後で6ヶ月間使用するために100%MeOHで-20°Cで保存されます。 - E10.5胚の場合は、ガラスピペットを使用して、1つの胚を冷やされた1x PBSで満たされた35mmペトリ皿に移します。後肢のすぐ上に細かい鉗子で慎重に胚をつまみ、横切りして胚の後部半分を取り除きます。これにより、胚はステップ4.2の矢状位置に平らに横たわることができる。新鮮な1x PBSで胚を2mLチューブに戻します。
注:対照および突然変異胚は、ステップ3.3から3.8の1つのチューブ内の同じ抗体溶液と組み合わせ、染色することができます。- 2つの胚を一緒に染色する場合は、最初の咽頭弓の上の1つの胚の頭部を切り取り、細かい鉗子でつまんで横断カットを行う。これは、各チューブ内の2つの異なる遺伝子型の胚を区別します。
- 胚を透過させるには、チューブから1倍のPBSをパイプアウトし、胚に触れないように注意する。PBSTを1 mL追加します。一晩穏やかな攪拌で4°Cにチューブを置きます。
注:(任意停止点)胚は、4°Cで数日間PBST溶液に保管することができます。 - 抗体の非特異的結合を防ぐために、まず、胚に触れないように気をつけて、チューブからPBSTを取り出します。600 μL のブロッキングバッファー溶液を胚に加えます。一晩穏やかな攪拌で4°Cで胚をブロックします。
注:ブロッキングソリューションは、破片を取り除くために使用する直前にベンチトップ遠心分離機で最高速度で回転する必要があります。 - ECを染色して定量するには、VEGFR2およびERGに対する抗体を使用してください。抗体溶液はブロッキング緩衝液で作られる。抗VEGFR2抗体は1:200に希釈され、ERG抗体は1:1000に希釈される。
注:抗体溶液は、微粒子を除去するために使用する直前にベンチトップ遠心分離機で最高速度で回転する必要があります。- 一次抗体で胚をインキュベートするには、チューブからブロッキング緩衝液を取り除き、胚に触れないように注意してください。各チューブに600μLの一次抗体溶液を加えます。4-5日間穏やかな攪拌で4°Cで胚をインキュベートする。
- 抗体溶液の胚を洗浄するには、まず一次抗体溶液をチューブから取り出します。室温(RT)で1mLのPBSTで1時間ごとに穏やかな攪拌で胚を洗います。胚を日中4~5回洗い、一晩穏やかな攪拌で4°Cでインキュベートする。翌日のリピートの打ち返し。
- 抗ヤギアレクサFluor 488と抗マウスアレクサFluor 555 1:300ブロッキングバッファで希釈することにより、二次抗体溶液を作ります。ブロッキングバッファで在庫 DAPI 1:1000 を希釈します。
注:抗体溶液は、微粒子を除去するために使用する直前にベンチトップ遠心分離機で最高速度で紡ぐ必要があります。さらに、他のアレクサ蛍光色素は488または555の代わりに使用することができます。- 胚を二次抗体でインキュベートするには、チューブからPBSTを取り出します。各チューブに600μLの二次抗体溶液を加えます。4-5日間穏やかな攪拌で4°Cで胚をインキュベートする。
- 抗体溶液の胚を洗浄するには、まずチューブから二次抗体溶液を取り出します。1 mLのPBSTで1時間ごとに胚をRTで穏やかな攪拌で洗います。胚を日中4~5回洗い、一晩穏やかな攪拌で4°Cでインキュベートする。翌日のリピートの打ち返し。
4. アガロースに胚を埋め込む
注:セクション4では、胚はアガロースに埋め込まれます。この埋め込みプロセスは、イメージング前に胚を適切に配向し、BABBでクリアされた後に胚を見つけるのを助けるという2つの目的を果たします(ステップ5.2.2 - 5.3.2)。
- アガロース2gを200mLのdH2O.マイクロ波に加えて、アガロースが全て溶解するまで200mLのアガロース溶液を調製します。
注:残りのアガロースは4°Cで保存し、後で使用するために再加熱することができます。 - プラスチックパラフィンモールドとガラスパイプを使用して、1つの胚を穏やかに金型に移します。胚からPBSTを慎重に取り除きます。胚を矢状の位置に置きます。迅速に、約0.5 mLのホットアガロースを金型に加え、胚を覆い、金型を充填するのに十分です。胚を囲む気泡がないことを確認します。
- カビを氷の上に置き、アガロースが固まるまでアルミホイルで覆います。
メモ:PBSTの除去後に胚を乾燥させないでください。アガロース溶液は、胚に添加される際に液体を保つほど温まっていなければなりません。胚を覆うのに十分なアガロースを加えるが、あまりにも多くはないが、そうでなければ画像を見ることは難しいだろう。画像の深さは、目的の作動距離によって部分的に決定されます。
5. 脱水と組織のクリア
注:このセクションでは、胚はメタノールシリーズを使用して脱水され、有機溶媒BABBでクリアされ、ゴムスペーサーで区切られた2つのカバーリップの間に取り付けられます。このプロトコルでは、高速ウェルゴムスペーサーが使用されています。ファストウェルバンパーは両面接着面を持っています。スペーサーは、胚が配置され、2つのカバーリップの間に保持される井戸を作成するために必要です。
-
メタノール脱水
- 新しい2 mLチューブにラベルを付け、胚ごとに1つ。チューブあたり25%のMeOHの1 mLを追加します。
- きれいなメスを使用して、胚の周りにアガロースを穏やかに切断し、鉗子で拾うことができるように胚の周りに十分に残します。細かい鉗子を使用して、埋め込み胚でアガロースを優しくつかみ、25%のMeOHでラベル付けされたチューブに入れてください。鉗子が胚に触れないようにしてください。
- 暗闇の中で1時間穏やかな攪拌でRTで胚をインキュベートする。
- 胚に触れないように注意して、チューブから25%のMeOHを取り除きます。チューブあたり50%のMeOHの1 mLを加えます。暗闇の中で1時間穏やかな攪拌でRTでインキュベート。
- 胚に触れないように注意して、チューブから50%のMeOHを取り除きます。チューブあたり75%のMeOHの1 mLを加えます。暗闇の中で1時間穏やかな攪拌でRTでインキュベート。
- 胚に触れないように注意して、チューブから75%のMeOHを取り除きます。チューブあたり100%のMeOHの1 mLを追加します。暗闇の中で1時間穏やかな攪拌でRTでインキュベート。100%MeOH洗浄を2回繰り返します。
-
BABB でのクリア
- 胚に触れないように注意して、チューブから100%MeOHを取り出します。チューブあたり50%BABBの1 mLを追加します。暗闇の中で1時間穏やかな攪拌でRTでインキュベート。
- 胚に触れないように注意して、チューブから50%のBABBを取り除きます。チューブあたり100%BABBの1 mLを追加します。暗闇の中で1時間穏やかな攪拌でRTでインキュベート。100%BABB洗浄を2回繰り返します。
注:(任意停止点)胚は約1週間チューブ内の100%BABBに残ることができます。長いストレージは、チューブのプラスチックを溶解するBABBを引き起こします。
-
イメージング用の胚の取り付け
- 24 mm x 60 mm #1.5 ガラスカバースリップに、片方の側面からプラスチック接着剤を剥がして、Fast Well バンパーを置きます。ゴム製のバンパーの上にプラスチック接着剤に優しい圧力をかけることで、カバースリップとバンパーの間に気泡がないことを確認してください。胚数、遺伝子型、および染色に使用される抗体に従ってカバースリップにラベルを付けます。
注:任意のスペーサーは、それが破砕または押しつぶし胚を防ぐのに十分な厚さである限り、カバーリップの間に配置することができます。私たちは、カバースリップにそれを固定するためのスペーサーの両側に接着面を含むその厚さと利便性のためにFast Wellスペーサーを使用しています。 - 慎重にパイプアウトし、チューブから100%BABBを捨てます。チューブ内のアガロース埋め込み胚を視覚化した後、細かい鉗子を使用してアガロースを拾い、慎重にファストウェル内のカバースリップに胚を移す - 鉗子が胚に触れないようにしてください。
- バンパーから2番目のプラスチック接着剤を取り外し、2番目のカバースリップを上に置きます。カバースリップを軽く押して気泡を取り除きます。ガラスを割らないように注意してください。
注:サンプルは、シールがきつい場合、RTで暗闇の中でスライドホルダーに平らに保管することができます。
- 24 mm x 60 mm #1.5 ガラスカバースリップに、片方の側面からプラスチック接着剤を剥がして、Fast Well バンパーを置きます。ゴム製のバンパーの上にプラスチック接着剤に優しい圧力をかけることで、カバースリップとバンパーの間に気泡がないことを確認してください。胚数、遺伝子型、および染色に使用される抗体に従ってカバースリップにラベルを付けます。
6. データの取得
注:以下の手順では、咽頭のアーチ3、4、および6の内皮は共焦点顕微鏡を使用して画像化されます。
-
顕微鏡ステージ上でのスライドの位置決め
- 胚を画像化するには、20倍の水浸し目的、開口0.95、作動距離0.95mm、NIS-Elements AR 5.11.01 64ビットソフトウェアを搭載した共焦点顕微鏡を使用します。
- 広視野蛍光を用いて、咽頭アーチを視覚的に見つける。フィールド ビューを 4 番目の PAA の中心に配置します。
- 目的の視野が咽頭アーチ領域全体を捉えていない場合は、1%の重なりのある大きなパネルを撮ってステッチします。大きな画像の取得中にサンプルの動きを防ぐには、成形粘土を使用してステージにカバースリップアセンブリを静かに固定します。
-
取得パラメータの設定
- ピンホールのサイズを 1.0 に設定します。
- [ND 取得] タブで、粗い調整を使用してイメージングの上下の制限を設定します。ソフトウェア仕様に従ってZステップサイズを設定します。目的の作業距離とサンプルの透明度によってイメージできる厚さを決定します。
- 胚の厚さのために、Zスタック全体のゲインを調整します。各チャンネル(405、488、および555)のZスタックの中央にレーザー強度とゲインを設定し、[Z強度補正]タブで値を割り当てます。
- 蛍光シグナルが薄暗く見えるまで胚をスクロールします。信号強度が前のセグメントと同様に表示されるまで、各チャンネルのゲインを上げます。[Z 強度補正]タブで新しい値を割り当てます。ND 取得に設定をインポートします。
- 実行 Z補正オプションを使用してスキャンを実行します。
7. Imaris ソフトウェアを使用した分析
注: これらの手順では、共焦点画像は、顕微鏡画像解析ソフトウェア、Imaris バージョン 9.2.0 を使用して分析されます。この解析では、まずサーフェスを作成して解析対象の領域を選択します。次に、これらの領域を視覚的に分離するために、マスク関数を使用します。最後に、スポット関数を使用して、対象領域内の各 IC の数を定量化します。
- 手順 6 で使用したイメージング ソフトウェアに応じて、Imaris ファイル コンバーターを使用してイメージを .ims に変換します。
- ims ファイルを開きます。[カメラ/ラベル]の下で画像を直交に設定する |カメラタイプパネル。
- PAA を見つけ、イメージの向きを変えて表示します。
注: ファイルを最初に開くと、イメージ化されたすべてのスライスを 3D コンパイルとして表示されます。このステップでは、PAA を 2D 画像にして配置します。2D 画像を使用すると、PAA を解析に適した方向に設定できます。- [プロパティ]パネルで、[音量] をオフにします。[プロパティ] パネルで、[新しいオルソ スライサーの追加]をクリックします。スライスの方向をXY 平面に設定します。スライス位置を使用して、PAA が見つかるまで画像をスクロールします。
- PAA がイメージの上下に平行でない場合は、マウス カーソルを使用して画像を自由に回転させ、PAA が画面を左から右に表示されるようにします。[イメージ処理] ドロップダウン メニューの [自由回転] を選択し、[OK]をクリックします。
- 3番目の咽頭アーチの表面化(図2A、B -B")
注: これらの手順では、咽頭のアーチと PAA はSurfaceツールを使用してトレースされ、対象の「サーフェス」領域が生成されます。これにより、関心のある各領域を周囲の組織から視覚的に分離することができます。ここでは、第3咽頭弓の内皮成分を表面化および解析するステップについて説明する。咽頭アーチ4と6は同様に解析される。- 3番目の咽頭アーチ全体で内皮を表面化するには、[プロパティ]パネルの下にある[新しいサーフェスの追加] ボタンをクリックします。サーフェス 1をダブルクリックして、新しいサーフェスの名前を「第3 咽頭アーチ」に変更します。
- [自動作成をスキップして手動で編集する] を選択します。[サーフェスの方向]を YZ 平面(コロナ方向)に設定します。スライス位置を使用して、3番目の PAA とドーサル大オルタが接続する場所に 3番目の咽頭アーチ面面を配置します。
- 3番目の咽頭アーチ面が見えるようにイメージを回転させます。オルソ スライサー 1 をオフにします。
- アンダー・ザ・ドロー |輪郭 |モードタブで、距離描画モード機能を選択します。必要に応じてパラメータ設定を調整します。サンプル間で一貫したサーフェス表示パラメータを維持します。この例では、頂点の間隔は 10 μm です。
- 画面表示を開始するには、Esc キーを押してから[描画]ボタンをクリックします。マウスカーソルで第3咽頭アーチの周囲をトレースします。スライス位置を使用して、10~25枚のスライスを移動します。咽頭のアーチの周囲をトレースします。咽頭のアーチが完全にトレースされるまで繰り返します。
- トレース領域のサーフェスを生成するには、[プロパティ]パネルで[サーフェスを作成]ボタンを選択します。
- 3 rd PAA のサーフェーシング(図 2C- C")
- 3rd PAAの内皮を表面化rdするには、まずステップ7.4から表面領域をオフにし、第3回咽頭アーチ面ボックスの選択を解除する。次に、[新しいサーフェスを追加]ボタンを再度クリックします。サーフェス 1をダブルクリックし、新しいサーフェスの名前を「3rd PAA」に変更します。
- [自動作成をスキップして手動で編集する] を選択します。[サーフェスの方向]を YZ 平面(コロナ方向)に設定します。スライス位置を使用して、3番目の PAA およびドーサル大オルタが接続する場所に 3番目の PAA サーフェスプレーンを配置してから、手順 7.4 を繰り返します。
- 表面構造のマスキング
注: 次の手順では、対象となる各サーフェス領域がマスクされます。マスキングは、関心のある領域が画像化された組織の残りの部分と視覚的に区別されることを可能にし、関心のあるこれらの異なる構造の定量化を可能にする。以下では、PAA内皮を視覚化して分析するイマリスのステップと、咽頭のアーチ内のPAAを取り巻く小さな血管系である神経叢について説明します。これらのステップでは、セクション7.7で説明されているスポット関数を使用してPAA上でのみ可視化および解析を実行するために、3番目のPAA表面がマスクされます。- すべてのマスクされたチャネルを視覚化するには、[ボリューム]を選択します。Escキーを押して画像を回転させ、イメージを XY 位置に配置します。
- 編集タブで、3番目の PAA のマスク選択を選択します。DAPI チャネルを選択し、[OK]をクリックします。残りのチャンネルについても同じ手順を繰り返します。
- キーボードで Ctrl + Dキーを押して、[調整の表示] パネルを表示します。新しいチャンネルを選択し、各チャンネルの表示内容を明確にするために名前を変更します。たとえば、これは 3 つの新しいチャネルになります: "3rd PAA DAPI"、"3rd PAA ERG"、および "3rd PAA VEGFR2" 。
注:ステップ7.6.4-7.6.7では、咽頭のアーチ叢のチャンネルのみを作成します。 - PAAとは別に内皮神経叢を可視化するために、まず第3PAA表面にマスク選択を選択します。DAPI チャネルを選択します。[サーフェス外のボクセルを選択]をオフにし、[サーフェス内のボクセルをボタンに選択]をオンにして、[サーフェス内のボクセルを選択]を[ゼロ]に設定します。[OK] をクリックします。
- 残りのチャンネルについても同じ手順を繰り返します。この操作では、新しいマスクされたチャネルから PAA を含むリージョンが除外されます。チャンネル名を変更して、各チャンネルの表示内容を明確にします。たとえば、このチャネルは、"非 PAA DAPI"、"非 PAA ERG"、および "非 PAA VEGFR2" という 3 つの新しいチャネルになります。
- 3番目の咽頭のアーチ内の内皮神経叢を視覚化するには、3番目の咽頭アーチのサーフェスの[編集]タブの下にある[マスク選択]を選択します。非PAA DAPIチャネルを選択します。[OK] をクリックします。
- 残りの非PAAチャンネルについても同じ手順を繰り返します。チャンネル名を変更して、各チャンネルの表示内容を明確にします。たとえば、これは 3 つの新しいチャネルになります: "プレクサス DAPI"、"プレクサス ERG"、および "プレクサス VEGFR2" 。
- EC 番号の定量化
注: ERG の発現は、内皮核を示すため、EC 番号の定量化が便利です。これらのステップでは、スポット関数を使用して EC の数を定量化し、PAA およびプレクサスの ERG 式でマークされた EC ごとにスポットを生成します。セクション7.7では、マスクされたPAAの各ERG陽性細胞に対してスポットが生成され、続いてERG陽性、VEGFR2陰性細胞のスポットの選択解除が行われる。- キーボードで Ctrl + Dキーを押して、[調整の表示] パネルを表示します。PAA ERG を除くすべてのチャネルをオフにします。
- プロパティタブで、[新しいスポットを追加]ボタンをクリックします。スポット1をクリックし、「PAA の合計数」に変更します。青い矢印ボタンをクリックします。[送信元チャネル] で PAA ERG チャネルを選択します。推定XY直径を4μmに調整します。青い矢印ボタンをクリックして次のパネルに進みます。
- スライドスケールを用いて見られるスポットの数を調整し、各EC核(ERG発現でマーク)が1つのスポットで表されることを確認する。緑色の二重矢印ボタンをクリックします。
- ディスプレイ調整で PAA ERG チャネルをオフにします。PAA VEGFR2チャネルをオンにして、PAA内皮を可視化します。
- ECの数を正確に定量化するため、各スポットがECマーカーERGとVEGFR2の両方を表現していることを確認します。これを行うには、[編集]タブの[オブジェクトのサーフェス]を選択します。パネルの追加/削除。Escキーを押して、シフトを押したままスポットを選択して、VEGFR2 陽性でないスポットを削除します。
注:次のステップでは、マスクされた神経叢の各ERG陽性細胞に対してスポットが生成され、その後ERG陽性、VEGFR2陰性細胞のスポットの選択解除が続きます。 - プロパティタブで、[新しいスポットを追加]ボタンをクリックします。スポット 1を選択し、「プレックスの合計 IC」に名前を変更します。青い矢印ボタンをクリックします。[送信元チャネル] で、プレクサス ERG チャネルを選択します。推定XY直径を4μmに調整します。手順 7.7.1 ~ 7.7.5 を繰り返して、Plexus の合計 EC の数を確認します。
- 各スポット関数の[統計]タブをクリックして、第3PAAおよび咽頭アーチ神経叢のICの総数を決定します。
- 残りのPAAと咽頭弓叢について、手順7.7.1~7.7.6を繰り返します。
結果
ここで示した全実装免疫蛍光プロトコルは、明確でクリーンな結果を生じ、図1Aに見られるように咽頭アーチ内皮の3D再構成を可能にする。各抗体溶液中で十分な時間、胚をインキュベートして、サンプルを通して完全に浸透し、また、抗体インキュベーション後の胚を十分に洗浄することが重要です。図1BBでは、抗体またはブロッキング緩衝液のいずれかで粒子状の結果として大きく、明るいドットが現れます。我々は、各抗体インキュベーションがこの問題を解決した後、使用前に各溶液を遠心分離し、PBSTを長時間に及ぶ。
図2は、プロトコルのセクション7に記載されているように、分析のために咽頭アーチとPAAを表面化するために使用されるプロセスを示す。マスクされた機能を使用して、Imarisソフトウェアは、表面化された領域を視覚的に分離し、独立して分析することを可能にする。
図3は、咽頭アーチ内の異なる血管区画の個々のマスキングを示しています:PAA(図3A、B、C)および叢(図3A'、B'、C')。マスキングにより、各構造のEC番号を個別に分析および定量化することができます。図 3C-C' では、スポット機能を使用して、ERG を発現する各核に単一のスポットを割り当てることにより、PAA とプレクサスの両方の EC の総数を定量化します。スポット関数に使用されるアルゴリズムは、指定されたサイズのピクセルに対してドットを生成するように設計されています。EC核のマーカーとしてここで使用されるERGは、神経堤細胞8でも発現している。神経堤細胞はVEGFR2を発現しません。図3DDは、イマリススポット関数によって生成されたERG陽性(緑色)、VEGFR2陰性(ピンク)スポットの例を示す。そのため、各ドットが 1 つの EC を表し、ERG と VEGFR2 の両方でラベル付けされていることを確認することが不可欠です。
| ステップ | 時間 | 温度 | |
| 1 | PBST洗浄/パーメアビライゼーション | 24時間またはO/N | 4°C |
| 2 | ブロッキング バッファ | 25時間またはO/N | 4°C |
| 3 | 一次抗体 | 4~5日 | 4°C |
| 4 | PBSTウォッシュ | 1日4~5回(2日間) | RT (O/N の場合は 4 °C) |
| 5 | 二次抗体 | 4~5日 | 4°C |
| 6 | PBSTウォッシュ | 1日4~5回(2日間) | RT (O/N の場合は 4 °C) |
| 7 | 埋め込み | N/a | Rt |
| 8 | メタノール脱水とBABB | ステップあたり1時間 | Rt |
表1:全型免疫蛍光プロトコルの概要O/N - 一晩。RT - 室温。
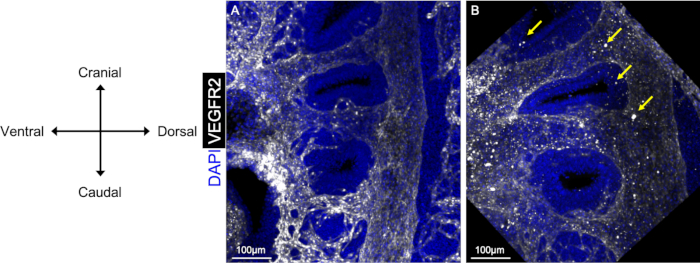
図1:全実装免疫蛍光に続く清潔な画像と汚れた画像の比較E10.5胚の矢状の図は、PAA内皮を可視化する抗VEGFR2抗体(白)の使用を示す。PBSTポスト抗体インキュベーション(A)で十分に洗浄された胚は、より高いシグナル対雑音比を有し、完全に洗浄されていない胚と比較して、よりクリーンな画像を生成する(B)。Bの矢印は、胚が十分に洗浄されていないか、抗体溶液が遠心分離されていないときに画像に現れたノイズ/汚れの領域を示しています。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:咽頭アーチ(PA)およびPAAの表面化。2D矢状ビュー(A)は、共焦点像内のPAAの位置を識別するために使用される。PAA を介してコロナオルソ スライサー (A, 黄色の線) が配置されます。水門アーチ(B)とPAA(C)は、イマリスの距離描画ツールを使用してコロナ方向に表面化されます。距離描画ツールは、10 μm に設定され、3番目の咽頭アーチ(B)または PAA (C) の周囲をトレースするために使用されます。アウトラインは、アーチ全体(B',C')を通して10〜25スライスごとに描かれます。アウトラインは、咽頭弓の3D面を生成するために結合されます ( B") または PAA (C") 。この図の大きなバージョンを表示するには、ここをクリックしてください。
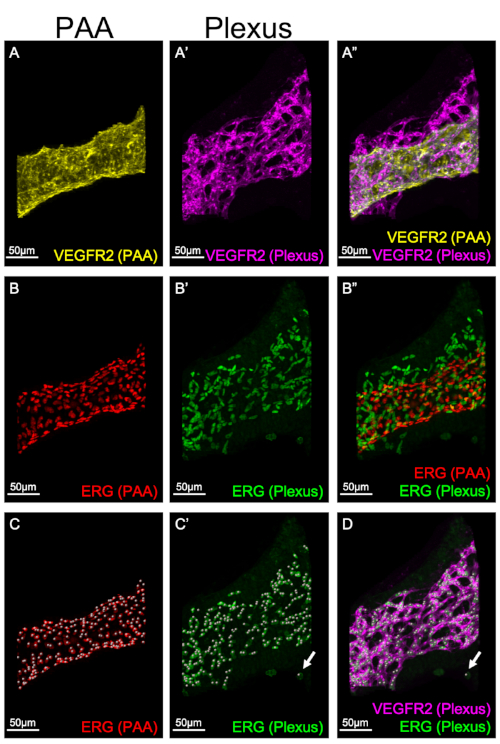
図3:PAAおよび神経叢におけるEC番号の定量化3D再構成は、PAAまたはECプレクサス内のECマーカーの血管構造と発現を別々に可視化するために使用されます。パネルA-A'は、PAA(A,黄色)および神経叢(A',ピンク)におけるVEGFR2の発現を示す。A, yellowパネルA"はPAAとプレキサスVEGFR2式の結合を示す。パネルB-B'は、PAA(B、赤)および神経叢(B',緑色)におけるERGの発現を示す。パネルB"はPAAと神経叢の結合を示す。C-C'.イマリスのスポット関数は、PAA またはプレクサスの IC の数を定量化するために使用されます。PAA(C,赤)または叢(C',緑色)の各ERG陽性セルには、単一のECをマークする単一のスポットが割り当てられます。C'-Dの矢印は、イマリススポット関数によって生成されたプレクサスにおけるERG陽性、VEGFR2陰性スポットの例を示しています。このスポットは定量化から除外されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
3Dでマウス胚の内皮を可視化する能力は、その発達に新たな洞察を提供しました 3.ここでは、胚の高解像度3Dイメージング、血管接続の可視化、およびPAA形成の定量的分析を可能にするプロトコルを提示する。このプロトコルは、遺伝的変化または環境侮辱がPAAの発達にどのような影響を与えるかを確認するために使用することができます。ここで報告された手順は、VEGFR2およびERGに対する抗体を使用してPAA形成を可視化し、EC数を定量化する。しかし、追加の抗体を使用して、神経堤の配置や平滑筋細胞分化など、アーチ動脈の発達の他の側面を視覚化し、分析することができます。この手順が胚発生の初期段階で使用される場合、このプロトコルで検出された一部の抗原(例えば、ERG)がまだ発現していない可能性があることに注意することが重要である。DAPIやDRAQ5などの他の核染色や、核タグ付きトレーサを用いた系統標識を使用して、EC番号を定量化することができます。
プロトコルには、1)胚が溶液の変化の間に乾燥しないようにするためのいくつかの重要なステップがあります。2)胚は抗体インキュベーション後に完全に洗浄される。そして3)胚がBABBで組織をクリアする前にMeOHで完全に脱水される。
組織をクリアする前にメタノールを用いたメタノールは、胚における蛍光タンパク質の発現(例えば、系統トレースに使用されるEGFPまたはtdTomatoの発現)による蛍光を排除すること、および組織を脱水する2つの目的を果たす。蛍光タンパク質からの蛍光の除去は、イメージングのための蛍光性の任意の組み合わせを使用することを可能にする。EGFPおよびTdTomato(チェリー)に対する抗体は、これらの蛍光タンパク質の発現を可視化するために使用することができる。あるいは、MeOHは、蛍光タンパク質9の蛍光を維持するためにテトラヒドロフランに置き換えることができる。
BABBのクリアリング前に適切に脱水されていない胚は、光散乱のために画像化が困難であることがわかりました。BABBは、不透明な組織をクリアするために有機溶媒中の完全な脱水を必要とする疎水性溶液である。完全なクリアリングは胚10、11の中で可能な最も深いレベルで画像を得る能力を11保障する。このプロトコルでは、実験時の長い作業距離と可用性のために、20倍の水浸漬目的を使用しました。BABBとオイルは水やBABBよりも近い屈折率を持つため、油浸漬目的はこのプロトコルに適しています。しかし、屈折率の差にもかかわらず、このプロトコルで使用される水浸漬目的は優れた画質を提供した。
このプロトコルには、いくつかの制限があります。ここで利用されているBABBの清算は毒性および腐食性1111、12、1312,13である。BABBは接着剤とプラスチックを溶解します。イメージング中にサンプルが適切に処理されない場合、顕微鏡対物レンズは、カバースリップの亀裂やFast Wellバンパーとカバースリップの間の破損したシールを介してサンプルから脱出する可能性のあるBABBによって損傷を受ける可能性があります。CLARITYなどの有機溶剤を使用しないクリア方法は、代替として使用することができます10,,11,,14.CLARITYの屈折率マッチング溶液は水と同様の屈折率を有し、水浸漬目的を使用する場合は適切なクリア法となる。このプロトコルの追加の制限は、それが生きている組織にしか実行できないため、ライブイメージングへの応用を妨げるという点です。
開示事項
著者らは開示するものは何もない。
謝辞
この原稿を丁寧に読んで編集してくれたブリアナ・アレクサンダー、カオラン・オドネル、マイケル・ワルカラに感謝します。この研究は、NIH R01 HL103920、R01 HL134935、R21 OD025323-01からSAへの国立心臓、肺および血液研究所からの資金提供によって支えられた。AJRは、NHLBI HL103920-08S1および国立関節炎・筋骨格・皮膚疾患研究所トレーニング助成金T32052283-11によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 10x PBS | MP Biomedicals | PBS10X02 | |
| 20x water immersion objective | Nikon | MRD77200 | |
| Agarose | Bio-Rad Laboratories | 1613101 | |
| Alexa Fluor 488 anti-goat | Invitrogen | A-11055 | |
| Alexa Fluor 555 anti-mouse | Invitrogen | A-31570 | |
| Analysis Software | Imaris 9.2.0 | ||
| Benzyl Alcohol | Sigma-Aldrich | 305197 | |
| Benzyl Benzoate | Sigma-Aldrich | 8.18701.0100 | |
| Cover Slips | VWR | 16004-312 | |
| DAPI (5 mg/mL stock) | Fisher Scientific | D3571 | |
| Eppendorf Tubes (2.0 mL) | Fisher Scientific | 05-408-138 | |
| Ethanol | VWR | 89370-084 | |
| Falcon tubes (50 mL) | Corning | 352098 | |
| Fast wells | Grace Bio Labs | 664113 | |
| Forceps | Roboz | RS-5015 | |
| Goat anti-VEGFR2 | R&D Systems, Inc. | AF644 | |
| Methanol | VWR | BDH1135-4LP | |
| Microscope | Nikon | A1HD25 | |
| Mouse anti-ERG | Abcam | ab214341 | |
| Normal Donkey Serum | Sigma-Aldrich | D9663 | |
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| Pasteur pipets | Fisher Scientific | 13-678-20D | |
| Petri dishes (35 mm) | Genesee Scientific | 32-103 | |
| Petri dishes (60 mm) | Genesee Scientific | 32-105 | |
| Plastic Molds | VWR | 18000-128 | |
| Scapels | Exelint International Co. | 29552 | |
| Triton-X-100 | Fisher Scientific | BP 151-500 |
参考文献
- Hiruma, T., Nakajima, Y., Nakamura, H. Development of pharyngeal arch arteries in early mouse embryo. Journal of Anatomy. 201 (1), 15-29 (2002).
- Hutson, M. R., Kirby, M. L. Model systems for the study of heart development and disease Cardiac neural crest and conotruncal malformations. Seminars in Cell & Developmental Biology. 18 (1), 101-110 (2007).
- Wang, X., et al. Endothelium in the pharyngeal arches 3, 4 and 6 is derived from the second heart field. Developmental Biology. 421 (2), 108-117 (2017).
- Jerome, L. A., Papaioannou, V. E. DiGeorge syndrome phenotype in mice mutant for the T-box gene, Tbx1. Nature Genetics. 27 (3), 286-291 (2001).
- Lindsay, E. A., et al. Tbx1 haploinsufficieny in the DiGeorge syndrome region causes aortic arch defects in mice. Nature. 410 (6824), 97-101 (2001).
- Weninger, W., et al. Visualising the Cardiovascular System of Embryos of Biomedical Model Organisms with High Resolution Episcopic Microscopy (HREM). Journal of Cardiovascular Development and Disease. 5 (4), 58 (2018).
- Phillips, H. M., et al. Pax9 is required for cardiovascular development and interacts with Tbx1 in the pharyngeal endoderm to control 4th pharyngeal arch artery morphogenesis. Development. 146 (18), (2019).
- Vlaeminck-Guillem, V., et al. The Ets family member Erg gene is expressed in mesodermal tissues and neural crests at fundamental steps during mouse embryogenesis. Mechanisms of Development. 91 (1-2), 331-335 (2000).
- Ertürk, A., et al. Three-dimensional imaging of the unsectioned adult spinal cord to assess axon regeneration and glial responses after injury. Nature Medicine. 18 (1), 166-217 (2012).
- Azaripour, A., et al. A survey of clearing techniques for 3D imaging of tissues with special reference to connective tissue. Progress in Histochemistry and Cytochemistry. 51 (2), 9-23 (2016).
- Richardson, D. S., Lichtman, J. W. Clarifying Tissue Clearing. Cell. 162 (2), 246-257 (2015).
- Becker, K., Jährling, N., Saghafi, S., Weiler, R., Dodt, H. U. Chemical Clearing and Dehydration of GFP Expressing Mouse Brains. PLoS One. 7 (3), e33916 (2012).
- Ertürk, A., et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nature Protocols. 7 (11), 1983-1995 (2012).
- Kuwajima, T., et al. ClearT: a detergent- and solvent-free clearing method for neuronal and non-neuronal tissue. Development. 140 (6), 1364-1368 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved