Method Article
생체 외에서 인간 호중구 떼의 화학 및 분자 분석을 위한 생체 입자 미세어레이
요약
이 프로토콜은 공간적으로 제어된 호중구 무리를 제공하는 생체 입자 마이크로어레이를 생성합니다. 그것은 호중구가 마이그레이션 하는 동안 해제 하는 중재자에 쉽게 액세스를 제공 하 고 정량적 이미징 분석을 허용 합니다.
초록
호중구 떼는 호중구가 감염 부위를 봉인하고 조직 재구성을 촉진하는 협력 과정입니다. 떼는 세포 이동의 특징적인 패턴을 보여주는 동물 모델에서 생체 내에서 고전적으로 연구되었습니다. 그러나 생체 내 모델에는 접근 및 분석이 어려운 세포간 중재자뿐만 아니라 인간 호중구를 직접 분석할 수 없는 등 여러 가지 한계가 있습니다. 이러한 제한 때문에, 인간 호중구로 떼지어 연구하고 떼지어 다니는 동안 생성되는 분자 신호에 쉽게 접근할 수 있는 시험관 내 플랫폼이 필요합니다. 여기서, 다단계 마이크로스탬핑 공정은 생체 내 감염을 모방하여 떼지어를 자극하는 생체 입자 마이크로어레이를 생성하는 데 사용된다. 생체 입자 마이크로 어레이는 호중구가 제어되고 안정적인 방식으로 무리를 유도합니다. 마이크로어레이에서 호중구는 속도가 증가하고 생물입자 클러스터 주변에 안정된 무리를 형성합니다. 추가적으로, 호중구에 의해 생성된 상온제는 분석되고 16개의 단백질은 무리의 과정을 통해 분별적으로 표현된 것으로 밝혀졌습니다. 이 시험관 내 무리 플랫폼은 재생 가능한 공간 제어 방식으로 호중구 이동 및 단백질 방출에 대한 직접적인 분석을 용이하게 합니다.
서문
혈류에서가장 풍부한 백혈구인 호중구는 1,3,2,3, 구획4,패혈증3,외상5,6,암1,7,8,각종 자가면역 질환5,9등 다양한 의료 조건에 관여할 수 있기 때문에 잠재적 진단 및 치료 표적으로 주목받고 있다. 호중구 떼는 연구5,10,11의특히 흥미로운 초점을 만드는 복잡성과다단계,엄격하게 규제 과정입니다. 무리 동안 호중구는 주변의 건강한 조직으로부터 염증 부위를분리5,10,11. 호중구 무리의 적절한 조절은 상처 치유와 궁극적으로 염증 해결을 촉진하는 데 필수적이다5,12. 호중구 떼는 주로 설치류12,13,14,15 및 제브라피시10,11,12,15 모델에서 생체 내에서 연구되었다. 그러나, 이러한 생체 내 동물 모델의 특성상 한계를 야기한다5. 예를 들어, 무리 동안 호중구에 의해 방출 된 중재자는 분석5에쉽게 접근 할 수 없습니다. 추가적으로, 생체 내에서 주어진 중재자에 대한 많은 잠재적인 공급원이 존재하므로 생체 내 실험은 주어진 프로세스에서 그 중재자의 역할을 조사하기 위해 세포 생산 및/또는 상호작용을 억제하는 유전적 결핍을 도입해야 한다13. 시험관 내 실험은 추가 세포의 맥락없이 호중구 관찰을 가능하게하여이 합병증을 우회. 추가적으로, 인간 호중구 조정한 이주를 기술하는 연구는16. 생체 외에서 무리 플랫폼에서, 인간의 호중구는 직접 분석 할 수 있습니다. 생체 외에서 떼지어 플랫폼은 생체 내 연구의 한계에 의해 남겨진 격차를 채울 수있는 기회를 제공함으로써 생체 내 연구에서 얻은 지식을 확장 할 수 있습니다.
생체 내 호중구 떼를 모방하는 체외 플랫폼의 필요성을 해결하기 위해, 우리는 공간적으로 제어 된 방식으로 호중구 떼를 자극하는 바이오 입자 마이크로 어레이를 패턴화 할 수있는 마이크로 스탬핑 플랫폼을 개발했습니다. 우리는 2 단계 공정에서 유리 슬라이드에 생체 입자 마이크로 어레이를 생성합니다. 첫째, 마이크로스탬핑을 사용하여 양이온폴리전해질(CP) 반점의 마이크로어레이를 생성합니다. 둘째, 정전기 상호 작용을 통해 CP 반점에 부착되는 바이오 입자 용액을 추가합니다. 먼저 CP 층을 패터닝함으로써, 우리는 원하는 호중구 군집 패턴을 생성하기 위해 음전하 바이오 입자를 선택적으로 패턴화 할 수 있습니다. 양전하층은 CP가 없는 유리 슬라이드의 영역에서 바이오입자를 제거하는 활발한 세척 단계를 통해 음전하된 바이오입자를 보유합니다. 그것은 유리 슬라이드에 미론 크기의 바이오 입자를 고정시키는 매우 높은 표면 전하를 가지며, 따라서 유리 슬라이드의 패턴 위치에서 입자를 제거하는 호중구를 억제합니다. 이로 인해 마이크로어레이로 배열된 생체 입자 클러스터가 생성됩니다. 우리가 마이크로어레이에 호중구를 추가했을 때, 그들은 생물입자 클러스터 주위에 안정된 무리를 형성했습니다. 호중구 이동추적을 통해, 우리는 호중구떼가 생체입자 클러스터로 적극적으로 이동한다는 것을 발견했습니다. 또한, 우리는 호중구가 떼지어 다니는 동안 방출되는 특정 중재자를 분석하기 위해이 플랫폼을 사용했습니다. 우리는 무리를 지어 다니는 동안 차별화된 16개의 중재자를 발견했습니다. 그들의 농도 는 시간이 지남에 따라 세 가지 일반적인 추세를 따릅니다: 증가, 감소, 또는 스파이크. 우리의 체외 호중구 떼 플랫폼은 공간적으로 제어 된 인간 호중구 무리의 분석뿐만 아니라 호중구 무리에 의해 발표 된 중재자의 수집 및 분석을 용이하게합니다. 이전 간행물에서, 우리는 특정 건강 상태 (외상, 자기 면역 질병 및 패혈증)를 가진 환자가 건강한 기증자에서 그것과 다르게 작동하는 호중구가 있었다는 것을 보여주었습니다5. 향후 연구 연구에서, 우리의 플랫폼은 다양한 환자 집단 사이에서 호중구 기능을 분석하는 데 사용될 수 있습니다. 이 플랫폼은 호중구 무리에 관련된 복잡한 조정을 정량적으로 분석할 수 있다. 추가 연구는 관심있는 병원체에 대한 특정 환자 집단 또는 호중구 반응의 호중구 기능에 대한 통찰력을 제공하기 위해 수행 될 수있다.
프로토콜
저자는 친절하게 자신의 혈액을 기증 건강한 자원 봉사자를 인정합니다. 혈액 표본은 오하이오 주립 대학에 있는 생물 의학 과학 위원회에 의해 검토된 기관 검토 위원회 (IRB) 프로토콜 #2018H0268 에 따라 통보된 자원봉사자 동의 후에 장악되었습니다.
1. 생체 입자 마이크로 어레이의 미세 가공
- 표준 포토리소그래피 절차를 사용하여 마스터 실리콘 웨이퍼를 생성합니다.
- CAD(컴퓨터 지원 설계) 소프트웨어를 사용하여 원하는 설계 증명을 생성한 다음 포토마스크 제조업체로 보내 크롬 포토마스크를 생성합니다. 여기에 사용된 설계는 150 μm 센터-센터 간격으로 원형으로 채워진 직경 30μm의 4mm x 4mm 직사각형 어레이입니다. 이 디자인은 다른 응용 프로그램에 대해 원하는대로 수정할 수 있습니다.
- 실리콘 웨이퍼에 음의 포토레지스트의 40 μm 두께의 층을 스핀 코팅합니다. 웨이퍼를 65°C에서 5분, 95°C에서 10분간 굽습니다.
- 웨이퍼를 150-160mJ/cm2(그림1A)로크롬 포토마스크를 통해 UV 광에 노출시다.
- 웨이퍼를 65°C에서 5분, 95°C에서 10분간 굽고, 포토레지스트 개발자에게 웨이퍼를 10분 간 담그고 이소프로필 알코올로 헹굽습니다. 이 단계에서 패턴은 웨이퍼에 표시되어야합니다(그림 1B).
- 폴리디메틸실록산 전합체와 그 경화제(즉, 프리폴리머 20 g 및 경화제 2g)의 10:1 비율을 철저히 혼합하고 페트리 접시에서 마스터 웨이퍼 위에 경화되지 않은 다디메틸실록산(PDMS) 혼합물을 부어 낸다(그림1C).
- 마스터 웨이퍼 위에 기포가 없을 때까지 경화되지 않은 PDMS 혼합물을 진공 처리합니다. 밤새 65°C에서 경화합니다.
- 메스를 사용하여 웨이퍼의 패턴 섹션의 외부를 절단하고 경화 된 PDMS 슬래브를 천천히 제거합니다. 패턴면이 위를 향하고 있는 깨끗한 도마 위에 PDMS 슬래브를 놓습니다(그림1D).
- 8mm 생검펀치(그림 1E)로PDMS 슬래브에서 개별 스탬프를 펀치아웃합니다. 유리 슬라이드 1개에 대해 8개의 스탬프가 필요합니다.
- 각 스탬프를 접착제 테이프에 아래로 향하게 놓아 이물질을 제거합니다.
- 사전에 물에 CP의 1.6 mg/mL 용액을 준비하십시오.
- 적절한 양의 CP 분말을 물에 첨가합니다(예: 0.8 g ~ 500 mL).
- 밤새 실온에서 또는 모든 고체가 물에 용해될 때까지 저어 줍니다. CP 용액은 실온에서 6개월 동안 보관할 수 있습니다.
- 원하는 경우, 플루오레세인 이소티오시아네이트(PLL-FITC)로 라벨이 부착된 폴리-L-리신을 첨가하여 CP 용액을 형광화시한다.
- CP 용액의 약 10 mL. Aliquoted 볼륨에 소량의 PLL-FITC(0.05 mg)를 추가합니다. 양을 변경하여 원하는 대로 형광의 밝기를 조정할 수 있습니다.
- 20초 동안 FITC로 표지된 CP 용액을 소용돌이치거나, 용액이 균일하고 옅은 노란색이 될 때까지. 빛으로부터 보호하고 4°C에서 최대 1개월 동안 보관하십시오.
- 스탬프를 향하게 하면 CP의 1.6 mg/mL 용액으로 각 스탬프를 프라임하여 CP 용액과 스탬프 사이에 기포가 형성되지 않도록합니다(그림 1F).
- 스탬프를 CP 솔루션 레이어로 반전합니다(그림1G).
- 1시간 후에 CP 용액에서 스탬프를 제거합니다.
- 젖은 스탬프를 깨끗한 유리 슬라이드에 6-8x 로 두드려 여분의 액체를 제거합니다.
- 진공 은 1-2 분 동안 우표를 처리합니다.
- 스탬프 배치를 위한 가이드로서 깨끗한 유리 슬라이드 상단에 8개의 웰, 9mm 직경의 이미징 스페이서를 부착합니다. 이 스페이서를 사용하면 각 유리 슬라이드에 8개의 마이크로어레이가 있을 수 있습니다.
- 이미징 스페이서의 각 웰 중앙에 있는 유리 슬라이드에 스탬프를 아래로 향하게 놓습니다(즉, 총 8개의 스탬프사용).
- 각 스탬프 위에 5.6 ±0.1 g의 균형 잡힌 무게를 놓고 스탬핑을 위해 10 분 동안 허용하십시오(그림 1H). 스탬프가 유리 슬라이드에 고르게 눌러지고 CP를 유리 슬라이드로 균등하게 전달하기 위해서는 균형 잡힌 무게가 필요합니다.
- 유리 슬라이드에서 분동 및 스탬프를 제거합니다(그림1I). 1.17단계에서 설명한 바와 같이, 생체 입자를 첨가하기 전에 CP 층이 실온에서 24시간 동안 건조되도록 한다. CP가 FITC로 태그된 경우, 1.17단계(도1M)로진행하기 전에 488 nm에서 형광 현미경으로 이 시점에서 스탬핑의 효과를 확인할 수 있다.
- 이미징 스페이서의 크기로 빈 PDMS 슬래브를 잘라 내고 8mm 생검 펀치를 사용하여 이미징 스페이서의 우물과 일치하는 PDMS에 우물을 만듭니다. 이미징 스페이서(그림1J)를사용하여 유리 슬라이드에 PDMS 슬래브를 부착합니다.
- 바이오 입자 (예를 들어, 대장균 또는 지모산)의 용액을 해동하고 주입 (WFI)을 위해 물에 500 μg / mL로 희석하십시오.
참고: 바이오 입자는 opsonized 할 필요가 없습니다. 호중구 표면 수용체는 이러한 생체 입자19,20,21에대한 분자를 직접 인식합니다. - 유리 슬라이드에 각 PDMS에 100 μL의 생체 입자 용액을 추가하십시오(그림 1K).
- 유리 슬라이드를 30분 동안 흔들어 보입니다.
- 우물을 물로 철저히 헹구십시오. 바이오입자 마이크로어레이는 4°C에서 먼지가 없는 환경에서 최대 3개월 동안 보관할 수 있습니다. 이 시점에서, 패턴은 2.1단계(도1N)로진행하기 전에 594 nm에서 형광 현미경으로 확인되어야 한다.
2. 견본 준비
- K2-EDTA 튜브에서 원하는 기증자로부터 적어도 2 mL의 신선한 혈액을 수집합니다. 호중구의 예상 수율은 1-2 x 106 세포/1 mL 전혈입니다. 화상 진찰 분석은 대략 1.5 x 105 호중구를 요구하고, 상구의 분석은 1 x 106 호중구를 요구합니다. 4 시간 이내에 혈액을 사용하십시오.
- 적혈구 를 1:5 비율로 전혈에 적혈구 응집제를 첨가하여 적혈구(RBC)를 분리한다. 반투명 층(버피 코트)이 RBC 층에서 분리될 때까지 45분 간 기다립니다.
- 버피 코트를 제거하고 인산염 완충 식염수(PBS)로 1 mL 버피 코트: 9 mL PBS를 사용하여 세척합니다.
- 190 x g 및 20 °C에서 5 분 동안 원심 분리기.
- 상급을 흡인하고 5 x 107 세포 / mL에서 펠릿을 다시 일시 중단하십시오.
- 호중구를 분리하기 위해 음의 면역 자기 선택 키트를 사용합니다.
- 항체 칵테일/1 mL 세포 현탁액 50 μL을 추가합니다. 10분 동안 기다립니다.
- 자기 비드/1 mL 셀 서스펜션 100 μL을 추가합니다. 10분 동안 기다립니다.
- 셀 서스펜션을 둥근 바닥 튜브에 추가하고 원통형 자석에 넣습니다. 10분 동안 기다립니다.
- 원심 분리튜브에 상급물을 붓습니다. 최대 10mL의 PBS를 추가합니다. 190 x g 및 20 °C에서 5 분 동안 원심 분리기.
- 흡인 상피. 0.4% 휴먼 세럼 알부민으로 IMDM에 화이트 펠릿을 다시 놓습니다.
- 37°C에서 10분 동안 20 μg/mL Hoechst 33342로 핵을 염색하였다.
- 0.4% 인간 혈청 알부민과 함께 IMDM 5 mL을 추가하여 헹구어 보도록 합니다. 190 x g 및 20 °C에서 5 분 동안 원심 분리기.
- 0.4% 인간 혈청 알부민으로 IMDM에서 7.5 x 105 세포/mL에서 세포를 다시 중단시다.
- 바이오입자 마이크로어레이를 함유하는 PDMS에 세포 현탁액의 100 μL을 추가한다. 셀 서스펜션이 PDMS 상단의 볼록하고 거품이 포함되어 있지 않은지 확인합니다.
- 직경 12mm 커버슬립으로 밀봉합니다. 직경 12mm 커버슬립으로 PDMS의 개구부를 잘 덮습니다. 핀셋으로 커버슬립을 가볍게 눌러 여분의 셀 서스펜션이 우물 가장자리로 빠져나오도록 합니다. 조직을 사용하여 과잉 세포 현탁액을 제거하십시오.
3. 분석 및 이미지 분석 실행
- 37°C, 5%CO2및 90% 상대 습도로 설정된 케이지 인큐베이터가 장착된 현미경으로 라이브 셀 이미징 스테이션에 세포와 함께 미립자 배열을 로드합니다.
- 타임랩스 형광 및 브라이트필드 현미경을 사용하여 405 nm, 594 nm 및 브라이트필드에서 10초마다 10배 배율로 이미지를 기록합니다. 일반적인 실험에서 이미지는 최대 2시간까지 수집됩니다.
- 자동화된 세포 추적 소프트웨어를 사용하여 개별 호중구가 바이오입자 클러스터로 이동하는 것을 추적합니다.
- 스팟 감지 셀 추적 소프트웨어의 자동 회귀 모드를 사용합니다. 스팟 반경을 5 μm(호중구 핵의 대략적인 크기)로 설정합니다. 최소 트랙 길이를 120초로 설정하고 최대 간격 크기를 한 프레임으로 설정합니다.
- 셀 추적 소프트웨어에 의해 생성 된 데이터에서 호중구 위치 및 속도를 포함하는 파일을 추출하십시오. 이러한 파일은 각각 호중구 마이그레이션트랙(그림 2C)과속도 대 시간의 히트 맵을 생성하는 그래프 소프트웨어와 함께 사용할 수 있습니다(그림2D).
- 405 nm 형광 등 이미지를 사용하여 선택한 이미지 분석 소프트웨어에서 시간이 지남에 따라 군단 크기를 추적할 수 있습니다.
- 호중구가 무리를 지어 각 생체 입자 클러스터 주위에 관심 영역(ROI)을 정의합니다. 동일한 크기의 ROI를 유지하여 각 생체 입자 클러스터를 분석합니다.
- 시간이 지남에 따라 각 ROI 내에서 405 nm 이미지의 평균 형광 강도를 분석합니다.
- 0 μm2에서 최대 군단 크기까지 다양한 군단 크기에서 수동 측정을 통해 평균 형광 강도의 교정 곡선을 군단 크기로 생성합니다. 이 보정을 사용하여 시간에 따라 군단 크기를 계산합니다.
4. 상급 수집 및 단백질 검출
- 37°C및 5% CO2에서 37°C및 5%CO2를 함유하는 웰즈에서 호중구를 3시간 동안 배양한다. 원하는 시점에서 샘플을 채취하십시오. 전형적으로, 샘플은 0, 0.5, 1 및 3시간에서 채취됩니다. 단백질 어레이 분석법의 검출 한계를 극복하기 위해, 단일 웰(200 μL)의 상상부부부부량의 전체 부피를 각 시점마다 사용하였다. 각 시점은 삼중항으로 분석되었다.
- 밝은 필드 현미경을 사용하여, 무리가 마이크로 어레이에 형성되어 있는지 확인합니다.
- 200 μL 파이펫으로 상한체를 흡인하고 0.45 μm 원심 분리 필터 튜브에 하중합니다.
- 상급체를 190 x g 및 20°C에서 5분 동안 5분 동안 원심분리하고 여과된 부피를 수집한다.
- 시료를 가공 시간까지 -80°C로 저장한다.
- 다양한 인간 단백질을 검출하여 샘플을 처리하는 마이크로어레이 키트를 사용합니다.
- 키트와 함께 제공되는 별도의 투석 튜브에 각 샘플의 200 μL을 추가합니다.
- 투석 튜브를 PBS의 500 mL 이상을 포함하는 비커에 놓습니다 (pH = 8.0). 4°C에서 3시간 이상 저어줍니다. 비커의 PBS를 변경하고 이 단계를 반복합니다.
- 각 샘플을 깨끗한 원심분리기 튜브와 원심분리기로 9,000 x g에서 5분 동안 옮겨 침전물 제거합니다. 각 상급체를 깨끗한 튜브로 옮김.
- 투석 시료의 총 단백질 1 mg당 키트로부터 36 μL의 1x 라벨링 시약을 180 μL에 첨가하여 각 시료를 바이오티니레이팅한다. 20°C에서 30분간 배양합니다.
- 키트와 함께 제공된 스톱 솔루션 3 μL을 각 샘플 튜브에 추가합니다. 각 샘플을 신선한 투석 튜브로 옮기고 4.6.2-4.6.3 단계를 반복합니다. 이 단계에서, 시료는 진행준비가 될 때까지 -20°C 또는 -80°C에서 보관할 수 있다.
- 키트와 함께 제공되는 유리 슬라이드는 -20°C에서 보관된다. 실온에 오도록 하십시오. 조립된 유리 슬라이드를 실온에서 1-2시간 동안 라미나 흐름 후드에 놓습니다.
- 키트와 함께 제공된 블로킹 버퍼의 400 μL을 조립된 유리 슬라이드의 각 웰에 추가합니다. 실온에서 30분 동안 배양합니다.
- 9,000 x g에서 5분 동안 제조된 샘플을 원심분리하여 침전물 또는 미립자를 제거한다. 블로킹 버퍼로 5x 희석합니다.
- 각 웰에서 차단 버퍼를 제거합니다. 희석된 시료 400 μL을 적절한 우물에 넣습니다. 흔들면서 실온에서 2 시간 동안 배양하십시오.
- 각 우물에서 샘플을 장식합니다. 1x 세척 버퍼의 800 μL로 3x를 흔들면서 실온에서 5 분 동안 키트와 함께 제공했습니다.
- 깨끗한 용기에 조립된 유리 슬라이드를 1x 세척 버퍼 I. 흔들면서 실온에서 각각 5분 동안 2x세척하십시오.
- 각 서브 어레이에 1x Cy3 컨쥬게이드 스트렙타비딘 400 μL을 추가합니다. 플라스틱 접착제 스트립으로 덮습니다. 프로토콜의 나머지 부분에 대해 빛으로부터 보호합니다.
- 흔들면서 실온에서 2 시간 동안 배양하십시오.
- 용액을 데낸트하고 샘플 챔버에서 유리 슬라이드를 분해합니다.
- 키트와 함께 제공되는 30 mL 원심 분리기 튜브에서 유리 슬라이드와 충분한 1x 세척 버퍼 I를 조심스럽게 추가하여 유리 슬라이드를 덮습니다. 흔들면서 실온에서 각각 3x를 10분 간 씻으소서.
- 30 mL 원심 분리기 튜브에서 흔들면서 실온에서 각각 5 분 동안 1 x 세척 버퍼 II로 2 x를 씻으십시오.
- 30 mL의 ddH2O로 유리 슬라이드를 5 분 동안 씻으십시오. 원심 분리관에서 유리 슬라이드를 제거하고 층류 후드에서 20 분 동안 건조시키십시오. 제조된 유리 슬라이드는 스캔준비가 될 때까지 -20°C에서 보관될 수 있다.
- 555 nm의 형광 방출에서 마이크로 어레이 스캐너로 유리 슬라이드를 스캔하십시오.
결과
호중구가 바이오 입자 마이크로 어레이에 추가되면, 생체 입자 클러스터와 접촉하는 호중구가 활성화되어 무리 반응을 시작합니다. 바이오입자 마이크로어레이는 타임랩스 형광 현미경을 사용하여 생체입자 클러스터를 향한 호중구 이동을 추적하는 것으로 검증되었습니다(비디오S1). 개별 호중구 핵의 이동은 생물입자 클러스터로 이동함에 따라 추적됩니다. 호중구가 생체 입자 클러스터에 도달하면 핵이 클러스터의 다른 핵과 겹칩니다. 따라서, 이 방법을 사용하여 클러스터 내의 호중구를 정확하게 추적할 수 없다. 자이모산과 대장균 생체 입자 클러스터는 모두 호중구 무리의 생성을 초래합니다. 결과를 위해 그림 2B는 대장균 입자에 의해 생성된 호중구 군단의 데이터를 사용합니다. 도 3 및 도 2의 다른 패널은 지모산 입자에 의해 생성된 호중구 떼를 사용한다. 얻어진 결과는 호중구가 클러스터에 접촉할 때 바이오입자 클러스터가 호중구 활성화를 자극한다는 것을 입증하였는데, 이는 궁극적으로 30-60분 후에 각 클러스터 주위에 안정된 호중구 무리의 형성으로이어졌다(그림 2A,상단). 대조적으로, 호중구는 생체 입자 클러스터의 부재에서 집단 이동을 나타내지 않았다(그림 2A,하단, 및 비디오 S2). 405 nm에서 염색된 호중구 핵의 형광 강도를 사용하여, 평균 호중구 무리 크기약 30 μm 직경 E. coli 바이오입자 클러스터는 1,490±680 μm2(평균 ±SD, 도 2B,상단)인 것으로 나타났다. 생체 입자 클러스터가 존재하지 않는 특정 영역의 형광 강도는 시간이 지남에 따라 거의 일정했으며, 이는 이 설정에서 집단 이동의부재를확인하였다(그림 2B,하단). 호중구 이동의 트랙은 호중구가 존재할 때 생체 입자 클러스터에 수렴되었음을보여준다(그림 2C,상단). 반대로, 제어시스템(도 2C,하단)에서 수렴이 관찰되지 않았다. 도 2D에도시된 바와 같이, 무리 및 비활성화 호중구의 속도(이동 거리/시간)를 측정하고 속도 분포에서 통계적으로 유의한 차이를 발견하였다(ANOVA, p< 0.0001). 무리 호중구에 대한 평균 속도는 20.6 ± 13.0 μm / min (평균 ± SD)이었고, 대조군 호중구의 평균 속도는 2.0 ± 2.2 μm / min이었다.
추가적으로, 무리 동안 호중구가 방출된 16개의 단백질의 농도를 분석하였다(그림3). 스모밍 공정에서 상이한 시점(t=0, 0.5, 1 및 3h)에서 각 단백질의 정규화된 농도를 계산하였고, 여기서 정규화된 농도는 (C - C분)/ (Cmax – Cmin). 10 단백질은 무리를 통해 농도증가. 이들 단백질은 아딥신, 갈렉틴-3, GROa, IL-6R, MIP-1a, MMP-8, MMP-9, 니도겐-1, TIMP-1, 및 TLR2였다. 두 단백질 (펜트라신 3 및 RANK) 무리를 통해 농도 감소. 나머지 4개의 단백질 (클러스터린, PF4, RANTES 및 Trappin-2)는 떼를 지어 첫 번째 시간 동안 증가했지만 그 후 감소하였다. 즉, 그 단백질의 농도는 떼를 지어 다니는 동안 "스파이크"됩니다. 확인된 16개의 단백질 의, 12개의 단백질은 우리의 이전 간행물5에서확인되었습니다. 아딥신, 갈렉틴-3, 니도겐-1, 펜트라신 3, TIMP-1, 및 TLR2는 군집, IL-6R, MMP-8 및 MMP-9, RANK 및 트랩핀-2가5가아닌 반면, 군집인, IL-6R, MMP-8 및 트랩핀-2는 군수특이적인 것으로 나타났다.

그림 1: 생체 입자 마이크로어레이의 생산. 음의 포토레지스트로 코팅된 실리콘 웨이퍼는 크롬포토마스크(A)를통해 자외선에 노출된다. 실리콘 웨이퍼를 구워 개발한 후 실리콘 웨이퍼 표면에 포토레지스트 패턴이 유지됩니다. 이것은 마스터 웨이퍼(B)입니다. 페트리 접시에서 PDMS 혼합물을 마스터 웨이퍼의 상단에 첨가합니다. PDMS는 PDMS 몰드(C)를 형성하기 위해65°C에서 하룻밤 경화된다. PDMS 몰드는 마스터 웨이퍼로부터 절단되고 생검 펀치는 개별 PDMS스탬프(D)를펀치아웃하는 데 사용된다. PDMS스탬프(E)는CP 용액(F)으로 코팅되어 있습니다. 스탬프는 CP용액(G)의얇은 층상에 반전됩니다. 1시간 동안 CP 용액에서 배양한 후, 스탬프를 유리 슬라이드 상에 블감하여 과도한 CP를 제거합니다. 스탬프를 제거하면 CP 패턴이유지됩니다(I). 프리컷 웰이 있는 PDMS 슬래브는 유리슬라이드(J)에부착됩니다. 이어서, CP패턴(K)에바이오입자 용액이 첨가된다. 음전하의 생체 입자는 정전기 상호 작용을 통해 양전하 다연화에 결합합니다. 과잉 생체 입자 용액은 CP 패턴(L)의상단에 패턴 된 생체 입자를 떠나, 멀리 세척된다. (M)FITC로 표지된 CP 층의 형광 이미지(배율 표율 막대 = 50 μm, 큰 이미지; 배율 막대 = 25 μm, 인세트). (N)텍사스 레드와 공액된 패턴의 자이모산 생체입자의 형광 이미지(스케일 바 = 100 μm, 대형 이미지; 배율 막대 = 50 μm, 인세트). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 생체 입자 클러스터 주위의 호중구 무리 성장. 생체 입자 클러스터의 존재, 호중구는 생물 입자 클러스터를 향해 집단 이동을 겪는다 (아래,제어 호중구). 바이오 입자가 존재하지 않을 때, 호중구는 집단 이동을 수행하지 않습니다. (A)지모산 생체 입자 클러스터가있는 경우 호중구는 30 분 안에 무리를 형성합니다. 생체 입자 클러스터가 없으면 군단이 형성되지 않습니다 (배율 막대 = 50 μm). (B)호중구 떼는 평균 크기로 성장 1,490 ±680 μm2 (평균 ± SD) 약 30 μm 직경 대장균 생물 입자 클러스터. 대조군 호중구는 군단 성장없음에 상응하는 일정한 밀도를 나타낸다(ANOVA, p< 0.0001, n=32 호중구 무리, N=1 공여자, 오차 바 = 표준 편차). (C)무리호중구의 트랙은 지모산 생체입자 클러스터에 수렴되는 반면, 제어 호중구는 수렴 점을 나타내지 않습니다(스케일 바 = 50 μm). (D)지모산 표적을 향해 몰려드는 호중구는 평균 속도가 20.6±13.0 μm/min(평균 ±SD)인 반면, 대조군 호중구는 평균 속도2.0±2.2 μm/min이다. 히트 맵의 각 카운트는 주어진 시점에서 주어진 순간 속도를 가진 호중구를 나타낸다. 이러한 히트 맵은 하나의 실험(n = 1 떼)을 대표합니다. N = 1 기증자; ANOVA, 6,114 = 무리 호중구, 32,116 = 제어 호중구, p < 0.0001). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
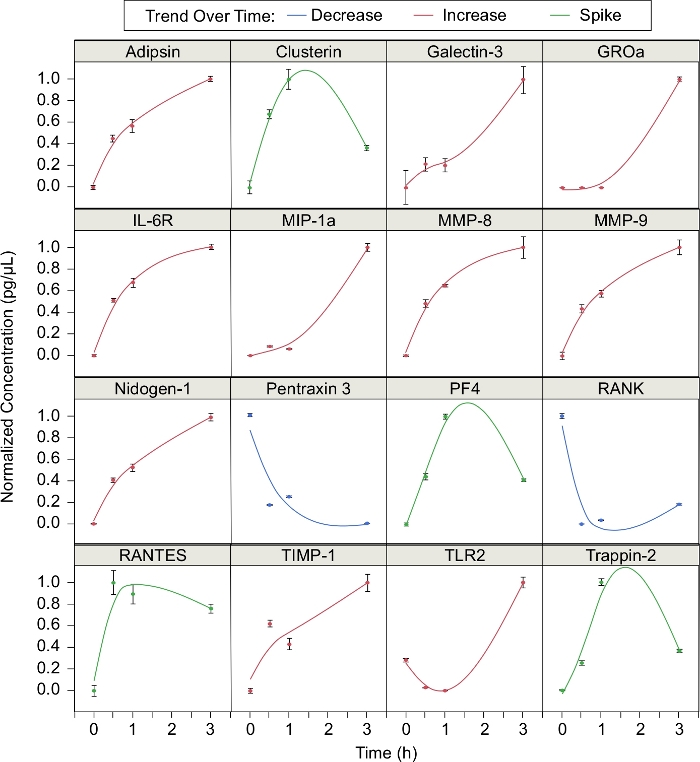
그림 3: 호중구 떼에 의해 방출 된 무료 중재자. 호중구 떼는 시간이 지남에 따라 다양한 단백질의 생산에 영향을 미칩니다. 단백질 농도는 0, 0.5, 1, 및 3시간에서 측정되었다. 데이터 포인트에 스무딩 스플래라인(λ = 0.05)이 장착되었습니다. 이 단백질은 세 가지 특성 동향 중 하나를 따르는 경향이: 시간이 지남에 따라 감소, 시간이 지남에 따라 증가, 또는 주위에 스파이크 1 시간 다음 감소 (오류 막대 = 표준 편차; n = 3 복제; N = 1 기증자). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
비디오 S1: 지모산 생물입자 클러스터를 향해 호중구 떼를 지어보며. 호중구 핵은 파란색으로 표시됩니다. 자이모산 대상은 빨간색 원으로 표시됩니다(배율 막대 = 50 μm, 원래 수집 시간 = 60분). 이 비디오를 다운로드하려면 여기를 클릭하십시오.
비디오 S2: 비활성화 호중구 무작위 마이그레이션. 호중구 핵은 청색으로 도시된다(스케일 바 = 50 μm; 원래 획득 시간 = 60분). 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
우리는 시험관 내 호중구 무리를 자극하기 위해 균일 한 바이오 입자 배열을 생성하는 마이크로 스탬핑 플랫폼을 개발했습니다. 우리의 플랫폼의 체외 특성은 우리가 생체 내 무리 실험으로 발생하는 합병증을 우회 할 수 있습니다, 즉 호중구를 무리에 의해 방출 중재자를 분석 할 수있는 가난한 능력5. 또한 생체 내 모델은 일반적으로 설치류11,12,13,15,22,23, 또는 제브라피시11,12,15,23에서수행된다. 우리의 플랫폼은 마우스와 인간 호중구 사이의 특정 유사성이 관찰되었지만 인간 질병의 맥락에서 결과를 보다 직접적으로 해석 할 수있는 인간 호중구를 사용합니다5,11. 또한, 우리는 인간 호중구 집단 이동의 분석뿐만 아니라 무리 호중구에 의해 발표 된 중재자의 수집 및 분석을 용이하게하는 높은 수준의 재현성을 제공함으로써 우리의 플랫폼을 생체 내 모델과 구별하는 공간 제어 된 무리 환경을 유지합니다.
마이크로 스탬핑 프로토콜을 개발하는 동안 신중한 문제 해결이 필요한 몇 가지 문제가 발생했습니다. 첫째, 마이크로스탬핑에 사용되는 CP는 친수성이 높고 PDMS 스탬프는 소수성이다. CP는 PDMS에 대한 높은 선호도를 가지고 있지 않기 때문에, 우리의 절차는 기포의 형성을 피하고 습윤을 촉진하기 위해 신중하게 설계되었습니다. 먼저 페이스업(1.8단계)동안 CP로 스탬프를 프라이밍함으로써 CP와 스탬프 사이의 기포 형성을 최소화합니다. 스탬프를 CP 층상에 반전시키고 1시간 동안 배양합니다. 이 긴 배양 시간은 스탬프의 모든 부분이 젖어 있는지 확인합니다. 둘째, 클린 글래스 슬라이드(step 1.11)에 스탬핑하기 전에 과도한 CP를 제거하는 과정이 일치하지 않을 수 있다. 1.11 단계를 수행하는 동안 스탬프를 주의 깊게 검토해야 합니다. 패턴이 표시되기 시작하면 스탬프는 1.12단계에 사용할 준비가 됩니다. 또한, 스탬프를 건조하는 데 필요한 진공 시간(단계 1.12)은 다를 수 있다. 이것은 주로 날씨에 따라 달라집니다. 따뜻하고 습한 날에는 2 분의 진공 시간이 필요합니다. 시원하고 건조한 날에는 진공 시간 1 분으로 충분합니다.
우리는 건강한 기증자에서 호중구가 생물 입자 클러스터 의 주위에 안정된 무리를 형성한다는 것을 보여주었습니다. 시간 경과 형광 현미경 검사법을 사용하면 군단 크기를 정량화하고 호중구 이동을 추적 할 수 있으므로 호중구 화학 변증을 정량적으로 분석 할 수있습니다 5. 예를 들어, 우리는 이전에이 플랫폼이 화학 적 지수 (CI, 호중구 속도 벡터와 가장 가까운 바이오 입자 클러스터 사이의 위치 벡터 사이의 각도의 코신, 속도 (호중구가 시간별로 나눈 거리), 방사형 속도 (CI를 곱한 속도), 및 총 거리 이동 (초기 및 최종 호중구 위치의 차이) 개별 이동호중구 5. 대부분의 시험관 내 연구 와는 달리24,25,26,우리의 플랫폼은 인공 화학 구배가 없기 때문에 호중구 간 통신은 호중구 이동의 유일한 원동력입니다. 또한, 호중구 떼에 의해 생성 된 상급은 쉽게 접근 할 수 있습니다. 우리는 생체 내에서 존재하는 다른 세포 유형의 간섭없이 호중구에 의해 방출 된 세포 간 매개체에 대한 상월체를 수집하고 분석 할 수 있습니다. 16 개의 단백질은 무리 동안 그의 발현이 세 가지 동향 중 하나로 설명 될 수 관찰되었다: 증가 (10 단백질), 감소 (두 단백질), 및 스파이크 (4 개의 단백질). 이 단백질의 6개는 시간 동안 무리 도중 이전에 보고된 동향을확인했습니다 5. 확인된 단백질 중 일부는 이전에 무리 특이적인 것으로 나타났으며, 반면 다른 단백질은 활성화된 비떼혈구5에의해 차별적으로 발현되었다. 시간이 지남에 따라 농도증가하는 단백질은 프로 염증 반응과 관련이 있습니다. 시간이 지남에 따라 농도가 증가하는 일부 단백질은 이미 염증 반응(예를 들어, 갈렉틴-3 및 MMP-9)27,28에관여하는 것으로 알려져 있다. 그밖 단백질과 염증 사이 관계는 보다 적게 잘 이해됩니다. 떼지어 다니는 동안 급증하거나 감소하는 단백질은 염증 조절에 관여할 수 있습니다. 그러나, 추가 연구는 무리 도중 차별화하게 표현되는 단백질의 많은 염증에 있는 역할을 이해하는 것이 필요합니다. 호중구 이동과 함께 방출 된 중재자를 분석하면 염증의 복잡한 그림과 호중구가 떼를 지어지는 동안 주변 조직에 미치는 영향을 더 잘 이해하는 데 도움이 될 수 있습니다.
향후 연구에서, 우리의 플랫폼은 패턴 생물 입자 클러스터 주위에 안정적인 무리를 생성하는 건강에 해로운 호중구의 능력을 철저히 연구하는 데 사용할 수 있습니다. 패혈증3,외상6,암1,8,17,18을포함한 다양한 의료 조건이 호중구와 관련이 있으며, 이는 이들 환자에서 호중구가 기능을 변경했을 수 있음을 시사한다. 이 플랫폼은 건강하고 건강에 해로운 호중구에 의해 풀어 놓인 세포간 중재자 사이 다름을 검토하기 위하여 이용될 수 있습니다. 추가적으로, 이 플랫폼은 살아있는 미생물을 패턴으로 수정하고 시험관내 살아있는 미생물에 호중구 반응을 분석하기 위하여 이용될 수 있었습니다.
결론적으로, 우리는 시험관에서 호중구 무리를 분석하기위한 새로운 플랫폼을 개발했습니다. 우리의 플랫폼의 고도로 제어 된 특성은 우리가 생체 중 호중구 무리 실험 중에 발생하는 문제를 완화 할 수 있습니다. 바이오 입자 마이크로 어레이에 호중구 떼는 시간 경과 형광 현미경 검사를 통해 쉽게 정량화 할 수 있습니다. 추가적으로, 우리는 생체 내에서 존재하는 다른 조직의 간섭없이 호중구에 의해 방출 된 중재자를 수집 할 수 있습니다. 이 플랫폼은 향후 연구에서 호중구의 건강하고 건강에 해로운 기증자로부터의 이동 행동 간의 차이를 정량화하는 데 사용할 수 있습니다.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
이 일은 오하이오 주립 대학에 있는 화학과 생물 분자 공학의 윌리엄 G. Lowrie 부 및 포괄적인 암 센터에서 자금조달에 의해 지원되었습니다. 이 보고서에 제시된 데이터는 오하이오 주립 대학의 캠퍼스 현미경 및 이미징 시설에서 사용할 수 있는 Imaris x64(9.3.0 비트플레인)를 사용하여 처리된 이미지에서 나왔습니다. 이 시설은 보조금 P30 CA016058, 국립 암 연구소, 베데스다, MD에 의해 부분적으로 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| "The Big Easy" EasySep Magnet | STEMCELL Technologies | 18001 | Magnet to use with neutrophil isolation kit |
| Cell Incubator | Okolab | 777057437 / 77057343 | Okolab cage incubator for temperature and CO2 control |
| EasySep Human Neutrophil Isolation Kit | STEMCELL Technologies | 17957 | Kit for immunomagnetic negative selection of human neutrophils |
| Eclipse Ti2 | Nikon Instruments | MEA54010 / MEF55037 | Inverted research microscope |
| Escherichia coli (K-12 strain) BioParticles Texas Red conjugate | Invitrogen | E2863 | Bioparticle powder, dissolve in water prior to addition to Zetag® array |
| Harris Uni-Core 8-mm biopsy punch | Sigma Aldrich | Z708925 | To cut PDMS stamps |
| HetaSep | STEMCELL Technologies | 7906 | Erythrocyte aggregation agent for separating buffy coat from red blood cells in fresh human blood |
| Hoechst 33342 | Life Technologies | H3570 | Nucleus fluorescent stain |
| Human L1000 Array | Raybiotech Inc. | AAH-BLG-1000-4 | High density array to detect 1000 human proteins |
| Human Serum Albumin (HSA) | Sigma Aldrich | A5843 | Low endotoxin HSA, to prepare 2 % solutions in IMDM for isolated neutrophils |
| Iscove's Modified Dulbeccos' Medium (IMDM) | Thermo Fisher Scientific | 12440053 | To resuspend isolated neutrophils |
| K2-EDTA tubes | Thermo Fisher Scientific | 02-657-32 | Tubes for blood collection |
| Low Reflective Chrome Photomask | Front Range Photomask | N/A | Dimensions 5" x 5" x 0.09" (L x W x D) |
| Microarray Scanner | Perkin Elmer | ASCNGX00 | Fluorescence reader of protein patterned microdomains |
| Microscopy Image Analsysis Software - Imaris | Bitplane | 9.3.0 | Software for automatic cell tracking analysis |
| NiS Elements Advanced Research Software Package | Nikon Instruments | MQS31100 | Software for automatic live cell imaging and swarm size calculation |
| Poly-L-lysine fluorescein isothiocyanate (PLL-FITC) | Sigma Aldrich | P3069-10MG | 30,000 - 70,000 MW PLL labeled with FITC, used to fluorescently label CP solution |
| SecureSeal 8-well Imaging Spacer | Grace Bio-Labs | 654008 | 8-well, 9-mm diameter, adhesive imaging spacer |
| Silicon Wafer | University Wafer | 590 | Silicon 100 mm N/P (100) 0- 100 ohm-cm 500 μm SSP test |
| Spin Coater | Laurell | WS-650MZ-23NPPB | Used to spincoat a 40-µm layer of photoresist onto silicon wafer |
| SU-8 2025 | MicroChem | 2025 | Negative photoresist to make silicon master wafer |
| SU-8 Developer | MicroChem | Y020100 | Photoresist developer. Remove non-crosslinked SU-8 2025 from silicon wafer |
| Sylgard 184 (polydimethylsiloxane, PDMS) | Dow | 1673921 | 2-part silicone elastomer kit for making microstamps and PDMS wells |
| UV Exposure Masking System | Kloé | UV-KUB 2 | Used to crosslink photoresist on silicon wafer through chrome mask with UV light |
| Water | Thermo Fisher Scientific | A1287303 | High quality water to dilute bioparticles |
| Zetag 8185 | BASF | 8185 | Cationic polyelectrolyte (CP), powder, Copolymer of acrylamide and quaternized cationic monomer, forms "inking solution" for microstamping when dissolved in water |
| Zymosan A S. cerevisiae BioParticles Texas Red conjugate | Invitrogen | Z2843 | Bioparticle powder, dissolve in water prior to addition to Zetag array |
참고문헌
- Coffelt, S. B., Wellenstein, M. D., de Visser, K. E. Neutrophils in cancer: neutral no more. Nature Reviews Cancer. 16 (7), 431-446 (2016).
- Jones, C. N., et al. Microfluidic Platform for Measuring Neutrophil Chemotaxis from Unprocessed Whole Blood. Journal of Visualized Experiments. (88), 1-6 (2014).
- Ellett, F., et al. Diagnosis of sepsis from a drop of blood by measurement of spontaneous neutrophil motility in a microfluidic assay. Nature Biomedical Engineering. 2, 207-214 (2018).
- Malawista, S. E., Chevance de Boisfleury, A., Naccache, P. H. Inflammatory Gout: Observations over a Half-Century. The FASEB Journal. 25 (12), 4073-4078 (2011).
- Reátegui, E., et al. Microscale arrays for the profiling of start and stop signals coordinating human-neutrophil swarming. Nature Biomedical Engineering. 1 (7), 1-12 (2017).
- Morgan, A. S. Risk factors for infection in the trauma patient. Journal of the National Medical Association. 84 (12), 1019-1023 (1992).
- Szczerba, B. M., et al. Neutrophils escort circulating tumour cells to enable cell cycle progression. Nature. 566, 553-557 (2019).
- Treffers, L. W., Hiemstra, I. H., Kuijpers, T. W., van den Berg, T. K., Matlung, H. L. Neutrophils in cancer. Immunological Reviews. 273, 312-328 (2016).
- Grayson, P. C., Kaplan, M. J. At the Bench: Neutrophil extracellular traps (NETs) highlight novel aspects of innate immune system involvement in autoimmune diseases. Journal of Leukocyte Biology. 99 (2), 253-264 (2016).
- Lämmermann, T. In the eye of the neutrophil swarm--navigation signals that bring neutrophils together in inflamed and infected tissues. Journal of Leukocyte Biology. 100 (1), 55-63 (2016).
- Kienle, K., Lämmermann, T. Neutrophil swarming: an essential process of the neutrophil tissue response. Immunological Reviews. 273 (1), 76-93 (2016).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Lämmermann, T., et al. Neutrophil swarms require LTB4 and integrins at sites of cell death in vivo. Nature. 498 (7454), 371-375 (2013).
- Kreisel, D., et al. In vivo two-photon imaging reveals monocyte-dependent neutrophil extravasation during pulmonary inflammation. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18073-18078 (2010).
- Coombes, J. L., Robey, E. A. Dynamic imaging of host-pathogen interactions in vivo. Nature Reviews Immunology. 10 (5), 353-364 (2010).
- Lämmermann, T. Cell migration: Arraying neutrophils in swarms. Nature Biomedical Engineering. 1 (7), 1-2 (2017).
- Powell, D. R., Huttenlocher, A. Neutrophils in the Tumor Microenvironment. Trends in Immunology. 37 (1), 41-52 (2016).
- Uribe-querol, E., Rosales, C. Neutrophils in Cancer: Two Sides of the Same Coin. Journal of Immunology Research. 2015, (2015).
- Underhill, D. M., Ozinsky, A. Toll-like receptors: Key mediators of microbe detection. Current Opinion in Immunology. 14 (1), 103-110 (2002).
- Netea, M. G., Van Der Meer, J. W., Kullberg, B. J. Recognition of fungal pathogens by toll-like receptors. Immunology of Fungal Infections. , 259-272 (2007).
- Thomas, C. J., Schroder, K. Pattern recognition receptor function in neutrophils. Trends in Immunology. 34 (7), 317-328 (2013).
- Prince, L. R., Whyte, M. K., Sabroe, I., Parker, L. C. The role of TLRs in neutrophil activation. Current Opinion in Pharmacology. 11 (4), 397-403 (2011).
- Tan, S. Y., Weninger, W. Neutrophil migration in inflammation: intercellular signal relay and crosstalk. Current Opinion in Immunology. 44, 34-42 (2017).
- Menezes, G. B., Rezende, R. M., Pereira-Silva, P. E. M., Klein, A., Cara, D. C., Francischi, J. N. Differential involvement of cyclooxygenase isoforms in neutrophil migration in vivo and in vitro. European Journal of Pharmacology. 598 (1-3), 118-122 (2008).
- Afonso, P. V., et al. LTB4 Is a Signal-Relay Molecule during Neutrophil Chemotaxis. Developmental Cell. 22 (5), 1079-1091 (2012).
- Gounni, A. S., et al. In Vivo Regulates Neutrophil Migration In Vitro and Chemorepellent Semaphorin 3E Negatively Chemorepellent Semaphorin 3E Negatively Regulates Neutrophil Migration In Vitro and In Vivo. The Journal of Immunology. 198, 1023-1033 (2017).
- Dumic, J., Dabelic, S., Flögel, M. Galectin-3: An open-ended story. Biochimica et Biophysica Acta - General Subjects. 1760 (4), 616-635 (2006).
- Padmanabhan Iyer, R., et al. Matrix metalloproteinase-9-dependent mechanisms of reduced contractility and increased stiffness in the aging heart. Proteomics - Clinical Applications. 10 (1), 92-107 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유