Method Article
الجسيمات الحيوية Microarrays للتحليل الكيميائي والجزيئي للالعدلة البشرية يحتشدون في المختبر
In This Article
Summary
يولد هذا البروتوكول ميكروصفات الجسيمات الحيوية التي توفر الحينة الخاضعة للرقابة المكانية تحت الإحتلال. فهو يوفر سهولة الوصول إلى الوسطاء الذين تطلقهم العدلات أثناء الترحيل ويسمح بتحليل التصوير الكمي.
Abstract
العدلات يحتشدون هي عملية تعاونية من خلالها العدلات ختم موقع للعدوى وتعزيز إعادة تنظيم الأنسجة. وقد درس يحتشدون تقليديا في الجسم الحي في نماذج الحيوانات التي تظهر أنماط مميزة من هجرة الخلايا. ومع ذلك، في نماذج الجسم الحي لديها العديد من القيود، بما في ذلك الوسطاء بين الخلايا التي يصعب الوصول إليها وتحليلها، فضلا عن عدم القدرة على تحليل العدلات البشرية مباشرة. وبسبب هذه القيود، هناك حاجة إلى منصة في المختبر التي تدرس يحتشدون مع العدلات البشرية ويوفر سهولة الوصول إلى الإشارات الجزيئية التي تم إنشاؤها أثناء الحشود. هنا ، يتم استخدام عملية ختم دقيق متعدد الخطوات لتوليد ميكروريسالجسيمات الحيوية التي تحفز الاحترار عن طريق محاكاة عدوى في الجسم الحي. تحفز الميكروسير اتافيليات الجسيمات الحيوية على السرب بطريقة مُتحكَّم ة ومستقرة. على الميكروarray ، العدلات زيادة في السرعة وتشكيل أسراب مستقرة حول مجموعات الجسيمات الحيوية. بالإضافة إلى ذلك، تم تحليل supernatant التي ولدتها العدلات وتم اكتشاف 16 بروتينا تم التعبير عنها بشكل تفاضلي على مدى يحتشدون. هذا في المختبر يحتشدون منصة يسهل التحليل المباشر للهجرة العدلات وإطلاق البروتين بطريقة قابلة للاستنساخ، وتسيطر عليها مكانيا.
Introduction
العدلات، وخلايا الدم البيضاء الأكثر وفرة في مجرى الدم1،تكتسب الاهتمام كأهداف التشخيص والعلاج المحتملة2،3 لأنها قد تشارك في مجموعة متنوعة من الحالات الطبية بما في ذلك النقرس4،تعفن الدم3،الصدمة5،6،السرطان1،7،8،ومختلف أمراض المناعة الذاتية5،9. العدلات يحتشدون هو متعدد المراحل، عملية منظمة بإحكام مع التعقيد الذي يجعلهامحور اهتمام خاص من الدراسة5،10،11. أثناء الإحتباس ، تعزل العدلات موقع الالتهاب من الأنسجة السليمة المحيطة5،10،11. التنظيم السليم للجنوماتر يحتشدون ضروري لتعزيز التئام الجروح والتهاب القرار في نهاية المطاف5،12. وقد درس في المقام الأول الاحترار العدلات في الجسم الحي في القوارض12،13،14،15 وحمار وحشي10،11،12،15 نماذج. ومع ذلك ، فإن طبيعة هذه النماذج الحيوانية في الجسم الحي تؤدي إلى قيود5. على سبيل المثال ، الوسطاء التي أفرج عنها العدلات أثناء الاحتباس ليست متاحة بسهولة للتحليل5. بالإضافة إلى ذلك ، هناك العديد من المصادر المحتملة لوسيط معين في الجسم الحي ، لذلك يجب أن تدخل تجربة الجسم الحي نقصًا وراثيًا لمنع الإنتاج الخلوي و / أو التفاعل من أجل التحقيق في دور ذلك الوسيط في عملية معينة13. تتحايل تجربة المختبر على هذه المضاعفات من خلال تمكين مراقبة العدلات دون سياق خلايا إضافية. بالإضافة إلى ذلك ، فإن البحوث التي تصف الهجرة المنسقة العدلات البشرية محدودة16. على منصة في المختبر يحتشدون، يمكن تحليل العدلات البشرية مباشرة. ويمكن لمنصة في المختبر يحتشدون توسيع نطاق المعرفة المكتسبة من الدراسات في الجسم الحي من خلال توفير الفرص لسد الثغرات التي خلفتها القيود المفروضة في دراسات الجسم الحي.
ولتلبية الحاجة إلى منصة في المختبر تحاكي في الحي الحي ّدات، قمنا بتطوير منصة ختم دقيقة تمكننا من نقش الجسيمات الحيوية الدقيقة التي تحفز العدلات تحت الحشود بطريقة خاضعة للرقابة المكانية. نحن توليد microarrays الجسيمات الحيوية على الشرائح الزجاجية في عملية من خطوتين. أولا، نحن نستخدم الختم الدقيق لتوليد ميكرور من البولي كتروليليت الموجبة (CP) البقع. ثانيا، نضيف حلا من الجسيمات الحيوية التي تلتزم البقع CP عن طريق التفاعل الكهروستاتيكي. من خلال أول نقش طبقة CP ، يمكننا نمط الجسيمات الحيوية المشحونة بشكل سلبي بشكل انتقائي لتوليد نمط الشد العدلات المطلوب. الطبقة المشحونة إيجابيا يحمل الجسيمات الحيوية المشحونة سلبا من خلال خطوة الغسيل القوية التي تزيل الجسيمات الحيوية من المناطق على الشريحة الزجاجية التي لا تحتوي على CP. بالإضافة إلى ذلك، CP المستخدمة هنا، copolymer من الأكريلاميد وأحادي المقط الرباعي، هو متوافق بيولوجيا، لذلك فإنه لا يحفز استجابة من العدلات. لديها شحنة سطحية عالية جدا ً تقوم بشل الجسيمات الحيوية بحجم الميكرون إلى الشريحة الزجاجية ، وبالتالي تمنع العدلات من إزالة الجسيمات من الموضع المنقوش على الشريحة الزجاجية. وهذا يؤدي إلى مجموعات الجسيمات الحيوية مرتبة في ميكروarray. عندما أضفنا العدلات إلى المايكروفير، شكلوا أسراب مستقرة حول مجموعات الجسيمات الحيوية. من خلال تتبع هجرة العدلات ، وجدنا أن العدلات المحتشدة تهاجر بنشاط نحو مجموعات الجسيمات الحيوية. وعلاوة على ذلك، استخدمنا هذه المنصة لتحليل بعض الوسطاء الذين تطلقهم العدلات أثناء الإحتلال. لقد وجدنا 16 وسيطاً يتم التعبير عنها بشكل تفاضلي أثناء الحشود. وتتبع تركيزاتها ثلاثة اتجاهات عامة على مر الزمن: الزيادة أو النقصان أو الارتفاع. لدينا في المختبر العدلات منصة يحتشدون يسهل تحليل العدلات البشرية التي تسيطر عليها مكانيا يحتشدون، فضلا عن جمع وتحليل الوسطاء الصادرة عن العدلات يحتشدون. في منشور سابق ، أثبتنا أن المرضى الذين يعانون من حالات طبية معينة (الصدمة ، وأمراض المناعة الذاتية ، والإنتان) ، لديهم العدلات التي تعمل بشكل مختلف عن تلك من المتبرعين الأصحاء5. في الدراسات البحثية المستقبلية، يمكن استخدام منصتنا لتحليل وظيفة العدلات بين مجموعة متنوعة من مجموعات المرضى. يمكن لهذه المنصة تحليل كمي للتنسيق المعقد الذي ينطوي عليه التَّلَّشّي في العدلات. يمكن إجراء دراسات إضافية لتوفير نظرة ثاقبة على وظيفة العدلات لمريض معين من السكان أو استجابة العدلات لمسببات الأمراض ذات الأهمية.
Protocol
ويعترف المؤلفون بالمتطوعين الأصحاء الذين تكرموا بالتبرع بدمائهم. تم الحصول على عينات الدم بعد موافقة المتطوعين المستنيرة وفقا لبروتوكول مجلس المراجعة المؤسسية (IRB) #2018H0268 استعرضت من قبل لجنة العلوم الطبية الحيوية في جامعة ولاية أوهايو.
1. microfabrication من الجسيمات الدقيقة الحيوية
- باستخدام إجراءات الطباعة الحجرية الضوئية القياسية، توليد رقاقة السيليكون الرئيسي.
- قم بإنشاء دليل على التصميم المطلوب باستخدام برنامج تصميم بمساعدة الكمبيوتر (CAD) ، ثم أرسله إلى الشركة المصنعة لقناع الضوئي لإنتاج قناع ضوئي من الكروم. التصميم المستخدم هنا هو صفائف مستطيلة 4 مم × 4 مم قطرها 30 ميكرومتر مملوءة بدوائر بتباعد من مركز إلى مركز 150 ميكرومتر. يمكن تعديل هذا التصميم حسب الرغبة للتطبيقات المختلفة.
- Spincoat طبقة سميكة 40 ميكرون من مقاومة ضوئية سلبية على رقاقة السيليكون. خبز رقاقة في 65 درجة مئوية لمدة 5 دقيقة و 95 درجة مئوية لمدة 10 دقيقة.
- كشف الرقاقة للضوء فوق البنفسجي من خلال قناع ضوئي الكروم مع 150-160 mJ/cm2 (الشكل 1A).
- خبز رقاقة في 65 درجة مئوية لمدة 5 دقيقة و 95 درجة مئوية لمدة 10 دقيقة. رقاقة الغمر في مطور مقاومة للضوء لمدة 10 دقيقة وشطف مع الكحول ايزوبروبيل. في هذه المرحلة ، يجب أن يكون النمط مرئيًا على الرقاقة(الشكل 1B).
- مزيج جيد 10:1 نسبة من البوليديميثيل سيلوكسان prepolymere وعامل المعالجة (أي 20 غرام من prepolymer و 2 غرام من عامل المعالجة) وصب خليط البولي ديميثيلسيلوكسان (PDMS) غير المعالجة على رقاقة الرئيسي في طبق بيتري(الشكل 1C).
- فراغ علاج خليط PDMS غير المعالجة حتى لا توجد فقاعات الهواء على رقاقة الرئيسي. علاج في 65 درجة مئوية بين عشية وضحاها.
- استخدام مشرط لقطع حول السطح الخارجي للقسم منقوشة من رقاقة، وإزالة ببطء لوح PDMS الشفاء. ضع لوح PDMS على لوحة قطع نظيفة مع الجانب المنقوش الذي يواجه(الشكل 1D).
- لكمة من الطوابع الفردية من بلاطة PDMS مع لكمة خزعة 8 ملم(الشكل 1E). وبالنسبة لشريحة زجاجية واحدة، ستكون هناك حاجة إلى ثمانية طوابع.
- وضع كل ختم الوجه لأسفل على شريط لاصق لإزالة أي حطام.
- في وقت مبكر، وإعداد محلول 1.6 ملغ / مل من CP في الماء.
- أضف الكمية المناسبة من مسحوق CP إلى الماء (على سبيل المثال، 0.8 غرام إلى 500 مل).
- تخلط على لوحة اثارة في درجة حرارة الغرفة بين عشية وضحاها، أو حتى يذوب كل الصلبة في الماء. يمكن تخزين حل CP في درجة حرارة الغرفة لمدة 6 أشهر.
- إذا رغبت في ذلك، وجعل الفلورسنت حل CP عن طريق إضافة بولي-L-ليسين وصفت مع الفلورسيز ايزوثيوسيانات (PLL-FITC).
- Aliquot حوالي 10 مل من حل CP. إضافة كمية صغيرة من PLL-FITC (0.05 ملغ) إلى حجم aliquoted. يمكن تغيير المبلغ لضبط سطوع الفلورسينس حسب الرغبة.
- دوامة حل CP المسمى مع FITC لمدة 20 s، أو حتى الحل هو موحد، لون أصفر شاحب. الحماية من الضوء وتخزينها في 4 درجة مئوية لمدة تصل إلى 1 شهر.
- مع الطوابع الوجه لأعلى، رئيس كل طابع مع 100 ميكرولتر من 1.6 ملغ / مل من محلول CP، وضمان عدم وجود شكل فقاعات الهواء بين حل CP والطابع(الشكل 1F).
- عكس الطوابع على طبقة من محلول CP(الشكل 1G).
- إزالة الطوابع من حل CP بعد 1 ساعة.
- الداب كل ختم الرطب وجهه إلى أسفل على شريحة زجاجية نظيفة 6-8x لإزالة السائل الزائد.
- فراغ علاج الطوابع لمدة 1-2 دقيقة.
- التمسك ثمانية جيدا، 9 مم قطر هاالتصوير فاصل على الجزء العلوي من شريحة زجاجية نظيفة كدليل لوضع الطوابع. مع هذا الفاصل، يمكن أن يكون لكل شريحة زجاجية ثمانية ميكروarrays.
- ضع وجه ًا للطوابع لأسفل على الشريحة الزجاجية في وسط كل بئر من فاصل التصوير (أي استخدام ثمانية طوابع إجمالية).
- ضع وزنًا متوازنًا 5.6 ± 0.1 جرام فوق كل طابع واسمح بـ 10 دقيقة للختم(الشكل 1H). مطلوب وزن متوازن لضمان ضغط الطابع بالتساوي على الشريحة الزجاجية وتعزيز نقل حتى CP إلى الشريحة الزجاجية.
- إزالة الأوزان والطوابع من الشريحة الزجاجية(الشكل 1I). السماح للطبقة CP لتجف في درجة حرارة الغرفة لمدة 24 ساعة قبل إضافة الجسيمات الحيوية، كما هو موضح في الخطوة 1.17. إذا تم وضع علامة CP مع FITC ، يمكن التحقق من فعالية الختم في هذه المرحلة بمجهر فلوري عند 488 نانومتر قبل الشروع في الخطوة 1.17(الشكل 1M).
- قطع لوح PDMS فارغة إلى حجم فاصل التصوير واستخدام لكمة خزعة 8 ملم لإنشاء آبار في PDMS التي تتماشى مع آبار فاصل التصوير. الانضمام إلى لوح PDMS إلى الشريحة الزجاجية مع فاصل التصوير(الشكل 1J).
- إذابة محلول من الجسيمات الحيوية (على سبيل المثال، الإشريكية القولونية أو الزيموسان) وتمييع إلى 500 ميكروغرام/مل في الماء للحقن (WFI).
ملاحظة: الجسيمات الحيوية لا تحتاج إلى أن تكون opsonized. مستقبلات سطح العدلات تعترف مباشرة الجزيئات على هذه الجسيمات الحيوية19،20،21. - إضافة 100 ميكرولتر من محلول الجسيمات الحيوية لكل PDMS بشكل جيد على الشريحة الزجاجية(الشكل 1K).
- صخرة الشريحة الزجاجية لمدة 30 دقيقة.
- شطف الآبار جيدا بالماء. يمكن تخزين ميكرور الجسيمات الحيوية في بيئة خالية من الغبار عند 4 درجات مئوية لمدة تصل إلى 3 أشهر. عند هذه النقطة ، يجب التحقق من النمط بمجهر فلوري عند 594 نانومتر قبل الانتقال إلى الخطوة 2.1(الشكل 1N).
2. إعداد العينة
- جمع ما لا يقل عن 2 مل من الدم الطازج في أنابيب K2-EDTA من المتبرع المطلوب. العائد المتوقع من العدلات هو 1-2 × 106 خلايا / 1 مل الدم كله. يتطلب إجراء التصوير ما يقرب من 1.5 × 105 العدلات ، ويتطلب تحليل الـ supernatant 1 × 106 العدلات. استخدام الدم في غضون 4 ساعة.
- فصل خلايا الدم الحمراء (RBCs) عن طريق إضافة عامل تجميع كريات الدم الحمراء في نسبة 1:5 إلى الدم كله. انتظر 45 دقيقة للحصول على طبقة شفافة (معطف بافي) لفصل من طبقة RBCs.
- إزالة معطف باهي وغسل مع الفوسفات المالحة العازلة (PBS) باستخدام 1 مل معطف بافي: 9 مل PBS.
- الطرد المركزي لمدة 5 دقيقة في 190 × ز و 20 درجة مئوية.
- يستنشق supernatant وresuspend بيليه في 5 × 107 خلايا / مل.
- استخدم مجموعة اختيار مغناطيسية مناعية سلبية لعزل العدلات.
- أضف 50 ميكرولتر من الأجسام المضادة كوكتيل/1 مل تعليق الخلية. انتظر 10 دقيقة.
- أضف 100 ميكرولتر من الخرز المغناطيسي/1 مل تعليق الخلية. انتظر 10 دقيقة.
- إضافة تعليق الخلية إلى أنبوب جولة أسفل ومكان في مغناطيس أسطواني. انتظر 10 دقيقة.
- صب supernatant في أنبوب الطرد المركزي. إضافة ما يصل إلى 10 مل من برنامج تلفزيوني. الطرد المركزي لمدة 5 دقيقة في 190 × ز و 20 درجة مئوية.
- يستنشق سوبرناستانت. إعادة تعليق بيليه الأبيض في IMDM مع 0.4٪ الألبومين المصل الإنسان.
- نوى وصمة عار مع 20 ميكروغرام / مل Hoechst 33342 لمدة 10 دقيقة في 37 درجة مئوية.
- إضافة 5 مل من IMDM مع 0.4٪ بومالين المصل البشري لشطف. الطرد المركزي لمدة 5 دقيقة في 190 × ز و 20 درجة مئوية.
- إعادة تعليق الخلايا في 7.5 × 105 خلايا / مل في IMDM مع 0.4٪ الألبومين المصل البشري.
- أضف 100 ميكرولتر من تعليق الخلية إلى PDMS يحتوي على ميكروarray الجسيمات الحيوية. تأكد من تعليق الخلية محدب على الجزء العلوي من PDMS بشكل جيد ولا يحتوي على أي فقاعات.
- ختم مع غطاء قطرها 12 ملم. تغطية افتتاح PDMS جيدا مع غطاء قطرها 12 ملم. اضغط على أسفل بلطف على غطاء مع ملاقط بحيث يفلت تعليق الخلية الزائدة إلى حافة البئر. استخدم الأنسجة لإزالة تعليق الخلية الزائد.
3. تشغيل تحليل التحاليل والصورة
- تحميل صفيف الجسيمات الدقيقة مع الخلايا على محطة التصوير الخلية الحية مع المجهر مجهزة حاضنة قفص تعيين إلى 37 درجة مئوية، 5٪ CO2،و 90٪ الرطوبة النسبية.
- استخدام الوقت الفاصل الفلورسنت والمجهر برايتفيلد لتسجيل الصور في التكبير 10x كل 10 s في 405 نانومتر، 594 نانومتر، وبرايتفيلد. في تجربة نموذجية، يتم جمع الصور تصل إلى 2 ساعة.
- استخدام برنامج تتبع الخلية الآلي لتتبع هجرة العدلات الفردية نحو كتلة الجسيمات الحيوية.
- استخدم وضع الانحدار التلقائي لبرنامج تتبع خلية الكشف الموضعي. تعيين نصف قطر البقعة إلى 5 ميكرومتر (الحجم التقريبي لنواة العدلات). تعيين الحد الأدنى لطول المسار إلى 120 s وحجم الفجوة الأقصى من إطار واحد.
- من البيانات التي تم إنشاؤها بواسطة برنامج تتبع الخلية، استخراج الملفات التي تحتوي على موضع العدلات والسرعة. ويمكن استخدام هذه الملفات مع برنامج الرسوم البيانية لتوليد مسارات الهجرة العدلات(الشكل 2C)وخريطة الحرارة من السرعة مقابل الوقت(الشكل 2D)،على التوالي.
- استخدام الصور الفلورية 405 نانومتر لتتبع حجم سرب مع مرور الوقت على برنامج تحليل الصور من اختيارك.
- تحديد المناطق ذات الأهمية (ROIs) حول كل مجموعة من الجسيمات الحيوية حيث سرب العدلات. احتفظ بنفس حجم عائد الاستثمار لتحليل كل كتلة من الجسيمات الحيوية.
- تحليل متوسط كثافة الفلورسنت من الصور 405 نانومتر داخل كل عائد على الاستثمار مع مرور الوقت.
- توليد منحنى معايرة من متوسط كثافة الفلورسنت لحجم سرب عن طريق اتخاذ القياسات اليدوية في أحجام سرب مختلفة من 0 ميكرومتر2 إلى الحد الأقصى لحجم سرب. استخدم هذه المعايرة لحساب حجم السرب بمرور الوقت.
4. جمع Supernatant والكشف عن البروتين
- احتضان العدلات في الآبار التي تحتوي على الجسيمات المجهرية الحيوية عند 37 درجة مئوية و5٪ ثاني أكسيد الكربون2 لمدة 3 ساعة. أخذ عينات في النقاط الزمنية المطلوبة. عادة، سيتم أخذ العينات في 0، 0.5، 1، و 3 ساعة. وللتغلب على حد الكشف عن مجموعة البروتين، استُخدم الحجم الكامل لسوبرناتانت بئر واحد (200 ميكرولتر) لكل نقطة زمنية. في كل مرة تم تحليل نقطة في ثلاثة توائم.
- باستخدام المجهر brightfield، تحقق من أن يتم تشكيل أسراب على microarray.
- يستنشق السوبرناستان مع ماصة 200 ميكرولتر والتحميل في أنبوب مرشح الطرد المركزي 0.45 ميكرومتر.
- الطرد المركزي supernatant في 190 × ز و 20 درجة مئوية لمدة 5 دقيقة وجمع حجم بليه.
- تخزين العينات في -80 درجة مئوية حتى وقت المعالجة.
- استخدم مجموعة ميكرورفير التي تكتشف مجموعة من البروتينات البشرية لمعالجة العينات.
- أضف 200 ميكرولتر من كل عينة إلى أنبوب غسيل كلوي منفصل مزود بالمجموعة.
- ضع أنابيب غسيل الكلى في كوب يحتوي على ما لا يقل عن 500 مل من PBS (درجة الحموضة = 8.0). يُحرّك المزيج برفق على طبق التحريك لمدة 3 درجات على الأقل عند درجة حرارة 4 درجات مئوية. تغيير برنامج تلفزيوني في الكأس وتكرار هذه الخطوة.
- نقل كل عينة إلى أنبوب طرد مركزي نظيف وأجهزة طرد مركزي بسرعة 9000 x g لمدة 5 دقيقة لإزالة أي رواسب. نقل كل supernatant إلى أنبوب نظيف.
- Biotinylate كل عينة عن طريق إضافة 36 ميكرولتر من 1x وضع العلامات كاشف من عدة لكل 1 ملغ من مجموع البروتين في عينة dialyzed إلى 180 ميكرولتر من عينة dialyzed. احتضان في 20 درجة مئوية لمدة 30 دقيقة. مزيج بلطف كل 5 دقيقة.
- إضافة 3 ميكرولتر من حل التوقف المقدمة مع عدة في كل أنبوب العينة. نقل كل عينة إلى أنبوب غسيل الكلى الطازجة وتكرار الخطوات 4.6.2-4.6.3. في هذه المرحلة، يمكن تخزين العينة عند -20 درجة مئوية أو -80 درجة مئوية حتى تكون مستعدًا للمتابعة.
- يتم تخزين الشريحة الزجاجية المتوفرة مع المجموعة عند -20 درجة مئوية. السماح لها أن تأتي إلى درجة حرارة الغرفة. ضع الشريحة الزجاجية المجمعة في غطاء تدفق لامينار لمدة 1-2 ساعة في درجة حرارة الغرفة.
- أضف 400 ميكرولتر من المخزن المؤقت للحظر المتوفرة مع المجموعة في كل بئر من الشريحة الزجاجية المجمعة. احتضان في درجة حرارة الغرفة لمدة 30 دقيقة.
- الطرد المركزي العينات المعدة لمدة 5 دقيقة في 9000 × ز لإزالة الرواسب أو الجسيمات. تمييع 5x مع حظر المخزن المؤقت.
- قم بإزالة المخزن المؤقت للحظر من كل بئر. أضف 400 ميكرولتر من العينات المخففة إلى الآبار المناسبة. احتضان لمدة 2 ساعة في درجة حرارة الغرفة في حين هزاز.
- Decant العينات من كل بئر. غسل 3x مع 800 ميكرولتر من العازلة غسل 1x قدمت مع عدة في درجة حرارة الغرفة لمدة 5 دقيقة كل في حين هزاز.
- في حاوية نظيفة، غمر الشريحة الزجاجية المجمعة في 1x غسل المخزن المؤقت I. غسل 2x في درجة حرارة الغرفة لمدة 5 دقيقة لكل منهما أثناء هزاز.
- أضف 400 ميكرولتر من 1x Cy3-مترافق تريبتافيدين إلى كل صفيف فرعي. تغطية مع شرائط لاصقة من البلاستيك. حماية من الضوء لبقية البروتوكول.
- احتضان لمدة 2 ساعة في درجة حرارة الغرفة في حين هزاز.
- فك الحل وتفكيك الشريحة الزجاجية من غرف العينة.
- في أنبوب الطرد المركزي 30 مل المقدمة مع عدة، إضافة بعناية الشريحة الزجاجية ويكفي 1x غسل العازلة الأول لتغطية الشريحة الزجاجية. غسل 3x لمدة 10 دقيقة لكل منهما في درجة حرارة الغرفة أثناء هزاز.
- في أنبوب الطرد المركزي 30 مل، وغسل 2x مع 1x غسل المخزن المؤقت الثاني لمدة 5 دقيقة لكل منهما في درجة حرارة الغرفة في حين هزاز.
- اغسل الشريحة الزجاجية بـ 30 مل من ddH2O لمدة 5 ساعات. أزيل الشريحة الزجاجية من أنبوب الطرد المركزي واترك لتجف لمدة 20 دقيقة في غطاء تدفق لامينار. يمكن تخزين الشريحة الزجاجية المعدة عند -20 درجة مئوية حتى تصبح جاهزة للمسح الضوئي.
- مسح الشريحة الزجاجية مع ماسح ضوئي ميكروريسفي انبعاث الفلورسينس من 555 نانومتر.
النتائج
عندما تضاف العدلات إلى الجسيمات المجهرية الحيوية ، يتم تنشيط العدلات التي تتصل بمجموعات الجسيمات الحيوية وتبدأ الاستجابة المحتشدة. تم التحقق من صحة الجسيمات المجهرية الحيوية باستخدام المجهر الفلوري الفاصل بين الوقت لتتبع الهجرة العدلات نحو مجموعات الجسيمات الحيوية(فيديو S1). يتم تتبع هجرة نواة العدلات الفردية أثناء هجرتهم نحو مجموعة الجسيمات الحيوية. عندما تصل العدلات إلى كتلة الجسيمات الحيوية ، تتداخل نواتها مع النوى الأخرى في الكتلة. وبالتالي، فإنه ليس من الممكن تتبع بدقة العدلات داخل الكتلة باستخدام هذا الأسلوب. Zymosan وE. القولونية مجموعات الجسيمات الحيوية على حد سواء يؤدي إلى توليد أسراب العدلات. بالنسبة لنتائجنا، يستخدم الشكل 2B بيانات من أسراب العدلات التي تم إنشاؤها بواسطة جزيئات الإشريكية القولونية. الشكل 3 والألواح الأخرى من الشكل 2 استخدام أسراب العدلات التي تولدها جزيئات زيموزان. تظهر النتائج التي تم الحصول عليها أن مجموعات الجسيمات الحيوية تحفز تنشيط العدلات عندما اتصل العدلات بالكتلة ، مما أدى في النهاية إلى تكوين أسراب العدلات المستقرة حول كل مجموعة بعد 30-60 دقيقة(الشكل 2A، أعلى). وعلى النقيض من ذلك، لم تظهر العدلات الهجرة الجماعية في غياب مجموعات الجسيمات الحيوية(الشكل 2A،أسفل، والفيديو S2). باستخدام كثافة الفلورسنت من نواة العدلات الملطخة في 405 نانومتر، تم العثور على متوسط حجم سرب العدلات حوالي 30 ميكرومتر قطرE. مجموعات الجسيمات الحيوية القولونية لتكون 1490 ± 680 ميكرومتر2 (متوسط ± SD، الشكل 2B،أعلى). كانت كثافة الفلورية في منطقة معينة ذات أهمية حيث لا توجد مجموعات من الجسيمات الحيوية ثابتة تقريبًا بمرور الوقت ، مما أكد عدم وجود هجرة جماعية في هذا الإعداد(الشكل 2B، أسفل). تظهر مسارات هجرة العدلات أن العدلات تقاربت على مجموعة الجسيمات الحيوية عندما كان أحد ها(الشكل 2C، أعلى). وعلى العكس من ذلك، لم يلاحظ أي تقارب في نظام التحكم(الشكل 2C، أسفل). تم قياس سرعة (المسافة المقطوعة / الوقت) من العدلات المحتشدة وغير المنشطة وتم العثور على فرق مهم إحصائيًا في توزيعات السرعة (ANOVA ، p < 0.0001) ، كما هو موضح في الشكل 2D. وكان متوسط سرعة العدلات المحتشدة 20.6 ± 13.0 ميكرومتر /دقيقة (متوسط ± SD)، وكان متوسط سرعة التحكم في العدلات 2.0 ± 2.2 ميكرومتر/دقيقة.
بالإضافة إلى ذلك ، تم تحليل تركيز 16 بروتينًا تم إصدارها خلال الحشود(الشكل 3). تم حساب التركيز العادي لكل بروتين في نقاط زمنية مختلفة في عملية الإحتلال (t = 0 و 0.5 و 1 و 3 h) ، حيث يكون التركيز العادي (C - Cmin)/ (CMax - Cmin). 10 بروتينات زيادة في التركيز في جميع أنحاء يحتشدون. وكانت هذه البروتينات أديبسين، جاليكتين-3، GROa، IL-6R، MIP-1a، MMP-8، MMP-9، نيدوجين-1، TIMP-1، وTLR2. اثنين من البروتينات (pentraxin 3 وRANK) انخفض في التركيز في جميع أنحاء يحتشدون. أما البروتينات الأربعة المتبقية (clusterin, PF4, RANTES, و Trappin-2) زادت خلال الساعة الأولى من الإحتكار ولكنها انخفضت بعد ذلك. وبعبارة أخرى، تركيزات تلك البروتينات "ارتفعت" خلال يحتشد. ومن بين البروتينات الـ 16 التي تم تحديدها، تم تحديد 12 بروتيناً في منشورنا السابق5. وقد تبين أن أديبسين، جاليكتين-3، نيدوجين-1، بنتراشين 3، TIMP-1، وTLR2 يحتشدون بشكل خاص، في حين أن clusterin، IL-6R، MMP-8، وMMP-9، RANK، وtrappin-2 لم تكن5.

الشكل 1: إنتاج ميكرور الجسيمات الحيوية. يتعرض رقاقة السيليكون المغلفة مع مقاومة سلبية للأشعة فوق البنفسجية من خلال قناع ضوئي الكروم(A). بعد خبز رقاقة السيليكون وتطويرها ، يبقى نمط مقاومة للضوء على سطح رقاقة السيليكون. هذا هو رقاقة ماجستير(ب). في طبق بيتري ، يتم إضافة خليط PDMS إلى الجزء العلوي من الرقاقة الرئيسية. يتم علاج PDMS بين عشية وضحاها في 65 درجة مئوية لتشكيل قالب PDMS(C). يتم قطع قالب PDMS من رقاقة الرئيسي ويتم استخدام لكمة خزعة لكمة من طوابع PDMS الفردية(D). ختم PDMS(E)مغطى بحل CP(F). يتم عكس الطابع على طبقة رقيقة من محلول CP(G). بعد الاحتضان في محلول CP لساعة واحدة ، يتم مسح الطابع على شريحة زجاجية لإزالة CP الزائدة. ثم يتم الضغط على ثمانية طوابع على شريحة زجاجية نظيفة بوزن 5.6 ± 0.1 غرام ، محاذية مع فاصل التصوير(H). عند إزالة الطابع، يبقى نمط CP(I). يتم الالتزام بلوح PDMS مع آبار مسبقة التقطيع إلى الشريحة الزجاجية(J). ثم، يتم إضافة حل الجسيمات الحيوية على نمط CP(K). ترتبط الجسيمات الحيوية المشحونة سلبًا بالبولي إليكروليتيت المشحون إيجابيًا عبر التفاعل الكهروستاتيكي. يتم غسل محلول الجسيمات الحيوية الزائدة ، وترك الجسيمات الحيوية منقوشة على رأس نمط CP(L). (M)صورة فلورية لطبقة CP المسماة مع FITC (أشرطة المقياس = 50 ميكرومتر ، صورة كبيرة ؛ مقياس شريط = 25 ميكرون، inset). (N)صورة فلورية للجسيمات الحيوية المنقوشة الزيميموسان ية مترافقة مع تكساس ريد (شريط المقياس = 100 ميكرومتر، صورة كبيرة؛ مقياس شريط = 50 ميكرون، inset). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: نمو سرب العدلات حول مجموعات الجسيمات الحيوية. في وجود مجموعات الجسيمات الحيوية ، تخضع العدلات للهجرة الجماعية نحو مجموعات الجسيمات الحيوية (القاع، العدلات الخاضعة للتحكم). عندما لا توجد جسيمات بيولوجية، لا تقوم العدلات بالهجرة الجماعية. (أ)في وجود مجموعات الجسيمات الحيوية zymosan ، العدلات تشكيل أسراب في 30 دقيقة. بدون مجموعات الجسيمات الحيوية ، لا تتشكل أسراب (أشرطة المقياس = 50 ميكرومتر). (ب)أسراب العدلات تنمو إلى متوسط حجم 1490 ± 680 ميكرومتر2 (متوسط ± SD) حول 30 ميكرومتر قطرE. مجموعات الجسيمات الحيوية القولونية. مراقبة العدلات يحمل كثافة ثابتة التي تتوافق مع أي نمو سرب (ANOVA، p < 0.0001، ن = 32 أسراب العدلات، N = 1 المانحة، أشرطة الخطأ = الانحراف المعياري). (C)تتلاقى مسارات العدلات المحتشدة على مجموعات الجسيمات الحيوية الزيموسانية، في حين أن العدلات الخاضعة للتحكم لا تظهر أي نقطة متقاربة (قضبان المقياس = 50 ميكرومتر). (D)العدلات يحتشدون نحو هدف زيموزان لديها متوسط سرعة 20.6 ± 13.0 ميكرومتر / دقيقة (متوسط ± SD)، في حين أن العدلات التحكم لديها متوسط سرعة 2.0 ± 2.2 ميكرومتر / دقيقة. يمثل كل عدد على خريطة الحرارة العدلات مع السرعة الفورية المعطاة في نقطة زمنية معينة. هذه الخرائط الحرارية هي ممثلة لتجربة واحدة (ن = 1 سرب; N = متبرع واحد؛ ANOVA, 6,114 = العدلات يحتشدون, 32,116 = العدلات التحكم, p < 0.0001). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
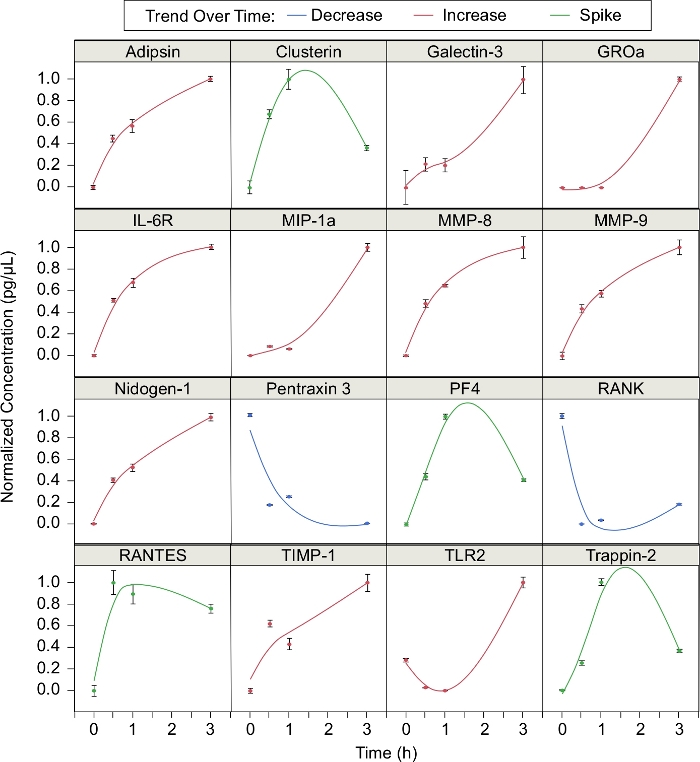
الشكل 3: الوسطاء الأحرار الذين يتم إطلاقسراحهم من قبل العدلات المحتشدة. العدلات يحتشدون يؤثر على إنتاج البروتينات المختلفة مع مرور الوقت. تم قياس تركيز البروتين في 0 و 0.5 و 1 و 3 ساعة. تم تزويد نقاط البيانات بخطوط ناعمة (= 0.05). هذه البروتينات تميل إلى اتباع واحد من ثلاثة اتجاهات مميزة: انخفاض مع مرور الوقت، وزيادة مع مرور الوقت، أو ارتفاع حول 1 ساعة ثم تناقص (أشرطة الخطأ = الانحراف المعياري؛ ن = 3 يكرر؛ N = متبرع واحد). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
فيديو S1: العدلات يحتشدون نحو مجموعات الجسيمات الحيوية zymosan. تظهر نواة العدلات باللون الأزرق. يتم وضع علامة على أهداف Zymosan بدوائر حمراء (شريط المقياس = 50 ميكرومتر؛ وقت الاستحواذ الأصلي = 60 دقيقة). يرجى الضغط هنا لتحميل هذا الفيديو.
فيديو S2: الهجرة العشوائية العدلة غير المنشطة. تظهر نواة العدلات باللون الأزرق (شريط المقياس = 50 ميكرومتر؛ وقت الاستحواذ الأصلي = 60 دقيقة). يرجى الضغط هنا لتحميل هذا الفيديو.
Discussion
قمنا بتطوير منصة الختم الدقيق لتوليد صفائف موحدة من الجسيمات الحيوية لتحفيز في المختبر العدلات يحتشدون. طبيعة المختبر من منصتنا يسمح لنا للتحايل على المضاعفات التي تنشأ مع في التجارب يحتشدون في الجسم الحي، وهي ضعف القدرة على تحليل الوسطاء الصادرة عن العدلات يحتشدون5. بالإضافة إلى ذلك ، عادة ما يتم تنفيذ نماذج في الجسم الحي في القوارض11،12،13،15،22،23، أو حمار وحشي11،12،15،23. يستخدم منصتنا العدلات البشرية ، والتي تمكننا من تفسير نتائجنا بشكل مباشر أكثر في سياق المرض البشري ، على الرغم من أن بعض أوجه التشابه بين الماوس والعدلات البشرية قد لوحظت5،11. بالإضافة إلى ذلك، نحن نحافظ على بيئة يحتشدون تحت السيطرة المكانية التي تميز منصتنا عن نماذج الجسم الحي من خلال توفير مستوى عال من الاستنساخ الذي يسهل تحليل الهجرة الجماعية العدلات البشرية، فضلا عن جمع وتحليل الوسطاء الصادرة عن العدلات يحتشدون.
أثناء تطوير بروتوكول الختم الدقيق لدينا ، نشأت العديد من التحديات التي تتطلب استكشاف الأخطاء وإصلاحها بعناية. أولاً ، CP المستخدمة في الختم المجهري هو مائي للغاية ، وطوابع PDMS هي مسعورة. لأن CP ليس لديها تقارب عالية لPDMS، تم تصميم الإجراء لدينا بعناية لتجنب تشكيل فقاعات وتعزيز التبول. من خلال أول فتيلة الطابع مع CP في حين الوجه المتابعة (الخطوة 1.8)، ونحن تقليل تشكيل فقاعات بين CP والطابع. ثم يتم عكس الطابع على طبقة من CP واحتضانه لمدة ساعة واحدة. يضمن هذا الوقت الطويل للحضانة أن كل قسم من الطوابع مبلل. ثانياً، يمكن أن تكون عملية إزالة CP الزائدة قبل ختم على شريحة زجاجية نظيفة (الخطوة 1.11) غير متناسقة. أثناء تنفيذ الخطوة 1.11، يجب فحص الطابع بعناية. عندما يبدأ النمط في أن يصبح مرئيًا، يكون الطابع جاهزًا للخطوة 1.12. بالإضافة إلى ذلك، يمكن أن يختلف وقت الفراغ المطلوب لتجفيف الطوابع (الخطوة 1.12). هذا يعتمد في المقام الأول على الطقس. في يوم دافئ ورطب ، مطلوب 2 دقيقة من وقت الفراغ. في يوم بارد وجاف ، 1 دقيقة من وقت الفراغ كافية.
لقد أظهرنا أن العدلات من المتبرعين الأصحاء تشكل أسراب مستقرة حول مجموعات الجسيمات الحيوية. مع المجهر الفلوري الفاصل بين الوقت، يمكننا قياس حجم سرب وتتبع الهجرة العدلات، والتي تمكننا من تحليل الضريبة الكيميائية العدلات كميا5. على سبيل المثال، لقد أظهرنا سابقاً أن هذه المنصة يمكن استخدامها لحساب مؤشر التكتيك الكيميائي (CI، جيب الزاوية بين متجه سرعة العدلات ومتجه الموضع بين العدلات وأقرب مجموعة من الجسيمات الحيوية)، والسرعة (المسافة التي يسافر بها العدلات مقسومًا على الزمن)، والسرعة الشعاعية (السرعةمضروبة في CI)، والمسافة الإجمالية المقطوعة (الفرق بين موضع العدلات الأولي والنهائي) للوحدة المهاجرة الفردية على عكس معظم الدراسات المختبرية24،25،26، لا تحتوي منصتنا على تدرج كيميائي اصطناعي ، لذلك فإن الاتصالات بين الخلايا العدلات هي القوة الدافعة الوحيدة لهجرة العدلات. بالإضافة إلى ذلك ، يمكن الوصول بسهولة إلى الـ supernatant المتولدة عن العدلات المحتشدة. يمكننا جمع وتحليل supernatant للوسطاء بين الخلايا التي تطلقها العدلات دون تدخل من أنواع الخلايا الأخرى الموجودة في الجسم الحي. لوحظ 16 بروتينا ً يمكن وصف تعبيرها أثناء الإحتباس بأنه واحد من ثلاثة اتجاهات: الزيادة (10 بروتينات) ، والنقصان (بروتينان) ، والارتفاع (أربعة بروتينات). أكدت ستة من هذه البروتينات الاتجاهات المبلغ عنها سابقا خلال يحتشدون مع مرور الوقت5. وقد تبين سابقا أن بعض البروتينات المحددة كانت تُحشّد على نحو محدد، في حين تم التعبير عن بروتينات أخرى بشكل تفاضلي من خلال تنشيط العُلمات غير المحتشدة5. من المرجح أن ترتبط البروتينات التي تزيد في التركيز بمرور الوقت بالاستجابة المؤيدة للالتهاب. ومن المعروف بالفعل أن بعض البروتينات التي تزيد في التركيز مع مرور الوقت تشارك في الاستجابة المؤيدة للالتهابات (على سبيل المثال، جاليكون-3 وMMP-9)27،28. العلاقة بين البروتينات الأخرى والالتهاب هو أقل فهما جيدا. قد تشارك البروتينات التي ترتفع أو تنخفض أثناء الإحتلال في تنظيم الالتهاب. ومع ذلك، من الضروري إجراء مزيد من البحوث لفهم الدور في التهاب العديد من البروتينات التي يتم التعبير عنها بشكل تفاضلي أثناء الحشود. تحليل الوسطاء المفرج عنهم جنبا إلى جنب مع الهجرة العدلات يمكن أن تساعدنا على فهم أفضل للصورة المعقدة للالتهاب وكيف تؤثر العدلات على الأنسجة المحيطة بها أثناء الحشود.
في الدراسات المستقبلية، يمكن استخدام منصتنا لدراسة شاملة لقدرة العدلات غير الصحية على توليد أسراب مستقرة حول مجموعات الجسيمات الحيوية المنقوشة. وقد ارتبطت الظروف الطبية المختلفة إلى العدلات، بما في ذلك الإنتان3،الصدمة6،والسرطان1،8،17،18،مما يشير إلى العدلات في هؤلاء المرضى قد تغيرت وظيفة. يمكن استخدام هذه المنصة لدراسة الاختلافات بين الوسطاء بين الخلايا التي تطلقها العدلات الصحية وغير الصحية. بالإضافة إلى ذلك ، يمكن تعديل هذه المنصة لنمط الميكروبات الحية واستخدامها لتحليل استجابة العدلات للميكروبات الحية في المختبر.
في الختام ، قمنا بتطوير منصة جديدة لتحليل العدلات يحتشدون في المختبر. طبيعة التحكم فيها للغاية من منصتنا يسمح لنا للتخفيف من القضايا التي تنشأ خلال التجارب في مجال العدلات في الجسم الحي. العدلات يحتشدون على ميكرور الجسيمات الحيوية قابلة للقياس الكمي بسهولة عن طريق المجهر الفلوري الفاصل بين الوقت. بالإضافة إلى ذلك، يمكننا جمع الوسطاء المفرج عنهم من قبل العدلات دون تدخل الأنسجة الأخرى الموجودة في الجسم الحي. يمكن استخدام هذه المنصة في الأبحاث المستقبلية لتحديد الاختلافات بين سلوكيات الهجرة من العدلات من المتبرعين الأصحاء وغير الأصحاء.
Disclosures
ولا يعلن صاحبا البلاغ أي تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل بتمويل من قسم ويليام ج. لوري للهندسة الكيميائية والجزيئية الحيوية ومركز السرطان الشامل في جامعة ولاية أوهايو. جاءت البيانات الواردة في هذا التقرير من الصور التي تمت معالجتها باستخدام Imaris x64 (ver. 9.3.0 Bitplane) المتاحة في مرفق المجهر والتصوير في الحرم الجامعي ، جامعة ولاية أوهايو. ويدعم هذا المرفق جزئيا من قبل منحة P30 CA016058، المعهد الوطني للسرطان، Bethesda، دكتوراه في الطب.
Materials
| Name | Company | Catalog Number | Comments |
| "The Big Easy" EasySep Magnet | STEMCELL Technologies | 18001 | Magnet to use with neutrophil isolation kit |
| Cell Incubator | Okolab | 777057437 / 77057343 | Okolab cage incubator for temperature and CO2 control |
| EasySep Human Neutrophil Isolation Kit | STEMCELL Technologies | 17957 | Kit for immunomagnetic negative selection of human neutrophils |
| Eclipse Ti2 | Nikon Instruments | MEA54010 / MEF55037 | Inverted research microscope |
| Escherichia coli (K-12 strain) BioParticles Texas Red conjugate | Invitrogen | E2863 | Bioparticle powder, dissolve in water prior to addition to Zetag® array |
| Harris Uni-Core 8-mm biopsy punch | Sigma Aldrich | Z708925 | To cut PDMS stamps |
| HetaSep | STEMCELL Technologies | 7906 | Erythrocyte aggregation agent for separating buffy coat from red blood cells in fresh human blood |
| Hoechst 33342 | Life Technologies | H3570 | Nucleus fluorescent stain |
| Human L1000 Array | Raybiotech Inc. | AAH-BLG-1000-4 | High density array to detect 1000 human proteins |
| Human Serum Albumin (HSA) | Sigma Aldrich | A5843 | Low endotoxin HSA, to prepare 2 % solutions in IMDM for isolated neutrophils |
| Iscove's Modified Dulbeccos' Medium (IMDM) | Thermo Fisher Scientific | 12440053 | To resuspend isolated neutrophils |
| K2-EDTA tubes | Thermo Fisher Scientific | 02-657-32 | Tubes for blood collection |
| Low Reflective Chrome Photomask | Front Range Photomask | N/A | Dimensions 5" x 5" x 0.09" (L x W x D) |
| Microarray Scanner | Perkin Elmer | ASCNGX00 | Fluorescence reader of protein patterned microdomains |
| Microscopy Image Analsysis Software - Imaris | Bitplane | 9.3.0 | Software for automatic cell tracking analysis |
| NiS Elements Advanced Research Software Package | Nikon Instruments | MQS31100 | Software for automatic live cell imaging and swarm size calculation |
| Poly-L-lysine fluorescein isothiocyanate (PLL-FITC) | Sigma Aldrich | P3069-10MG | 30,000 - 70,000 MW PLL labeled with FITC, used to fluorescently label CP solution |
| SecureSeal 8-well Imaging Spacer | Grace Bio-Labs | 654008 | 8-well, 9-mm diameter, adhesive imaging spacer |
| Silicon Wafer | University Wafer | 590 | Silicon 100 mm N/P (100) 0- 100 ohm-cm 500 μm SSP test |
| Spin Coater | Laurell | WS-650MZ-23NPPB | Used to spincoat a 40-µm layer of photoresist onto silicon wafer |
| SU-8 2025 | MicroChem | 2025 | Negative photoresist to make silicon master wafer |
| SU-8 Developer | MicroChem | Y020100 | Photoresist developer. Remove non-crosslinked SU-8 2025 from silicon wafer |
| Sylgard 184 (polydimethylsiloxane, PDMS) | Dow | 1673921 | 2-part silicone elastomer kit for making microstamps and PDMS wells |
| UV Exposure Masking System | Kloé | UV-KUB 2 | Used to crosslink photoresist on silicon wafer through chrome mask with UV light |
| Water | Thermo Fisher Scientific | A1287303 | High quality water to dilute bioparticles |
| Zetag 8185 | BASF | 8185 | Cationic polyelectrolyte (CP), powder, Copolymer of acrylamide and quaternized cationic monomer, forms "inking solution" for microstamping when dissolved in water |
| Zymosan A S. cerevisiae BioParticles Texas Red conjugate | Invitrogen | Z2843 | Bioparticle powder, dissolve in water prior to addition to Zetag array |
References
- Coffelt, S. B., Wellenstein, M. D., de Visser, K. E. Neutrophils in cancer: neutral no more. Nature Reviews Cancer. 16 (7), 431-446 (2016).
- Jones, C. N., et al. Microfluidic Platform for Measuring Neutrophil Chemotaxis from Unprocessed Whole Blood. Journal of Visualized Experiments. (88), 1-6 (2014).
- Ellett, F., et al. Diagnosis of sepsis from a drop of blood by measurement of spontaneous neutrophil motility in a microfluidic assay. Nature Biomedical Engineering. 2, 207-214 (2018).
- Malawista, S. E., Chevance de Boisfleury, A., Naccache, P. H. Inflammatory Gout: Observations over a Half-Century. The FASEB Journal. 25 (12), 4073-4078 (2011).
- Reátegui, E., et al. Microscale arrays for the profiling of start and stop signals coordinating human-neutrophil swarming. Nature Biomedical Engineering. 1 (7), 1-12 (2017).
- Morgan, A. S. Risk factors for infection in the trauma patient. Journal of the National Medical Association. 84 (12), 1019-1023 (1992).
- Szczerba, B. M., et al. Neutrophils escort circulating tumour cells to enable cell cycle progression. Nature. 566, 553-557 (2019).
- Treffers, L. W., Hiemstra, I. H., Kuijpers, T. W., van den Berg, T. K., Matlung, H. L. Neutrophils in cancer. Immunological Reviews. 273, 312-328 (2016).
- Grayson, P. C., Kaplan, M. J. At the Bench: Neutrophil extracellular traps (NETs) highlight novel aspects of innate immune system involvement in autoimmune diseases. Journal of Leukocyte Biology. 99 (2), 253-264 (2016).
- Lämmermann, T. In the eye of the neutrophil swarm--navigation signals that bring neutrophils together in inflamed and infected tissues. Journal of Leukocyte Biology. 100 (1), 55-63 (2016).
- Kienle, K., Lämmermann, T. Neutrophil swarming: an essential process of the neutrophil tissue response. Immunological Reviews. 273 (1), 76-93 (2016).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Lämmermann, T., et al. Neutrophil swarms require LTB4 and integrins at sites of cell death in vivo. Nature. 498 (7454), 371-375 (2013).
- Kreisel, D., et al. In vivo two-photon imaging reveals monocyte-dependent neutrophil extravasation during pulmonary inflammation. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18073-18078 (2010).
- Coombes, J. L., Robey, E. A. Dynamic imaging of host-pathogen interactions in vivo. Nature Reviews Immunology. 10 (5), 353-364 (2010).
- Lämmermann, T. Cell migration: Arraying neutrophils in swarms. Nature Biomedical Engineering. 1 (7), 1-2 (2017).
- Powell, D. R., Huttenlocher, A. Neutrophils in the Tumor Microenvironment. Trends in Immunology. 37 (1), 41-52 (2016).
- Uribe-querol, E., Rosales, C. Neutrophils in Cancer: Two Sides of the Same Coin. Journal of Immunology Research. 2015, (2015).
- Underhill, D. M., Ozinsky, A. Toll-like receptors: Key mediators of microbe detection. Current Opinion in Immunology. 14 (1), 103-110 (2002).
- Netea, M. G., Van Der Meer, J. W., Kullberg, B. J. Recognition of fungal pathogens by toll-like receptors. Immunology of Fungal Infections. , 259-272 (2007).
- Thomas, C. J., Schroder, K. Pattern recognition receptor function in neutrophils. Trends in Immunology. 34 (7), 317-328 (2013).
- Prince, L. R., Whyte, M. K., Sabroe, I., Parker, L. C. The role of TLRs in neutrophil activation. Current Opinion in Pharmacology. 11 (4), 397-403 (2011).
- Tan, S. Y., Weninger, W. Neutrophil migration in inflammation: intercellular signal relay and crosstalk. Current Opinion in Immunology. 44, 34-42 (2017).
- Menezes, G. B., Rezende, R. M., Pereira-Silva, P. E. M., Klein, A., Cara, D. C., Francischi, J. N. Differential involvement of cyclooxygenase isoforms in neutrophil migration in vivo and in vitro. European Journal of Pharmacology. 598 (1-3), 118-122 (2008).
- Afonso, P. V., et al. LTB4 Is a Signal-Relay Molecule during Neutrophil Chemotaxis. Developmental Cell. 22 (5), 1079-1091 (2012).
- Gounni, A. S., et al. In Vivo Regulates Neutrophil Migration In Vitro and Chemorepellent Semaphorin 3E Negatively Chemorepellent Semaphorin 3E Negatively Regulates Neutrophil Migration In Vitro and In Vivo. The Journal of Immunology. 198, 1023-1033 (2017).
- Dumic, J., Dabelic, S., Flögel, M. Galectin-3: An open-ended story. Biochimica et Biophysica Acta - General Subjects. 1760 (4), 616-635 (2006).
- Padmanabhan Iyer, R., et al. Matrix metalloproteinase-9-dependent mechanisms of reduced contractility and increased stiffness in the aging heart. Proteomics - Clinical Applications. 10 (1), 92-107 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved