Method Article
人体神经细胞在体外热的化学和分子分析的生物粒子微阵列
摘要
该协议生成生物粒子微阵列,提供空间控制的嗜中性粒细胞群。它便于接触嗜中性粒细胞在迁移过程中释放的介质,并允许定量成像分析。
摘要
中性粒细胞群是一个合作的过程,通过它,嗜中性粒细胞封闭一个感染部位,并促进组织重组。在动物模型中,在动物模型中对蜂拥性进行了经典的研究,显示了细胞迁移的特征模式。然而,在体内模型有几个限制,包括细胞间介质难以访问和分析,以及无法直接分析人类嗜中性粒细胞。由于这些限制,需要一个体外平台,研究蜂拥与人类嗜中性粒细胞,并提供容易访问在蜂群生成分子信号。在这里,一个多步骤的微冲过程用于生成生物粒子微阵列,通过模仿体内感染来刺激蜂群。生物粒子微阵列以可控、稳定的方式诱导嗜中性粒细胞成群。在微阵列上,嗜中性粒细胞在生物粒子簇周围增加速度并形成稳定的群。此外,对嗜中性粒细胞产生的上清液进行了分析,发现16种蛋白质在蜂群过程中表达得不同。这个体外蜂群平台有助于以可重复的空间控制方式直接分析中性粒细胞迁移和蛋白质释放。
引言
中性粒细胞,血流中最丰富的白细胞1,正在获得关注作为潜在的诊断和治疗目标2,3,因为他们可能涉及各种医疗条件,包括痛带4,败血症3,创伤5,6,癌症1,7,8和各种自身免疫性疾病5,9。中性粒细胞群是一个多阶段,严格监管的过程,其复杂性使它成为研究5,10,11特别有趣的焦点。在蜂拥而至期间,嗜中性粒细胞从周围的健康组织5、10、11分离出炎症部位。正确调节嗜中性粒细胞蜂群对于促进伤口愈合并最终解决炎症决议5,12是必要的。中性粒细胞群主要研究啮齿动物12,13,14,15和斑马鱼10,11,12,15模型在体内。然而,这些体内动物模型的性质引起限制5。例如,在蜂群中由嗜中性粒细胞释放的介质不容易被分析5。此外,在体内有许多潜在的中介,因此体内实验必须引入基因缺陷来抑制细胞生产和/或相互作用,以调查该中介在给定过程中的作用13。体外实验通过启用中性粒细胞观察来规避这种并发症,而无需额外的细胞上下文。此外,描述人类中性粒细胞协调迁移的研究也有限。在体外蜂群平台上,可以直接分析人类嗜中性粒细胞。体外蜂群平台可以通过提供机会来填补体内研究的局限性所留下的空白,从而扩大从体内研究中获得的知识。
为了满足对模仿体内嗜中性粒细胞群的体外平台的需求,我们开发了一个微冲压平台,使我们能够以空间控制的方式对生物粒子微阵列进行阵列,以刺激嗜中性粒细胞蜂群。我们分两步在玻璃玻片上生成生物粒子微阵列。首先,我们使用微冲压来生成阳离子聚电解质 (CP) 位微阵列。其次,我们添加通过静电相互作用粘附在CP点的生物粒子溶液。通过首先对CP层进行图案化,我们可以有选择地对带负电荷的生物粒子进行模式化,以生成所需的中性粒细胞蜂群模式。带正电荷的层通过剧烈的洗涤步骤将生物粒子从玻璃滑道上没有CP的区域移除。 此外,这里使用的CP,丙烯酰胺和四元阳离子单体的共聚物,具有生物相容性,因此不会引起中性粒细胞的反应。它具有非常高的表面电荷,使微米大小的生物颗粒固定到玻璃滑动,从而阻止嗜中性粒从玻璃滑轨上的图案位置去除颗粒。这导致生物粒子簇排列在微阵列中。当我们在微阵列中加入嗜中性粒细胞时,它们在生物粒子簇周围形成了稳定的群。通过跟踪中性粒细胞迁移,我们发现成群的中性粒细胞会主动向生物粒子簇迁移。此外,我们利用这个平台分析中性粒细胞在蜂拥过程中释放的某些介质。我们发现16个调解员在蜂拥而至时表达不同。随着时间的推移,它们的浓度遵循三个总趋势:增加、减少或峰值。我们的体外中性粒细胞蜂群平台有助于分析空间控制的人类嗜中性粒细胞蜂群,以及收集和分析由嗜中性粒细胞蜂群释放的介质。在以前的出版物中,我们证明了患有某些医疗条件(创伤、自身免疫性疾病和败血症)的患者,其功能与健康捐赠者不同。在未来的研究中,我们的平台可用于分析各种患者群体中的中性粒细胞功能。该平台可以定量分析中性粒细胞群中涉及的复杂协调。可以进行其他研究,以深入了解特定患者群体的嗜中性粒细胞功能或对感兴趣的病原体的嗜中性粒细胞反应。
研究方案
作者感谢健康的志愿者谁亲切地献血。根据俄亥俄州立大学生物医学科学委员会审查的机构审查委员会(IRB)协议#2018H0268知情的志愿者同意后,获得血液标本。
1. 生物粒子微阵列的微观制造
- 使用标准光刻程序,生成主硅晶圆。
- 使用计算机辅助设计 (CAD) 软件生成所需设计的证明,然后发送给照片蒙版制造商以生成镀铬照片蒙版。此处采用的设计是 4 mm x 4 mm 矩形阵列,直径为 30 μm,以 150 μm 中心到中心间距填充圆形。此设计可根据需要针对不同的应用进行修改。
- 将40微米厚的负光胶层剥离到硅晶片上。在 65°C 下烘烤晶圆 5 分钟,95°C 烘烤 10 分钟。
- 通过 150*160 mJ/cm2的镀铬光掩膜将晶圆暴露在紫外线下(图 1A)。
- 在65°C下烘烤晶圆5分钟,95°C烘烤10分钟。将晶圆浸入光刻胶显影剂中10分钟,然后用等丙醇冲洗。在此阶段,图案应在晶圆上可见 (图 1B)。
- 彻底混合10:1比例的聚二甲基硅氧烷预聚物及其固化剂(即20克预聚物和2克固化剂),并将未固化的二甲基硅氧烷(PDMS)混合物倒在培养皿中的主晶圆上(图1C)。
- 真空处理未固化的 PDMS 混合物,直到主晶圆上不存在气泡。在65°C过夜。
- 使用手术刀切割晶圆图案部分的外部,并缓慢取出固化的 PDMS 板。将 PDMS 板放在一个干净的切割板上,带图案的侧朝上(图 1D)。
- 用 8 mm 活检冲孔从 PDMS 板中冲出单个图章(图 1E)。对于一张玻璃幻灯片,需要八枚邮票。
- 将每个戳面朝下放在胶带上,以清除任何碎屑。
- 提前制备水中1.6mg/mL的CP溶液。
- 将适当数量的 CP 粉末加入水中(例如,0.8 g 至 500 mL)。
- 在室温下搅拌板过夜,或直到所有固体溶解入水中。CP溶液可在室温下储存6个月。
- 如果需要,通过添加标有荧光素等位子(PLL-FITC)的聚L-流生素使CP溶液荧光。
- 与CP溶液的10 mL的比分。在配号体积中加入少量的PLL-FITC(0.05mg)。可以改变量,根据需要调整荧光的亮度。
- 涡旋 CP 溶液标有 FITC 20 s,或直到溶液均匀浅黄色。防光,在4°C下存放长达1个月。
- 与邮票正面朝上,黄金每枚邮票与100 μL 1.6毫克/mL的CP溶液,确保CP溶液和邮票之间没有气泡形成(图1F)。
- 将图邮票反转到 CP 溶液层上 (图 1G)。
- 1 小时后从 CP 解决方案中删除图章。
- 将每个湿邮票正面朝下涂抹在干净的玻璃幻灯片上 6-8 倍,以去除多余的液体。
- 真空处理邮票1⁄2分钟。
- 将直径为 9 mm 的 8 个井成像垫片粘在干净的玻璃滑片顶部,作为邮票放置的指南。有了这个垫片,每个玻璃滑块可以有八个微阵列。
- 将邮票正面朝下放在成像垫片每个井中心的玻璃滑块上(即,总共使用八枚邮票)。
- 在每个邮票顶部放置一个 5.6 × 0.1 g 的平衡重量,并留出 10 分钟进行冲压(图 1H)。需要平衡的重量,以确保将戳件均匀地压在玻璃玻片上,并促进 CP 均匀地传输到玻璃滑块。
- 从玻璃滑块上取下重量和图章(图1I)。如步骤 1.17 所述,在添加生物颗粒之前,让 CP 层在室温下干燥 24 小时。如果 CP 被标记为 FITC,此时可以使用 488 nm 的荧光显微镜检查冲压的有效性,然后再继续执行步骤 1.17(图 1M)。
- 将空白 PDMS 板切割到成像间隔器的大小,并使用 8 mm 活检冲孔在 PDMS 中创建与成像垫片孔对齐的孔。使用成像垫片将 PDMS 板粘附到玻璃滑块上(图 1J)。
- 解冻生物颗粒溶液(如大肠杆菌或酶),并稀释至500微克/mL水中注射(WFI)。
注:生物颗粒不需要进行菌落。嗜中性粒表面受体直接识别这些生物粒子19、20、21上的分子。 - 在玻璃幻灯片上为每个 PDMS 打好生物颗粒溶液添加 100 μL (图 1K)。
- 摇动玻璃滑块 30 分钟。
- 用水彻底冲洗水井。生物粒子微阵列可在4°C的无尘环境中储存长达3个月。此时,应在步骤 2.1(图 1N)之前,使用 594 nm 处的荧光显微镜检查图案。
2. 样品制备
- 从所需的供体中收集K2-EDTA管中至少2 mL的新鲜血液。中性粒细胞的预期产量为1⁄2 x 106细胞/1 mL全血。成像测定需要大约 1.5 x 105个嗜中性粒细胞,而对上清液的分析需要 1 x 106嗜中性粒细胞。在4小时内使用血液。
- 通过在全血中添加1:5的比例的红细胞聚集剂来分离红血球(RBCs)。等待 45 分钟,让半透明层(布漆涂层)与 RBC 层分离。
- 取下布洗涂层,用磷酸盐缓冲盐水 (PBS) 使用 1 mL 布漆:9 mL PBS。
- 在 190 x g和 20 °C 下离心 5 分钟。
- 吸气上清液,在5 x 107细胞/mL处重新悬浮颗粒。
- 使用负免疫磁选择试剂盒分离嗜中性粒细胞。
- 加入50μL抗体鸡尾酒/1 mL细胞悬浮液。等待 10 分钟。
- 加入100μL的磁珠/1 mL细胞悬浮液。等待 10 分钟。
- 将电池悬浮液添加到圆底管中,并放入圆柱形磁铁中。等待 10 分钟。
- 将上清液倒入离心管中。加最多 10 mL 的 PBS。在 190 x g和 20 °C 下离心 5 分钟。
- 吸气上清。用0.4%人血清白蛋白在IMDM中重新悬浮白颗粒。
- 在37°C下,用20μg/mL Hoechst 33342染色核10分钟。
- 加入5 mL的IMDM与0.4%人血清白蛋白冲洗。在 190 x g和 20 °C 下离心 5 分钟。
- 在IMDM中以7.5 x 105细胞/mL与0.4%人血清白蛋白重新悬浮细胞。
- 将100μL的细胞悬浮液添加到含有生物粒子微阵列的PDMS孔中。确保电池悬架在 PDMS 顶部凸过,且不包含任何气泡。
- 具有 12 mm 直径盖玻片的密封件。用直径为 12 mm 的盖玻片盖住 PDMS 井的开口。用钳子轻轻按压盖玻片,使多余的细胞悬架逃逸到井边。使用组织去除多余的细胞悬浮液。
3. 运行测定和图像分析
- 在活细胞成像站上加载带有细胞的微粒阵列,显微镜配有设置为37°C、5%CO2和90%相对湿度的笼式培养箱。
- 使用延时荧光和明场显微镜在 405 nm、594 nm 和明场以每 10 s 的放大倍数 10 倍的速度记录图像。在典型的实验中,图像被收集长达 2 小时。
- 使用自动细胞跟踪软件跟踪单个嗜中性粒细胞向生物粒子簇的迁移。
- 使用现场检测单元跟踪软件的自动回归模式。将点半径设置为 5 μm(嗜中性粒细胞核的近似大小)。将最小轨道长度设置为 120 s 和一帧的最大间隙大小。
- 从细胞跟踪软件生成的数据中提取包含嗜中性粒细胞位置和速度的文件。这些文件可与图形软件一起使用,分别生成中性粒细胞迁移轨迹(图2C)和速度与时间的热图(图2D)。
- 使用 405 nm 荧光图像在您选择的图像分析软件上跟踪群的体积随时间而增加。
- 定义每个生物粒子簇周围感兴趣的区域 (ROIs),其中嗜中性粒细胞会蜂拥而至。保持相同大小的 ROI,以分析每个生物粒子簇。
- 分析每个 ROI 内 405 nm 图像随时间之年的平均荧光强度。
- 通过以从 0 μm2到最大群大小的各种群大小进行手动测量,生成平均荧光强度到群大小的校准曲线。使用此校准可计算随时间而显示的群大小。
4. 上清液收集和蛋白质检测
- 在含有生物粒子微阵列的井中孵育嗜中性粒,在37°C和5%CO2孵育3小时。在所需时间点采集样本。通常,样品将在 0、0.5、1 和 3 小时采集。为了克服蛋白质阵列检测的极限,每个时间点都使用单口(200 μL)的上清液全体积。每个时间点都以三元分析。
- 使用明场显微镜,验证在微阵列上形成群。
- 用200μL移液器吸气上清液,并加载在0.45μm离心滤管中。
- 将上清液在190 x g和20°C下离心5分钟,并收集过滤体积。
- 将样品储存在-80°C,直到处理时间。
- 使用微阵列试剂盒检测一系列人类蛋白质以处理样品。
- 将每个样品的200μL添加到套件随附的独立透析管中。
- 将透析管放入含有至少 500 mL PBS(pH = 8.0)的烧杯中。在 4°C 下轻轻搅拌搅拌搅拌板至少 3 小时。更改烧杯中的 PBS 并重复此步骤。
- 将每个样品转移到清洁的离心管和离心机在9,000 x g下5分钟,以去除任何沉淀物。将每个上清液转移到干净的管中。
- 通过在透析样品中每1mg总蛋白试剂盒中加入36μL的1x标记试剂,将每个样品的生物素化到180μL的透析样品。在20°C孵育30分钟,每5分钟轻轻混合一次。
- 将套件随附的 3 μL 停止溶液添加到每个样品管中。将每个样品转移到新的透析管中,并重复步骤 4.6.2~4.6.3。在此阶段,样品可以储存在-20°C或-80°C,直到您准备好继续。
- 套件随附的玻璃滑块存储在 -20°C。允许它进入室温。将组装的玻璃滑块置于层状流量罩中 1⁄2 小时,在室温下。
- 将套件随附的阻塞缓冲液 400 μL 添加到组装玻璃滑片的每个井中。在室温下孵育30分钟。
- 在 9,000 x g下将制备的样品离心 5 分钟,以去除沉淀物或微粒。用阻塞缓冲液稀释5倍。
- 从每个井中取出阻塞缓冲区。将400μL的稀释样品加入适当的井中。在室温下孵育2小时,同时摇动。
- 从每个井中抽取样品。用1x洗涤缓冲液的800 μL清洗3次,我在室温下随套件一起摇动5分钟。
- 在干净的容器中,将组装的玻璃滑块浸入 1x 洗涤缓冲液 I. 在室温下,在摇动时每次洗涤 2 分钟。
- 在每个子阵列中加入400 μL的1x Cy3结合链球菌。用塑料胶条盖住。在协议的剩余部分保护免受光线照射。
- 在室温下孵育2小时,同时摇动。
- 将溶液分解,从样品室中拆解玻璃滑块。
- 在套件随附的 30 mL 离心管中,小心地添加玻璃滑块和足够的 1x 洗涤缓冲液 I 以覆盖玻璃滑片。在室温下,摇动时,每洗3次10分钟。
- 在30 mL离心管中,在摇动时,用1x洗涤缓冲液II清洗2次,每次5分钟。
- 用 30 mL ddH2O 清洗玻璃滑块 5 分钟,从离心管中取出玻璃滑块,在层流罩中干燥 20 分钟。准备好的玻璃滑块可储存在-20°C,直到准备扫描。
- 在荧光发射 555 nm 时,使用微阵列扫描仪扫描玻璃滑块。
结果
当中性粒细胞添加到生物粒子微阵列中时,接触生物粒子簇的嗜中性粒细胞被激活并启动聚集反应。生物粒子微阵列使用延时荧光显微镜进行验证,以跟踪中性粒细胞向生物粒子簇的迁移(视频S1)。单个嗜中性粒细胞核在向生物粒子簇迁移时被跟踪。当嗜中性粒细胞到达生物粒子簇时,其核与星团中的其他核重叠。因此,无法使用此方法准确跟踪群集中的嗜中性粒细胞。日莫桑和大肠杆菌生物粒子簇都导致中性粒群的产生。对于我们的结果,图2B使用来自大肠杆菌颗粒产生的中性粒群的数据。图3和图2的其他面板使用由酶粒子生成的中性粒群。结果表明,当中性粒细胞接触该簇时,生物粒子簇会刺激中性粒细胞活化,最终导致在30-60分钟后在每个簇周围形成稳定的中性粒细胞群(图2A,上图)。相比之下,在缺乏生物粒子簇的情况下,嗜中性粒细胞没有显示集体迁移(图2A、底部和视频S2)。利用405nm染色嗜中性粒细胞核的荧光强度,发现直径约30微米的大肠杆菌生物粒子团的平均中性粒细胞群大小为1,490~680μm2(均值= SD,图2B,顶部)。不存在生物粒子簇的给定区域的荧光强度随时间大致相同,这证实了此设置中不存在集体迁移(图 2B,底部)。中性粒细胞迁移轨迹显示,当一个在存在时,嗜中性粒细胞聚集在生物粒子簇上(图2C,上图)。相反,在控制系统中未观察到收敛(图2C,底部)。测量了蜂群和非活性中性粒细胞的速度(距离/时间),并发现速度分布的统计显著性差异(ANOVA,p <0.0001),如图2D所示。 蜂群嗜中性粒细胞的平均速度为20.6~13.0 μm/min(均值= SD),对照中性粒细胞的平均速度为2.0~2.2μm/分钟。
此外,还分析了中性粒细胞在聚集过程中释放的16种蛋白质的浓度(图3)。计算了在蜂群过程中不同时间点(t = 0、0.5、1 和 3 h)中每种蛋白质的标准化浓度,其中归一化浓度为 (C = Cmin)/ (C最大值= C分钟)。10种蛋白质在蜂群中浓度增加。这些蛋白质是阿地平、加莱克丁-3、GROa、IL-6R、MIP-1a、MMP-8、MMP-9、尼多根-1、TIMP-1和TLR2。两种蛋白质(Pentraxin 3 和 RANK)在整个蜂群中浓度下降。其余四种蛋白质(聚类、PF4、RANTES和Trappin-2)在蜂拥的第一个小时增加,但随后减少。换句话说,这些蛋白质的浓度在蜂拥过程中"峰值"。在已鉴定的16种蛋白质中,有12种蛋白质是在我们上一份出版物5中鉴定的。阿迪普辛、加列克辛-3、尼多根-1、Pentraxin 3、TIMP-1和TLR2被证明是蜂群特异性的,而聚类素、IL-6R、MMP-8和MMP-9、RANK和陷阱针-2不是5。

图1:生物粒子微阵列的生产。涂有负光胶的硅晶片通过镀铬光掩膜(A) 暴露在紫外线下。硅晶片烘焙和开发后,硅晶片表面仍留有光刻胶图案。这是主晶圆 (B).在培养皿中,PDMS 混合物被添加到主晶圆的顶部。PDMS 在 65°C 下一夜之间固化,形成 PDMS 模具 (C)。PDMS 模具从主晶圆切割,活检冲孔用于冲孔单个 PDMS 图章 (D)。PDMS 标记 (E) 涂有 CP 溶液 (F) 。邮票倒置到一层薄薄的CP溶液(G)上。在CP溶液中孵育1小时后,邮票被印在玻璃玻片上,以去除多余的CP。 八枚邮票然后被压在一个净玻璃幻灯片上,重量为5.6 ×0.1克,与成像垫片(H)对齐。删除图章时,CP 模式将保留 (I)。带预切井的 PDMS 板粘附在玻璃滑块 (J) 上。然后,在CP模式(K) 上添加生物粒子溶液。带负电荷的生物粒子通过静电相互作用与带正电荷的聚电解质结合。多余的生物颗粒溶液被冲走,留下生物粒子图案在CP模式(L) 的顶部。(M) 标有 FITC 的 CP 层的荧光图像(刻度条 = 50 μm,大图像;刻度条 = 25 μm,内设)。(N) 与德州红相联的花纹酶生物粒子的荧光图像(刻度条 = 100 μm,大图像;刻度条 = 50 μm,内设)。请点击此处查看此图的较大版本。

图2:在生物粒子簇周围生长的中性粒群。在生物粒子簇的存在中,嗜中性粒细胞会向生物粒子簇(底部,控制嗜中性粒细胞)进行集体迁移。当没有生物粒子时,嗜中性粒细胞不进行集体迁移。(A) 在酶生物粒子簇的存在下,嗜中性粒细胞在30分钟内形成群。如果没有生物粒子簇,不会形成群形(刻度条 = 50 μm)。(B) 中性粒群平均大小为 1,490 ~ 680 μm2 (均值 = SD),直径约 30 μm大肠杆菌生物粒子簇。对照中性粒细胞表现出与无蜂生长相对应的恒定密度(ANOVA,p <0.0001,n = 32中性粒细胞群,N = 1个供体,误差条 + 标准偏差)。 (C) 聚集的嗜中性粒细胞的轨迹收敛在酶生物粒子簇上,而对照中性粒细胞则显示没有收敛点(刻度条 = 50 μm)。(D) 嗜中性粒细胞蜂拥至 zymosan 目标的平均速度为 20.6 ± 13.0 μm/min (均值 = SD),而对照嗜中性粒细胞的平均速度为 2.0 ± 2.2 μm/min。热图上的每个计数表示在给定时间点具有给定瞬时速度的嗜中性粒细胞。这些热图代表一个实验(n = 1 个群;N = 1 个捐赠者;ANOVA, 6,114 = 群育嗜中性粒细胞,32,116 = 对照嗜中性粒细胞,p < 0.0001)。请点击此处查看此图的较大版本。
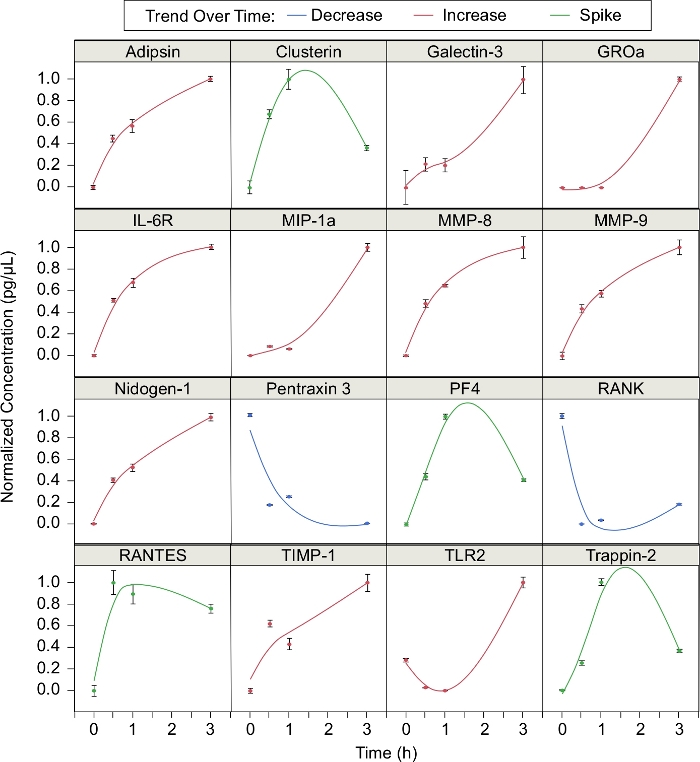
图3:由成群的嗜中性粒细胞释放的自由中介。随着时间的推移,中性粒细胞蜂群会影响各种蛋白质的产生。蛋白质浓度在0、0.5、1和3小时时测量。数据点配有平滑样条线(= = 0.05)。这些蛋白质往往遵循三种特征趋势之一:随时间而减少,随时间增加,或窥探约1小时,然后减少(误差柱 = 标准偏差;n = 3复制;N = 1 个捐赠者)。请点击此处查看此图的较大版本。
视频 S1: 嗜中性粒群向酶生物粒子簇。嗜中性粒细胞核以蓝色显示。Zymosan 目标用红色圆圈标记(刻度条 = 50 μm;原始采集时间 = 60 分钟)。请点击此处下载此视频。
视频 S2:非活化中性粒细胞随机迁移。嗜中性粒细胞核以蓝色显示(刻度条 = 50 μm;原始采集时间 = 60 分钟)。请点击此处下载此视频。
讨论
我们开发了一个微冲压平台,以生成统一的生物粒子阵列,以刺激体外嗜中性粒细胞蜂群。我们的平台的体外性质使我们能够避免在体内蜂群实验产生的并发症,即分析由蜂群嗜中性粒细胞5释放的中介物的能力差。此外,体内模型通常在啮齿动物11,12,13,15,22,23或斑马鱼11,12,15,23。我们的平台使用人类嗜中性粒细胞,这使我们能够更直接地解释我们的结果在人类疾病的背景下,虽然老鼠和人类中性粒细胞之间的某些相似之处已经观察到5,11。此外,我们维护一个空间控制的蜂群环境,通过提供高水平的可重现性,促进分析人类中性粒细胞集体迁移,以及收集和分析由大量嗜中性粒细胞释放的介质,使我们的平台与体内模型区别开来。
在开发微冲压协议期间,出现了一些需要仔细故障排除的挑战。首先,用于微冲压的CP是高度亲水性的,PDMS邮票是疏水性的。由于 CP 对 PDMS 的亲和力不高,我们的程序经过精心设计,以避免气泡的形成并促进润湿。通过在正面朝上(步骤 1.8)时先用 CP 启动图章,我们将 CP 和戳记之间的气泡形成降至最低。然后,邮票倒置到CP层上,孵育1小时。这漫长的孵育时间确保邮票的每一部分都湿润。其次,在冲压干净的玻璃滑块(步骤 1.11)之前去除多余的 CP 的过程可能不一致。执行步骤 1.11 时,必须仔细检查图章。当模式开始变得可见时,图章已准备好执行步骤 1.12。此外,干燥图章所需的真空时间(步骤 1.12)可能会有所不同。这主要取决于天气。在温暖潮湿的天气,需要2分钟的真空时间。在凉爽干燥的一天,1分钟的真空时间就足够了。
我们已经表明,来自健康捐赠者的嗜中性粒细胞在生物粒子簇周围形成稳定的群。通过延时荧光显微镜,我们可以量化群的大小并跟踪中性粒细胞迁移,这使我们能够定量地分析中性粒细胞化学。例如,我们之前已经表明,该平台可用于计算化学战术指数(CI,嗜中性粒细胞速度矢量与中微粒和最近生物粒子簇之间的位置矢量之间的随方),速度(中性粒细胞传播的距离除以时间)、径向速度(速度乘以CI)和单个迁移中性粒细胞位置的总距离(初始和最终嗜中性粒体位置之间的差值)。与大多数体外研究不同,我们的平台没有人工化学梯度,因此中性粒细胞间通信是中性粒细胞迁移的唯一驱动力。此外,由成群的中性粒细胞产生的上清液也很容易获得。我们可以收集和分析中性粒细胞释放的细胞间介质的上清液,不受体内其他细胞类型的干扰。观察到16种蛋白质,其表达在蜂群中可描述为三种趋势之一:增加(10种蛋白质)、减少(2种蛋白质)和尖峰(4种蛋白质)。其中6种蛋白质证实了之前报告的趋势,在蜂拥而至的时间5。一些被识别的蛋白质先前被证明是蜂群特异性的,而其他的蛋白质则由激活的非热灭性中性粒细胞5的不同表达。随着时间的推移,浓度增加的蛋白质可能与亲炎症反应相关。一些随着时间的推移浓度增加的蛋白质已知参与亲炎反应(例如,加莱克辛-3和MMP-9)27,28。其他蛋白质和炎症之间的关系不太清楚。在蜂群中出现或减少的蛋白质可能参与炎症的调节。然而,进一步的研究是必要的,以了解在蜂群中不同表达的许多蛋白质的炎症的作用。分析释放的介质以及嗜中性粒细胞迁移可以帮助我们更好地了解炎症的复杂情况,以及嗜中性粒细胞在蜂群中如何影响周围组织。
在未来的研究中,我们的平台可用于深入研究不健康的嗜中性粒细胞在图案生物粒子簇周围产生稳定群的能力。各种医疗条件都与嗜中性粒细胞有关,包括败血症3、创伤6和癌症1、8、17、18,这表明这些患者中的嗜中性粒细胞可能改变了功能。该平台可用于检查健康、不健康的嗜中性粒细胞释放的细胞间介质之间的差异。此外,该平台可以修改为活微生物模式,并用于分析中性粒细胞对体外活微生物的反应。
总之,我们开发了一种分析体外云友群的新平台。我们的平台的高度可控性使我们能够缓解在体内嗜中性粒细胞蜂群实验中出现的问题。通过延时荧光显微镜,生物粒子微阵列上的中性粒群很容易量化。此外,我们可以收集嗜中性粒细胞释放的介质,而不受体内其他组织的干扰。该平台可用于未来的研究,以量化来自健康和不健康的捐赠者的嗜中性粒细胞迁移行为之间的差异。
披露声明
提交人声明没有利益冲突。
致谢
这项工作得到了威廉·劳里化学和生物分子工程系以及俄亥俄州立大学综合癌症中心的资助。本报告中提供的数据来自使用俄亥俄州立大学校园显微镜和成像设施提供的 Imaris x64(ver. 9.3.0 Bit 平面)处理的图像。该设施部分由国家癌症研究所P30 CA016058资助,贝塞斯达,医学博士。
材料
| Name | Company | Catalog Number | Comments |
| "The Big Easy" EasySep Magnet | STEMCELL Technologies | 18001 | Magnet to use with neutrophil isolation kit |
| Cell Incubator | Okolab | 777057437 / 77057343 | Okolab cage incubator for temperature and CO2 control |
| EasySep Human Neutrophil Isolation Kit | STEMCELL Technologies | 17957 | Kit for immunomagnetic negative selection of human neutrophils |
| Eclipse Ti2 | Nikon Instruments | MEA54010 / MEF55037 | Inverted research microscope |
| Escherichia coli (K-12 strain) BioParticles Texas Red conjugate | Invitrogen | E2863 | Bioparticle powder, dissolve in water prior to addition to Zetag® array |
| Harris Uni-Core 8-mm biopsy punch | Sigma Aldrich | Z708925 | To cut PDMS stamps |
| HetaSep | STEMCELL Technologies | 7906 | Erythrocyte aggregation agent for separating buffy coat from red blood cells in fresh human blood |
| Hoechst 33342 | Life Technologies | H3570 | Nucleus fluorescent stain |
| Human L1000 Array | Raybiotech Inc. | AAH-BLG-1000-4 | High density array to detect 1000 human proteins |
| Human Serum Albumin (HSA) | Sigma Aldrich | A5843 | Low endotoxin HSA, to prepare 2 % solutions in IMDM for isolated neutrophils |
| Iscove's Modified Dulbeccos' Medium (IMDM) | Thermo Fisher Scientific | 12440053 | To resuspend isolated neutrophils |
| K2-EDTA tubes | Thermo Fisher Scientific | 02-657-32 | Tubes for blood collection |
| Low Reflective Chrome Photomask | Front Range Photomask | N/A | Dimensions 5" x 5" x 0.09" (L x W x D) |
| Microarray Scanner | Perkin Elmer | ASCNGX00 | Fluorescence reader of protein patterned microdomains |
| Microscopy Image Analsysis Software - Imaris | Bitplane | 9.3.0 | Software for automatic cell tracking analysis |
| NiS Elements Advanced Research Software Package | Nikon Instruments | MQS31100 | Software for automatic live cell imaging and swarm size calculation |
| Poly-L-lysine fluorescein isothiocyanate (PLL-FITC) | Sigma Aldrich | P3069-10MG | 30,000 - 70,000 MW PLL labeled with FITC, used to fluorescently label CP solution |
| SecureSeal 8-well Imaging Spacer | Grace Bio-Labs | 654008 | 8-well, 9-mm diameter, adhesive imaging spacer |
| Silicon Wafer | University Wafer | 590 | Silicon 100 mm N/P (100) 0- 100 ohm-cm 500 μm SSP test |
| Spin Coater | Laurell | WS-650MZ-23NPPB | Used to spincoat a 40-µm layer of photoresist onto silicon wafer |
| SU-8 2025 | MicroChem | 2025 | Negative photoresist to make silicon master wafer |
| SU-8 Developer | MicroChem | Y020100 | Photoresist developer. Remove non-crosslinked SU-8 2025 from silicon wafer |
| Sylgard 184 (polydimethylsiloxane, PDMS) | Dow | 1673921 | 2-part silicone elastomer kit for making microstamps and PDMS wells |
| UV Exposure Masking System | Kloé | UV-KUB 2 | Used to crosslink photoresist on silicon wafer through chrome mask with UV light |
| Water | Thermo Fisher Scientific | A1287303 | High quality water to dilute bioparticles |
| Zetag 8185 | BASF | 8185 | Cationic polyelectrolyte (CP), powder, Copolymer of acrylamide and quaternized cationic monomer, forms "inking solution" for microstamping when dissolved in water |
| Zymosan A S. cerevisiae BioParticles Texas Red conjugate | Invitrogen | Z2843 | Bioparticle powder, dissolve in water prior to addition to Zetag array |
参考文献
- Coffelt, S. B., Wellenstein, M. D., de Visser, K. E. Neutrophils in cancer: neutral no more. Nature Reviews Cancer. 16 (7), 431-446 (2016).
- Jones, C. N., et al. Microfluidic Platform for Measuring Neutrophil Chemotaxis from Unprocessed Whole Blood. Journal of Visualized Experiments. (88), 1-6 (2014).
- Ellett, F., et al. Diagnosis of sepsis from a drop of blood by measurement of spontaneous neutrophil motility in a microfluidic assay. Nature Biomedical Engineering. 2, 207-214 (2018).
- Malawista, S. E., Chevance de Boisfleury, A., Naccache, P. H. Inflammatory Gout: Observations over a Half-Century. The FASEB Journal. 25 (12), 4073-4078 (2011).
- Reátegui, E., et al. Microscale arrays for the profiling of start and stop signals coordinating human-neutrophil swarming. Nature Biomedical Engineering. 1 (7), 1-12 (2017).
- Morgan, A. S. Risk factors for infection in the trauma patient. Journal of the National Medical Association. 84 (12), 1019-1023 (1992).
- Szczerba, B. M., et al. Neutrophils escort circulating tumour cells to enable cell cycle progression. Nature. 566, 553-557 (2019).
- Treffers, L. W., Hiemstra, I. H., Kuijpers, T. W., van den Berg, T. K., Matlung, H. L. Neutrophils in cancer. Immunological Reviews. 273, 312-328 (2016).
- Grayson, P. C., Kaplan, M. J. At the Bench: Neutrophil extracellular traps (NETs) highlight novel aspects of innate immune system involvement in autoimmune diseases. Journal of Leukocyte Biology. 99 (2), 253-264 (2016).
- Lämmermann, T. In the eye of the neutrophil swarm--navigation signals that bring neutrophils together in inflamed and infected tissues. Journal of Leukocyte Biology. 100 (1), 55-63 (2016).
- Kienle, K., Lämmermann, T. Neutrophil swarming: an essential process of the neutrophil tissue response. Immunological Reviews. 273 (1), 76-93 (2016).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Lämmermann, T., et al. Neutrophil swarms require LTB4 and integrins at sites of cell death in vivo. Nature. 498 (7454), 371-375 (2013).
- Kreisel, D., et al. In vivo two-photon imaging reveals monocyte-dependent neutrophil extravasation during pulmonary inflammation. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18073-18078 (2010).
- Coombes, J. L., Robey, E. A. Dynamic imaging of host-pathogen interactions in vivo. Nature Reviews Immunology. 10 (5), 353-364 (2010).
- Lämmermann, T. Cell migration: Arraying neutrophils in swarms. Nature Biomedical Engineering. 1 (7), 1-2 (2017).
- Powell, D. R., Huttenlocher, A. Neutrophils in the Tumor Microenvironment. Trends in Immunology. 37 (1), 41-52 (2016).
- Uribe-querol, E., Rosales, C. Neutrophils in Cancer: Two Sides of the Same Coin. Journal of Immunology Research. 2015, (2015).
- Underhill, D. M., Ozinsky, A. Toll-like receptors: Key mediators of microbe detection. Current Opinion in Immunology. 14 (1), 103-110 (2002).
- Netea, M. G., Van Der Meer, J. W., Kullberg, B. J. Recognition of fungal pathogens by toll-like receptors. Immunology of Fungal Infections. , 259-272 (2007).
- Thomas, C. J., Schroder, K. Pattern recognition receptor function in neutrophils. Trends in Immunology. 34 (7), 317-328 (2013).
- Prince, L. R., Whyte, M. K., Sabroe, I., Parker, L. C. The role of TLRs in neutrophil activation. Current Opinion in Pharmacology. 11 (4), 397-403 (2011).
- Tan, S. Y., Weninger, W. Neutrophil migration in inflammation: intercellular signal relay and crosstalk. Current Opinion in Immunology. 44, 34-42 (2017).
- Menezes, G. B., Rezende, R. M., Pereira-Silva, P. E. M., Klein, A., Cara, D. C., Francischi, J. N. Differential involvement of cyclooxygenase isoforms in neutrophil migration in vivo and in vitro. European Journal of Pharmacology. 598 (1-3), 118-122 (2008).
- Afonso, P. V., et al. LTB4 Is a Signal-Relay Molecule during Neutrophil Chemotaxis. Developmental Cell. 22 (5), 1079-1091 (2012).
- Gounni, A. S., et al. In Vivo Regulates Neutrophil Migration In Vitro and Chemorepellent Semaphorin 3E Negatively Chemorepellent Semaphorin 3E Negatively Regulates Neutrophil Migration In Vitro and In Vivo. The Journal of Immunology. 198, 1023-1033 (2017).
- Dumic, J., Dabelic, S., Flögel, M. Galectin-3: An open-ended story. Biochimica et Biophysica Acta - General Subjects. 1760 (4), 616-635 (2006).
- Padmanabhan Iyer, R., et al. Matrix metalloproteinase-9-dependent mechanisms of reduced contractility and increased stiffness in the aging heart. Proteomics - Clinical Applications. 10 (1), 92-107 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。