Method Article
ביו-מאמר מיקרומערכים למיקרוטקטיקה וניתוח מולקולרי של נויטרופילים אנושיים
In This Article
Summary
פרוטוקול זה יוצר מיקרו-מערכים ביוביופית המספקים שורצים בעלי מליטה באמצעות הספפיל. הוא מספק גישה קלה למגשרים כי נויטרופילים שחרור במהלך הגירה ומאפשר ניתוח הדמיה כמותית.
Abstract
נויטרופילים שורצים הוא תהליך משותף שבו נויטרופילים לאטום את אתר של זיהום ולקדם התארגנות רקמות. המונים נחקרו באופן קלאסי בvivo בדגמי בעלי חיים המציגים דפוסים אופייניים של נדידת תאים. עם זאת, במודלים vivo יש מספר מגבלות, כולל מגשרים אינטרתאיים שקשה לגשת ולנתח, כמו גם חוסר יכולת לנתח במישרין את הנויטרופילים האנושיים. בגלל מגבלות אלה, יש צורך בפלטפורמת מבחנה כי מחקרים שורצים עם נויטרופילים האדם ומספק גישה קלה האותות המולקולריים שנוצרו במהלך שורצים. בשלב זה, משתמשים בתהליך מיקרו-מעבדים מרובה-צעדים כדי ליצור מיקרוarray של מאמר ביוגרפי, המעוררת שורצים בvivo זיהום. ביוביומאמר microarray גורם נויטרופילים נחיל בצורה מבוקרת ויציבה. על מיקרוarray, העלייה נויטרופילים במהירות וליצור נחילים יציבים סביב אשכולות מאמר ביוגרפי. בנוסף, supernatant שנוצר על ידי נויטרופילים נותחו ו 16 חלבונים התגלו להתבטא באופן מהותי במהלך שורצים. זה בפלטפורמת מתורבת שורצים מקלה ניתוח ישיר של הגירה נויטרופילים ושחרור חלבון באופן שאינו מפוקח, בצורה מבוקרת מרחב.
Introduction
נויטרופילים, הנפוץ ביותר של תא דם לבן במחזור הדם1, הם צוברים תשומת לב כמטרות אבחון וטיפול פוטנציאלי2,3 כי הם עשויים להיות מעורבים במגוון של מצבים רפואיים כולל שיגרון4, אלח דם3, טראומה5,6, סרטן1,7,8, מחלות אוטואימוניות שונים5,9. נויטרופילים שורצים היא מרובת השלבים, תהליך מוסדר בחוזקה עם מורכבות זה עושה את זה מוקד מעניין במיוחד של לימוד5,10,11. במהלך שורצים, נויטרופילים לבודד אתר של דלקת מתוך רקמות בריאות שמסביב5,10,11. התקנה הנכונה של נויטרופילים שורצים חיוני כדי לקדם ריפוי הפצע בסופו של דבר החלטה דלקת5,12. נויטרופילים שורצים נחקרו בעיקר בשנת vivo ב מכרסם12,13,14,15 ו דג הזברפיש10,11,12, 15 מודלים . עם זאת, הטבע של אלה בדגמי בעלי חיים vivo מעניקה מגבלות5. לדוגמה, המגשרים שפורסמו על ידי נויטרופילים במהלך שורצים אינם נגישים בקלות לניתוח5. בנוסף, ישנם מקורות פוטנציאליים רבים עבור מתווך נתון vivo, כך בניסוי vivo חייב להחדיר מחסור גנטי כדי לעכב את הייצור הסלולר ו/או אינטראקציה כדי לחקור את התפקיד של המגשר הזה בתהליך נתון13. על ידי הפעלת התבוננות נויטרופילים ללא ההקשר של תאים נוספים. בנוסף, מחקר המתאר נויטרופילים האדם הגירה מתואמת הוא מוגבל16. על הפלטפורמה שורצים מתורבת, נויטרופילים האדם יכול להיות מנותח ישירות. פלטפורמת שורצים מבחנה יכולה להתרחב על הידע שנרכש במחקרים vivo על ידי מתן הזדמנויות למלא את הפערים שנותרו על ידי מגבלות במחקרים vivo.
כדי לטפל בצורך בפלטפורמת מבחנה המחקה ב vivo נויטרופילים שורצים, פיתחנו פלטפורמת מיקרוהטבעה המאפשרת לנו דפוס ביופסיה מאמר מיקרו מערכים המעוררים נויטרופילים שורצים באופן מבוקר מרחב. אנו יוצרים מיקרוערכים ביוביומאמר על מגלשות זכוכית בתהליך דו-שלבים. ראשית, אנו משתמשים במיקרו-הטבעה כדי ליצור מיקרו מערך של כתמי פוליאלקטרוליט (CP). שנית, אנו מוסיפים פתרון של מאמרים הנצמדים לנקודות CP באמצעות אינטראקציה אלקטרוסטטית. על-ידי הראשון מעורר את שכבת CP, אנחנו יכולים באופן סלקטיבי דפוס מאמרים טעונה באופן שלילי על מנת ליצור את התבנית הרצויה נויטרופילים שורצים. השכבה טעונה באופן חיובי מחזיקה את מאמרים ביוטעונים שלילית באמצעות השלב השוטף הנמרץ המסיר את מאמרי הביויולים מהאזורים בשקופית הזכוכית שאין להם את ה-cp. בנוסף, cp השתמשו כאן, סופולימר של אקרילאמיד ו-מונומר מונומר, הוא ביו תואם, אז זה לא לגרום ל יש לו טען משטח גבוה מאוד כי משתק את מאמרי ביוביומיקרון בגודל בינוני לשקופית זכוכית, ובכך מעכב נויטרופילים להסיר את החלקיקים מהמיקום בתבנית על שקופית זכוכית. התוצאה היא אשכולות ביוביומאמרים המסודרים במיקרו-מערך. כאשר הוספנו נויטרופילים למיקרו-מערך, הם יצרו נחילים יציבים סביב האשכולות של המאמרים. באמצעות מעקב הגירה נויטרופילים, מצאנו כי שורצים באופן פעיל להגר לכיוון אשכולות המאמרים ביופסיה. יתר על כן, השתמשנו בפלטפורמה זו כדי לנתח מגשרים מסוימים שחרור נויטרופילים במהלך שורצים. מצאנו 16 מגשרים שמתבטאים באופן מכריע בזמן שורצים. הריכוזים שלהם לעקוב אחר שלוש מגמות כלליות לאורך זמן: להגדיל, להקטין, או ספייק. שלנו בפלטפורמת מבחנה שורצים הפלטפורמה מקלה על ניתוח של שליטת נויטרופילים האדם מבוקרת, כמו גם את האוסף וניתוח של מגשרים שפורסמו על ידי נויטרופילים שורצים. בפרסום קודם, הדגמנו כי חולים עם מצבים רפואיים מסוימים (טראומה, מחלות אוטואימוניות, ו אלח דם), היו נויטרופילים שפעלו באופן שונה מאלה תורמים בריאים5. במחקרי מחקר עתידיים, הפלטפורמה שלנו יכול לשמש לניתוח הפונקציה נויטרופילים בקרב מגוון רחב של אוכלוסיות החולה. פלטפורמה זו יכולה לנתח את הקואורדינציה המורכבת הכרוכה בנויטרופילים שורצים. מחקרים נוספים ניתן לעשות כדי לספק תובנה על הפונקציה נויטרופילים של אוכלוסיית החולה ספציפית או תגובת נויטרופילים לפתוגן של עניין.
Protocol
המחברים מכירים במתנדבים הבריאים שתרמו באדיבות את דמם. דגימות דם הושגו לאחר הסכמה מתנדבת מושכלת על פי הלוח ביקורת מוסדית (IRB) פרוטוקול #2018H0268 נבדקו על ידי הוועדה למדעים ביו-רפואי באוניברסיטת אוהיו.
1. המיקרו-מיקרוקוד של ביוביומאמר
- באמצעות נוהלי ליתוגרפיה סטנדרטיים, ליצור וופל סיליקון מאסטר.
- צור הוכחה לעיצוב הרצוי באמצעות תוכנת עיצוב בעזרת מחשב (CAD), ולאחר מכן שלח ליצרן פוקשו לייצר מגוון כרום. העיצוב המשמש כאן הוא 4 מ"מ x 4 מ מ מערכים מלבניים של 30 יקרומטר קוטר ממולא במעגלים עם 150 יקרומטר מרכז למרכז מרווח. עיצוב זה יכול להיות שונה כנדרש עבור יישומים שונים.
- Spincoat עיל a 40 יקרומטר שכבה עבה של photoresist שלילית על וופל סיליקון. אופים וופל ב 65 ° צ' עבור 5 דקות ו 95 ° צ' עבור 10 דקות.
- לחשוף וופל לאור UV באמצעות פוברז כרום עם 150 – 160 mJ/cm2 (איור 1א).
- אופים וופל ב 65 ° צ' עבור 5 דקות ו 95 ° c עבור 10 דקות. לטבול וופל במפתח photoresist עבור 10 דקות ולשטוף עם אלכוהול איזופרופילי. בשלב זה, התבנית צריכה להיות גלויה על הפרוסת (איור 1ב).
- ביסודיות לערבב 10:1 יחס של polydiמתיל סילאוקאן preoxane ואת הסוכן שלה ריפוי (כלומר, 20 גרם של prepolymer ו 2 גרם של ריפוי הסוכן) ויוצקים את התערובת polydiמתיל siloxane (PDMS) על וופל מאסטר בצלחת פטרי (איור 1ג).
- ואקום לטפל בתערובת PDMS לא נרפא עד בועות אוויר לא נמצאים מעל וופל המאסטר. לרפא ב 65 ° c בלילה.
- השתמש אזמל לחתוך מסביב לחלק החיצוני של הקטע של הפרוסת וופל, ולהסיר לאט את הלוח PDMS נרפא. מניחים את לוח PDMS על לוח חיתוך נקי עם הצד הפונה כלפי מעלה (איור 1ד).
- ניקוב בולים בודדים מלוח PDMS עם פונץ ' ביופסיה של 8 מ"מ (איור 1E). , עבור מגלשת זכוכית אחת. יהיה צורך בשמונה בולים
- מניחים כל הפנים בול על הסרט דבק כדי להסיר את כל הפסולת.
- מראש, להכין פתרון 1.6 mg/mL של CP במים.
- להוסיף את הכמות הנכונה של אבקת CP למים (למשל, 0.8 g כדי 500 mL).
- מערבבים על צלחת מהומה בטמפרטורת החדר לילה, או עד שכל המוצקים מומס למים. פתרון CP ניתן לאחסן בטמפרטורת החדר במשך 6 חודשים.
- אם רצונך בכך, הפוך את ה-CP לפתרון פלורסנט על-ידי הוספת פולי-L-ליזין מתויג עם fluorescein isothiocyanate (PLL-FITC).
- הנורית כ-10 mL של פתרון CP. הוסף כמות קטנה של PLL-FITC (0.05 מ"ג) לכרך המצוטט. ניתן לשנות את הסכום כדי לכוונן את בהירות הזריחה כרצונך.
- מערבולת פתרון CP המסומן עם FITC עבור 20 s, או עד הפתרון הוא אחיד, צבע צהוב חיוור. הגן מפני אור ואחסן ב-4 ° צ' עד חודש אחד.
- עם החותמות עם הפנים כלפי מעלה, הממשלה כל חותמת עם 100 μL של 1.6 mg/mL הפתרון של CP, להבטיח לא טופס בועות אוויר בין הפתרון CP ואת החותמת (איור 1F).
- היפוך החותמות על שכבה של פתרון CP (איור 1G).
- הסר את הבולים מהפתרון CP לאחר 1 h.
- לטפוח על כל בול רטוב הפנים מטה אל שקופית זכוכית נקייה 6-8x כדי להסיר את עודפי הנוזלים.
- ואקום לטפל החותמות 1 – 2 דקות.
- לדבוק שמונה היטב, בקוטר 9 מ"מ מרווח הדמיה בחלק העליון של שקופית זכוכית נקייה כמדריך למיקום בחותמת. עם החלל הזה, כל מגלשת הזכוכית. יכולה להיות שמונה מיקרו-מערכים
- הניחו את פני החותמת על שקופית הזכוכית במרכז של כל באר של מרווח ההדמיה (כלומר, השתמשו בשמונה כולל בולים).
- מקום 5.6 ± 0.1 g מאוזנת משקל על גבי כל חותמת ולאפשר 10 דקות עבור הטבעה (איור 1H). משקל מאוזן נדרש כדי להבטיח את החותמת היא לחצה באופן שווה על שקופית זכוכית ולקדם אפילו העברה של CP לשקופית זכוכית.
- הסר את המשקולות והחותמות מתוך שקופית הזכוכית (איור 1I). הניחו לשכבת ה-CP להתייבש בטמפרטורת החדר במשך 24 שעות לפני הוספת מאמרי הביוביו, כמתואר בשלב 1.17. אם CP הוא מתויג עם FITC, את האפקטיביות של הטבעה ניתן לבדוק בנקודה זו עם מיקרוסקופ פלורסנט ב 488 ננומטר לפני שתמשיך צעד 1.17 (איור 1M).
- גזור לוח PDMS ריק לגודל מרווח ההדמיה והשתמש בפונץ ' ביופסיה של 8 מ"מ כדי ליצור בארות ב-PDMS היישר עם הבארות של מרווח הדמיה. לדבוק את לוח PDMS לשקופית הזכוכית עם מרווח הדמיה (איור 1J).
- הפשרת פתרון של ביוטיפים (למשל, e. coli או zymosan) ולדלל עד 500 Μg/mL במים להזרקה (wfi).
הערה: אין צורך להיות מאמרים בביויוטיפים. קולטני פני השטח של נויטרופילים לזהות באופן ישיר מולקולות על הביוטיפים האלה19,20,21. - הוסף 100 μL של פתרון ביוביומאמרים לכל מחשב של PDMS על שקופית הזכוכית (איור 1K).
- . נענעי את הזכוכית במשך 30 דקות
- שטפו את הבארות ביסודיות במים. ניתן לאחסן את המיקרו-מערך ביוביומטר בסביבה נטולת אבק ב-4 ° c עד 3 חודשים. בשלב זה, התבנית יש לבדוק עם מיקרוסקופ פלורסנט ב 594 ננומטר לפני שתמשיך צעד 2.1 (איור 1N).
2. הכנה לדוגמא
- לאסוף לפחות 2 מ ל דם טרי בצינורות K2-EDTA מן התורם הרצוי. התשואה הצפויה של נויטרופילים היא 1 – 2 x 106 תאים/1 מ"ל דם שלם. שיטת ההדמיה דורשת כ 1.5 x10 נויטרופילים, וניתוח של supernatant דורש 1 x 106 נויטרופילים. . תשתמש בדם בתוך 4 שעות
- הפרד בין כדוריות הדם האדומות (RBCs) על-ידי הוספת סוכן צבירה של אריתרופואריציט ביחס של 1:5 לכל הדם. המתן 45 דקות עבור שכבה שקופה (מעיל באפי) כדי להפריד מהשכבה של RBCs.
- הסר את מעיל באפי ולשטוף עם מלוחים באגירה פוספט (PBS) באמצעות מעיל באפי 1 mL: 9 מ"ל PBS.
- צנטריפוגה עבור 5 דקות ב 190 x ו 20 ° c.
- ומשהה את הגלולה ב -5 x 107 תאים/mL.
- השתמש בערכת הבחירה החיסונית שלילית כדי לבודד נויטרופילים.
- הוסף 50 μL של מתלה/מכשיר השעיה של תא נוגדן/1 mL. . חכה 10 דקות
- הוסף 100 μL של מתלה מגנטי חרוזים/1 mL. . חכה 10 דקות
- הוסף השעיית תא לצינור תחתון עגול ומקום במגנט גלילי. . חכה 10 דקות
- . תשפוך את הסופרנטאנט לתוך צינורית צנטריפוגה הוסף עד 10 מ ל של PBS. צנטריפוגה עבור 5 דקות ב 190 x ו 20 ° c.
- . מנושף את הסופראנט השהה מחדש גלולה לבנה ב-IMDM עם 0.4% אלבומין סרום אנושי.
- גרעיני כתם עם 20 μg/mL הואכסט 33342 עבור 10 דקות ב 37 ° c.
- הוסף 5 מ ל IMDM עם 0.4% סרום האדם אלבומין לשטוף. צנטריפוגה עבור 5 דקות ב 190 x ו 20 ° c.
- להשעות את התאים בשעה 7.5 x 105 תאים/ML ב imdm עם 0.4% הנסיוב האנושי אלבומין.
- הוסף 100 μL של השעיית התא ל-PDMS היטב המכיל מיקרוarray של מאמר ביוגרפי. ודא כי ההשעיה התא הוא קמור מעל החלק העליון של PDMS היטב אינו מכיל בועות כלשהן.
- חותם עם שמיכות. בקוטר 12 מ"מ לכסות את הפתח של היטב PDMS עם שמיכות בקוטר 12 מ"מ. לחץ למטה בעדינות על הכיסויים עם מלקחיים כך ההשעיה התא עודף בורח לקצה של הבאר. השתמש ברקמה כדי להסיר את השעיית התאים העודפים.
3. הפעלת הטיפול וניתוח התמונה
- טען מערך מיקרו-חלקיק עם תאים בתחנת הדימות של התא החי עם מיקרוסקופ המצויד באינקובטור מכלוב שנקבע ל-37 ° c, 5% CO2, ו 90% לחות יחסית.
- השימוש פלורסנט זמן ומיקרוסקופ ברייטפילד להקליט תמונות בהגדלה 10x כל 10 ב 405 ננומטר, 594 nm, ו ברייטפילד. בניסוי אופייני, התמונות נאספות עד 2 שעות.
- השתמש בתוכנה אוטומטית למעקב אחר תאים כדי לעקוב אחר הגירה של נויטרופילים בודדים לכיוון אשכול מאמר ביוגרפי.
- השתמש במצב שינוי אוטומטי של תוכנת מעקב אחר תא לזיהוי ספוט. הגדר את רדיוס הספוט ל-5 יקרומטר (הגודל המשוער של גרעין נויטרופילים). הגדר את אורך המסלול המינימלי ל-120 s וגודל הפער המרבי של מסגרת אחת.
- מן הנתונים שנוצרו על ידי תוכנת מעקב התא, לחלץ את הקבצים המכילים את מיקום נויטרופילים ומהירות. קבצים אלה ניתן להשתמש עם תוכנה גרפים לייצר מסלולים הגירה נויטרופילים (איור 2ג) ו מפת חום של מהירות לעומת זמן (איור 2D), בהתאמה.
- השתמש בתמונות פלורסנט 405 ננומטר כדי לעקוב אחר גודל נחיל לאורך זמן על תוכנה ניתוח תמונה על פי בחירתך.
- הגדר אזורים של עניין (ROIs) סביב כל מאמר ביוביוזה שבאשכולות שבו נויטרופילים יהיה נחיל. שמור על אותו גודל תשואה כדי לנתח כל אשכול של מאמר ביוגרפי.
- לנתח את עוצמת פלורסנט מתכוון של 405 ננומטר תמונות בתוך כל ROI לאורך זמן.
- צור עקומת כיול של עוצמת פלורסנט מתכוון לגודל נחיל על ידי נקיטת מדידות ידניות בגדלים שונים נחיל מ 0 יקרומטר2 לגודל נחיל מקסימלית. השתמש בכיול זה כדי לחשב את גודל הנחיל לאורך זמן.
4. איסוף וזיהוי חלבון
- דגירה של נויטרופילים בבארות המכילים את מיקרוarray מאמר ביוביומטר ב 37 ° צ' ו 5% CO2 עבור 3 h. קחו דגימות מנקודות הזמן הרצויות. בדרך כלל, הדגימות יילקחו ב 0, 0.5, 1, ו-3 h. כדי להתגבר על מגבלת הזיהוי של מערך החלבון שיטת, הנפח כולו של supernatant של באר אחת (200 μL) שימש עבור כל נקודת זמן. . כל פעם נותחו בטרילקאט
- באמצעות מיקרוסקופ ברייטפילד, ודא שנחילים נוצרים במיקרו-מערך.
- מייבש את supernatant עם הפיפטה 200 μl וטען בצינור 0.45 מסנן צנטריפוגה יקרומטר.
- צנטריפוגה את supernatant ב 190 x g ו 20 ° צ' עבור 5 דקות ולאסוף את נפח filtrated.
- החנות דגימות ב-80 ° c עד הזמן עיבוד.
- השתמש בערכת microarray המזהה מגוון של חלבונים אנושיים כדי לעבד דגימות.
- הוסף 200 μL של כל מדגם לצינור דיאליזה נפרד המסופק עם הערכה.
- מניחים את הצינורות דיאליזה בגביע המכיל לפחות 500 mL של PBS (pH = 8.0). מערבבים בעדינות על צלחת מהומה לפחות 3 שעות ב -4 ° c. שינוי ה-PBS בגביע וחזור על שלב זה.
- העבר כל מדגם לצינור צנטריפוגה נקי וצנטריפוגה ב 9,000 x g עבור 5 דקות כדי להסיר את כל הזרז. . העבירו כל סופרנטאנט לצינור נקי
- Biotinylate אוחר כל מדגם על ידי הוספת 36 μl של תיוג 1x מגיב מערכת לכל 1 מ"ג של חלבון מוחלט במדגם דיאליזה כדי 180 μl של המדגם דיאליזה. מודקון ב 20 ° c עבור 30 דקות. מערבבים בעדינות כל 5 דקות.
- הוסף 3 μL של פתרון העצירה שסופקו עם הערכה לתוך כל צינור לדוגמה. העבר כל מדגם לצינור דיאליזה טרי ושלבים חוזרים 4.6.2 – 4.6.3. בשלב זה, ניתן לאחסן את המדגם ב-20 ° c או-80 ° c עד שתהיה מוכן להמשיך.
- שקופית הזכוכית המסופקת עם הערכה מאוחסנת ב-20 ° c. . הרשי לו להגיע לטמפרטורת החדר הניחו את שקופית הזכוכית המכונעת במכסה של זרם למינארי בטמפרטורה של 1 – 2 h בטמפרטורת החדר.
- הוסף 400 μL של מאגר חסימת שסופק עם הערכה לתוך כל טוב של שקופית זכוכית מורכב. דגירה בטמפרטורת החדר עבור 30 דקות.
- צנטריפוגה את הדגימות המוכנות עבור 5 דקות ב 9,000 x g כדי להסיר מאיצים או חלקיקים. לדלל 5x עם מאגר חוסם.
- הסר את המאגר החוסם מכל באר. הוסף 400 μL של הדגימות המדוללת לתוך הבארות המתאימות. דגירה של 2 h בטמפרטורת החדר בזמן הנדנדה.
- . הדקי את הדגימות מכל באר שטוף 3x עם 800 μL של מאגר הכביסה 1x שסיפקתי עם הערכה בטמפרטורת החדר עבור 5 דקות כל אחד בזמן הנדנדה.
- במיכל נקי, להטביע את השקופית זכוכית מורכב ב-1x מאגר לשטוף אני. לשטוף 2x בטמפרטורת החדר עבור 5 דקות כל אחד בזמן הנדנדה.
- הוסף 400 μL של 1x Cy3 מצוותת streptavidin לכל מערך משנה. מכסים עם רצועות פלסטיק דבק. הגן מפני אור לשארית הפרוטוקול.
- דגירה של 2 h בטמפרטורת החדר בזמן הנדנדה.
- Decant הפתרון ולפרק את שקופית הזכוכית מתאי המדגם.
- ב 30 מ ל שפופרת צנטריפוגה מסופק עם הערכה, בזהירות להוסיף את שקופית זכוכית מספיק 1x לשטוף מאגר אני לכסות את השקופית זכוכית. כביסה 3x עבור 10 דקות כל אחד בטמפרטורת החדר בזמן הנדנדה.
- ב שפופרת צנטריפוגה 30 מ ל, לשטוף 2x עם מאגר כביסה 1x II עבור 5 דקות כל אחד בטמפרטורת החדר בזמן נדנדה.
- שטוף את שקופית הזכוכית עם 30 מ ל של ddH2O עבור 5 דקות להסיר את שקופית הזכוכית מצינור הצנטריפוגה ולאפשר ייבוש 20 דקות במכסה הזרם למינארי. ניתן לאחסן את שקופית הזכוכית המוכנה ב-20 ° c עד שהיא מוכנה לסריקה.
- סרוק את שקופית הזכוכית עם סורק מיקרוarray בפליטת פלואורסצנטית של 555 ננומטר.
תוצאות
כאשר נויטרופילים נוספים למיקרו מאמר ביוביומערך, נויטרופילים ליצור קשר עם אשכולות המאמרים להיות מופעל וליזום את התגובה שורצים. המיקרומערך הביויואלי אומת באמצעות מיקרוסקופ פלורסנט בזמן הקפיצה כדי לעקוב אחר הגירה נויטרופילים לקראת האשכולות מאמר ביופסיה (וידאו S1). הגירה של גרעיני נויטרופילים בודדים מתבצע מעקב כאשר הם עוברים לעבר אשכול ביופסיה. כאשר נויטרופילים להגיע אשכול מאמר ביוגרפי, גרעיני שלהם חופפים עם גרעינים אחרים באשכול. לכן, לא ניתן לעקוב באופן מדויק של נויטרופילים בתוך האשכול באמצעות שיטה זו. Zymosan ו -E. coli ביופסיה מאמר אשכולות הן התוצאה בדור של נחילים נויטרופילים. עבור התוצאות שלנו, איור 2B משתמש נתונים מתוך הנחילים נויטרופילים שנוצר על ידי חלקיקים E. coli . איור 3 ואת לוחות אחרים של דמות 2 להשתמש בנחילים נויטרופילים שנוצרו על ידי חלקיקי zymosan. התוצאות התקבלו להפגין כי אשכולות המאמרים מעוררת נויטרופילים הפעלה כאשר נויטרופילים יצרו קשר עם האשכול, אשר בסופו של דבר הובילו היווצרות של נחיפיל יציבה ברחבי כל אשכול לאחר 30 – 60 דקות (איור 2,למעלה). לעומת זאת, הנויטרופילים לא הראו הגירה קולקטיבית בהעדר אשכולות ביופסיה (איור 2א, תחתון, ו- S2 וידאו). באמצעות עוצמת הפלורסנט של גרעיני נויטרופילים ויטראז ב 405 nm, הממוצע הנחיל נויטרופילים בגודל סביב 30 יקרומטר קוטר E. coli אשכולות ביופסיה נמצאה להיות 1,490 ± 680 יקרומטר2 (ממוצע ± SD, איור 2B, למעלה). העוצמה הפלואורסצנטית של אזור מסוים של עניין שבו לא קיימים אשכולות ביופסיה של המאמר היה בערך קבוע לאורך זמן, אשר אישר את היעדר הגירה קולקטיבית בהגדרה זו (איור 2B, למטה). שירים של הגירה נויטרופילים להראות כי נויטרופילים התכנס באשכול מאמר ביוגרפי כאשר אחד היה נוכח (איור 2ג, למעלה). לעומת זאת, לא נצפתה התכנסות במערכת הבקרה (איור 2ג, למטה). מהירות (מרחק נסיעה/זמן) של נויטרופילים שאינם מופעלים נמדד הבדל משמעותי סטטיסטית בהפצות המהירות נמצאה (ANOVA, p < 0.0001), כפי שמוצג באיור 2D. מהירות ממוצעת עבור שורצים נויטרופילים היה 20.6 ± 13.0 μm/min (ממוצע ± SD), ואת המהירות הממוצעת לשלוט נויטרופילים היה 2.0 ± 2.2 μm/min.
בנוסף, הריכוז של 16 חלבונים כי נויטרופילים שוחרר במהלך שורצים נותחו (איור 3). הריכוז המנורמל של כל חלבון בנקודות זמן שונות בתהליך השורצים (t = 0, 0.5, 1 ו-3 h) חושבו, כאשר הריכוז המנורמל הוא (C-Cדקות)/(cMax – cדקות). 10 חלבונים גדלו בריכוז לאורך שורצים. חלבונים אלה היו אדיפפסין, galectin-3, GROa, IL-6R, MIP-1a, MMP-8, MMP-9, Nidogen -1, TIMP-1, ו TLR2. שני חלבונים (מחומש 3 ו דרגה) ירדו בריכוז לאורך שורצים. ארבעת החלבונים הנותרים (הPF4, RANTES, ו טראפין -2) גדלו במהלך השעה הראשונה של שורצים אך ירדו לאחר מכן. במילים אחרות, ריכוזי החלבונים האלה "מחודדים" בזמן שורצים. מתוך 16 החלבונים שזוהו, 12 חלבונים זוהו בפרסום הקודם שלנו5. אדיפסין, galectin-3, nidogen-1, פנטרשין 3, TIMP-1, ו TLR2 הוכחו להיות שורצים ספציפי, בעוד ברדק, IL-6R, MMP-8, ו MMP-9, דרגה, ו trappin 2 לא5.

איור 1: הפקת מיקרוarray של מאמר ביוגרפי. סיליקון מצופה וופל עם photoresist שלילית נחשף לאור UV באמצעות פושאול כרום (א). לאחר וופל הסיליקון הוא אפוי ומפותח, תבנית photoresist נשאר על פני השטח של וופל סיליקון. זה המאסטר וופל (ב). בצלחת פטרי, תערובת PDMS מתווספת לראש וופל הראשי. PDMS נרפא לילה ב 65 ° צ' כדי ליצור את העובש PDMS (C). העובש PDMS נחתך מן וופל המאסטר אגרוף ביופסיה משמש כדי אגרוף את בולים PDMS בודדים (D). חותמת PDMS (E) מצופה בפתרון CP (F). החותמת הפוכה על שכבה דקה של פתרון CP (G). לאחר דגירה של הפתרון CP עבור 1 h, החותמת היא למחוק על שקופית זכוכית כדי להסיר CP עודף. שמונה בולים הם לוחצים על שקופית זכוכית נקייה עם משקל 5.6 ± 0.1 g, מיושר עם מרווח דימות (h). כאשר החותמת מוסרת, תבנית CP נותרת (I). טבלת PDMS עם בארות מקדימות מדבקה בשקופית הזכוכית (J). לאחר מכן, פתרון ביוביואלי נוסף באמצעות תבנית CP (K). הביו-מאמרים הטעונים שלילית מאגד את הפוליאלקטרוליט הטעון באופן חיובי באמצעות אינטראקציה אלקטרוסטטית. התמיסה העודפת של המאמרים נשטפה לכאן ומשאירה מאמרים ביוביוטיפים על גבי תבנית CP (L). (ז) תמונת פלורסנט של שכבת CP המסומנת עם Fitc (סולם ברים = 50 μm, תמונה גדולה; סרגל בקנה מידה = 25 μm, שיבוץ). (N) התמונה הפלואורסצנטית של בדוגמת zymosan ביוטיפים בעלי מעלה עם טקסס אדום (סרגל קנה מידה = 100 μm, תמונה גדולה; סרגל בקנה מידה = 50 μm, שיבוץ). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הצמיחה נויטרופילים ברחבי הנושא אשכולות ביופסיה. בנוכחות אשכולות ביופסיה, הנויטרופילים עוברים הגירה קולקטיבית לקראת אשכולות המאמרים (למטה, שליטה נויטרופילים). כאשר אין מאמרים ביוקיים, הנויטרופילים לא לבצע הגירה קולקטיבית. (א) בנוכחותם של אשכולות zymosan ביופסיה, טופס נויטרופילים הנחילים ב 30 דקות. ללא אשכולות ביופסיה, אין צורת נחילים (סרגל קנה מידה = 50 μm). (ב) נויטרופילים לגדול בגודל ממוצע של 1,490 ± 680 יקרומטר2 (ממוצע ± SD) בסביבות 30 יקרומטר קוטר E. coli ביופסיה מאמר אשכולות. בקרת נויטרופילים התערוכה צפיפות קבועה המתאימה לצמיחה נחיל לא (ANOVA, p < 0.0001, n = 32 נויטרופילים נחילים, n = 1 תורם, שגיאה שורות = סטיית התקן). (ג) מסלולים של נויטרופילים שורצים להתכנס על אשכולות ביופסיה zymosan, תוך שליטה נויטרופילים להראות לא נקודת מתכנס (סולם ברים = 50 μm). (ד) נויטרופילים שורצים לכיוון היעד zymosan יש מהירות ממוצע של 20.6 ± 13.0 μm/min (פירושו ± SD), בעוד שליטה נויטרופילים יש מהירות ממוצע של 2.0 ± 2.2 μm/min. כל ספירה על מפת החום מייצגת נויטרופילים עם מהירות מיידית נתון בנקודת זמן נתונה. מפות החום הללו מייצגות ניסוי אחד (n = 1 נחיל; התורם נ = 1; ANOVA, 6,114 = שורצים נויטרופילים, 32,116 = שליטה נויטרופילים, p < 0.0001). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
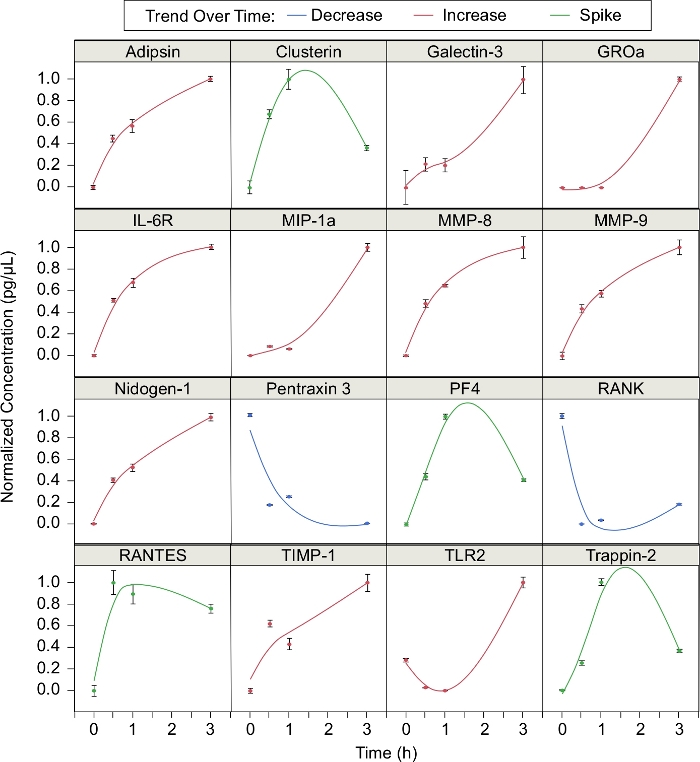
איור 3: מגשרים חינם שפורסמו על ידי שורצים נויטרופילים. שורצים נויטרופילים משפיע על הייצור של חלבונים שונים לאורך זמן. ריכוז החלבון נמדד ב-0, 0.5, 1 ו-3 שעות. נקודות הנתונים הותאמו עם splines החלקה (λ = 0.05). חלבונים אלה נוטים לפעול בעקבות אחת משלוש מגמות אופייניות: הפחתה במשך הזמן, הגדלה לאורך זמן, או מעלה סביב 1 h ולאחר מכן יורדת (קווי שגיאה = סטיית תקן; n = 3 משכפל;) נ = 1 תורם). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
וידאו S1: נויטרופילים שורצים לקראת אשכולות ביופסיה zymosan. גרעיני נויטרופילים מוצגים בכחול. מטרות zymosan מסומנים עם עיגולים אדומים (סרגל קנה מידה = 50 μm; הרכישה המקורית זמן = 60 דקות). אנא לחץ כאן כדי להוריד וידאו זה.
וידאו S2: הגירה ללא הפעלה אקראית נויטרופילים. גרעיני נויטרופילים מוצגים בכחול (סרגל קנה מידה = 50 μm; הרכישה המקורית זמן = 60 דקות). אנא לחץ כאן כדי להוריד וידאו זה.
Discussion
פיתחנו מיקרורקיעת הפלטפורמה כדי ליצור מערכים אחידים של ביויוטיפים כדי לגרות בתוך מבחנה שורצים. הטבע מתורבת של הפלטפורמה שלנו מאפשר לנו לעקוף את הסיבוכים הנובעים עם vivo שורצים ניסויים, כלומר היכולת המסכנה לנתח מגשרים שפורסמו על ידי שורצים נויטרופילים5. בנוסף, ב vivo מודלים מבוצעים בדרך כלל מכרסמים11,12,13,15,22,23, או דג זברה11,12,15,23. הפלטפורמה שלנו משתמשת נויטרופילים האדם, אשר מאפשר לנו יותר ישירות לפרש את התוצאות בהקשר של המחלה האנושית, למרות דמיון מסוים בין העכבר האדם נויטרופילים נצפתה5,11. בנוסף, אנו שומרים על סביבת שורצים בשליטה spatially אשר מבדיל את הפלטפורמה שלנו מתוך מודלים vivo על ידי מתן רמה גבוהה של שליטה מתוך מסייע בניתוח של הגירה הקולקטיבית נויטרופילים האדם, כמו גם את איסוף וניתוח של מגשרים שפורסמו על ידי שורצים נויטרופילים.
במהלך הפיתוח של פרוטוקול המיקרו-הטבעה שלנו, התעוררה מספר אתגרים שדרשו בעיות זהירות. ראשית, ה-CP המשמש למיקרו-הטבעה הוא הידרופיפילית מאוד, ובולים PDMS הם הידרופובי. בגלל CP אין זיקה גבוהה עבור PDMS, ההליך שלנו תוכנן בקפידה כדי למנוע את היווצרות בועות ולקדם הרטבה. על ידי לראשונה הטרמה חותמת עם CP בעת הפנים כלפי מעלה (שלב 1.8), אנו מזער את היווצרות של בועות בין CP ואת החותמת. החותמת היא הפוכה ולאחר מכן על שכבה של CP ו הדגירה עבור 1 h. זמן דגירה ארוך זה מבטיח כי כל קטע של החותמת מורשמת. שנית, התהליך של הסרת CP עודף לפני הטבעה על שקופית זכוכית נקייה (שלב 1.11) יכול להיות לא עקבי. בעת ביצוע שלב 1.11, יש לבדוק את החותמת בקפידה. כאשר התבנית מתחילה להיות גלויה, החותמת מוכנה לשלב 1.12. בנוסף, זמן ואקום נדרש לייבש את החותמות (שלב 1.12) יכול להשתנות. דבר זה תלוי בעיקר במזג האוויר. ביום חם, לח, 2 דקות של זמן ואקום נדרש. ביום קריר, יבש, 1 דקות של ואקום זמן מספיק.
הצגנו כי נויטרופילים מתורמים בריאים טופס הנחילים ברחבי אשכולות ביוביומאמרים. עם הזמן מיקרוסקופית פלורסנט, אנחנו יכולים לכמת את גודל נחיל ולעקוב אחר הגירה נויטרופילים, אשר מאפשר לנו לנתח נויטרופילים כימומוניות ככמת5. לדוגמה, הצגנו בעבר כי ניתן להשתמש בפלטפורמה זו כדי לחשב את האינדקס של כימוטקטקטיקה (CI, את הקוסינוס של הזווית בין וקטור מהירות נויטרופילים ואת וקטור המיקום בין נויטרופילים לבין האשכול ביופסיה הקרובה ביותר), מהירות (מרחק את מסעות נויטרופילים מחולק על ידי הזמן), מהירות רדיאלית (מהירות מוכפל ב-CI), ואתהמרחק הכולל נסע (ההבדל בין מיקום הראשוני והסופי נויטרופילים בניגוד לרוב במחקרים מחוץ למוח24,25,26, הפלטפורמה שלנו אין מעבר כימוטקטיק מלאכותי, כך התקשורת הבינתאית נויטרופילים הוא הכוח המניע הבלעדי של הגירה נויטרופילים. בנוסף, supernatant שנוצר על ידי שורצים נויטרופילים הוא נגיש בקלות. אנחנו יכולים לאסוף ולנתח את הסופרנטאנט עבור מגשרים בין-סלולאריים שפורסמו על ידי נויטרופילים ללא הפרעות מסוגים אחרים של תאים הנמצאים vivo. 16 חלבונים נצפו שהביטוי במהלך שורצים יכול להיות מתואר כאחת משלוש מגמות: להגדיל (10 חלבונים), להקטין (שני חלבונים), ו ספייק (ארבעה חלבונים). שישה מן החלבונים הללו אישר מגמות שדווחו בעבר במהלך שורצים לאורך זמן5. כמה חלבונים שזוהו הוכחו בעבר להיות שורצים ספציפי, ואילו אחרים הביעו באופן מהותי על ידי הפעלת לא שורצים נויטרופילים5. חלבונים המגבירים את הריכוז לאורך זמן עלולים להיות משויכים לתגובה הפרו-דלקת. חלק מחלבונים המגבירים את הריכוז לאורך זמן ידועים כבר להיות מעורבים בתגובה הפרו דלקתית (g., galectin-3 ו-mmp-9)27,28. היחסים בין חלבונים ודלקת אחרים פחות מובנים היטב. החלבונים כי ספייק או ירידה במהלך שורצים עשויים להיות מעורבים בוויסות של דלקת. עם זאת, מחקר נוסף הכרחי כדי להבין את התפקיד בדלקת של רבים מן החלבונים, כי הם מבוטא באופן מכריע במהלך שורצים. ניתוח מגשרים שפורסמו יחד עם הגירה נויטרופילים יכול לעזור לנו טוב יותר להבין את התמונה המורכבת של דלקת וכיצד נויטרופילים ההשפעה על הרקמה המקיפה במהלך שורצים.
במחקרים עתידיים, הפלטפורמה שלנו ניתן להשתמש כדי ללמוד ביסודיות את היכולת של נויטרופילים בריא ליצור נחילים יציבים סביב ביופסיה בדוגמת אשכולות מאמר. מצבים רפואיים שונים היו קשורים נויטרופילים, כולל אלח דם3, טראומה6, סרטן1,8,17,18, אשר מציע נויטרופילים בחולים אלה עשויים להשתנות פונקציה. פלטפורמה זו ניתן להשתמש כדי לבחון את ההבדלים בין המגשרים הבינתאיים שפורסמו על ידי נויטרופילים בריא ולא בריא. בנוסף, פלטפורמה זו יכולה להיות שונה כדי התבנית חיידקים חיים ומשמש לניתוח תגובת נויטרופילים לחיידקים לחיות מבחנה.
מסקנה, פיתחנו פלטפורמה הרומן לניתוח נויטרופילים שורצים בתוך מבחנה. האופי הנשלט ביותר של הפלטפורמה שלנו מאפשר לנו להמתיק בעיות שעולות במהלך ניסויים vivo נויטרופילים שורצים. נויטרופילים שורצים מאמר ביוגרפי מיקרוarray בקלות ניתן לכמת דרך מיקרוסקופ הזמן לשגות פלורסנט. בנוסף, אנחנו יכולים לאסוף את המגשרים שפורסמו על ידי הנויטרופילים ללא הפרעה של רקמות אחרות הקיימות vivo. פלטפורמה זו ניתן להשתמש במחקר עתידי כדי לכמת הבדלים בין התנהגויות הגירה של נויטרופילים מתורמים בריאים ולא בריאים.
Disclosures
המחברים אינם מצהירים על ניגודי אינטרסים.
Acknowledgements
עבודה זו היתה נתמכת על ידי מימון של ויליאם G. Lowrie המחלקה להנדסה כימית ביוקולקלית ואת מרכז הסרטן המקיף באוניברסיטת אוהיו. הנתונים המוצגים בדו ח זה הגיעו מתמונות שעובדו באמצעות מיכל x64 (ver. 9.3.0 Bitplane טוס) זמין במכון המיקרוסקופיה של הקמפוס והדמיה, האוניברסיטה הממלכתית של אוהיו. מתקן זה נתמך בחלקו על ידי גרנט P30 CA016058, המכון הלאומי לסרטן, בת, MD.
Materials
| Name | Company | Catalog Number | Comments |
| "The Big Easy" EasySep Magnet | STEMCELL Technologies | 18001 | Magnet to use with neutrophil isolation kit |
| Cell Incubator | Okolab | 777057437 / 77057343 | Okolab cage incubator for temperature and CO2 control |
| EasySep Human Neutrophil Isolation Kit | STEMCELL Technologies | 17957 | Kit for immunomagnetic negative selection of human neutrophils |
| Eclipse Ti2 | Nikon Instruments | MEA54010 / MEF55037 | Inverted research microscope |
| Escherichia coli (K-12 strain) BioParticles Texas Red conjugate | Invitrogen | E2863 | Bioparticle powder, dissolve in water prior to addition to Zetag® array |
| Harris Uni-Core 8-mm biopsy punch | Sigma Aldrich | Z708925 | To cut PDMS stamps |
| HetaSep | STEMCELL Technologies | 7906 | Erythrocyte aggregation agent for separating buffy coat from red blood cells in fresh human blood |
| Hoechst 33342 | Life Technologies | H3570 | Nucleus fluorescent stain |
| Human L1000 Array | Raybiotech Inc. | AAH-BLG-1000-4 | High density array to detect 1000 human proteins |
| Human Serum Albumin (HSA) | Sigma Aldrich | A5843 | Low endotoxin HSA, to prepare 2 % solutions in IMDM for isolated neutrophils |
| Iscove's Modified Dulbeccos' Medium (IMDM) | Thermo Fisher Scientific | 12440053 | To resuspend isolated neutrophils |
| K2-EDTA tubes | Thermo Fisher Scientific | 02-657-32 | Tubes for blood collection |
| Low Reflective Chrome Photomask | Front Range Photomask | N/A | Dimensions 5" x 5" x 0.09" (L x W x D) |
| Microarray Scanner | Perkin Elmer | ASCNGX00 | Fluorescence reader of protein patterned microdomains |
| Microscopy Image Analsysis Software - Imaris | Bitplane | 9.3.0 | Software for automatic cell tracking analysis |
| NiS Elements Advanced Research Software Package | Nikon Instruments | MQS31100 | Software for automatic live cell imaging and swarm size calculation |
| Poly-L-lysine fluorescein isothiocyanate (PLL-FITC) | Sigma Aldrich | P3069-10MG | 30,000 - 70,000 MW PLL labeled with FITC, used to fluorescently label CP solution |
| SecureSeal 8-well Imaging Spacer | Grace Bio-Labs | 654008 | 8-well, 9-mm diameter, adhesive imaging spacer |
| Silicon Wafer | University Wafer | 590 | Silicon 100 mm N/P (100) 0- 100 ohm-cm 500 μm SSP test |
| Spin Coater | Laurell | WS-650MZ-23NPPB | Used to spincoat a 40-µm layer of photoresist onto silicon wafer |
| SU-8 2025 | MicroChem | 2025 | Negative photoresist to make silicon master wafer |
| SU-8 Developer | MicroChem | Y020100 | Photoresist developer. Remove non-crosslinked SU-8 2025 from silicon wafer |
| Sylgard 184 (polydimethylsiloxane, PDMS) | Dow | 1673921 | 2-part silicone elastomer kit for making microstamps and PDMS wells |
| UV Exposure Masking System | Kloé | UV-KUB 2 | Used to crosslink photoresist on silicon wafer through chrome mask with UV light |
| Water | Thermo Fisher Scientific | A1287303 | High quality water to dilute bioparticles |
| Zetag 8185 | BASF | 8185 | Cationic polyelectrolyte (CP), powder, Copolymer of acrylamide and quaternized cationic monomer, forms "inking solution" for microstamping when dissolved in water |
| Zymosan A S. cerevisiae BioParticles Texas Red conjugate | Invitrogen | Z2843 | Bioparticle powder, dissolve in water prior to addition to Zetag array |
References
- Coffelt, S. B., Wellenstein, M. D., de Visser, K. E. Neutrophils in cancer: neutral no more. Nature Reviews Cancer. 16 (7), 431-446 (2016).
- Jones, C. N., et al. Microfluidic Platform for Measuring Neutrophil Chemotaxis from Unprocessed Whole Blood. Journal of Visualized Experiments. (88), 1-6 (2014).
- Ellett, F., et al. Diagnosis of sepsis from a drop of blood by measurement of spontaneous neutrophil motility in a microfluidic assay. Nature Biomedical Engineering. 2, 207-214 (2018).
- Malawista, S. E., Chevance de Boisfleury, A., Naccache, P. H. Inflammatory Gout: Observations over a Half-Century. The FASEB Journal. 25 (12), 4073-4078 (2011).
- Reátegui, E., et al. Microscale arrays for the profiling of start and stop signals coordinating human-neutrophil swarming. Nature Biomedical Engineering. 1 (7), 1-12 (2017).
- Morgan, A. S. Risk factors for infection in the trauma patient. Journal of the National Medical Association. 84 (12), 1019-1023 (1992).
- Szczerba, B. M., et al. Neutrophils escort circulating tumour cells to enable cell cycle progression. Nature. 566, 553-557 (2019).
- Treffers, L. W., Hiemstra, I. H., Kuijpers, T. W., van den Berg, T. K., Matlung, H. L. Neutrophils in cancer. Immunological Reviews. 273, 312-328 (2016).
- Grayson, P. C., Kaplan, M. J. At the Bench: Neutrophil extracellular traps (NETs) highlight novel aspects of innate immune system involvement in autoimmune diseases. Journal of Leukocyte Biology. 99 (2), 253-264 (2016).
- Lämmermann, T. In the eye of the neutrophil swarm--navigation signals that bring neutrophils together in inflamed and infected tissues. Journal of Leukocyte Biology. 100 (1), 55-63 (2016).
- Kienle, K., Lämmermann, T. Neutrophil swarming: an essential process of the neutrophil tissue response. Immunological Reviews. 273 (1), 76-93 (2016).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Lämmermann, T., et al. Neutrophil swarms require LTB4 and integrins at sites of cell death in vivo. Nature. 498 (7454), 371-375 (2013).
- Kreisel, D., et al. In vivo two-photon imaging reveals monocyte-dependent neutrophil extravasation during pulmonary inflammation. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18073-18078 (2010).
- Coombes, J. L., Robey, E. A. Dynamic imaging of host-pathogen interactions in vivo. Nature Reviews Immunology. 10 (5), 353-364 (2010).
- Lämmermann, T. Cell migration: Arraying neutrophils in swarms. Nature Biomedical Engineering. 1 (7), 1-2 (2017).
- Powell, D. R., Huttenlocher, A. Neutrophils in the Tumor Microenvironment. Trends in Immunology. 37 (1), 41-52 (2016).
- Uribe-querol, E., Rosales, C. Neutrophils in Cancer: Two Sides of the Same Coin. Journal of Immunology Research. 2015, (2015).
- Underhill, D. M., Ozinsky, A. Toll-like receptors: Key mediators of microbe detection. Current Opinion in Immunology. 14 (1), 103-110 (2002).
- Netea, M. G., Van Der Meer, J. W., Kullberg, B. J. Recognition of fungal pathogens by toll-like receptors. Immunology of Fungal Infections. , 259-272 (2007).
- Thomas, C. J., Schroder, K. Pattern recognition receptor function in neutrophils. Trends in Immunology. 34 (7), 317-328 (2013).
- Prince, L. R., Whyte, M. K., Sabroe, I., Parker, L. C. The role of TLRs in neutrophil activation. Current Opinion in Pharmacology. 11 (4), 397-403 (2011).
- Tan, S. Y., Weninger, W. Neutrophil migration in inflammation: intercellular signal relay and crosstalk. Current Opinion in Immunology. 44, 34-42 (2017).
- Menezes, G. B., Rezende, R. M., Pereira-Silva, P. E. M., Klein, A., Cara, D. C., Francischi, J. N. Differential involvement of cyclooxygenase isoforms in neutrophil migration in vivo and in vitro. European Journal of Pharmacology. 598 (1-3), 118-122 (2008).
- Afonso, P. V., et al. LTB4 Is a Signal-Relay Molecule during Neutrophil Chemotaxis. Developmental Cell. 22 (5), 1079-1091 (2012).
- Gounni, A. S., et al. In Vivo Regulates Neutrophil Migration In Vitro and Chemorepellent Semaphorin 3E Negatively Chemorepellent Semaphorin 3E Negatively Regulates Neutrophil Migration In Vitro and In Vivo. The Journal of Immunology. 198, 1023-1033 (2017).
- Dumic, J., Dabelic, S., Flögel, M. Galectin-3: An open-ended story. Biochimica et Biophysica Acta - General Subjects. 1760 (4), 616-635 (2006).
- Padmanabhan Iyer, R., et al. Matrix metalloproteinase-9-dependent mechanisms of reduced contractility and increased stiffness in the aging heart. Proteomics - Clinical Applications. 10 (1), 92-107 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved