Method Article
마우스 두개안면 조직 및 분해되지 않은 뼈의 조직 준비 및 면역 염색
* 이 저자들은 동등하게 기여했습니다
요약
여기에서, 우리는 마우스 두개안면 조직을 사용하여 면역 염색에 의해 두개안면 형태 형성/병인 동안 단백질 수준을 검출하고 정량화하는 상세한 프로토콜을 제시합니다. 또한, 우리는 면역 염색을 위한 젊은 마우스에게서 decalcified 되지 않은 단단한 조직의 준비 그리고 저온 절제를 위한 방법을 기술합니다.
초록
조직 면역 염색은 주어진 조직 내의 관심 있는 단백질의 고도로 특이하고 믿을 수 있는 검출을 제공합니다. 여기에서 우리는 예를 들면 마우스 두개안면 조직을 사용하여 두개안면 형태 형성/병인 도중 단백질 발현을 검출하는 완전하고 간단한 프로토콜을 기술합니다. 프로토콜은 조직의 준비 및 냉동 부피, 간접 면역 형광, 이미지 수집 및 정량화로 구성됩니다. 또한 면역 염색을위한 비해짐 경조직의 준비 및 냉동 절제 방법은 두개안면 조직과 긴 뼈를 예로 들수 있습니다. 그 방법은 두개안면 형태 형성/병인 동안 다양한 조직에서 단백질 발현 및 형태학적/해부학적 변화를 결정하는 데 핵심적인 것입니다. 그(것)들은 또한 적당한 수정을 가진 그밖 조직에 적용가능합니다. 연구 결과에 대한 지식과 섹션의 높은 품질은 실험 결과에서 과학적 결론을 도출하는 데 중요합니다. 이 방법론의 잠재적 한계는 항체의 특이성 및 정량화의 어려움에 한정되지 않으나, 이는 또한 여기에서 논의된다.
서문
얼굴은 인간 정체성의 중요한 부분이며 상피, 근육, 뼈, 연골, 치아와 같은 여러 가지 유형의 조직으로 구성됩니다. 그 조직은 모든 3개의 세균 층에서 파생됩니다: ectoderm, 내배엽및 중배엽 1,2. 두개안면 조직의 적절한 패터닝 및 개발을 위해서는 Wnt, Fgf, Hh 및 Bmp 경로3,4와 같은 특정 신호 경로에 의해 세포 증식, 사망 및 분화가 고도로 조정되고 조절되어야 합니다. ,5. 세포의 증식, 생존 또는 분화의 결함은 가장 자주 발생하는 선천성 선천성 선천적 인 결함 중 하나 인 두개안면 기형으로 이어질 것입니다. 형질전환 마우스는 두개안면 형태 형성 및 병인의 메커니즘을연구하는 데 유용한 도구1, 2,3,4,5. 발달과 병인 동안 두개안면 구조의 변화를 이해하는 것은 주요 발달 원리뿐만 아니라 두개안면 기형의 메커니즘을 명확히하는 데 도움이 될 것입니다1,2,3 ,4,5.
특정 항체를 가진 전체 마운트 또는 단면 조직의 염색은 관심 있는 단백질의 공간 분포를 결정하기 위한 귀중한 기술이다 6. 공식적으로, 조직 면역 염색은 면역 조직 화학 (IHC) 또는 면역 형광 (IF)에 의존 할 수 있습니다. IHC에 의해 3,3'-디아미노벤지딘(DAB)과 같은 발색성 기질로 생성된 불투명 반응 생성물과 비교하여, IF는 형광 현미경 검사법에 의해 보이는 형광 접합체의 사용을 포함한다. 따라서 IF는 배경 잡음으로부터 양성 세포를 명확하게 구별할 수 있으며, ImageJ 및 Adobe Photoshop7,8과같은 소프트웨어에 의해 이미지를 정량적으로 분석하고 향상시킬 수 있다. 전체 마운트 염색 접근법은 작은 조직 블록 (두께 5mm 미만)에서 작동하며섹션9, 10에서 재건 할 필요없이 단백질 / 항원의 위치에 대한 3 차원 정보를 제공 할 수있습니다. . 그러나, 조직 단면도와 비교해, 전체 마운트 면역 염색은 시간이 오래 걸리고 항체 해결책의 대량을 요구합니다. 모든 항체가 기본 전체 마운트 접근법과 호환되는 것은 아닙니다. 또한, 항체의 불완전한 침투는 고르지 못한 염색 또는 거짓 음성 염색을 초래할 것이다. 여기에서 우리는 단면조직에 단백질/항원의 면역형광 검출에 집중할 것입니다. 단단한 조직(예를 들어, 머리, 치아, 긴 뼈)의 경우, 발달/병인 동안 칼슘 침착은 면역 염색 치료 동안 시료를 단면화하기 어렵게 하고 쉽게 헹구게 한다11,12. 현재 이용 가능한 대부분의 프로토콜은 절편을 쉽게 하기 위해 삽입하기 전에 단단한 조직을 decalcify, 이는 시간이 많이 걸리고 부적절하게 처리하는 경우 샘플의 형태 및 항원을 파괴 할 수있다11,12. 문제를 극복하기 위해, 우리는 decalcification없이 단단한 조직의 냉동 절제에 대한 접근 방식을 최적화, 그들의 형태와 신호 단백질의 분포의 개선 시각화로 이어지는.
여기서 기술된 프로토콜은 BMP 형질전환 마우스의 두개안면 조직에서 형태측정 및 조직학적 변화를 결정하는 데 사용되고 있다. 구체적으로, 이 프로토콜은 (1) 두체 조직을 수확및 해부하는 것, (2) 실험 마커의 절편 및 면역염색(Ki67, pSmad1/5/9)과 TUNEL 염색, (3) 형광 현미경을 사용하여 단면을 이미징하고, 마지막으로 (4) 결과를 분석하고 정량화합니다. 탈석없이 경조직을 준비하고 저온절하는 프로토콜도기재되어있다. 그 방법은 두개안면 조직에 최적화되어 있습니다. 그(것)들은 또한 적당한 수정을 가진 견본의 각종 나이에서 그밖 조직에 적용가능합니다.
프로토콜
모든 마우스 실험은 연구에서 동물의 인도적 관리 및 사용을 다루는 미시간 대학 지침에 따라 수행되었다. 이 연구에서 사용된 모든 동물 절차는 미시간 대학의 기관 동물 관리 및 사용 위원회 (IACUC)에 의해 승인되었습니다 (프로토콜 #PRO00007715).
1. 조직 준비
-
배아 조직의 준비
- 10cm 접시 1개, 인산완충식염수(PBS)를 함유한 3.5cm 접시 1개, 임신한 마우스마다 PBS에 2 mL 4% 파라포름알데히드(PFA)가 들어있는 12웰 배양 플레이트 1개를 준비한다. 모든 페트리 요리와 접시를 얼음 위에 놓습니다.
참고: 연기 후드에 4% PFA를 처리합니다. - 앞서 설명한 바와 같이 집게와 가위로 얼음 차가운 PBS에서 임신 한 마우스에서 배아를 해부14.
- 간단히, CO2로 임신 마우스를 안락사, 집게로 배의 중심 아래 피부를 잡고 피부를 통해 잘라, 다음 부드럽게 기본 복근 벽에서 분리 피부를 당겨.
- 다음으로, 피부 절개의 동일한 라인을 따라 복강으로 잘라. 배아의 문자열을 포함하는 자궁을 제거하고 자궁 벽을 부드럽게 절단하여 배아를 제거합니다. 노른자 낭 및 양수와 같은 배아 조직은 제거됩니다.
- 각 배아에서 머리를 자르고 분리합니다.
- 플라스틱 전사 파이펫 또는 집게로 4% PFA를 포함하는 12웰 플레이트의 각 웰에 각 헤드를 옮김을 옮김을 넣습니다. 4°C에서 4°C의 PFA에서 4%의 시료를 4°C에서 PBS에서 헹구고 12시간 동안 부드럽게 흔들어 시료를 고정합니다.
참고: 배아일 16.5(E16.5)보다 어린 배아의 경우, 분리 후 직접 4% PFA로 배아 머리를 고정합니다. E16.5 이상 배아의 경우, 피부와 지방 조직을 머리에서 제거하고 고정하기 전에 얼음 차가운 PBS에서 여러 번 헹구십시오. - 냉동 보호 헤드.
- 플라스틱 전사 파이펫 또는 집게를 사용하여 PBS에서 30% 자당의 2 mL을 포함하는 새로운 12 웰 플레이트에 각 헤드를 옮김을 옮김. 머리가 접시의 바닥에 가라 앉을 때까지 4 °C에서 부드럽게 교반.
- 헤드를 포함합니다.
- 최적 절삭 온도(OCT) 화합물이 포함된 금형으로 냉동 보호 헤드를 옮니다. OCT에서 몇 분 동안 샘플을 평형화합니다. 집게로 샘플의 위치와 방향을 조정합니다.
- 금형을 드라이 아이스 위에 놓고 얼립니다. 냉동 절편이 준비될 때까지 -80°C의 비닐 봉지에 극저온을 보관하십시오.
참고: 시료의 트리밍 된 면은 임베딩 금형의 바닥을 향해야 합니다.
- 10cm 접시 1개, 인산완충식염수(PBS)를 함유한 3.5cm 접시 1개, 임신한 마우스마다 PBS에 2 mL 4% 파라포름알데히드(PFA)가 들어있는 12웰 배양 플레이트 1개를 준비한다. 모든 페트리 요리와 접시를 얼음 위에 놓습니다.
-
출생 후 분신되지 않은 경조직의 준비
- CO2를 가진 3 주 또는 3달 오래된 마우스에서 안락사 . 피부와 지방 조직을 제거하십시오. 머리 또는 긴 뼈를 마우스에서 자르고 분리합니다.
- 단계 1.1.3-1.1.4에 기재된 바와 같이 마우스의 머리 또는 긴 뼈를 고치고 냉동 보호한다.
- 1.1.5단계와 유사한 방식으로 8% 젤라틴에 포함시다. 냉동 부조가 될 때까지 - 80 °C에서 비닐 봉지에 cryomolds을 유지합니다.
참고: 여기서는 탈석화가 필요하지 않습니다. 8% 젤라틴을 준비하려면 8 g의 젤라틴을 PBS 100 mL와 섞고 전자레인지를 사용하여 끓입니다. 혼합물이 쉽게 끓는다는 점에 유의하십시오.
2. 냉동 부속
- OCT 또는 -25°C에 내장된 연조직을 위해 저온 온도를 -18°C로 설정하고 젤라틴에 내장된 비정형 경질 조직을 위해 더 낮게 설정합니다. 저온 온도에 평형을 위해 약 30 분 동안 저온 유지 챔버에 샘플을 유지합니다.
- 극저온에서 블록을 추방하십시오. OCT 드롭으로 장착하여 시편 척(티슈 홀더)에 블록을 고정시. 샘플의 트림된 면을 척에서 가장 멀리 유지합니다(작업자를 향하게 함).
- 블록 장착 척을 저온 극저온 물체 홀더에 로드합니다. 블레이드 홀더를 조정하여 시료를 기준으로 블레이드의 각도를 3°-5°로 만듭니다.
- 코팅 된 현미경 슬라이드에 10 μm 섹션을 수집합니다. RT에서 완전히 건조 된 다음 -80 °C에 보관하십시오.
3. 조직학적 염색 및 현미경 이미징
- 면역형광 염색
- -80 °C에서 슬라이드를 꺼내십시오. RT에서 1시간 동안 에어드라이 섹션에 슬라이드를 유지합니다. 0.1% PBST(0.1% 폴리에틸렌 글리콜 테르트-옥틸페닐 에테르PBS; 재료 표참조)에서 0.1%의 슬라이드를 헹구어 OCT를 세척하고 섹션을 투과시하기 위해 각각 5분 동안 세 번 참조하십시오.
- 선택적으로, 항원 회수(선택사항)를 수행한다.
- 구연산염 완충제 (10 mM 구연산 나트륨 pH 6)를 스테인딩 접시에 증기또는 수조로 95-100 °C로 예열합니다. 구연산염 버퍼에 슬라이드를 담그고 10 분 동안 배양하십시오.
- 스티머 나 수조에서 염색 접시를 RT로 가져 가라.
참고: 대안으로, Tris-EDTA 버퍼(10 mM Tris base, 1mM EDTA, 0.05% 트웬트 20, pH 9.0) 또는 EDTA 버퍼(1 mMEDTA, 0.05% 트웬20, pH 8.0)를 열 유도 항원 회수에 사용한다. 뜨거운 증기선 이외에 열 유도 항원 회수를 위해 압력 밥솥, 전자 레인지 또는 수조를 사용하십시오. 트립신 또는 펩신을 이용한 효소 유도 항원 회수는 또 다른 대안이다. 효소 검색의 농도 및 처리 시간을 최적화하여 손상된 부분을 방지합니다. 각 항체/항원 조합에 대한 항원 검색 방법을 최적화합니다.
- 각 슬라이드에 200 μL의 차단 용액 (5 % 당나귀 혈청을 0.1 % PBST로 희석)으로 30 분 동안 RT에서 인큐베이션한 다음 헹구지 않고 차단 용액을 제거하십시오.
- 1차 항체 또는 4°C에서 RT 또는 O/N에서 1시간 동안 차단 용액으로 희석된 100 μL의 각 슬라이드를 배양합니다. RT에서 각각 10분 동안 PBS로 슬라이드를 세 번 헹구십시오.
- RT. Rinse 슬라이드에서 1시간 동안 차단 용액에 희석된 이차 항체 100 μL로 각 슬라이드를 10분 동안 PBS에서 10분 동안 3회 배양합니다.
- 슬라이드를 마운트합니다.
- 슬라이드에 DAPI(4', 6-diamidino-2-phenylindole)와 함께 페이드 방지 매체 2방울을 넣습니다. 그런 다음 커버슬립으로 덮습니다.
- 이미지가 준비될 때까지 어두운 4°C에서 보관하십시오.
참고: 대안으로, DAPI 또는 Hoechst 33324 염료로 핵을 라벨을 붙인 후 RT에서 PBS에서 1:2,000을 희석한 다음 글리세롤로 장착합니다.
- 단말 디옥시클레오디딜 트랜스퍼라제 dUTP 닉 엔드 라벨링(TUNEL) 염색.
참고: 3'-하이드록실 테르미니(3'OH DNA termini)를 가진 이중 가닥 DNA는 세포에 있는 세포자멸 도중 형성될 것입니다. 여기서, 우리는 상용 키트를 사용하여 특정 염색에 의해 말단 디옥시뉴클레오디딜 트랜스퍼라제(TdT)를 활용한 디곡시게닌-뉴클레오티드와 DNA 단편라벨링을 통해 자리에 자유 3'OH DNA 테르미니를 라벨링하는 프로토콜을 제공한다(재료표 참조) ).- 선택적으로, TUNEL 염색 전에 1차 및 알렉사 플루오르-488 표지된 이차 항체를 가진 얼룩 섹션. 슬라이드를 PBS에서 10분 동안 세 번 헹구십시오.
참고: 이 단계는 동일한 슬라이드에서 단백질과 TUNEL의 이중 염색에 대한 선택 사항입니다. - RT. 린스 슬라이드에서 RT. 린스 슬라이드에서 5분 동안 100 μL Proteinasae K(10 mMS pH 7.5 및 5 mM EDTA)로 각 슬라이드를 100μl 씩 인큐베이션합니다.
참고: 각 조직 유형에 대한 단백질분해아제 K의 배양 시간 및 온도를 조정합니다. 4% PFA에 고정된 배아 헤드의 10 μm 섹션의 경우 RT에서 5분 동안 배양합니다. 프로틴라제 K를 사용하는 방법 이외에, 필요에 따라 대체 요법을 사용, 포함 하 여 (1) 갓 제조 0.1% 폴리에틸렌 글리콜 tert-옥틸페닐 에테르, 0.1% 구연산 나트륨, 37°C에서 10 분; (2) HCl (pH 2) 또는 0.25 % 트립신에서 0.25 % 펩신, 37 °C에서 10 분; (3) 0.1 M 구연산염 완충제 (pH 6)로 전자 레인지 조사. - 각 슬라이드에 차단 용액 200 μL (0.1 % PBST로 희석 된 5 % 당나귀 혈청)을 바르고 RT에서 30 분 동안 배양하고 헹구지 않고 차단 용액을 탭하십시오.
- 키트에서 공급되는 평형 버퍼의 50 μL을 RT의 각 슬라이드에 10s 이상 적용합니다.
- TdT 효소와 키트에 의해 공급되는 반응 완충액을 3:7의 비율로 혼합하여 반응 혼합물(작동 강도 TdT 효소)을 준비합니다. 각 슬라이드에 반응 혼합물의 50 μL을 적용하고, 37 °C에서 1 시간 동안 배양하십시오. 헹구지 않고 완충액을 탭합니다.
- 각 슬라이드에 키트에 의해 공급되는 스톱 버퍼(1:30ddH 2O에서 희석된 1:30)의 200 μL을 적용한 다음 RT에서 10분 동안 인큐베이션합니다.
- 로다민 항체로 라벨.
- 각 슬라이드에 미리 온난(RT) 안티 디곡시겐 응고체(로다민)(블로킹 용액에 희석된 1:1)를 50 μL을 적용합니다. RT에서 30분 동안 어두운 환경에서 배양합니다.
- PBS로 슬라이드를 10분 동안 세 번 헹구십시오. 슬라이드를 3.1.6 단계로 마운트합니다.
- 선택적으로, TUNEL 염색 전에 1차 및 알렉사 플루오르-488 표지된 이차 항체를 가진 얼룩 섹션. 슬라이드를 PBS에서 10분 동안 세 번 헹구십시오.
4. 이미징 획득
- 양성 대조군(표적 항원에 대해 양성 조직)을 사용하여 신호 라벨링 및 음성 대조군(표적 항원에 대한 1차 항체, 등형 조절 또는 음성 조직 제외)을 확인하여 형광 아래이미지의 배경을 평가합니다. 현미경.
- 음극 및 포지티브 컨트롤의 신호 강도를 기반으로 이미징을 위해 장비 및 카메라 조건(노출 및 기타 일반 설정)을 설정합니다.
참고: 이러한 조건은 (1) 이미징에 사용되는 카메라 및 현미경, (2) 항체 및 (3) 각 실험에 대한 조직에 따라 다릅니다. 두개안면 조직에 사용되는 일반적인 조건은 ISO 200이며 1/100s에서 1s까지의 노출 시간은 항체의 품질과 특이성에 따라 다릅니다. 적절한 배율은 샘플의 크기와 실험 목적에 따라 달라집니다. - 기존의 에피오레소레전스 현미경 또는 공초점 현미경으로 이미지를 수집합니다. 각 색상 채널에 대해 동일한 조건에서 이미지(해당 컨트롤 포함)를 수집합니다. 동일한 형식으로 이미지를 저장합니다(tiff는 정보를 보존하는 것이 가장 좋습니다).
5. 형광 정량화
참고: 통계적으로 다른 그룹 사이의 얼룩을 비교하는 것은 많은 경우에 더 유익할 것입니다. 면역형광 이미지를 사용하면 신호 밀도를 측정하거나, 양성 세포를 계산하거나, 양성 영역을 계산하여 단백질의 상대적 수준을 정량화합니다. 통계 분석을 위해, 생물학적으로 독립적인 샘플의 최소 수는 3이다. 일반적인 방법은 각 샘플에서 적어도 3개의 섹션을 생성하고 각 섹션에서 적어도 3개의 대표 영역에 대한 이미지를 찍는 것입니다.
-
ImageJ를 사용하여 형광 강도 정량화
- 소프트웨어를 열고 분석 > 측정 설정(값)을 사용하여 면적 및 통합 밀도만 선택되어 있는지 확인합니다. 파일 > 열림을 사용하여 이미지를 열어 분석합니다.
- 도구 모음을 사용하여 맨 왼쪽에 있는 사각형 또는 원 아이콘을 선택합니다. 선택 도구를 사용하여 이미지에서 분석할 영역을 선택합니다. 분석 > 측정을 사용하여 선택한 영역의 판독값과 결과 창에서 통합 밀도를 가져옵니다. 배경을 읽을 형광이 없는 양전지 옆의 영역을 선택합니다.
- 5.1.2단계를 반복하여 다른 이미지를 분석합니다. 분석할 영역을 첫 번째 이미지의 이미지와 일치하도록 조정했습니다.
- 분석이 끝나면 결과 창의 모든 데이터를 복사하고 스프레드시트에 붙여넣습니다.
- 보정된 형광 강도(CTCF)를 통합 밀도로 계산합니다(선택한 셀 영역 x 배경 판독값의 평균 형광 영역). 시료 간의 교정된 총 세포 형광의 차이를 비교하고 그래프를 만듭니다.
-
ImageJ를 사용하여 형광 이미지의 양성 세포 수의 정량화
- 수동 셀 카운트.
- 셀 카운터 플러그인을 설치하려면 ImageJ > 플러그인 > 분석을 사용합니다.
- 파일 > 열림을 사용하여 이미지를 열어 분석합니다. 플러그인 > 분석 > 셀 카운터를 사용하여 카운터 창과 결과 창을 엽니다.
참고: 셀 카운터는 스택에서 작동하지 않습니다. 스택 을 계산하려면 플러그인 플롯 Z 축프로파일을 사용한 다음 이미지 > 스택 > 플롯 Z 축 프로파일을 사용하여 파티클 추적 도구를 사용하여 움직이는 ROI의 강도를 모니터링합니다. 이 도구는 수동 또는 자동 중 하나가 될 수 있습니다. - 카운터 창 하단에 있는 버튼 중 하나를 클릭하여 계산을 시작합니다. 셀/오브젝트를 직접 클릭하여 완료될 때까지 계산합니다.
- 카운트 창에서 결과 단추를 클릭합니다. 계산된 총 셀 수는 결과 창에 표시됩니다. 결과 로그를 스프레드시트로 저장하고 분석합니다.
- 자동 셀 카운트.
- 파일 > 열림을 사용하여 이미지를 열어 분석합니다. 계속하기 전에 RGB 이미지를 회색 배율 이미지로 변환합니다.
- 이미지 > 조정 > 임계값을 사용하여 계산해야 하는 모든 영역을 선택합니다.
- 분석 > 입자 를 분석하여 셀/파티클 수를 가져옵니다. 특정 범위 내의 셀/파티클을 계산하기 위해 0-Infinity의 기본값 대신 유효한 입자 크기(예: 100-무한대)의 범위를 설정합니다. 결과 로그를 스프레드시트로 저장하고 분석합니다.
참고: 영역에서 다른 정보를 얻으려면 영역 외에 분석 > 측정 설정으로 이동하여 필요한 정보 옆에 있는 상자를 선택합니다.
- 수동 셀 카운트.
결과
배아 두개안면 조직 섹션
상기 단계에 따라, 머리는 배아의 날(E) 16.5 또는 18.5에서대조군(P0-Cre)또는 돌연변이체(신경 문장 세포에서 Bmpr1a, P0-Cre; caBmpr1a)에서배아를 해부하였다. 4 시간 동안 4 % PFA에 고정 한 후, 샘플을 OCT에 내장하고 코로나절하였다. 결과된 절편은 프로토콜에 따라 항원 검색 없이 pSmad1/5/9(다운스트림 BMP 신호 인자) 또는 Ki67(세포 증식 마커)에 대한 항체로 면역화되었다. 도시된 바와 같이, pSmad1/5/9 (도1A)및 Ki67 (그림1C)은대조군 배아의 정면 뼈에서 양성이었다. 돌연변이 배아에서, pSmad1/5/9의 수준이 증가하였다 (그림1B),Ki67의 그 감소하는 동안 (그림1D)정면 뼈에서. 그 견본에 있는 세포 죽음은 또한 프로토콜에 따라 확인되었습니다. 도시된 바와 같이, 돌연변이 배아의 전두골에서 대조군 배아보다 더 많은 세포사멸세포가 관찰되었다(도1E,F).
비정형 두개안면 조직 또는 긴 뼈 섹션
비정형 경조직에 대한 위의 단계에 따라, 3주 된마우스(P0-Cre; mTmG(멤브레인-토마토 및 멤브레인 GFP)로부터의 머리를 4% PFA로 고정시키고 8% 젤라틴에 내장하였다. 코로나 저온 절을 PBST로 세척하고 DAPI와 함께 안티 페이드 배지로 장착하였다. 그림 2A B는 젤라틴이 단면 된 조직에서 형광 신호를 방해하지 않는다는 것을 보여줍니다.
3주 령 또는 3개월 된 생쥐의 머리와 페모라를 사용하여 젤라틴이 삽입된 비정형 조직이 IF에 좋은지 여부를 확인하였다. 전체 머리와 페모라는 프로토콜에 따라 처리되고 단면화되었습니다. 결과된 절편은 SOX9 면역염색(도3) 또는 OSX 및 E11/포도플라닌 이중 면역염색(도 4)에 사용되었다. 도시된 바와 같이, 양호한 품질 섹션은 대퇴골의 외형 및 피질 구획을 포함한 3주 된 단단한 조직 대부분에서 수득되었다(도3A,B, 도 4A-D),정면 뼈 (도4E, F),절개 (그림3E,F, 도 4I,J), 비강 조직 (그림3C,D), 및 비강 - premaxilla 봉합사 및 주변 뼈를 포함하는 두개골 (그림4G,H )을 머리로 합니다. 반면, 3개월 된 시료를 사용하여, 좋은 품질의 단면도는 대퇴골의 흔적 구획을 포함한 일부 경질 조직에서만 수득되었다 (도3G,H, 도 4K,L),비강 조직 (그림3I) ,J)및 두개골을 포함하는 비강-프리맥실라 봉합사 및 주변 뼈(도4M,N)를 머리의. 도3에 나타낸 바와 같이, SOX9 양성 세포는 대퇴골 및 비강 중격으로부터 성장판(도3B)과관절(도3H)의연골세포에서 특이히 검출되었다(도3D,J). 3주 된 절개에서, SOX9은 중간엽 세포에서 검출되었다(도3F). OSX 및 E11 이중 염색 결과는 OSX가 조골세포에서 검출된 반면, E11은 대퇴골과 머리로부터 뼈의 골혈구에서 검출된 것으로 나타났다(도4B,D, H, L,N). 3주 간 절개에서, OSX는 오돈토블라스트에서 양성이었고, E11은 모낭 중간엽세포에서 양성이었다(도 4J). 이러한 결과는 젤라틴이 포함된 비석화되지 않은 단단한 조직이 항원 기능을 잘 보존한다는 것을 나타냅니다.
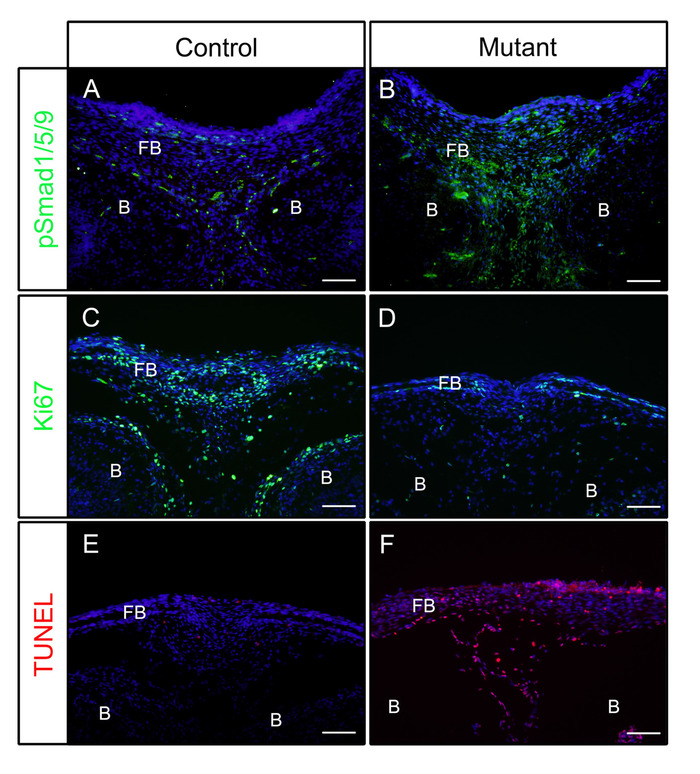
도 1: BMP 활성이 향상된 대조군 배아 및 돌연변이 배아에서 pSmad1/5/9, Ki67 또는 TUNEL의 IF 결과의 예. 구성적으로 활성화된 Bmpr1a(caBmpr1a) 마우스를 P0-Cre 마우스와 교차하여 신경 문장 세포(NCC)에서 BMP 신호 활성을 증가시하였다. 제어의 머리(P0-Cre; caBmpr1a++)및 돌연변이 (P0-Cre ;caBmpr1afx/+) 배아는 E16.5 또는 E18.5에서 해부되었고, 4 시간 동안 4 % PFA로 고정되었으며, 1 일 동안 30 % 자당으로 냉동 보호, OCT에 내장되어 있습니다. -18 °C에서 냉동 절제. 정면 뼈의 단면도 (눈과 유사한 수준) pSmad1/5/9, Ki67, 또는 TUNEL 염색에 대하여 면역 검출을 위해 이용되었습니다. (A,B) pSmad1/5/9 (녹색) 전두엽 뼈의 염색패턴 (A) 또는 돌연변이체 (B) 배아 E16.5. (C,D) Ki67 (녹색) 대조군 (C) 또는 돌연변이체 (D)배아의 정면 뼈에서 E18.5에서 염색 패턴. (E,F) 조정 (빨간색) 제어의 정면 뼈에 얼룩 패턴(E) 또는 돌연변이 (F) E18.5에서 배아. 핵을 DAPI(파랑)로 염색하였다. FB = 정면 뼈, B = 뇌. 배율 막대 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
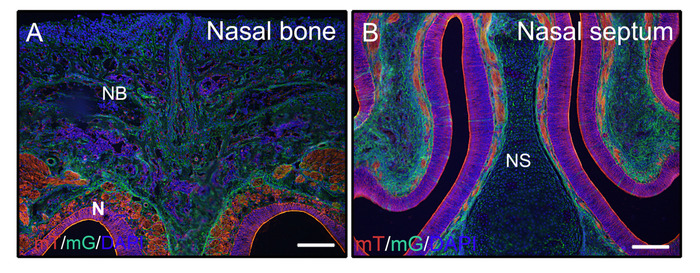
도 2: mTmG 리포터 신호 의 예로는 머리에 있는 비분해 조직들의 결과. 3주 된 P0-Cre 마우스에서 멤브레인 토마토 및 멤브레인 GFP(mTmG)를 가진 헤드를 해부하고, 4시간 동안 4% PFA로 고정하고, 2일 동안 30% 자당으로 냉동 보호하고, 8% 젤라틴에 내장하고, -25°C에서 저온절을 하였다. 머리 섹션은 명확하게 GFP를 표시 (녹색, Cre 재조합 양성) 및 토마토 (빨강, Cre 재조합 음성) 비강 조직및 비강 조직(A,B). 핵을 DAPI(파랑)로 염색하였다. NB = 비강 뼈, N = 비강 조직, NS = 비강 중격. 배율 막대 = 250 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
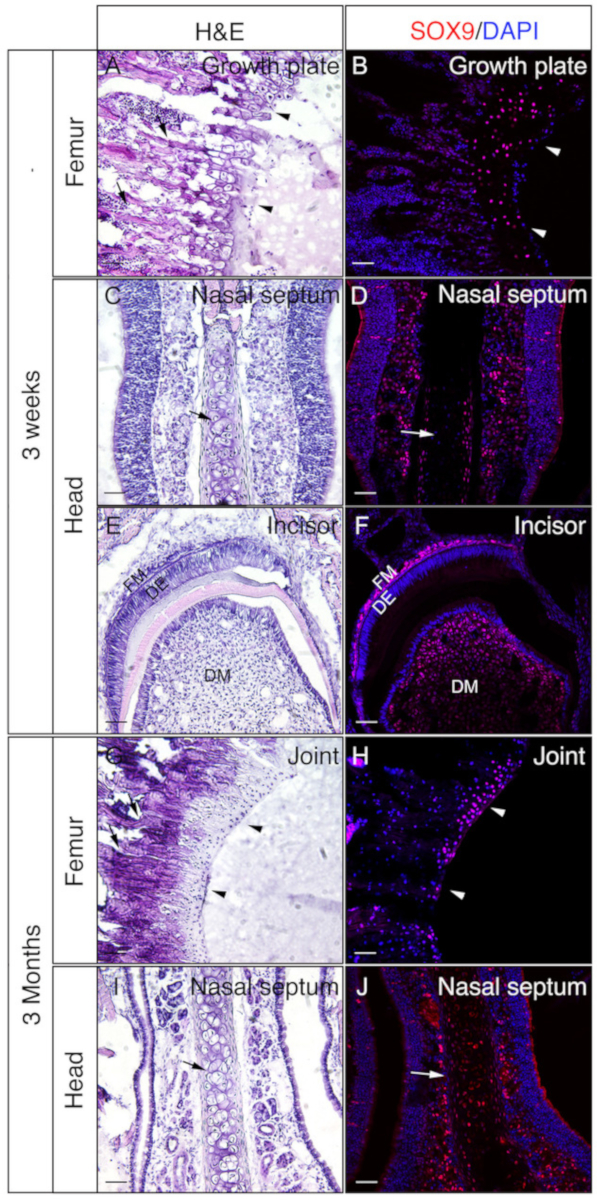
도 3: SOX9 면역 염색 의 예는 머리와 페모라에서 비정형 조직의 결과. 머리와 페모라는 3주 또는 3개월 된 생쥐로부터 해부하고, 4시간 동안 4% PFA로 고정하고, 2일 동안 30% 자당으로 저온 보호하고, 8% 젤라틴에 내장하고, -25°C에서 저온절구를 하였다. 슬라이드는 SOX9(적색)에 대한 면역 검출을 위해 사용되었다. 핵을 DAPI(파랑)로 염색하였다(B,D, F, H,J). 그 조직의 인접한 부분은 헤마톡실린 및 에오신 (H&E) 염색(A, C, E, G,I)에 사용되었다. A와 B의 화살표 머리는 성장 판을 나타내고 G와 H, 관절 연골을 나타냅니다. A와 G의 화살표는 근방 뼈와 C, D, I 및 J, 비강 중격을 나타냅니다. DM = 치과 중간엽, DE = 치과 상피, FM = 여포 중간엽. 배율 막대 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
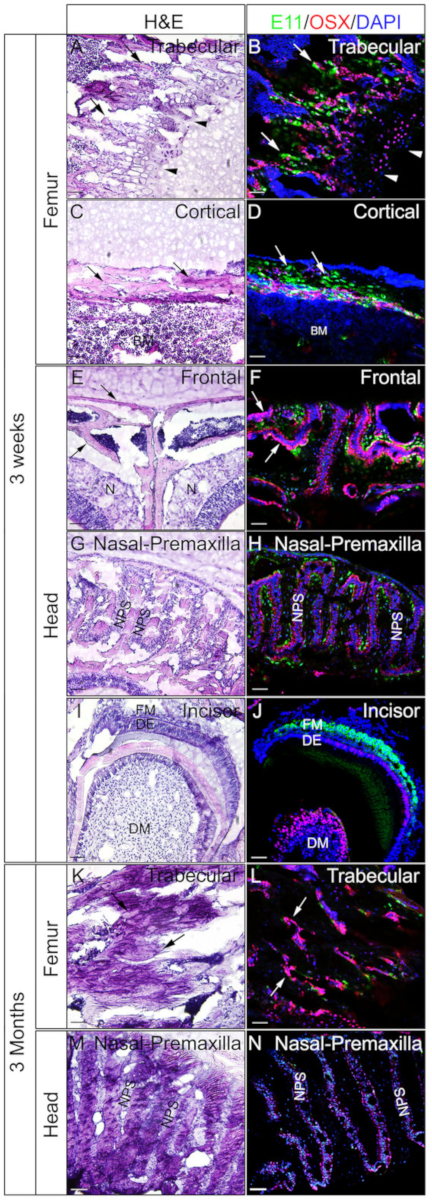
도 4: OSX 및 E11 이중 면역 염색 결과 머리와 페모라에서 의 비정형 조직의 예. 머리와 페모라는 3주령 또는 3개월된 생쥐로부터 해부하고, 4시간 동안 4% PFA로 고정하고, 2일 동안 30% 자당으로 냉동 보호하고, 8% 젤라틴에 내장하고, -25°C에서 냉동절제하였다. 섹션은 OSX (적색) 및 E11/포도플라닌 (녹색)에 대하여 항체를 가진 이중 면역 염색을 위해 이용되었습니다. 핵은 DAPI(파랑)로 염색하였다(B,D, F, H, J, L,N). 그 조직의 인접한 부분은 H&E 염색(A, C, E, G, I, K,M)에 사용되었다. A, B, K 및 L의 화살표는 대퇴골의 흔적 구획을 나타냅니다. C 및 D, 대퇴골의 피질 구획; 그리고 E와 F에서, 정면 뼈. A와 B의 화살촉은 성장 판을 나타냅니다. BM = 골수, N = 비강 조직, DM = 치과 중간엽, DE = 치과 상피, FM = 여포 중간엽, NPS = 비강 프리맥실라 봉합사. 전두엽 뼈(E,F) 및 비강 프리맥실라 봉합사 및 주변 뼈 (G,H, M,N)도 표시됩니다. 배율 막대 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에서 우리는 마우스 헤드 및 dedecalcified 뼈 조직의 준비를 위한 상세한 프로토콜을 제공하고, 세포 증식, 세포 사멸 및 BMP 신호 마커의 면역 염색을 위한 냉동 부피. 우리는 또한 면역 형광 이미지에서 정량적 데이터를 얻기위한 전략을 자세히 설명합니다. 그 방법은 또한 적절한 수정을 가진 그밖 조직에 적용될 수 있습니다.
조직 준비를위한 조건은 조직의 크기와 유형에 따라 다릅니다. 고정 및 냉동 보호 시간은 일반적으로 하룻밤에 몇 시간이 필요합니다. 고정 후, 조직은 파라핀에 내장되어 마이크로토메16으로단면화 될 수 있습니다. 파라핀과 OCT 는 면역 염색에 잘 작동하지만, 그들 사이에는 몇 가지 차이점이 있습니다. 파라핀 블록은 RT에서 수년 동안 보관할 수 있으며 OCT 블록은 -80 °C에서 1 년 동안 유지됩니다. 파라핀은 조직 형태를 보존하며, OCT 포함 중에 형성된 얼음 결정은 조직 구조에 부정적인 영향을 줄 수 있습니다. 파라핀은 때때로 항원의 에피토프를 가리고, OCT는 효소 활동과 항원 에피토프를 보존합니다. 따라서, 4% PFA에 고정된 경우 대부분의 항체에 대한 항원 회수의 필요성이 4시간 이하에 불과하고 OCT에 내장되어 있다. 그것은, 그러나, 항원 검색에 의해 더 나은 결과를 얻을 수, 긍정적 인 대조는 저온 절에 좋은 염색 결과를 보여주지 않은 경우.
Hoechst 염료와 DAPI는 모두 핵 카운터 염색에 사용할 수 있습니다. 그들은 유사성을 가지고, 둘 다 (1) UV 흥분으로, 총 DNA 함량에 비례하는 신호를 방출하는 작은 홈 결합 화학 물질, (2) 긴 노출 후 사진 표백을 실시한다. 그러나 Hoechst 염료는 일반적으로 높은 투과성으로 인해 살아있는 세포에서 DNA 함량을 염색하는 데 사용됩니다. DAPI는 일반적으로 낮은 막 투과성으로 인해 고정 된 세포에서 DNA염색에 사용됩니다. 또한, DAPI는 Hoechst보다 더 강력하고 안정적인 신호를 생성합니다.
적절한 제어는 IF에 필수적입니다. 모든 새로운 항체의 특이성은 적용 가능한 경우 서양 얼룩 분석에 의해 확인되어야합니다. 특정 1 차 항체의 최적 작동 농도는 직렬 희석의 사용을 통해 결정되어야한다. 양성 대조군(단백질/항원을 발현하는 것으로 입증된 조직 또는 세포)을 포함하여 항체의 IF 공정 및 특이성을 확인해야 한다. 음성 대조는 또한, 예를 들어, 1차 항체의 부재, 또는 표적 항원에 대한 1차 항체, 또는 조직 음성에 대한 동일한 종으로부터의 정상 IgG의 치환을 포함해야 한다. 사진을 찍을 때, 이차 항체(배경 제어)가 없는 샘플은 각 채널과 독립적으로 검사하여 최종 이미징에 적응할 신호 게인 및 오프셋의 한계를 설정해야 합니다. 여러 레이블을 감지하려면 스펙트럼 중복 아티팩트를 방지하기 위해 백그라운드 제어 및 단일 레이블이 지정된 컨트롤을 준비해야 합니다. 각 채널의 자동 형광 수준이 크게 다르기 때문에 다중 라벨 샘플의 이미지를 얻는 데 사용되는 모든 채널은 독립적 인 배경 보정을 받아야합니다.
우리는 또한 젤라틴에 내장 된 비수정 된 하드 조직의 준비 및 냉동 절제프로토콜을 제공합니다. OCT 임베디드 데칼화 된 하드 조직의 경우, 대부분의 경질 조직 섹션은 슬라이드의 낮은 접착 특성 때문에 면역 염색 절차 중에 슬라이드 안경에서 분리됩니다. 냉동 절편을 용이하게하도록 설계된 접착제 테이프는 좋은 품질의 섹션을 생성하는 데 도움이됩니다. 그러나 테이프가 벗겨지면 이러한 섹션이 쉽게 손상됩니다. 젤라틴 임베디드 조직의 경우, 좋은 품질의 섹션을 생성하기 위해 테이프 전달 시스템이 필요하지 않습니다. 포함 배지로서, 젤라틴은 OCT에 비해 점도가 낮지만, 젤라틴은 세포의 뇌 조직17,18 및 초박형 절편과 같은 다른 조직학적 응용 분야에서 사용되어 왔지만, 샘플을 잘 침투할 수 있습니다. 면역 세포 화학19. 여기에서, 젤라틴은 OCT보다 저온 절편이 쉬운 블록을 생성하는 비해지지 않은 뼈를 포함하는 데 사용되었다. 젤라틴 임베디드 의 좋은 부분을 얻기 위해 몇 가지 작은 팁이 있습니다. 중요한 단계는 OCT 대신 젤라틴을 포함시키는 것입니다. 더 나은 침투를 얻으려면 샘플이 바닥에 가라 앉은 후 샘플을 30 % 자당에 하루 더 보관하십시오. 온도를 약 -25°C에서 평소보다 낮게 설정하는 것이 똑같이 중요합니다. 매우 날카로운 블레이드가 필요하지 않습니다. 낮은 저온 온도 (-25 °C)는 OCT 임베디드 의 저온 절제에 대한 몇 가지 개선을 하지만, 조직 구조의 좋은 무결성을 얻기 위해 여전히 어렵다. 도2, 도3, 및 도4에 도시된 바와 같이, 면역 염색에 적용되는 양질의 섹션은 젤라틴 임베디드 경질 조직(예를 들어, 궤적 뼈, 피질 뼈, 두개골 뼈, 비강 조직 및 절개)으로부터 수득하였다. 그 결과는 젤라틴 임베딩이 경질 조직 단면의 표본 무결성을 현저하게 향상시키지만, 또한 유리를 미끄러지게 하는 단면의 접착력을 향상시킨다는 것을 증명했습니다. 또한 젤라틴은 항원 기능을 보존하고 형광 신호 및 면역 염색과의 호환성을 나타냅니다. 그러나 이 기술은 최대 3개월 된 샘플에 대해서만 잘 작동합니다. 이 방법의 잠재적 개선은 (1) 조직의 구조를 간단하게하기 위해 다른 부분에서 대상 조직을 분리하기 위해 샘플을 추가로 해부하는 것입니다 (치아의 경우, 하악골 또는 상악골은 전체 머리 대신 해부및 고정되어야함) (2) 10% EDTA를 사용하여 냉동 보호 전에 2-3일 동안만 조직을 데칼화합니다. 데칼화의 이 짧은 시간은 면역 염색 결과를 손상시키지 않을 것입니다. 또 다른 관심사는 비 수성 포함 매체로서 젤라틴을 슬라이드에서 쉽게 제거 할 수 없으므로 염색 방법 (예 : H & E 염색)에 따라 더 높은 배경으로 이어질 수 있습니다.
면역 염색 결과는 정량화하기 쉽지 않습니다, 그래서 그들은 일반적으로 반 정량적으로 사용됩니다. 두개안면 조직의 면역 염색의 어려움 및 제한은 다음과 같은 것을 포함하지만 이에 제한되지 는 않습니다: (1) 두개안면 조직의 구조의 복잡성으로 인해 계산되는 영역을 정의하기는 어렵습니다. (2) 면역염색의 비선형 성질로 인해 표지된 영역 또는 표지된 세포를 정의하는 것은 어렵다; (3) 신호의 동적 범위에 대한 정보가 제한되어 있다; (4) 이미지 수집 시 형광 신호의 퇴색으로 인해 이미지 또는 그룹 간의 신호 강도를 비교하기가 어렵습니다. (5) 신호 배경은 항체, 슬라이드 및 샘플 사이에서 유의히 변화할 수 있다. 정량화 결과의 신뢰성을 높이기 위해 실험은 신중하고 엄격하게 수행되어야 합니다. 모든 샘플은 동일한 조건에서 처리되어야 합니다. 면역 염색 동안, 신호 배경을 평가하고 신호에 대한 양성 영역 또는 세포를 정의하기 위해 다양한 제어가 요구된다. 설득력 있고 대표적인 이미지를 사용하여 계산할 영역과 대비가 좋은 레이블이 지정된 셀을 명확하게 표시합니다. 또한 이미지 수집 중에는 카메라 설정 및 장비 설정을 일관되게 유지해야 합니다.
종합하면, 우리는 마우스 두개안면 조직에 면역 형광에 대한 간단한 표준 프로토콜을 제시, 특히 decalcified 하드 조직에 대한. 두개안면 조직의 면역 염색 분석은 발달 중에 형태 형성의 메커니즘을 이해하는 데 도움이 될뿐만 아니라 발병 기전 동안의 변화를 보여줍니다. 또한, 면역염색은 또한 세포 증식, 세포 사멸 및 BMP 신호화 경로 외에 다른 신호화 경로 리간드, 수용체, 또는 다른 표현형 마커의 발현 패턴을 연구하는데 사용될 수 있다. 그러나, 면역 염색 실험의 중요한 단계는 특정 염색및 최소화된 비특이적 배경 신호를 얻기 위하여 각 항원/항체 또는 조직에 대해 적당하게 수정되어야 합니다.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 국립 보건원 (R01DE020843 ~ Y.M.), 국제 FOP 협회 (Y.M.), 중국 국립 자연 과학 재단 (31500788 ~ J.Y.)의 보조금 지원으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Adhesive tape | Leica | #39475214 | |
| Alexa fluor 488-goat anti-Rabbit secondary antibody | Invitrogen | A-11034 | |
| Antifade Mountant with DAPI | Invitrogen | P36931 | |
| Bovine serum albumin | Sigma | A2153 | |
| Coverslips | Fisher Brand | 12-545-E | |
| Cryostat | Leica | CM1850 | |
| EDTA | Sigma | E6758 | |
| Fluorescence microscope | Olympus | BX51 | |
| Gelatin | Sigma | G1890 | |
| In Situ Cell Death Detection Kit | Millipore | S7165 | |
| Microscope slides | Fisher Brand | 12-550-15 | |
| OCT Compound | Fisher Healthcare | 23-730-571 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | Sigma | P4417 | |
| Polyethylene glycol tert-octylphenyl ether | Sigma | T9284 | Triton X-100 |
| Proteinase K | Invitrogen | AM2542 | |
| Rabbit anti-Ki67 antibody | Cell Signaling Technology | 9129 | Lot#:3; RRID:AB_2687446 |
| Rabbit anti-pSmad1/5/9 antibody | Cell Signaling Technology | 13820 | Lot#:3; RRID:AB_2493181 |
| Sodium citrate | Sigma | 1613859 | |
| Sucrose | Sigma | S9378 | |
| Tris | Sigma | 10708976001 |
참고문헌
- Trinh, L. e. A., Fraser, S. E. Imaging the cell and molecular dynamics of craniofacial development: challenges and new opportunities in imaging developmental tissue patterning. Current Topics in Developmental Biology. 115, 599-629 (2015).
- Marcucio, R., et al. Facial morphogenesis: physical and molecular interactions between the brain and the face. Current Topics in Developmental Biology. 115, 299-320 (2015).
- Graf, D., et al. Common mechanisms in development and disease: BMP signaling in craniofacial development. Cytokine & Growth Factor Reviews. 27, 129-139 (2016).
- Snider, T. N., Mishina, Y. Cranial neural crest cell contribution to craniofacial formation, pathology, and future directions in tissue engineering. Birth Defects Research Part C: Embryo Today. 102 (3), 324-332 (2014).
- Mishina, Y., Snider, T. N. Neural crest cell signaling pathways critical to cranial bone development and pathology. Experimental Cell Research. 325 (2), 138-147 (2014).
- Van Hecke, D. Routine Immunohistochemical Staining Today: Choices to Make, Challenges to Take. Journal of Histotechnology. 1, 45-54 (2002).
- Xiao, C., Dan-Bi, C. Double staining immunohistochemistry. North American Journal of Medical Sciences. 2 (5), 241-245 (2010).
- Zongli, Q., et al. Comparison of immunofluorescence and immunohistochemical staining with anti-insulin antibodies on formalin-fixed paraffin-embedded human pancreatic tissue microarray sections. International Journal of Clinical and Experimental Pathology. 10 (3), 3671-3676 (2017).
- Montgomery, S. C., Cox, B. C. Whole mount dissection and immunofluorescence of the adult mouse cochlea. Journal of Visualized Experiments. (107), e53561 (2016).
- Dun, X. P., Parkinson, D. B. Whole mount immunostaining on mouse sciatic nerves to visualize events of peripheral nerve regeneration. Methods in Molecular Biology. 1739, 339-348 (2018).
- Akkiraju, H., et al. An Improved Immunostaining and Imaging Methodology to Determine Cell and Protein Distributions within the Bone Environment. Journal of Histochemistry & Cytochemistry. 64 (3), 168-178 (2016).
- González-Chávez, S. A., et al. Assessment of different decalcifying protocols on Osteopontin and Osteocalcin immunostaining in whole bone specimens of arthritis rat model by confocal immunofluorescence. International Journal of Clinical and Experimental Pathology. 6 (10), 1972-1983 (2013).
- Kapelsohn, K. Improved Methods for Cutting, Mounting, and Staining Tissue for Neural Histology. Protocol Exchange. , (2015).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of Visualized Experiments. (85), e50803 (2014).
- Shi, S. R., et al. Antigen retrieval techniques: current perspectives. Journal of Histochemistry & Cytochemistry. 49 (8), 931-937 (2001).
- Adell, T., et al. Immunohistochemistry on paraffin-embedded planarian tissue sections. Methods in Molecular Biology. 1774, 367-378 (2018).
- Griffioen, H. A., et al. Gelatin embedding to preserve lesion-damaged hypothalami and intracerebroventricular grafts for vibratome slicing and immunocytochemistry. Journal of Neuroscience Methods. 43, 43-47 (1992).
- Sarkar, S., et al. In situ demonstration of Fluoro-Turquoise conjugated gelatin for visualizing brain vasculature and endothelial cells and their characterization in normal and kainic acid exposed animals. Journal of Neuroscience Methods. 219 (2), 276-284 (2013).
- Oorschot, V., et al. A novel flat‐embedding method to prepare ultrathin cryosections from cultured cells in their in situ orientation. Journal of Histochemistry & Cytochemistry. 50, 1067-1080 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유