Method Article
Préparation des tissus et immunostaining des tissus craniofacial de souris et de l'os non décalcifié
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous présentons un protocole détaillé pour détecter et quantifier des niveaux de protéine pendant la morphogénèse/pathogénie craniofacial par immunostaining utilisant des tissus craniofacial de souris comme exemples. En outre, nous décrivons une méthode pour la préparation et la cryosectioning des tissus durs non décalcifiés des jeunes souris pour immunostaining.
Résumé
L'immunostaining tissulaire fournit la détection très spécifique et fiable des protéines d'intérêt dans un tissu donné. Ici nous décrivons un protocole complet et simple pour détecter l'expression de protéine pendant la morphogenèse/pathogénie craniofacial utilisant des tissus craniofacial de souris comme exemples. Le protocole consiste en la préparation et la cryosection des tissus, l'immunofluorescence indirecte, l'acquisition d'images et la quantification. En outre, une méthode pour la préparation et la cryosectioning des tissus durs non décalcifiés pour immunostaining est décrite, utilisant des tissus craniofacial et des os longs comme exemples. Ces méthodes sont essentielles pour déterminer l'expression des protéines et les changements morphologiques/anatomiques dans divers tissus pendant la morphogénèse craniofaciale/pathogénie. Ils sont également applicables à d'autres tissus avec des modifications appropriées. La connaissance de l'histologie et la haute qualité des sections sont essentielles pour tirer des conclusions scientifiques à partir des résultats expérimentaux. Les limites potentielles de cette méthodologie comprennent, sans s'y limiter, la spécificité des anticorps et les difficultés de quantification, qui sont également discutées ici.
Introduction
Le visage est un élément clé de l'identité humaine, et est composé de plusieurs types de tissus, tels que l'épithélium, muscle, os, cartilage, dent. Ces tissus sont dérivés des trois couches germinales: ectoderm, endoderm, et mesoderm1,2. Pour le bon modelage et le développement des tissus craniofacial, la prolifération cellulaire, la mort et la différenciation doivent être fortement coordonnées et réglées par des voies de signalisation spécifiques, telles que Wnt, Fgf, Hh et Bmp voies3,4 ,5. Les défauts dans la prolifération, la survie ou la différenciation des cellules mèneront aux malformations craniofacial, qui sont parmi les défauts congénitaux les plus fréquents de naissance. Les souris transgéniques sont des outils utiles pour étudier les mécanismes de la morphogénèse craniofaciale et de la pathogénie1,2,3,4,5. Comprendre les changements dans les structures craniofaciales au cours du développement et de la pathogénie aidera à clarifier les principes clés du développement ainsi que les mécanismes des malformations craniofaciales1,2,3 ,4,5.
La coloration de monture entière ou de tissus sectionnés avec des anticorps spécifiques est une technique inestimable pour déterminer la distribution spatiale des protéines d'intérêt 6. Formellement, l'immunostaining de tissu peut compter sur l'immunohistochimie (IHC) ou l'immunofluorescence (IF). Par rapport au produit de réaction opaque produit avec un substrat chromogénique tel que 3,3'-Diaminobenzidine (DAB) par IHC, IF implique l'utilisation de conjugués fluorescents visibles par microscopie fluorescence. Par conséquent, IF peut clairement différencier les cellules positives du bruit de fond, et permet aux images d'être quantitativement analysées et améliorées d'une manière simple par des logiciels tels que ImageJ et Adobe Photoshop7,8. L'approche de coloration de montage entier fonctionne sur de petits blocs de tissu (moins de 5 mm d'épaisseur), qui peuvent fournir des informations tridimensionnelles sur l'emplacement des protéines/antigènes sans avoir besoin de reconstruction des sections9,10 . Cependant, par rapport aux sections de tissu, l'immunostaining de montage entier prend le temps et exige de grands volumes de solutions d'anticorps. Tous les anticorps ne sont pas compatibles avec l'approche de base de la monture entière. En outre, la pénétration incomplète des anticorps entraînera une coloration inégale ou une fausse coloration négative. Ici, nous nous concentrerons sur la détection d'immunofluorescence des protéines/antigènes sur les tissus sectionnés. Pour les tissus durs (par exemple, tête, dent, os long), le dépôt de calcium pendant le développement/pathogénie rend l'échantillon difficile à sectionner et facilement rincé pendant le traitement immunostaining11,12. La plupart des protocoles actuellement disponibles décalciment les tissus durs avant l'intégration pour faciliter la section, ce qui prend du temps et peut détruire la morphologie et les antigènes des échantillons s'ils sont manipulés de façon inappropriée11,12. Pour surmonter les problèmes, nous avons optimisé une approche pour la cryosection des tissus durs sans décalcification, conduisant à une meilleure visualisation de leur morphologie et la distribution des protéines de signalisation.
Le protocole décrit ici est utilisé pour déterminer les changements morphométriques et histologiques dans les tissus craniofacial des souris transgéniques BMP. Plus précisément, le protocole comprend (1) la récolte et la disséquement des tissus crâniens, (2) la section et l'immunostaining des marqueurs expérimentaux (Ki67, pSmad1/5/9) ainsi que la coloration TUNEL, (3) l'imagerie des sections à l'aide du microscope à fluorescence, et enfin (4) l'analyse et la quantification des résultats. Le protocole pour préparer et cryosection tissus durs sans décalcification est également décrit13. Ces méthodes sont optimisées pour les tissus craniofacial. Ils sont également applicables à d'autres tissus de différents âges d'échantillons avec des modifications appropriées.
Protocole
Toutes les expériences sur la souris ont été menées conformément aux lignes directrices de l'Université du Michigan concernant les soins et l'utilisation des animaux dans la recherche. Toutes les procédures animales utilisées dans cette étude ont été approuvées par le Comité institutionnel de soins et d'utilisation des animaux (IACUC) de l'Université du Michigan (Protocole #PRO00007715).
1. Préparation des tissus
-
Préparation des tissus embryonnaires
- Préparer un plat de 10 cm et plusieurs plats de 3,5 cm contenant de la saline tamponnée en phosphate (PBS), et une plaque de culture de 12 puits contenant 2 mL 4 % de paraformaldéhyde (PFA) en PBS dans chaque puits pour chaque souris enceinte. Déposer tous les plats Petri et l'assiette sur la glace.
REMARQUE: Manipulez 4% de PFA dans une hotte de fumée. - Disséquer les embryons de souris enceintes dans le PBS glacé avec des forceps et des ciseaux comme décrit précédemment14.
- En bref, euthanasier une souris enceinte avec CO2, saisir la peau sous le centre du ventre avec des forceps et couper à travers la peau seulement, puis tirez doucement sur la peau pour la séparer de la paroi musculaire abdominale sous-jacente.
- Ensuite, couper dans la cavité abdominale en suivant la même ligne de l'incision de la peau. Enlever l'utérus contenant une chaîne d'embryons et enlever les embryons en coupant doucement la paroi utérine. Les tissus extraembryonnaires tels que le sac jaune et l'amnion seront enlevés.
- Couper et isoler la tête de chaque embryon.
- Transférer chaque tête dans chaque puits d'une plaque de 12 puits contenant 4% de PFA avec une pipette de transfert en plastique ou des forceps. Fixer les échantillons dans 4 % de PFA à 4 oC pendant 4 h. Rincer les échantillons en PBS à 4 oC avec une secousse douce pendant 12 h.
REMARQUE: Pour les embryons de moins de 16,5 (E16.5) embryonnaires, fixez les têtes d'embryon avec 4 % de PFA directement après l'isolement. Pour les embryons à E16.5 ou plus tard, retirer pour jeter la peau et le tissu adipeux des têtes et rincer plusieurs fois dans le PBS froid de glace avant la fixation. - Cryoprotect têtes.
- Transférer chaque tête dans une nouvelle plaque de 12 puits contenant 2 ml de 30 % de saccharose en PBS à l'aide d'une pipette ou de forceps de transfert en plastique. Agiter doucement à 4 oC jusqu'à ce que la tête s'enfonce au fond du plat.
- Enclenché des têtes.
- Transférer la tête cryoprotégée dans un moule contenant un composé optimal de température de coupe (OCT). Equilibrate échantillons en OCT pendant plusieurs minutes. Ajuster l'emplacement et la direction des échantillons avec des forceps.
- Placer le moule sur de la glace sèche pour congeler. Conserver les cryomolds qui en résultent dans un sac en plastique à -80 oC jusqu'à ce qu'ils soient prêts à être cryosectionné.
REMARQUE: Le côté taillé des échantillons doit faire face au fond du moule d'encastrement.
- Préparer un plat de 10 cm et plusieurs plats de 3,5 cm contenant de la saline tamponnée en phosphate (PBS), et une plaque de culture de 12 puits contenant 2 mL 4 % de paraformaldéhyde (PFA) en PBS dans chaque puits pour chaque souris enceinte. Déposer tous les plats Petri et l'assiette sur la glace.
-
Préparation des tissus durs non décalcifiés postnatals
- Euthanasier à 3 semaines ou 3 mois souris avec CO2. Enlever la peau et les tissus adipeux. Couper et isoler la tête ou les os longs de la souris.
- Fixer et cryoprotéger la tête ou le long os des souris tel que décrit dans les étapes 1.1.3-1.1.4.
- Encastré dans 8% de gélatine de la même manière que l'étape 1.1.5. Conserver les cryomolds dans un sac en plastique à -80 oC jusqu'à ce que la cryosection soit cryosection.
REMARQUE: La décalcification n'est pas nécessaire ici. Pour préparer 8 % de gélatine, mélanger 8 g de gélatine avec 100 ml de PBS et faire bouillir à l'aide d'un micro-ondes. Sachez que le mélange bout facilement.
2. Cryosectioning
- Fixer la température du cryostat à -18 oC pour les tissus mous incorporés dans l'OCT ou à -25 oC et plus bas pour les tissus durs non décalcifiés incorporés dans la gélatine. Conserver les échantillons dans la chambre cryostat pendant environ 30 min pour l'équilibre à la température du cryostat.
- Expulser le bloc du cryomold. Congelez le bloc sur le mandrin de spécimen (porte de tissu) par le montage avec une baisse d'OCT. Gardez le côté paré de l'échantillon le plus éloigné du mandrin (face à l'opérateur).
- Chargez le mandrin monté sur le support de l'objet cryostat. Ajustez le support de la lame pour que l'angle de la lame soit de 3 à 5 degrés par rapport à l'échantillon.
- Recueillir des sections de 10 m sur des lames de microscope enduites. Sécher complètement les sections à RT, puis les stocker à -80 oC.
3. Staining histologique et imagerie microscopique
- Coloration d'immunofluorescence
- Sortez les toboggans à partir de -80 oC. Gardez les diapositives à RT pendant 1 h pour les sections de dry. Rincer les diapositives dans 0,1 % de PBST (0,1 % D'éthylène glycol tert-octylyl dans PBS; voir Table of Materials) trois fois pendant 5 min chacun pour laver les sections OCT et perméabilize.
- Optionnellement, effectuer la récupération d'antigène (facultatif).
- Préchauffer le tampon de citrate (10 mM de citrate de sodium pH 6) dans le plat de coloration avec vapeur ou bain d'eau à 95 à 100 oC. Immerger les glissières dans le tampon de citrate, couver pendant 10 min.
- Sortez le plat de coloration du vapeur ou du bain d'eau pour RT. Refroidir les toboggans à RT pendant 20 min ouplus 15.
REMARQUE: Comme alternatives, utilisez le tampon Tris-EDTA (base Tris 10 mM, 1mM EDTA, 0,05% Tween 20, pH 9.0) ou edTA buffer (1 mM EDTA, 0.05% Tween 20, pH 8.0) pour la récupération d'antigène induite par la chaleur. Utilisez un autocuiseur, un four à micro-ondes ou un bain d'eau pour la récupération d'antigènes induits par la chaleur, en plus du vapeur chaud. Une récupération d'antigène induite par l'enzyme à l'aide de trypsine ou de pepsine est une autre alternative. Optimiser la concentration et le temps de traitement de la récupération enzymatique pour éviter les sections dommageables. Optimisez la méthode de récupération d'antigène pour chaque combinaison anticorps/antigène.
- Incuber chaque diapositive avec 200 l de solution de blocage (5% de sérum d'âne dilué en 0,1% DepBST) à RT pendant 30 min, puis retirer la solution de blocage sans rincer.
- Incuber chaque diapositive avec 100 oL d'anticorps primaires ou d'anticorps dilués dans la solution de blocage pendant 1 h à RT ou O/N à 4 oC. Rincer les diapositives avec PBS trois fois pendant 10 min chacune à RT.
- Incuber chaque diapositive avec 100 l d'anticorps secondaires dilués dans la solution de blocage pendant 1 h à RT. Rinse glisse en PBS trois fois pendant 10 min chacun à RT. Protégez les diapositives de la lumière.
- Monts coulis.
- Ajouter deux gouttes de milieu anti-fade avec DAPI (4', 6-diamidino-2-phenylindole) sur la diapositive. Ensuite, couvrez-le d'un bordereau.
- Conserver à 4 oC dans l'obscurité jusqu'à ce qu'il soit prêt à l'image.
REMARQUE: Comme alternative, étiquetez les noyaux avec DAPI ou Hoechst 33324 colorant dilué 1:2,000 dans PBS à RT d'abord, puis monter avec du glycérol.
- Terminal deoxynucleotidyl transferase dUTP nick end labeling (TUNEL) coloration.
REMARQUE: L'ADN à double brin avec 3'-hydroxyl termini (3'OH DNA termini) se formera pendant l'apoptose dans la cellule. Ici, nous fournissons un protocole qui étiquete le termini d'ADN 3'OH gratuit in situ via l'étiquetage des fragments d'ADN avec la digoxinine-nucléotide en utilisant terminal deoxynucleotidyl transferase (TdT) par coloration spécifique à l'aide d'un kit commercial (voir Tableau des matériaux ).- Optionnellement, les sections de tache avec les anticorps secondaires primaires et Alexa Fluor-488 étiquetés avant la coloration de TUNEL. Rincer les diapositives en PBS trois fois pendant 10 min chacune.
REMARQUE: Cette étape est facultative pour une double coloration d'une protéine et TUNEL dans la même diapositive. - Incuber chaque diapositive avec 100 L Proteinase K (10 g/mL en 10 mM Tris pH 7,5 et 5 mM EDTA) pendant 5 min à RT. Rinse glisse avec PBS trois fois pendant 10 min chacun à RT.
REMARQUE: Ajuster le temps d'incubation et la température de Proteinase K pour chaque type de tissu. Pour 10 sections de têtes d'embryons fixées en 4% PFA, incuber pendant 5 min à RT. En plus de la méthode utilisant Proteinase K, utiliser des traitements alternatifs au besoin, y compris (1) fraîchement préparé 0,1% Polyéthylène glycol tert-octylyl éther, 0,1% de citrate de sodium, 10 min à 37 oC; (2) 0,25 % à 0,5 % de Pepsin en HCl (pH 2) ou 0,25 % de trypsine, 10 min à 37 oC; et (3) irradiation micro-ondes avec tampon de citrate de 0,1 M (pH 6). - Appliquer 200 l de solution de blocage (5 % de sérum d'âne dilué en 0,1 % de PBST) sur chaque diapositive, incuber à RT pendant 30 min, appuyez sur la solution de blocage sans rincer.
- Appliquer 50 ll du tampon d'équilibre fourni par le kit sur chaque diapositive à RT pendant au moins 10 s. Appuyez sur le tampon sans rinçant.
- Préparer le mélange de réaction (enzyme TdT de force de travail) en mélangeant TdT Enzyme avec le tampon de réaction fourni par le kit au rapport de 3:7. Appliquer 50 ll du mélange de réaction sur chaque diapositive et incuber à 37 oC pendant 1 h. Appuyez sur le tampon sans rincer.
- Appliquer 200 l l de la mémoire tampon d'arrêt (1:30 diluée en ddH2O) fournie par le kit à chaque diapositive, puis incuber à RT pendant 10 min. Rincer les diapositives avec PBS trois fois pendant 10 min chacune.
- Étiquette avec anticorps Rhodamine.
- Appliquer 50 ll de conjugué anti-digoxigenine (rhodamine) (1:1 dilué dans la solution de blocage) à chaque diapositive. Incuber à RT pendant 30 min dans l'obscurité.
- Rincer les diapositives avec PBS trois fois pendant 10 min chacune. Le mont glisse comme étape 3.1.6.
- Optionnellement, les sections de tache avec les anticorps secondaires primaires et Alexa Fluor-488 étiquetés avant la coloration de TUNEL. Rincer les diapositives en PBS trois fois pendant 10 min chacune.
4. Acquisition d'imagerie
- Utiliser des contrôles positifs (tissus positifs pour l'antigène cible) pour vérifier l'étiquetage du signal et les contrôles négatifs (omettre l'anticorps primaire, contrôle de l'isotype ou des tissus négatifs pour l'antigène cible) pour évaluer l'arrière-plan des images sous le fluorescent microscope.
- Définir les conditions de l'équipement et de la caméra (expositions et autres paramètres généraux) pour l'imagerie en fonction de l'intensité du signal des contrôles négatifs et positifs.
REMARQUE: Ces conditions varient par (1) caméras et microscopes utilisés pour l'imagerie, (2) anticorps et (3) tissus pour chaque expérience. Les conditions courantes utilisées pour les tissus craniofacial sont ISO 200 avec un temps d'exposition allant de 1/100 s à 1 s dépendent de la qualité et la spécificité des anticorps. Les grossissements appropriés varient selon la taille des échantillons et le but des expériences. - Acquérir des images avec un microscope épifluorescence classique ou un microscope confocal. Acquérir des images (y compris celles des contrôles correspondants) dans les mêmes conditions pour chaque canal couleur. Enregistrer des images avec le même format (tiff est le meilleur pour préserver l'information).
5. Quantification de la fluorescence
REMARQUE: Dans de nombreux cas, la comparaison statistique des taches entre les différents groupes sera plus instructive. Avec les images d'immunofluorescence, quantifiez le niveau relatif de la protéine en mesurant la densité du signal, en comptant les cellules positives ou en calculant les zones positives. Pour l'analyse statistique, le nombre minimum d'échantillons biologiquement indépendants est de 3. Une méthode typique consiste à générer au moins trois sections de chaque échantillon et à prendre des images pour au moins trois zones représentatives dans chaque section.
-
Quantification de l'intensité de la fluorescence à l'aide d'ImageJ
- Ouvrez le logiciel, et utilisez Analyze 'gt; Set Measurements pour vérifier que seule la zone et la densité intégrée sont sélectionnées. Utilisez le Fichier 'gt; Ouvrez pour ouvrir les images à analyser.
- Utilisez la barre d'outils pour sélectionner l'icône carrée ou circulaire à l'extrême gauche. Sélectionnez la zone à analyser sur l'image à l'aide de l'outil de sélection. Utilisez Analyze 'gt; Mesure pour obtenir la lecture de la zone sélectionnée et la densité intégrée dans la fenêtre Résultats. Sélectionnez une région à côté d'une cellule positive qui n'a pas de fluorescence pour lire l'arrière-plan.
- Répétez l'étape 5.1.2 pour analyser d'autres images. Ajusté la zone à analyser pour correspondre à celle de la première image.
- Copiez toutes les données de la fenêtre Résultats et collez dans une feuille de calcul une fois terminée sa mise en analyse.
- Calculer l'intensité de fluorescence corrigée (CTCF) comme densité intégrée — (Zone de cellule sélectionnée x Fluorescence moyenne des lectures de fond). Comparez la différence de fluorescence cellulaire totale corrigée entre les échantillons et faites un graphique.
-
Quantification du nombre de cellules positives d'images fluorescentes à l'aide d'ImageJ
- Comptage manuel des cellules.
- Utilisez ImageJ 'gt; Plugins 'gt; Analyse pour installer le plugin Cell Counter.
- Utilisez le Fichier 'gt; Ouvrez pour ouvrir les images à analyser. Utilisez Plugins et Analyse pour ouvrir la fenêtre Counter et la fenêtre Résultats.
REMARQUE: Le compteur cellulaire ne fonctionne pas sur les piles. Pour compter les piles, plugin Plot Z Axis Profile, puis utilisez image 'gt; Stacks 'gt; Plot Z Axis Profile pour surveiller l'intensité d'un retour sur investissement en mouvement à l'aide d'un outil de suivi des particules. Cet outil peut être manuel ou automatique. - En cliquant sur l'un des boutons au bas de la fenêtre Counter pour initier le comptage. Cliquez directement sur une cellule/objet à compter jusqu'à la fin.
- Cliquez sur le bouton Résultats dans la fenêtre Compter. Le nombre total de cellules comptées sera indiqué dans la fenêtre Résultats. Enregistrez le journal des résultats sous forme de feuille de calcul et analysez.
- Comptage automatisé des cellules.
- Utilisez le Fichier 'gt; Ouvrez pour ouvrir les images à analyser. Convertissez l'image RGB en une image à l'échelle grise avant de procéder.
- Utilisez l'Image 'gt; Ajuster 'gt; Seuil pour sélectionner toutes les zones qui doivent être comptées.
- Utilisez Analyze 'gt; Analyser les particules pour obtenir le nombre de cellules / particules. Définir une plage de la taille de particules valides (par exemple, 100-Infinity) au lieu de la valeur par défaut de 0-Infinity pour compter les cellules/particules dans une plage spécifique. Enregistrez le journal des résultats sous forme de feuille de calcul et analysez.
REMARQUE: Pour obtenir d'autres informations de l'image, en plus de la zone, allez à analyser les mesures et définir les mesures et sélectionnez la boîte à côté de l'information nécessaire.
- Comptage manuel des cellules.
Résultats
Sections embryonnaires de tissu craniofacial
Après les étapes ci-dessus, les têtes ont été disséquées du contrôle (P0-Cre) ou mutant (bmpr1a activé de façon constitutive dans les cellules de crête neurale, P0-Cre; caBmpr1a) embryons au jour embryonnaire (E) 16.5 ou 18.5. Après fixation dans 4% PFA pendant 4 h, les échantillons ont été incorporés dans OCT et coronally cryosectionné. Les sections obtenues étaient immunostained avec des anticorps contre pSmad1/5/9 (facteurs de signalisation en aval de BMP) ou Ki67 (un marqueur de prolifération cellulaire) sans récupération d'antigène selon le protocole. Comme nous l'avons montré, pSmad1/5/9 (figure 1A) et Ki67 (figure 1C) étaient positifs dans les os frontaux des embryons témoins. Chez les embryons mutants, les niveaux de pSmad1/5/9 ont été augmentés (figure 1B), tandis que ceux de Ki67 ont été diminués (figure 1D) dans les os frontaux. La mort cellulaire dans ces échantillons a également été vérifiée selon le protocole. Comme nous l'avons vu, plus de cellules apoptotiques ont été observées dans les os frontaux des embryons mutants que dans celles des embryons témoins (Figure 1E,F).
Tissus craniofacial non décalcifiés ou longues sections osseuses
Suivant les étapes ci-dessus pour les tissus durs non décalcifiés, les têtes des souris de 3 semaines(P0-Cre; mTmG (membrane-tomate et membrane GFP)) ont été fixées avec 4% PFA et incorporées dans la gélatine de 8%. Les cryosections coronales ont été lavées avec PBST et montées avec le milieu anti-fade avec DAPI. Figure 2A ,B démontrent que la gélatine n'interfère pas avec les signaux fluorescents des tissus sectionnés.
Des têtes et des fémoras des souris de 3 semaines ou de 3 mois ont été employées pour vérifier si les tissus non décalcifiés incorporés de gélatine sont bons pour IF. Les têtes entières et la fémora ont été traitées et sectionnés selon le protocole. Les sections qui en ont résulté ont été utilisées pour l'immunostaining SOX9 (figure 3) ou OSX et E11/Podoplanin double immunostaining (Figure 4). Comme nous l'avons vu, des sections de bonne qualité ont été obtenues à partir de la plupart des tissus durs de 3 semaines, y compris les compartiments trabeculaires et corticaux du fémur (Figure 3A, B, Figure 4A-D), les os frontaux (Figure 4E, F), l'incisor (Figure 3E, F, Figure 4I,J), tissus nasaux ( Figure3C,D), et le crâne, y compris la suture nasale-prémaxillaire et les os environnants ( Figure4G,H ) de la tête. Alors que, avec des échantillons de 3 mois, des sections de bonne qualité n'ont été obtenues que dans certains tissus durs, y compris les compartiments trabeculaires du fémur (Figure 3G, H, Figure 4K, L), tissus nasaux ( Figure3I ,J), et le crâne, y compris la suture nasale-premaxilla et les os environnants (Figure 4M, N) de la tête. Comme le montre la figure 3, des cellules positives SOX9 ont été détectées spécifiquement dans les chondrocytes de la plaque de croissance (figure 3B) et de l'articulation (figure 3H) du fémur, et du septum nasal (Figure 3D, J). Dans l'inciseur de 3 semaines, SOX9 a été détecté dans les cellules mésenchymales (Figure 3F). Les résultats de la double coloration OSX et E11 ont montré qu'OSX avait été détecté dans les ostéoblastes, tandis que l'E11 était détecté dans les ostéocytes des os du fémur et de la tête ( Figure 4B,D,H,L,N ). Dans l'incisor de 3 semaines, OSX était positif dans les odontoblasts, tandis que E11 était positif dans les cellules mésenchymales folliculaires (Figure 4J). Ces résultats indiquent que les tissus durs non décalcifiés incorporés avec la gélatine bien-préserver les fonctions d'antigène.
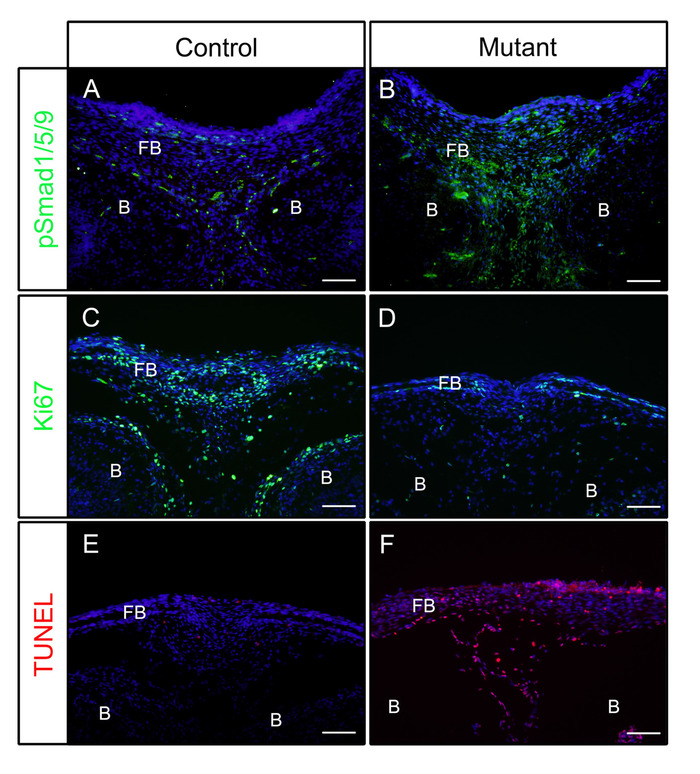
Figure 1 : Exemples de résultats IF de pSmad1/5/9, Ki67 ou TUNEL dans les embryons témoins et les embryons mutants avec une activité BMP améliorée. Des souris Bmpr1a activées de façon constitutive (caBmpr1a) ont été croisées avec des souris P0-Cre pour augmenter l'activité de signalisation de BMP dans les cellules neurales de crête (NCCs). Les têtes de contrôle (P0-Cre;caBmpr1a)et mutantes (P0-Cre;caBmpr1afx/MD) embryons ont été disséqués à E16.5 ou E18.5, fixé avec 4% PFA pour 4h, cryoprotégé avec 30% de saccharose pour 1 jour, intégré dans OCT, OCT, et cryosectionné à -18 oC. Des sections de l'os frontal (niveau semblable avec l'oeil) ont été employées pour l'immunodétection contre pSmad1/5/9, Ki67, ou tUNEL coloration. (A, B) pSmad1/5/9 (vert) modèles de coloration dans les os frontaux de contrôle (A) ou mutants (B) embryons à E16.5. (C, D) Ki67 (vert) motifs de coloration dans les os frontaux de contrôle (C) ou mutants (D) embryons à E18.5. (E, F) TUNEL (rouge) motifs de coloration dans les os frontaux de contrôle (E) ou mutants (F) embryons à E18.5. Les noyaux étaient tachés de DAPI (bleu). FB - os frontal, B et cerveau. Barres d'échelle de 100 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
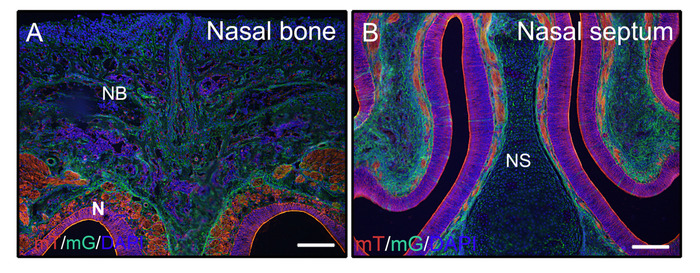
Figure 2 : Des exemples de signaux de signal de journaliste mTmG des tissus non décalcifiés dans la tête. Des têtes de souris P0-Cre de 3 semaines avec membrane-tomate et membrane GFP (mTmG) journaliste ont été disséquées, fixées avec 4% PFA pour 4h, cryoprotégées avec 30% de saccharose pendant 2 jours, incorporées dans 8% de gélatine, et cryosectionnées à -25 oC. Les sections de tête montrent clairement le signal gFP (vert, recombinaison de Cre positif) et tomate (rouge, recombinaison de Cre négatif) dans l'os nasal et les tissus nasaux (A, B). Les noyaux étaient tachés de DAPI (bleu). NB - os nasal, N - tissus nasaux, NS et septum nasal. Barres d'échelle de 250 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
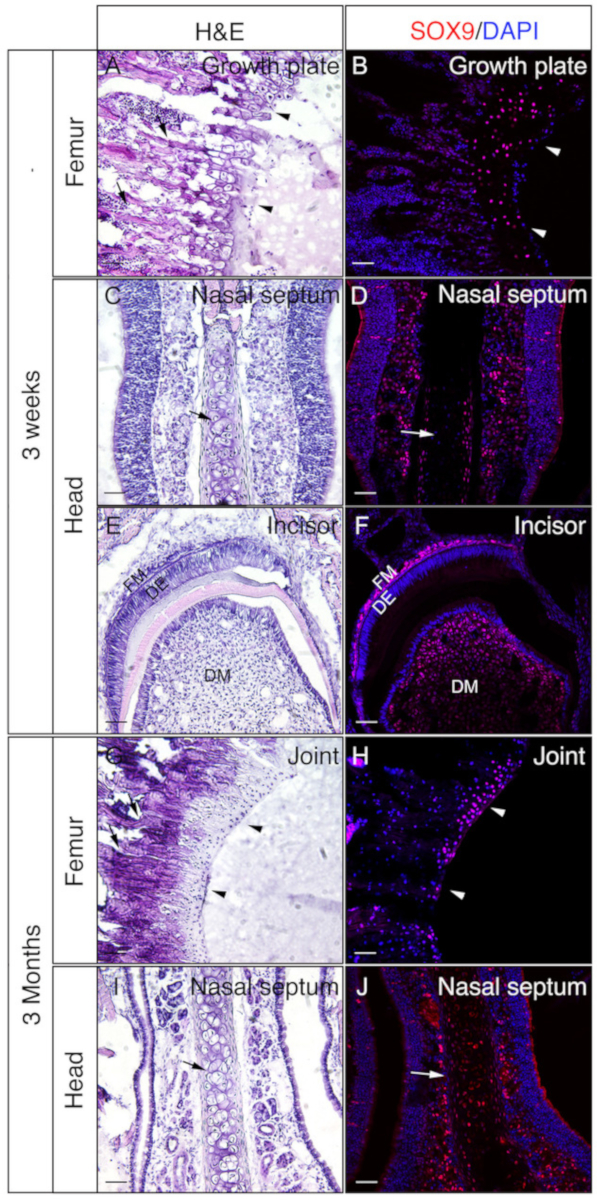
Figure 3 : Exemples de résultats immunostaining SOX9 des tissus non décalcifiés dans la tête et la fémora. Les têtes et les fémoras ont été disséqués à partir de souris de 3 semaines ou 3 mois, fixées à 4% DE PFA pour 4h, cryoprotégées à 30% de saccharose pendant 2 jours, incorporées dans 8% de gélatine, et cryosectionnées à -25 oC. Des diapositives ont été employées pour l'immunodétection contre SOX9 (rouge). Les noyaux ont été tachés de DAPI (bleu) (B, D, F, H, J). Des sections adjacentes de ces tissus ont été utilisées pour la coloration de l'hématoxylin et de l'éosine (H et E)(A, C, E, G, I). Les têtes de flèche en A et B indiquent la plaque de croissance et dans G et H,cartilage articulaire. Les flèches en A et G indiquent les os trabeculaires et dans C, D, I et J, septum nasal. DM - mésenchyme dentaire, DE - épithélium dentaire, FM - mésenchyme follicule. Barres d'échelle de 50 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
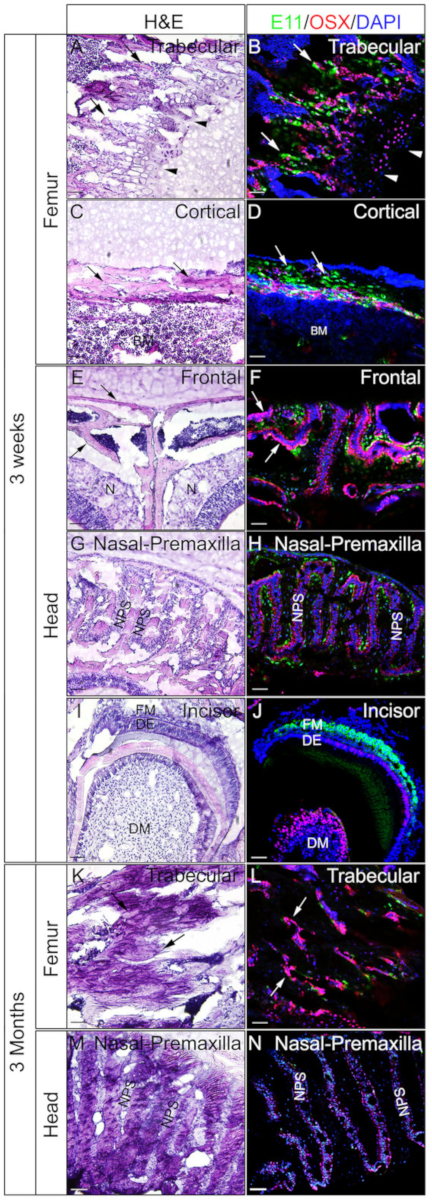
Figure 4 : Exemples de résultats d'IMMUNOstaining d'OSX et d'E11 de tissus non décalcifiés dans la tête et la fémora. Les têtes et les fémoras ont été disséqués à partir de souris de 3 semaines ou 3 mois, fixées avec 4% de PFA pour 4h, cryoprotégées avec 30% de saccharose pendant 2 jours, incorporées dans 8% de gélatine, et cryosectionnées à -25 oC. Des sections ont été employées pour l'immunostaining double avec des anticorps contre OSX (rouge) et E11/Podoplanin (vert). Les noyaux ont été tachés de DAPI (bleu) (B, D, F, H, J, L, N). Des sections adjacentes de ces tissus ont été utilisées pour la coloration de H et E (A, C, E, G, I, K, M). Les flèches en A, B, K et L indiquent des compartiments trabeculaires du fémur; C et D, compartiments corticaux du fémur; et en E et F, les os frontaux. Les pointes de flèche dans A et B indiquent la plaque de croissance. BM - moelle osseuse, N - tissus nasaux, DM - mésenchyme dentaire, DE - épithélium dentaire, FM - mésenchyme follicule, NPS - suture nasale prémaxillaire. Les os frontaux (E, F) et la suture nasale-premaxilla et les os environnants (G, H, M, N) sont également montrés. Barres d'échelle de 50 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Ici nous fournissons un protocole détaillé pour la préparation de la tête de souris et des tissus osseux non décalcifiés, et la cryosection ingation pour l'immunostaining de la prolifération cellulaire, de la mort cellulaire, et des marqueurs de signalisation de BMP. Nous détaillons également la stratégie d'obtention de données quantitatives à partir d'images immunofluorescentes. Ces méthodes peuvent également s'appliquer à d'autres tissus avec des modifications appropriées.
Les conditions de préparation des tissus varient selon la taille et le type de tissus. Le temps de fixation et de cryoprotection nécessite généralement plusieurs heures à la nuit. Après fixation, le tissu peut également être incorporé dans la paraffine et sectionné avec un microtome16. Bien que la paraffine et l'OCT fonctionnent bien pour l'immunostaining, il y a quelques différences entre eux. Les blocs de paraffine peuvent être conservés pendant plusieurs années à RT, tandis que les blocs OCT sont pour 1 an à -80 oC. La paraffine préserve la morphologie des tissus, tandis que le cristal de glace formé pendant l'intégration OCT peut affecter négativement les structures tissulaires. La paraffine masque parfois des épitopes d'antigènes, tandis que l'OCT préserve les activités enzymatiques et les épitopes d'antigène. Par conséquent, il n'y a aucun besoin de récupération d'antigène pour la plupart des anticorps s'ils sont fixés en 4% PFA pour seulement 4 h ou moins et intégrés dans OCT. Il est, cependant, encore possible d'obtenir de meilleurs résultats par la récupération d'antigène, si les contrôles positifs n'ont pas montré de bons résultats de coloration dans les cryosections.
Le colorant Hoechst et le DAPI peuvent être utilisés pour la contre-coloration nucléaire. Ils ont des similitudes, car les deux (1) sont des produits chimiques légers à rainure uv pour émettre des signaux proportionnels à la teneur totale en ADN, et (2) sont soumis à un blanchiment photo après une longue exposition. Cependant, les colorants Hoechst sont généralement utilisés pour tacher la teneur en ADN dans les cellules vivantes en raison de leur perméabilité élevée. DAPI est généralement utilisé pour tacher l'ADN dans les cellules fixes en raison de sa faible perméabilité de la membrane. En outre, DAPI génère un signal plus fort et plus stable que Hoechst.
Des contrôles appropriés sont essentiels pour LA FI. La spécificité de chaque nouvel anticorps doit être confirmée par l'analyse western blot, le cas échéant. La concentration de travail optimale d'un anticorps primaire particulier doit être déterminée par l'utilisation de dilutions en série. Un contrôle positif (tissu ou cellule qui est prouvé pour exprimer la protéine/antigène) devrait être inclus pour vérifier le processus de FI et la spécificité de l'anticorps. Un contrôle négatif devrait également être inclus, par exemple, l'absence de l'anticorps primaire, ou la substitution de l'IgG normal de la même espèce pour l'anticorps primaire, ou des tissus négatifs pour l'antigène cible. Lors de la prise de photos, l'échantillon sans anticorps secondaires (contrôle de fond) doit être examiné indépendamment avec chaque canal pour fixer les limites du gain de signal et de compensation pour être adapté pour l'imagerie finale. Pour la détection de plusieurs étiquettes, le contrôle des arrière-plan et les commandes à étiquette unique doivent être préparés pour éviter les artefacts de chevauchement spectral. Tous les canaux qui seront utilisés pour obtenir une image d'un échantillon à étiquettes multiples doivent être soumis à une correction de fond indépendante, car le niveau d'autofluorescence dans chaque canal varie considérablement.
Nous fournissons également le protocole pour la préparation et la cryosection des tissus durs non décalcifiés incorporés dans la gélatine. Pour les tissus durs déscalcifiés intégrés oct, la plupart des sections de tissu dur seront détachées des verres de glissière pendant des procédures d'immunostaining, en raison de leur caractère bas d'adhérence sur la glissière. Le ruban adhésif conçu pour faciliter la cryosectionnage aide à générer des sections de bonne qualité. Mais, ces sections sont facilement endommagées lorsque le ruban est décoller. Pour les tissus incorporés à la gélatine, il n'est pas nécessaire d'avoir un système de transfert de ruban adhésif pour générer des sections de bonne qualité. En tant que milieu d'intégration, la gélatine peut bien s'infiltrer dans l'échantillon, bien qu'elle ait une viscosité plus faible par rapport à l'OCT. La gélatine a été utilisée dans d'autres applications histologiques, telles que le tissu cérébral17,18 et les sections ultraminces des cellules pour l'immunocytochimie19. Ici, la gélatine a été utilisée pour incorporer l'os non décalcifié, qui génère des blocs plus faciles à cryosection que OCT. Il y a plusieurs petits bouts pour obtenir de bonnes sections des tissus durs incorporés de gélatine non décalcifiés. L'étape critique consiste à intégrer la gélatine au lieu de l'OCT. Pour obtenir une meilleure pénétration, conservez les échantillons dans 30% de saccharose un jour de plus après que les échantillons coulent au fond. Il est tout aussi important de fixer la température plus bas que d'habitude à environ -25 oC. Une lame ultra-forte n'est pas nécessaire. Bien qu'une température cryo plus basse (-25 oC) apporte quelques améliorations pour la cryosection des tissus durs non décalcifiés oct, il est encore difficile d'obtenir une bonne intégrité des structures tissulaires. Comme le montre la figure 2, la figure 3et la figure 4, des sections de bonne qualité applicables à l'immunostaining ont été obtenues à partir de tissus durs incorporés à la gélatine (p. ex. os trabeculaires, os corticaux, os du crâne, tissus nasaux et inciseurs). Ces résultats ont prouvé que l'incorporation de gélatine améliore considérablement l'intégrité des sections de tissu dur, mais améliore également l'adhérence des sections aux verres de glissement. En outre, la gélatine préserve les fonctions d'antigène, et montre la compatibilité avec les signaux fluorescents et immunostaining. Cependant, cette technique ne fonctionne bien que pour les échantillons jusqu'à 3 mois. Les améliorations potentielles de cette méthode sont (1) de disséquer davantage les échantillons pour séparer le tissu cible d'autres parties pour rendre la structure du tissu simple (dans le cas des dents, la mandibule ou le maxillaire doit être disséqué et fixé au lieu de la tête entière) et (2) d'utiliser 10 % d'EDTA pour décalcier les tissus pendant seulement 2 à 3 jours avant la cryoprotection. Ce court laps de temps de décalcification ne compromettra pas les résultats immunostaining. Une autre préoccupation est que, en tant que milieu d'intégration non aqueous, la gélatine ne peut pas être facilement enlevée des diapositives, ce qui peut conduire à un arrière-plan plus élevé en fonction des méthodes de coloration (par exemple, la coloration H et E).
Les résultats immunostaining ne sont pas faciles à quantifier, de sorte qu'ils sont généralement utilisés semi-quantitatif. Les difficultés et les limites de la quantification de l'immunostaining des tissus craniofacial incluent mais ne sont pas limités aux suivants : (1) il est difficile de définir la zone à compter en raison de la complexité de la structure des tissus craniofacial ; (2) il est difficile de définir la zone étiquetée ou les cellules étiquetées en raison de la nature non linéaire de l'immunostaining; (3) il y a peu d'informations sur la plage dynamique du signal; (4) il est difficile de comparer l'intensité des signaux entre les images ou les groupes en raison de la décoloration du signal fluorescent lors de l'acquisition de l'image; et (5) l'arrière-plan du signal peut changer considérablement entre les anticorps, les diapositives et les échantillons. Pour augmenter la fiabilité des résultats de quantification, l'expérience doit être effectuée avec soin et rigueur. Tous les échantillons doivent être traités dans les mêmes conditions. Pendant l'immunostaining, divers contrôles sont exigés pour évaluer le fond de signal et pour définir la zone ou les cellules positives pour le signal. Prenez des images convaincantes et représentatives pour montrer clairement la zone à compter et étiqueté cellules avec un bon contraste. De plus, lors de l'acquisition de l'image, le réglage de la caméra et de l'équipement doit être maintenu cohérent.
Pris ensemble, nous présentons un protocole standard simple pour l'immunofluorescence sur des tissus craniofacial de souris, particulièrement pour les tissus durs non décalcifiés. L'analyse immunostaining des tissus craniofacial aidera non seulement à comprendre le mécanisme de la morphogénèse pendant le développement, mais illustrera également les changements pendant la pathogénie. En outre, l'immunostaining peut également être employé pour étudier le modèle d'expression d'autres ligands de voie de signalisation, récepteurs, ou d'autres marqueurs phénotypiques, outre la prolifération cellulaire, la mort cellulaire, et la voie de signalisation de BMP. Cependant, les étapes critiques d'une expérience d'immunostaining doivent être modifiées convenablement pour chaque antigène/anticorps ou tissu pour obtenir la coloration spécifique et les signaux de fond non spécifiques réduits au minimum.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été soutenu par les National Institutes of Health (R01DE020843 à Y.M.), l'International FOP Association (Y.M.) et une subvention de la National Natural Science Foundation of China (31500788 à J.Y.).
matériels
| Name | Company | Catalog Number | Comments |
| Adhesive tape | Leica | #39475214 | |
| Alexa fluor 488-goat anti-Rabbit secondary antibody | Invitrogen | A-11034 | |
| Antifade Mountant with DAPI | Invitrogen | P36931 | |
| Bovine serum albumin | Sigma | A2153 | |
| Coverslips | Fisher Brand | 12-545-E | |
| Cryostat | Leica | CM1850 | |
| EDTA | Sigma | E6758 | |
| Fluorescence microscope | Olympus | BX51 | |
| Gelatin | Sigma | G1890 | |
| In Situ Cell Death Detection Kit | Millipore | S7165 | |
| Microscope slides | Fisher Brand | 12-550-15 | |
| OCT Compound | Fisher Healthcare | 23-730-571 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | Sigma | P4417 | |
| Polyethylene glycol tert-octylphenyl ether | Sigma | T9284 | Triton X-100 |
| Proteinase K | Invitrogen | AM2542 | |
| Rabbit anti-Ki67 antibody | Cell Signaling Technology | 9129 | Lot#:3; RRID:AB_2687446 |
| Rabbit anti-pSmad1/5/9 antibody | Cell Signaling Technology | 13820 | Lot#:3; RRID:AB_2493181 |
| Sodium citrate | Sigma | 1613859 | |
| Sucrose | Sigma | S9378 | |
| Tris | Sigma | 10708976001 |
Références
- Trinh, L. e. A., Fraser, S. E. Imaging the cell and molecular dynamics of craniofacial development: challenges and new opportunities in imaging developmental tissue patterning. Current Topics in Developmental Biology. 115, 599-629 (2015).
- Marcucio, R., et al. Facial morphogenesis: physical and molecular interactions between the brain and the face. Current Topics in Developmental Biology. 115, 299-320 (2015).
- Graf, D., et al. Common mechanisms in development and disease: BMP signaling in craniofacial development. Cytokine & Growth Factor Reviews. 27, 129-139 (2016).
- Snider, T. N., Mishina, Y. Cranial neural crest cell contribution to craniofacial formation, pathology, and future directions in tissue engineering. Birth Defects Research Part C: Embryo Today. 102 (3), 324-332 (2014).
- Mishina, Y., Snider, T. N. Neural crest cell signaling pathways critical to cranial bone development and pathology. Experimental Cell Research. 325 (2), 138-147 (2014).
- Van Hecke, D. Routine Immunohistochemical Staining Today: Choices to Make, Challenges to Take. Journal of Histotechnology. 1, 45-54 (2002).
- Xiao, C., Dan-Bi, C. Double staining immunohistochemistry. North American Journal of Medical Sciences. 2 (5), 241-245 (2010).
- Zongli, Q., et al. Comparison of immunofluorescence and immunohistochemical staining with anti-insulin antibodies on formalin-fixed paraffin-embedded human pancreatic tissue microarray sections. International Journal of Clinical and Experimental Pathology. 10 (3), 3671-3676 (2017).
- Montgomery, S. C., Cox, B. C. Whole mount dissection and immunofluorescence of the adult mouse cochlea. Journal of Visualized Experiments. (107), e53561 (2016).
- Dun, X. P., Parkinson, D. B. Whole mount immunostaining on mouse sciatic nerves to visualize events of peripheral nerve regeneration. Methods in Molecular Biology. 1739, 339-348 (2018).
- Akkiraju, H., et al. An Improved Immunostaining and Imaging Methodology to Determine Cell and Protein Distributions within the Bone Environment. Journal of Histochemistry & Cytochemistry. 64 (3), 168-178 (2016).
- González-Chávez, S. A., et al. Assessment of different decalcifying protocols on Osteopontin and Osteocalcin immunostaining in whole bone specimens of arthritis rat model by confocal immunofluorescence. International Journal of Clinical and Experimental Pathology. 6 (10), 1972-1983 (2013).
- Kapelsohn, K. Improved Methods for Cutting, Mounting, and Staining Tissue for Neural Histology. Protocol Exchange. , (2015).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of Visualized Experiments. (85), e50803 (2014).
- Shi, S. R., et al. Antigen retrieval techniques: current perspectives. Journal of Histochemistry & Cytochemistry. 49 (8), 931-937 (2001).
- Adell, T., et al. Immunohistochemistry on paraffin-embedded planarian tissue sections. Methods in Molecular Biology. 1774, 367-378 (2018).
- Griffioen, H. A., et al. Gelatin embedding to preserve lesion-damaged hypothalami and intracerebroventricular grafts for vibratome slicing and immunocytochemistry. Journal of Neuroscience Methods. 43, 43-47 (1992).
- Sarkar, S., et al. In situ demonstration of Fluoro-Turquoise conjugated gelatin for visualizing brain vasculature and endothelial cells and their characterization in normal and kainic acid exposed animals. Journal of Neuroscience Methods. 219 (2), 276-284 (2013).
- Oorschot, V., et al. A novel flat‐embedding method to prepare ultrathin cryosections from cultured cells in their in situ orientation. Journal of Histochemistry & Cytochemistry. 50, 1067-1080 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon