Method Article
Gewebevorbereitung und Immunostainierung von Craniofacial Tissues und unkalkulierten Knochen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein detailliertes Protokoll zur Erkennung und Quantifizierung des Proteinspiegels während der craniofacialmorphogenese/pathogenese durch Immunfärbung anhand von Maus-Craniofacial-Geweben als Beispiele vor. Darüber hinaus beschreiben wir eine Methode zur Herstellung und Kryosektion von nicht verkalkten harten Geweben von jungen Mäusen zur Immunfärbung.
Zusammenfassung
Die Gewebeimmunostainierung ermöglicht einen hochspezifischen und zuverlässigen Nachweis von Proteinen, die innerhalb eines bestimmten Gewebes von Interesse sind. Hier beschreiben wir ein vollständiges und einfaches Protokoll zum Nachweis der Proteinexpression während der craniofacialmorphogenese/pathogenese anhand von Maus-Craniofacial-Geweben als Beispiele. Das Protokoll besteht aus der Aufbereitung und Kryosektion von Geweben, indirekter Immunfluoreszenz, Bildaufnahme und Quantifizierung. Darüber hinaus wird eine Methode zur Herstellung und Kryosektion von nicht verkalkten harten Geweben zur Immunfärbung beschrieben, bei der craniofacial Gewebe und lange Knochen als Beispiele verwendet werden. Diese Methoden sind der Schlüssel zur Bestimmung der Proteinexpression und morphologischen/anatomischen Veränderungen in verschiedenen Geweben während der kraniofazianischen Morphogenese/Pathogenese. Sie gelten auch für andere Gewebe mit entsprechenden Modifikationen. Kenntnisse der Histologie und eine hohe Qualität der Abschnitte sind entscheidend, um wissenschaftliche Schlussfolgerungen aus experimentellen Ergebnissen zu ziehen. Mögliche Einschränkungen dieser Methodik sind unter anderem die Spezifität von Antikörpern und Quantifizierungsschwierigkeiten, die auch hier erörtert werden.
Einleitung
Das Gesicht ist ein wichtiger Teil der menschlichen Identität, und besteht aus verschiedenen Arten von Geweben, wie Epithel, Muskel, Knochen, Knorpel, Zahn. Diese Gewebe werden aus allen drei Keimschichten abgeleitet: Ektoderm, Endoderm und Mesoderm1,2. Für die richtige Musterung und Entwicklung von craniofacial Geweben, Zellproliferation, Tod und Differenzierung müssen stark koordiniert und reguliert werden durch spezifische Signalwege, wie Wnt, Fgf, Hh und Bmp Wege3,4 ,5. Defekte in der Proliferation, Überleben oder Differenzierung von Zellen führen zu craniofacial Fehlbildungen, die zu den am häufigsten auftretenden angeborenen Geburtsfehlern gehören. Transgene Mäuse sind nützliche Werkzeuge, um Mechanismen der craniofacial Morphogenese und Pathogenese1,2,3,4,5zu untersuchen. Das Verständnis der Veränderungen der craniofacial Strukturen während der Entwicklung und Pathogenese wird dazu beitragen, die wichtigsten Entwicklungsprinzipien sowie die Mechanismen der craniofacial Mformationen1,2,3 zu klären ,4,5.
Die Färbung ganzer Reit- oder Schnittgewebe mit spezifischen Antikörpern ist eine unschätzbare Technik zur Bestimmung der räumlichen Verteilung von Proteinen von Interesse 6. Formal kann sich die Gewebeimmunfärbung entweder auf die Immunhistochemie (IHC) oder die Immunfluoreszenz (IF) stützen. Im Vergleich zu dem opaken Reaktionsprodukt, das mit einem chromogenen Substrat wie 3,3'-Diaminobenzidin (DAB) von IHC erzeugt wird, beinhaltet IF die Verwendung von fluoreszierenden Konjugaten, die durch Fluoreszenzmikroskopie sichtbar sind. Daher kann IF positive Zellen deutlich von Hintergrundrauschen unterscheiden und ermöglicht es, Bilder auf einfache Weise durch Software wie ImageJ und Adobe Photoshop7,8zu analysieren und zu verbessern. Der gesamte Mount-Färbungsansatz funktioniert auf kleinen Gewebeblöcken (weniger als 5 mm dick), die dreidimensionale Informationen über die Lage von Proteinen/Antigenen liefern können, ohne dass eine Rekonstruktion aus den Abschnitten9,10 erforderlich ist. . Im Vergleich zu Gewebeabschnitten ist die Immunfärbung ganzer Halterungen jedoch zeitaufwändig und erfordert große Mengen an Antikörperlösungen. Nicht alle Antikörper sind mit dem grundlegenden Gesamtmontageansatz kompatibel. Darüber hinaus führt das unvollständige Eindringen von Antikörpern zu ungleichmäßigen Färbungen oder falsch negativen Färbungen. Hier konzentrieren wir uns auf den Immunfluoreszenznachweis von Proteinen/Antigenen auf geschnittenen Geweben. Bei hartem Gewebe (z.B. Kopf, Zahn, langer Knochen) erschwert die Kalziumablagerung während der Entwicklung/Pathogenese die Entnahme der Probe und wird während der Immunfärbung semmen1,12leicht abspült. Die meisten der derzeit verfügbaren Protokolle entkalken harte Gewebe vor der Einbettung, um das Teilen zu erleichtern, was zeitaufwändig ist und Morphologie und Antigene von Proben zerstören kann, wenn sie unsachgemäß behandelt werden11,12. Um die Probleme zu überwinden, optimierten wir einen Ansatz für das Kryosektionen von hartem Gewebe ohne Entkalkung, was zu einer verbesserten Visualisierung ihrer Morphologie und Verteilung von Signalproteinen führte.
Das hier beschriebene Protokoll wird verwendet, um morphometrische und histologische Veränderungen im craniofaziale Gewebe von Transgenen Von BMP-Mäusen zu bestimmen. Konkret umfasst das Protokoll (1) Ernte und Sezieren von Kopfgeweben, (2) Abschnitt und Immunostainierung von experimentellen Markern (Ki67, pSmad1/5/9) zusammen mit TUNEL-Färbung, (3) Abbildung der Abschnitte mit Fluoreszenzmikroskop und schließlich (4) Analyse und Quantifizierung der Ergebnisse. Das Protokoll zur Vorbereitung und Kryosektion von hartem Gewebe ohne Entkalkung wird ebenfalls beschrieben13. Diese Methoden sind für craniofacial Gewebe optimiert. Sie gelten auch für andere Gewebe aus verschiedenen Altersgruppen von Proben mit entsprechenden Modifikationen.
Protokoll
Alle Mausexperimente wurden in Übereinstimmung mit den Richtlinien der University of Michigan durchgeführt, die die humane Pflege und den Einsatz von Tieren in der Forschung betreffen. Alle in dieser Studie verwendeten tierischen Verfahren wurden vom Institutional Animal Care and Use Committee (IACUC) der University of Michigan (Protokoll #PRO00007715) genehmigt.
1. Gewebevorbereitung
-
Herstellung von embryonalen Geweben
- Bereiten Sie eine 10 cm Schale und mehrere 3,5 cm Teller mit Phosphat gepufferter Kochsaline (PBS) und eine 12-Well-Kulturplatte mit 2 ml 4% Paraformaldehyd (PFA) in PBS in jedem Brunnen für jede schwangere Maus zu. Legen Sie alle Petri-Gerichte und den Teller auf Eis.
HINWEIS: Behandeln Sie 4% PFA in einer Dunstabzugshaube. - Sezieren Sie Embryonen von trächtigen Mäusen in eiskaltem PBS mit Zangen und Schere, wie zuvor beschrieben14.
- Kurz, einschläfern eine schwangere Maus mit CO2, greifen Sie die Haut unter der Mitte des Bauches mit Zange und schneiden Sie durch die Haut nur, dann ziehen Sie sanft an der Haut, um es von der darunter liegenden Bauchmuskelwand zu trennen.
- Als nächstes in die Bauchhöhle nach der gleichen Linie des Hautschnitts geschnitten. Entfernen Sie die Gebärmutter, die eine Reihe von Embryonen enthält, und entfernen Sie die Embryonen, indem Sie die Gebärmutterwand vorsichtig abschneiden. Die extraembryonalen Gewebe wie der Dottersack und das Amnion werden entfernt.
- Kopf von jedem Embryo schneiden und isolieren.
- Übertragen Sie jeden Kopf in jeden Brunnen einer 12-Well-Platte, die 4% PFA mit einer Kunststoff-Transferpipette oder Zange enthält. Proben in 4% PFA bei 4 °C für 4 h fixieren. Proben in PBS bei 4 °C mit sanftem Schütteln für 12 h abspülen.
HINWEIS: Bei Embryonen, die jünger als embryonaler Tag 16.5 (E16.5) sind, fixieren Embryoköpfe mit 4% PFA direkt nach der Isolierung. Bei Embryonen bei E16.5 oder höher entfernen, um Haut und Fettgewebe aus den Köpfen zu entsorgen und vor der Fixierung mehrmals in eiskaltem PBS zu spülen. - Cryoprotect Köpfe.
- Übertragen Sie jeden Kopf in eine neue 12-Well-Platte mit 2 ml 30% Saccharose in PBS mit einer Kunststoff-Transferpipette oder Zange. Rühren Sie sanft bei 4 °C, bis der Kopf auf den Boden der Schale sinkt.
- Einbetten von Köpfen.
- Übertragen Sie den kryogeschützten Kopf in eine Form mit optimaler Schnitttemperatur (OCT) Verbindung. Gleichgewichtsproben im OCT für mehrere Minuten. Passen Sie die Position und Richtung der Proben mit Zangen an.
- Legen Sie die Form auf Trockeneis zum Einfrieren. Die resultierenden Kryomolde in einer Plastiktüte bei -80 °C lagern, bis sie zum Kryosektionen bereit sind.
HINWEIS: Die getrimmte Seite der Proben muss sich der Unterseite der Einbettform stellen.
- Bereiten Sie eine 10 cm Schale und mehrere 3,5 cm Teller mit Phosphat gepufferter Kochsaline (PBS) und eine 12-Well-Kulturplatte mit 2 ml 4% Paraformaldehyd (PFA) in PBS in jedem Brunnen für jede schwangere Maus zu. Legen Sie alle Petri-Gerichte und den Teller auf Eis.
-
Vorbereitung von postnatalen undecalcierten Hartgeweben
- Euthanisieren bei 3 Wochen oder 3 Monate alte Maus mit CO2. Entfernen Sie die Haut und Fettgewebe. Schneiden und isolieren Sie den Kopf oder lange Knochen von der Maus.
- Fixieren und kryoprochen den Kopf oder langen Knochen von Mäusen, wie in den Schritten 1.1.3–1.1.4 beschrieben.
- In ähnlicher Weise wie Schritt 1.1.5 in 8% Gelatine einbetten. Bewahren Sie die Kryomolden in einer Plastiktüte bei -80 °C bis zum Kryosektionen auf.
HINWEIS: Eine Entkalkung ist hier nicht notwendig. Um 8% Gelatine zuzubereiten, 8 g Gelatine mit 100 ml PBS mischen und mit einer Mikrowelle kochen. Beachten Sie, dass die Mischung leicht überkocht.
2. Kryosektion
- Setzen Sie die Kryostattemperatur auf -18 °C für Weichgewebe, die in OCT oder -25 °C eingebettet sind, und niedriger für nicht verkalkte harte Gewebe, die in Gelatine eingebettet sind. Halten Sie Proben in der Kryostatkammer für ca. 30 min, um die Kryostattemperatur zu kompensieren.
- Vertreiben Sie den Block aus dem Kryomold. Einfrieren des Blocks auf das Probenfutter (Gewebehalter) über die Montage mit einem OCT-Tropfen. Halten Sie die getrimmte Seite der Probe am weitesten vom Futter (mit Blick auf den Bediener).
- Laden Sie das blockmontierte Futter auf den Cryostat-Objekthalter. Passen Sie den Klingenhalter so an, dass der Winkel der Klinge 3°–5° relativ zur Probe ist.
- Sammeln Sie 10 m Abschnitte auf beschichtete Mikroskopschlitten. Trockene Abschnitte vollständig bei RT, dann lagern Sie sie bei -80 °C.
3. Histologische Färbung und mikroskopische Bildgebung
- Immunfluoreszenzfärbung
- Nehmen Sie Rutschen von -80 °C heraus. Halten Sie die Dias bei RT für 1 h bis airdry Abschnitte. Spülen Sie Dias in 0,1% PBST (0,1% Polyethylenglykoltert-Octylphenylether in PBS; siehe Materialtabelle) dreimal für jeweils 5 min, um OCT- und Permeabilize-Abschnitte auszuwaschen.
- Optional führen Sie Antigenabruf (optional) durch.
- Citratpuffer (10 mM Natriumcitrat pH 6) in der Färbeschale mit Dampfer oder Wasserbad auf 95–100 °C vorheizen. Tauchen Sie in den Citratpuffer, inkubieren für 10 min.
- Nehmen Sie die Färbeschale aus dem Dampfer oder Wasserbad zu RT. Kühlen Sie die Rutschen bei RT für 20 min oder länger15.
HINWEIS: Als Alternative verwenden Sie Tris-EDTA-Puffer (10 mM Tris-Basis, 1mM EDTA, 0,05 % Tween 20, pH 9,0) oder EDTA-Puffer (1 mM EDTA, 0,05 % Tween 20, pH 8,0) für die wärmeinduzierte Antigenabrufung. Verwenden Sie einen Schnellkochtopf, eine Mikrowelle oder ein Wasserbad für die wärmeinduzierte Antigenrückgewinnung, zusätzlich zum Heißdampfer. Eine Enzym-induzierte Antigen-Retrieval mit Trypsin oder Pepsin ist eine weitere Alternative. Optimieren Sie die Konzentration und Behandlungszeit des enzymatischen Abrufs, um schädliche Abschnitte zu vermeiden. Optimieren Sie die Antigen-Retrieval-Methode für jede Antikörper-Antigen-Kombination.
- Inkubieren Sie jeden Schlitten mit 200 l Blockierlösung (5% Eselserum in 0,1% PBST verdünnt) bei RT für 30 min, dann entfernen Sie die Blockierlösung ohne Spülung.
- Inkubieren Sie jeden Schlitten mit 100 l Primärantikörpern oder Antikörpern, die in einer Blockierlösung für 1 h bei RT oder O/N bei 4 °C verdünnt werden. Spülen Sie Dias mit PBS dreimal für jeweils 10 min bei RT.
- Inkubieren Sie jeden Schlitten mit 100 l Sekundärantikörper in Blockierlösung für 1 h bei RT verdünnt. Spülen Sie diagleitet in PBS dreimal für jeweils 10 min bei RT. Schützen Sie Dias vor Licht.
- Montieren Sie Rutschen.
- Fügen Sie zwei Tropfen Anti-Fade-Medium mit DAPI (4', 6-Diamidino-2-Phenylindole) auf der Folie. Dann mit einem Coverslip abdecken.
- Bei 4 °C im Dunkeln lagern, bis es bildbereit ist.
HINWEIS: Als Alternative, beschriften Sie die Kerne mit DAPI oder Hoechst 33324 Farbstoff verdünnt 1:2.000 in PBS bei RT zuerst, dann mit Glycerin montieren.
- Terminal desoxynucleotidyl transferase dUTP nick end labeling (TUNEL) Färbung.
HINWEIS: Doppelsträngige DNA mit 3'-Hydroxyl-Termini (3'OH DNA termini) bildet sich während der Apoptose in der Zelle. Hier stellen wir ein Protokoll zur Verfügung, das die kostenlosen 3'OH DNA-Termini in situ durch Kennzeichnung von DNA-Fragmenten mit dem Digoxigenin-Nukleotid unter Verwendung von Terminal-Deoxynukleotidyl-Transferase (TdT) durch spezifische Färbung mit einem kommerziellen Kit kennzeichnen (siehe Tabelle der Materialien ).- Optional sind Fleckenabschnitte mit primärer und Alexa Fluor-488 als Sekundärantikörper vor der TUNEL-Färbung gekennzeichnet. Spülen Sie die Dias in PBS dreimal für jeweils 10 min.
HINWEIS: Dieser Schritt ist optional für eine doppelte Färbung eines Proteins und TUNEL in der gleichen Folie. - Inkubieren Sie jeden Schlitten mit 100 l Proteinase K (10 g/ml in 10 mM Tris pH 7,5 und 5 mM EDTA) für 5 min bei RT. Spülen Sie Dias mit PBS dreimal für 10 min jeweils bei RT.
HINWEIS: Passen Sie die Inkubationszeit und Temperatur von Proteinase K für jeden Gewebetyp an. Für 10 m Abschnitte von Embryoköpfen, die in 4% PFA fixiert sind, inkubieren Sie für 5 min bei RT. Zusätzlich zu der Methode mit Proteinase K, verwenden Sie alternative Behandlungen nach Bedarf, einschließlich (1) frisch zubereitet 0,1% Polyethylenglykol tert-octylphenylether, 0,1% Natriumcitrat, 10 min bei 37 °C; (2) 0,25%–0,5% Pepsin in HCl (pH 2) oder 0,25% Trypsin, 10 min bei 37 °C; und (3) Mikrowellenbestrahlung mit 0,1 M Citratpuffer (pH 6). - Tragen Sie 200 l Blockierlösung (5% Eselsserum in 0,1% PBST verdünnt) auf jeden Schlitten auf, inkubieren Bei RT für 30 min, tippen Sie die Blockierlösung ohne Spülung ab.
- Tragen Sie 50 l des vom Kit bereitgestellten Ausgleichspuffers auf jede Folie bei RT für mindestens 10 s auf. Tippen Sie den Puffer ohne Spülung ab.
- Vorbereiten Sie das Reaktionsgemisch (Arbeitsstärke TdT-Enzym) durch Mischen von TdT-Enzym mit dem vom Kit gelieferten Reaktionspuffer im Verhältnis 3:7. 50 l des Reaktionsgemisches auf jeden Schlitten auftragen und bei 37 °C für 1 h inkubieren. Tippen Sie den Puffer ohne Spülung ab.
- Tragen Sie 200 l des vom Kit gelieferten Stop-Puffers (1:30 in ddH2O) auf jede Rutsche auf, und inkubieren Sie dann bei RT 10 min. Spülen Sie Dias mit PBS dreimal für jeweils 10 min.
- Etikett mit Rhodamine Antikörper.
- Tragen Sie 50 l vorgewärmtes (RT) Anti-Digoxigenin-Konjugat (Rhodamine) (1:1 in Blockierlösung verdünnt) auf jede Rutsche auf. Inkubieren bei RT für 30 min in dunkel.
- Spülen Sie Dias mit PBS dreimal für jeweils 10 min. Gleitet als Schritt 3.1.6 montieren.
- Optional sind Fleckenabschnitte mit primärer und Alexa Fluor-488 als Sekundärantikörper vor der TUNEL-Färbung gekennzeichnet. Spülen Sie die Dias in PBS dreimal für jeweils 10 min.
4. Imaging Acquisition
- Verwenden Sie positive Kontrollen (Gewebe positiv für das Zielantigen), um die Signalkennzeichnung und negative Kontrollen (auslassen sie den primären Antikörper, die Isotypkontrolle oder das Gewebe negativ für das Zielantigen) zu überprüfen, um den Hintergrund von Bildern unter dem fluoreszierenden mikroskop.
- Stellen Sie die Geräte- und Kamerabedingungen (Belichtungen und andere allgemeine Einstellungen) für die Bildgebung basierend auf der Signalintensität negativer und positiver Steuerungen ein.
HINWEIS: Diese Bedingungen variieren je nach (1) Kameras und Mikroskopen, die für die Bildgebung verwendet werden, (2) Antikörpern und (3) Geweben für jedes Experiment. Häufige Bedingungen für craniofacial Gewebe sind ISO 200 mit einer Expositionszeit von 1/100 s bis 1 s abhängig von der Qualität und Spezifität von Antikörpern. Die entsprechenden Vergrößerungen variieren je nach Größe der Proben und Zweck der Experimente. - Erfassen Sie Bilder mit konventionellem Epifluoreszenzmikroskop oder Konfokalmikroskop. Erfassen Sie Bilder (einschließlich der entsprechenden Steuerelemente) unter den gleichen Bedingungen für jeden Farbkanal. Speichern Sie Bilder mit demselben Format (tiff ist am besten, um Informationen zu bewahren).
5. Fluoreszenzquantifizierung
HINWEIS: Der statistische Vergleich der Färbung zwischen verschiedenen Gruppen wird in vielen Fällen informativer sein. Mit den Immunfluoreszenzbildern quantifizieren Sie den relativen Gehalt des Proteins, indem Sie die Signaldichte messen, positive Zellen zählen oder positive Bereiche berechnen. Für die statistische Analyse beträgt die Mindestanzahl biologisch unabhängiger Proben 3. Eine typische Methode besteht darin, aus jeder Stichprobe mindestens drei Abschnitte zu generieren und Bilder für mindestens drei repräsentative Bereiche in jedem Abschnitt zu erstellen.
-
Quantifizierung der Fluoreszenzintensität mit ImageJ
- Öffnen Sie die Software, und verwenden Sie Analysieren > Messungen festlegen, um zu überprüfen, ob nur Fläche und integrierte Dichte ausgewählt sind. Verwenden Sie Datei > Öffnen, um zu analysierende Bilder zu öffnen.
- Verwenden Sie die Symbolleiste, um entweder das Quadrat- oder Kreissymbol ganz links auszuwählen. Wählen Sie den Bereich aus, der auf dem Bild analysiert werden soll, indem Sie das Auswahlwerkzeug verwenden. Verwenden Sie Analysieren > Messen, um das Auslesen des ausgewählten Bereichs und der integrierten Dichte im Ergebnisfenster abzulesen. Wählen Sie einen Bereich neben einer positiven Zelle aus, der keine Fluoreszenz zum Auslesen des Hintergrunds hat.
- Wiederholen Sie Schritt 5.1.2, um andere Bilder zu analysieren. Der zu analysierende Bereich wurde an die Fläche angepasst, die mit der des ersten Bildes übereinstimmt.
- Kopieren Sie alle Daten im Ergebnisfenster, und fügen Sie sie nach Abschluss der Analyse in eine Kalkulationstabelle ein.
- Berechnen Sie die korrigierte Fluoreszenzintensität (CTCF) als integrierte Dichte — (Fläche der ausgewählten Zelle x Mittlere Fluoreszenz von Hintergrundwerten). Vergleichen Sie die Differenz der korrigierten Gesamtzellfluoreszenz zwischen Denproben, und erstellen Sie ein Diagramm.
-
Quantifizierung der positiven Zellzahl von fluoreszierenden Bildern mit ImageJ
- Manuelle Zellzählung.
- Verwenden Sie ImageJ > Plugins > Analysis, um das Cell Counter Plugin zu installieren.
- Verwenden Sie Datei > Öffnen, um zu analysierende Bilder zu öffnen. Verwenden Sie Plugins > Analyse > Zellenzähler, um das Fenster Zähler und das Ergebnisfenster zu öffnen.
HINWEIS: Der Zellenzähler funktioniert nicht auf Stapeln. Zum Zählen von Stacks, Plugin Plot Z Achsenprofil, verwenden Sie dann Bild > Stapel > Plot Z Achsenprofil, um die Intensität eines sich bewegenden ROI mit einem Partikel-Tracking-Tool zu überwachen. Dieses Tool kann manuell oder automatisch sein. - Klicken Sie auf eine der Schaltflächen am unteren Rand des Schalterfensters, um die Zählung zu initiieren. Klicken Sie direkt auf eine Zelle/ein Objekt, die bis zum Abschluss gezählt werden soll.
- Klicken Sie im Fenster Anzahl auf die Schaltfläche Ergebnisse. Die Gesamtzahl der gezählten Zellen wird im Fenster Ergebnisse angezeigt. Speichern Sie das Ergebnisprotokoll als Kalkulationstabelle und analysieren Sie es.
- Automatisierte Zellzählung.
- Verwenden Sie Datei > Öffnen, um zu analysierende Bilder zu öffnen. Konvertieren Sie das RGB-Bild in ein Graustufenbild, bevor Sie fortfahren.
- Verwenden Sie Bild > Anpassen > Schwellenwert, um alle Bereiche auszuwählen, die gezählt werden müssen.
- Verwenden Sie Analysieren > Partikel analysieren, um die Anzahl der Zellen/Partikel abzubekommen. Legen Sie einen Bereich der gültigen Partikelgröße (z. B. 100-Infinity) anstelle der Standardeinstellung 0-Infinity fest, um Zellen/Partikel innerhalb eines bestimmten Bereichs zu zählen. Speichern Sie das Ergebnisprotokoll als Kalkulationstabelle und analysieren Sie es.
HINWEIS: Um weitere Informationen aus dem Bild zu erhalten, gehen Sie neben dem Bereich zu Analysieren > Messungen festlegen und wählen Sie das Feld neben den benötigten Informationen aus.
- Manuelle Zellzählung.
Ergebnisse
Embryonale craniofacial Gewebeabschnitte
Nach den obigen Schritten wurden die Köpfe am embryonalen Tag (E) 16,5 oder 18,5 von der Kontrolle (P0-Cre) oder mutierten (konstitutiv aktivierten Bmpr1a in neuralen Kammzellen, P0-Cre; caBmpr1a) Embryonen seziert. Nach der Fixierung in 4% PFA für 4 h wurden die Proben in OCT eingebettet und koronal kryosectioniert. Die ergebnisseweise Abschnitte wurden mit Antikörpern gegen pSmad1/5/9 (nachgeschaltete BMP-Signalfaktoren) oder Ki67 (ein Zellproliferationsmarker) ohne Antigenabruf gemäß dem Protokoll immungefärbt. Wie gezeigt, waren pSmad1/5/9 (Abbildung 1A) und Ki67 (Abbildung 1C) in den Frontalknochen von Kontrollembryonen positiv. Bei mutierten Embryonen wurde der Gehalt an pSmad1/5/9 erhöht (Abbildung 1B), während die von Ki67 in den Frontalknochen verringert wurde (Abbildung 1D). Auch der Zelltod in diesen Proben wurde nach dem Protokoll überprüft. Wie gezeigt, wurden mehr apoptotische Zellen in den Frontalknochen mutierter Embryonen beobachtet als bei Kontrollembryonen (Abbildung 1E,F).
Unkalziertes craniofacial Gewebe oder lange Knochenabschnitte
Nach den obigen Schritten für unkalkuliertes hartes Gewebe wurden Köpfe von 3 Wochen alten Mäusen(P0-Cre; mTmG (Membran-Tomate und Membran GFP)) mit 4% PFA fixiert und in 8% Gelatine eingebettet. Koronale Kryosektionen wurden mit PBST gewaschen und mit Anti-Fade-Medium mit DAPI montiert. Abbildung 2A ,B zeigen, dass Gelatine die fluoreszierenden Signale von geschnittenem Gewebe nicht stört.
Köpfe und Femora von 3 Wochen alten oder 3 Monate alten Mäusen wurden eingesetzt, um zu überprüfen, ob gelatinetes undecalciertes Gewebe gut für IF ist. Die gesamten Köpfe und Femora wurden nach dem Protokoll verarbeitet und geschnitten. Die resultierenden Abschnitte wurden für die SOX9-Immunostainierung (Abbildung 3) oder OSX und E11/Podoplanin Doppelimmunfärbung (Abbildung 4) verwendet. Wie gezeigt, wurden aus den meisten der dreiwöchigen harten Gewebe, einschließlich des Trabeekulars und der kortikalen Fächer des Oberschenkelknochens, gute Schnitte von guter Qualität gewonnen (Abbildung 3A, B, Abbildung 4A–D), die Frontalknochen (Abbildung 4E, F), der Schneidezahn (Abbildung 3E, F, Abbildung 4I,J), Nasengewebe (Abbildung 3C,D), und der Schädel einschließlich der Nasen-Premaxilla-Naht und der umgebenden Knochen (Abbildung 4G, H ) des Kopfes. Während bei 3 Monate alten Proben nur in einigen der harten Gewebe, einschließlich der trabekulären Fächer des Oberschenkelknochens , von guter Qualität entnommen wurden (Abbildung 3G, H, Abbildung 4K, L), Nasengewebe ( Abbildung3I ,J), und der Schädel einschließlich der Nasen-Premaxilla-Naht und umgebenden Knochen (Abbildung 4M,N) des Kopfes. Wie in Abbildung 3dargestellt, wurden SOX9-positive Zellen speziell in den Chondrozyten der Wachstumsplatte ( Abbildung3B) und des Gelenks (Abbildung 3H) aus dem Oberschenkelknochen und des Nasenseptums (Abbildung 3D,J) nachgewiesen. Im 3 Wochen alten Schneidezahn wurde SOX9 in den mesenchymalen Zellen nachgewiesen (Abbildung 3F). OSX und E11 Doppelfärbung Ergebnisse zeigten, dass OSX in Osteoblasten nachgewiesen wurde, während E11 in Osteozyten der Knochen aus dem Oberschenkelknochen und dem Kopf nachgewiesen wurde (Abbildung 4B, D,H,L,N). In der 3-Wöchigen Schneidezähne war OSX in Odontoblasten positiv, während E11 in mesenchymalen Follikelzellen positiv war (Abbildung 4J). Diese Ergebnisse deuten darauf hin, dass nicht verkalkte harte Gewebe mit Gelatine gut erhalten Antigen-Funktionen eingebettet.
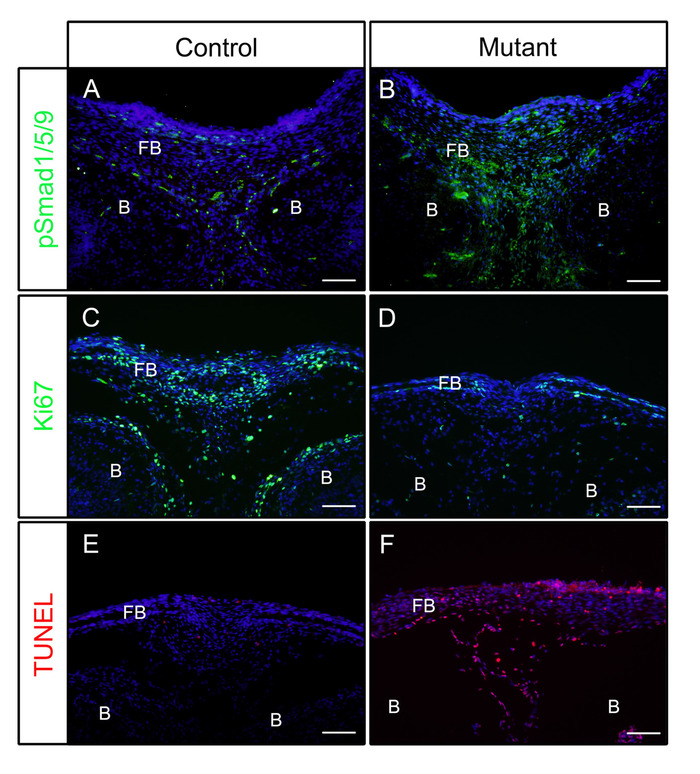
Abbildung 1: Beispiele für IF-Ergebnisse von pSmad1/5/9, Ki67 oder TUNEL bei Kontrollembryonen und mutierten Embryonen mit verbesserter BMP-Aktivität. Konstitutiv aktivierte Bmpr1a -caBmpr1a) Mäuse wurden mit P0-Cre-Mäusen gekreuzt, um die BMP-Signalaktivität in neuralen Kammzellen (NCCs) zu erhöhen. Kontrollköpfe (P0-Cre; caBmpr1a+/+) und mutierte (P0-Cre; caBmpr1afx/+) Embryonen wurden bei E16.5 oder E18.5 seziert, fixiert mit 4% PFA für 4h, kryogeschützt mit 30% Saccharose für 1 Tag, eingebettet in OCT, und bei -18 °C kryokentiert. Abschnitte des Frontalknochens (ähnliche Ebene mit dem Auge) wurden zur Immundetektion gegen pSmad1/5/9, Ki67 oder TUNEL Färbung verwendet. (A, B) pSmad1/5/9 (grün) Färbemuster in den frontalen Knochen der Kontrolle (A) oder mutierte (B) Embryonen bei E16.5. (C, D) Ki67 (grün) Färbemuster in den frontalen Kontrollknochen (C) oder mutierten (D) Embryonen bei E18.5. (E, F) TUNEL (rote) Färbemuster in den frontalen Kontrollknochen (E) oder mutierten (F) Embryonen bei E18.5. Nuclei wurden mit DAPI (blau) gefärbt. FB = Frontalknochen, B = Gehirn. Skalenbalken = 100 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
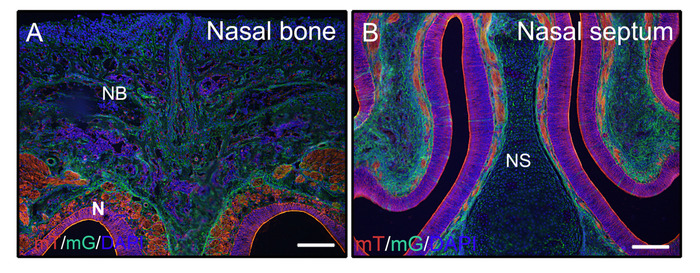
Abbildung 2: Beispiele für mTmG-Reportersignalergebnisse von nicht verkalkten Geweben im Kopf. Köpfe von 3 Wochen alten P0-Cre-Mäusen mit Membran-Tomate und Membran GFP (mTmG) Reporter wurden seziert, mit 4% PFA für 4h fixiert, mit 30% Saccharose für 2 Tage kryogeschützt, eingebettet in 8% Gelatine, und bei -25 °C kryokentiert. Kopfabschnitte zeigen deutlich GFP (grün, Cre Rekombination positiv) und Tomate (rot, Cre Rekombination negativ) Signal in den Nasenknochen und Nasengewebe (A, B). Nuclei wurden mit DAPI (blau) gefärbt. NB = Nasenknochen, N = Nasengewebe, NS = Nasenseptum. Skalenbalken = 250 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
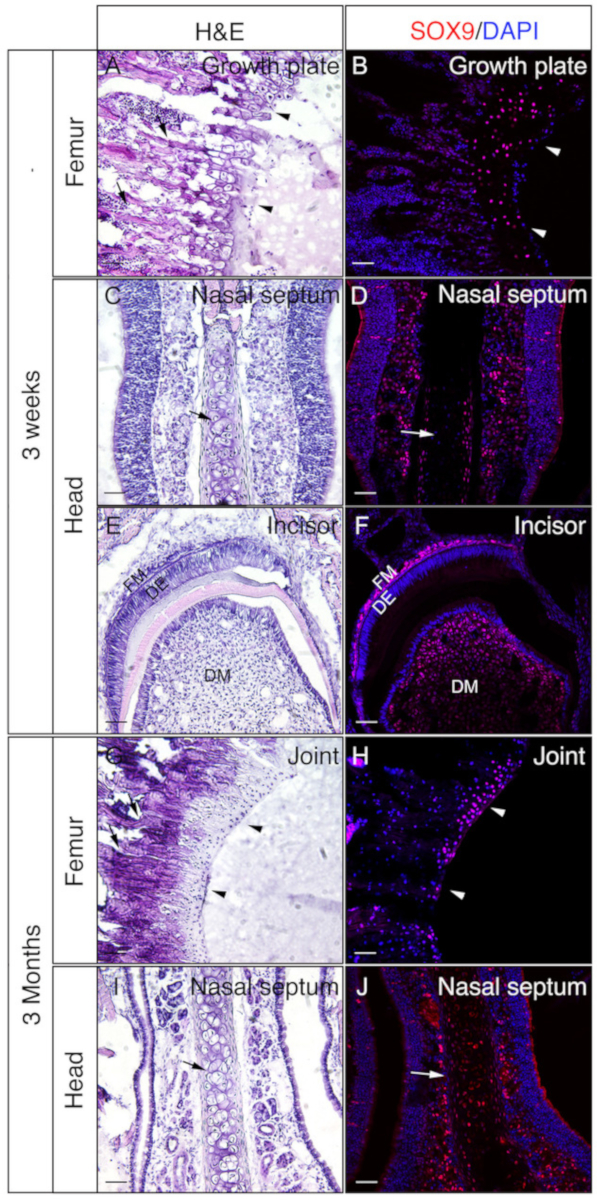
Abbildung 3: Beispiele für SOX9-Immunfärbungsergebnisse von nicht verkalkten Geweben im Kopf und in der Femora. Köpfe und Femora wurden von 3 Wochen oder 3 Monate alten Mäusen seziert, mit 4% PFA für 4h fixiert, mit 30% Saccharose für 2 Tage kryogeschützt, in 8% Gelatine eingebettet und bei -25 °C kryosectioniert. Dias wurden zur Immundetektion gegen SOX9 (rot) eingesetzt. Kerne wurden mit DAPI (blau)(B, D, F, H,J) gefärbt. Angrenzende Abschnitte dieser Gewebe wurden für Hämatoxylin & Eosin (H&E) Färbung(A, C, E, G, I) verwendet. Pfeilköpfe in A und B zeigen Wachstumsplatte und in G und H,Gelenkknorpel. Pfeile in A und G zeigen trabekuläre Knochen und in C, D, I und J,Nasenseptum. DM = Zahnmesenchym, DE = Zahnepithel, FM = Follikelme. Skalenbalken = 50 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
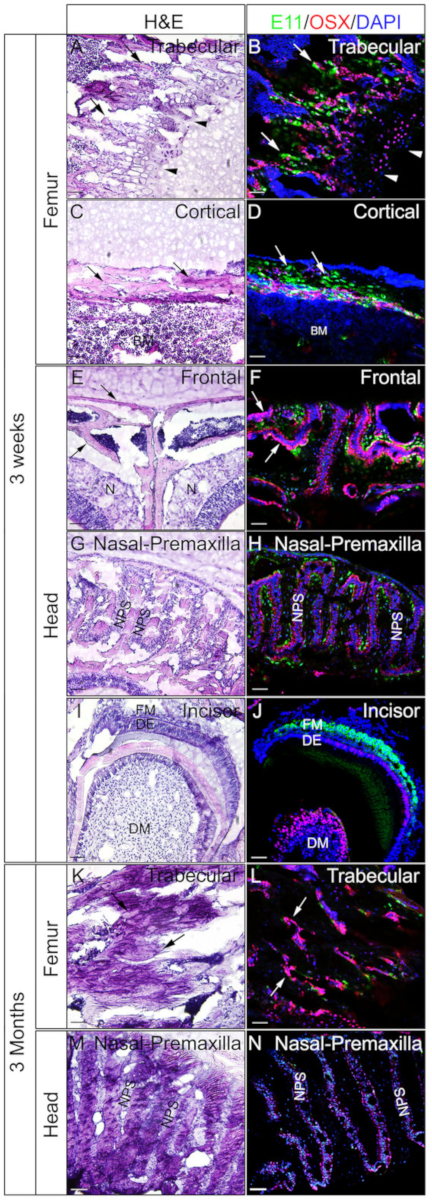
Abbildung 4: Beispiele für OSX- und E11-Doppelimmunfärbungsergebnisse von nicht verkalkten Geweben im Kopf und in der Femora. Köpfe und Femora wurden von 3 Wochen alten oder 3 Monate alten Mäusen seziert, mit 4% PFA für 4h fixiert, mit 30% Saccharose für 2 Tage kryogeschützt, in 8% Gelatine eingebettet und bei -25 °C kryokentiert. Abschnitte wurden zur doppelten Immunfärbung mit Antikörpern gegen OSX (Rot) und E11/Podoplanin (Grün) eingesetzt. Kerne wurden mit DAPI (blau)(B, D, F, H, J, L,N) gefärbt. Angrenzende Abschnitte dieser Gewebe wurden für H&E-Färbungverwendet (A, C, E, G, I, K, M). Pfeile in A, B, K und L zeigen trabekkuläre Fächer des Oberschenkelknochens an; C und D, kortikale Fächer des Oberschenkelknochens; und in E und F,den Frontalknochen. Pfeilspitzen in A und B zeigen Wachstumsplatte an. BM = Knochenmark, N = Nasengewebe, DM = Zahnmesenchym, DE = Zahnepithel, FM = Follikelmesenchym, NPS = nasale Prämaxilla-Sutur. Die Frontalknochen (E, F) und die Nasen-Premaxilla-Naht und die umgebenden Knochen (G, H, M, N) werden ebenfalls gezeigt. Skalenbalken = 50 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hier bieten wir ein detailliertes Protokoll für die Vorbereitung von Mauskopf und nicht verkalkten Knochengeweben und Kryosektionen zur Immunfärbung der Zellproliferation, des Zelltodes und der BMP-Signalmarker. Wir beschreiben auch die Strategie zur Gewinnung quantitativer Daten aus immunfluoreszierenden Bildern. Diese Methoden können auch auf andere Gewebe mit entsprechenden Modifikationen anwendbar sein.
Die Bedingungen für die Gewebevorbereitung variieren je nach Größe und Art des Gewebes. Die Fixierungs- und Kryoschutzzeit benötigt in der Regel mehrere Stunden bis über Nacht. Nach der Fixierung kann das Gewebe auch in Paraffin eingebettet und mit einem Mikrotom16geschnitten werden. Obwohl sowohl Paraffin als auch OCT gut für die Immunfärbung funktionieren, gibt es einige Unterschiede zwischen ihnen. Paraffinblöcke können mehrere Jahre bei RT aufbewahrt werden, während OCT-Blöcke für 1 Jahr bei -80 °C sind. Paraffin bewahrt die Gewebemorphologie, während Eiskristall, der während der OCT-Einbettung gebildet wird, die Gewebestrukturen negativ beeinflussen kann. Paraffin maskiert manchmal Epitope von Antigenen, während OCT Enzymaktivitäten und Antigenepitope konserviert. Daher besteht für die meisten Antikörper keine Notwendigkeit für Antigenabruf, wenn sie in 4% PFA für nur 4 h oder weniger fixiert und in OCT eingebettet sind. Es ist jedoch immer noch möglich, bessere Ergebnisse durch Antigen-Retrieval zu erzielen, wenn positive Kontrollen keine guten Färbeergebnisse in Kryosektionen zeigten.
Sowohl Hoechst Farbstoff als auch DAPI können für die nukleare Gegenfärbung verwendet werden. Sie weisen Ähnlichkeiten auf, da beide (1) UV-erregte, kleine, rillenbindende Chemikalien sind, um Signale auszusenden, die proportional zum gesamten DNA-Gehalt sind, und (2) nach langer Belichtung einer Photobleiche ausgesetzt sind. Hoechst-Farbstoffe werden jedoch aufgrund ihrer hohen Durchlässigkeit in der Regel zur Färbung von DNA-Inhalten in lebenden Zellen verwendet. DAPI wird in der Regel für die Färbung von DNA in festen Zellen aufgrund seiner geringen Membrandurchlässigkeit verwendet. Darüber hinaus erzeugt DAPI ein stärkeres und stabileres Signal als Hoechst.
Richtige Kontrollen sind für IF unerlässlich. Die Spezifität jedes neuen Antikörpers sollte gegebenenfalls durch eine Western-Blot-Analyse bestätigt werden. Die optimale Arbeitskonzentration eines bestimmten Primärantikörpers sollte durch den Einsatz von seriellen Verdünnungen bestimmt werden. Eine positive Kontrolle (Gewebe oder Zelle, die nachweisbar das Protein/Antigen ausdrückt) sollte aufgenommen werden, um den IF-Prozess und die Spezifität von Antikörpern zu überprüfen. Eine negative Kontrolle sollte ebenfalls einbezogen werden, z. B. das Fehlen des primären Antikörpers oder die Substitution eines normalen IgG von derselben Spezies durch den primären Antikörper oder Gewebe, die für das Zielantigen negativ sind. Bei der Aufnahme von Bildern sollte die Probe ohne sekundäre Antikörper (Hintergrundsteuerung) unabhängig mit jedem Kanal untersucht werden, um die Grenzen der Signalverstärkung und des Offsets festzulegen, die für die endgültige Abbildung angepasst werden sollen. Für die Erkennung mehrerer Beschriftungen müssen Hintergrundsteuerelemente und einbeschriftete Steuerelemente vorbereitet werden, um spektrale Überlappungsartefakte zu vermeiden. Alle Kanäle, die verwendet werden, um ein Bild einer Multiple-Label-Probe zu erhalten, müssen einer unabhängigen Hintergrundkorrektur unterzogen werden, da der Grad der Autofluoreszenz in jedem Kanal erheblich variiert.
Wir bieten auch das Protokoll für die Vorbereitung und Kryosektion von nicht verkalkten harten Geweben in Gelatine eingebettet. Für das ÜLG eingebettet enkalifizierte harte Gewebe, die meisten der Hartgewebe Abschnitte werden von Dia-Brille während der Immunfärbung Verfahren, wegen ihrer geringen Haftung Sittigkeit Charakter auf der Folie abgelöst werden. Das Klebeband, das entwickelt wurde, um das Kryosektionieren zu erleichtern, hilft, hochwertige Abschnitte zu erzeugen. Aber, diese Abschnitte sind leicht beschädigt, wenn das Band abblättert. Für Gelatine-Eingebettete Gewebe ist kein Bandtransfersystem erforderlich, um Abschnitte von guter Qualität zu erzeugen. Als Einbettungsmedium kann Gelatine die Probe gut infiltrieren, obwohl sie eine niedrigere Viskosität im Vergleich zu OCT hat. Gelatine wurde in anderen histologischen Anwendungen verwendet, wie Z. Hirngewebe17,18 und ultradünne Zellabschnitte. für Immunzytochemie19. Hier wurde Gelatine verwendet, um nicht verkalkte Knochen einzubetten, was Blöcke erzeugt, die leichter kryosection als OCT sind. Es gibt mehrere kleine Tipps, um gute Abschnitte von Gelatine eingebettet unkalkulierte harte Gewebe zu bekommen. Der entscheidende Schritt besteht darin, sich mit Gelatine anstelle von OCT einzubetten. Um eine bessere Penetration zu erhalten, halten Sie Proben in 30% Saccharose einen weiteren Tag, nachdem Proben auf den Boden sinken. Ebenso wichtig ist es, die Temperatur auf ca. -25 °C niedriger als üblich einzustellen. Eine ultrascharfe Klinge ist nicht notwendig. Obwohl eine niedrigere Kryotemperatur (-25 °C) einige Verbesserungen für die Kryosektion von OCT eingebettet unkalkulierten harten Geweben macht, ist es immer noch schwierig, eine gute Integrität der Gewebestrukturen zu erhalten. Wie in Abbildung 2, Abbildung 3und Abbildung 4dargestellt, wurden aus gelatineförmigem hartem Gewebe (z. B. trabekuläre Knochen, kortikale Knochen, Schädelknochen, Nasengewebe und Schneidezähne) hochwertige Abschnitte gewonnen, die für die Immunfärbung anwendbar sind. Diese Ergebnisse haben gezeigt, dass die Einbettung von Gelatine die Probenintegrität von Hartgewebeabschnitten erheblich verbessert, aber auch die Haftung der Abschnitte an Gleitgläsern verbessert. Darüber hinaus bewahrt Gelatine Antigenfunktionen und zeigt Kompatibilität mit fluoreszierenden Signalen und Immunostainierung. Diese Technik funktioniert jedoch nur für bis zu 3 Monate alte Proben. Mögliche Verbesserungen dieser Methode sind (1) die Proben weiter zu sezieren, um das Zielgewebe von anderen Teilen zu trennen, um die Struktur des Gewebes einfach zu machen (im Falle von Zähnen sollte der Unterkiefer oder die Maxilla seziert und anstelle des ganzen Kopfes fixiert werden) und (2) 10% EDTA verwenden, um Gewebe nur 2–3 Tage vor dem Kryoschutz zu entkalken. Diese kurze Zeit der Entkalkung wird die immunstainierenden Ergebnisse nicht gefährden. Eine weitere Sorge ist, dass Gelatine als nicht wässrige Einbettungsmedium nicht einfach aus Dias entfernt werden kann, was je nach Färbemethode (z. B. H&E-Färbung) zu einem höheren Hintergrund führen kann.
Immunostaining Ergebnisse sind nicht einfach zu quantifizieren, so dass sie in der Regel semi-quantitative verwendet werden. Zu den Schwierigkeiten und Einschränkungen der Quantifizierung der Immunostainierung von craniofacial Geweben gehören unter anderem: (1) Es ist schwierig, den zu zählenden Bereich aufgrund der Komplexität der Struktur von craniofacial Geweben zu definieren; (2) Es ist aufgrund der nichtlinearen Natur der Immunfärbung schwierig, den markierten Bereich oder die markierten Zellen zu definieren; (3) Es gibt nur begrenzte Informationen über den Dynamikbereich des Signals; (4) es ist schwierig, die Intensität von Signalen zwischen Bildern oder Gruppen aufgrund des Verblassens des Fluoreszenzsignals während der Bildaufnahme zu vergleichen; und (5) der Signalhintergrund kann sich zwischen Antikörpern, Dias und Proben erheblich ändern. Um die Zuverlässigkeit der Quantifizierungsergebnisse zu erhöhen, sollte das Experiment sorgfältig und streng durchgeführt werden. Alle Proben sollten unter den gleichen Bedingungen verarbeitet werden. Während der Immunfärbung sind verschiedene Steuerungen erforderlich, um den Signalhintergrund auszuwerten und den positiven Bereich oder die Zellen für das Signal zu definieren. Nehmen Sie überzeugende und repräsentative Bilder, um den zu zählenden Bereich und die beschrifteten Zellen mit gutem Kontrast deutlich zu zeigen. Darüber hinaus müssen bei der Bildaufnahme die Kameraeinstellung und die Geräteeinstellung konsistent gehalten werden.
Zusammen stellen wir ein einfaches Standardprotokoll für die Immunfluoreszenz von KraniofacialGeweben der Maus vor, insbesondere für nicht verkalkte harte Gewebe. Die Immunostainierende Analyse von craniofacial Geweben wird nicht nur helfen, den Mechanismus der Morphogenese während der Entwicklung zu verstehen, sondern auch die Veränderungen während der Pathogenese zu veranschaulichen. Darüber hinaus kann Die Immunfärbung auch verwendet werden, um das Expressionsmuster anderer Signalwegliganden, Rezeptoren oder anderer phäotypischer Marker zu untersuchen, neben zellproliferation, Zelltod und dem BMP-Signalweg. Die kritischen Schritte eines Immunfleckenexperiments müssen jedoch für jedes Antigen/Antikörper oder Gewebe entsprechend modifiziert werden, um eine spezifische Färbung zu erhalten und unspezifische Hintergrundsignale zu minimieren.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von den National Institutes of Health (R01DE020843 bis Y.M.), der International FOP Association (Y.M.) und einem Stipendium der National Natural Science Foundation of China (31500788 bis J.Y.) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Adhesive tape | Leica | #39475214 | |
| Alexa fluor 488-goat anti-Rabbit secondary antibody | Invitrogen | A-11034 | |
| Antifade Mountant with DAPI | Invitrogen | P36931 | |
| Bovine serum albumin | Sigma | A2153 | |
| Coverslips | Fisher Brand | 12-545-E | |
| Cryostat | Leica | CM1850 | |
| EDTA | Sigma | E6758 | |
| Fluorescence microscope | Olympus | BX51 | |
| Gelatin | Sigma | G1890 | |
| In Situ Cell Death Detection Kit | Millipore | S7165 | |
| Microscope slides | Fisher Brand | 12-550-15 | |
| OCT Compound | Fisher Healthcare | 23-730-571 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | Sigma | P4417 | |
| Polyethylene glycol tert-octylphenyl ether | Sigma | T9284 | Triton X-100 |
| Proteinase K | Invitrogen | AM2542 | |
| Rabbit anti-Ki67 antibody | Cell Signaling Technology | 9129 | Lot#:3; RRID:AB_2687446 |
| Rabbit anti-pSmad1/5/9 antibody | Cell Signaling Technology | 13820 | Lot#:3; RRID:AB_2493181 |
| Sodium citrate | Sigma | 1613859 | |
| Sucrose | Sigma | S9378 | |
| Tris | Sigma | 10708976001 |
Referenzen
- Trinh, L. e. A., Fraser, S. E. Imaging the cell and molecular dynamics of craniofacial development: challenges and new opportunities in imaging developmental tissue patterning. Current Topics in Developmental Biology. 115, 599-629 (2015).
- Marcucio, R., et al. Facial morphogenesis: physical and molecular interactions between the brain and the face. Current Topics in Developmental Biology. 115, 299-320 (2015).
- Graf, D., et al. Common mechanisms in development and disease: BMP signaling in craniofacial development. Cytokine & Growth Factor Reviews. 27, 129-139 (2016).
- Snider, T. N., Mishina, Y. Cranial neural crest cell contribution to craniofacial formation, pathology, and future directions in tissue engineering. Birth Defects Research Part C: Embryo Today. 102 (3), 324-332 (2014).
- Mishina, Y., Snider, T. N. Neural crest cell signaling pathways critical to cranial bone development and pathology. Experimental Cell Research. 325 (2), 138-147 (2014).
- Van Hecke, D. Routine Immunohistochemical Staining Today: Choices to Make, Challenges to Take. Journal of Histotechnology. 1, 45-54 (2002).
- Xiao, C., Dan-Bi, C. Double staining immunohistochemistry. North American Journal of Medical Sciences. 2 (5), 241-245 (2010).
- Zongli, Q., et al. Comparison of immunofluorescence and immunohistochemical staining with anti-insulin antibodies on formalin-fixed paraffin-embedded human pancreatic tissue microarray sections. International Journal of Clinical and Experimental Pathology. 10 (3), 3671-3676 (2017).
- Montgomery, S. C., Cox, B. C. Whole mount dissection and immunofluorescence of the adult mouse cochlea. Journal of Visualized Experiments. (107), e53561 (2016).
- Dun, X. P., Parkinson, D. B. Whole mount immunostaining on mouse sciatic nerves to visualize events of peripheral nerve regeneration. Methods in Molecular Biology. 1739, 339-348 (2018).
- Akkiraju, H., et al. An Improved Immunostaining and Imaging Methodology to Determine Cell and Protein Distributions within the Bone Environment. Journal of Histochemistry & Cytochemistry. 64 (3), 168-178 (2016).
- González-Chávez, S. A., et al. Assessment of different decalcifying protocols on Osteopontin and Osteocalcin immunostaining in whole bone specimens of arthritis rat model by confocal immunofluorescence. International Journal of Clinical and Experimental Pathology. 6 (10), 1972-1983 (2013).
- Kapelsohn, K. Improved Methods for Cutting, Mounting, and Staining Tissue for Neural Histology. Protocol Exchange. , (2015).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of Visualized Experiments. (85), e50803 (2014).
- Shi, S. R., et al. Antigen retrieval techniques: current perspectives. Journal of Histochemistry & Cytochemistry. 49 (8), 931-937 (2001).
- Adell, T., et al. Immunohistochemistry on paraffin-embedded planarian tissue sections. Methods in Molecular Biology. 1774, 367-378 (2018).
- Griffioen, H. A., et al. Gelatin embedding to preserve lesion-damaged hypothalami and intracerebroventricular grafts for vibratome slicing and immunocytochemistry. Journal of Neuroscience Methods. 43, 43-47 (1992).
- Sarkar, S., et al. In situ demonstration of Fluoro-Turquoise conjugated gelatin for visualizing brain vasculature and endothelial cells and their characterization in normal and kainic acid exposed animals. Journal of Neuroscience Methods. 219 (2), 276-284 (2013).
- Oorschot, V., et al. A novel flat‐embedding method to prepare ultrathin cryosections from cultured cells in their in situ orientation. Journal of Histochemistry & Cytochemistry. 50, 1067-1080 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten