Method Article
הכנה לרקמה וכתמים של רקמות הגולגולת והעצמות הבלתי מתויטות
* These authors contributed equally
In This Article
Summary
כאן, אנו מציגים פרוטוקול מפורט כדי לזהות ולכמת את רמות החלבון במהלך הגולגולת מורפולגנזה/פתוגנזה על ידי מכתים באמצעות העכבר ברקמות הגולגולת כמו דוגמאות. בנוסף, אנו מתארים שיטה להכנה והקפאה של רקמות קשות בלתי מתויטות מעכברים צעירים לצורך חיסוני.
Abstract
חיסוני רקמות מספק זיהוי ספציפי ואמין מאוד של חלבונים של עניין בתוך רקמה נתונה. כאן אנו מתארים פרוטוקול שלם ופשוט כדי לזהות ביטוי חלבון במהלך הגולגולת מורפולגנזה/פתוגנזה באמצעות העכבר ברקמות הגולגולת כדוגמאות. הפרוטוקול כולל הכנה והקפאה של ממחטות נייר, אימונולואוורנציה עקיפים, רכישת תמונות וכימות. בנוסף, שיטה להכנה ולהקפאה של רקמות קשות בלתי מוצקות לשימוש חיסוני מתוארת, באמצעות רקמות הגולגולת ועצמות ארוכות כדוגמאות. שיטות אלה הן מפתח כדי לקבוע את ביטוי החלבון ואת השינויים מורפולוגיים/אנטומיים ברקמות שונות במהלך הגולגולת מורגנזה/פתוגנזה. הם חלים גם על רקמות אחרות עם שינויים מתאימים. הידע של היסטולוגיה ואיכות גבוהה של סעיפים הם קריטיים כדי להסיק מסקנות מדעיות מתוצאות ניסיוני. מגבלות פוטנציאליות של מתודולוגיה זו כוללות אך אינן מוגבלות לספציפיות של נוגדנים וקשיי כימות, הנדונים גם כאן.
Introduction
הפנים הוא חלק מרכזי של הזהות האנושית, והוא מורכב מכמה סוגים שונים של רקמות, כגון אפיתל, שריר, עצם, סחוס, השן. הרקמות הללו נגזרות מכל שלוש שכבות הנבט: העור, האנדועור, ומזועור1,2. עבור מעצבים הנכון ופיתוח של רקמות הגולגולת, התפשטות התא, מוות ובידול צריך להיות מתואם מאוד מוסדר על ידי מסלולים מסוימים איתות, כגון wnt, fgf, Hh ו Bmp מסלולים3,4 ,5. פגמים בהפצה, הישרדות או הבדלה של תאים יוביל להמומים הגולגולת, אשר הם בין פגמים לידה מולדים הנפוץ ביותר. עכברים טרנסגניים הם כלים שימושיים כדי לחקור מנגנונים של הגולגולת מורפוגנזה ו פתוגנזה1,2,3,4,5. הבנת השינויים במבני הגולגולת במהלך הפיתוח והפתוגנזה תסייע להבהיר עקרונות התפתחותיים מרכזיים, כמו גם את המנגנונים של מומים הגולגולת1,2,3 ,4,5.
ההכתים של הר שלם או רקמות מנות עם נוגדנים ספציפיים היא טכניקה לא יסולא בפז לקביעת התפלגות מרחבית של חלבונים של ריבית 6. באופן רשמי, חיסוני רקמות יכול להסתמך על כימיה אימונוהיסטוכימיה (IHC) או אימונולואואורנציה (IF). בהשוואה למוצר התגובה האטום שנוצר עם המצע כרומוגניים כגון 3, 3 '-Diaminobenzidine (בתוספת) על ידי IHC, אם כרוך השימוש של שערים פלורסנט גלוי על ידי מיקרוסקופ ניאון. לכן, אם ניתן בבירור להבדיל בין תאים חיוביים לרעשי רקע, ומאפשרת לתמונות להיות מנותחות ומשופרות בצורה פשוטה באמצעות תוכנה כגון imagej ו-Adobe Photoshop7,8. הגישה כל הר מכתים עובד על בלוקים קטנים של רקמה (פחות מ 5 מ"מ עבה), אשר יכול לספק מידע תלת מימדי על המיקום של חלבונים/אנטיגנים ללא צורך שחזור מסעיפים9,10 . עם זאת, לעומת מקטעי רקמות, חיסוני כל הר כל הוא זמן רב ודורש כמויות גדולות של פתרונות נוגדן. לא כל הנוגדנים תואמים את כל הגישה הבסיסית של הר. בנוסף, החדירה הלא מלאה של נוגדנים תגרום לצביעת לא אחיד או כתמים שליליים שווא. כאן נתמקד בזיהוי של חלבונים/אנטיגנים ברקמות הסנות. עבור רקמות קשות (למשל, ראש, שיניים, עצם ארוך), התצהיר סידן במהלך פיתוח/פתוגנזה עושה את המדגם קשה סעיף בקלות לשטוף את במהלך טיפול חיסוני11,12. רוב הפרוטוקולים הזמינים הנוכחי decalcify רקמות קשות לפני הטבעה כדי להפוך את הפחתת קל יותר, וזה זמן רב והוא יכול להרוס מורפולוגיה ואנטיגנים של דגימות אם מטופלים כראוי11,12. כדי להתגבר על הסוגיות, אנו אופטימיזציה גישה להקפאה של רקמות קשות ללא decalcification, המוביל ויזואליזציה משופרת של המבנה שלהם והפצה של חלבונים איתות.
הפרוטוקול המתואר כאן משמש כדי לקבוע שינויים מורמטרים והיסטולוגית ברקמות הגולגולת של עכברים טרנסגניים BMP. באופן ספציפי, הפרוטוקול כולל (1) קצירת וניתוח רקמות הראש, (2) מקטע ומכתים של סמנים ניסיוניים (Ki67, pSmad1/5/9) יחד עם כתמים TUNEL, (3) הדמיה סעיפים באמצעות מיקרוסקופ הזריחה, ולבסוף (4) ניתוח וכימות התוצאות. הפרוטוקול להכין ולקריוחלק רקמות קשות ללא decalcification מתואר גם13. שיטות אלו ממוטבות לרקמות הגולגולת. הם חלים גם על רקמות אחרות מגילאים שונים של דגימות עם שינויים מתאימים.
Protocol
כל ניסויי העכבר נעשו בהתאם להנחיות של אוניברסיטת מישיגן המכסים את הטיפול ההומאנית ושימוש בבעלי חיים במחקר. כל הליכים בעלי חיים המשמשים במחקר זה אושרו על ידי הוועדה לטיפול בבעלי חיים מוסדיים (IACUC) באוניברסיטת מישיגן (פרוטוקולPRO00007715).
1. הכנת רקמה
-
הכנת רקמות עובריים
- להכין 1 10 ס"מ צלחת ומספר 3.5 ס"מ מנות המכילות פוספט מלוחים באגירה (PBS), ו 1 12-לוחית התרבות המכילה 2 מ"ל 4% פאראפורמלדהיד (בשיא) ב PBS בכל הבאר עבור כל עכבר בהריון. הניחו את כל מנות הפטרי ואת הצלחת על הקרח.
הערה: . התמודד עם 4% בכיוון הבית - לנתח עוברים מעכברים בהריון ב-PBS קר קרח עם מלקחיים ומספריים כפי שתוארו בעבר14.
- בקצרה, המתת החסד עכבר בהריון עם CO2, לתפוס את העור מתחת למרכז הבטן עם מלקחיים וחותכים את העור בלבד, ואז למשוך בעדינות את העור כדי להפריד אותו מן הבסיס שריר הבטן הקיר.
- הבא, לחתוך לתוך חלל הבטן בעקבות אותו קו של חתך העור. להסיר את הרחם המכיל מחרוזת של עוברים ולהסיר את העוברים על ידי גזירה עדינה של קיר הרחם. רקמות מעובריים כגון שק החלמון ו בדיקת השפיר יוסרו.
- חותכים ומבודדים את הראש מכל עובר.
- להעביר כל ראש לכל באר של 12-היטב צלחת המכילה 4% בלקוט עם מלקחיים מפלסטיק העברה או במרק. לתקן דגימות ב 4% בכיוון הערוץ ב -4 ° c עבור 4 h. לשטוף דגימות ב-PBS ב 4 ° צ' עם טלטול עדין עבור 12 h.
הערה: לעוברים צעירים יותר מיום העובריים 16.5 (E 16.5), לתקן ראשי העוברים עם 4% בכיוון הכלדור ישירות לאחר בידוד. עבור עוברים ב-E 16.5 או מאוחר יותר, להסיר את העור ואת רקמת השומן מן הראש ולשטוף מספר פעמים ב-PBS קרח קר לפני קיבעון. - . הקפאת ראשים
- העבר כל ראש לתוך צלחת 12-באר חדשה המכילה 2 מ ל 30% סוכרוז ב-PBS באמצעות מלקחיים העברה פלסטיק או במרק. מתפרעים בעדינות ב -4 ° צ' עד שהראש שוקע לתחתית המנה.
- הטמע ראשים.
- העבר את הראש החתוך לתוך עובש המכיל טמפרטורת חיתוך אופטימלית (OCT). דגימות שבטניות ב-OCT למשך מספר דקות. להתאים את המיקום ואת הכיוון של דגימות עם מלקחיים.
- הניחו את העובש על הקרח היבש כדי להקפיא. החנות המקומבת המתקבלת בשקית ניילון ב-80 ° c עד שהיא מוכנה להקפאה.
הערה: הצד החתוך של הדגימות חייב להתמודד עם החלק התחתון של עובש הטבעה.
- להכין 1 10 ס"מ צלחת ומספר 3.5 ס"מ מנות המכילות פוספט מלוחים באגירה (PBS), ו 1 12-לוחית התרבות המכילה 2 מ"ל 4% פאראפורמלדהיד (בשיא) ב PBS בכל הבאר עבור כל עכבר בהריון. הניחו את כל מנות הפטרי ואת הצלחת על הקרח.
-
הכנת רקמות קשות לאחר הלידה הפוסט-לידתיים
- המתת חסד ב 3 שבועות או 3 העכבר הישן עם CO2. הסירי את העור ואת הרקמה האדיפוז. חותכים לבודד את הראש או עצמות ארוכות מן העכבר.
- תקן והקפאת הראש או עצם ארוך של עכברים כפי שמתואר בשלבים 1.1.3 – 1.1.4.
- להטביע ב 8% ג'לטין באופן דומה כמו שלב 1.1.5. שמרו את הקריובני בשקית ניילון ב-80 ° c עד להקפאה.
הערה: . אין צורך בדקיפיקציה כדי להכין 8% ג'לטין, מערבבים 8 גרם של ג'לטין עם 100 mL של PBS ומרתיחים באמצעות מיקרוגל. להיות מודע לכך התערובת מצטמצם בקלות.
2. קריוסיס1
- הגדרת טמפרטורת קריוסטט ל-18 ° צ' לרקמות רכות המוטבעות ב-OCT או -25 ° צ' ונמוכות יותר עבור רקמות קשות בלתי משובצות המוטבעות בג. לשמור דגימות בחדר קריוסטט במשך כ 30 דקות כדי למדוד את טמפרטורת קריוסטט.
- . לגרש את הבלוק מהקריוזקן להקפיא את הבלוק על הדגימה צ ' אק (מחזיק הרקמה) דרך להרכבה עם ירידה OCT. שמור את הצד החתוך של המדגם הרחוק ביותר מ-צ'אק (מול האופרטור).
- טען את הצ המעוגן בלוק אל מחזיק האובייקט של הקריוסטט. כוונן את מחזיק הלהב כדי להפוך את זווית הלהב 3 ° – 5 ° יחסית למדגם.
- לאסוף 10 מקטעי יקרומטר על שקופיות מצופה מיקרוסקופ. חלקים יבשים לגמרי ב RT, ואז לאחסן אותם ב-80 ° c.
3. מכתים היסטולוגית ומיקרוסקופיים הדמיה
- כתמים אימונולואורונסנציה
- להוציא שקופיות מ-80 ° c. שמור שקופיות ב-RT עבור 1 h עד מקטעים באוויר. לשטוף שקופיות ב 0.1% PBST (0.1% פוליאתילן גליקול tert-octylphenyl אתר ב-PBS; ראה לוח חומרים) שלוש פעמים עבור 5 דקות כל אחד כדי לשטוף את אוקטובר מקטעים החדיר.
- באופן אופציונלי, בצע אחזור אנטיגן (אופציונלי).
- מחממים מאגר ציטראט (10 מ"מ נתרן ציטראט משנת 6) בצלוחית הכתמים עם מרחץ-קיטור או אמבט מים ל-95 – 100 ° c. לטבול שקופיות במאגר ציטראט, מודתיאט עבור 10 דקות.
- לקחת את המנה מכתים מהמים או אמבט מים כדי RT. Cool השקופיות ב-RT עבור 20 דקות או יותר15.
הערה: כמו חלופות, השימוש מאגר טריס-EDTA (10 מ מ טריס בסיס, 1mM EDTA, 0.05% הרצף 20, pH 9.0) או מאגר EDTA (1 מ"מ EDTA, 0.05% הרצף 20, pH 8.0) עבור לשליפה המושרה החום אנטיגן. השתמש בסיר לחץ, מיקרוגל, או אמבט מים עבור לאחזור אנטיגן המושרה בחום, בנוסף על סיר חם. שימוש בטריפסין או בפפסין הוא חלופה אחרת לאיחזור אנזימים. מיטוב זמן הריכוז והטיפול באחזור אנזימטי כדי למנוע פגיעה בסעיפים. למטב את שיטת האחזור אנטיגן עבור כל שילוב נוגדן/אנטיגן.
- מודלת כל שקופית עם 200 μL של פתרון חסימה (5% בסרום חמור מדולל ב 0.1% PBST) ב RT עבור 30 דקות, לאחר מכן להסיר את הפתרון חסימת מבלי לשטוף.
- דגירה כל שקופית עם 100 μL של נוגדן ראשוני או נוגדנים מדולל בפתרון חסימה עבור 1 h ב RT או O/N ב 4 ° c. לשטוף שקופיות עם PBS שלוש פעמים עבור 10 דקות כל אחד ב RT.
- מודלת כל שקופית עם 100 μL של נוגדן משני מדולל בפתרון חסימת עבור 1 h ב RT. לשטוף שקופיות ב-PBS שלוש פעמים עבור 10 דקות כל אחד ב-RT.. להגן על שקופיות מהאור
- . שקופיות מאונט
- הוסף שתי טיפות של מדיום אנטי לדעוך עם DAPI (4 ', 6-diamidino-2-פניינילידול) בשקופית. . ואז לכסות עם שמיכות
- אחסן ב-4 ° c בחשיכה עד שהוא מוכן לתמונה.
הערה: כחלופה, התווית את הגרעינים עם DAPI או הואכסט 33324 לצבוע מדולל 1:2000 ב PBS ב RT הראשון, ולאחר מכן הר עם גליצרול.
- מסוף deאוקסינוקלאוטיל מעביר את התיוג הסופי (TUNEL).
הערה: כפול תקועים DNA עם 3 '-הידרוקסיל טרמיני (3 ' הו DNA termini) טופס במהלך אפופטוזיס בתא. כאן, אנו מספקים פרוטוקול כי תווית חינם 3 ' הו DNA termini באתרו באמצעות תיוג שברי דנ א עם digoxigenin-נוקלאוטיד בטרמינל deoxynucleotidyl טרנספראז (tdt) על ידי כתמים ספציפיים באמצעות ערכה מסחרית (ראה טבלת חומרים ).- באופן אופציונלי, מקטעים כתם עם הראשי ו-אלקסה Fluor-488 המסומנים נוגדנים משניים לפני כתמי TUNEL. שטוף את השקופיות ב-PBS שלוש פעמים עבור 10 דקות כל אחד.
הערה: שלב זה הוא אופציונלי לצביעת כפול של חלבון ו-TUNEL באותה שקופית. - דגירה כל שקופית עם 100 μL פרוטטינואז K (10 μg/mL ב 10 מ"מ מילימטר Tris pH 7.5 ו 5 מ"מ EDTA) עבור 5 דקות ב RT. לשטוף שקופיות עם PBS שלוש פעמים עבור 10 דקות כל אחד ב RT.
הערה: להתאים את זמן הדגירה ואת הטמפרטורה של פרוטאינאז K עבור כל סוג של רקמה. עבור 10 מקטעים יקרומטר של ראשי העובר קבוע ב 4% בתחתית, דגירה עבור 5 דקות ב RT. בנוסף לשיטה באמצעות פרוטטינואז K, השתמש טיפולים חלופיים לפי הצורך, כולל (1) טרי מוכן 0.1% פוליאתילן גליקול octylphenyl אתר, 0.1% נתרן ציטראט, 10 דקות ב 37 ° צ'; (2) 0.25% – 0.5% pepsin ב-HCl (pH 2) או 0.25% טריפסין, 10 דקות ב-37 ° c; ו (3) הקרנה מיקרוגל עם 0.1 M ציטראט מאגר (pH 6). - החלת 200 μL של פתרון חסימה (5% בסרום חמור מדולל ב 0.1% PBST) על כל שקופית, מודלת ב-RT עבור 30 דקות, להקיש את הפתרון חסימת ללא שטיפה.
- החל 50 μL של מאגר האקוויליציה המסופק על-ידי הערכה לכל שקופית ב-RT עבור לפחות 10 ס מ. הקשה על המאגר ללא שטיפה.
- להכין תערובת התגובה (כוח עבודה TdT האנזים) על ידי ערבוב האנזים TdT עם מאגר התגובה המסופק על ידי הערכה ביחס של 3:7. החל 50 μL של תערובת התגובה לכל שקופית, ו דגירה ב 37 ° צ' עבור 1 h. להקיש על המאגר ללא שטיפה.
- החל 200 μL של מאגר העצירה (1:30 מדולל ב-ddH2O) שסופקו על ידי הערכה לכל שקופית, ולאחר מכן דגירה ב-RT עבור 10 דקות. לשטוף שקופיות עם PBS שלוש פעמים עבור 10 דקות כל אחד.
- . תווית עם נוגדן רודאמיין
- החל 50 μL של טרום מחומם (RT) anti-digoxigenin המשלים (rhodamine) (1:1 מדולל בפתרון חסימה) על כל שקופית. דגירה ב-RT עבור 30 דקות בחושך.
- לשטוף שקופיות עם PBS שלוש פעמים עבור 10 דקות כל אחד. טעינת שקופיות כשלב 3.1.6.
- באופן אופציונלי, מקטעים כתם עם הראשי ו-אלקסה Fluor-488 המסומנים נוגדנים משניים לפני כתמי TUNEL. שטוף את השקופיות ב-PBS שלוש פעמים עבור 10 דקות כל אחד.
4. רכישת הדמיה
- השתמש בפקדים חיוביים (רקמות חיוביות עבור אנטיגן היעד) כדי לבדוק את האותות תיוג ופקדים שליליים (להשמיט את הנוגדן העיקרי, בקרת isotype, או רקמות שליליות עבור אנטיגן היעד) כדי להעריך את הרקע של תמונות מתחת פלורסנט מיקרוסקופ.
- הגדר את הציוד ואת תנאי המצלמה (חשיפות והגדרות כלליות אחרות) עבור דימות בהתבסס על עוצמת האות של פקדים חיוביים ושליליים.
הערה: תנאים אלה משתנים על-ידי (1) מצלמות ומיקרוסקופים המשמשים לדימות, (2) נוגדנים, ו (3) רקמות עבור כל ניסוי. התנאים השכיחים המשמשים לרקמות הגולגולת הם ISO 200 עם זמן חשיפה החל מ 1/100 s ל 1 תלוי באיכות וספציפיות של נוגדנים. מדגמים מתאימים משתנים בהתאם לגודל הדגימות ולמטרת הניסויים. - לרכוש תמונות עם מיקרוסקופ אפיפלואורסצלי קונבנציונאלי או מיקרוסקופ קונפוקלית וקד. לרכוש תמונות (כולל אלה של פקדים תואמים) באותם תנאים עבור כל ערוץ צבע. שמור תמונות בתבנית זהה (tiff היא הטובה ביותר לשימור מידע).
5. כימות הזריחה
הערה: מבחינה סטטיסטית השוואת ההכתמים בין קבוצות שונות יהיה אינפורמטיבי יותר במקרים רבים. עם התמונות החיסוניות, לכמת את הרמה היחסית של החלבון על ידי מדידת צפיפות האות, ספירת תאים חיוביים, או חישוב אזורים חיוביים. לניתוח סטטיסטי, המספר המינימלי של דגימות עצמאיות ביולוגית הוא 3. שיטה טיפוסית היא ליצור לפחות שלושה חלקים מכל מדגם ולצלם תמונות לפחות שלושה אזורים מייצגים בכל מקטע.
-
קוונפיקציה של עוצמה פלואורסצנטית באמצעות ImageJ
- פתח את התוכנה והשתמש באפשרות ' נתח > קביעת מדידות ' כדי לבדוק שהאזור בלבד ודחיסות משולבת נבחרו. השתמש בקובץ > פתוח כדי לפתוח תמונות לניתוח.
- השתמש בסרגל הכלים כדי לבחור את סמל הריבוע או העיגול שמשמאל. בחרו באזור שינותח בתמונה בעזרת כלי הבחירה. השתמש באפשרות ' נתח ≫ מדידה ' כדי לקבל את הבדיקה של האזור שנבחר ודחיסות משולבת בחלון ' תוצאות '. בחר אזור ליד תא חיובי שאין לו זריחה כדי לקרוא את הרקע.
- חזור על שלב 5.1.2 לניתוח תמונות אחרות. מותאם את האזור לניתוח כדי להתאים את זה של התמונה הראשונה.
- העתק את כל הנתונים בחלון התוצאות והדבק לתוך גיליון אלקטרוני בסיום הניתוח.
- חישוב עוצמת הקרינה הפלואורסצנטית המתוקנת (CTCF) כדחיסות משולבת — (שטח התא הנבחר x ממוצע הזריחה של קריאות הרקע). השוואת ההפרש בין הזריחה הכוללת המתוקנת של תא לבין דגימות והפיכת גרף.
-
קוונפיקציה של מספר התאים החיוביים של תמונות פלורסנט באמצעות ImageJ
- . ספירת תאים ידנית
- השתמש ב- Imagej > תוספים > ניתוח כדי להתקין את ה-plugin של מונה התא .
- השתמש בקובץ > פתוח כדי לפתוח תמונות לניתוח. השתמש בתוספים > ניתוח > מונה התא כדי לפתוח את חלון המונה ואת חלון התוצאות.
הערה: מונה התאים אינו פועל על ערימות. עבור ספירת ערימות, תוסף מגרש z הציר פרופיל, לאחר מכן להשתמש בתמונה > ערימות ≫ מתווה Z ציר פרופיל כדי לפקח על עוצמת ההחזר הנעה באמצעות כלי מעקב אחר חלקיקים. כלי זה יכול להיות ידני או אוטומטי. - לחיצה על אחד מהלחצנים בתחתית חלון המונה כדי ליזום ספירה. לחץ ישירות על תא/אובייקט שיש לספור עד לסיום.
- לחץ על לחצן התוצאות בחלון הספירה. המספר הכולל של תאים שנספרו יוצג בחלון התוצאות . שמור את יומן התוצאות כגיליון אלקטרוני ונתח.
- . ספירת תאים אוטומטית
- השתמש בקובץ > פתוח כדי לפתוח תמונות לניתוח. המירו את תמונת ה-RGB לתמונה בקנה מידה אפור לפני שתמשיך.
- השתמש בתמונה ≫ כוונן את > הסף כדי לבחור את כל האזורים שיש לספור.
- השתמש לנתח ≫ לנתח חלקיקים כדי לקבל את מספר התאים/חלקיקים. הגדר טווח של גודל החלקיקים החוקי (לדוגמה, 100-Infinity) במקום ברירת המחדל של 0-Infinity כדי לספור תאים/חלקיקים בתוך טווח מסוים. שמור את יומן התוצאות כגיליון אלקטרוני ונתח.
הערה: כדי לקבל מידע נוסף מהתמונה, מלבד האזור, עבור לניתוח ≫ קביעת מדידות ובחר את התיבה שליד המידע הדרוש.
- . ספירת תאים ידנית
תוצאות
מחתכי רקמה מתחלקים בגולגולת
בעקבות הצעדים שלעיל, הראשים הופעלו משליטה (P0) או מוטציה (הופעל באופן מכונן Bmpr1a בתאי ציצה עצבית, P0-יצור; caBmpr1a) עוברים ביום עובריים (E) 16.5 או 18.5. לאחר התיקון ב-4% בכיוון הג עבור 4 שעות, הוטבעו דגימות ב-OCT ובהקפאה. סעיפים התוצאה היו מוכתם חיסוני נגד pSmad1/5/9 (במורד מקדמי איתות BMP) או Ki67 (הפצת תא סמן) ללא אחזור אנטיגן על פי הפרוטוקול. כפי שמוצג, pSmad1/5/9 (איור 1A) ו-Ki67 (איור 1a) היו חיוביים בעצמות המצח של עוברי שליטה. ב עוברי מוטציה, רמות של pSmad1/5/9 הוגדלה (איור 1B), בעוד אלה של Ki67 הצטמצמה (איור 1b) בעצמות המצח. גם מוות תאים בדגימות אלה נבדק בהתאם לפרוטוקול. כפי שמוצג, התאים יותר האפוטוטיים נצפו בעצמות הקדמית של עוברי מוטציה מאשר אלה של עוברי שליטה (איור 1E, F).
רקמות גולגולת לא מתויטות או חתכי עצם ארוכים
בעקבות השלבים לעיל עבור רקמות קשות בלתי מP0, ראשים מתוך 3 שבועות עכברים ישנים (-המוני; mTmG (ממברנה-עגבניה ו ממברנה gfp)) תוקנו עם 4% כלגון ו מוטבע ב 8% ג'לטין. מקטעי קריוגונים נשטפו עם PBST ורכוב עם מדיום אנטי לדעוך עם DAPI. איור 2A , B הפגינו כי ג'לטין אינו מפריע לאותות פלורסנט מרקמות שנות מנות.
ראשי ופמורה מ 3 בן שבוע או עכברים בן 3 חודשים המועסקים כדי לבדוק אם הרקמות המוטבעים בלתי מוטבע הג הם טובים IF. כל הראשים והפמורה היו מעובדים ומחוקים לפי הפרוטוקול. בסעיפים הSOX9 שימשו לשימוש חיסוני (איור 3) או OSX ו-E11/Podoplanin חיסוני כפול (איור 4). כפי שמוצג, מקטעים באיכות טובה התקבלו מרוב 3 השבוע רקמות קשות, כולל הטראפקיום ואת התאים הקורטיקליים של עצם הירך (איור 3A, B, איור 4a– D), את העצמות המצח (איור 4a, F), the חותכת (איור 3e, F, איור 4i, J), רקמות האף (איור 3e, D), ואת הגולגולת כולל את התפר האף premaxilla ואת העצמות שמסביב (איור 4i, H ) של הראש. בעוד, עם דגימות של 3 חודשים, מקטעים באיכות טובה התקבלו רק בחלק הרקמות הקשות, כולל את התאים הטראבתים של עצם הירך (איור 3G, H, איור 4k, L), רקמות האף (איור 3g , J), והגולגולת כולל את התפר הפרקסאדיליה ואת העצמות שמסביב (איור 4m, N) של הראש. כפי שמוצג באיור 3, תאים SOX9 חיוביים זוהו במיוחד כונדרוציטים של צלחת הצמיחה (איור 3b) ואת המפרק (איור 3b) מן הירך, ואת האף מחיצת (איור 3b, J). ב 3 שבועות, חותכת, SOX9 זוהה בתאי mesenchymal (איור 3F). OSX ו E11 התוצאות מכתים כפול הראו כי OSX זוהה באוסטאופתים, בעוד E11 זוהה ב אוסטאופציטים של עצמות מעצם הירך והראש (איור 4B, D, H, L, N). ב 3 שבועות חותכת, OSX היה חיובי ב שפיטופיצוצים, בעוד E11 היה חיובי בתאים זקיק mesenchymal (איור 4J). תוצאות אלה מעידות על רקמות קשה undecalcified מוטבע עם ג'לטין היטב לשמר פונקציות אנטיגן.
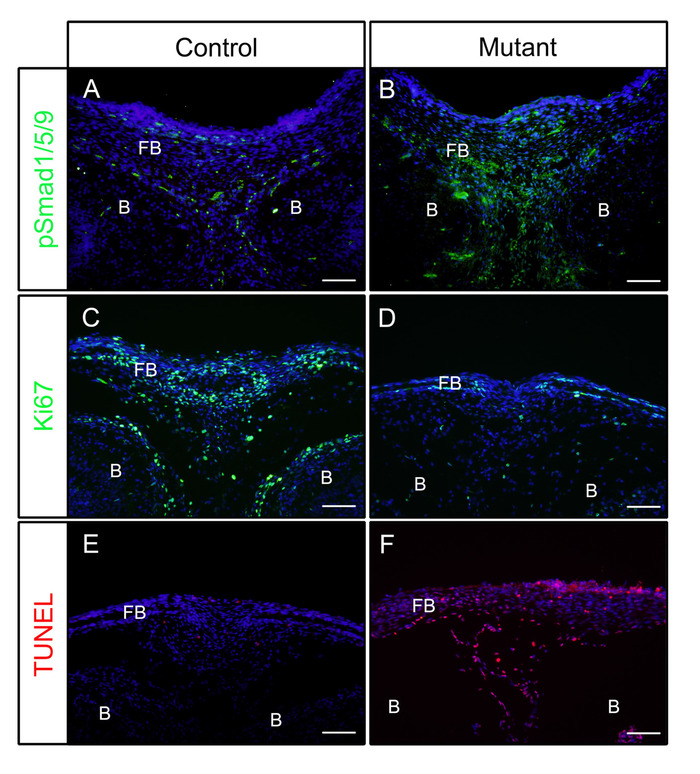
איור 1: דוגמאות לתוצאות IF של pSmad1/5/9, Ki67 או TUNEL בעוברי בקרה ועוברי מוטציה עם פעילות BMP משופרת. עכברים המופעלות Bmpr1a (caBmpr1a) הופעלו עם עכברים P0- יצור כדי להגדיל את פעילות איתות BMP בתאי ציצה עצבית (nccs ק). ראשי שליטה (P0-היצור; caBmpr1a+/+) ו-מוטציה (P0-יצור; caBmpr1afx/+) העוברים היו בנוי על e 16.5 או e 29.7, קבוע עם 4% התחתית עבור 4h, הקפאה עם 30% סוכרוז ליום אחד, מוטבע OCT, והקפאה ב-18 ° c. חלקים של העצם הקדמית (ברמה דומה עם העין) שימשו זיהוי חיסוני נגד pSmad1/5/9, Ki67, או כתמים TUNEL. (A, B) pSmad1/5/9 (ירוק) מכתים תבניות בעצמות הקדמית של שליטה (א) או המוטציות (ב) העוברים ב-16.5. (ג, ד) Ki67 (ירוק) כתמים דפוסים בעצמות הקדמית של שליטה (C) או מוטציה (ד) עוברים ב-e 29.8. (E, F) TUNEL (אדום) הצביעת תבניות בעצמות הקדמית של שליטה (E) או מוטציה (F) עוברים ב-E 29.8. גרעינים היו מוכתמים DAPI (כחול). פנסיון מלא = עצם המצח, B = מוח. קנה מידה של סרגלים = 100 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
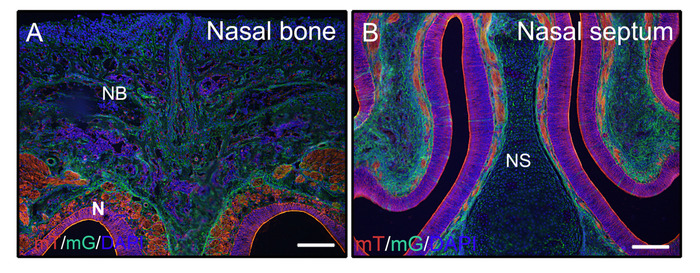
איור 2: דוגמאות של כתבת מmtmg האות תוצאות של רקמות בלתי מתויטות בראש. ראשים מתוך 3 שבועות P0-יצורים בעלי ממברנה-עגבניות וממברנה gfp (mtmg) העיתונאי היו גזור, קבוע עם 4% החצי האלוף עבור 4h, הקפאה עם 30% סוכרוז במשך יומיים, מוטבע ב 8% ג'לטין, ו להקפאה ב-25 ° c. מקטעי ראש להראות בבירור GFP (ירוק, היצור שילוב מחדש חיובי) ו עגבניות (אדום, היצור משולבת שלילי) אות בעצם האף ורקמות האף (A, B). גרעינים היו מוכתמים DAPI (כחול). NB = עצם האף, N = רקמות האף, NS = מחיצת האף. קנה מידה של סרגלים = 250 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
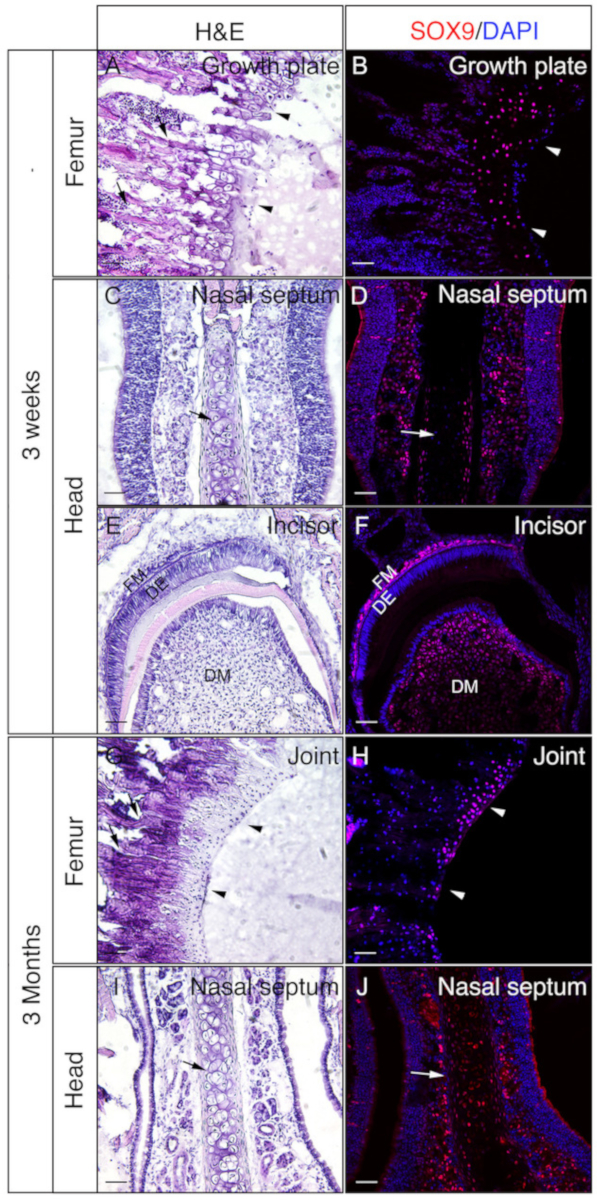
איור 3: דוגמאות של SOX9 מכתים את תוצאות הרקמות הבלתי מתויטות בראש ובפמורה. ראשי ופמורה היו בגזור מ 3 שבועות או 3 בחודש עכברים, קבוע עם 4% בכיוון השני עבור 4h, הקפאה עם 30% סוכרוז במשך יומיים, הוטבע 8% ג'לטין, ו להקפאה ב-25 ° c. שקופיות שימשו לזיהוי חיסוני נגד SOX9 (אדום). הגרעינים היו מוכתמים ב-DAPI (כחול) (B, D, F, H, J). חלקים סמוכים של רקמות אלה שימשו עבור המטאוקסילין & אאוזין (H & E) הצביעת (A, C, e, G, I). ראשי חץ ב ו B לציין צלחת הצמיחה ו G ו- H, סחוס המוח. חיצים ב-A ו- G מצביעים על העצמות הטראבגית ובתוך C, D, I ו- J, מחיצת האף. DM = שיניים מmesenchyme, DE = שיניים אפיתל, FM = זקיק mesenchyme. קנה מידה של סרגלים = 50 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
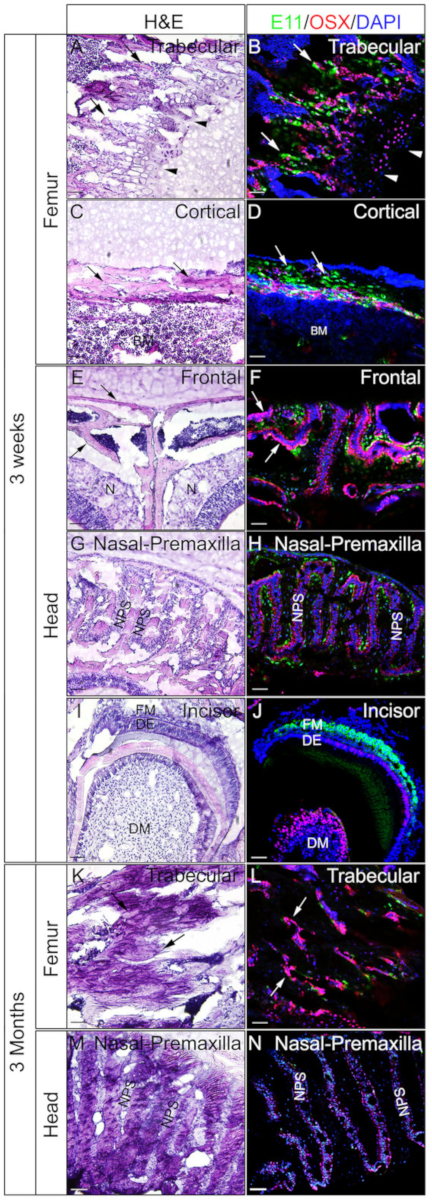
איור 4: דוגמאות של OSX ו-E11 חיסוני כפול התוצאות של רקמות בלתי מתויטות בראש ובפמורה. ראשי ופמורה היו בגזור מ 3 שבוע בן או 3 העכברים הישנים, קבוע עם 4% בכיוון השני עבור 4h, הקפאה עם 30% סוכרוז במשך יומיים, הוטבע ב 8% ג'לטין, ו להקפאה ב-25 ° c. מקטעים שימשו לשימוש חיסוני כפול עם נוגדנים נגד OSX (אדום) ו E11/Podoplanin (ירוק). גרעינים היו מוכתמים DAPI (כחול) (ב, D, F, H, J, L, N). חלקים סמוכים של הרקמות האלה שימשו לצביעת H & E (A, C, E, G, I, K, M). חיצים ב- A, B, K, ואני מציין שבתאי הירך של טראפני; C ו -D, התאים הקורטיקליים של עצם הירך; ו- E ו- ו', עצמות המצח. ראשי חץ ב ו B מצביעים על לוחית הצמיחה. מוניטור = מח עצם, N = רקמות האף, DM = שיניים mesenchyme, DE = שיניים אפיתל, FM = זקיק mesenchyme, NPS = האף premaxilla תפר. העצמות המצח (E, F) והתפר הטרום-מקדים והעצמות שמסביב (G, H, M, N) מוצגים גם הם. קנה מידה של סרגלים = 50 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
כאן אנו מספקים פרוטוקול מפורט להכנת ראש העכבר ורקמות העצם הבלתי מתויטות, והקפאה להכתמים של הפצת תאים, מוות תאים, ו-BMP איתות סמנים. כמו כן, אנו מפרטים את האסטרטגיה להשגת נתונים כמותיים מתמונות מאימונולווקארדורף. שיטות אלה יכולות גם להיות ישימות על רקמות אחרות עם שינויים מתאימים.
התנאים להכנת רקמות משתנים לפי גודל וסוג של רקמות. הקיבעון והקפאת הזמן בדרך כלל זקוקים למספר שעות עד הלילה. לאחר קיבעון, הרקמה יכולה גם להיות מוטבע פרפין ומנות עם מיקרוטומה16. למרות פרפין ו-OCT לעבוד היטב עבור כתמים חיסוני, יש כמה הבדלים ביניהם. בלוקים פרפין ניתן לשמור במשך שנים מרובות ב RT, בעוד OCT בלוקים עבור 1 שנה ב-80 ° c. פרפין שומר על מורפולוגיה של רקמות, בעוד גביש הקרח נוצר במהלך הטבעה של OCT עשוי להשפיע לרעה על מבני הרקמה. פרפין לפעמים מסכות אפיאוסקופים של אנטיגנים, בעוד OCT שומר על פעילויות אנזים ובעלי אפיסקופים אנטיגן. לכן, אין צורך באחזור אנטיגן עבור רוב הנוגדנים אם הוא קבוע 4% בתחתית עבור רק 4 h או פחות מוטבע OCT. זה, עם זאת, עדיין אפשרי לקבל תוצאות טובות יותר על ידי אחזור אנטיגן, אם פקדים חיוביים לא להראות תוצאות מכתים טוב בקריודורים.
ניתן להשתמש בצבע הואכסט ו-DAPI לשימוש גרעיני נגד כתמים. יש להם קווי דמיון, כמו שניהם (1) הם UV-נרגש, מינורי groove כימיקלים מחייב לפלוט אותות יחסיים לתוכן ה-DNA הכולל, ו (2) חשופים הלבנת תמונה לאחר חשיפה ארוכה. עם זאת, צבעים Hoechst משמשים בדרך כלל לצביעת תוכן ה-DNA בתאים חיים בשל חדירות גבוהות שלהם. DAPI משמש בדרך כלל עבור צביעת DNA בתאים קבועים בשל חדירות הקרום הנמוך שלה. בנוסף, DAPI יוצר אות חזק ויציב יותר מאשר הואכסט.
שליטה נכונה חיונית עבור IF. יש לאשר את הספציפיות של כל נוגדן חדש על-ידי ניתוח כתמי האבן המערבי, אם הדבר ישים. יש לקבוע את ריכוז העבודה האופטימלי של נוגדן ראשוני מסוים באמצעות השימוש בדילול סדרתי. שליטה חיובית (רקמה או תא אשר הוכח לבטא את החלבון/אנטיגן) יש לכלול כדי לבדוק את התהליך IF וספציפיות של נוגדן. שליטה שלילית צריך להיכלל גם, למשל, העדר הנוגדן העיקרי, או החלפת IgG נורמלי מאותו מינים של הנוגדן העיקרי, או רקמות שליליות עבור אנטיגן היעד. בעת צילום תמונות, המדגם ללא נוגדנים משניים (בקרת רקע) צריך להיבדק באופן עצמאי עם כל ערוץ כדי להגדיר את המגבלות של רווח אות והיסט כדי להתאים את ההדמיה הסופית. לאיתור מספר רב של תוויות, בקרת רקע ופקדים בעלי תווית יחידה צריכים להיות מוכנים כדי להימנע מחפצי חפיפה ספקטרלי. כל הערוצים שישמשו לקבלת תמונה של דגימת תוויות מרובות חייבים להיות חשופים לתיקון רקע בלתי תלוי, מכיוון שרמת הקרינה האוטומטית בכל אחד מהערוצים משתנה באופן משמעותי.
כמו כן, אנו מספקים את הפרוטוקול להכנה והקפאה של רקמות קשות בלתי משובצות מוטבע ג'לטין. עבור הרקמות הקשות מוטבעות של OCT, רוב מקטעי הרקמה הקשה ינותקו מכוסות שקופיות במהלך הליכי הדבקה, בגלל האופי הנמוך שלהם בשקופית. הסרט הדביק שנועד להקל על ההקפאה מסייע ליצור קטעים איכותיים. אבל, הסעיפים האלה פגומים בקלות כאשר הקלטת מתקלפת. עבור רקמות מוטבעות ג'לטין, אין צורך במערכת העברת קלטות כדי ליצור מקטעים באיכות טובה. כמדיום הטבעה, ג'לטין יכול לחדור למדגם היטב, למרות שיש לו צמיגות נמוכה יותר לעומת OCT. ג'לטין נעשה שימוש ביישומים היסטלוגיים אחרים, כגון רקמת המוח17,18 ו-ודק חלקים של תאים . בשביל כימיה מאימונוציטוטוכימיה19 כאן, ג'לטין שימש להטביע עצם בלתי מסויד, אשר מייצר בלוקים קל יותר לקריוחלק מ-OCT. יש כמה טיפים קטנים כדי לקבל חלקים טובים של הג מוטבע הרקמות הקשות undecalcified השלב הקריטי הוא להטביע עם ג'לטין במקום OCT. כדי לקבל חדירה טובה יותר, לשמור דגימות ב 30% סוכרוז עוד יום אחד אחרי דגימות לשקוע לתחתית. זה חשוב באותה מידה להגדיר את הטמפרטורה נמוך מהרגיל בסביבות-25 ° c. . להב חד במיוחד אינו הכרחי למרות שטמפרטורת ההקפאה נמוכה יותר ( -25 ° c) עושה כמה שיפורים עבור קריוסיקום של הרקמות הקשות של אוקטובר מוטבע, זה עדיין קשה לקבל יושר טוב של מבני רקמות. כפי שמוצג באיור 2, איור 3, ואיור 4, מקטעים באיכות טובה החלים על כתמים חיסוני הושגו מרקמות מוטבעות של ג'לטין (למשל, בעצמות המוח, עצמות קורטיקלית, עצמות הגולגולת, רקמות האף והחותכת). תוצאות אלה הוכיחו כי הטבעה הג'לטין משפר באופן משמעותי את שלמות הדגימה של סעיפים רקמות קשות, אבל גם מגביר את הדבקה של סעיפים כדי משקפיים השקופית. בנוסף, ג'לטין שומר פונקציות אנטיגן, ומציג תאימות עם אותות פלורסנט וכתמים חיסוני. עם זאת, טכניקה זו פועלת היטב עד 3 חודשים בן דגימות. שיפורים פוטנציאליים של שיטה זו הם (1) כדי לנתח את הדגימות עוד כדי להפריד את רקמת היעד מחלקים אחרים כדי להפוך את המבנה של הרקמה פשוט (במקרה של שיניים, הלסת התחתונה או לסת צריך להיות גזור ותוקן במקום הראש כולו) ו (2) להשתמש 10% EDTA לרקמות decalcify עבור רק 2 – 3 ימים לפני הקפאה. זה זמן קצר של decalcification לא להתפשר על תוצאות החיסונית. חשש נוסף הוא כי, כמו מדיה הטבעה לא מימית, ג'לטין לא ניתן להסיר בקלות משקופיות, אשר עשוי להוביל לרקע גבוה יותר בהתאם לשיטות הצביעת (למשל, H & E כתמים).
תוצאות חיסוני אינן קלות לכמת, כך הם משמשים בדרך כלל חצי כימות. קשיים ומגבלות של כימות החיסוני של רקמות הגולגולת כוללים אך אינם מוגבלים לאלה: (1) קשה להגדיר את האזור להיות נספרות בשל המורכבות של המבנה של רקמות הגולגולת; (2) קשה להגדיר את האזור המסומן בתווית או תאים המסומנים בשל האופי הלא ליניארי של ההכתמים החיסוני; (3) יש מידע מוגבל עבור טווח דינמי של האות; (4) קשה להשוות את עוצמת האותות בין תמונות או קבוצות עקב התפוגגות אות פלורסנט במהלך רכישת תמונה; ו-(5) רקע האות עשוי להשתנות באופן משמעותי בין נוגדנים, שקופיות ודגימות. כדי להגביר את האמינות של תוצאות הכמת, הניסוי צריך להיות בקפידה וביצוע מדויק. יש לעבד את כל הדגימות באותם תנאים. במהלך כתמים מסוימים, פקדים שונים נדרשים להערכת רקע אותות ולהגדרת האזור או התאים החיוביים עבור האות. קח משכנעת ומייצגים תמונות כדי להראות בבירור את האזור לספור ולתייג תאים עם ניגודיות טובה. בנוסף, במהלך רכישת תמונה, יש לשמור על עקביות בהגדרת המצלמה ובהגדרת הציוד.
יחד, אנו מציגים פרוטוקול תקן פשוט עבור immunofluorescence באמצעות רקמות הגולגולת של העכבר, במיוחד עבור רקמות קשות undecalcified. ניתוח חיסוני של רקמות הגולגולת לא רק לעזור להבין את המנגנון של מורפולגנזה במהלך הפיתוח, אלא גם להמחיש את השינויים במהלך הפתוגנזה. בנוסף, החיסוני יכול לשמש גם כדי ללמוד את דפוס הביטוי של ליגונים מסלול איתות אחרים, קולטנים, או סמנים אחרים פנוטימית, מלבד התפשטות התא, מוות תאים, ואת מסלול האיתות BMP. עם זאת, הצעדים הקריטיים של ניסוי חיסוני חייב להיות שונה כראוי עבור כל אנטיגן/נוגדן או רקמות כדי לקבל כתמים מסוימים וממוזער אותות רקע לא ספציפיים.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו נתמכת על ידי המכון הלאומי לבריאות (R01DE020843 to Y.M.), האגודה הבינלאומית FOP (Y.M.), ו מענק סיוע מתוך הקרן הלאומית למדעי הטבע של סין (31500788 לJ.Y.).
Materials
| Name | Company | Catalog Number | Comments |
| Adhesive tape | Leica | #39475214 | |
| Alexa fluor 488-goat anti-Rabbit secondary antibody | Invitrogen | A-11034 | |
| Antifade Mountant with DAPI | Invitrogen | P36931 | |
| Bovine serum albumin | Sigma | A2153 | |
| Coverslips | Fisher Brand | 12-545-E | |
| Cryostat | Leica | CM1850 | |
| EDTA | Sigma | E6758 | |
| Fluorescence microscope | Olympus | BX51 | |
| Gelatin | Sigma | G1890 | |
| In Situ Cell Death Detection Kit | Millipore | S7165 | |
| Microscope slides | Fisher Brand | 12-550-15 | |
| OCT Compound | Fisher Healthcare | 23-730-571 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | Sigma | P4417 | |
| Polyethylene glycol tert-octylphenyl ether | Sigma | T9284 | Triton X-100 |
| Proteinase K | Invitrogen | AM2542 | |
| Rabbit anti-Ki67 antibody | Cell Signaling Technology | 9129 | Lot#:3; RRID:AB_2687446 |
| Rabbit anti-pSmad1/5/9 antibody | Cell Signaling Technology | 13820 | Lot#:3; RRID:AB_2493181 |
| Sodium citrate | Sigma | 1613859 | |
| Sucrose | Sigma | S9378 | |
| Tris | Sigma | 10708976001 |
References
- Trinh, L. e. A., Fraser, S. E. Imaging the cell and molecular dynamics of craniofacial development: challenges and new opportunities in imaging developmental tissue patterning. Current Topics in Developmental Biology. 115, 599-629 (2015).
- Marcucio, R., et al. Facial morphogenesis: physical and molecular interactions between the brain and the face. Current Topics in Developmental Biology. 115, 299-320 (2015).
- Graf, D., et al. Common mechanisms in development and disease: BMP signaling in craniofacial development. Cytokine & Growth Factor Reviews. 27, 129-139 (2016).
- Snider, T. N., Mishina, Y. Cranial neural crest cell contribution to craniofacial formation, pathology, and future directions in tissue engineering. Birth Defects Research Part C: Embryo Today. 102 (3), 324-332 (2014).
- Mishina, Y., Snider, T. N. Neural crest cell signaling pathways critical to cranial bone development and pathology. Experimental Cell Research. 325 (2), 138-147 (2014).
- Van Hecke, D. Routine Immunohistochemical Staining Today: Choices to Make, Challenges to Take. Journal of Histotechnology. 1, 45-54 (2002).
- Xiao, C., Dan-Bi, C. Double staining immunohistochemistry. North American Journal of Medical Sciences. 2 (5), 241-245 (2010).
- Zongli, Q., et al. Comparison of immunofluorescence and immunohistochemical staining with anti-insulin antibodies on formalin-fixed paraffin-embedded human pancreatic tissue microarray sections. International Journal of Clinical and Experimental Pathology. 10 (3), 3671-3676 (2017).
- Montgomery, S. C., Cox, B. C. Whole mount dissection and immunofluorescence of the adult mouse cochlea. Journal of Visualized Experiments. (107), e53561 (2016).
- Dun, X. P., Parkinson, D. B. Whole mount immunostaining on mouse sciatic nerves to visualize events of peripheral nerve regeneration. Methods in Molecular Biology. 1739, 339-348 (2018).
- Akkiraju, H., et al. An Improved Immunostaining and Imaging Methodology to Determine Cell and Protein Distributions within the Bone Environment. Journal of Histochemistry & Cytochemistry. 64 (3), 168-178 (2016).
- González-Chávez, S. A., et al. Assessment of different decalcifying protocols on Osteopontin and Osteocalcin immunostaining in whole bone specimens of arthritis rat model by confocal immunofluorescence. International Journal of Clinical and Experimental Pathology. 6 (10), 1972-1983 (2013).
- Kapelsohn, K. Improved Methods for Cutting, Mounting, and Staining Tissue for Neural Histology. Protocol Exchange. , (2015).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of Visualized Experiments. (85), e50803 (2014).
- Shi, S. R., et al. Antigen retrieval techniques: current perspectives. Journal of Histochemistry & Cytochemistry. 49 (8), 931-937 (2001).
- Adell, T., et al. Immunohistochemistry on paraffin-embedded planarian tissue sections. Methods in Molecular Biology. 1774, 367-378 (2018).
- Griffioen, H. A., et al. Gelatin embedding to preserve lesion-damaged hypothalami and intracerebroventricular grafts for vibratome slicing and immunocytochemistry. Journal of Neuroscience Methods. 43, 43-47 (1992).
- Sarkar, S., et al. In situ demonstration of Fluoro-Turquoise conjugated gelatin for visualizing brain vasculature and endothelial cells and their characterization in normal and kainic acid exposed animals. Journal of Neuroscience Methods. 219 (2), 276-284 (2013).
- Oorschot, V., et al. A novel flat‐embedding method to prepare ultrathin cryosections from cultured cells in their in situ orientation. Journal of Histochemistry & Cytochemistry. 50, 1067-1080 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved